Los marcadores biológicos están siendo usados en el diagnóstico y tratamiento de enfermedades tan prevalentes como las cardiovasculares o el cáncer. Los biomarcadores son muy útiles en la práctica clínica habitual como método no invasivo para el diagnóstico más preciso de las enfermedades, para la monitorización de las mismas y para crear posibles regímenes de tratamiento personalizados. El asma es una enfermedad heterogénea con diferentes fenotipos. Los test de función pulmonar a menudo confirman el diagnóstico, pero no reflejan el proceso patológico responsable de los diferentes fenotipos que presenta la enfermedad. Los corticosteroides inhalados junto a los agonistas beta adrenérgicos han sido la piedra angular del tratamiento del asma en los últimos 30 años, pero la heterogeneidad de la enfermedad hace que no todos los asmáticos respondan al mismo tratamiento. Los biomarcadores son una herramienta útil para identificar estos fenotipos específicos. Esta revisión se centra en la utilidad de los biomarcadores de inflamación de la vía aérea en el manejo de los pacientes asmáticos obtenidos por técnicas no invasivas como es el esputo, el aire exhalado o el suero.
Biological markers are being used in the diagnosis and treatment of disease as prevalent as cardiovascular or cancer. Biomarkers are a useful in clinical practice as a non invasive methods for the accurate diagnosis of the disease, monitor disease and create personalized treatment regimes. Asthma is a heterogeneous disease with different phenotypes. Pulmonary function test are most often used to confirm the diagnosis, but not reflect the pathological processes responsible for different phenotypes that present the disease. Inhaled corticosteroids and beta 2 agonists have been mainstay of asthma therapy for over 30 years, but the heterogeneity of the disease means not all asthmatics respond to the same treatment. Biomarkers are useful tools to identify these specific phenotypes. This review focuses on the utility of biomarkers of inflammation of the airway in the management of asthma patients obtained by noninvasive tecniques including sputum, exhaled breath or serum.
El Instituto Nacional de la Salud define biomarcador como “una característica que es objetivamente medida y evaluada como un indicador de procesos biológicos normales, procesos patogénicos o respuesta farmacológica a una intervención terapéutica”1.
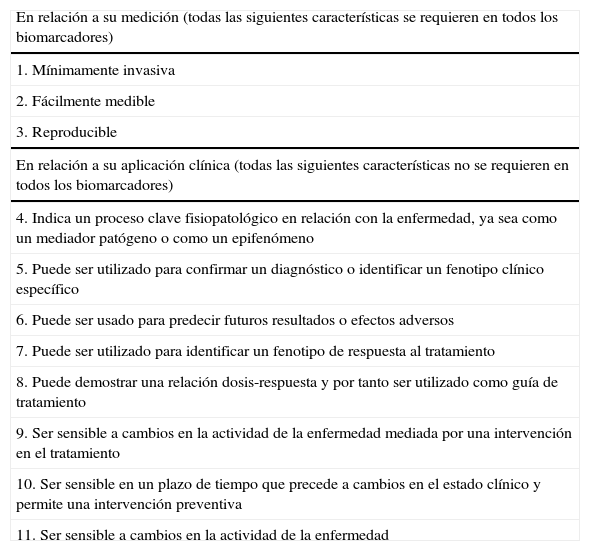
Las características que debe tener un marcador ideal se enumeran en la tabla 1. Son necesarios rigurosos procesos de validación biológica y clínica antes de que un biomarcador pueda ser aprobado para su utilización en la práctica clínica. Sin embargo, más allá de las cuestiones metodológicas (límites de detección, precisión, y reproducibilidad), existen aspectos técnicos específicos del tracto respiratorio que añaden dificultad al desarrollo de un marcador. A diferencia de la orina o la sangre, las muestras de aire exhalado o las secreciones de la vía aérea requieren una estandarización, ya que factores como la contaminación orofaríngea, el espacio muerto, o el flujo espiratorio afectan a la muestra. Recientes avances han proporcionado una desconcertante variedad de compuestos medibles que están relacionados con la fisiopatología de la enfermedad de las vías aéreas. Sin embargo, la transición del laboratorio a la práctica clínica es un camino largo y dificultoso, y en ocasiones, con escaso rendimiento.
Características de un marcador ideal
| En relación a su medición (todas las siguientes características se requieren en todos los biomarcadores) |
| 1. Mínimamente invasiva |
| 2. Fácilmente medible |
| 3. Reproducible |
| En relación a su aplicación clínica (todas las siguientes características no se requieren en todos los biomarcadores) |
| 4. Indica un proceso clave fisiopatológico en relación con la enfermedad, ya sea como un mediador patógeno o como un epifenómeno |
| 5. Puede ser utilizado para confirmar un diagnóstico o identificar un fenotipo clínico específico |
| 6. Puede ser usado para predecir futuros resultados o efectos adversos |
| 7. Puede ser utilizado para identificar un fenotipo de respuesta al tratamiento |
| 8. Puede demostrar una relación dosis-respuesta y por tanto ser utilizado como guía de tratamiento |
| 9. Ser sensible a cambios en la actividad de la enfermedad mediada por una intervención en el tratamiento |
| 10. Ser sensible en un plazo de tiempo que precede a cambios en el estado clínico y permite una intervención preventiva |
| 11. Ser sensible a cambios en la actividad de la enfermedad |
El asma es una enfermedad inflamatoria de la vía aérea, y dicha inflamación es responsable en parte de los síntomas, del número de exacerbaciones que presentan los pacientes y de otros aspectos relacionados con la actividad de la enfermedad. La mayoría de los biomarcadores que existen en el asma reflejan la inflamación que se desarrolla en la vía aérea de estos pacientes, pero la inflamación no es el único componente patológico de la enfermedad. La remodelación de la vía aérea desempeña un papel más importante en la patogenia del asma y, así, los biomarcadores diseñados para indicar cambios estructurales, tales como el daño epitelial, la hiperplasia de la mucosa, la proliferación de los miofibroblastos o el crecimiento del músculo liso que existe en el asma, también podrían resultar útiles para definir un fenotipo específico de la enfermedad.
El asma está empezando a ser considerado como un síndrome overlap, con otras patologías y fenotipos contribuyendo a una importante heterogeneidad en las manifestaciones clínicas, en la progresión de la enfermedad y en la respuesta al tratamiento. La espirometría es incapaz de discernir entre los distintos subtipos de enfermedad y discriminar qué individuos responderán a los regímenes de tratamiento habituales. La caracterización de los fenotipos del asma y el reconocimiento de estos se asocian con una importante variabilidad en respuesta a las nuevas terapias, lo que ha impulsado la búsqueda de marcadores en el asma. Sin embargo, el papel de los biomarcadores es incierto, pero deberán utilizarse como prueba complementaria a los métodos de diagnóstico clínico, así como en la monitorización de la enfermedad.
Las recomendaciones actuales para valorar el control del asma no incluyen medidas de inflamación de la vía aérea, pero la necesidad de un método no invasivo, validado para medir dicha inflamación, es vital para el estudio de las enfermedades respiratorias inflamatorias tan prevalentes como es el asma o la enfermedad pulmonar obstructiva crónica (EPOC).
La biopsia bronquial, el lavado broncoalveolar (LBA) y el cepillado bronquial son herramientas útiles para medir la inflamación que existe en la vía aérea pero de forma invasiva. En la actualidad, existen técnicas no invasivas, como el esputo inducido, el condensado de aire exhalado y la nariz electrónica, que pueden aportar información, importante y precisa, sobre la vía aérea en pacientes asmáticos y pueden ser futuros marcadores de inflamación. Las ventajas y desventajas de las técnicas no invasivas se describen en la tabla 2, y el resumen de los biomarcadores más utilizados para medir la inflamación en el asma en la tabla 3.
Ventajas y desventajas de técnicas no invasivas que miden los biomarcadores de inflamación en el asma
| Esputo inducido | Fracción exhalada de óxido nítrico | Condensado Aire exhalado | Nariz electrónica | |
| Ventajas | • Medición de múltiples biomarcadores• Recuento celular diferencial en citospin reproducible• Herramienta válida para el diagnóstico (ej. asma refractaria) o evaluación de terapia antiinflamatoria | • No invasivo• Reproducible• Medición barata• Resultados directos• Permite medidas seriadas• Herramienta para el diagnóstico y evaluación de la terapia antiinflamatoria en asma | • No invasivo• Medición de múltiples biomarcadores• Permite medidas seriadas• Potente herramienta para el diagnóstico y evaluación de terapia antiinflamatoria | • No invasivo y portátil• Casi en tiempo real• Alta dimensión de la señal del biomarcador• Permite medidas seriadas• Potente herramienta para el diagnóstico y evaluación de terapia antiinflamatoria |
| Desventajas | • Marcadores solubles sujetos a dilución• No es posible repetir en un periodo corto de tiempo• Se precisa experiencia y pericia por un especialista• Se necesita medicación de rescate al realizar la técnica• Está contraindicada en asma persistente severo, EPOC, trastornos cardiovasculares activos | • Equipo caro• Muchos factores perturbadores• Se precisa de un muestreo longitudinal dentro de un mismo paciente para tener más información que la que aporta una sola medida | • Los ensayos de detección no son totalmente reproducibles• Caro y alto consumo de tiempo en el procedimiento• Marcadores solubles sujetos a dilución• Se precisa de laboratorio especializado | • La validación externa no se ha completado todavía• El programa SPSS se requiere para el análisis• La tecnología de los sensores está aún en desarrollo |
EPOC: enfermedad pulmonar obstructiva crónica.
Resumen de los biomarcadores más utilizados para medir la inflamación en el asma
| Técnica |
| Esputo inducido |
| Fase sólida o pellet: |
| • Recuento diferencial de las células inflamatorias (eosinófilos/neutrófilos) |
| • Proteína catiónica del eosinófilo |
| • Proteína eosinofílica |
| • Peroxidasa del eosinófilo |
| Fase líquida o sobrenadante: |
| • Proteasas |
| • Eicosanoides: |
| — Cisteinil-leucotrienos |
| — 8 isoprostano (el eicosanoide más estudiado en el esputo inducido) |
| Aire exhalado |
| Peróxido de hidrógeno |
| Óxido nítrico y sus derivados: |
| • Marcador más estudiado |
| Metabolitos del ácido araquidónico (eicosanoides): |
| • Cisteinil-leucotrienos |
| • 8 isoprostano: es el eicosanoide más estudiado pH: |
| • Marcador mejor medido en el CAE |
| Nariz electrónica |
| Compuestos orgánicos volátiles |
| Proteínas séricas |
| Proteína catiónica del eosinófilo |
| Leptina/adiponectina |
| Quimiocina CCL-17 |
| Proteína YKL-7 |
| IL-6, IL-8 |
En 1980, Hargreave y sus colaboradores fueron pioneros en la utilización del recuento de los eosinófilos en la muestra de esputo, como posible medida indirecta de la inflamación de la vía aérea, en pacientes asmáticos2. La European Respiratory Society (ERS) ha elaborado un documento con recomendaciones para la estandarización de la inducción, colección, procesamiento y análisis del esputo inducido3.
En las muestras de esputo se puede obtener dos fases tras el procesamiento y el centrifugado de la muestra: una fase sólida o pellet, con las células entrelazadas entre el moco, y la fase líquida o sobrenadante, sin células.
Biomarcadores en la fase sólida de la muestra de esputoEl contaje de las células inflamatorias en las muestras de esputo se está posicionando como un método complementario muy valioso para la toma de decisiones en el algoritmo del manejo del asma. En 2002, Green y sus colaboradores demostraron que cuando añades el recuento de eosinófilos del esputo en el manejo del asma, sobre todo con relación al ajuste de la medicación, la frecuencia y la severidad de las exacerbaciones de estos pacientes disminuye de forma significativa4.
Esta técnica se ha utilizado para identificar subpoblaciones de asmáticos, que diferencia entre asma eosinofílico y asma neutrofílico y, por tanto, menos propensos a responder a corticoides5. En pacientes con asma moderada severa, la ausencia de eosinofilia en esputo no distingue entre pacientes que sufren asma no eosinofílico y asmáticos cuya eosinofilia es controlada por esteroides. Un estudio reciente ha identificado a la proteína catiónica del eosinófilo, a la proteína eosinofílica y a la peroxidasa del eosinófilo en macrófagos cultivados que han consumido eosinófilos apoptóticos. La proteína catiónica del eosinófilo/peroxidasa del eosinófilo positivas, ambas, en macrófagos están incrementadas en el esputo de pacientes con asma moderada severa tratada con esteroides inhalados, en pacientes con bronquitis eosinofílica y en pacientes que sufren eosinofilia tras la retirada de los corticoides. Por lo tanto, la proteína del eosinófilo, en el macrófago del esputo, es un marcador indirecto de la eosinofilia de la vía aérea que puede identificar asmáticos sometidos a tratamiento con esteroides6.
En conclusión, el recuento de los eosinófilos y los neutrófilos en el asma son considerados marcadores reproducibles y validados para medir la inflamación de la vía aérea de estos pacientes y, su número, se relaciona con la severidad de la enfermedad7.
Biomarcadores en la fase líquida en las muestras de esputoEn la actualidad, existen numerosos mediadores inflamatorios que incluyen una variedad de proteasas, citocinas, quimiocinas, eicosanoides, y que pueden ser medidos en el sobrenadante del esputo. Sin embargo, la validez y reproducibilidad de las distintas técnicas no ha sido todavía establecida. Además de la propia técnica de inducción de esputo, existen otras tres razones que pueden afectar a la medida de los marcadores de inflamación en el sobrenadante de las muestras de esputo.
La primera de ellas es que al procesar la muestra se puede afectar la medición del marcador. En la mayoría de los protocolos se utiliza el ditiotreitol (DTT), que es agente reductor que recupera las células del esputo a través de la escisión de los puentes disulfuro del moco8. Sin embargo, el DTT afecta a los puentes disulfuro y también a la medición de algunos marcadores, incluyendo a muchas citocinas y quimiocinas. Diferentes grupos de investigación han realizado modificaciones en el procesamiento de la muestra de esputo, para optimizar la recuperación de los marcadores9.
En segundo lugar, las diferentes diluciones que se utilizan para cuantificar el marcador pueden afectar al resultado. En la actualidad no existe ningún factor validado para corregir este problema10.
Y por último, algunos marcadores pueden permanecer por debajo del límite de detección de técnicas ampliamente utilizadas, por lo tanto se requieren técnicas de detección más sensibles11.
En el sobrenadante del esputo es posible medir proteasas envueltas en el proceso de degradación de la matriz extracelular. En el asma se han observado incrementos de la metaloproteinasa de la matriz 9 (MMP-9) en el esputo, LBA y biopsias bronquiales12. Diferentes investigadores observan un desequilibrio entre la MMP-9 y el tejido inhibidor de las metaloproteasas (TIMP), observando un aumento de la gravedad del asma dependiente de dicha relación13.
En conclusión, la relación entre MMP-9/TIMP en el esputo es un potente marcador de monitorización de los efectos de las intervenciones terapéuticas realizadas en el remodelado de las vías aéreas.
Los eicosanoides están envueltos en la fisiopatología del asma, en el esputo de pacientes que desarrollan esta enfermedad se aprecian incrementos de los cisteinil-leucotrienos (Cys-LTs), correlacionándose con la severidad del asma, sin verse afectados por los corticosteroides14.
El 8 isoprostano es el eicosanoide más estudiado y sus niveles se han observado en el esputo de pacientes con asma y sujetos sanos, apreciándose un incremento de sus valores en los asmáticos más severos y en las exacerbaciones15.
La técnica de esputo inducido está bien estandarizada, pero tiene limitaciones para su utilización en la práctica clínica habitual, ya que es una técnica laboriosa que requiere de personal de laboratorio entrenado, de una infraestructura específica y los resultados a veces son difíciles de reproducir.
Condensado de aire exhaladoEl condensado de aire exhalado (CAE) representa un método no invasivo que permite medir una amplia variedad de moléculas volátiles y no volátiles del tracto respiratorio, que pueden ser marcadores de inflamación útiles para la monitorización y diagnóstico de enfermedades respiratorias. Los marcadores en el aire exhalado han sido objeto de numerosos estudios en el pasado, introduciéndose, algunos de ellos en la actualidad, en la práctica clínica habitual.
La mayoría de los marcadores de inflamación medidos, incluyendo las citocinas y las quimiocinas, muestran baja reproducibilidad hasta el momento. Por este motivo, los biomarcadores más estudiados en el CAE son los siguientes: el peróxido de hidrógeno (H2O2), el óxido nítrico y sus derivados, los metabolitos del ácido araquidónico (eicosanoides) y el pH.
Incrementos del H2O2 en el CAE, marcador de estrés oxidativo de las células inflamatorias, se han observado en diferentes estudios de pacientes con asma más severo, correlacionándose con la gravedad de la enfermedad y la función pulmonar16. En pacientes con asma alérgico no controlado, sin tratamiento previo con esteroides, se ha demostrado una correlación inversa entre FEV1, la PC20 de la histamina y el H2O2 en el CAE. En pacientes con similares características, la terapia antiinflamatoria con corticoides inhalados reduce el H2O2 en el CAE con incrementos en el FEV117.
Los eicosanoides se pueden medir en el CAE y niveles elevados de los cisteinil-leucotrienos se observan en el CAE de pacientes asmáticos. Al igual que ocurre con el esputo, sus niveles se correlacionan con la severidad de la enfermedad18 y se reducen con terapia antiinflamatoria19. El 8 isoprostano es el prostanoide más estudiado en el CAE, ya que es estable, y detectado tanto en pacientes asmáticos, como en sujetos sanos. En el asma los niveles de 8 isoprostano se correlacionan con la gravedad de la enfermedad, pero sus niveles no se inhiben completamente con el tratamiento corticosteroideo y, por tanto, puede ser un indicador potencial para medir la inflamación de las vías aéreas a pesar del tratamiento antiinflamatorio20. Datos recientes sugieren una relación entre la concentración del 8 isoprostano en el CAE y la inflamación de la vía aérea pequeña21.
Hasta la fecha no hay una estandarización completa de la recogida de las muestras del CAE y de su posterior análisis, por lo que esto dificulta su aplicabilidad en la práctica clínica habitual.
El óxido nítrico exhalado es el más estudiado hasta la fecha, con un incremento de su valor en pacientes con asma sin esteroides, correlacionándose con la eosinofilia que existe en la vía aérea. Se ha propuesto como marcador que mide la inflamación de la vía aérea requiriendo menos experiencia que el recuento celular en el esputo. Se ha utilizado para optimizar el tratamiento en pacientes con asma, ya que puede ser aplicado como un marcador, no invasivo, que indica probable respuesta a la terapia esteroidea22 o pérdida de control, sobre todo si se observa un cambio con respecto a mediciones previas23. Un valor del FeNO menor de 25 partes por billón (ppb) indica poca probabilidad de sufrir asma eosinofílico. Un valor del FeNO por encima de 50 ppb sugiere fuertemente eosinofilia en la vía aérea y una respuesta esteroidea.
En los pacientes con asma de control difícil tratados con corticoides inhalados, el FeNO puede indicar si el pobre control de la enfermedad se debe a la inflamación no controlada que existe en la vía aérea o a una causa no inflamatoria. A pesar de lo anterior, diferentes estudios controlados randomizados han concluido que el FeNO tiene poco valor por sí solo, en comparación con los síntomas clínicos, para optimizar la dosis de esteroides que se precisan para el tratamiento del asma24. Es importante señalar que cada uno de los seis ensayos revisados utilizan diferentes valores de corte del FeNO que van desde 20 a 45 ppb para dirigir las decisiones de tratamiento, por lo que es difícil comparar los resultados de los ensayos. Por el contrario, el FeNO es el mejor marcador para valorar si la dosis de corticoide es suficiente para controlar la inflamación que exista en la vía aérea25.
La variación interindividual en el FeNO, junto con una inherente heterogeneidad del asma incrementa la inespecificidad de la prueba, lo que hace al FeNO una herramienta relativamente insensible para guiar la terapia en todos los pacientes asmáticos. Sin embargo, los valores del FeNO en un individuo son altamente reproducibles, por lo que puede ser más valioso utilizar valores personalizados de corte para cada sujeto, en lugar de utilizar un valor de corte único para todos los pacientes.
El pH es considerado el marcador mejor medido en el CAE, ya que está ampliamente validado y es un biomarcador reproducible, simple de medir y barato. En un estudio realizado por Hunt y sus colaboradores demostraron que el pH del CAE fue significativamente más bajo en pacientes con una crisis asmática que en pacientes con asma controlado, y que el pH del CAE se normalizó al tratar la exacerbación26. Sin embargo, no es un marcador específico de asma, ya que se observa un pH disminuido también en pacientes con fibrosis quística, EPOC, fumadores o infecciones. Por lo tanto, se podría considerar como un posible marcador de monitorización de la actividad de la enfermedad.
Nariz electrónica (e-nose)El aire exhalado contiene una mezcla compleja de compuestos orgánicos derivados del metabolismo sistémico y local, de la actividad inflamatoria y oxidativa. Los compuestos orgánicos volátiles (COV) se pueden utilizar para monitorizar enfermedades respiratorias e incluso sistémicas. La técnica es completamente no invasiva y permite un alto rendimiento del análisis metabólico. La técnica estándar de detección de los componentes moleculares en el aire exhalado es la cromatografía de gases acoplada a la espectrometría de masas. La nariz electrónica utiliza nanosensores con diferentes sensibilidades para múltiples COV basadas en distintas tecnologías: sensores colorimétricos, sensores ópticos, etc. La aplicación clínica de la nariz electrónica está emergiendo junto con un rápido desarrollo instrumental y estadístico.
Los estudios transversales con la nariz electrónica han demostrado poder discriminar entre enfermedades respiratorias. Esto se ha observado en pacientes con cáncer de pulmón frente a sujetos sanos y frente a pacientes con EPOC27. Los pacientes con asma se pueden diferenciar de los controles sanos y de los pacientes con EPOC con un nivel de precisión de un 80–100%28. Los datos preliminares, usando sets de validación externa de pacientes con asma y EPOC están empezando a ser útiles y muestran datos satisfactorios. Esto sugiere que la nariz electrónica puede tener un papel en el diagnóstico diferencial de las enfermedades respiratorias.
En el caso del asma, además de ser útil para el diagnóstico, puede facilitar la identificación de diferentes patrones de COV que discriminen de forma rápida y sencilla distintos fenotipos inflamatorios celulares que existen en esta enfermedad, permitiendo un manejo terapéutico más óptimo.
Para la implantación definitiva de esta técnica en la práctica clínica habitual se necesitan más estudios con un volumen grande de casos que permitan determinar los patrones de COV más específicos de cada enfermedad.
Proteínas séricasLos estudios de biomarcadores en asma tienden a concentrarse en los cambios en la composición del aire exhalado. Aunque en principio el asma es una enfermedad de las vías aéreas, hay evidencias que sugieren que existe un componente sistémico en la enfermedad29. En este caso, los metabolitos en circulación pueden ser capaces de actuar como biomarcadores del asma. La recogida de sangre, el aislamiento del suero y su análisis son técnicas altamente estandarizadas, mínimamente invasivas y una fuente ideal de datos reproducibles. Las proteínas en suero han ganado credibilidad como biomarcador en otras enfermedades inflamatorias respiratorias. En el caso del asma, los niveles de la proteína catiónica del eosinófilo se incrementan en respuesta a un estímulo alergénico, y disminuyen después de evitar el alérgeno o con la terapia con corticosteroides, aunque en una menor proporción que los eosinófilos en el esputo o el FeNO. Sin embargo, en un ensayo randomizado, realizado en pacientes con asma, tratados según el nivel de la proteína catiónica del eosinófilo, se observó que los síntomas no mejoraron si se compara con los pacientes tratados con técnicas de monitorización tradicional30. Además, la proteína catiónica del eosinófilo es un marcador inespecífico de asma, puesto que un estudio en pacientes pediátricos con fibrosis quística y bronquiolitis viral ha demostrado la existencia de esta proteína.
Numerosos estudios han demostrado una asociación entre el asma y la obesidad. El balance entre la leptina/adiponectina es un importante regulador del metabolismo de la grasa corporal y su relación se altera en la obesidad. Varios estudios han demostrado niveles de leptina y adiponectina en sangre alterados en pacientes obesos y no obesos con asma31.
Otro marcador alterado en la circulación de los pacientes con asma es la quimiocina CCL-17 liberada por las células dendríticas y células epiteliales después del contacto con alergeno, envuelta en el reclutamiento de las células TH2 en el pulmón. Los niveles de CCL-17 en el esputo están incrementados en los pacientes asmáticos32 y también se observan niveles de CCL-17 incrementados en el suero de niños con asma y bajos en niños tratados con corticosteroides33.
La proteína YKL-7 también está incrementada en el suero de pacientes adultos con asma y se correlaciona con los niveles de esputo y con varios marcadores clínicos de severidad del asma34.
Finalmente, las células epiteliales en el asma liberan varias proteinasas y quimiocinas inflamatorias, como la IL-6 y la IL-8, necesarias para la activación de la cascada de la inflamación. Es posible que niveles de estas moléculas en la circulación puedan ser de ayuda para advertir una exacerbación o incluso indicar un subtipo de inflamación particular en un paciente.
Hasta hace años el asma se ha descrito como una enfermedad de la vía aérea, pero en la actualidad parece que pudiera ser una enfermedad sistémica como lo es la EPOC, por lo que la determinación de las proteínas séricas en la clínica habitual podrían ser útiles como biomarcadores de la enfermedad, pero son necesarios más estudios para implementarlo en la guías de práctica clínica.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.