Introducción
El diagnóstico etiológico del derrame pleural continúa siendo un problema en la práctica clínica ya que existen más de 100 causas.
Dentro de los exudados el derrame pleural maligno (DPM) es el más frecuente principalmente en los pacientes con edad superior a 50 años. Las técnicas más utilizadas como patrón de referencia diagnóstica son la citología y la biopsia pleural con una especificidad (E) elevada y una sensibilidad (S) intermedia1,2.
La determinación sérica y en líquido pleural (LP) de marcadores tumorales (MT) para el diagnóstico del DPM presenta una elevada E pero una S baja. Su aplicación en la clínica se debe considerar en aquellos casos en los que sus niveles alterados puedan ser capaces de modificar la probabilidad prepueba, para permitir la toma de decisiones en función de la misma y la aplicación de otras técnicas invasivas atendiendo a las características clínicas de los pacientes.
Las variaciones observadas en los resultados de varias series entre S y E de un mismo MT depende de varios factores: a) tamaño de la muestra; b) los puntos de corte para cada marcador; c) la técnica de laboratorio utilizada y d) la histología o tipo de tumor maligno. Aunque ninguno de los MT ha demostrado ser órgano específico, hay cierta tendencia en algunos de ellos a encontrarse elevados en función de la estirpe y origen tumoral primitivo.
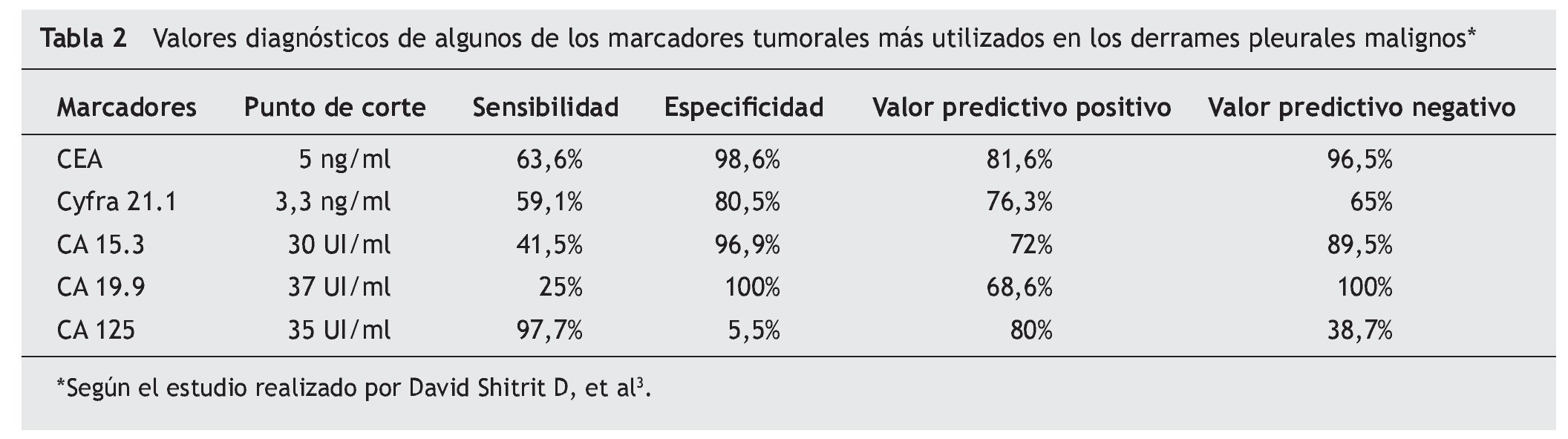
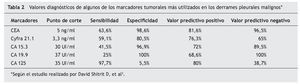
En los últimos años han aparecido numerosos estudios con diversas moléculas antigénicas expresadas en pacientes con DPM. Hemos querido reflejar en esta revisión la utilidad de algunos de estos marcadores (tabla 1). Los MT en bioquímica se miden mediante métodos cuantitativos (quimioluminiscencia/radioinmunoanálisis [RIA]/enzimoinmunoanálisis [ELISA]). El punto de corte y eficacia de los más utilizados se resume en la tabla 2 según el estudio de Shitrit et al3, en el que se analizan 116 casos y se realiza una revisión de la literatura. Los MT en inmunohistoquímica se miden fundamentalmente de forma cualitativa, clasificándose en epiteliales y mesoteliales en función de su expresividad en las muestras pleurales obtenidas.
Marcadores tumorales en bioquímica
Antígenos asociados a tumor
Antígeno carcinoembrionario (CEA)
Es una glucoproteína que forma parte del glucocálix del epitelio derivado del endodermo, descubierta por Gold y Freedman en 1965 en pacientes con cáncer de colon. Sin embargo, el CEA no es un marcador específico de tumor sino más bien un marcador plasmático asociado a tumor. Aparece sobreexpresado particularmente en adenocarcinomas de colon y recto, especialmente en tumores bien diferenciados, pero pueden observarse incrementos de la cifra de CEA en otros tumores como el cáncer de mama, pulmón, páncreas, estómago, vejiga y tiroides. Incluso pueden observarse niveles discretamente elevados en ausencia de enfermedades malignas, por ejemplo, en fumadores, pacientes con tuberculosis pulmonar, enfermedad inflamatoria intestinal y en hepatopatías, ya que el CEA plasmático se aclara normalmente a través del hígado.
La presencia de CEA elevado en LP resulta controvertida a pesar de haber pasado más de 30 años desde su descripción. Constituye uno de los marcadores más utilizados, en general, en los procesos tumorales y, en particular, en el diagnóstico del DPM. Su medición se efectúa por quimioluminiscencia o RIA y los niveles pueden variar según la técnica empleada.
Antígeno de carcinoma de células escamosas (SCC)
Ha sido descrito como un marcador con alta S para SCC y baja en linfoma, aunque diferentes estudios en los que la determinación se realizó mayoritariamente por RIA han demostrado que no añade valor diagnóstico en la diferenciación del DPM respecto del benigno4.
Antígenos carbohidratados
Antígeno carbohidratado 125 (CA 125)
Es una glucoproteína de alto peso molecular que se sintetiza en los epitelios derivados de la cavidad celómica. Se encuentra en estructuras variadas como pleura, peritoneo, pericardio, miocardio, trompa de Falopio, endometrio, endocérvix y fondo vaginal. Por tanto, puede ser sintetizada tanto por células normales como malignas. Se emplea como marcador en la evolución del cáncer de ovario tanto en su tratamiento como en su seguimiento. Este marcador puede estar elevado en otras neoplasias como adenocarcinomas (mama, pulmón, de origen digestivo), linfomas, leiomiosarcomas o melanomas, patología ginecológica benigna (tumores benignos, salpingitis agudas o crónicas, abscesos tuboováricos, endometriosis), hepatopatías (granulomatosis hepática, hepatitis crónica alcohólica o vírica), pancreatitis, insuficiencia renal, derrame pericárdico o pleural, sarcoidosis, tuberculosis peritoneal, colagenosis y procedimientos quirúrgicos o que causan una rotura traumática del peritoneo, como la diálisis peritoneal.
Antígeno carbohidratado 15.3 (CA 15.3)
El CA 15.3 es una glucoproteína de alto peso molecular usada principalmente en el diagnóstico, seguimiento y evaluación de la respuesta en el cáncer de mama. Este marcador también puede aparecer elevado en otros carcinomas (ovario, pulmón, páncreas, hígado), y en patologías no oncológicas como tumores benignos de ovario, enfermedades benignas de la mama, hepatopatía crónica o cirrosis hepática, sarcoidosis, tuberculosis, lupus eritematoso sistémico o disfunción tiroidea.
Antígeno carbohidratado 19.9 (CA 19.9)
Es una glucoproteína de peso molecular superior a los 400 kDa con características estructurales comunes a los grupos sanguíneos de Lewis, y un antígeno tumoral cuyos niveles séricos se elevan fundamentalmente en los tumores gastrointestinales, sobre todo los de origen pancreático, aunque también en procesos no malignos como la pancreatitis y algunas enfermedades tiroideas. No se han encontrado diferencias estadísticamente significativas entre el valor diagnóstico de la determinación del CA 19.9 en LP y la ratio LP/suero5.
Antígeno carbohidratado 72.4 (CA 72.4)
El CA 72.4 ha sido determinado en LP en pocos estudios6-8 y aunque los resultados confirman una alta S en todo tipo de adenocarcinoma, también se encontraron altos niveles en carcinoma de célula escamosa y en casos aislados de pacientes con linfoma. En un estudio posterior de Villena et al9 se encuentra una S inferior en probable relación con diferencias en el origen de los tumores incluidos en su serie (mayor número de mesoteliomas y tumores hematológicos que usualmente tienen bajos niveles del marcador y menor número de tumores gastrointestinales que comúnmente, junto con el adenocarcinoma ovárico, lo incrementan). Demuestran además que el CA 72.4 en el LP aumenta la S diagnóstica de la citología aislada (57% frente a 46%), y que los niveles de CA 72.4 (determinados por RIA) fueron significativamente más elevados en DPM respecto a los benignos. Para un punto de corte de CA 72.4 > 10 UI/ml, la S fue del 35% y la E del 98%. Para conseguir la E del 100% el punto de corte se elevó a 16 UI/ml, obteniendo una S del 30%.
Antígeno carbohidratado 549 (CA 549)
El CA 549 es un marcador mucinoso descrito en 1987. Se mide con técnica de RIA que incluye dos anticuerpos monoclonales (BC4E 549 y BC4N). No se trata de un marcador órgano específico. Se utiliza en el cáncer de mama pero también puede estar elevado en la patología benigna de mama y de hígado, así como en tumores metastáticos de ovario, pulmón, próstata, colon y endometrio10. El mejor campo de aplicación para CA 549 es la monitorización y detección precoz de las recurrencias de cáncer de mama, no siendo suficientemente sensible ni específico para el diagnóstico de esta enfermedad11,12.
Enzimas
Enolasa neuroespecífica (NSE)
La NSE es una isoenzima de la enolasa encontrada en neuronas del sistema nervioso central y periférico y en células precursoras de descarboxilación. La dosificación de NSE depende no sólo de las características neuroendocrinas de las células sino también del turnover celular y de la actividad glucolítica anaeróbica.
Los estudios han detectado niveles significativamente aumentados de NSE especialmente en tumores neuroendocrinos y en el carcinoma broncogénico de células pequeñas (SCLC), comparado con otros grupos de carcinoma no célula pequeña y mesoteliomas, y respecto de procesos benignos3,13,14. El 50-70% de SCLC exhiben altos niveles pleurales de NSE, especialmente en la enfermedad extendida.
La serie de Romero et al15 es una de las primeras que estudia la NSE en LP. Para un punto de corte de NSE > 12 ng/ml la S fue de 51% y la E de 74%. Para conseguir una E de 100% se elevó el valor de corte a 40 ng/ml pero se redujo la S al 18,6%. Posteriormente Kuralay et al13 encontraron más alta S y E de la NSE en el LP con un punto de corte de 8,7 ng/ml, y la NSE pleural fue significativamente más elevada en SCLC comparado a otros DPM (en el 100% de los SCLC con DPM y en el 41,1% de los no SCLC con DPM) y sólo en el 4,7% de los derrames pleurales benignos (falsos positivos en derrames tuberculosos). El aumento de NSE en enfermedades benignas puede ser debido a la destrucción de eritrocitos, plaquetas y linfocitos que contienen NSE en su citoplasma. En el estudio de Alatas et al16 no se observan diferencias entre niveles de NSE en LP para DPM o benigno. Sin embargo, en un estudio más reciente17, la determinación mediante ELISA de NSE en LP sí muestra diferencias estadísticamente significativas (p < 0,001) entre DPM y benigno para un punto de corte en LP de 12,21 ng/ml con una S del 68,4% y una E del 75%.
Citoqueratinas (CK)
Las CK son péptidos fibrosos componentes del citoesqueleto de casi todas las células epiteliales y de algunas no epiteliales. Se clasifican numéricamente según peso molecular y punto isoeléctrico y se han identificado 19 subtipos.
El Cyfra 21.1, el antígeno polipeptídico tisular (TPA) y el antígeno polipeptídico específico tisular (TPS) son tres componentes de CK que actualmente se utilizan como MT18.
Fragmento de la citoqueratina 19 (Cyfra 21.1)
Los niveles séricos de este marcador se encuentran elevados en los carcinomas broncogénicos no célula pequeña, sobre todo en los escamosos. Si tenemos en cuenta que más de la mitad de los DPM son secundarios a un carcinoma broncogénico, muchos autores consideran la determinación de este marcador en LP muy prometedora19 y algunos estudios apuntan a su valor en el diagnóstico del derrame pleural secundario a mesotelioma pleural maligno16.
Antígeno polipeptídico tisular (TPA)
Es un antígeno proteico, componente de las CK 8, 18 y 19, típicas del epitelio sano y presentes en algunos carcinomas. Se puede identificar en suero, en fluidos corporales y en tejidos mediante técnicas de RIA20. Se expresa y se detecta en el citoplasma de las células de tumores de estirpe epitelial, incluido el carcinoma broncogénico. Cuando se emplea en el seguimiento de estos tumores su determinación sérica es útil para valorar la respuesta al tratamiento21,22. También se detecta TPA en las células mesoteliales normales. Los escasos estudios que intentan validar el empleo de este marcador en el LP muestran una escasa S y E por lo que su valor es limitado23. Para obtener suficiente E el valor de corte debe ser más alto que el empleado en suero (80-100 UI/ml). A pesar de utilizar valores de hasta 2.000 UI/ml en LP se obtiene baja S, por lo que se ha desestimado su uso24.
Antígeno polipeptídico específico tisular (TPS)
Esta proteína se ha identificado usando anticuerpos monoclonales que reconocen el epítope específico M3 del TPA liberado por células tumorales en proliferación. Su liberación y concentración extracelulares están relacionadas con la síntesis de ADN.
El TPS se ha aislado también en el suero de pacientes con patologías pulmonares inflamatorias benignas. Presenta, por tanto, una baja E en la distinción de patologías benignas y malignas (para un punto de corte de > 80 UI/ml la S es de 64% y la E de 69%)25.
El trabajo de un grupo español ha demostrado que ni el análisis del TPS en LP (con un valor de corte > 20.000 UI/ml obtuvieron una S de 21% y una E del 98%), ni la relación de este valor frente a la determinación en suero son útiles tampoco en el diagnóstico de los derrames pleurales26.
Péptidos de membrana
Mesotelina
La mesotelina es un péptido de membrana que se expresa normalmente en la superficie de las células mesoteliales, así como en varios tumores como el mesotelioma, los carcinomas de ovario, páncreas, gastrointestinales, pulmonares o sarcomas. Existe una forma soluble que se libera de la
membrana y se puede detectar en el suero de los pacientes con mesotelioma. Se eleva principalmente en los pacientes con mesotelioma epitelial, y en menor concentración en los pacientes con exposición a asbesto, con o sin patología pleural27. Se ha planteado que pudiera tener un papel en la detección precoz del mesotelioma epitelial, utilizándose en el cribaje de los sujetos expuestos a asbesto28, si bien su S y E distan en el momento actual de alcanzar los valores idóneos para su recomendación como método diagnóstico29, monitorización de la enfermedad, valoración de la respuesta al tratamiento o la detección de recidivas30.
Estudios de combinación de marcadores tumorales en líquido pleural
Aunque la lista de publicaciones y de marcadores estudiados es amplia6,31,32, en un estudio reciente con 416 pacientes (166 con DPM, 77 con derrame probablemente maligno y 173 con derrames benignos), Porcel et al33 observaron que un panel de 4 marcadores en el LP (CEA, CA 125, CA 15.3, y Cyfra 21.1) alcanzaban una S del 54%. La combinación de estos marcadores conjuntamente con la utilización de la citología aumentó la S a un 69%. Más de un tercio (37%) de los DPM con citología negativa presentaron al menos un marcador positivo.
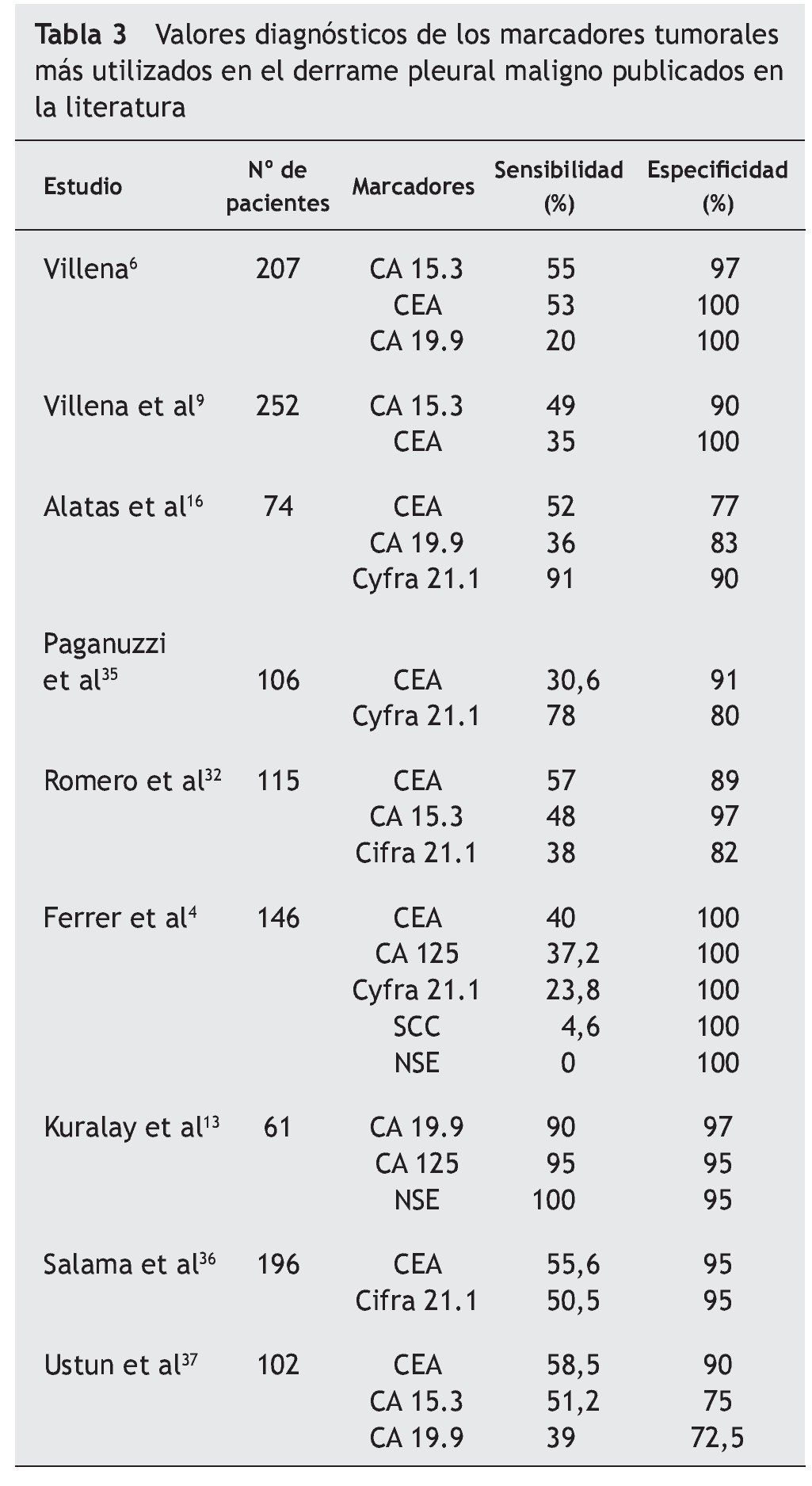
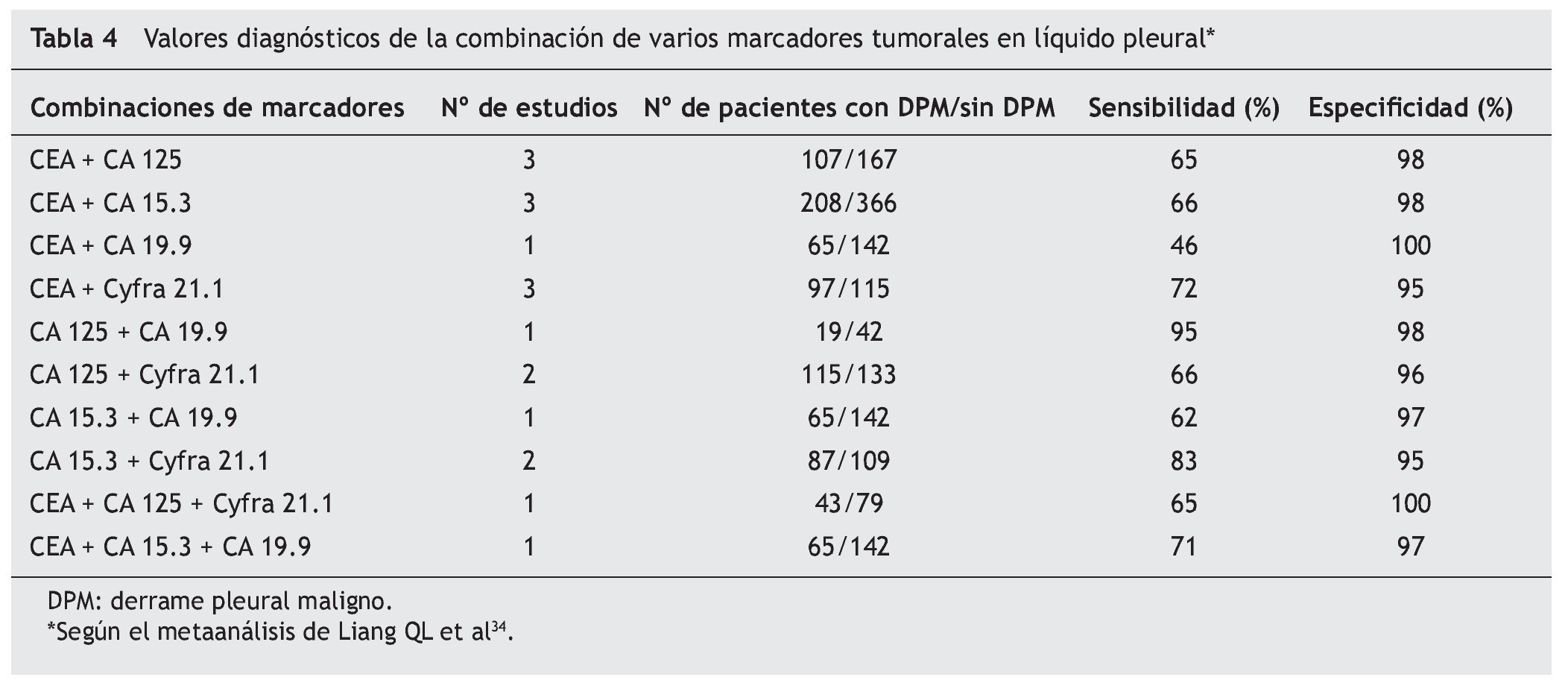
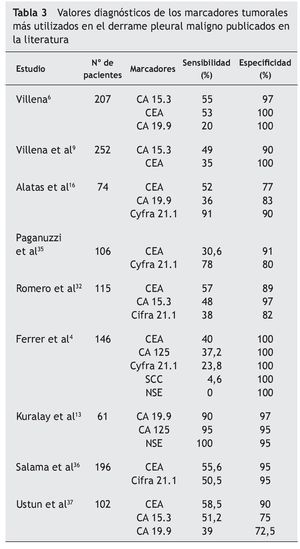
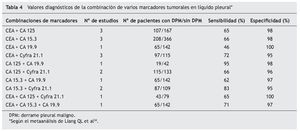
En un reciente metaanálisis34, Liang et al seleccionaron 29 artículos y analizaron los datos disponibles de cinco marcadores en LP (CEA, CA 125, CA 15.3, CA 19.9, y Cyfra 21.1). La S y E resultante del CA 125 fue de 48 y 85% y del CA 15.3 de 51 y 96%, respectivamente. También describieron una E elevada en el caso del CA 19.9 y del Cyfra 21.1 que según las series osciló entre un 73-100% y un 80-100% y una S baja de entre el 13-89% y 20-91%, respectivamente. En éste y en otros trabajos4,6,9,13,16,32,35-37 (tabla 3) se concluye que todos estos marcadores son muy específicos pero insuficientemente sensibles para diagnosticar el DPM y que la combinación de dos o más (CEA y Cyfra 21.1, CA 15.3 y Cyfra 21.1, CEA y CA 19.9) aumenta la S y la rentabilidad diagnóstica frente a su uso individual (tabla 4)34.
En cuanto a los estudios de supervivencia en base a niveles de marcadores en LP en pacientes con DPM tipo adenocarcinoma y carcinomas escamosos, Bielsa et al38 han pu blicado recientemente un estudio en 224 pacientes con DPM a los que se les midió el CEA, CA 15.3, CA 125 y Cyfra 21.1. La combinacion de CA 125 con niveles superiores a 1.000 U/ml y Cyfra > 41 UI/ml durante el primer mes desde el diagnós tico predijo una baja supervivencia (4 frente a 11,7 meses con una p = 0,03 para el CA 125 y 0,3 frente a 8,4 meses con una p = 0,003 para el Cyfra). Ni el CA 15.3 ni el CEA predijeron cambios en la supervivencia.
Varios estudios encuentran que la determinación de NSE en LP mejora su sensibilidad con la combinación de otros MT. Sánchez de Cos et al39 encuentran en la combinación CEA y NSE una S del 80,9% y E del 91,4% y en el estudio de Lee et al17 la combinación de C15.3 y NSE alcanza una mayor E con menor S que sus determinaciones aisladas (S: 57,5% y E: 91,9%). En el estudio de Miedougé et al8, la asociación Cyfra, NSE y SCC puede discriminar adenocarcinoma de carcinoma de célula pequeña pulmonar con una predicción del 89,4%. Por tanto, la S para el diagnóstico de DPM del NSE en LP, incluyendo tumores de célula pequeña, es baja. La determinación de NSE en LP de forma aislada posee un escaso valor para el diagnóstico de DPM, pero la combinación de dos o más MT sí puede ser más sensible.
Dos grupos españoles han estudiado el marcador CA 549 en LP9,40. En el primero se combinó CA 549 con la medición de CEA y en el segundo, además, con CA 15.3 y CA 72.4. En ambos estudios la S de CA 549 para malignidad fue baja pero su E fue del 99%. La rentabilidad diagnóstica aumentó cuando se combinó con otro marcador. En el estudio de Villena et al, cuando se descartaron los mesoteliomas y las neoplasias hematológicas, la combinación de tres marcadores (CA 49, CEA y CA 15.3) mostró una S del 77% y una E del 100%. La suma de cualquier marcador mejoró el valor diagnóstico de la citología.
Marcadores tumorales en inmunohistoquímica
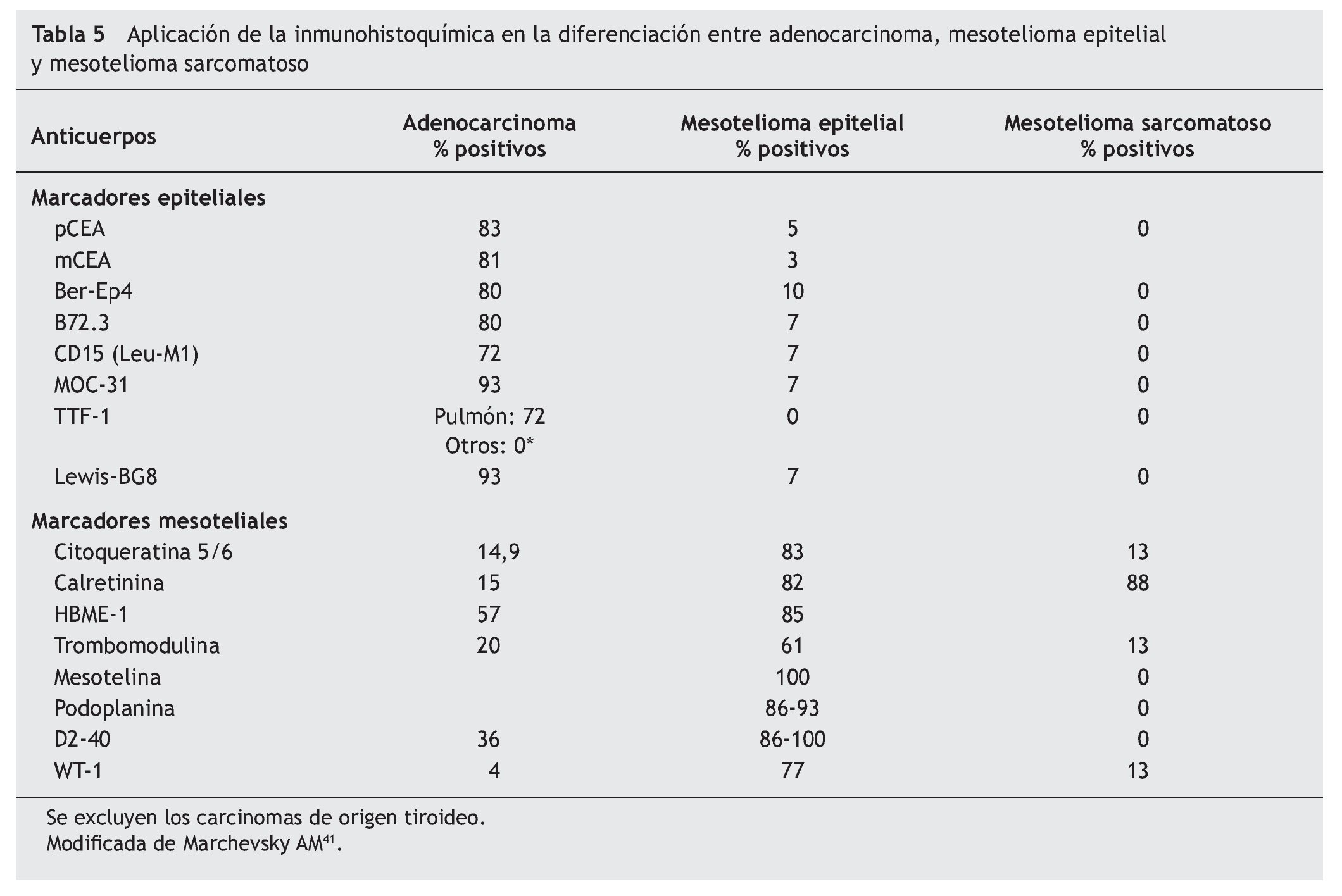
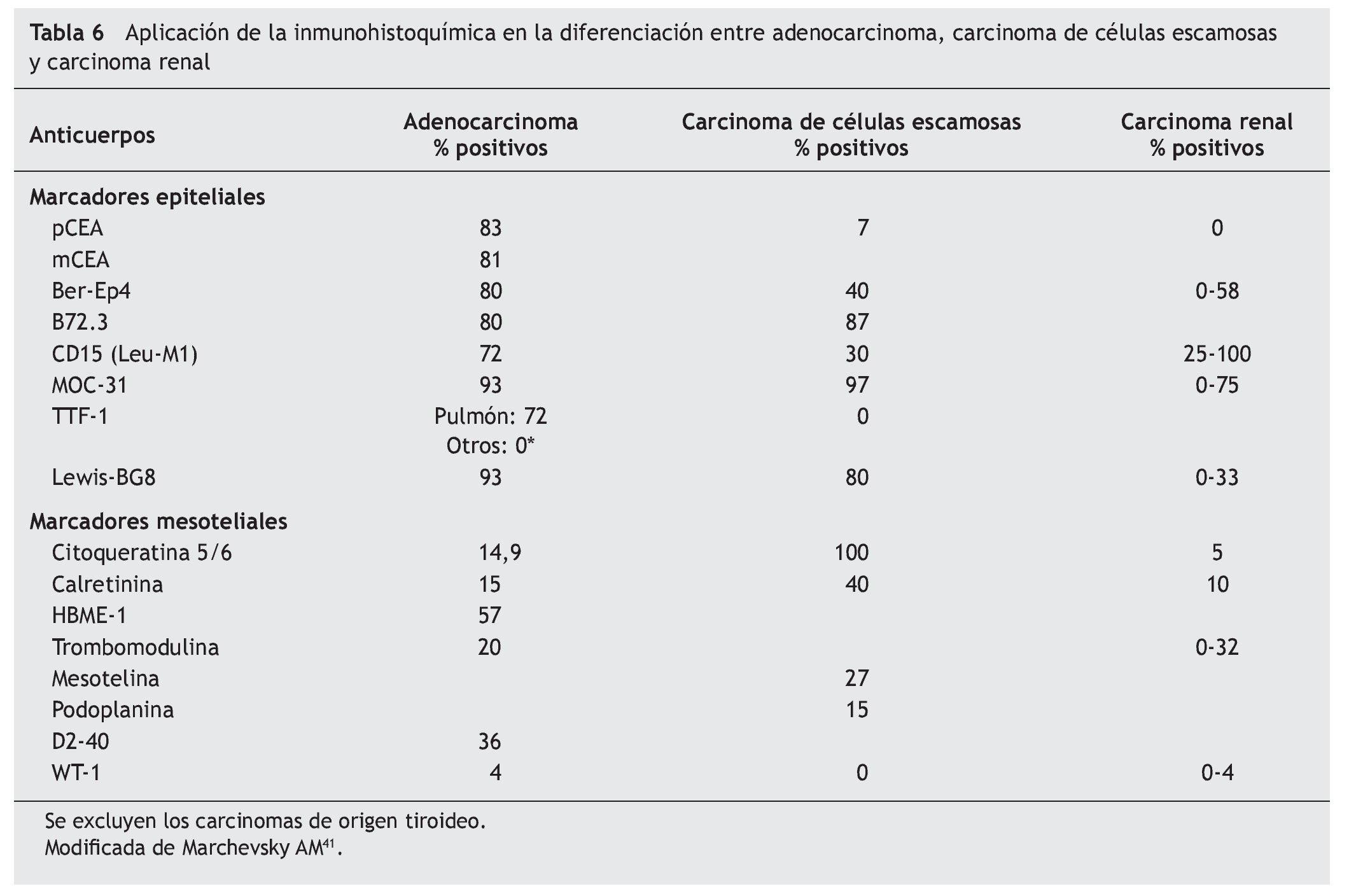
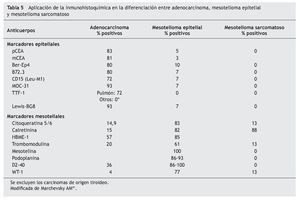
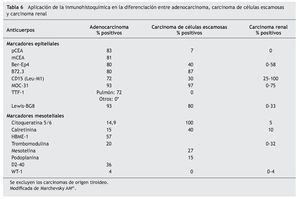
El panel de marcadores que generalmente se propone para la distinción entre mesotelioma maligno y otras neoplasias generalmente incluye dos o más marcadores epiteliales que permitan excluir el diagnóstico de carcinoma y dos o más marcadores mesoteliales que dejen confirmar el diagnóstico de mesotelioma. La mayor parte de estos marcadores tiene una excelente sensibilidad y especificidad para el diagnóstico diferencial entre la variante epitelial del mesotelioma y el adenocarcinoma, particularmente de origen pulmonar. Sin embargo, su eficacia es menor en el diagnóstico de la variante sarcomatosa del mesotelioma y en el diagnóstico diferencial entre el mesotelioma y el carcinoma de células escamosas, el carcinoma renal, ovárico o de otro origen (tablas 5 y 6)41.
Epiteliales
Antígeno carcinoembrionario: policlonal (p) y monoclonal (m)
El CEA fue el primer marcador de inmunohistoquímica que se utilizó para la diferenciación entre los mesoteliomas epitelioides o sarcomatosos y el adenocarcinoma pulmonar42. El CEA se expresa en el 50-90% de los adenocarcinomas pulmonares, y en más de dos tercios de los carcinomas epidermoides pulmonares. Sin embargo, es frecuente que el CEA sea negativo en otros carcinomas, como los renales43, por lo que no es útil para la diferenciación con estos tumores. El marcador es negativo en casi la totalidad de los mesoteliomas44.
En un principio se utilizaba el CEA policlonal, con el que se obtenían algunos falsos positivos por reacciones cruzadas, pero posteriormente mejoró la especificidad (97%) con la utilización del CEA monoclonal, con una ligera pérdida en la sensibilidad (81%)41,45.
Anticuerpo monoclonal Ber-Ep4
Reacciona con un epítope, presentado por 2 polipéptidos de 34 y de 39 kDa, que se localiza en las células epiteliales humanas y no lo hace con las células no epiteliales o neoplásicas. Esta propiedad lo hace especialmente útil en las enfermedades del aparato respiratorio para diferenciar tumores no epiteliales de los carcinomas indiferenciados, mesoteliomas de adenocarcinomas y células mesoteliales reactivas de las células de carcinoma en LP46. Tiene poca expresividad en el mesotelioma epiteloide y en las células mesoteliales reactivas y detecta una alta proporción de adenocarcinoma pulmonar, con un 80% de S y un 90% de E. La tasa de positividad es más baja para los carcinomas no pulmonares, especialmente en el caso de los tumores renales.
Anticuerpo monoclonal B72.3
El B72.3 reacciona con una glucoproteína de gran peso molecular, TAG72 (tumor associated glycoprotein-72). Se expresa en una gran variedad de adenocarcinomas (pulmón, mama, tracto gastrointestinal, ovario, páncreas y endometrio) y se muestra mayoritariamente negativo en los mesoteliomas malignos y en las células mesoteliales reactivas. También tiene poca o nula reactividad para el carcinoma renal, melanoma, sarcoma, linfoma y leucemia45.
Anticuerpo monoclonal Leu-M1 (CD-15)
Reacciona con el epítope X-hapten o Lewis-X en la membrana de los mielomonocitos. Tiene especial afinidad por las células de Reed-Stenberg pero también reacciona con los linfocitos T activados. Presenta una alta E y baja S para diferenciar mesotelioma y adenocarcinoma. Sin embargo, como la mayoría de los tumores renales expresa este marcador, es útil para distinguir estos tumores de los mesoteliomas epiteliales47.
Marcador epitelial MOC-31
El biomarcador MOC-31 es una glucoproteína transmembrana de función desconocida que está presente en la membrana de las células epiteliales, pero no en las mesoteliales48,49. La reactividad frente a este marcador en el LP es un indicador de la etiología maligna del derrame50. Se ha demostrado su utilidad en la diferenciación de adenocarcinoma, mesotelioma y células mesoteliales reactivas en muestras de LP51, mostrando mayor expresividad en el primero y escasa o nula en los dos últimos.
Factor 1 de transcripción tiroidea (TTF-1)
El TTF-1 es una proteína de regulación nuclear de 38 kDa que contiene un homodominio del gen de la familia Nkx2. Par ticipa en el crecimiento celular y en su proceso de diferenciación. Se expresa de forma selectiva en las células epiteliales de origen tiroideo y pulmonar, así como en ciertas áreas del cerebro fetal (diencéfalo)52-54. En el pulmón se expresa en los neumocitos tipo II y en las células del epitelio bronquiolar no ciliado55. Se ha comprobado que es un marcador útil en el cáncer de pulmón, tanto en muestras citológicas como histológicas56. En concreto, presenta una alta frecuencia de expresión en el carcinoma de células pequeñas y en el adenocarcinoma, mientras que en el carcinoma epidermoide y en el de células grandes no muestra expresión o lo hace en muy baja frecuencia57. Por otra parte, los adenocarcinomas de origen distinto al pulmonar y al tiroideo no muestran reactividad frente al TTF-1, por lo que este factor constituye un marcador sensible y altamente específico en la diferenciación entre adenocarcinoma primario y metastásico de pulmón58,59. También se ha demostrado su utilidad para distinguir entre adenocarcinoma metastático pulmonar y extrapulmonar en muestras de LP60.
Marcador epitelial Lewis BG-8
Al igual que sucede con el MOC-31, los adenocarcinomas metastásicos tienden a teñirse positivamente y las células mesoteliales reactivas o las células mesoteliales malignas no muestran reactividad con estos anticuerpos61,62.
Mesoteliales
Citoqueratinas
En los epitelios normales la expresión de CK 5 se encuentra restringida a las células basales de los epitelios glandular, escamoso, mioepitelio y mesotelio; debido a esto y a la particularidad de que las células epiteliales mantienen su patrón de CK durante la malignización y la metástasis, es útil en la tipificación inmunohistoquímica de mesoteliomas y en el diagnóstico diferencial con adenocarcinomas de pulmón. La CK 6 se expresa en epitelios escamosos proliferativos, frecuentemente junto con CK 16. La aplicación conjunta de anticuerpos contra CK 5 y 6 (CK 5/6) permite distinguir entre carcinomas de células escamosas poco diferenciadas y algunos adenocarcinomas. Algunos adenocarcinomas extrapulmonares también pueden expresar CK 5/6 (páncreas, ovario, endometrio).
En LP se ha observado alta E y S de CK 5/6 para mesotelioma, siendo uno de los marcadores aconsejados en el diagnóstico diferencial entre esta patología y las metástasis de adenocarcinoma63. No obstante, se recomienda incluirlo en paneles con otros marcadores como p63, D2-40 y WT-1 para ayudar en esta diferenciación64.
Calretinina
Es una proteína ligadora del calcio con función tampón al prevenir un aumento excesivo de calcio intracelular. Se estudia mediante tinción inmunohistoquímica con antisuero anticalretinina, considerando positivas las muestras con > 5% de tinción moderada-fuerte. Se ha demostrado una altísima S y E para las células del mesotelio, tanto normal como maligno, en líquidos serosos62,65. Para el diagnóstico de líquidos benignos y malignos la E sube hasta el 100% y la S al 97,1% al combinar calretinina con E-cadherina66. La combinación de tinción negativa para calretinina y positiva para marcadores epiteliales ha demostrado elevada S y E para adenocarcinoma67-70.
Aunque la calretinina es un marcador inmunohistoquímico sensible para mesotelioma, no es específico y tiñe en ocasiones adenocarcinomas. Se consigue aumentar su S y E de forma muy importante para el diagnóstico de mesoteliomas al asociarlo a otros marcadores como CK 5/6, D2-40, HBME-1 y WT-162,64.
Podoplanina
Se trata de una mucoproteína que fue inicialmente identificada en las células epiteliales glomerulares de los ratones (podocitos). Los capilares linfáticos también son capaces de expresar esta proteína. Muestra unas altas E y S en el diagnóstico del mesotelioma de estirpe epitelial, por lo que algunos autores han propuesto su inclusión en el panel de screening de diferenciación del mesotelioma71. Resulta, por tanto, un marcador útil para diferenciar esta patología de otras entidades tales como el adenocarcinoma pulmonar metastático y otro tipo de tumores de estirpe sarcomatosa (sarcoma de Kaposi, linfangioma y subgrupos de angiosarcomas).
Mesotelina
Como marcador inmunohistoquímico ha mostrado su positividad sobre las células mesoteliales, en particular de estirpe epitelial, pero también se ha mostrado expresivo en el carcinoma de células escamosas, sin que por el momento exista consenso para su inclusión en los paneles de marcadores para el diagnóstico diferencial de los DPM41.
Trombomodulina
Se trata de una glucoproteína que se distribuye entre las células mesoteliales, endoteliales, osteoblastos, fagocitos mononucleares y algunos epitelios. Se han realizado estudios determinando la trombomodulina junto a otros marcadores para conocer su utilidad en el diagnóstico del mesotelioma pleural y su diferenciación con el DPM (adenocarcinoma, metastático, etc.) como el de Yaziji et al72. La trombomodulina presentó una S del 68% y una E del 92%. Comparativamente su E para el diagnóstico de mesotelioma fue superior a CK 5, calretinina, vimentina y HBME-1. Sin embargo, la S fue inferior al resto de las moléculas estudiadas (calretinina, HBME-1, CK y mesotelina).
Anticuerpo monoclonal HBME-1
El HBME-1 se ha empleado en el diagnóstico diferencial del mesotelioma de estirpe epitelial, ya que no muestra expresividad en la variante desmoplástica/sarcomatosa. Sin embargo, es menos eficiente que otros marcadores en la distinción entre mesotelioma y adenocarcinoma metastático, ya que se puede mostrar positivo en ambos. Por ello, su uso es bastante limitado en la práctica diaria73.
Anticuerpo monoclonal D2-40
El D2-40 reconoce un antígeno oncofetal presente en las células germinales fetales. Tiene unas altas S y E por el endotelio linfático pero este anticuerpo también se expresa en las células mesoteliales normales y reactivas, por lo que se ha sugerido su utilidad en el diagnóstico del mesotelioma. Su S para la tinción en la membrana celular se sitúa por encima del 85% para los mesoteliomas epiteliales41. La tinción en el mesotelioma es difusa, mientras que el 15% de otros tumores que son positivos a este marcador presentan una tinción focal71. Algunos autores también han estudiado su valor para diferenciar el mesotelioma sarcomatoide del adenocarcinoma sarcomatoide pulmonar74.
Proteína WT-1
El WT-1 es un gen supresor tumoral localizado en el cromosoma 11p13 que se expresa en tejidos derivados del mesodermo y urogenitales. La proteína del gen WT-1 es una proteína nuclear de 52-52 kDa que es útil como marcador de células mesoteliales tanto en muestras de tejido como citología, mostrando una mayor positividad en los mesoteliomas epiteliales que en los sarcomatosos. No obstante, también muestra expresividad en los carcinomas peritoneales primarios, en los carcinomas papilares serosos y de alto grado de ovario y endometrio y en una pequeña proporción de adenocarcinomas mamarios. Todo ello puede representar un problema cuando se evalúan DPM en mujeres75.
Conclusiones
El valor diagnóstico de los MT en la diferenciación entre DPM y benignos, tanto en sangre periférica como en LP, ha sido evaluado en los últimos años, pero su papel clínico no ha sido definitivamente establecido. La combinación de varios MT puede aumentar la capacidad diagnóstica y añadir S a la citología pleural, evitando otros procedimientos diagnósticos más invasivos o insuficientes. Aunque el único método diagnóstico con S y E cercanas al 100% en DPM es la toracoscopia y ninguna combinación de MT ha alcanzado su nivel de exactitud, los resultados de los estudios realizados en este campo son cada vez más prometedores. No obstante, la evidencia no recomienda usar un solo MT para el diagnóstico de DPM, y aunque la combinación de dos o más parece ser más sensible, los resultados deben ser interpretados en paralelo con los datos clínicos y resultados de pruebas convencionales.
*Autor para correspondencia.
Correo electrónico:nurabad@terra.es (M.T. Río Ramírez).
Recibido el 26 de noviembre de 2009;
aceptado el 31 de mayo de 2010