Comparar o ângulo de fase de pacientes com osteogênese imperfeita atendidos em um hospital universitário terciário com pacientes de um grupo controle de crianças saudáveis, bem como avaliar o estado nutricional desses pacientes pelo índice de massa corporal proposto pela Organização Mundial de Saúde.
MétodosEstudo transversal feito em hospital universitário que incluiu sete pacientes com osteogênese imperfeita e um grupo controle composto por 17 crianças saudáveis de mesmo sexo e idade. Foram aferidos peso e estatura e foi feito o exame de impedância bioelétrica. Posteriormente, o ângulo de fase foi calculado a partir dos valores de resistência e reactância.
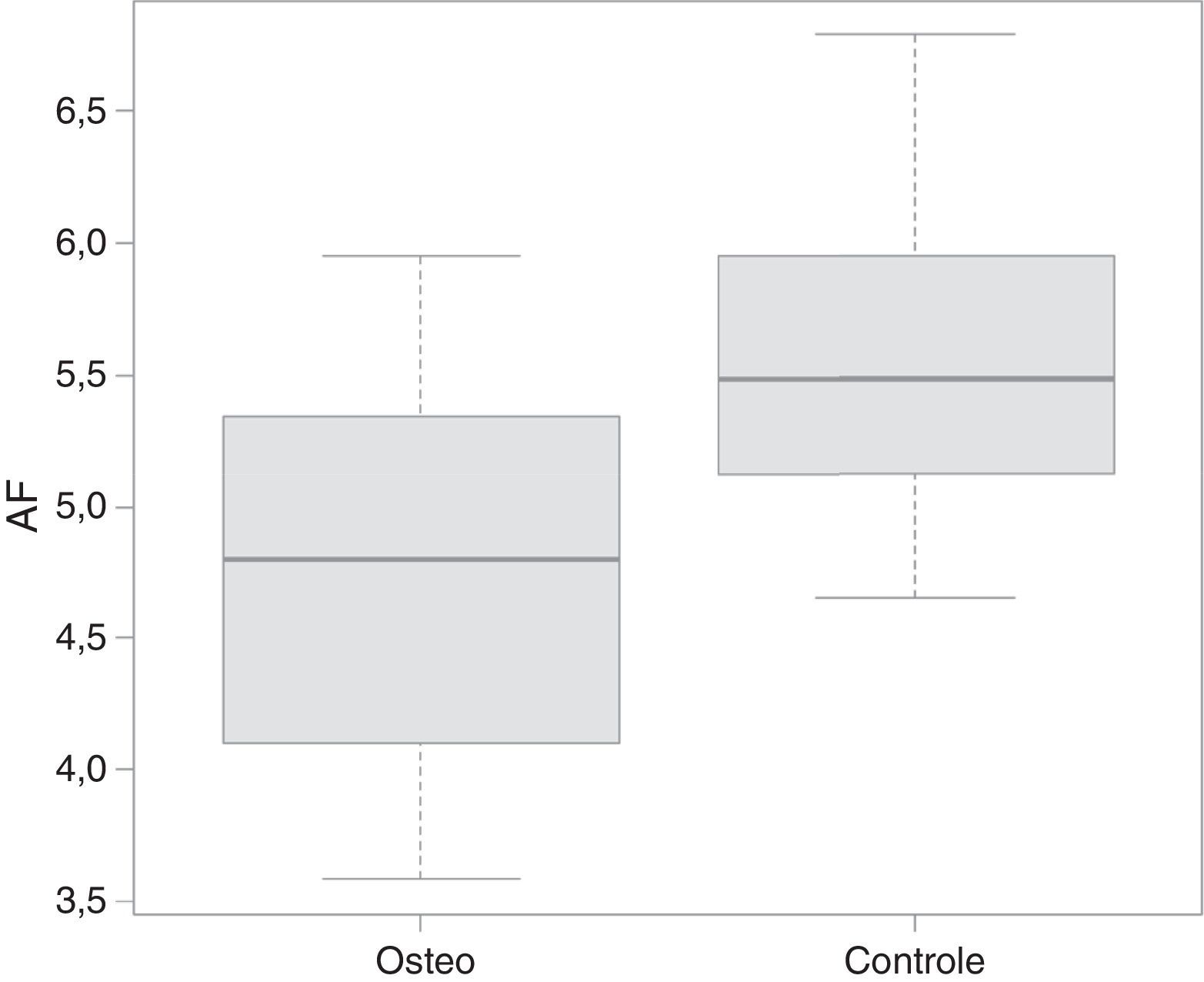
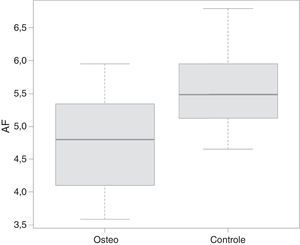
ResultadosO ângulo de fase do grupo de crianças com osteogênese imperfeita foi significativamente menor do que o do grupo controle (p<0,05). O critério de índice de massa corporal por idade da Organização Mundial de Saúde não mostrou diferença entre os grupos.
ConclusõesCrianças com osteogênese imperfeita têm um risco nutricional detectado pelo ângulo de fase, é uma ferramenta útil para triagem nutricional. O resultado do cálculo poderia auxiliar a dietoterapia de pacientes com osteogênese imperfeita.
To compare the phase angle of patients with osteogenesis imperfecta treated at a tertiary university hospital with patients in a control group of healthy children, and to assess the nutritional status of these patients through the body mass index proposed by the World Health Organization.
MethodsCross‐sectional study carried out in a university hospital that included seven patients with osteogenesis imperfecta and a control group of 17 healthy children of the same gender and age. Weight and height were measured and bioelectrical impedance was performed. Subsequently, the phase angle was calculated based on resistance and reactance values.
ResultsThe phase angle of the group of children with osteogenesis imperfecta was significantly lower than that of the control group (p<0.05). The body mass index criterion for age of the World Health Organization showed no difference between groups.
ConclusionsChildren with osteogenesis imperfecta have a nutritional risk detected by the phase angle, which is a useful tool for nutritional screening. The calculation result could help in the diet therapy of patients with osteogenesis imperfecta.
A osteogênese imperfeita (OI) é uma doença hereditária caracterizada por fragilidade óssea e predisposição para fraturas, que ocorrem com trauma mínimo ou mesmo nenhum. Pacientes com essa doença apresentam, muitas vezes, baixa massa óssea, mas estudos sobre o estado nutricional em crianças acometidas por OI são escassos.1
Em 2012, um estudo publicado com pacientes portadores de OI dos tipos I e III apontou para a necessidade de conhecimento da composição corporal, uma vez que está associada ao aparecimento de fraturas.2 Os autores indicaram a necessidade de individualizar a dieta dos portadores da enfermidade para que houvesse melhoria na composição corporal.
O ângulo de fase (AF), encontrado a partir de análise secundária de impedância bioelétrica, por analisar a composição corporal sem a necessidade do uso de parâmetros antropométricos, poderia ser usado nos pacientes com osteogênese imperfeita, uma vez que a antropometria, principalmente a aferição da estatura, é difícil de ser feita com precisão.3,4 O AF é o arco tangente reactância por resistência (Xc/R), ou seja, é obtido a partir da avaliação de impedância bioelétrica com o uso de medidas diretas dos componentes do vetor de R e Xc, e ao ser usado como indicador de estado nutricional e massa celular corporal (MCC) elimina consideravelmente os erros de análise pela impedância bioelétrica.5 Seu uso tem sido recomendado como indicador de prognóstico na prática clínica. Em adultos, já foram encontradas associações positivas entre ângulo de fase e sobrevida de pacientes HIV‐positivos,6,7 câncer pulmonar8 e sepse e hemodiálise.9
Nesse contexto, o objetivo do presente estudo foi comparar o ângulo de fase de pacientes com osteogênese imperfeita, atendidos pelo Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFRMP‐USP), com um grupo controle de crianças saudáveis, bem como avaliar o estado nutricional desses pacientes pelos parâmetros da Organização Mundial de Saúde (OMS) de índice de massa corporal por idade (IMC/I).
MétodoEste foi um estudo transversal que incluiu sete crianças diagnosticadas com osteogênese imperfeita (tipos I, III e IV) que faziam uso de pamidronato no HCFMRP‐USP, em análise secundária. Todos os pacientes foram acompanhados pelo ambulatório de ortopedia e endocrinologia infantil do mesmo hospital. Essas crianças não representam a totalidade dos pacientes pediátricos com OI tratados nesse hospital. Elas foram escolhidas aleatoriamente para outro estudo e são analisadas separadamente pela complexidade da doença. Os dados desses pacientes foram comparados com 17 crianças de mesmo sexo e idade, saudáveis de um grupo controle. As crianças do grupo controle fazem parte do ambulatório de puericultura e pediatria do posto de saúde Cuiabá de Ribeirão Preto. Esse local foi escolhido uma vez que atende crianças saudáveis de mesmo nível socioeconômico das atendidas no hospital terciário do estudo. Foram estratificadas por sexo e idade. Não houve pareamento, pois trata‐se de grupos independentes.
Quatro crianças do grupo de estudo e 12 do grupo controle assinaram termo de assentimento (>sete anos de idade); todos os pacientes tiveram o termo de consentimento livre e esclarecido assinado por seus responsáveis. Trata‐se uma análise secundária do estudo sobre a prevalência de desnutrição no HCFMRP‐USP feito em 2013.9 O estudo foi aprovado pelo Comitê de Ética em Pesquisa do HCFMRP‐USP.
Dados de peso e de impedância bioelétrica foram coletados de acordo com procedimentos internacionais.10 A estatura/comprimento foi aferida, em alguns casos, no próprio leito dos pacientes, uma vez que esses eram incapazes de permanecer de pé (n=6). O índice de massa corporal (IMC) foi calculado para classificação de IMC/I pelos gráficos da OMS.11
O AF foi calculado através da fórmula: Φ=(Xc/R)x(180°/π), em que Xc é o valor da reactância, R da resistência e pi o valor matemático de 3,1415. Essa conversão é feita para transformar o valor final de radianos em graus.12
Para análise estatística dos dados, usou‐se o software SPSS modelo 20.0 (Statistical Package for the Social Sciences, Westlands Road, Quarry Bay, Hong Kong, 2009) e o R (R Foundation for Statistical Computing, University of Auckland, New Zealand, 1993). Foi usada estatística não paramétrica, considerando‐se que não há certeza de distribuição normal para dados antropométricos de pacientes com OI. Foi feito o teste de Mann‐Whitney de amostras independentes para comparação das variáveis de interesse.
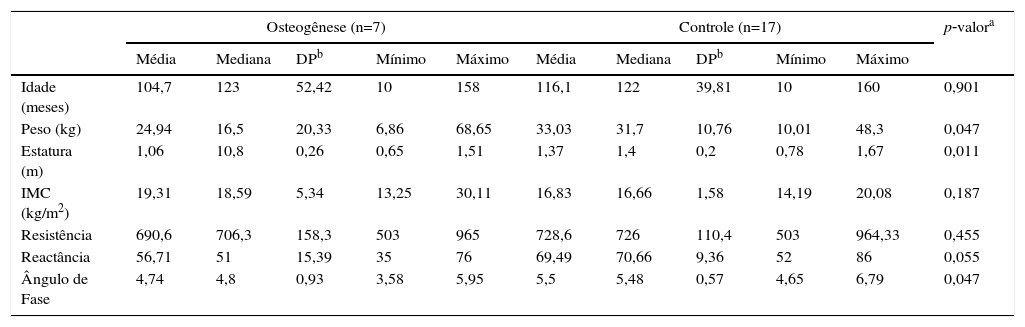
ResultadosA antropometria e a composição corporal por impedância bioelétrica, bem como o cálculo do ângulo de fase, estão descritos na tabela 1.
Caracterização da amostra: dados antropométricos dos dois grupos
| Osteogênese (n=7) | Controle (n=17) | p‐valora | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Média | Mediana | DPb | Mínimo | Máximo | Média | Mediana | DPb | Mínimo | Máximo | ||
| Idade (meses) | 104,7 | 123 | 52,42 | 10 | 158 | 116,1 | 122 | 39,81 | 10 | 160 | 0,901 |
| Peso (kg) | 24,94 | 16,5 | 20,33 | 6,86 | 68,65 | 33,03 | 31,7 | 10,76 | 10,01 | 48,3 | 0,047 |
| Estatura (m) | 1,06 | 10,8 | 0,26 | 0,65 | 1,51 | 1,37 | 1,4 | 0,2 | 0,78 | 1,67 | 0,011 |
| IMC (kg/m2) | 19,31 | 18,59 | 5,34 | 13,25 | 30,11 | 16,83 | 16,66 | 1,58 | 14,19 | 20,08 | 0,187 |
| Resistência | 690,6 | 706,3 | 158,3 | 503 | 965 | 728,6 | 726 | 110,4 | 503 | 964,33 | 0,455 |
| Reactância | 56,71 | 51 | 15,39 | 35 | 76 | 69,49 | 70,66 | 9,36 | 52 | 86 | 0,055 |
| Ângulo de Fase | 4,74 | 4,8 | 0,93 | 3,58 | 5,95 | 5,5 | 5,48 | 0,57 | 4,65 | 6,79 | 0,047 |
De acordo com o teste de Mann‐Whitney, os pacientes com osteogênese tiveram sua classificação de peso, estatura e ângulo de fase significativamente menores quando comparados com o grupo controle. A distribuição dos dados em relação ao ângulo de fase pode ser observada na figura 1.
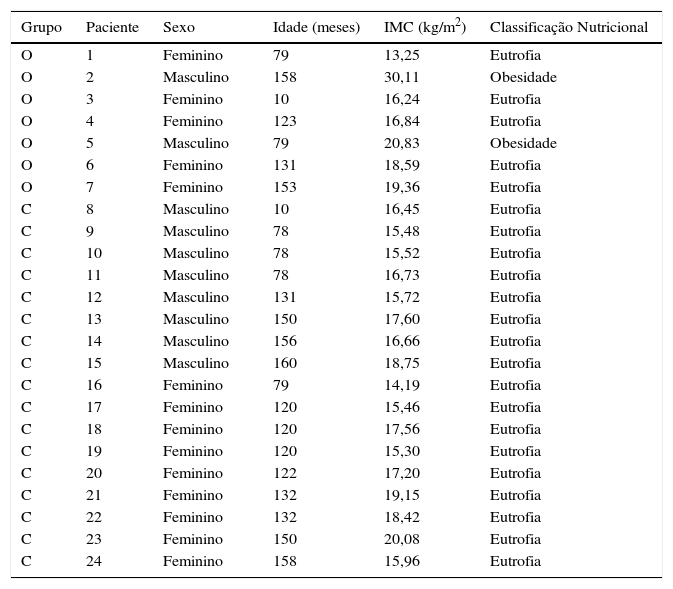
Todos os pacientes do grupo controle foram classificados como eutróficos segundo critérios da OMS. Já no grupo de pacientes com osteogênese, dois foram classificados como obesos (percentil IMC>97) e os demais como eutróficos (tabela 2).
Classificação do estado nutricional segundo critério da OMS e IMC/I
| Grupo | Paciente | Sexo | Idade (meses) | IMC (kg/m2) | Classificação Nutricional |
|---|---|---|---|---|---|
| O | 1 | Feminino | 79 | 13,25 | Eutrofia |
| O | 2 | Masculino | 158 | 30,11 | Obesidade |
| O | 3 | Feminino | 10 | 16,24 | Eutrofia |
| O | 4 | Feminino | 123 | 16,84 | Eutrofia |
| O | 5 | Masculino | 79 | 20,83 | Obesidade |
| O | 6 | Feminino | 131 | 18,59 | Eutrofia |
| O | 7 | Feminino | 153 | 19,36 | Eutrofia |
| C | 8 | Masculino | 10 | 16,45 | Eutrofia |
| C | 9 | Masculino | 78 | 15,48 | Eutrofia |
| C | 10 | Masculino | 78 | 15,52 | Eutrofia |
| C | 11 | Masculino | 78 | 16,73 | Eutrofia |
| C | 12 | Masculino | 131 | 15,72 | Eutrofia |
| C | 13 | Masculino | 150 | 17,60 | Eutrofia |
| C | 14 | Masculino | 156 | 16,66 | Eutrofia |
| C | 15 | Masculino | 160 | 18,75 | Eutrofia |
| C | 16 | Feminino | 79 | 14,19 | Eutrofia |
| C | 17 | Feminino | 120 | 15,46 | Eutrofia |
| C | 18 | Feminino | 120 | 17,56 | Eutrofia |
| C | 19 | Feminino | 120 | 15,30 | Eutrofia |
| C | 20 | Feminino | 122 | 17,20 | Eutrofia |
| C | 21 | Feminino | 132 | 19,15 | Eutrofia |
| C | 22 | Feminino | 132 | 18,42 | Eutrofia |
| C | 23 | Feminino | 150 | 20,08 | Eutrofia |
| C | 24 | Feminino | 158 | 15,96 | Eutrofia |
Grupo O, pacientes com osteogênese imperfeita; Grupo C, pacientes do grupo controle.
De acordo com nosso conhecimento, trata‐se do primeiro estudo que usa impedância bioelétrica e o cálculo de ângulo de fase em pacientes pediátricos com osteogênese imperfeita como coadjuvante para avaliação do estado nutricional. O AF tem sido usado como marcador do estado nutricional na prática clínica de adultos6–9 e infantil13 e, quando associado aos dados antropométricos de peso e estatura em pacientes sob risco nutricional, torna‐se uma boa ferramenta de triagem.
Nagano et al. sugeriram o AF como parâmetro útil para avaliação nutricional da massa celular corporal em pacientes pediátricos estáveis.13 Ele mostrou‐se importante na avaliação de gravidade e prognóstico ao refletir diferentes propriedades elétricas dos tecidos, que são afetados por doenças, estado nutricional e hidratação, pois avalia diferentes dimensões do estado nutricional, incorpora tanto a avaliação funcional como a morfológica.4,13–15 Assim, seu valor é influenciado pela massa celular corporal e pela quantidade de fluído corporal.16,17
De acordo com Barbosa‐Silva et al., tal parâmetro permite um acompanhamento rotineiro por meio de análise pontual e/ou sequenciada da criança doente, pode ser interpretado como um indicador de distribuição hídrica entre os espaços intra e extracelular e de integridade de todas as membranas celulares.15 O baixo valor de AF sugere morte celular ou diminuição de integridade de membranas celulares, enquanto valores altos são compatíveis com maior valor de reactância e grande quantidade de membranas celulares intactas.14,15
No presente estudo, os valores estatisticamente inferiores do AF no grupo OI provavelmente estão relacionados aos valores mais baixos de reactância. Ainda que não haja diferença estatística significativa para os dados de reactância (representados na tabela 1), há clara tendência a valores inferiores em pacientes com OI, provavelmente influenciados por integridade de membrana de osteócitos e pelo comprometimento do estado nutricional dessas crianças.
A avaliação antropométrica de pacientes com OI pelos critérios da OMS pode não ser a mais adequada, visto que, para a aferição de estatura/comprimento, em alguns casos, foi necessária a estimativa no leito. Isso impede a confiabilidade da classificação, faz com que análises secundárias, como o ângulo de fase, sejam preferidas para avaliar o risco nutricional.
A OI é uma doença rara, que faz com que a densidade mineral óssea seja reduzida e os pacientes fiquem sujeitos a fraturas múltiplas e consequentes deformidades, o que impede uma análise precisa de risco nutricional. Os objetivos principais do tratamento da OI são maximizar a mobilidade e as competências diárias na vida, além de diminuir a dor e a fragilidade óssea,18 sem deixar de lado a melhoria do estado nutricional, diretamente ligado a essa melhoria. A classificação do estado nutricional pelo critério da OMS de IMC/I não constatou mudanças importantes na maioria dos pacientes. Entretanto, como comentado anteriormente, esses valores podem não ser fidedignos à real estatura/comprimento da criança pelas deformações, com evidente encurtamento de membros. Assim, uma análise auxiliar torna‐se necessária.
Barufaldi et al. também apontaram que os critérios da OMS são menos sensíveis em relação à capacidade de detecção de situações de subnutrição e risco nutricional e mais sensíveis para detecção de sobrepeso. Mesmo conseguindo maior distinção para o excesso de peso, esse critério não distingue qual o motivo da mudança em relação à composição corporal. Assim, o uso do AF poderia ser considerado uma ferramenta útil e sensível para a classificação de mudanças corporais quanto à subnutrição de pacientes com OI, embora menos específica.19
A saúde óssea dos portadores de OI pode ser melhorada por meio de uma abordagem multidisciplinar, com o uso de pamidronato,20 terapias manuais e terapia nutricional adequadas. Todos os pacientes do presente estudo estavam em uso do medicamento citado. Como a saúde óssea está atrelada a uma nutrição adequada, é preciso estar atento ao estado nutricional dessas crianças durante a hospitalização e às orientações de alta.
A melhoria da densidade mineral óssea está atrelada ao consumo de micronutrientes (especialmente fósforo, cálcio e zinco), bem como a um adequado aporte de proteínas de alto valor biológico para a idade.21 Além disso, no caso de recém‐nascidos, a amamentação exclusiva nos primeiros meses de vida deve ser estimulada, pois tem se mostrado fator protetor para a formação óssea.22 Assim, o cálculo do ângulo de fase, usado como ferramenta coadjuvante para analisar o estado nutricional, seria importante, uma vez que essa análise não depende de parâmetros antropométricos, como peso e estatura ou comprimento, e possivelmente para melhoria do estado nutricional do paciente.
O presente estudo tem algumas limitações. A primeira delas seria o pequeno número de pacientes analisados, uma vez que se trata de doença rara. A segunda seria não ser possível criar grupos em relação ao tipo de osteogênese. Uma terceira, seria o fato de que, proporcionalmente, existem mais pacientes do sexo feminino no grupo de pacientes com osteogênese em relação ao grupo controle. Acreditamos, no entanto, que por apresentar valores de impedância bioelétrica compatíveis com dados internacionais, semelhantes em idade escolar e na adolescência, as alterações puberais, se presentes, não influenciaram no valor final da análise.4
Apesar dessas limitações, como existem raros estudos a respeito do estado e da classificação nutricional de crianças com osteogênese imperfeita, a presente investigação é importante para avaliar o uso de novas ferramentas (AF) para melhorar o tratamento daqueles que têm a condição. Para que mais dados sejam coletados, sugere‐se o exame de impedância bioelétrica como forma de rotina nesses pacientes, bem como a inserção de dados de resistência e reactância no registro nacional para osteogênese imperfeita (Centro de Referência em Osteogênese Imperfeita – Crois – Instituto Fernandes Figueira – Fiocruz), situação que favoreceria a análise de um número maior de pacientes e a obtenção de dados mais consistentes.
Conclui‐se que o uso do ângulo de fase pode auxiliar a classificar o estado nutricional de crianças com osteogênese imperfeita e melhorar a conduta nutricional e multidisciplinar. Por ser de baixo custo, pode ser incorporado de forma rotineira no atendimento de pacientes portadores de OI em nosso meio. Sugere‐se a análise prospectiva desses pacientes, a inserção no banco de dados nacional para favorecer a melhoria na nutrição desses pacientes, bem como em sua saúde óssea.
FinanciamentoBolsa de Mestrado Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aos técnicos em informática Vitor Hugo Padovan e Luiz Cláudio Colares.