Avaliar a frequência de complicações infecciosas em pacientes portadores de doença falciforme (DF) submetidos à esplenectomia cirúrgica, após episódio de sequestro esplênico (SE).
MétodosCoorte retrospectiva de crianças com DF que nasceram após 2002 e que estavam em acompanhamento regular até julho de 2013. Os pacientes foram divididos em dois grupos, casos (constituído pelas crianças com DF que fizeram esplenectomia cirúrgica após sequestro esplênico) e controles (crianças com DF que não tiveram SE e não foram submetidas ao procedimento), a fim de comparar a frequência de infecções invasivas (sepse, meningite, bacteremia com hemocultura positiva, síndrome torácica aguda e/ou pneumonia) por meio de informações obtidas do prontuário. A análise estatística foi descritiva.
ResultadosForam avaliados 44 pacientes com idade média no momento da esplenectomia de 2,6 anos (1‐6,9 anos) e com tempo médio de seguimento após esplenectomia de 6,1 anos (3,8‐9,9 anos). O grupo controle foi formado por 69 pacientes com idade média do início do seguimento de 5,6 meses (1‐49 meses) e tempo de acompanhamento médio de 7,2 anos (4‐10,3 anos). Todos receberam a vacina pneumocócica conjugada. Não foi observada diferença significativa entre os grupos em relação aos processos infecciosos durante o período de seguimento.
ConclusõesA esplenectomia cirúrgica nas crianças com doença falciforme e que sofreram sequestro esplênico não se associou ao aumento na frequência de complicações infecciosas após seis anos de acompanhamento clínico.
To evaluate the frequency of infectious complications in children with sickle cell disease (SCD) after surgical splenectomy for acute splenic sequestration crisis.
MethodsRetrospective cohort of children with SCD who were born after 2002 and were regularly monitored until July 2013. Patients were divided into two groups: cases (children with SCD who underwent surgical splenectomy after an episode of splenic sequestration) and controls (children with SCD who did not have splenic sequestration and surgical procedures), in order to compare the frequency of invasive infections (sepsis, meningitis, bacteremia with positive blood cultures, acute chest syndrome and/or pneumonia) by data collected from medical records. Data were analyzed by descriptive statistical analysis.
Results44 patients were included in the case group. The mean age at the time of splenectomy was 2.6 years (1‐6.9 years) and the mean postoperative length of follow‐up was 6.1 years (3.8‐9.9 years). The control group consisted of 69 patients with a mean age at the initial follow‐up visit of 5.6 months (1‐49 months) and a mean length of follow‐up of 7.2 years (4‐10.3 years). All children received pneumococcal conjugate vaccine. No significant difference was observed between groups in relation to infections during the follow‐up.
ConclusionsSurgical splenectomy in children with sickle cell disease that had splenic sequestration did not affect the frequency of infectious complications during 6 years of clinical follow‐up.
A doença falciforme (DF) é uma anemia hemolítica decorrente de uma hemoglobinopatia que, devido à substituição do ácido glutâmico pela valina na sexta posição da cadeia beta da globina, leva à formação de uma hemoglobina anômala, chamada S (HbS).1 A DF compreende a anemia falciforme (AF) e as associações que ocorrem quando o gene da HbS se associa ao gene de outras hemoglobinopatias, como hemoglobinopatia SC (HbSC), HbS‐beta talassemia (HbSβ).1
Entre as complicações da DF, o sequestro esplênico (SE) acomete 7,5% a 30% dos pacientes, geralmente entre três meses e cinco anos de idade. É a segunda causa de morte na primeira década de vida.1,2 A taxa de mortalidade por crise de SE pode chegar a 12% e recorrer em mais de 50% dos pacientes.1,3,4 O tratamento deve ser imediato, com a intenção de restaurar a volemia, por meio de transfusão de glóbulos vermelhos.1 A prevenção da recorrência do SE pode ser feita por meio de transfusões periódicas cronicamente ou de esplenectomia.1,5‐8
A eficácia da transfusão crônica na prevenção da recidiva ainda não está bem estabelecida. Estudo demonstrou que a crise de SE ocorre apesar da redução da hemoglobina S (HbS) para menos de 30% e fica o risco de recorrência similar para os pacientes que receberam transfusão crônica e para os que ficaram apenas em observação clínica.6 Porém, estudos randomizados são necessários para confirmar esses dados.2 Brousse et al. verificaram que o risco de recorrência foi maior quando o primeiro episódio de SE ocorreu antes de dois anos de idade e concluíram que um tratamento preventivo mais agressivo deve ser feito nessa faixa etária.9
A feitura de esplenectomia nos primeiros anos de vida é sempre questionada devido ao risco aumentado de infecção por bactérias capsuladas.10 Porém, deve‐se considerar que crianças portadoras de doença falciforme já apresentam hipofunção esplênica desde os primeiros meses de vida11 e que o avanço na prevenção dessas infecções, por meio de profilaxia com penicilina e vacinas conjugadas, alterou esse risco.12,13
Em razão do exposto, o objetivo deste estudo foi avaliar, em crianças portadoras de DF e que sofreram SE, a frequência de complicações infecciosas após a feitura da esplenectomia cirúrgica.
MétodoTrata‐se de coorte retrospectiva com dados obtidos dos prontuários médicos dos pacientes acompanhados em um serviço de hematologia pediátrica. A população estudada (GP) foi constituída de crianças com DF que nasceram de 2002 até 2007, fizeram esplenectomia cirúrgica após o primeiro episódio de sequestro esplênico entre janeiro de 2003 e fevereiro de 2009 e estavam em acompanhamento regular até julho de 2013. Esses pacientes, após o primeiro episódio de sequestro esplênico, eram submetidos a esquema de transfusão crônica de hemácias a cada quatro semanas até completar o esquema de imunização com a vacina pneumocócica 7‐valente entre os 12 e 15 meses de idade. A esplenectomia eletiva é indicada após esse requisito. O grupo controle (GC) foi formado por crianças portadoras de DF nascidas entre 2002 e 2009 e que não tiveram sequestro esplênico, não foram submetidas à esplenectomia cirúrgica e estavam em acompanhamento regular em nosso serviço até julho de 2013.
Ambos os grupos receberam profilaxia com penicilina desde o diagnóstico até no mínimo cinco anos de idade, até terem recebido o reforço da vacina pneumocócica polissacarídica 23‐valente. Todos os pacientes estavam com a imunização adequada e completa para a idade quanto às vacinas pneumocócicas conjugada 7‐valente, meningocócica, anti‐hemófilo e pneumocócica polissacarídica 23‐valente. Todos os pacientes receberam as vacinas conjugadas ao longo do primeiro ano de vida.
Os dados clínicos e laboratoriais foram obtidos dos prontuários com as consultas de rotina desses pacientes no ambulatório e se levaram em consideração as informações dos responsáveis e/ou resumo de alta hospitalar e/ou resultado de exames. Os dados obtidos para o GP foram: genótipo, idade no primeiro episódio de sequestro esplênico e no momento da esplenectomia, tempo de acompanhamento após esplenectomia, complicações infecciosas após esplenectomia (meningite bacteriana, sepse, hemocultura [HMC] positiva para Streptococcus pneumoniae e/ou outros agentes bacterianos, síndrome torácica aguda [STA]/pneumonia). Os mesmo dados clínicos foram obtidos dos prontuários do grupo controle (GC).
Para análise dos resultados foi levada em consideração a natureza das variáveis, já que se tratava de amostras não relacionadas. Foi feita a análise descritiva do perfil dos pacientes estudados. Para análise das variáveis categóricas para se comprovar a significância das diferenças entre o GP e o GC, em relação às complicações infecciosas foi aplicado o teste exato de Fisher. O nível descritivo de p<0,05 foi considerado estatisticamente significativo, ao se rejeitar a hipótese de igualdade.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo.
ResultadosDos 53 pacientes que fizeram esplenectomia cirúrgica durante o período de inclusão no estudo, participaram 44 (83%) portadores de DF que continuavam em acompanhamento regular durante o período de seguimento. A idade das crianças durante o episódio de sequestro esplênico variou de dois a 79 meses (média de 21,2±16,5 meses) e 21 (70,5%) pacientes tinham idade inferior a dois anos quando da ocorrência do primeiro episódio de sequestro esplênico e a idade quando fizeram a esplenectomia era de um a 6,9 anos (média de 2,6±1,3 anos). Quanto ao genótipo, 39 (88,6%) pacientes eram portadores de Hb SS, 4 (9,1%) de Hb Sβ0 talassemia e 1 (2,3%) de Hb SC. O tempo de seguimento após a esplenectomia foi de 3,8 a 9,9 anos (média de 6,1±1,6 anos).
Em relação ao GC foram avaliados os dados de 69 pacientes que estavam em acompanhamento regular, a idade de início de acompanhamento era de um a 49 meses (média de 5,6±9,2 meses) e o tempo de seguimento de quatro a 10,3 anos (média de 7,2±1,9 anos). Em relação ao genótipo, 57 (82,6%) eram portadores de Hb SS, 1 (1,4%) de Hb Sβ0 talassemia e 11 (16%) de Hb SC.
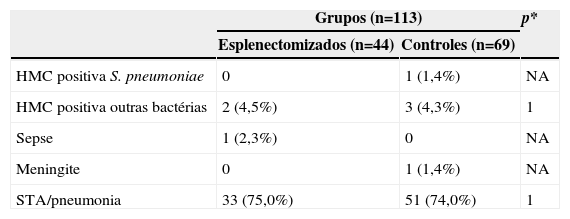
Na tabela 1 estão apresentadas as complicações infecciosas das crianças portadoras de doença falciforme após feitura de esplenectomia cirúrgica e do grupo controle. Durante o seguimento desses pacientes não se observou diferença entre o GP e GC em relação aos processos infecciosos.
Complicações infecciosas das crianças portadoras de doença falciforme após esplenectomia cirúrgica e das crianças do grupo controle
| Grupos (n=113) | p* | ||
|---|---|---|---|
| Esplenectomizados (n=44) | Controles (n=69) | ||
| HMC positiva S. pneumoniae | 0 | 1 (1,4%) | NA |
| HMC positiva outras bactérias | 2 (4,5%) | 3 (4,3%) | 1 |
| Sepse | 1 (2,3%) | 0 | NA |
| Meningite | 0 | 1 (1,4%) | NA |
| STA/pneumonia | 33 (75,0%) | 51 (74,0%) | 1 |
STA, síndrome torácica aguda; NA, dados não analisáveis.
*Teste exato de Fisher.
Os agentes infecciosos isolados em hemocultura no GP foram Salmonella spp (um paciente) e Klebsiella spp (um paciente) e no GC Escherichia coli (um paciente), S. pneumoniae (um paciente) e Klebsiella spp (um paciente).
DiscussãoVários estudos, assim como este, verificaram que a crise de sequestro esplênico é mais frequente em menores de dois anos,3‐5. Essa é a faixa etária na qual as infecções por bactérias encapsuladas, especialmente o Streptococcus pneumoniae, são mais prevalentes.14 O baço exerce importante papel na defesa contra esses microrganismos e a retirada desse órgão está associada ao aumento do risco infeccioso.11 Portanto, a indicação de esplenectomia nessa faixa etária deve ser sempre criteriosa.
Como os pacientes portadores de anemia falciforme apresentam hipofunção esplênica desde os primeiros meses de vida e sofrem a autoesplenectomia por volta dos cinco anos,1,11 o risco infeccioso está aumentado. Dessa forma, tais pacientes recebem profilaxia com penicilina desde os dois meses de vida15 e vacinas contra microrganismos encapsulados, como o hemófilo e o pneumococo.12 A introdução da profilaxia e das vacinas, especialmente das vacinas conjugadas, levou à diminuição importante da mortalidade por infecção nesses pacientes e até o momento essas medidas preventivas se mostram eficazes, apesar da contínua preocupação e necessidade de vigilância quanto ao surgimento de cepas de pneumococo resistentes à penicilina ou de cepas invasivas não cobertas pela vacina.12,13 Assim, pode‐se considerar que os pacientes com DF, esplenectomizados cirurgicamente ou não, apresentam maior risco para infecção, porém fica a preocupação se a perda completa da função esplênica nos primeiros anos de vida após esplenectomia cirúrgica poderia aumentar o número de complicações infecciosas.
Estudo de série de casos de pacientes com anemia falciforme esplenectomizados de 1988 a 1992 não mostrou diferença estatística na incidência de sepse antes e após a esplenectomia,16 resultado semelhante ao observado por Kalpatthi et al., que fizeram estudo de coorte retrospectivo de 58 pacientes e também não encontraram diferença no risco de infecção invasiva antes e após a cirurgia.17 O risco de infecção invasiva, principalmente pneumocócica, em crianças com doença falciforme é maior nos primeiros três anos de vida e diminui consideravelmente após os cinco anos.18,19 Assim, seguir o mesmo paciente antes e após esplenectomia cirúrgica leva a um viés, tendo em vista que as infecções invasivas vão diminuindo no decorrer dos anos de vida, mesmo nos pacientes esplenectomizados cirurgicamente, como foi observado pelos estudos citados anteriormente.16,17
Nosso estudo comparou a frequência de infecção invasiva entre pacientes falciformes, da mesma faixa etária, com mesmo tempo de seguimento, com e sem esplenectomia cirúrgica, de modo similar ao estudo de Wright et al., que também usaram um grupo controle em sua coorte retrospectiva.20 Em ambos os estudos não se observou diferença na taxa de infecção entre os grupos.
A incidência de STA em pacientes com doença falciforme é de aproximadamente 30%.2,21 No presente estudo, cerca de 75% dos pacientes tinham anotações no prontuário quanto à ocorrência pregressa de STA/pneumonia. Isso provavelmente se deve aos critérios diversos usados nos serviços de emergência para caracterizar essa complicação. Tal viés ocorreu de forma homogênea nos dois grupos.
A principal limitação do estudo foi a obtenção de dados retrospectivos dos prontuários, que estão sujeitos a viés de memória e que impossibilitam o estabelecimento de critérios homogêneos para definir o diagnóstico das complicações infecciosas. A feitura de estudos prospectivos é necessária para melhor avaliar essa questão e confirmar os resultados observados até o momento.
Pode‐se concluir que a indicação de esplenectomia cirúrgica nas crianças com doença falciforme que sofreram sequestro esplênico não se mostrou associada ao aumento na frequência de processos infecciosos invasivos durante o período de seguimento.
FinanciamentoO estudo não recebeu financiamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.