Elucidar se a insulina é eficaz ou não em pacientes com fibrose cística antes da fase de diabetes.
Fontes de dadosO estudo foi feito de acordo com o método Prisma entre agosto e setembro de 2014, nas bases de dados PubMed, Embase, Lilacs e SciELO. Foram incluídos estudos prospectivos publicados em inglês, português e espanhol de 2002 a 2014 que avaliaram o efeito da insulina nos parâmetros peso, índice de massa corporal e função pulmonar, em pacientes com fibrose cística, com média de 17,37 anos, antes da fase de diabetes.
Síntese dos dadosForam identificados oito artigos que incluíram 180 indivíduos submetidos ao uso de insulina. O tamanho das amostras variou de 4 a 54 pacientes, idade média entre 12,4 e 28 anos. O tipo de acompanhamento, o tempo de uso de insulina, a dose e o cronograma de implementação foram muito heterogêneos entre os estudos.
ConclusõesExistem razões teóricas para se acreditar que a insulina tenha um efeito benéfico na população estudada. Os diferentes métodos e populações encontrados não permitem afirmar se a terapia precoce com insulina deve ou não ser feita em pacientes com fibrose cística previamente ao diagnóstico de diabetes. Portanto, são necessários estudos com amostras maiores e uniformidade de uso da insulina.
To elucidate whether insulin is effective or not in patients with cystic fibrosis before the diabetes mellitus phase.
Data sourceThe study was performed according to the Prisma method between August and September 2014, using the PubMed, Embase, Lilacs and SciELO databases. Prospective studies published in English, Portuguese and Spanish from 2002 to 2014, evaluating the effect of insulin on weight parameters, body mass index and pulmonary function in patients with cystic fibrosis, with a mean age of 17.37 years before the diabetes mellitus phase were included.
Data synthesisEight articles were identified that included 180 patients undergoing insulin use. Sample size ranged from 4 to 54 patients, with a mean age ranging from 12.4 to 28 years. The type of follow‐up, time of insulin use, the dose and implementation schedule were very heterogeneous between studies.
ConclusionsThere are theoretical reasons to believe that insulin has a beneficial effect in the studied population. The different methods and populations assessed in the studies do not allow us to state whether early insulin therapy should or should not be carried out in patients with cystic fibrosis prior to the diagnosis of diabetes. Therefore, studies with larger samples and insulin use standardization are required.
O diabetes relacionado à fibrose cística (DRFC) é a comorbidade mais comum em pacientes com fibrose cística (FC) e afeta 20% dos adolescentes e 40%‐50% dos adultos com FC.1
Os distúrbios da glicose em pacientes com FC geralmente se iniciam com uma hiperglicemia pós‐prandial intermitente, seguida por intolerância à glicose oral sem hiperglicemia em jejum e, finalmente, diabetes com hiperglicemia em jejum.2,3
A deficiência de insulina e a hiperglicemia resultantes afetam a doença pulmonar.3–5 A insulina é um hormônio com efeitos anabólicos e sua deficiência pode ter um impacto clínico negativo em pacientes considerados “pré‐diabéticos”.6 Um aumento nos níveis séricos de glicose (≥144mg/dL) pode ter uma influência desfavorável na função pulmonar; além disso, o aumento da glicose na árvore brônquica favorece o crescimento de patógenos respiratórios.5 Ainda há uma perda de massa magra corporal devido ao estado catabólico causado pela deficiência de insulina, o que leva a um consumo de gordura e proteínas e afeta também a função pulmonar.7
Portanto, a deficiência de insulina promove uma deterioração clínica nessa população, e não somente um metabolismo anormal da glicose, o que pode ser melhorado pela intervenção precoce com o uso de insulina.6 Tanto o diabetes quanto a intolerância à glicose reduzem a expectativa de vida em pacientes com FC, a insulina é o único tratamento que melhora os parâmetros clínicos.8 O tratamento precoce com insulina poderia diminuir a morbimortalidade da doença subjacente.9,10
Além disso, a classificação dos pacientes com FC pelo teste de tolerância oral à glicose (TTOG) em intolerantes e diabéticos é fundamentada em critérios obtidos a partir de estudos epidemiológicos em indivíduos sem FC, deixa dúvidas se esses limites convencionais de diagnóstico seriam adequados ou relevantes para pacientes com FC.11 Assim, o uso de medidas convencionais de avaliação da glicose na população com FC poderia subestimar o número de pacientes com metabolismo anormal da glicose e, consequentemente, esse grupo poderia se beneficiar de uma intervenção precoce com a insulina, em níveis de glicose inferiores aos considerados anormais em populações sem fibrose cística.12
Pelo que se conhece até o momento, nenhuma revisão sistemática sobre início precoce da insulinoterapia em pacientes com FC foi feita. Portanto, este estudo teve como objetivo identificar os efeitos dessa intervenção e procurar ajudar a prática clínica e as pesquisas futuras.
MétodoO processo de pesquisa foi desenvolvido de acordo com o método Prisma (Preferred Reporting Items for Systematic Reviews and Meta‐Analyses).13 A pesquisa foi feita entre agosto e setembro de 2014 nas seguintes bases de dados eletrônicas: PubMed, Lilacs, SciELO e Banco de Dados Excerpta Médica (Embase).
As seguintes expressões e descritores Medical Subjects Headings (MeSH) foram usados para a pesquisa: “cystic fibrosis”, “early insulin”, “insulin”, “body mass index”, “impaired glucose tolerance” e “therapy”; nas combinações: “cystic fibrosis and early insulin”, “cystic fibrosis and insulin and body mass index”, “cystic fibrosis and early insulin”, “cystic fibrosis and insulin and body mass index”, “impaired glucose tolerance and cystic fibrosis and insulin and therapy”.
Foram identificados estudos entre 2002 e 2014 por meio de busca eletrônica por dois revisores independentes que avaliaram os títulos e os resumos dos artigos. As referências dos artigos selecionados também foram revistas a fim de identificar os estudos não encontrados nas bases pesquisadas. As discrepâncias entre os revisores foram discutidas e resolvidas por consenso. A data da primeira pesquisa feita foi 28 de agosto de 2014 e da última, 22 de setembro de 2014.
Os critérios de inclusão foram: (I) artigos originais; (II) estudos prospectivos; (III) artigos em inglês, espanhol ou português; (IV) diagnóstico de fibrose cística; (V) desarranjos de glicose; (VI) uso de insulina (independentemente do tipo, da dose ou do cronograma de implementação); (VII) a avaliação dos resultados em parâmetros clínicos (peso ou altura ou índice de massa corporal e função pulmonar). Considerou‐se distúrbio de glicose como um TTOG que não se caracterizava como diabetes pelos critérios da ADA (American Diabetes Association) e com valores de glicose TTOG acima de 140mg/dL em qualquer tempo, exceto no basal e 120 minutos; ou glicose pós‐prandial ou aleatória acima de 200mg/dL; ou diagnóstico de intolerância à glicose (IGT) pelos critérios da ADA.14
Os critérios de exclusão foram: (I) artigos não originais, tais como cartas, anais de congressos e editoriais; (II) estudos que só avaliaram DRFC sem outros tipos de distúrbios de glicose.
Os dados extraídos foram: desenho do estudo, tamanho da amostra, características da população, tempo de acompanhamento, tipo de insulinoterapia (incluindo dose e regime de uso) e os efeitos sobre peso, índice de massa corporal e função pulmonar.
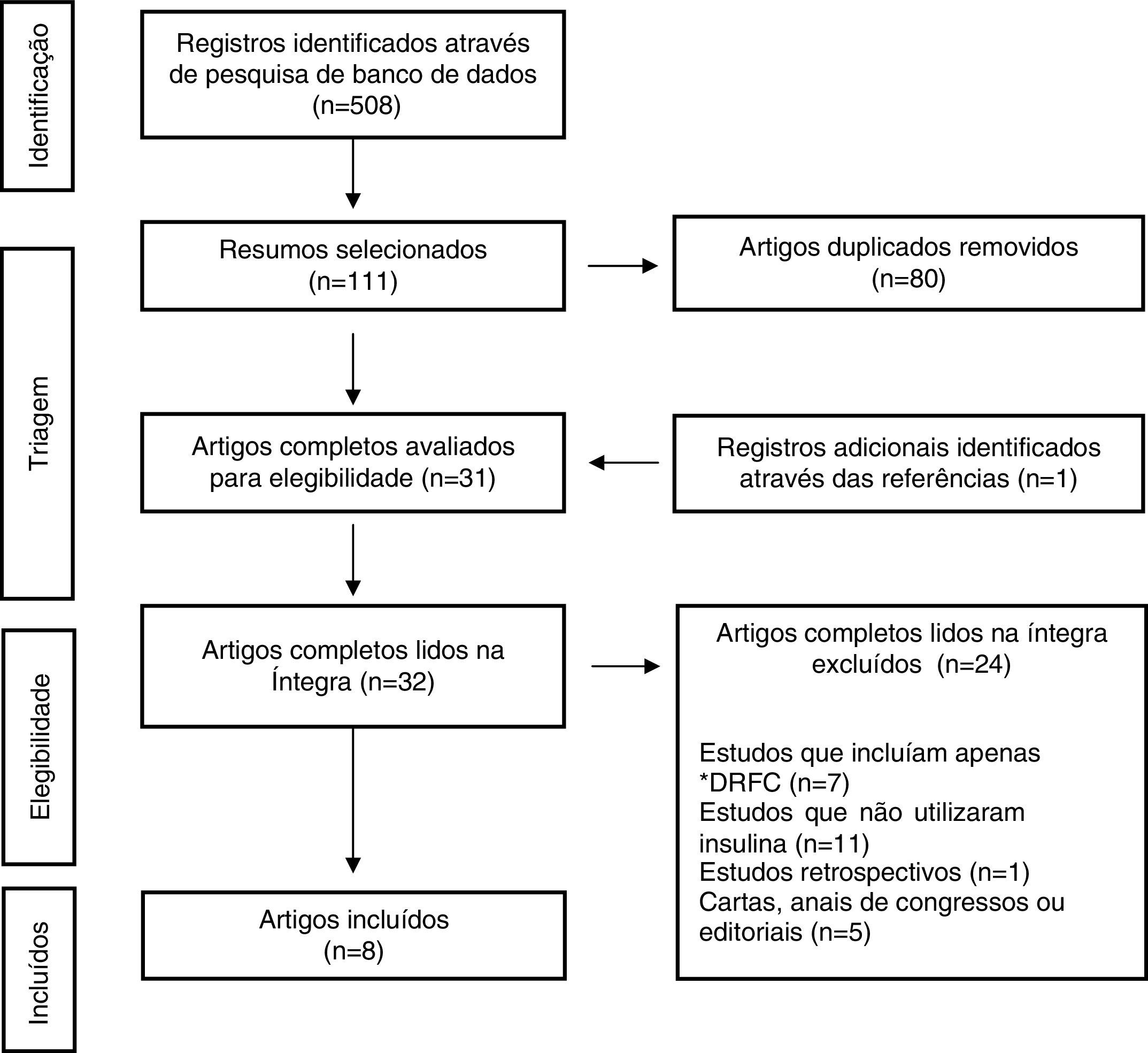
ResultadosA busca inicial identificou 508 artigos, dos quais 111 foram selecionados pelo exame de títulos e resumos. As referências dos trabalhos selecionados também foram revisadas e um estudo adicional foi incluído. Desses, 80 foram identificados como duplicados e removidos; assim, 32 artigos foram lidos na íntegra, dos quais 24 foram excluídos pelos critérios de exclusão. A seleção final foi composta por oito itens (fig. 1). As características dos resultados do estudo se encontram resumidas na tabela 1.
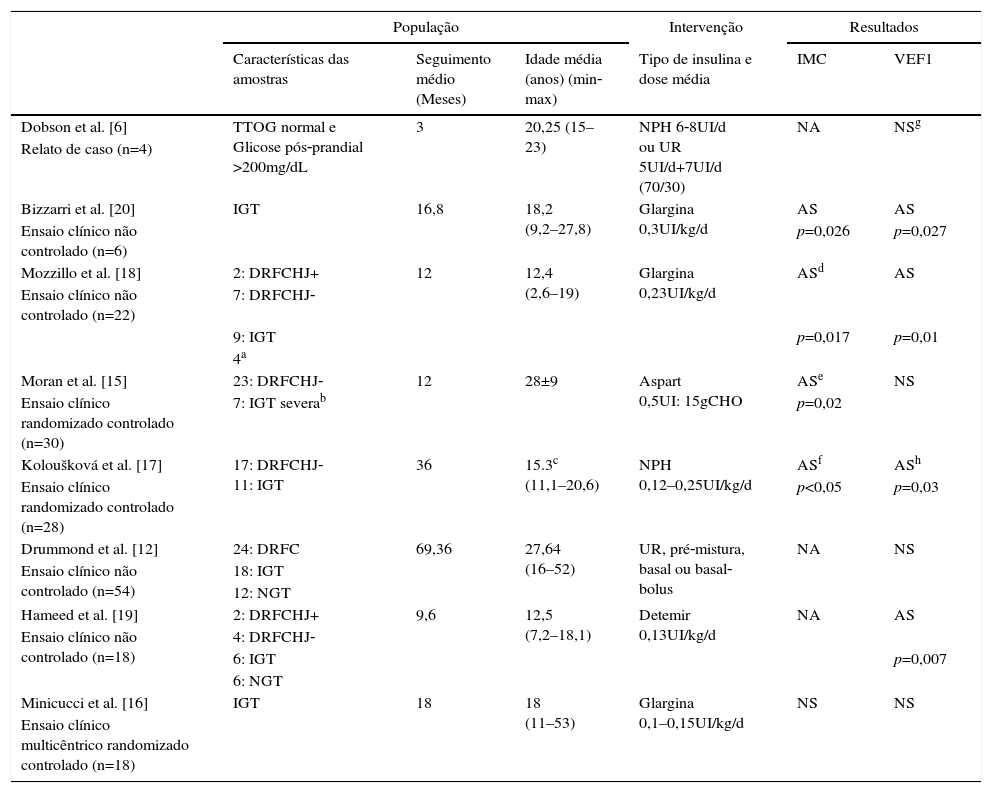
Características dos estudos incluídos
| População | Intervenção | Resultados | ||||
|---|---|---|---|---|---|---|
| Características das amostras | Seguimento médio (Meses) | Idade média (anos) (min‐max) | Tipo de insulina e dose média | IMC | VEF1 | |
| Dobson et al. [6] | TTOG normal e Glicose pós‐prandial >200mg/dL | 3 | 20,25 (15–23) | NPH 6‐8UI/d ou UR 5UI/d+7UI/d (70/30) | NA | NSg |
| Relato de caso (n=4) | ||||||
| Bizzarri et al. [20] | IGT | 16,8 | 18,2 (9,2–27,8) | Glargina 0,3UI/kg/d | AS | AS |
| Ensaio clínico não controlado (n=6) | p=0,026 | p=0,027 | ||||
| Mozzillo et al. [18] | 2: DRFCHJ+ | 12 | 12,4 (2,6–19) | Glargina 0,23UI/kg/d | ASd | AS |
| Ensaio clínico não controlado (n=22) | 7: DRFCHJ‐ | |||||
| 9: IGT | p=0,017 | p=0,01 | ||||
| 4a | ||||||
| Moran et al. [15] | 23: DRFCHJ‐ | 12 | 28±9 | Aspart 0,5UI: 15gCHO | ASe | NS |
| Ensaio clínico randomizado controlado (n=30) | 7: IGT severab | p=0,02 | ||||
| Koloušková et al. [17] | 17: DRFCHJ‐ 11: IGT | 36 | 15.3c (11,1–20,6) | NPH 0,12–0,25UI/kg/d | ASf | ASh |
| Ensaio clínico randomizado controlado (n=28) | p<0,05 | p=0,03 | ||||
| Drummond et al. [12] | 24: DRFC | 69,36 | 27,64 (16–52) | UR, pré‐mistura, basal ou basal‐bolus | NA | NS |
| Ensaio clínico não controlado (n=54) | 18: IGT | |||||
| 12: NGT | ||||||
| Hameed et al. [19] | 2: DRFCHJ+ | 9,6 | 12,5 (7,2–18,1) | Detemir 0,13UI/kg/d | NA | AS |
| Ensaio clínico não controlado (n=18) | 4: DRFCHJ‐ | |||||
| 6: IGT | p=0,007 | |||||
| 6: NGT | ||||||
| Minicucci et al. [16] | IGT | 18 | 18 (11–53) | Glargina 0,1–0,15UI/kg/d | NS | NS |
| Ensaio clínico multicêntrico randomizado controlado (n=18) | ||||||
DRFCHJ+, DRFC com hiperglicemia de jejum; DRFCHJ‐, DRFC sem hiperglicemia de jejum; NGT, tolerância normal à glicose; CHO, carboidrato; VEF1, volume expiratório no primeiro segundo; UR, insulina ultrarrápida; NA, dados não avaliados; NS, não significativo; AS, Aumento significativo.
O tamanho da amostra dos estudos incluídos variou de 4 a 54 pacientes com média de 12,4 a 28 anos. Pesquisadores e sujeitos não eram cegos para atribuição do tratamento em qualquer dos estudos.
O tipo de acompanhamento, o tempo de insulina, a dose e o cronograma de implantação foram muito heterogêneos, o que pode ser visualizado na tabela 1. Três estudos usaram grupos controle para comparar os efeitos da insulina. Moran et al.15 selecionaram controles correspondentes submetidos a outros tipos de intervenção (repaglinida ou placebo), enquanto que Minicucci et al.16 usaram controles com IGT e Koloušková et al.,17 controles com TTOG normal pelos critérios da ADA (NGT). Nesses dois últimos estudos os controles não foram submetidos a intervenções farmacológicas.
Os critérios de inclusão dos estudos foram muito heterogêneos. Mozzillo et al.18 usaram os seguintes critérios de inclusão: nenhum uso de corticosteroide sistêmico e ausência de exacerbação da doença pulmonar. Minicucci et al.16 incluíram pacientes com pelo menos uma das seguintes condições: (I) índice de massa corporal IMC6 Em contraste, Moran et al.15 optaram por intervir em um grupo de pacientes clinicamente mais estável e usaram os seguintes critérios de inclusão: (I) término do crescimento linear; (II) estabilidade de peso nos últimos 3 meses; (III) ausência de infecção aguda nos últimos 2 meses. Os critérios de exclusão para esse estudo foram: (I) uso de corticoides orais ou intravenosos nos últimos 6 meses; (II) hiperglicemia de jejum no ano anterior; (III) disfunção hepática; (IV) gravidez. Deficiência insulínica precoce, diagnosticada pelo teste de tolerância de glicose intravenosa (IVGTT) e/ou níveis elevados de glicose no TTOG foram usados como critério de inclusão para os estudos de Koloušková et al.17 e Hameed et al. 19
Cinco estudos avaliaram os efeitos da insulina no IMC dos pacientes com FC.15–18,20 Bizzarri et al.,20 de Moran et al.15 e Koloušková et al.17 demonstraram um aumento significativo do IMC após intervenção com insulina. Mozillo et al.18 observaram um aumento significativo do IMC apenas em pacientes com z‐escore inicial <–1 de IMC. Apesar de Moran et al.15 identificarem melhoria no IMC no grupo como um todo, no grupo específico de IGT não notaram aumento significativo nesse parâmetro. Dobson et al.,6 Drummond et al.12 e Hameed et al.19 optaram pela avaliação do peso corporal. Hameed et al.19 e Drummond et al.12 observaram ganho de peso significativo após a intervenção com insulina, enquanto Dobson et al.6 sugeriram essa tendência, uma vez que os dados não foram estatisticamente avaliados.
O VEF1 foi o único parâmetro clínico avaliado por todos os estudos. Bizzarri et al.,20 Mozzillo et al.18 e Hameed et al.19 observaram um aumento significativo no VEF1 após o uso da insulina. Koloušková et al.17 observaram que, no fim do seguimento, o grupo com intervenção apresentou maior VEF1 em comparação com o grupo controle. Dobson et al.6 mostraram um aumento aparente desse parâmetro com o uso de insulina, uma vez que tratava apenas de um relato de caso. Nos estudos de Moran et al.,15 Drummond et al.12 e Minicucci et al.,16 o VEF1 permaneceu inalterado após a intervenção. Porém Drummond et al.12 avaliaram separadamente apenas os pacientes diagnosticados com IGT, e observaram uma redução significativa na taxa de declínio do VEF1 em pacientes que usaram insulina. Hameed et al.19 avaliaram separadamente apenas os pacientes com deficiência de insulina precoce (excluindo os pacientes com DRFC) e nesse grupo também observaram um aumento significativo no VEF1. Moran et al.15 relataram uma aparente menor diminuição do VEF1 em doentes que usaram insulina em comparação com o grupo placebo, mas essa estabilidade não foi estatisticamente significativa.
Mozzillo et al.18 observaram uma redução no número de exacerbações pulmonares (em comparação com o ano anterior), enquanto Bizzarri et al.20 não observaram alterações no número de hospitalizações por exacerbações. Os quatro pacientes avaliados por Dobson et al.6 apresentaram aumento na capacidade vital forçada (CVF) com o uso de insulina. Hameed et al.19 observaram melhoria significativa na CVF após a intervenção.
Nos resultados de Bizzarri et al.20 não houve alteração significativa nos níveis de hemoglobina glicosilada (HbA1c) após a insulina, enquanto que o grupo de pacientes avaliados por Minicucci et al.16 mostrou uma redução significativa na HbA1c com o uso de insulina.
Episódios frequentes de hipoglicemia foram relatados apenas por Drummond et al.12 Nos demais estudos citados nesta revisão os efeitos adversos da insulinoterapia foram pouco frequentes e bem tolerados.
DiscussãoHá poucos artigos publicados sobre o uso de insulina em pacientes com fibrose cística antes da detecção de diabetes. A maioria é limitada a um único centro e, principalmente, a populações adultas. Em nosso conhecimento esta é a primeira revisão sistemática a examinar os benefícios e os riscos do uso de insulina em pacientes com FC antes do diagnóstico de diabetes.
A intolerância à glicose indica a presença de uma deficiência insulínica, o que faz com que ocorra um consumo proteico e impacto clínico/nutricional negativos; portanto, o tratamento precoce da insulina pode ter um efeito positivo em pacientes com FC na fase de “pré‐diabetes”.20
Os resultados dos estudos fazem sentido quando se considera a fisiopatologia da evolução para o DRFC. Inicialmente há uma deficiência insulínica que gera um catabolismo proteico e excursões glicêmicas, com consequente dificuldade de manutenção/ganho de peso e pioria da função pulmonar. Portanto, a introdução da insulina nessa fase provavelmente impediria os efeitos catabólicos da insulinopenia.
Dados atuais são claros sobre o tratamento com insulina para pacientes com DRFC com ou sem hiperglicemia em jejum,14 mas não há resultados consistentes para determinar se esse tratamento também deve ser feito para aqueles com outras desordens glicêmicas, uma vez que não está bem definido o que são distúrbios glicêmicos nessa população específica. Além disso, há a dúvida se os valores de corte para diagnóstico de DRFC e IGT para a FC são válidos, uma vez que se baseiam em populações sem a doença.
Um impacto negativo da fase de pré‐diabetes está descrito no estado nutricional e na função pulmonar em pacientes com FC,6,21 sugere que a insulina deva ser iniciada antes do diagnóstico da DRFC pelos métodos atuais disponíveis, já que a insulina tem efeitos anabólicos e esses pacientes têm poucos efeitos colaterais (hipoglicemia). O único estudo que relatou episódios frequentes de hipoglicemia foi o de Drummond et al.,12 mas, nesse estudo, vários regimes de terapia de insulina foram usados em pacientes com DRFC, IGT e NGT, não houve descrição do tipo de insulina ou da dose ministrada para cada grupo, o que pode estar relacionado com a diferença na frequência de hipoglicemias observadas entre os estudos.
Embora a maioria dos estudos tenha um tamanho de amostra pequeno e tenha usado mais do que um tipo de insulina, somente Moran et al.15 e Minicucci et al.16 não relataram efeitos positivos com terapia precoce de insulina, porém esses estudos têm algumas peculiaridades descritas abaixo, sugerindo que o início precoce da terapêutica com insulina em pacientes com FC poderia trazer benefícios.
Minicucci et al.16 não demonstraram melhoria clínica com o uso de glargina em pacientes com FC com IGT (critérios ADA). Os autores presumem que a participação no estudo tornava os pacientes mais conscientes de sua alteração no metabolismo da glicose, o que levou a melhor comportamento nutricional. A maioria dos outros estudos6,17–20 apresentou resultados positivos, contudo as doses de insulina usadas eram mais altas.
Mozzillo et al.18 observaram que após 12 meses de terapêutica com insulina a curva de IMC (CDC – Centers for Disease Control) melhorou em pacientes com z‐escore inicial abaixo de ‐1; o que está de acordo com o estudo da Koloušková et al.,17 que também relataram melhoria no IMC, independentemente do escore‐z inicial.
Koloušková et al.17 demonstraram que a administração de insulina tem efeitos positivos sobre a massa corporal magra devido à reversão do catabolismo proteico. No entanto, o grupo controle também mostrou uma tendência a essa melhoria, provavelmente devido à melhor orientação nutricional, uma vez que, em ambos os grupos, houve recomendação de aumento da ingestão calórica a 120%‐150% das necessidades diárias. Segundo os autores, os resultados reforçam o conceito de que a deficiência insulínica, avaliada nesse estudo por IVGTT e TTOG, leva à deterioração clínica em pacientes com FC e que o início precoce da terapêutica com insulina poderia ser recomendado mais cedo do que é atualmente aceito (DRFC).
Dobson et al.,6 Bizzarri et al.20 e Hameed et al.19 observaram uma melhoria no peso dos pacientes que usaram insulina.
Moran et al.15 relataram que a insulina reverte a perda de peso em pacientes com DRFC sem hiperglicemia em jejum, mas não em pacientes com IGT grave. No entanto, a população estudada se encontrava em idade adulta e parece haver uma melhor resposta quando esses indivíduos são crianças e adolescentes. Além disso, o grupo em questão tinha IGT grave (TTOG≥200mg/dL em qualquer momento e 120 minutos entre 180‐199mg/dL) e, em outros estudos, os pacientes foram selecionados previamente à etapa de IGT grave, o que pode explicar a diferenças encontradas nos resultados.
Bizarri et al.20 observaram melhoria no VEF1 sem redução nas exacerbações pulmonares. Mozzillo et al.18 relataram um aumento no VEF1 e uma redução das exacerbações pulmonares com o uso de insulina. Hameed et al.19 evidenciaram uma queda do VEF1 antes de iniciar o tratamento e melhoria após a introdução da insulina. Koloušková et al.17 e Drummond et al.12 analisaram VEF1 em comparação com sujeitos não tratados e identificaram no grupo de controle um declínio da função do pulmão, o que não foi observado no grupo tratado com insulina. Moran et al.15 e Minicucci et al.16 não mostraram qualquer melhoria no VEF1 com o uso precoce de insulina. No entanto, no estudo de Minicucci et al.16 houve perda de 10% do VEF1 no ano anterior à intervenção, o que pode ser um viés, uma vez que nem mesmo os pacientes com DRFC apresentam tal declínio nesse parâmetro. Koloušková et al.17 e Drummond et al.,12 que tinham uma série de casos mais consistentes, observaram que o VEF1 foi menor no grupo não tratado em comparação com aqueles tratados com a insulina, o que confirma os resultados descritos por Dobson et al.,6 Bizarri et al.20 e Hameed et al.19
Dobson et al.6 sugerem uma melhoria da função pulmonar (VEF1 e CVF) com o uso de insulina. No entanto, nesse estudo o tamanho da amostra foi pequeno (n=4), a amostra foi selecionada por conveniência, sem controle, a reavaliação ocorreu em um curto período (3 meses), sem padronização para os tipos de insulina usados (mais do que um tipo de insulina foi usado) e não houve uma avaliação estatística, provavelmente pelo tamanho da amostra.
Hameed et al.19 avaliaram a altura separadamente e não encontraram diferenças após o início da terapêutica com insulina. Isso é provavelmente devido ao resultado observado em outro estudo de Bizzarri et al..22 Ele sugere que quando do desenvolvimento do DRFC já há um comprometimento significativo e irreversível da altura, uma vez que a maioria dos pacientes com FC desenvolve diabetes na puberdade, mesmo momento em que ocorre o estirão de crescimento.22
A evidência favorável ou não ao uso da insulina antes de detecção de diabetes em pacientes com FC permanece inconclusiva com pouco conhecimento sobre resultados em longo prazo. São poucos estudos prospectivos sobre o uso da insulina antes da detecção de diabetes em pacientes com FC e incluem populações com diferentes tipos de distúrbios de glicose, sem delimitação da faixa etária, tempo de seguimento, tipos, dosagem e cronograma de implantação da insulina. Apenas dois estudos15,16 foram multicêntricos e três, controlados.15–17 Além disso, não foi possível avaliar o efeito de variáveis importantes, como rotina nutricional, e uma padronização na definição de desarranjos glicêmicos.
Ao analisar os resultados desses estudos com relação aos efeitos anabólicos da insulina, existem razões teóricas para acreditar que a insulina tenha um efeito benéfico na população estudada. No entanto, a adição de um tratamento para a diabetes em um regime de tratamento com múltiplas drogas é complicada, o que torna essa decisão ainda mais controversa.
Ensaios multicêntricos, na faixa etária pediátrica, randomizados, com suporte nutricional adequado, tipo e doses padronizadas de insulina (suficiente para promover o anabolismo), são necessários para determinar se esse tratamento é ou não justificado. Lembra‐se que estudos controlados com placebo são de difícil execução, devido ao fato de a insulina ser um medicamento injetável.
ConclusãoOs diferentes métodos e casuísticas usados nos estudos não permitem afirmar que a terapia precoce com insulina deva ser aplicada em pacientes com FC e distúrbios glicêmicos. Para tal, são necessários estudos com amostras maiores, padronização da dieta, faixa etária e uniformidade de uso da insulina.
FinanciamentoO presente estudo não teve fontes de financiamento. Um dos coautores recebe bolsa de doutorado da Fapesp (Fundação de Amparo à Pesquisa do Estado de São Paulo, processo n° 2014/00611‐2).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.