Investigar a associação entre os níveis séricos de ácido úrico e a resistência insulínica em crianças e adolescentes com obesidade.
MétodosEstudo transversal, com 245 crianças e adolescentes (134 obesos e 111 controles), entre oito e 18 anos. Foram coletadas variáveis antropométricas (peso, estatura e circunferência abdominal), pressão arterial e parâmetros bioquímicos. As características clínicas dos grupos foram analisadas pelo teste t ou pelo qui‐quadrado. Para avaliar a associação entre os níveis de ácido úrico e a resistência insulínica usaram‐se o teste de Pearson e regressão logística. A resistência insulínica foi a variável dependente no modelo de regressão.
ResultadosA prevalência de resistência insulínica foi de 26,9%. As variáveis antropométricas, a pressão arterial sistólica e diastólica e as variáveis bioquímicas foram maiores no grupo obeso (p<0,001), exceto o colesterol de alta densidade. Foi observada correlação positiva e significativa entre as variáveis antropométricas e o ácido úrico com o HOMA‐IR no grupo obeso e no controle. Essa foi maior no grupo obeso e na amostra total. No modelo de regressão logística que incluiu idade, sexo e obesidade, a odds ratio do ácido úrico como fator associado à resistência insulínica foi de 1,91 (IC95% 1,40‐2,62; p<0,001).
ConclusõesObserva‐se que o aumento no nível sérico de ácido úrico apresenta correlação estatística positiva com a resistência insulínica e está associado à elevação no risco em crianças e adolescentes obesos.
To investigate the association between serum uric acid levels and insulin resistance in children and adolescents with obesity.
MethodsCross‐sectional study with 245 children and adolescents (134 obese and 111 controls), aged 8 to 18 years. The anthropometric variables (weight, height and waist circumference), blood pressure and biochemical parameters were collected. The clinical characteristics of the groups were analyzed by t‐test or chi‐square test. To evaluate the association between uric acid levels and insulin resistance the Pearson's test and logistic regression were applied.
ResultsThe prevalence of insulin resistance was 26.9%. The anthropometric variables, systolic and diastolic blood pressure and biochemical variables were significantly higher in the obese group (p<0.001), except for the high‐density‐lipoprotein cholesterol. There was a positive and significant correlation between anthropometric variables and uric acid with HOMA‐IR in the obese and in the control groups, which was higher in the obese group and in the total sample. The logistic regression model that included age, gender and obesity, showed an odds ratio of uric acid as a variable associated with insulin resistance of 1.91 (95%CI 1.40 to 2.62; p<‐0.001).
ConclusionsThe increase in serum uric acid showed a positive statistical correlation with insulin resistance and it is associated with and increased risk of insulin resistance in obese children and adolescents.
O ácido úrico é o produto final do metabolismo das purinas, produzido pelo fígado e excretado pelos rins,1 com reconhecida ação antioxidante quando seus níveis sanguíneos se encontram dentro dos limites fisiológicos.2 Porém, a elevação nos níveis séricos, denominada hiperuricemia, é considerada fator de risco independente para doenças cardiovasculares e também tem papel no desenvolvimento de doenças metabólicas.3‐5 Além disso, estudos prospectivos recentes, com amostras representativas, apontam a hiperuricemia como preditora do desenvolvimento de resistência insulínica e da diabetes melito tipo 2.4,5 Krishnan et al.5 demonstraram que a hiperuricemia aumenta em 1,87 vez a chance de desenvolver diabetes melito tipo 2 e em 1,36 vez a chance de desenvolver resistência insulínica após 15 anos de seguimento.
Uma das condições patológicas associadas à hiperuricemia é a obesidade.6,7 Indivíduos obesos mostram menor excreção renal de ácido úrico e podem apresentar também maior produção.8 Em crianças e adolescentes, estudos apontam que a relação entre hiperuricemia e obesidade é positiva6 e associada a complicações cardiometabólicas como hipertensão, aterosclerose e síndrome metabólica.9‐12 Yoo et al.13 avaliaram a prevalência de resistência insulínica e síndrome metabólica em pacientes com gota, que é uma doença metabólica caracterizada por hiperuricemia e deposição de cristais de monourato de sódio nas articulações e nos tecidos. Os autores concluíram que esses pacientes têm maior prevalência de resistência insulínica e síndrome metabólica, comparados com seus pares saudáveis, e que a hiperuricemia, em associação com a resistência insulínica, pode ter como causa a obesidade abdominal.13
Nesse contexto, em que a hiperuricemia tem sido apontada como mais um elo entre a obesidade e a resistência insulínica, estudos com a população pediátrica ainda são escassos. Portanto, o objetivo deste estudo foi investigar a associação entre os níveis séricos de ácido úrico e resistência insulínica em crianças e adolescentes com obesidade.
MétodoEstudo de delineamento transversal, com abordagem quantitativa, parte de um projeto intitulado “Associação de polimorfismos genéticos de relevância cardiovascular com hipertensão arterial sistêmica e obesidade na infância e adolescência” aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de Juiz de Fora, MG, Brasil, sob o número 1942.001.2010. Todos os envolvidos na pesquisa, pais ou responsáveis e crianças e adolescentes, foram esclarecidos sobre os objetivos e procedimentos da pesquisa e os que concordaram em participar assinaram o Termo de Consentimento Livre e Esclarecido.
A população deste estudo foi constituída por crianças e adolescentes atendidas no ambulatório no Instituto da Criança e do Adolescente de Juiz de Fora e no Ambulatório de Endocrinologia Infantil do Núcleo Interdisciplinar de Estudos e Pesquisa em Nefrologia (Niepen) da Universidade Federal de Juiz de Fora. Foi feita uma amostragem por conveniência, que incluiu 134 crianças e adolescentes obesos no grupo experimental e 111 crianças e adolescentes eutróficos. Os critérios de não inclusão foram doença crônica, doenças endócrinas, uso de fármacos, sinais de infecção aguda e gravidez. Todas as crianças e todos os adolescentes foram submetidos a exame físico.
O peso e altura foram medidos com os participantes vestindo roupas leves e sem calçados. A altura foi medida com precisão de 0,1cm, com ‐se um estadiômetro de parede. O peso corporal foi medido com uma balança digital de precisão de 0,1kg. A obesidade foi definida como índice de massa corporal (IMC) acima do percentil 95 de acordo com idade e sexo.14 A circunferência abdominal (CA) foi medida com fita inelástica, no ponto médio entre a última costela e a borda superior da crista ilíaca.15 A pressão arterial foi aferida pelo método auscultatório e considerados o tamanho adequado do manguito. Após repouso de 10 minutos em ambiente calmo, foi feita a aferição da pressão arterial.16 Após o exame físico, foi feita a coleta de sangue, por punção venosa de manhã, depois de 12 horas de jejum. O sangue foi imediatamente centrifugado à temperatura ambiente e as amostras de plasma e soro foram armazenadas a ‐70°C até ser analisadas.
As concentrações de glicose e ácido úrico e os parâmetros lipídicos (colesterol total, triglicérides e lipoproteína de alta densidade [HDL]) foram determinados em soro, com métodos enzimáticos de rotina, com o uso de kits comerciais (Labtest Diagnósticos, AS, Lagoa Santa, Brasil). A concentração da lipoproteína de baixa densidade (LDL) foi estimada pela fórmula de Friedewald.17 A concentração de insulina foi determinada por imunoensaio enzimático em soro (kit Genese Produtos Diagnósticos, São Paulo, Brasil). A estimativa da resistência à insulina foi obtida por meio do Homeostasis Model Assessment for Insulin Resistance (HOMA‐IR), que é o produto da insulina de jejum (μU/mL) e da glicemia de jejum (mmol/L) dividido por 22,5. A resistência à insulina foi definida quando o valor de HOMA‐IR foi maior ou igual a 3,16.18
Os dados estão apresentados como média±desvio padrão. As características clínicas dos grupos foram analisadas por meio do teste t ou qui‐quadrado. Para avaliar a associação entre idade, IMC, CA, pressão arterial sistólica, pressão arterial diastólica, HDL e ácido úrico com o HOMA‐IR, usamos o teste de correlação de Pearson. Foi também produzido um modelo de regressão logística para mensurar a associação entre os níveis de ácido úrico (variável independente) e a resistência insulínica (variável dependente binária). Outras variáveis independentes e potenciais variáveis de confusão (idade, sexo e obesidade) foram incluídas no modelo de regressão com a finalidade de controlar seu possível efeito na resistência insulínica. As variáveis independentes selecionadas foram incluídas no modelo em virtude da conhecida associação entre elas e a resistência insulínica.6 O nível de significância adotado foi de 5% (p<0,05) para todos os testes e o programa estatístico usado foi o SPSS versão 15.0.
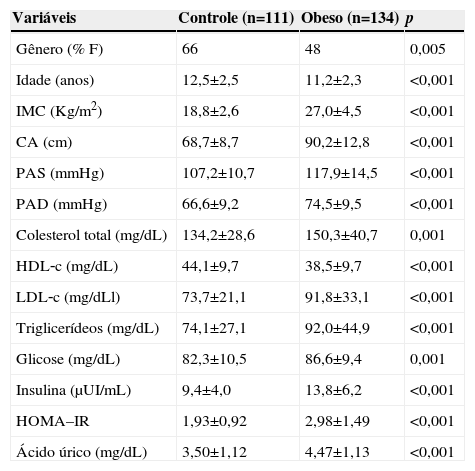
ResultadosAvaliamos 245 crianças e adolescentes (55,9% do sexo feminino) e a prevalência de resistência insulínica foi de 26,9%. As características clínicas dos grupos avaliados estão representadas na tabela 1. Como esperado, o grupo obeso apresentou IMC e CA maiores do que o grupo controle (p<0,001). A pressão arterial sistólica e a diastólica foram mais elevadas no grupo obeso, comparado com o grupo controle (p<0,001). Além disso, todas as características bioquímicas, colesterol total, LDL, triglicérides, glicose, ácido úrico, insulina e HOMA‐IR apresentaram‐se em níveis mais altos no grupo obeso, exceto o HDL, que foi mais baixo no grupo obeso comparado com o grupo controle (p<0,001).
Características clínicas dos grupos estudados
| Variáveis | Controle (n=111) | Obeso (n=134) | p |
|---|---|---|---|
| Gênero (% F) | 66 | 48 | 0,005 |
| Idade (anos) | 12,5±2,5 | 11,2±2,3 | <0,001 |
| IMC (Kg/m2) | 18,8±2,6 | 27,0±4,5 | <0,001 |
| CA (cm) | 68,7±8,7 | 90,2±12,8 | <0,001 |
| PAS (mmHg) | 107,2±10,7 | 117,9±14,5 | <0,001 |
| PAD (mmHg) | 66,6±9,2 | 74,5±9,5 | <0,001 |
| Colesterol total (mg/dL) | 134,2±28,6 | 150,3±40,7 | 0,001 |
| HDL‐c (mg/dL) | 44,1±9,7 | 38,5±9,7 | <0,001 |
| LDL‐c (mg/dLl) | 73,7±21,1 | 91,8±33,1 | <0,001 |
| Triglicerídeos (mg/dL) | 74,1±27,1 | 92,0±44,9 | <0,001 |
| Glicose (mg/dL) | 82,3±10,5 | 86,6±9,4 | 0,001 |
| Insulina (μUI/mL) | 9,4±4,0 | 13,8±6,2 | <0,001 |
| HOMA–IR | 1,93±0,92 | 2,98±1,49 | <0,001 |
| Ácido úrico (mg/dL) | 3,50±1,12 | 4,47±1,13 | <0,001 |
F, feminino; M, masculino; IMC, índice de massa corporal; CA, circunferência abdominal; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; HDL, lipoproteína de alta densidade; LDL, lipoproteína de baixa densidade; HOMA‐IR, modelo de avaliação da homeostase‐índice de resistência insulínica.
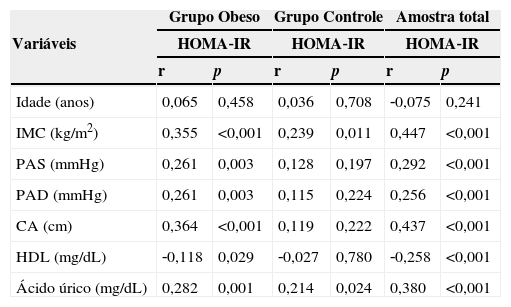
Na tabela 2 estão apresentados os resultados da análise de correlação entre as variáveis idade, IMC, CA, pressão arterial sistólica, pressão arterial diastólica, HDL e ácido úrico com o HOMA‐IR nos grupos obeso, controle e em ambos os grupos. No grupo obeso foi observada correlação positiva e significativa entre a maioria das variáveis com o HOMA‐IR, exceto a idade, que não se correlacionou com o HOMA‐IR, e o HDL, que apresentou correlação negativa. No grupo controle, foi observada correlação positiva e significativa entre o IMC e o HOMA‐IR e o ácido úrico e o HOMA‐IR. Quando analisada a amostra total, observa‐se correlação positiva e significativa entre a maioria das variáveis e o HOMA‐IR, exceto a idade, que não se correlacionou com o HOMA‐IR, e o HDL, que apresentou correlação negativa. As variáveis antropométricas (IMC e circunferência abdominal) e o ácido úrico foram as que apresentaram melhor correlação com o HOMA‐IR (r=0,447, r=0,437 e r=380; p<0,001 respectivamente).
Correlação entre HOMA‐IR e as variáveis analisadas por grupos
| Grupo Obeso | Grupo Controle | Amostra total | ||||
|---|---|---|---|---|---|---|
| Variáveis | HOMA‐IR | HOMA‐IR | HOMA‐IR | |||
| r | p | r | p | r | p | |
| Idade (anos) | 0,065 | 0,458 | 0,036 | 0,708 | ‐0,075 | 0,241 |
| IMC (kg/m2) | 0,355 | <0,001 | 0,239 | 0,011 | 0,447 | <0,001 |
| PAS (mmHg) | 0,261 | 0,003 | 0,128 | 0,197 | 0,292 | <0,001 |
| PAD (mmHg) | 0,261 | 0,003 | 0,115 | 0,224 | 0,256 | <0,001 |
| CA (cm) | 0,364 | <0,001 | 0,119 | 0,222 | 0,437 | <0,001 |
| HDL (mg/dL) | ‐0,118 | 0,029 | ‐0,027 | 0,780 | ‐0,258 | <0,001 |
| Ácido úrico (mg/dL) | 0,282 | 0,001 | 0,214 | 0,024 | 0,380 | <0,001 |
IMC, índice de massa corporal; CA, circunferência abdominal; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; HDL, lipoproteína de alta densidade; HOMA‐IR, modelo de avaliação da homeostase‐índice de resistência insulínica.
Analisou‐se ainda a associação de resistência insulínica com os níveis de ácido úrico, em um modelo de regressão logística que incluiu idade, sexo e obesidade como variáveis independentes. O modelo de regressão logística produzido para mensurar a associação entre os níveis de ácido úrico (variável independente) e a resistência insulínica (variável dependente binária) incluiu outras variáveis independentes e potenciais variáveis de confusão (idade, sexo e obesidade), inseridas no modelo com a finalidade de controlar seus possíveis efeitos na resistência insulínica. A variável dependente (resistência insulínica) foi dicotomizada em função do ponto de corte do HOMA‐IR (3,16). O odds ratio (OR) do ácido úrico foi 1,91 (IC95%: 1,40 a 2,62; p<0,001). Isso indica que o aumento de uma unidade ácido úrico eleva em 91% a probabilidade de resistência insulínica.
DiscussãoO principal achado deste estudo foi a associação entre os níveis séricos de ácido úrico e a resistência insulínica em crianças e adolescentes, mesmo após os ajustes para idade, obesidade e sexo. Depois do ajuste para essas variáveis, observou‐se que a cada aumento de 1 mg/dL nos níveis séricos de ácido úrico haveria um aumento de 91% na chance de resistência insulínica. Mesmo ao analisar o grupo obeso e o controle de forma isolada, o ácido úrico e o IMC mostraram correlação com o HOMA‐IR (tabela 2).
Esse achado está de acordo com outros autores que também observaram associação entre os níveis de ácido úrico e resistência insulínica em estudos que envolveram crianças em faixa etária mais restrita.6,9 Gil‐Campos et al.6 verificaram que em crianças obesas pré‐puberes a concentração de ácido úrico foi significativamente maior, comparada com o grupo controle, após ajuste para sexo, idade e IMC associada à resistência insulínica. Esses autores propõem que a elevação sérica do ácido úrico pode ser um indicador de alteração metabólica precoce associada com outras características da resistência à insulina. Em nosso estudo, observou‐se diferença estatística na idade entre os grupos avaliados, que foi de apenas metade do desvio padrão (50%), e com distribuição normal. Assim, considerou‐se que a diferença não foi clinicamente relevante, tendo em vista o grau de dispersão dessa variável.
De fato, na população adulta, estudos prospectivos recentes apontam ser a hiperuricemia preditora de resistência insulínica e diabetes melito tipo 2.4,5,19 Após seguimento de 15 anos, Krishnan et al.5 evidenciaram que a hiperuricemia aumenta em 1,87 vez a chance de desenvolver diabetes melito tipo 2 e em 1,36 vez a chance de desenvolver resistência insulínica. Em metanálise, Kodama et al.19 apontaram aumento de 17% no risco de diabete tipo 2 para cada aumento de 1 mg/dL no ácido úrico sérico.
Embora os mecanismos fisiopatológicos da ligação entre a hiperuricemia e a resistência insulínica ainda não estejam claramente estabelecidos, a hiperuricemia é, com frequência, apontada como o resultado da redução na excreção renal de ácido úrico sob ação da hiperinsulinemia.1,20 Todavia, os estudos citados se contrapõem a essa ideia por evidenciar que a hiperuricemia precede a resistência insulínica.4,5,19
No presente estudo, também não foi possível responder quais são os mecanismos fisiopatológicos da contribuição dos níveis séricos de ácido úrico sobre a resistência insulínica na obesidade, mas nos apoiaremos em resultados anteriores, tanto de estudos com modelos animais como de estudos clínicos, para fazer algumas especulações.
A obesidade é considerada importante fator de risco para a resistência insulínica e desenvolvimento de diabetes melito tipo 2, uma vez que, em indivíduos obesos, o tecido adiposo libera substâncias envolvidas no desenvolvimento de resistência à insulina, como ácidos graxos não esterificados, hormônios e citocinas pró‐inflamatórias.21,22 O tecido adiposo tem capacidade de secretar citocinas e fatores de crescimento que participam de diversos processos metabólicos. Algumas dessas citocinas, com características pró‐inflamatórias e aumentadas na obesidade, estão diretamente associadas à resistência a insulina, como a leptina, o TNF‐α e a visfatina, enquanto a adiponectina, uma citocina com característica anti‐inflamatória, está reduzida na presença de obesidade e é descrita como inversamente associada à resistência insulínica.21
Outro achado do nosso estudo foi que o grupo obeso apresentou níveis séricos de ácido úrico estatisticamente mais elevados, comparado com o grupo controle (4,47±1,13 vs. 3,50±1,12, p<0,001). Essa característica pode ser atribuída aos seguintes fatores: 1) indivíduos obesos apresentam redução na depuração renal de ácido úrico, o que pode implicar maiores níveis séricos;23 2) o tecido adiposo, similar ao fígado e ao intestino, apresenta abundante atividade da xantina oxidase (enzima responsável por catalisar purinas a ácido úrico) e a obesidade é associada com elevada atividade da xantina oxidase e maior produção de ácido úrico pelo tecido adiposo.8
Um dos possíveis elos entre a hiperuricemia e a resistência insulínica parece ser a disfunção endotelial. A indução de hiperuricemia em animais resultou em redução na biodisponibilidade de óxido nítrico, vasoconstrição e desenvolvimento de doença microvascular24 e, segundo Park et al.,25 o ácido úrico é responsável por atenuar a produção de óxido nítrico por meio da diminuição da interação entre a eNOS (enzima óxido nítrico sintase endotelial) e a calmodulina. De fato, estudos clínicos apontam que elevados níveis de ácido úrico estão associados a prejuízo na função vascular de crianças e adolescentes12,26 Assim, a disfunção endotelial mediada pela hiperuricemia poderia resultar em menor captação de insulina pela redução no fluxo sanguíneo em tecidos periféricos (menor oferta de óxido nítrico).1
Além de interferir na produção de óxido nítrico, o ácido úrico também pode ser responsável pela sua degradação. Embora, em concentrações fisiológicas, o ácido úrico tenha efeito antioxidante e seja, portanto, um fator de proteção endotelial, a elevação nos níveis séricos faz com que assuma um papel pró‐oxidante, pois sua via de formação pela xantina oxidase produz espécies reativas de oxigênio e peróxido de hidrogênio, que, em excesso, irão reagir com o óxido nítrico endotelial e formar o peroxinitrito, importante agente oxidante.27
Embora a concentração sérica média de ácido úrico observada em nosso estudo tenha se mostrado significativamente maior no grupo obeso comparado com o controle, não existe concordância na literatura sobre os valores de referência desse marcador em crianças e adolescentes, o que impede comparações. Todavia, acreditamos que a dosagem do ácido úrico sérico seja uma boa opção para avaliar o risco cardiometabólico mesmo em faixa etária jovem, como é possível constatar em nossos resultados. Para isso, tornam‐se necessários estudos que visem a estabelecer valores de referência para auxiliar no diagnóstico clínico.
Este estudo apresenta algumas limitações e, dentre elas, aponta‐se o uso do HOMA‐IR para avaliar a resistência insulínica. Esse indicador, embora não seja o padrão ouro, é um método amplamente usado devido à sua viabilidade. A ausência de avaliação do estado puberal é outra limitação deste estudo, tendo em vista a variação da faixa etária analisada (oito a 18 anos). A natureza transversal do estudo também não nos permite estabelecer relação de causalidade entre as variáveis.
Com base nos resultados observados, pode‐se concluir que o aumento no nível sérico de ácido úrico apresenta correlação estatística positiva com a resistência insulínica e se associa à elevação no risco em crianças e adolescentes obesos.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosAo Núcleo Interdisciplinar de Estudos e Pesquisa em Nefrologia (Niepen) e à Dra. Débora Cristine Souza‐Costa.