A diabetes mellitus é maioritariamente subdividida em diabetes tipo 1 (DM1) ou tipo 2 (DM2). No entanto, a existência de fatores genéticos, imunológicos e metabólicos partilhados entre estas 2 entidades e a evidência clínica de uma forma de diabetes autoimune diagnosticada no adulto (LADA) sugerem a possibilidade de uma continuidade fisiopatológica.
ObjetivoDescrever os principais mecanismos genéticos, imunológicos e metabólicos comuns ao desenvolvimento de DM1 e de DM2. Fundamentar a hipótese de um contínuo fisiopatológico entre os 2 principais subtipos de diabetes.
MétodosPesquisa sistematizada na base de dados da PubMed de artigos originais ou de revisões sistemáticas publicados até abril de 2013. Os termos de pesquisa utilizados foram: «type 1 diabetes mellitus»; «type 2 diabetes mellitus»; «latent auto-immune diabetes in adults»; «pathophysiology».
ConclusõesA LADA assume, sob o ponto de vista fisiopatológico, uma posição intermédia entre a DM1 e a DM2 com partilha de mecanismos genéticos e imunológicos. Verificou-se que a autorreatividade celular e apoptose da célula β não são processos exclusivos da DM1 e que a insulino-resistência, sendo um elemento fulcral na patogénese da DM2, condiciona uma progressão mais rápida da DM1. A expressão fenotípica da diabetes resulta assim do desequilíbrio criado entre estes mecanismos fisiopatológicos, ao longo da evolução da doença. Mais do que a classificação do doente num destes subtipos de diabetes é o reconhecimento dos mecanismos conducentes às alterações metabólicas que permite uma terapêutica adequada. A definição de LADA como entidade isolada poderá vir a ser retirada.
Diabetes mellitus is mainly subdivided into type 1 diabetes (DM1) or type 2 (DM2). The existence of genetic, metabolic and immunological mechanisms involving these two entities, and clinical evidence of an autoimmune form of diabetes diagnosed in adults (LADA), suggests the possibility of a pathophysiological continuity.
ObjectiveTo describe the main genetic, immunological and metabolic mechanisms common to the development of DM1 and DM2. To support the hypothesis of a pathophysiological continuum between the two main subtypes of diabetes.
MethodsSystematic search in PubMed database of the original articles or systematic reviews published until April 2013. The search terms used were: «type 1 diabetes mellitus», «type 2 diabetes mellitus», «latent auto-immune diabetes in adults», «pathophysiology».
ConclusionsLADA assumes, under the pathophysiological point of view, an intermediate position between DM1 and DM2, sharing genetic and immunological mechanisms. It was found that self-reactivity and apoptosis of the β cell are not exclusive processes of DM1, and that insulin resistance, being a key factor in the pathogenesis of DM2, determines a more rapid progression of DM1. Phenotypic expression of diabetes results from the imbalance created between these pathophysiological mechanisms, along the course of the disease. More than the classification of the patient in a subtype of diabetes it is the recognition of mechanisms leading to metabolic changes that allows an adequate therapy. The definition of LADA as an isolated entity could be withdrawn.
Classificada pela Organização Mundial de Saúde em 4 subtipos etiologicamente distintos1, na prática clínica a diabetes mellitus assume-se maioritariamente sob a forma de diabetes tipo 1 (DM1) ou tipo 2 (DM2). Numa distinção simplista, a DM1 parece resultar de uma destruição da célula β pancreática essencialmente na decorrência de fenómenos autoimunes, e a DM2 parece variar entre um estado de insulino-resistência predominante com défice insulínico relativo e um predomínio do defeito secretor com insulino-resistência associada2.
Na prática, com base nestes pressupostos, o diagnóstico de DM1 estabelece-se geralmente em doentes jovens, magros, com manifestações clínicas e analíticas compatíveis com insulinopenia, sendo confirmado pela presença de autoanticorpos antigénios específicos ou de determinados alelos do antigénio leucocitário humano (HLA). A DM2, por ausência de marcadores específicos, normalmente diagnostica-se após exclusão de DM1 ou de outras causas determinantes de hiperglicemia, nomeadamente outras endocrinopatias3.
A existência de uma forma de diabetes autoimune diagnosticada no adulto, denominada «latent auto-imune diabetes in adults» (LADA), sugere a possibilidade de uma continuidade fisiopatológica entre estas entidades. Recentes estudos europeus revelaram que aproximadamente um décimo (9,7%) dos doentes com diabetes diagnosticada entre os 30-70 anos apresentam uma forma autoimune da doença, sendo a LADA mais prevalente que a diabetes mellitus tipo 1 clássica4. O diagnóstico de LADA baseia-se em 3 critérios: (1) idade superior a 30 anos; (2) positividade para pelo menos um dos 4 autoanticorpos identificados na DM1; e (3) ausência de necessidade de insulinoterapia nos primeiros 6 meses após o diagnóstico5. Além da presença de autoimunidade com disfunção imunomediada da célula β em doentes com características fenotípicas de DM2, verificou-se que também existe partilha de características genéticas, tanto da DM16–8 como da DM29, e que a insulino-resistência também integra a sua etiopatogenia10.
Desta forma, a existência de fatores imunológicos, genéticos e metabólicos que se podem associar simultaneamente à DM1 e à DM2 dificulta o estabelecimento de um diagnóstico clínico imediato e definitivo em cada doente, e acima de tudo permite fundamentar a hipótese de um «continuum» fisiopatológico dos diferentes subtipos de diabetes tradicionalmente definidos. Assim, pode ser questionado o rigor da individualização da LADA como definindo uma entidade clínica e fisiopatológica isolada11.
Predisposição genéticaDiabetes mellitus tipo 1O locus IDDM1 da região HLA Classe II, no braço curto do cromossoma 6 (6p21), codifica múltiplos genes envolvidos na função e regulação da resposta imune e constitui o principal determinante genético da DM17. O risco associado ao genótipo HLA é definido pela combinação de alelos de suscetibilidade e de proteção. O maior risco é conferido pelos haplótipos de predisposição: HLA-DQA1*0501-DQB1*0201 (DQ2) (geralmente herdado com o DRB1*0301 [DR3]) e HLA-DQA1*0301-DQB1*0302 (DQ8) (geralmente herdado com DRB1*0401 ou DRB1*0405 [DR4]). Os alelos de proteção são: HLA DRB1*1501/DQA1*0102- DQB1*0602 (DR2-DQ6)7.
Um indivíduo portador de genótipo HLA de elevada predisposição para a DM1 contabiliza um risco absoluto de apenas 5% para desenvolver a doença pelos 15 anos de idade. Esse risco quadruplica na presença de história familiar de DM1, sugerindo o efeito aditivo de outros genes7.
Os 3 principais loci não-HLA estabelecidos na DM1 são: o número variável de frequências repetidas (VNTR) do gene da insulina (IDDM2), o gene cytotoxic T-lymphocyte-associated antigen (CTLA4) e o gene protein tyrosine phosphatase nonreceptor-type 22 (PTPN22)12.
O locus IDDM2 constitui o segundo maior locus de suscetibilidade para DM1. Localiza-se no gene da insulina, no braço curto do cromossoma 11 (11p15.5) e contribui com 10% da suscetibilidade genética para a doença. A associação mais forte foi definida para a região VNTR13, extremamente polimórfica, que compreende 3 classes de alelos de acordo com o seu tamanho, sendo este determinado pelo número de repetições. Com distribuição bimodal, os alelos tendem a agrupar-se em intervalos de 30-60 repetições (alelos classe I) ou de 120-170 repetições (alelos classe III), sendo os alelos classe II, com um número intermédio de repetições, extremamente raros14. O gene da insulina é ativamente transcrito no timo sendo que os diferentes alelos modulam a tolerância à insulina através da sua concentração local. Comparativamente aos alelos classe I, os alelos classe III associam-se a uma transcrição de insulina 2 a 3 vezes superior e otimizam uma seleção negativa de linfócitos T autorreativos ou uma seleção positiva de células T reguladoras15. A homozigotia para alelos VNTR classe I (genótipo AA) determina níveis mais baixos de insulina no timo, que podem conduzir à autoimunidade.
O gene CTLA4, localizado no braço longo do cromossoma 2 (2q23), codifica uma molécula da superfície celular da superfamília das imunoglobulinas16. Inúmeros polimorfismos deste gene têm sido associados com a DM1 devido ao seu papel regulador da resposta imune. O polimorfismo 49A>G do gene CTLA4 (genótipo A/G) associa-se a uma maior predisposição para o desenvolvimento de DM1 ou de outras patologias autoimunes7.
Por fim, o gene PTPN22, localizado no braço curto do cromossoma 1 (1p13), codifica a proteína tirosina fosfatase, que é expressa primariamente nos tecidos linfoides, e inibe a ativação das células T16. O polimorfismo C1858T do gene PTPN22 (genótipo CT/TT), à semelhança do anterior, predispõe ao desenvolvimento de patologia autoimune, nomeadamente DM1.
Diabetes mellitus tipo 2A DM2, sendo uma doença poligénica por excelência, tem mais de 40 loci genéticos referenciados. No entanto, coletivamente explicam menos de 10% do componente genético da doença17. A natureza heterogénea da DM2 e a complexidade nos seus padrões de transmissão genética limitam a identificação precisa dos genes que contribuem para a doença. Recentes estudos de associação do genoma completo «Genome-wide association study (GWAS)» têm introduzido e validado sucessivamente novos loci; curiosamente, muitos parecem associar-se mais à secreção insulínica do que à insulino-resistência18.
Atualmente, o gene transcription factor-like 2 (TCF7L2) no cromossoma 10 (10q25) constituiu o principal marcador genético associado à DM2. O TCF7L2 é um fator de transcrição envolvido na via de sinalização Wnt. O polimorfismo TCF7L2 C7903146T (genótipo CT/TT) associa-se a um aumento de aproximadamente 50% no risco de DM2 dos indivíduos portadores19.
O gene SLC30A8, localizado no cromossoma 8 (8q24.11), codifica a proteína ZnT8 que efetua o transporte de zinco para o citoplasma celular e pelos grânulos secretores de insulina nas células β pancreáticas20. Recentes estudos de associação genética têm demonstrado que os indivíduos portadores do polimorfismo rs13266634 C>T do gene SLC30A8 possuem um maior risco para o desenvolvimento de DM221.
Diabetes mellitus tipo 1, diabetes tipo 2 e diabetes autoimune diagnosticada no adulto: semelhanças genéticasVários estudos epidemiológicos revelaram uma associação positiva entre a história familiar de diabetes mellitus e o risco de aparecimento de novos casos tanto de DM1 como de DM2. Na Suécia, 32% das pessoas com diabetes tipo 1 referiram um familiar com DM2, comparativamente a 12,5% de casos no grupo de referência de não diabéticos22. Na Finlândia, 14% das famílias com mais do que um elemento diabético tipo 2 apresentaram também no seu seio uma pessoa com diabetes tipo 123. A presença de uma história familiar com DM1 e DM2 também parece aumentar a frequência de LADA. Os anticorpos anti-glutamato descarboxílase 65 (Acs anti-GAD) foram mais frequentemente identificados em pessoas com diabetes tipo 2 provenientes destas famílias (18%) do que naqueles provenientes de famílias em que apenas havia o diagnóstico de casos de DM2 (8%)23. Por outro lado, uma «predisposição genética dupla» parece induzir um fenótipo intermédio na pessoa com diabetes. Nas famílias com casos de DM1 e DM2 as pessoas com diabetes tipo 1 apresentam maior resistência à insulina24 e mais complicações cardiovasculares25, as pessoas com diabetes tipo 2 são mais magras e registam menos complicações cardiovasculares26, e as pessoas com LADA apresentam concentrações de peptídeo C inferiores26.
Estes dados sugerem que uma grande proporção de pessoas com diabetes pode ter os processos genéticos de DM1 e de DM2 a contribuir para o seu fenótipo e que a LADA poderá constituir a intersecção genética entre estas 2 entidades, sendo que:
- •
As pessoas com LADA, de forma similar ao verificado na DM1, apresentam uma maior frequência de alelos HLA de suscetibilidade, quer em comparação com as pessoas com diabetes tipo 2 (27 vs. 6,9%)6 quer com a população geral (16,9 vs. 7,3%)27. No entanto, contabilizam uma maior frequência de alelos protetores (8,1%) comparativamente às pessoas com DM1 (3,2%)6, facto justamente apontado como a possível explicação para a sua evolução mais indolente. Assim, a mediação HLA suporta simultaneamente o conceito de continuidade, com uma tendência decrescente na frequência de alelos de suscetibilidade entre os diferentes subtipos de diabetes. Segundo o estudo de Lin et al., o haplótipo DQ2 apresentou frequências de 15-21,2% na DM1, de 4,6-12,7% na LADA e de apenas 3,6% na DM2, face a uma frequência de 3,3% no grupo de controlo28.
- •
Como a insulina tem um papel central na patogénese de ambas as formas de diabetes, o seu gene tem sido considerado o candidato ideal para mediar uma suscetibilidade genética comum. As pessoas com diabetes tipo 1 são mais frequentemente homozigóticos para alelos classe I (76%) do que aquelas com diabetes tipo 2 (53%) ou a população geral (56%). As pessoas com LADA apresentam uma frequência do genótipo AA sobreponível à registada nas pessoas com diabetes tipo 18. Relativamente aos alelos classe III deste gene, apesar da controvérsia entre os diferentes estudos e de não se comprovar um excesso de homozigotia nas pessoas com diabetes tipo 2, a sua expressão parece associar-se a hiperinsulinemia em jejum, maior insulino-resistência e maior índice de massa corporal (IMC)29.
- •
Relativamente aos outros 2 principais loci não-HLA estabelecidos na DM1, as pessoas com LADA também registam uma maior frequência dos genótipos de suscetibilidade. O genótipo A/G do gene CTLA4 apresenta uma frequência similar à verificada nas pessoas com DM1 (69%)30 e os genótipos CT/TT do gene PTPN22 contabilizam uma frequência decrescente nas pessoas com DM1 (32%), LADA (29,7%), DM2 (23%) e o grupo de controlo não diabético (17,1%)31.
- •
A identificação do gene TCF7L2 como o principal gene de suscetibilidade para o desenvolvimento de DM2 possibilitou testar novas hipóteses de mediação genética. Apesar de não se verificar um aumento da frequência dos genótipos CT/TT do referido gene na DM1, as pessoas com LADA registam um aumento da sua frequência muito semelhante ao verificado naquelas com diabetes tipo 29,32. A homozigotia para este alelo é mais frequente em indivíduos mais jovens33, com menor IMC32, e condiciona uma concentração de peptídeo C inferior34.
- •
Por fim, o locus SLC30A8, incrementador de risco para o desenvolvimento de DM2 codifica a proteína ZnT8, alvo major para autoanticorpos (Acs anti-ZnT8) na DM135.
Até ao momento, tem sido a presença de autoanticorpos antigénios específicos que tem permitido distinguir a DM1 e a LADA da DM2. Aos 4 autoanticorpos – anti-ilheus de Langerhans (ICA), anti-insulina (Acs anti-insulina), anti- tirosina fosfatase (Acs anti-IA-2) e Acs anti-GAD – mais amplamente utilizados36, associaram-se recentemente os Acs anti-ZnT8. Estes últimos parecem complementar o papel dos anteriores na identificação de DM135.
Sendo que na DM1 a expressão dos marcadores de autoimunidade se vai combinando em diferentes proporções ao longo da evolução da doença, na LADA os principais anticorpos identificados são os ICA e os Acs anti-GAD, de forma isolada ou em combinação com os Acs anti-IA-2 e os Acs anti-ZnT8. Isoladamente, cada um destes 2 últimos anticorpos apresenta frequências semelhantes e pouco significativas37. Os Acs anti-insulina, que constituem um marcador específico da DM1, pela sua raridade em adultos, são aparentemente desprovidos de utilidade na LADA38. Estes doentes apresentam frequentemente positividade isolada para os Acs anti-GAD39, sendo que a sua existência é suficiente para identificar uma maior deficiência de insulina em relação à DM2. Doentes com múltiplos anticorpos identificados, ou elevados títulos de Acs anti-GAD, apresentam uma aproximação gradual às características fenotípicas da DM1 – menor idade à data do diagnóstico, menor concentração de peptídeo C, maior probabilidade de vir a necessitar de insulina4,40,41, bem como maior probabilidade de associar outros processos autoimunes42. Alguns autores defendem inclusivamente a subdivisão em LADA tipo 1 e LADA tipo 2, consoante a maior aproximação às características fenotípicas de cada subtipo de diabetes43. A frequência de genótipos HLA de suscetibilidade para DM1 também se associa com a concentração sérica dos Acs anti-GAD: frequências de 30% em casos de concentrações baixas do anticorpo, quase 50% se concentrações elevadas43.
Além de diferenças na positividade e no agrupamento dos autoanticorpos identificados, também parecem existir diferenças antigénicas especificas entre a LADA e DM1 que podem justificar as suas diferentes evoluções:
- •
Os Acs anti-GAD e Acs anti-IA-2 constituíam 60% dos autoanticorpos anti-ilheus identificados em pessoas com diabetes tipo 1, mas apenas 37,5% dos autoanticorpos naquelas com LADA. Estes dados, apresentados por Seissler et al., sugerem a existência de outros antigénios ainda não caracterizados44.
- •
A subclasse Ig4 dos Acs anti-GAD é predominante no soro das pessoas com LADA, o que condiciona uma resposta Th2 dominante em apoio a uma resposta imune mais controlada45. Esta restrição de subclasse pode ser geneticamente determinada, dependente dos antigénios que mantêm a produção dos anticorpos ou resultado de fatores regulatórios46.
- •
O processo de reconhecimento do antigénio GAD65 é diferente. Os anticorpos das pessoas com LADA apresentam uma menor ligação à porção terminal-COOH do GAD65 (65 vs. 90%) e uma maior ligação à porção terminal-NH2 (20 vs. 5%), comparativamente às pessoas com DM147.
- •
Verificou-se também, na LADA, maior reatividade a uma proteína de tirosina fosfatase 2 específica (IA-2256-760). Através da utilização de 7 partículas IA2 sintetizadas verificou-se que a especificidade deste marcador, atualmente, poderá estar a ser subestimada, através da análise dos autoanticorpos clássicos48.
Aproximadamente 50% das pessoas com diabetes tipo 1 sem autoanticorpos identificados são portadores de alelos de alto risco, alertando para a presença de autoimunidade atualmente indetetável apenas pela pesquisa de anticorpos49. Ao longo dos anos identificou-se, quer na DM1 quer na LADA, reatividade das células T a múltiplas proteínas dos ilhéus50–52. A presença de células T reativas correlaciona-se diretamente com a disfunção pancreática. Estas identificam os indivíduos com maior lesão da célula β, em comparação com a demonstração isolada da presença de autoanticorpos53. Na LADA, esta reatividade apresenta uma magnitude inferior e é mais heterogénea do que na DM1. Ambas apresentam resposta semelhante para proteínas de regiões específicas, nomeadamente na vizinhança dos 97 kDa, mas diferem na resposta a proteínas de outras regiões, espelhando assim semelhanças, mas mantêm diferenças, dos mecanismos regulatórios52.
A incapacidade dos métodos atuais na identificação de autoanticorpos afastou durante algum tempo o conceito da existência de fenómenos imunológicos na DM2. No entanto, a identificação de autorreatividade das células T em pessoas com fenótipo de DM2, sem autoanticorpos identificados (designados por T-LADA), evidenciou o papel da autoimunidade no progressivo declínio da célula β observada nestes doentes54. Estes achados permitem a utilização de novos marcadores para o diagnóstico, com a vantagem de menores flutuações individuais do que o doseamento de autoanticorpos (cuja negatividade aumenta tanto com a idade aquando do diagnóstico como posteriormente com o decorrer do tempo)49. No entanto, são ainda necessários estudos longitudinais complementares, que avaliem as repercussões destes achados com o passar do tempo, na falência da célula β ou no aparecimento de autoanticorpos54.
Integração metabólica e funcionalInsulino-resistênciaA insulino-resistência é universalmente reconhecida na patogénese da DM255, mas também parece contribuir para a história natural da DM156 e da LADA10.
Em 2001, Wilkin defendeu o conceito da insulino-resistência na patogénese DM1 ao sugerir a intervenção de 3 principais processos, denominados «aceleradores», nos diferentes subtipos de diabetes: (1) insulino-resistência, (2) autoimunidade e (3) constituição física (sobrecarga ponderal ou obesidade)57. Esta teoria, reconhecida como «hipótese do acelerador», representou uma perspetiva inovadora na compreensão da evolução da diabetes mellitus, mas despoletou uma grande controvérsia na comunidade científica.
Até ao momento não existem dados que comprovem o papel de acelerador da insulino-resistência na apoptose das células β ou no desenvolvimento de autoimunidade58. A resistência à insulina funciona apenas como uma covariável, que acelera o desenvolvimento da doença em indivíduos geneticamente predispostos e incapazes de acompanhar o aumento das necessidades de insulina, por apresentarem a função das células β comprometida (no caso da DM1 por um processo autoimune)56.
Chiu et al. verificaram, pelo modelo homeostático de medição de resistência à insulina (HOMA-IR) ajustado ao IMC, que as pessoas com LADA apresentavam valores de insulino-resistência significativamente superiores aos do grupo de controlo não diabético e comparáveis aos das pessoas com diabetes tipo 2. Uma vez que as pessoas com LADA frequentemente são obesas, a interação da insulino-resistência (característica da DM2) com a lesão autoimune da célula β (característica da DM1) poderá determinar a sua progressão clínica. Este estudo inferiu ainda que as pessoas com LADA apresentavam um risco semelhante ao das pessoas com diabetes tipo 2 para o desenvolvimento de comorbilidades associadas à insulino-resistência (dislipidemia, disfunção endotelial, hipertensão, coagulopatia e aterosclerose)10. Este é um tema controverso, existindo trabalhos recentes que mostram que a frequência de síndroma metabólica em doentes com LADA (37,3%) é superior à apresentada por pessoas com DM1 (15,5%) e inferior à apresentada por pessoas com DM2 (67,2%)59.
Disfunção da célula βNa DM1, a falência pancreática está predominantemente dependente de fenómenos autoimunes, que induzem perda celular e consequente dependência de insulina exógena. Na altura do diagnóstico existe uma redução de 70-80% na massa de células β. A ausência de simultaneidade de fenómenos de necrose e a presença de graus variados de insulite sugerem que esta perda celular é lenta e progressiva ao longo dos anos60.
Na DM2, o controlo do metabolismo glicémico depende tanto do número total de células β como da sua capacidade secretora55. Inicialmente, para compensar uma insulino-resistência constante, verifica-se um aumento tanto da produção e secreção de insulina como do número total de células β. Posteriormente, este mecanismo compensatório falha, promovendo o despoletar e a progressão da doença61. São vários os condicionantes de disfunção da célula β, entre os quais o declínio fisiológico decorrente do envelhecimento, a carga genética individual, o grau de insulino-resistência, a acumulação pancreática de peptídeo amiloide, o desenvolvimento de anomalias do eixo das incretinas, um aumento do stress oxidativo com acumulação de espécies reativas de oxigénio e um aumento da concentração sérica de glicose e ácidos gordos livres55. Alguns destes mecanismos, particularmente o ciclo vicioso induzido pela «glicolipotoxicidade», não só se correlacionam negativamente com a secreção de insulina como parecem induzir a apoptose celular62. Os estudos anatomopatológicos iniciais verificaram uma redução de 25-50% na massa de células β na altura do diagnóstico de DM255,60. No entanto, quando ajustada ao IMC, essa redução é significativamente maior, com índices apoptóticos 3 vezes superiores63.
Desta forma, a apoptose das células β é um processo transversal nos diferentes subtipos de diabetes. Muitos fatores envolvidos em processos específicos da DM1 também medeiam a lesão celular despoletada na DM2: IL-1β, Fas, fator nuclear-κβ, stress do reticulo endoplasmático e aumento da expressão de c-Myc64. Os mediadores inflamatórios inerentes à DM1 (inflamação crónica dos ilhéus) e à DM2 (inflamação sistémica) parecem combinar-se numa via final comum resultando na falência da célula β.
Na LADA a disfunção da célula β tem sido reportada como intermédia entre os 2 principais subtipos de diabetes. As pessoas com LADA apresentam um maior declínio dos níveis de peptídeo C face às pessoas com diabetes tipo 2, mas menor que o reportado nos casos de DM165.
ConclusãoAs pessoas com diabetes tipo 1 e tipo 2 concentram-se nas mesmas famílias. O perfil genético condiciona o percurso evolutivo das diferentes formas de diabetes. A mediação HLA suporta o conceito de continuidade, no entanto, múltiplos genes parecem prestar uma importante contribuição. A LADA, numa espécie de «intersecção genética», partilha características tanto com a DM1 (genes HLA, INS, PTPN22 e CTL4A) como com a DM2 (gene TCF7L2), sendo que variantes alélicas do mesmo gene poderão mesmo contribuir para o desenvolvimento de ambos os subtipos de diabetes (genes INS e SLC30A8). Esta herança modula o fenótipo do doente, aumentando a positividade para autoanticorpos e prejudicando a secreção de insulina.
Neste aspeto, a LADA assemelha-se à DM1 ou à DM2, de acordo com número e concentração dos autoanticorpos identificados. Além de humoral, também se verificam processos de autorreatividade celular tanto na DM1 e na LADA, como na DM2, evidenciando a importância de redefinir conceitos e reconhecer o contributo de fenómenos imunes para a falência da célula β nas pessoas com diabetes tipo 2.
Os processos autoimunes podem assumir diversas formas, em diferentes indivíduos, com diferentes cargas genéticas, e podem mesmo coexistir com outros processos de doença, nomeadamente com insulino-resistência11. Esta associa-se a uma progressão mais rápida da DM1 e contribui para o aparecimento da LADA. Quando ajustados ao IMC, os índices de insulino-resistência nas pessoas com LADA e com DM2 são sobreponíveis. Por fim, tanto na DM1 como na DM2 ocorre perda funcional e estrutural das células β. Fenómenos genéticos, imunológicos e metabólicos parecem convergir em mecanismos moleculares comuns condicionando a apoptose da célula β.
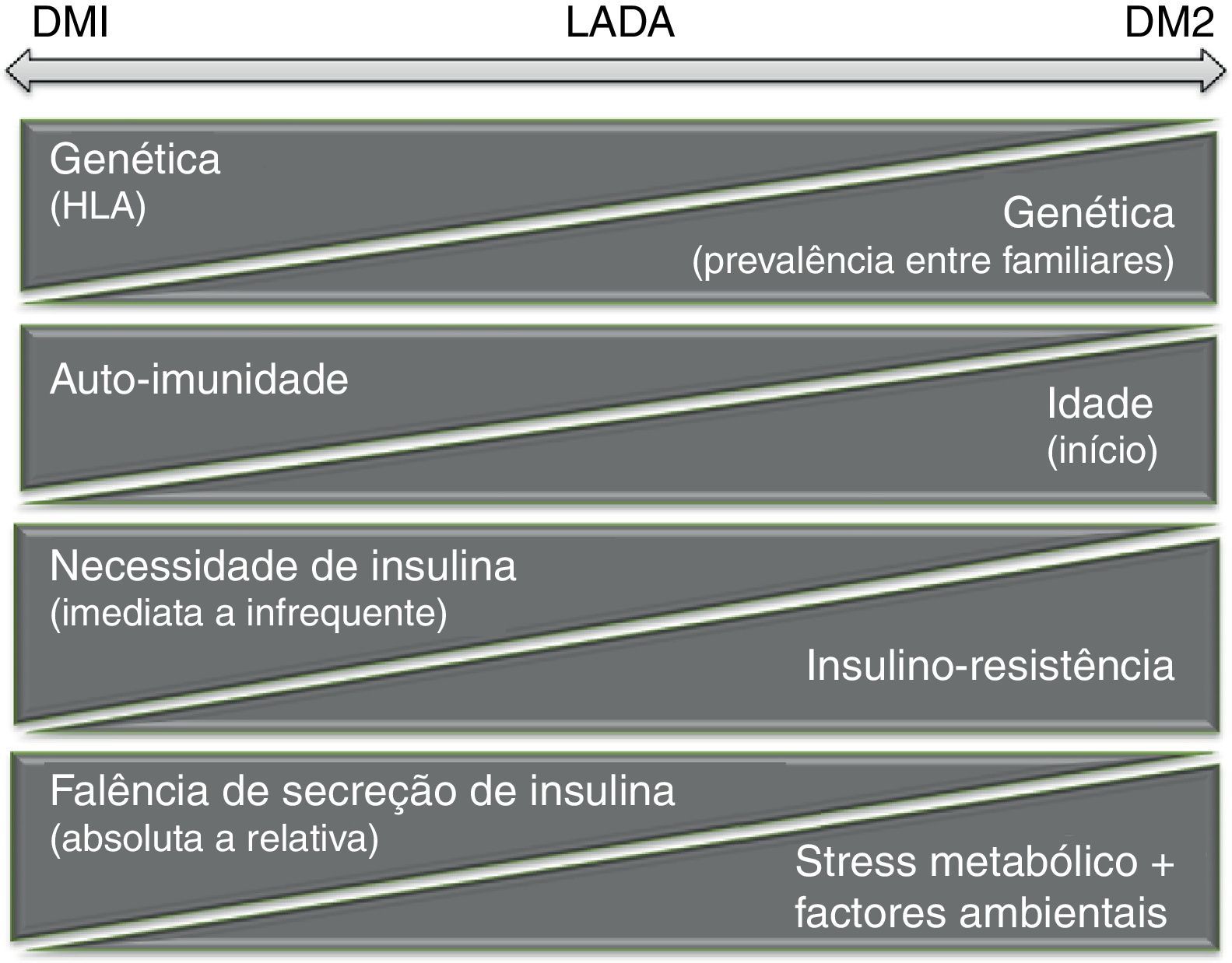
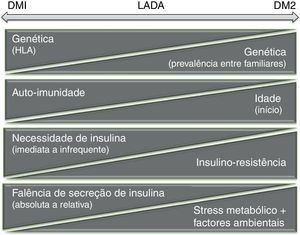
Segundo os autores, a hipótese de um «continuum» fisiopatológico fundamenta-se no princípio de que para o desenvolvimento de diabetes mellitus num determinado indivíduo, é necessária a interação de fatores desencadeantes (p. ex. obesidade) com a sua base individual de suscetibilidade (p. ex. determinantes genéticos). É do tipo de desequilíbrio criado que resulta o aparecimento de manifestações fenotipicamente distintas, aproximando-se mais de um ou do outro extremo do espetro da doença (fig. 1). Dada a sobreposição dos mecanismos fisiopatológicos descritos, a designação de LADA, como entidade isolada, poderá vir a ser retirada.
Para o clínico e para o doente é menos importante classificar o subtipo de diabetes do que entender a patogénese da hiperglicemia e tratá-la efetivamente2. Uma compreensão holística da fisiopatologia da doença em cada doente permite uma abordagem mais dirigida e eficaz, bem como um melhor acompanhamento do seu percurso evolutivo.
Conflito de interessesOs autores declaram não haver conflito de interesses.