Os sobreviventes oncológicos são frequentemente confrontados com disfunção reprodutiva.
Sexo masculino, 30 anos, referenciado por infertilidade e com antecedentes de leucemia linfoblástica aguda B, em remissão, tratada com quimioterapia e transplante de medula óssea há 10 anos. Clinicamente sem queixas, com função sexual e volume testicular normais. Analiticamente, constatou‐se FSH elevada, com testosterona total e livre normal. O espermograma revelou azoospermia, provavelmente iatrogénica. Em consulta de infertilidade, foi realizado cariótipo – 46XX e pesquisa de microdeleções do cromossoma Y – ausência das sequências do cromossoma Y importantes para a gametogénese. A razão destes achados tornou‐se óbvia após revisão do caso: a dadora de medula óssea foi a irmã e, como tal, os leucócitos de sangue periférico são 46XX. A existência de cromossoma X e Y nas células da mucosa bucal do doente confirmou esta hipótese.
Este caso ilustra alguns desafios diagnósticos e problemas no âmbito da fertilidade em sobreviventes oncológicos.
Cancer survivors have frequently reproductive dysfunction.
A 30‐year‐old man was referred because of infertility. His medical past was remarkable for acute lymphoblastic leukemia B nowadays in remission, treated with chemotherapy and bone marrow transplantation 10‐years ago. He had no clinical complaints, his sexual function and testicular volume were normal. Biochemically, it was seen an elevation of FSH, with normal measurements of total and free testosterone. The spermogram revealed azoospermia. Infertility expert requested karyotype which was 46XX and the search for chromosome Y microdelections confirmed absence of Y‐sequences relevant for spermatogenesis. The reason for that became clear after revision of the case: the donor of the bone marrow was his sister, and for that reason his peripheral leukocytes were 46XX. Later, the existence of X and Y chromosomes in the buccal mucosa of our patient confirmed this hypothesis.
This case illustrate some diagnostic challenges and problems regarding fertility in cancer survivors.
O tratamento das doenças oncológicas tem avançado nas últimas décadas. O número crescente de sobreviventes oncológicos tem suscitado interesse em aspetos relacionados com a qualidade de vida e complicações crónicas da doença, ou do seu tratamento1.
A infertilidade é uma das consequências mais comuns e devastadoras, e depende do tipo de doença/tratamento1 (tabela 1). A prevalência de disfunção reprodutiva em sobreviventes de neoplasias hematológicas pode atingir 70‐100% e condiciona reduzidas taxas de parentalidade (3‐8%)1. A quimioterapia (QT) ou radioterapia (RT), mesmo em baixas doses, podem lesar o epitélio seminífero e afetar a espermatogénese. Por outro lado, 15% das neoplasias no sexo masculino ocorrem antes dos 55 anos2. Assim, a fertilidade deve merecer especial atenção em doentes oncológicos.
Níveis de risco de subfertilidade/infertilidade, de acordo com o diagnóstico e/ou tratamentos oncológicos
| Baixo risco de infertilidade (<20%) |
| Leucemia linfoblástica aguda |
| Tumor Wilms |
| Sarcoma (estádio 1) |
| Tumores de células germinativas (não submetidos a RT) |
| Retinoblastoma |
| Tumores do sistema nervoso central (RT<24Gy) |
| Moderado risco de infertilidade |
| Leucemia mieloblástica aguda |
| Hepatoblastoma |
| Osteosarcoma |
| Sarcoma de Ewing não‐metastático |
| Sarcoma (estádios 2 e 3) |
| Neuroblastoma |
| Linfomas não‐Hodgkin |
| Tumores do sistema nervoso central (RT>24Gy) |
| Alto risco de infertilidade (>80%) |
| Irradiação corporal total |
| RT localizada à região pélvica/testículo |
| QT de condicionamento pré‐transplante de medula óssea |
| QT com agentes alquilantes |
| Linfoma de Hodgkin |
| Sarcoma (estádio 4) |
| Sarcoma de Ewing metastático |
Reporta‐se um caso clínico que ilustra alguns desafios no diagnóstico/manuseamento da infertilidade em sobreviventes oncológicos.
Descrição do casoDoente do sexo masculino, 30 anos, caucasiano, referenciado por infertilidade primária. Clinicamente sem queixas, com função sexual, distribuição pilosa, pénis e volume testicular normais. Sem história familiar de infertilidade. Dos antecedentes pessoais, destacava‐se o diagnóstico de leucemia linfoblástica aguda B (LLA‐B) há 10 anos, tratada com QT (ciclofosfamida, daunorrubicina, vincristina e prednisolona) e transplante de medula óssea (TMO), com pré‐condicionamento com ciclofosfamida, citarabina e irradiação corporal total (ICT). Desde então, em remissão completa.
A avaliação hormonal revelou FSH e LH elevadas (25,6mU/mL [<11] e 11,6mU/mL [<6], respetivamente), com testosterona total e livre normais (683,9ng/dL [250‐900] e 18,0pg/mL [9‐27], respetivamente). O estradiol estava ligeiramente elevado (63,6pg/mL [<55]); prolactina, TSH, T4 livre, IGF‐1, ACTH e cortisol sérico dentro dos valores de referência. Dos restantes parâmetros laboratoriais, verificou‐se apenas elevação da creatinina (1,7mg/dL [0,9‐1,3]). O espermograma revelou azoospermia, provavelmente iatrogénica (QT e ICT).
Atendendo à vontade reprodutiva foi encaminhado para consulta de infertilidade, tendo realizado cariótipo de sangue periférico: 46XX‐normal para indivíduo do sexo feminino. Ausência de anomalias cromossómicas, bem como inexistência do gene SRY (gene determinante sexual). A pesquisa de microdeleções AZF/cromossoma Y evidenciou ausência das sequências do cromossoma Y importantes para a gametogénese, incluindo o gene SRY, constando no relatório que a determinação testicular pode ocorrer na ausência do gene SRY, tratando‐se de uma ocorrência rara; os indivíduos afetados têm gónadas masculinas desprovidas de células germinativas, desaconselhando a realização de biópsia testicular, para colher espermatozoides para técnicas de procriação medicamente assistida.
Colocou‐se, então, a hipótese da infertilidade poder estar relacionada com disfunção genética da determinação sexual. A revisão do caso esclareceu os referidos achados: a dadora de medula óssea foi a sua irmã e, como tal, os leucócitos do doente eram 46XX. Para confirmar esta hipótese, procedeu‐se a análise por FISH de células da mucosa bucal do doente que revelou 100% dos núcleos com cromossoma X e Y, correspondendo a indivíduo masculino.
ComentárioA disfunção gonádica e subfertilidade são complicações frequentes em sobreviventes oncológicos. Os principais mecanismos de infertilidade masculina são: hipogonadismo primário, como resultado do dano testicular induzido pelos efeitos citotóxicos da QT/RT, ou hipogonadismo secundário, devido a disfunção hipotálamo‐hipofisária quando o sistema nervoso central é irradiado3. O epitélio germinativo e as células de Sertoli são mais suscetíveis à lesão citotóxica do que as células de Leydig, produtoras de testosterona, sendo a infertilidade mais frequente do que a carência de testosterona4, como verificado no nosso doente. A perda de células germinativas associa‐se a FSH elevada, devido à diminuição da secreção de inibina B pelas células de Sertoli.5
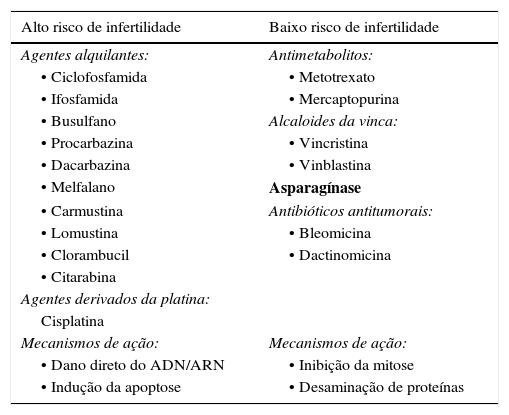
Muitos fármacos citotóxicos penetram a barreira constituída pelas células de Sertoli e danificam as células germinativas, especialmente as espermatogónias que têm maior atividade proliferativa2. Os agentes alquilantes, como a ciclofosfamida, são os fármacos que acarretam maior risco de infertilidade, embora outros estejam identificados2,3,6 (tabela 2).
Agentes quimioterápicos gonadotóxicos
| Alto risco de infertilidade | Baixo risco de infertilidade |
|---|---|
| Agentes alquilantes: | Antimetabolitos: |
| • Ciclofosfamida | • Metotrexato |
| • Ifosfamida | • Mercaptopurina |
| • Busulfano | Alcaloides da vinca: |
| • Procarbazina | • Vincristina |
| • Dacarbazina | • Vinblastina |
| • Melfalano | Asparagínase |
| • Carmustina | Antibióticos antitumorais: |
| • Lomustina | • Bleomicina |
| • Clorambucil | • Dactinomicina |
| • Citarabina | |
| Agentes derivados da platina: | |
| Cisplatina | |
| Mecanismos de ação: | Mecanismos de ação: |
| • Dano direto do ADN/ARN | • Inibição da mitose |
| • Indução da apoptose | • Desaminação de proteínas |
Múltiplas variáveis influenciam a gonadotoxicidade causada pela RT: tipo de irradiação, dose, fracionamento, duração, idade do doente, suscetibilidade individual7. Doses muito baixas, na ordem dos 0,15Gy, podem causar oligospermia8. Azoospermia reversível pode ocorrer para doses entre 0,35‐0,5Gy. Doses ≥1,2Gy minimizam a recuperação da espermatogénese, podendo condicionar azoospermia permanente, que ocorre sempre para doses>2,5Gy. As células de Leydig são lesadas com doses a partir de 15Gy2,7,8.
O tratamento das neoplasias hematológicas pressupõe frequentemente TMO, cujo condicionamento envolve doses altas de agentes alquilantes e ICT. Durante a ICT, o testículo é irradiado com aproximadamente 1,2Gy9. Nos doentes condicionados com ciclofosfamida +ICT, a recuperação da espermatogénese ocorre em 17% e nunca antes do quarto ano; recuperações tardias (até 9 anos pós‐TMO) estão descritas. A incidência de azoospermia nestes casos é de 70,3%10. A recuperação da espermatogénese depende essencialmente da sobrevivência das espermatogónias6,11. No presente caso, a azoospermia verificada 10 anos pós‐TMO, foi assumida como definitiva e iatrogénica, atendendo à gonadotoxicidade dos tratamentos utilizados (ICT; ciclofosfamida; citarabina; vincristina; metotrexato).
Em homens com cancro, a criopreservação de gâmetas deve ser oferecida previamente aos tratamentos que acarretem risco de infertilidade2. Tal não aconteceu com o nosso doente, que se viu forçado mais tarde a recorrer a gâmetas de dador.
A elevada frequência de anomalias genéticas em homens oligo/azoospérmicos (10‐15%) justifica a investigação genética de oligo/azoospermia12. Os doentes hemato‐oncológicos apresentam frequentemente anomalias cromossómicas que lhes conferem suscetibilidade para a doença e, eventualmente, para infertilidade genética. Estão descritos 2 doentes hemato‐oncológicos 46XX e fenotipicamente homens13,14. Este distúrbio da diferenciação sexual designa‐se como XX male syndrome13,15 (tabela 3) e constituiu diagnóstico diferencial perante o cariótipo do nosso doente.
«XX male syndrome»
| XX male syndrome |
| Condição clínica caracterizada pela presença de um cariótipo 46XX, com fenótipo e genitália interna e externa masculina, mas com presença de azoospermia (devido à ausência do braço longo do cromossoma Y) |
| Incidência |
| 1/20.000 |
| Mecanismos patogénicos |
| 1) Translocações anormais X‐Y (90%) |
| troca de porções distais dos braços curtos dos cromossomas X e Y durante a meiose paterna |
| o gene SRY fica incluído no genótipo destes doentes, definindo a formação testicular e o fenótipo masculino (homens XX, SRY+) |
| 2) Mosaicismo |
| 3) Envolvimento de outros genes «não‐definidores» do testículo |
| ausência total do cromossoma Y, bem como de todas as suas sequências (homens XX, SRY‐) |
| defeito genético pressupõe essencialmente: |
| a) mutações inativadoras de genes promotores de diferenciação ovárica: WNT4, RSPO1, FOXL2 |
| b) mutações ativadoras de genes intermediários na diferenciação testicular, independentemente da existência do gene SRY: SOX3, SOX9, SOX10 |
| Clínica |
| Heterogeneidade fenotípica |
| A maioria dos doentes apresenta genitália externa e interna masculina, podendo desenvolver ginecomastia (30%), hipogonadismo e infertilidade (sempre) após a puberdade |
| Análises hormonais têm mostrado níveis normais de testosterona durante a puberdade, que podem diminuir durante o estado adulto; em alguns casos, pode haver evolução para hipogonadismo hipergonadotrófico |
| Diagnóstico |
| Avaliação clínica, análises hormonais, cariótipo e pesquisa do gene SRY |
A extração de ADN genómico para estudos genéticos é efetuada habitualmente a partir de leucócitos de sangue periférico. Em doentes submetidos a TMO alogénicos, os leucócitos circulantes passam a ter origem nas células hematopoiéticas estaminais dos dadores, transportando a sua carga genética. Assim, quando se procede a um estudo genético em doente transplantado, o ADN deve‐se extrair sempre de amostras celulares do próprio12. Este aspeto é muito importante, pois obvia diagnósticos erróneos, medidas diagnostico‐terapêuticas fúteis e situações psicossociais complexas. Neste caso, a discordância fenótipo‐genótipo facilitou a interpretação da situação; caso o dador fosse do sexo masculino, provavelmente teriam sido empregues procedimentos diagnósticos/terapêuticos desapropriados, como a biópsia testicular.
Este caso ilustra alguns desafios e alerta para alguns aspetos no âmbito da infertilidade masculina em sobreviventes de doença hemato‐oncológica.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.