É geralmente aceite que a ingestão excessiva de alimentos de elevada palatibilidade, geralmente ricos em açúcar e em gordura, exerce fortes influências no sistema de recompensa cerebral. No entanto, continua a ser debatido se a sua ingestão pode levar a sintomas de dependência. Existe evidência crescente de paralelismos neurobiológicos e clínicos entre indivíduos obesos e dependentes e, apesar de existirem também distinções relevantes entre as duas patologias, o fenótipo de dependência alimentar parece desempenhar um papel importante na etiopatologia da obesidade e do Binge Eating Disorder (BED). Considerar um modelo de dependência alimentar para os pacientes com BED e para alguns indivíduos com obesidade, pode contribuir para novas perspetivas de intervenção farmacológica e de intervenções terapêuticas que visem a aprendizagem efetiva de estratégias para controlar a hiperingestão a longo termo.
It is widly accepeted that overeating of palatable foods can have powerful effects on brain reward systems. However, it is still debated whether their excessive intake can produce symptoms of dependence such as those seen in drug addiction. There is increasing evidence of neurobiological and clinical underpinnings of obesity and and drug addiction, and although there are still relevant differences between the two disorders, the food addiction phenothype seems to have an important role in obesity and Binge Eating Disorder (BED). To consider a food addiction framework for patients with BED and, at least, for some obese individuals, may contribute to new pharmacological interventions as well as behavioral therapies aiming the long‐term control of overeating.
Estima‐se que a nível mundial 1,5 mil milhões de adultos tenham pré‐obesidade (indice de massa corporal – IMC – entre 25,0‐29,9Kg/m2) ou obesidade (IMC ≥30Kg/m2)1, contribuindo para o aumento da morbilidade (diabetes, hipertensão arterial, doença coronária, dislipidemia, patologia biliar, e cancro)2 e mortalidade, bem como para um elevado burden económico3,4. Em Portugal, considerando os estudos mais recentes de prevalência desta patologia entre adultos (18‐64 anos de idade) verificou‐se um aumento de 15 para 19,9% para homens, e de 13,4 para 19,8% para mulheres5,6.
A definição clássica de obesidade traduz‐se num fenótipo resultante de ingestão alimentar excessiva que, combinada com sedentarismo, favorece um balanço energético positivo e, consequentemente, o aumento ponderal. Este desequilíbrio entre a energia ingerida e despendida pode ser revertido através da restrição energética e exercício. No entanto, a efetividade a médio ou longo prazo das intervenções com objetivo de redução do peso baseadas neste pressuposto demonstraram que a obesidade é uma patologia determinada, e mantida, por mecanismos bastante mais complexos. Existe evidência quanto ao envolvimento de circuitos neurais implicados na regulação do apetite e na etiopatologia da obesidade, sugerindo que esta doença deve ser considerada no espectro das patologias neuropsicológicas7.
A obesidade é determinada por complexas interações entre fatores genéticos e ambientais, mediados em grande parte por sistemas neurais e hormonais8. Entre os fatores ambientais destacam‐se alterações dramáticas no ambiente alimentar, nomeadamente a ampla disponibilidade de alimentos com teores elevados de açúcar e de gordura, de grande palatibilidade, elevada conveniência e de baixo custo, muito frequentemente providenciados em porções desadequadas9.
A ingestão alimentar excessiva desempenha um papel fundamental na obesidade e resulta, pelo menos em parte, da experiência de prazer que está associada à ingestão de alimentos de elevada palatibilidade10. Alimentos de elevada palatibilidade, ricos em açúcar e em gordura, ativam circuitos de recompensa do sistema nervoso central, através de mecanismos orais e pós‐orais11,12, contribuindo para o aumento da sua ingestão13.
Para além de estar implicado no prazer desencadeado por recompensas naturais como a comida, o sistema de recompensa cerebral constitui a base neural para os fenómenos relacionados com a dependência. Ou seja, as drogas de adição atuam nos mesmos mecanismos neurais que modulam a motivação para procurar e obter alimentos14. A dopamina (DA) em particular, sendo um neurotransmissor chave da dependência, desempenha um papel extremamente relevante na regulação da ingestão alimentar e nos efeitos de reforço dos alimentos. O sistema dopaminérgico, através de vias de recompensa mesolímbicas (que regulam mecanismos de percepção de recompensa e emoções), mesoestriatais (envolvidas na formação de comportamentos habituais) e vias mesocorticais (relacionadas com a função executiva) constitui um substrato comum na neurobiologia de perturbações da adição e de procura de alimentos de elevada palatibilidade 15.
Existe evidência crescente de que a disrupção da homeostase energética pode afetar o circuito de recompensa cerebral e que a hiperingestão de alimentos de elevada palatibilidade pode levar a alterações neste sistema, resultando num padrão de ingestão compulsiva com características semelhantes às do fenótipo de dependência14. A investigação nesta área tem produzido evidências que realçam as semelhanças neurais e comportamentais subjacentes à dependência e a alguns fenótipos de obesidade13,14,16.
A Yale Food Addiction Scale (YFAS)17 é o instrumento mais utilizado para avaliar a dependência alimentar18–26. Esta escala aplica os sete critérios de dependência de substâncias do Diagnostic and Statistical Manual Fourth Edition,Text Revision (DSM‐IV‐TR)27 [tabela 1] ao comportamento alimentar, permitindo identificar indivíduos que exibem sintomas de dependência relativamente a alimentos ricos em açúcar e/ou gordura (e, portanto, de elevada palatibilidade).
Critérios de diagnóstico de dependência de substâncias definidos pelo DSM‐IV‐TR
| 1. Tolerância, definida por um dos seguintes critérios:a. Necessidade de quantidades marcadamente aumentadas de substâncias para atingir intoxicação ou o efeito desejado.b. Efeito marcadamente diminuído com o uso contínuo da mesma quantidade da substância. |
| 2. Abstinência, manifestada por um dos seguintes critérios:a. Síndrome de abstinência característica da substânciab. A mesma substância (ou outra semelhante) é usada para aliviar ou evitar sintomas de abstinência |
| 3. A substância é frequentemente usada em grandes quantidades, ou durante um período de tempo superior ao pretendido |
| 4. Desejo persistente ou esforço mal sucedido para diminuir ou controlar o uso da substância. |
| 5. Grandes períodos de tempo despendidos em atividades necessárias para obter a substância, usá‐la ou recuperar‐se dos seus efeitos. |
| 6. Redução ou abandono de atividades sociais, recreativas ou ocupacionais devido ao uso da substância. |
| 7. Uso continuado da substância, apesar da consciência de que o mesmo está a causar ou a agravar um problema físico ou psicológico persistente/recorrente. |
Esta revisão narrativa apresenta as principais semelhanças genéticas, neurobiológicas e clínicas entre a obesidade e a dependência. Serão ainda apresentadas as evidências mais recentes de dependência alimentar em humanos.
Evidência relativa a bases genéticos comunsNa última década, vários estudos demonstraram que o alelo Taq I A1 do gene que codifica o recetor D2 de DA (D2R DA) está associado tanto com a dependência, nomeadamente com o alcoolismo, abuso de drogas, tabagismo e jogo compulsivo, como com a obesidade28,29. De forma semelhante, mutações no gene do recetor de canabinóides de tipo 1 (envolvidos em vias homeostáticas e de recompensa) estão relacionadas com o risco de obesidade30 e com a dependência31. Por outro lado, o polimorfismo A118G no OPRM1 (gene do recetor μ‐opióide) tem sido associado com maior vulnerabilidade para o Binge Eating Disorder (BED)32 e para o alcoolismo33.
Evidência relativa a bases neurobiológicas comunsPara além dos aspectos etiogenéticos em comum, verificam‐se também semelhanças ao nível de estruturas cerebrais e do perfil bioquímico de indivíduos dependentes e de indivíduos obesos, existindo paralelismos em circuitos neurais relacionados com o processamento da recompensa, tomada de decisões, aprendizagem e memória, entre indivíduos com estas patologias16,34,35.
De facto, algumas alterações no sistema dopaminérgico mesolímbico estão diretamente associadas com a dependência e com a obesidade. Tanto indivíduos dependentes de cocaína36, metanfetaminas37, álcool38 ou heroína39, como indivíduos com obesidade severa (IMC>40kg/m2)40 apresentam reduções significativas do D2R DA estriado (relativamente a controlos saudáveis normoponderais e sem dependências). Adicionalmente, tanto em indivíduos dependentes como em obesos mórbidos verificou‐se que a baixa disponibilidade de D2R DA estava associada ao hipometabolismo do córtex orbito‐frontal (COF), giro cingulado (GC) e do córtex pré‐frontal dorsolateral (CPFDL)36,37,40,41. Como estas estruturas estão envolvidas no controlo inibitório42 e no processamento de emoções43, foi sugerido que a sua regulação, alterada em indivíduos dependentes e em indivíduos obesos, podia estar na base da perda de controlo durante o consumo (de drogas ou alimentos, respetivamente) e da sua baixa autorregulação emocional. De facto, existe evidência de défice na função executiva (FE; conjunto de capacidades cognitivas de formulação e planeamento de objetivos, visando a sua execução de forma eficaz), tanto em indivíduos dependentes44–46, como em obesos47–49. Por exemplo, verificou‐se que indivíduos obesos apresentavam dificuldade pronunciada na tomada de decisões, medida através da Iowa gambling task (teste neuropsicológico de FE, desenhado para simular tomadas de decisões reais e de aprendizagem em termos de reforço/punição)50,51.
Tendo em conta que a disponibilidade (quer em termos de quantidade quer de variedade) de alimentos disponíveis aumenta a probabilidade da sua ingestão52, a capacidade individual de inibir as respostas aos estímulos dos alimentos poderá modular o seu risco de hiperingestão no ambiente obesogénico atual13,53. Desta forma, a associação com o metabolismo pré‐frontal sugere que a diminuição dos recetores D2 em obesos pode contribuir para a hiperingestão, em parte através da desregulação de regiões implicadas no controlo inibitório e na regulação emocional.
A dependência é, cada vez mais, vista como o resultado final de uma série de transições desde o consumo inicial de substâncias aditivas, em que estas são consumidas voluntariamente pelos seus efeitos de reforço, até à perda de controlo sobre este comportamento que acaba por se tornar habitual, contribuindo para a compulsão. Evidências empíricas indicam que, quando os comportamentos são sustentados por hábitos, são automaticamente desencadeados pela presença de estímulos ou de estados motivacionais internos54. Tem sido sugerido que os comportamentos “habituais” são mantidos devido a uma “eficiência mental” que se caracteriza pela velocidade e facilidade com que os padrões de comportamento adquiridos ou “habituais” podem ser iniciados e executados, e pela automaticidade, ou seja, a não consciência de se estar a desempenhar o comportamento54. Estas adaptações parecem estar relacionadas com a DA, nomeadamente com o seu papel na memória e na aprendizagem que, por sua vez, se relaciona com a dependência e com a obesidade55.
Os efeitos das drogas nos sistemas de memória sugerem que estímulos neutros podem adquirir propriedades de reforço através da aprendizagem condicionada. Quando estímulos neutros são emparelhados com drogas, após associações repetidas, adquirem a capacidade de aumentar a DA no núcleo accunbens (NAc) e no estriato dorsal (tornando‐se assim estímulos condicionados)55,56. Também relativamente à ingestão alimentar, o papel da DA não se resume à modulação da recompensa, estando envolvida no condicionamento de estímulos que aumentam a motivação para a ingestão13. Tem sido proposto que, com a exposição repetida a alimentos de elevada palatibilidade, a resposta dopaminérgica sofre habituação, sendo gradualmente transferida para os estímulos associados com a recompensa alimentar (ex., o aroma da comida), que passam a ser processados como preditores de recompensa. Ou seja, tornam‐se estímulos condicionados57. Em modelos animais, a apresentação de estímulos neutros, condicionados com sacarose, levaram ao aumento da DA estriada e este aumento relacionou‐se com o comportamento necessário para obter mais sacarose. Quando os mesmos estímulos eram apresentados a ratos que não tinham sido treinados com este emparelhamento, não se verificou o mesmo aumento na libertação de DA, sugerindo que nos ratos treinados desenvolveu‐se a associação entre os estímulos e a disponibilidade de sacarose58. Tendo em conta estas evidências, foi sugerido que, em humanos, os estímulos alimentares aumentariam a DA extracelular estriada e que este aumento será preditor da motivação para a obtenção de alimentos. Com recurso a tomografia por emissão de positrões (PET), indivíduos saudáveis em jejum foram expostos a estímulos neutros ou a estímulos condicionados (associados a alimentos). Para amplificar as alterações na DA, foi administrado aos sujeitos metilfenidato (MFD) (20mg por via oral), de forma a bloquear os transportadores de DA (o principal mecanismo de remoção da DA extracelular). Verificou‐se que os estímulos condicionados aumentaram significativamente a DA estriada, relativamente aos estímulos neutros, e que este aumento se correlacionou com aumento da fome e de desejo por alimentos (auto relatados)59. Em comparação com indivíduos normoponderais, indivíduos obesos expostos a imagens de alimentos hiperenergéticos mostraram maior ativação neural de regiões cerebrais dos circuitos de recompensa (NAc, COF, amígdala, hipocampo e ínsula)60. No entanto, a ingestão propriamente dita deste tipo de alimentos, levou a menor ativação dos circuitos de recompensa em obesos, relativamente aos indivíduos normoponderais. Por outro lado, nos indivíduos obesos verificou‐se maior ativação de regiões corticais somatosensoriais, responsáveis, pelo menos em parte, pelo processamento da palatibilidade61. A atividade aumentada de regiões que processam a palatibilidade em indivíduos obesos pode contribuir para que estes favoreçam a comida em detrimento de outros reforços naturais. Por outro lado, a ativação dopaminérgica diminuída durante a ingestão alimentar propriamente dita pode levar à hiperingestão57.
Este conjunto de evidências sugere que na obesidade há um aumento da sensibilidade do circuito de recompensa a estímulos condicionados (perceção, nomeadamente visual ou olfativa, de alimentos hiperenergéticos de elevada palatibilidade que predizem a recompensa) e, simultaneamente, uma diminuição da sensibilidade das vias dopaminérgicas à recompensa da ingestão propriamente dita. Assumindo que há um desajuste entre a recompensa esperada e a recompensa efetivamente obtida (que não corresponde à expetativa), a hiperingestão funcionará como uma tentativa de alcançar o nível de recompensa ambicionado. No entanto, esta hipótese carece ainda de evidência, nomeadamente em humanos42.
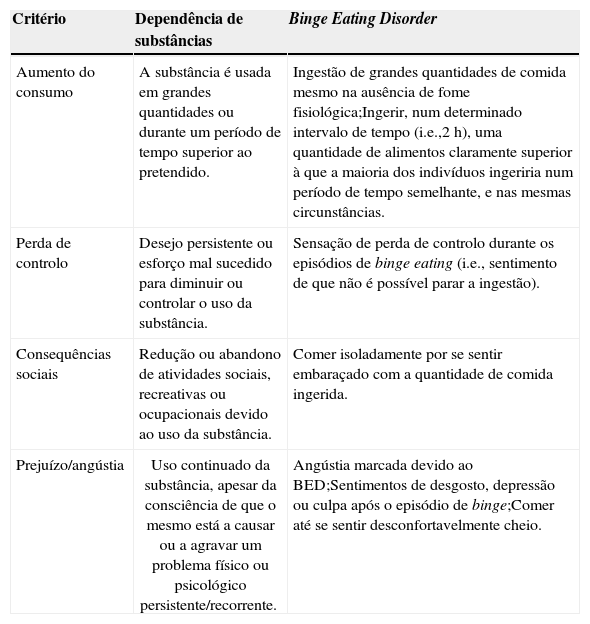
Evidência relativa a aspetos clínicos comunsAo atribuir à hiperingestão a conotação de comportamento aditivo, não é de todo apropriado abranger todos os casos de obesidade. Por outro lado, o BED (perturbação de ingestão alimentar compulsiva, com episódios de voracidade alimentar compulsiva) é uma patologia particularmente adequada a esta conceptualização10, tendo em conta que é definida por critérios que vão de encontro aos utilizados pelo DSM‐V62 para estabelecer o diagnóstico de dependência de substâncias (tabela 2). Mais especificamente, tanto a dependência de substâncias como o BED estão associados à perda de controlo sobre o consumo (de drogas ou alimentos, respetivamente), à dificuldade em diminuir a quantidade ou a frequência do uso da substância e são marcados pelo consumo continuado apesar da percepção (pelo próprio ou por outros significantes) de consequências negativas, tais como, problemas físicos ou emocionais. Para além disto, tanto os indivíduos dependentes como os indivíduos com BED são frequentemente mal sucedidos nas tentativas de parar ou reduzir o consumo57,63. Estes comportamentos são geralmente acompanhados de sentimentos de culpa e angústia27,57.
Comparação das definições de dependência de substâncias e de binge eating disorder (adaptadas do DSM‐V)
| Critério | Dependência de substâncias | Binge Eating Disorder |
|---|---|---|
| Aumento do consumo | A substância é usada em grandes quantidades ou durante um período de tempo superior ao pretendido. | Ingestão de grandes quantidades de comida mesmo na ausência de fome fisiológica;Ingerir, num determinado intervalo de tempo (i.e.,2h), uma quantidade de alimentos claramente superior à que a maioria dos indivíduos ingeriria num período de tempo semelhante, e nas mesmas circunstâncias. |
| Perda de controlo | Desejo persistente ou esforço mal sucedido para diminuir ou controlar o uso da substância. | Sensação de perda de controlo durante os episódios de binge eating (i.e., sentimento de que não é possível parar a ingestão). |
| Consequências sociais | Redução ou abandono de atividades sociais, recreativas ou ocupacionais devido ao uso da substância. | Comer isoladamente por se sentir embaraçado com a quantidade de comida ingerida. |
| Prejuízo/angústia | Uso continuado da substância, apesar da consciência de que o mesmo está a causar ou a agravar um problema físico ou psicológico persistente/recorrente. | Angústia marcada devido ao BED;Sentimentos de desgosto, depressão ou culpa após o episódio de binge;Comer até se sentir desconfortavelmente cheio. |
Adaptado de Smith e Robbins, 201257.
Outra das características‐chave da dependência é a tolerância. De uma forma geral, a tolerância ocorre quando um estímulo leva a uma resposta fisiológica progressivamente diminuída a cada exposição57. Esta característica é concordante com a teoria da “hipofunção dopaminérgica”, segundo a qual a estimulação excessiva dos recetores de DA, quer por alimentos de elevada palatibilidade, quer por drogas de adição, leva a uma dessensibilização destes recetores, resultando numa resposta de recompensa atenuada64,65. Desta forma, os indivíduos obesos podem exibir tolerância às propriedades de recompensa dos alimentos, tal como acontece com as substâncias de adição. Requerem assim maior exposição ao estímulo, quer este seja drogas ou alimentos, para atingir o mesmo nível de recompensa experienciado anteriormente, traduzindo‐se num aumento do consumo57. Verificou‐se que o IMC se correlaciona de forma positiva com a frequência e a gravidade dos episódios de binge eating. Por outro lado, uma grande proporção de adultos com BED reportou ter excesso de peso antes do início da perturbação alimentar, sugerindo que, ao longo do tempo, a ingestão crónica de alimentos de elevada palatibilidade pode perpetuar a hiperingestão e o aumento de peso, contribuindo para a gravidade do BED66. Ambos os casos providenciam evidências indiretas de efeitos de tolerância.
O impacto da tolerância na progressão de comportamentos aditivos torna‐se mais relevante pela sua sinergia com os sintomas de abstinência. Alguns alimentos, nomeadamente o açúcar, podem provocar sintomas de abstinência pronunciados quando são removidos da dieta67. As evidências que melhor suportam este efeito derivam de estudos com ratos mantidos inicialmente com uma solução de 25% de glicose67,68. Após a sua remoção, os ratos mostram sinais de agressão, ansiedade, diminuição da temperatura corporal e tremor da cabeça, sintomas semelhantes aos da abstinência de drogas como a heroína. As descrições de situação de abstinência de açúcar em humanos são consensuais a descrever dores de cabeça e irritabilidade. No entanto, provêm principalmente de observações clínicas anedóticas e não foram submetidas a investigação científica10.
Apesar de a palatibilidade não ser per se, o critério de seleção de alimentos em um episódio de ingestão compulsiva, os alimentos de elevada palatibilidade, ricos em açúcar e/ou em gordura, estão particularmente associados a situações de craving69 e a um maior valor de reforço70 Adicionalmente, os estudos que exploraram sintomas de tolerância e de abstinência no que respeita a alimentos (em animais) reportam essencialmente estes sintomas para o consumo de açúcar 67 e de alimentos processados71.
A impulsividade, geralmente definida como a tendência para agir com insuficiente deliberação, planeamento ou controlo (resultando em respostas inadequadas), que é uma componente‐chave do défice de tomada de decisões10, representa outra das semelhanças clínicas entre a dependência e a obesidade. A expressão do fenótipo que inclui tanto o défice no controlo inibitório como a impulsividade apresenta uma forte relação com o BED72–74 e com a dependência de drogas44,75,76. Existe também evidência de que crianças obesas77, mulheres obesas com e sem BED72,78,79 e indivíduos com comportamento alimentar restritivo80 são mais impulsivos do que os controlos. Por outro lado, o autocontrolo, definido como a tendência crónica para inibir tendências indesejáveis de comportamento (ex., impulsos) relaciona‐se negativamente com doenças do comportamento alimentar, abuso de drogas e com outros problemas psicológicos, nomeadamente a depressão81.
As semelhanças descritas entre obesidade e dependência de substâncias contribuíram para que se defendesse a inclusão de determinados subtipos de obesidade como doença mental no DSM‐V82. A inclusão da obesidade neste manual de diagnóstico não se concretizou, nomeadamente devido à falta de consenso sobre a evidência que a suportava. Por outro lado, o BED, que se encontrava incluído na categoria «outras patologias de comportamento alimentar não especificadas», mereceu no DSM‐V a sua própria categoria de patologia de comportamento alimentar62, realçando a importância da investigação nesta área.
Evidência de dependência alimentar em humanosCom a finalidade de investigar a legitimidade do constructo de dependência alimentar em humanos, foi realizado um estudo de caso‐controlo com uma amostra de 72 obesos adultos (49 mulheres e 23 homens), tendo sido utilizado a YFAS para avaliar dependência alimentar. Entre os indivíduos que cumpriram os critérios de dependência alimentar (n=18), o diagnóstico de BED e de depressão foi mais frequente, relativamente aos indivíduos sem dependência alimentar. Estes indivíduos apresentaram também maior número de traços de impulsividade, bem como maior défice de atenção, relativamente a controlos com idade e peso equivalentes. Os indivíduos com dependência alimentar também obtiveram pontuações mais elevadas de ingestão emocional (i.e., ingestão em resposta a emoções negativas como a ansiedade e a irritabilidade) e a ingestão externa (i.e., ingestão em resposta a estímulos externos, tais como a visualização ou o aroma dos alimentos)83 e de fome hedónica (avaliada pela Power of Food Scale), comparativamente aos controlos84. No entanto, é importante referir que neste estudo não foram controladas variáveis relevantes, tais como alguns traços da personalidade (ex. «harm avoidanc») potencialmente relevantes na etiologia e manutenção do BED85.
Num estudo canadiano com um total de 652 participantes adultos (415 mulheres, 237 homens) com uma média de IMC de 27,4 (5,4) Kg/m2, encontrou‐se uma frequência de dependência alimentar de 5,4% (6,7 nas mulheres e 3,0% nos homens) que aumentava com as categorias de IMC. Quando os indivíduos com diagnóstico de dependência alimentar eram classificados de acordo com o IMC, 11,4% inseriam‐se nas categorias de peso baixo/normal e 88,6% apresentavam pré‐obesidade ou obesidade. Verificou‐se também que todos os métodos de avaliação da obesidade utilizados (perímetro da cintura, anca, percentagem de gordura corporal e percentagem de gordura do tronco) se correlacionavam positivamente com os sintomas de dependência alimentar 24.
Gearhardt et al. estudaram 96 obesos com BED (média de IMC de 38,3 (5,7) Kg/m2), que procuraram tratamento para a obesidade no contexto de cuidados de saúde primários. Verificaram que 41,5% (n=39) dos participantes cumpriam os critérios de diagnóstico de dependência alimentar, de acordo com o Y‐FAS Estes indivíduos apresentavam níveis significativamente mais elevados de emoções negativas, desregulação emocional e de baixa autoestima. Quanto mais elevadas as pontuações na YFAS, mais precoce era a idade com que os indivíduos se tinham tornado obesos. As pontuações na YFAS também se mostraram preditoras da frequência dos episódios de binge86.
Eichen et al. realizaram um estudo com 178 indivíduos (133 mulheres e 45 homens) com pré obesidade e obesidade (média de IMC de 36,2 (4,8) Kg/m2) sem BED, dos quais 15,2% cumpriam os critérios de diagnóstico de dependência alimentar. Do total de participantes, 45% (n=80) apresentavam pelo menos 3 dos sintomas abrangidos pela YFAS. Destes, os mais frequentes foram: incapacidade para diminuir ou parar a ingestão (96,1%), consumo continuado apesar das consequências (44,4%) e tolerância (36%). Os indivíduos com dependência alimentar obtiveram pontuações mais elevadas de depressão. No entanto, não se encontrou uma correlação significativa entre os sintomas de dependência alimentar e o IMC87.
A dependência alimentar parece estar também relacionada com piores resultados de perda de peso. Num grupo de 57 mulheres obesas (IMC médio de 38,2 (8,1) Kg/m2) participantes num programa de intervenção comportamental para perda de peso, verificou‐se que a gravidade dos sintomas de dependência alimentar estava relacionada com menor perda de peso (avaliada após sete semanas), depressão, ingestão emocional, BED, preconceito em relação ao peso e baixa autoeficácia relativamente à alimentação. Os autores do estudo sugeriram que os sintomas de dependência (ex., tolerância e abstinência) podem tornar a adoção de hábitos alimentares saudáveis especialmente difícil, minimizando a possibilidade de perda de peso23.
De uma amostra de 67 indivíduos com obesidade severa, submetidos a tratamento cirúrgico da obesidade, 53,7% apresentaram os critérios de diagnóstico de dependência alimentar avaliados com a Y‐FAS previamente à cirurgia. Relativamente aos obesos que não cumpriram os critérios de diagnóstico, os indivíduos com dependência alimentar apresentaram resultados menos favoráveis de perda de peso, (32 vs. 27%)20.
Por fim, importa relatar os resultados de um estudo clínico em que foi utilizada uma metodologia genética recente para diagnóstico de dependência alimentar, em que são atribuídas pontuações a 6 polimorfismos do sistema dopaminérgico, de acordo com o aumento da sinalização da DA estriada a que estão associados. A pontuação total (de 0 a 6) dá origem a um multilocus genetic profile score (MLGP) individual que, teoricamente, reflete a predisposição para dependência alimentar. Do total de 120 participantes, 21 foram diagnosticados com dependência alimentar. Tal como previsto, as pontuações MLGP foram mais elevadas nos indivíduos com dependência alimentar e correlacionaram‐se positivamente com BED e ingestão emocional. Este estudo apoia a hipótese de que existe uma predisposição genética para dependência alimentar, neste caso determinada por polimorfismos do sistema dopaminérgico relacionados com alterações na transmissão de DA e/ou com a responsividade do estriato ventral26.
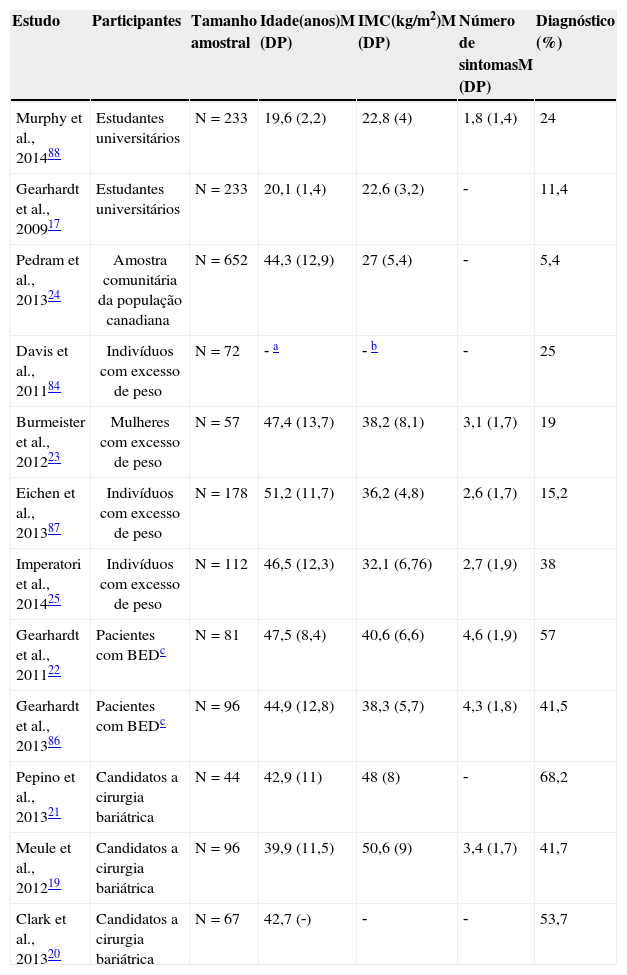
Na tabela 3 é possível verificar o número médio de sintomas e percentagem de participantes que cumpriram o diagnóstico de dependência alimentar nos principais estudos realizados com a YFAS.
Número médio de sintomas e percentagem de participantes que cumpriram o diagnóstico de dependência alimentar em estudos realizados com a YFAS
| Estudo | Participantes | Tamanho amostral | Idade(anos)M (DP) | IMC(kg/m2)M (DP) | Número de sintomasM (DP) | Diagnóstico (%) |
|---|---|---|---|---|---|---|
| Murphy et al., 201488 | Estudantes universitários | N=233 | 19,6 (2,2) | 22,8 (4) | 1,8 (1,4) | 24 |
| Gearhardt et al., 200917 | Estudantes universitários | N=233 | 20,1 (1,4) | 22,6 (3,2) | ‐ | 11,4 |
| Pedram et al., 201324 | Amostra comunitária da população canadiana | N=652 | 44,3 (12,9) | 27 (5,4) | ‐ | 5,4 |
| Davis et al., 201184 | Indivíduos com excesso de peso | N=72 | ‐ a | ‐ b | ‐ | 25 |
| Burmeister et al., 201223 | Mulheres com excesso de peso | N=57 | 47,4 (13,7) | 38,2 (8,1) | 3,1 (1,7) | 19 |
| Eichen et al., 201387 | Indivíduos com excesso de peso | N=178 | 51,2 (11,7) | 36,2 (4,8) | 2,6 (1,7) | 15,2 |
| Imperatori et al., 201425 | Indivíduos com excesso de peso | N=112 | 46,5 (12,3) | 32,1 (6,76) | 2,7 (1,9) | 38 |
| Gearhardt et al., 201122 | Pacientes com BEDc | N=81 | 47,5 (8,4) | 40,6 (6,6) | 4,6 (1,9) | 57 |
| Gearhardt et al., 201386 | Pacientes com BEDc | N=96 | 44,9 (12,8) | 38,3 (5,7) | 4,3 (1,8) | 41,5 |
| Pepino et al., 201321 | Candidatos a cirurgia bariátrica | N=44 | 42,9 (11) | 48 (8) | ‐ | 68,2 |
| Meule et al., 201219 | Candidatos a cirurgia bariátrica | N=96 | 39,9 (11,5) | 50,6 (9) | 3,4 (1,7) | 41,7 |
| Clark et al., 201320 | Candidatos a cirurgia bariátrica | N=67 | 42,7 (‐) | ‐ | ‐ | 53,7 |
As evidências descritas anteriormente sugerem que o fenótipo de dependência alimentar é um moderador do risco para a obesidade. A sua relação com variáveis como BED, ingestão emocional e externa, fome hedónica, depressão, entre outras, demonstra a sua relevância na etiopatologia da obesidade e a necessidade de investigação adicional nesta área. Adicionalmente, a identificação de fenótipos específicos de obesidade e dos seus fatores de risco, pode contribuir para o desenvolvimento de novas abordagens terapêuticas mais específicas. No entanto, apesar dos vários aspectos etiológicos aparentemente relacionados, existem distinções relevantes entre a dependência de drogas e o conceito de dependência alimentar. A mais notável é que a comida, ao contrário das drogas, é indispensável para a sobrevivência. Desta forma, existe uma panóplia de regiões anatómicas, hormonas e neurotransmissores que modulam a ingestão alimentar, para além dos mecanismos de recompensa. Os mecanismos implicados na obesidade podem resultar de alterações em ambos os sistemas, levando à disfunção dos mediadores orexigénicos e/ou anorexigénicos. Adicionalmente, existe evidência suficiente de que as respostas de recompensa desencadeadas por alimentos de elevada palatibilidade nos sistemas dopaminérgico e opioide, não são tão pronunciadas como as que resultam do consumo de substâncias de adição, que influenciam diretamente estas vias neuroquímicas. Existem ainda diferenças na magnitude dos processos cognitivos associados com a adição e obesidade, bem como importantes diferenças nos sintomas fisiológicos de abstinência57.
No entanto, estas diferenças não são suficientes para subestimar a natureza compulsiva e a perda de controlo associadas ao BED ou as alterações neuroquímicas que ocorrem devido à ingestão crónica de açúcar e gordura. Desta forma, em alguns indivíduos que lutam contra o seu peso e comportamento alimentar, é possível que o fenótipo de dependência alimentar se adeque melhor aos seus sintomas e comportamentos. Considerar um modelo de dependência alimentar para os pacientes com BED e para alguns indivíduos com obesidade ‐ com o pressuposto de que estes indivíduos travam uma luta contra fortes pressões neurobiológicas para a hiperingestão num ambiente que as potencia ‐ pode contribuir para novas perspetivas de intervenção farmacológica e de intervenções terapêuticas que visem a aprendizagem efetiva de estratégias para controlar a hiperingestão a longo termo.
Conflitos de interessesOs autores declaram não haver conflito de interesses.