A síndrome de Turner (ST) é uma das cromossomopatias mais frequentes nas mulheres. Vários estudos revelaram associação entre ST e aumento da prevalência de diabetes mellitus (DM). Na consulta de endocrinologia do centro onde foi desenvolvido este trabalho foram seguidas 60 mulheres com ST até à data. Aqui, as doentes foram vigiadas considerando o seu risco aumentado de desenvolvimento de doenças metabólicas, nomeadamente as alterações do metabolismo dos hidratos de carbono. O principal objetivo deste artigo é realizar uma revisão da literatura acerca da associação entre DM e ST, tendo como ponto de partida as 4 doentes reportadas.
Os primeiros 3 casos correspondem a doentes com ST que desenvolveram DM tipo 2 (DM2). O diagnóstico de ST suspeitou‐se por infertilidade, baixa estatura (BE) associada a amenorreia primária e amenorreia primária, tendo os cariótipos sido 45,X/46,X,i(Xq), 45,X e 45,X[18]/47,XXX[10]/46,XX[2], respetivamente. O diagnóstico de DM2 estabeleceu‐se após prova de tolerância à glucose oral (PTGO), aos 40 e 47 anos, nas 2 primeiras doentes e após glicemias de jejum consecutivamente >126mg/dl, aos 34 anos, no terceiro caso. Foram medicadas com metformina, apresentando bom controlo metabólico. A quarta doente foi diagnosticada com ST aos 2 anos por BE, com cariótipo 45,X/46,X,i(Xq). Aos 10 anos foi‐lhe diagnosticada DM1 e, posteriormente, tiroidite autoimune e doença celíaca. Esta doente tem apresentado insatisfatório controlo, tendo sido detetada, aos 32 anos, retinopatia diabética.
Os casos apresentados de DM2 foram facilmente controlados, apresentando‐se em idades jovens, como previamente descrito. Contudo, é reconhecido que a mortalidade, sobretudo cardiovascular, é elevada nesta síndrome. Sabe‐se também que a autoimunidade está aumentada na ST, o que contribui para o desenvolvimento de DM1. Foi demonstrada associação entre determinadas alterações citogenéticas e DM. São essenciais: o reconhecimento deste risco e estabelecimento de vigilância adequada, em equipa especializada e multidisciplinar.
Turner syndrome (TS) is one of the most common chromosomal abnormalities in women. Several studies have shown an association between ST and increased prevalence of diabetes mellitus (DM). Sixty ST patients have been followed in the Endocrine clinics of the centre where this work was developed. These patients were regularly monitored considering their increased risk of developing metabolic disorders, in particular, changes in carbohydrates’ metabolism. The aim of this article is to perform a review of literature on DM and ST, taking as its starting point the four reported cases.
The first three women developed type 2 diabetes (T2DM). The diagnosis of TS was suspected by infertility, short stature (SS) associated with primary amenorrhea and primary amenorrhea, and the karyotype was 45,X/46,X,i(Xq), 45,X and 45X[18]/47,XXX[10]/46,XX[2], respectively. T2DM was established after oral glucose tolerance test, at the age of 40 and 47, respectively, in the first two cases, and after consecutive fasting glucose levels >126mg/dl, at 34, in the third case. They were all medicated with metformin, achieving good metabolic control. The fourth patient was diagnosed with ST at the age of 2 due to SS, with karyotype 45,X/46,X,i(Xq). At 10 she was diagnosed with T1DM, and subsequently with autoimmune thyroiditis and celiac disease. This patient has presented an unsatisfactory control, and she was diagnosed with diabetic retinopathy at the age of 42.
T2DM cases were easily controlled and were diagnosed at young ages, as previously described. However, it's recognized that mortality, especially cardiovascular, is augmented in this syndrome. It's also known that autoimmunity is increased in TS, which contributes to the development of T1DM. It was demonstrated association between certain cytogenetic alterations and DM. The recognition of this risk and the establishment of an adequate follow‐up in a specialized and multidisciplinary team are essential.
A síndrome de Turner (ST) é a anomalia cromossómica relacionada com o sexo mais frequentemente diagnosticada nas mulheres, afetando 1/2.000 das meninas recém‐nascidas1. Esta síndrome foi descrita a primeira vez em 1768 por Giovani Morgagni. Posteriormente, em 1902, Funke descreveu uma doente de 15 anos com as características que viriam a ser consideradas as clássicas desta síndrome – disgenesia gonadal, baixa estatura, ausência de puberdade, linfedema congénito e pescoço alado. Em 1930, Ullrich relatou as características definitivas da ST, sendo o diagnóstico confirmado pelo cariótipo 57 anos depois. A síndrome foi nomeada em 1938 após Henry Turner, um endocrinologista americano de Oklahoma, ter descrito 7 doentes com as características fenotípicas típicas da ST, tendo sido o primeiro a iniciar a terapêutica de substituição com estrogénios2.
A ST ocorre em doentes do sexo feminino com perda parcial ou total de um cromossoma X, que apresentam uma ou mais características clínicas classicamente associadas à ST, como a baixa estatura ou a disgenesia gonadal3. Estudos sugerem que cerca de metade das doentes apresentam cariótipo 45,X, 20‐30% demonstram mosaicismo e as restantes evidenciam anomalias estruturais do cromossoma X4. Existe uma correlação entre a citogenética e o fenótipo – doentes com cariótipo 45,X apresentam o fenótipo mais alterado e os mosaicismos associam‐se frequentemente a um fenótipo menos severo e até 40% progridem espontaneamente na puberdade5. O isocromossoma Xq é a alteração estrutural mais comum, estando frequentemente associada a doenças autoimunes e surdez2. A baixa estatura é uma condição quase invariável nas mulheres com ST, presente em todas aquelas com monossomia do X e em mais de 96% nas que apresentam mosaico ou alterações estruturais do cromossoma X6,7.
Foi descrito que a haploinsuficiência do gene short stature homeobox‐containing gene (SHOX) se encontra na origem da diminuição da estatura final em 95‐99% das doentes com ST3,8. Este gene pertence a uma família de genes homeobox, reguladores da transcrição e controladores chave dos processos de desenvolvimento9, e expressa‐se nos cromossomas X e Y ativos e inativos. Apesar da deficiência de hormona do crescimento (HC) não ser a principal etiologia da baixa estatura nestas doentes, a literatura refere que o eixo insulin‐like growth factor‐1 (IGF‐1) – proteína de ligação do IGF‐1 não se encontra equilibrado nestas mulheres. Este distúrbio pode envolver resistência relativa às ações da HC10,11, falência da produção hipofisária de HC ou aumento das proteínas de ligação12. Tendo em conta estas alterações, sabe‐se que o tratamento com somatropina em doses suprafisiológicas pode melhorar a estatura final destas doentes, sendo um tratamento universalmente aceite13,14. Aumentar a atividade do eixo HC‐IGF‐1 de níveis subnormais pode beneficiar alguns fatores de risco cardiovascular, como a tensão arterial e as resistências vascular e à insulina, apresentando efeito benéfico na composição corporal e no perfil lipídico15. Contudo, a hipersecreção de HC aumenta a mortalidade cardiovascular, como ocorre nos doentes com acromegalia, que apresentam frequência aumentada de diabetes16. Níveis elevados de HC induzem insulinorresistência no fígado e noutros tecidos, diminuindo a captação periférica (músculo esquelético) e aumentando a produção hepática de glucose17. Este tipo de tratamento levanta algumas preocupações acerca do potencial efeito diabetogénico das concentrações excessivas de HC.
Estudos que reviram os antecedentes familiares de um grande grupo de doentes com ST revelaram que a prevalência de diabetes mellitus (DM) nos parentes de 1.° grau era semelhante à da população em geral18. Tem sido também notada uma elevada taxa de DM na síndrome de Klinefelter19, o que levanta a suspeita da existência de alguma alteração cromossómica responsável pela frequência aumentada da DM na ST.
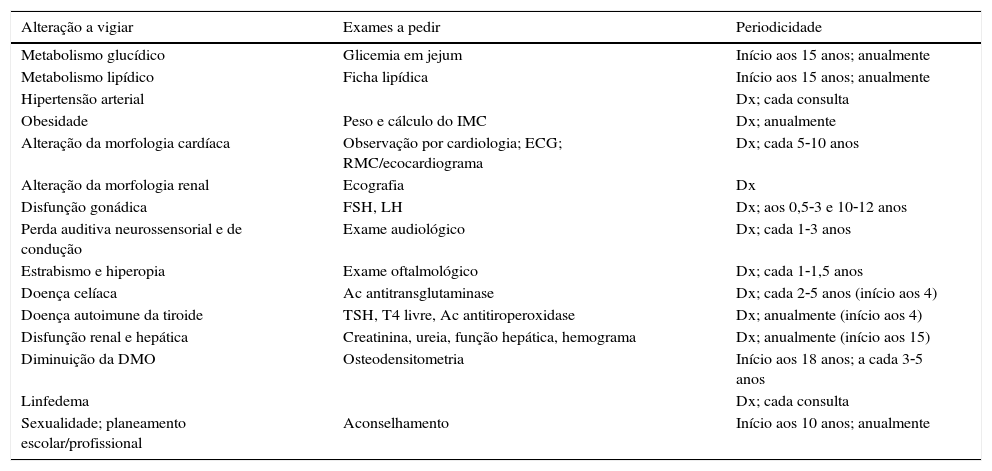
Na consulta de endocrinologia do centro onde foi desenvolvido este trabalho foram seguidas 60 mulheres com ST, entre 1982‐2014. Nesta consulta as doentes são seguidas tendo em consideração o seu risco aumentado de desenvolvimento, entre outras, de doenças metabólicas, nomeadamente das alterações do metabolismo dos hidratos de carbono. O protocolo de seguimento das doentes com ST em fase adulta do centro onde foi desenvolvido este trabalho encontra‐se na tabela 1.
| Alteração a vigiar | Exames a pedir | Periodicidade |
|---|---|---|
| Metabolismo glucídico | Glicemia em jejum | Início aos 15 anos; anualmente |
| Metabolismo lipídico | Ficha lipídica | Início aos 15 anos; anualmente |
| Hipertensão arterial | Dx; cada consulta | |
| Obesidade | Peso e cálculo do IMC | Dx; anualmente |
| Alteração da morfologia cardíaca | Observação por cardiologia; ECG; RMC/ecocardiograma | Dx; cada 5‐10 anos |
| Alteração da morfologia renal | Ecografia | Dx |
| Disfunção gonádica | FSH, LH | Dx; aos 0,5‐3 e 10‐12 anos |
| Perda auditiva neurossensorial e de condução | Exame audiológico | Dx; cada 1‐3 anos |
| Estrabismo e hiperopia | Exame oftalmológico | Dx; cada 1‐1,5 anos |
| Doença celíaca | Ac antitransglutaminase | Dx; cada 2‐5 anos (início aos 4) |
| Doença autoimune da tiroide | TSH, T4 livre, Ac antitiroperoxidase | Dx; anualmente (início aos 4) |
| Disfunção renal e hepática | Creatinina, ureia, função hepática, hemograma | Dx; anualmente (início aos 15) |
| Diminuição da DMO | Osteodensitometria | Início aos 18 anos; a cada 3‐5 anos |
| Linfedema | Dx; cada consulta | |
| Sexualidade; planeamento escolar/profissional | Aconselhamento | Início aos 10 anos; anualmente |
AC: anticorpo; DMO: densidade mineral óssea; Dx: diagnóstico; ECG: eletrocardiograma; IMC: índice de massa corporal; RMC: ressonância magnética cardíaca.
Das doentes seguidas em consulta, 4 foram diagnosticadas com DM, patologia que se crê ser mais prevalente neste grupo de doentes. O principal objetivo deste artigo é realizar uma revisão da literatura acerca das alterações do metabolismo glucídico na ST, tendo como ponto de partida os 4 casos descritos seguidamente.
Descrição dos casosCaso clínico n.° 1Doente sem antecedentes familiares relevantes, nomeadamente de DM, operária fabril, diagnosticada com ST aos 35 anos após investigação por infertilidade, com cariótipo 45,X/46,X,i(Xq). Apresentava história pregressa de menarca aos 17 anos, baixa estatura não medicada com somatropina e aracnoidocelo intraselar. Antropometricamente apresentava estatura de 143cm, peso de 47kg e índice de massa corporal (IMC) de 22,98kg/m2. Ao exame objetivo, no que diz respeito às características típicas da ST, mostrava inserção baixa do cabelo, tórax com afastamento mamilar e nevos pigmentados em número moderado, sobretudo no tronco. Não necessitou de ser submetida a terapêutica hormonal de substituição (THS). Aos 40 anos, em análises de rotina, notou‐se glicemia de jejum de 107mg/dl, com hemoglobina glicada (HbA1c) de 4,7%. Foi então submetida a PTGO que revelou um valor de glicemia aos 0 e 120 minutos de 110 e 240mg/dl, respetivamente, na altura com parâmetros antropométricos sobreponíveis. Realizou posteriormente ecografia abdominal que não demonstrou esteatose hepática. Manteve‐se controlada com o cumprimento dos cuidados alimentares e exercício físico, tendo repetido, 4 anos depois, a PTGO, que mostrou, aos 120 minutos, glicemia de 210mg/dl, apresentando na altura HbA1c de 6,3%. Foi também diagnosticada com hipertensão arterial (HTA), tendo sido medicada com indapamida 2,5mg e ramipril 2,5mg diariamente. Aos 46 anos repetiu ecografia abdominal, tendo sido descrita ligeira esteatose hepática. Nesta altura, apesar de analiticamente manter valores sobreponíveis, decidiu‐se iniciar terapêutica com metformina 1.000mg/dia. Manteve bom controlo metabólico (HbA1c∼6%) com esta medicação.
Caso clínico n.° 2Doente sem antecedentes familiares relevantes, doméstica, com diagnóstico de ST aos 32 anos, após investigação por baixa estatura e amenorreia primária. O estudo citogenético revelou cariótipo 45,X. Auxologicamente apresentava estatura de 139cm, peso de 39,5kg e IMC de 20,44kg/m2. Objetivamente, no que diz respeito às características particulares da ST, evidenciava pescoço curto com baixa inserção a nível da nuca, pterygium colli muito evidente, afastamento mamilar, nevus pigmentares na face, pescoço e dorso, abóbada palatina em ogiva e cubitus valgus. %. Foi medicada com etinilestradiol+levonorgestrel (0,02+0,1mg), apresentando hemorragias de privação. Foi‐lhe diagnosticada também HTA, dislipidemia e dilatação da aurícula esquerda. Aos 47 anos foi‐lhe pedida PTGO, que foi compatível com o diagnóstico de diabetes, dado que se verificou glicemia de 266mg/dl aos 120 minutos. Manteve cuidados alimentares e exercício físico, com autovigilância ocasional de glicemia capilar em jejum, que oscilava ente 90‐130mg/dl, e pós‐prandial entre 130‐210mg/dl. Três anos depois, aos 50 anos, por alterações persistentes da glicemia decidiu‐se iniciar metformina 1.000mg/dia; tinha apresentado aumento ponderal de 5kg ao longo deste período. Havia realizado ecografia abdominal que não mostrou alterações. Permaneceu controlada, até à data, com HbA1c∼6%.
Caso clínico n.° 3Doente de 31 anos, assistente operacional num lar de idosos, com antecedentes familiares de HTA (pai), bócio multinodular (mãe) e diabetes mellitus tipo 1 (DM1) (primo direito materno), diagnosticada com ST, aos 16 anos, após investigação por amenorreia primária. O estudo genético revelou cariótipo 45,X[18]/47,XXX[10]/46,XX[2]. Na primeira observação de endocrinologia, aos 31 anos, apresentava altura de 148,3cm, peso de 98,4kg e IMC de 44,7kg/m2. Fenotipicamente observou‐se palato em ogiva, pescoço curto, tórax de conformação normal e encurtamento do 4.° e 5.° metacarpos bilateralmente. Foi medicada também com etinilestradiol+levonorgestrel (0,02+0,1mg). Aos 34 anos, realizou eco abdominal que notou esteatose hepática, sendo que a função hepática a seguinte: alanina aminotransferase (ALT) 39UI/L (<34), fosfatase alcalina 62UI/L (30‐120), gama‐glutamil transferase (γ‐GT) 64UI/L (<38) e bilirrubina total 0,4mg/dL (0,3‐1,2). Nesse ano, tinha vindo a apresentar consecutivamente glicemias em jejum sempre na ordem dos 130‐140mg/dl, pelo que se admitiu diagnóstico de DM tipo 2 (DM2). Iniciou terapêutica com metformina 1.000mg (mantinha o peso de 98kg). Permaneceu sempre com HbA1c∼6,5%
Caso clínico n.° 4Doente sem antecedentes familiares relevantes que, aos 2 anos, por baixa estatura e diminuição da velocidade de crescimento, foi diagnosticada com ST com cariótipo 45,X/46,X,i(Xq). Apesar de confirmada a baixa estatura, não foi submetida a terapêutica com somatropina. Aos 10 anos, em contexto de queixas de polidipsia e poliúria, estabeleceu‐se o diagnóstico de DM1. No ano seguinte foi‐lhe detetado hipotiroidismo primário por tiroidite autoimune. Fez também rastreio de doença celíaca, que foi positivo. A partir dos 14 anos foi iniciada indução pubertária.
Observada a primeira vez em endocrinologia de adultos aos 16 anos. Auxologicamente apresentava estatura de 133,7cm, peso de 40kg, IMC 22,38kg/m2. Fenotipicamente, no que concerne às características típicas da ST, observava‐se pescoço curto, tórax com afastamento mamilar e encurtamento do 4.° metatarso e estádio Tanner 3. Medicada, na altura, com esquema de insulinoterapia convencional intensiva funcional (1,4U/kg), levotiroxina 50μg, etinilestradiol+gestodeno (0,02+0,75mg). Hemorragia de privação aos 17 anos.
Esta doente tem vindo a apresentar controlo metabólico muito lábil, variando a HbA1c entre 6‐9,1%. Aos 32 anos de idade foi‐lhe diagnosticada retinopatia diabética.
ComentáriosA prevalência da diabetes (6,7%) – 5% de DM2 e 1,7% de DM1 – nas doentes com ST seguidas neste centro foi inferior à referenciada na literatura. Sabe‐se que aproximadamente uma em cada 4 doentes com ST apresentam DM220. À exceção do caso n.° 3, as outras 2 doentes com DM2 eram normoponderais. Estudos prévios21 evidenciaram que o aumento da insulinorresistência nas mulheres com esta síndrome é independente da percentagem de massa corporal gorda e magra corrigidas para a altura. Os casos apresentados, à exceção da DM1, são de DM muito incipiente, de fácil controlo, como previamente relatado por outros autores20.
A frequência aumentada de DM nas mulheres com ST foi descrita a primeira vez em 1963 por Forbes e Engel22. Sabe‐se que a DM2 é 2‐4 vezes mais comum em mulheres com ST e tende a ocorrer em idades mais jovens23,24, tal como se verificou nas doentes por nós apresentadas. A diminuição da tolerância à glicose (DTG) é ainda mais prevalente, afetando 25‐78% destas doentes25,26. A mortalidade na ST é 3‐4 vezes superior à da população em geral, associada a um risco cardiovascular que é 2 vezes maior. Têm sido implicadas neste aumento as alterações da sensibilidade e da atividade da insulina24. Um estudo populacional dinamarquês1 com doentes com ST demonstrou que o risco de mortalidade por doenças endócrinas e metabólicas se encontra aumentado à custa da elevada frequência de diabetes; verificou ainda que a diabetes contribuiu para a mortalidade, mesmo quando não constituiu a verdadeira causa de morte.
A literatura suporta a forte correlação existente entre a ST, a sensibilidade à insulina e a terapêutica com somatropina17,27,28. Um estudo realizado por Mazzanti et al.29, que avaliou a sensibilidade à insulina de 46 doentes que foram submetidas a aproximadamente 10 anos de somatropina em altas doses, verificou que este parâmetro se encontrava diminuído nas doentes com ST mesmo antes do início da terapêutica. Com o princípio do tratamento, verificaram ainda maior redução da sensibilidade à insulina; após a cessação da somatropina esse parâmetro retornou aos níveis pré‐terapêuticos. Observaram, portanto, que o aumento da insulinorresistência durante a terapêutica com somatropina é reversível, tal como verificado por outros autores17,30. Neste estudo, esta reversibilidade foi influenciada negativamente pelo IMC e níveis de triglicerídeos e, positivamente, pelo número de anos de cessação de somatropina. Evidências sugerem que 6‐12 meses após a suspensão do tratamento a insulinorresistência retorna aos valores basais2. Nos casos por nós descritos, nenhuma das doentes havia sido submetida a tratamento com somatropina e, portanto, esta terapêutica não se associou ao desenvolvimento de DM. Caprio et al.27 sugeriram que a insulinorresistência usualmente se evidencia numa fase precoce da história natural da ST. Esta resistência parece estar relacionada com as vias não‐oxidativas do metabolismo da glucose e, provavelmente, predispõe estas doentes ao subsequente desenvolvimento de diabetes. Estudos demonstraram DTG em meninas com ST com 5 anos de idade, muito antes da terapêutica com somatropina ou com hormonas sexuais31. Um grupo holandês30 descreveu também o efeito da descontinuação do tratamento a longo prazo com somatropina nos níveis de glucose e insulina, mas também no IMC, tensão arterial e perfil lipídico. Demonstraram que estes parâmetros, após um aumento durante a terapêutica com somatropina, regressaram aos valores basais após a suspensão do tratamento, mas, neste estudo, os valores de insulina após esta descontinuação foram comparáveis aos das raparigas normais na pós‐puberdade. Considerando que a insulinorresistência predispõe ao desenvolvimento de DM2, estes autores sugerem a prevenção do aumento de peso nas doentes com ST.
Durante a adolescência, as doentes com ST podem ser submetidas a terapêutica com somatropina, que pode ser associada a estradiol (para indução pubertária). Um estudo que avaliou os efeitos deste tratamento combinado no metabolismo glucídico verificou que, para além da terapêutica com somatropina induzir insulinorresistência nas doentes com ST, essa alteração não foi agravada pelo tratamento concomitante com 17β‐estradiol32.
Ao contrário do que acontece com o tratamento com a somatropina nas doentes com ST, em que existem diferentes estudos a investigar a influência desta terapêutica hormonal no metabolismo glucídico, o mesmo não é verdade para a THS que estas doentes realizam em fase adulta. Um estudo de Gravholt et al.33 verificou pequenas alterações em resposta à THS usando 17β‐estradiol e noretisterona. A fructosamina, medida da média da glicemia nos 14 dias precedentes, e os níveis de insulinemia em jejum foram significativamente reduzidos durante a THS, comparativamente à ausência de tratamento. A sensibilidade à insulina permaneceu inalterada, mas mais indivíduos apresentaram diminuição da tolerância à glucose oral durante a THS. Esta deterioração da tolerância durante a terapêutica foi semelhante nos grupos com terapêutica oral (2mg de 17β‐estradiol nos dias 1‐12, 2mg 17β‐estradiol e 1mg de acetato de noretisterona nos dias 13‐22, e 1mg 17β‐estradiol nos dias 23‐28) e com substituição de estrogénios por via transdérmica (50μg de 17β‐estradiol durante 28 dias associados a 1mg de noretisterona oral nos dias 13‐22). Estes autores defendem a hipótese de que, uma vez que se considera que os estrogénios não apresentam ou têm efeitos benéficos no metabolismo dos hidratos de carbono, o componente responsável pela diminuição da tolerância à glucose poderá ser a noretisterona. Apesar de existirem muitos estudos que investigam a associação entre a THS e a sensibilidade à insulina em mulheres em pós‐menopausa, é muito difícil estabelecer comparações fidedignas entre esta população e as doentes com ST, dada a grande diferença de idades, para além de que muitas mulheres com ST sofrem falência ovárica prematura. Num estudo com mulheres jovens com falência ovárica prematura sem ST34 (que poderá ser comparável com a população de ST em termos etários), verificou‐se que a THS diminuiu a sensibilidade à insulina. Por outro lado, outro estudo com uma série comparável (mulheres de 35‐50 anos com menopausa cirúrgica)35 não encontrou nenhum efeito da THS no metabolismo glucídico. Portanto, são necessários mais estudos controlados a longo prazo para a avaliação do efeito desta terapêutica nas mulheres com esta síndrome.
Uma investigação publicada por Hjerrild et al.36 tentou avaliar a função das células ß nas mulheres com ST, comparando com um grupo controlo meticulosamente emparelhado para a idade e composição corporal. Verificaram que nem a diminuição da sensibilidade à insulina nem a diminuição da função da célula ß, após estimulação com hiperglicemia ou após arginina e GLP‐1, explicaram as alterações observadas na homeostasia da glucose nas doentes com ST. Contudo, as mulheres jovens com esta síndrome apresentaram sinais discretos precoces de redução da função da célula ß durante a PTGO e a prova de tolerância à glucose intravenosa. Os autores advogaram que estas alterações estiveram relacionadas com a própria síndrome, colocando a hipótese de que algumas alterações genéticas poderão estar na base do desenvolvimento destas anomalias do metabolismo da glucose. Outro estudo37 avaliou o índice de secreção‐sensibilidade da insulina (ISSI‐2) – produto da sensibilidade e da secreção de insulina –, que reflete a função da célula ß, na ST. Verificaram que este índice era baixo, estando relacionado com a intolerância à glucose observada nestas doentes.
A redução do gastric inhibitory polypeptide (GIP) observada em mulheres jovens com ST que apresentam DTG, comparativamente com doentes com ST emparelhadas para a idade, mas com tolerância à glucose normal, sugere que existe um desequilíbrio na interação incretina ‐ célula ß, que pode contribuir para os distúrbios da secreção de insulina38.
Estudos demonstraram uma prevalência 11 vezes superior à da população em geral de DM1 nas doentes com ST24. Sabe‐se que a autoimunidade está aumentada nesta síndrome39,40, contribuindo para o incremento deste tipo de diabetes, tal como se verificou no caso clínico n.° 4, em que a doente, para além da DM1, apresentou também tiroidite autoimune e doença celíaca. Ensaios clínicos têm documentado aumento dos níveis de proteína C‐reativa41, bem como dos anticorpos anti‐descarboxilase do ácido glutâmico (GAD)40, o que suporta também a associação entre autoimunidade e DM na ST.
Observámos, nas doentes apresentadas, que as alterações citogenéticas encontradas não foram uniformes entre as 4 doentes. Contudo, parece existir associação entre determinados cariótipos e a DM. Um estudo realizado por Bakolov et al.20 representou um grande avanço no esclarecimento da etiologia genética do incremento da frequência da DM na ST. Os autores encontraram uma prevalência de 25% de DM2 numa grande amostra de doentes com ST (n=224) com uma idade média de 35 anos. Consideraram que o fenótipo da diabetes na ST pareceu ser semelhante àquele observado nos doentes com maturity‐onset diabetes of the young, causada por haploinsuficiência dos genes envolvidos na função da célula‐ß, sendo a idade de início também tipicamente entre os 30‐40 anos de idade e a DM, usualmente, de fácil controlo. Apesar da prevalência de DM nas doentes com ST seguidas no centro onde este trabalho foi realizado ser inferior à reportada, verificámos também que foi facilmente controlada apenas com um antidiabético oral, para além de ter sido frequentemente diagnosticada na quarta década de vida. Aqueles autores20 observaram também que 18% das doentes por eles estudadas apresentaram cariótipo 45,X, 23% delXp, 9% (semelhante à população em geral) delXq e 43% isocromossoma Xq. Estes resultados foram consistentes com a hipótese de que a haploinsuficiência do(s) gene(s) de Xp aumenta o risco de diabetes. Estes dados são concordantes com um estudo que demonstrou que a mortalidade da diabetes nas mulheres com ST foi superior nas doentes com isocromossoma Xq42. Bakolov et al.20 sugeriram ainda que a haploinsuficiência dos genes desconhecidos de Xp pareceu constituir o primeiro passo na suscetibilidade à DM e que a trissomia do Xq representou um segundo passo que aumentou a probabilidade de desenvolvimento de DM. Aparentemente, cópias supranumerárias de Xq podem aumentar o risco de DM mesmo na ausência de monossomia X, como na síndrome de Klinefelter19,43. Por comparação dos perfis de expressão de genes de 45,X vs. 46,Xi(Xq), aqueles autores verificaram ainda que vários genes envolvidos na função e sobrevivência da célula ß, autoimunidade e processamento e sinalização de insulina se encontravam sobre‐expressos nestas doentes20. O aumento dos níveis dos anticorpos antiGAD, bem como de proteína C reativa e IGF‐2 nos doentes com isocromossoma Xq, sugeriu um estado pró‐inflamatório nas mulheres com esta alteração cromossómica. Estes achados ilustram a complexidade do estabelecimento de associações genótipo‐fenótipo nesta doença.
Portanto, estes estudos constituíram um passo significativo na compreensão da base genética destas alterações metabólicas, aparentemente mais prevalentes nas doentes com isocromossoma Xq. Estas doentes poderão constituir um grupo considerado de maior risco a requerer uma vigilância mais apertada relativamente ao seu perfil metabólico, tendo em conta que a DM2, apesar de usualmente mais branda, pode ocorrer em idades mais precoces. É importante também ter conhecimento que estas doentes podem apresentar, muitas vezes, DM1 e outras condições autoimunes associadas. Apesar da prevalência da ST na nossa amostra ser inferior à reportada, é essencial reconhecer o risco aumentado de diabetes na ST, já que se sabe que a mortalidade cardiovascular nestas doentes se encontra aumentada. Neste sentido, é essencial estabelecer uma vigilância apertada, como realizada nas doentes por nós relatadas, integrada sempre numa equipa especializada e multidisciplinar, de forma a que o diagnóstico e tratamento sejam estabelecidos atempadamente. É também de vital importância que nas doentes com ST, muitas vezes diagnosticadas em idade pediátrica, seja feita uma transição cuidada, envolvendo a doente e a família, para consulta de endocrinologia de adultos.
Seria interessante levar a cabo um estudo prospetivo multicêntrico nacional onde a prevalência da DM fosse avaliada neste grupo de doentes, considerando também os parâmetros associados ao desenvolvimento da DM na ST, não só na fase adulta, mas durante a infância e adolescência, altura em que muitas são submetidas a terapêutica com somatropina e estrogénios.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.