A doença mineral e óssea associada a insuficiência renal crónica abrange vários distúrbios do metabolismo ósseo, incluindo alterações dos níveis séricos de cálcio, fósforo, hormona paratiroideia e vitamina D, alterações da arquitetura óssea e calcificações vasculares e de tecidos moles. O seu tratamento é crucial em doentes pediátricos ao condicionar deformidades ósseas, fraturas e atraso de crescimento, e se associar a importante risco cardio‐vascular devido às calcificações vasculares. O tratamento deve ser precoce com vitamina D e quelantes de fósforo. Em adultos utilizam‐se frequentemente os novos análogos da vitamina D, como o paricalcitol, com bons resultados e menor risco de hipercalcémia, mas o uso em crianças é ainda muito limitado.
Descrição de caso clínicoOs autores descrevem o caso de uma menina de 3 anos de idade, em programa regular de hemodiálise com diagnóstico de hiperparatiroidismo grave, com alterações ósseas e sem resposta ao tratamento convencional. Foi efetuado tratamento com paricalcitol em alta dose, com boa evolução clínica, com normalização dos valores da hormona paratiroideia para os níveis adequados ao grau de insuficiência renal e regressão das alterações ósseas.
Chronic kidney disease (CKD) – mineral and bone disorder (CKD‐MBD) includes several abnormalities associated to progressive kidney disease with either altered seric levels of calcium, phosphorus, parathyroid hormone and vitamin D, disturbances in bone modelling and remodelling and soft tissue calcifications. Its treatment in children is crucial because it can lead to bone deformities, fractures and growth failure. Therapy should be initiated early mostly with vitamin D or analogues and phosphate binders. In adults new vitamin D analogues, such as paricalcitol, are widely used, with good results in terms of efficacy and less hypercalcemic effect. In children it lacks experience but it has been used already with also good results.
Case reportA 3‐year old girl haemodialysis patient had severe secondary hyperparathyroidism conditioning bone abnormalities and refractory to conventional treatment. She was successfully treated on high dose paricalcitol therapy avoiding need of surgical treatment (parathyroidectomy).
A doença mineral e óssea associada a insuficiência renal crónica (IRC) integra um largo espectro de alterações do metabolismo ósseo, incluíndo alterações dos níveis séricos de cálcio, fósforo, hormona paratiroideia e vitamina D, alterações da arquitetura óssea (e consequente aparecimento de fraturas e diminuição do crescimento linear em crianças), e calcificações vasculares e de tecidos moles. Se o tratamento não for precoce e eficaz durante as fases críticas do crescimento, pode conduzir a atraso do crescimento e deformidades esqueléticas, com grave repercussão na vida destes doentes1,2.
O hiperparatiroidismo secundário (HPT) deve‐se à retenção de fósforo, que se inicia nos estadios precoces da insuficiência renal crónica, e à diminuição da produção de itamin D. A identificação destes factores é fundamental, de modo a prevenir ou atrasar a progressão natural com o tratamento. Este consiste na correção da hiperfosfatémia, através de restrição dietética de fósforo e/ou administração de quelantes de fósforo, e fornecimento de vitamina D e suplementos de cálcio.
Habitualmente, em crianças em diálise, a vitamina D utilizada é o 1‐α‐hidroxicolecalciferol ou calcitriol (1,25– dihidroxicolecalciferol), que permitem um bom controlo do hiperparatiroidismo secundário. Contudo, os seus efeitos secundários mais comuns, a hipercalcémia e a hiperfosfatémia, podem limitar a sua utilização4,5.
De forma a controlar a osteodistrofia renal, mas também a evitar a supressão excessiva da PTH com risco de doença óssea adinâmica, o objetivo do tratamento é definido através de níveis alvo de hormona paratiroideia intacta (iPTH). Estes não estão bem estabelecidos em crianças. As recomendações da National Kidney Foundation (KDOQI guidelines) têm como alvo a manutenção da iPTH entre 200 e 300 pg/ml em crianças com IRC estádio 52, enquanto que as orientações da KDIGO (Kidney Disease Improving Global Outcomes) sugerem que a iPTH seja mantida em valores entre 2‐9 vezes o limite superior da normalidade, embora não haja referência específica à idade pediátrica nestas últimas6.
O paricalcitol (19‐nor‐1α, 25‐dihidroxivitamina D2) é um análogo da vitamina D, que ativa seletivamente os recetores da vitamina D (VDR) a nível da glândula paratiroideia, com efeitos mínimos a nível da absorção intestinal. Está aprovado para tratamento de doentes adultos em hemodiálise desde 1998 e para utilização em crianças também em hemodiálise a partir dos cinco anos desde 2004, mas a experiência em idade pediátrica é ainda muito reduzida3. Tem‐se demonstrado muito eficaz, levando a uma descida mais rápida da hormona paratiroideia (PTH), mesmo em doentes com hiperparatiroidismo secundário resistente ao tratamento com calcitriol, com menor incidência de efeitos secundários7,8.
Descrição do casoOs autores apresentam o caso de uma criança de três anos, sexo feminino, raça negra, com insuficiência renal crónica secundária a esclerose mesangial difusa, em programa de diálise.
Nos antecedentes familiares não há referência a história de doença renal conhecida. A criança foi fruto de uma gestação de termo, com vigilância irregular. Nasceu de parto eutócico, hospitalar, com serologias maternas para sífilis, hepatite B e VIH, realizadas peri‐parto, negativas. Apresentava uma somatometria adequada à idade gestacional.
No 12° dia de vida iniciou quadro de dificuldade respiratória que motivou internamento e conduziu ao diagnóstico de insuficiência renal com anasarca e hipertensão arterial.
Por manter proteinúria nefrótica persistente, com hipoalbuminémia, foi efectuada biopsia renal que revelou quadro histológico compatível com esclerose mesangial difusa.
Com um mês de vida, por uremia, foi iniciada terapêutica substitutiva de função renal com diálise peritoneal.
Nos meses seguintes, necessitou de múltiplos internamentos por intercorrências infecciosas, nomeadamente várias infecções respiratórias, um episódio de sépsis e alguns episódios de peritonite e infeção do cateter, com implicações diretas no tratamento e alternância, por períodos, entre a diálise peritoneal e a hemodiálise.
Manteve hipertensão arterial, com necessidade de medicação com dois fármacos anti‐hipertensores (nifedipina e enalapril). Adicionalmente encontrava‐se sob terapêutica de suporte com ácido fólico, ferro, complexo vitamínico B, carbonato de cálcio, 1‐α‐hidroxicolecalciferol e eritropoietina administrada por via subcutânea.
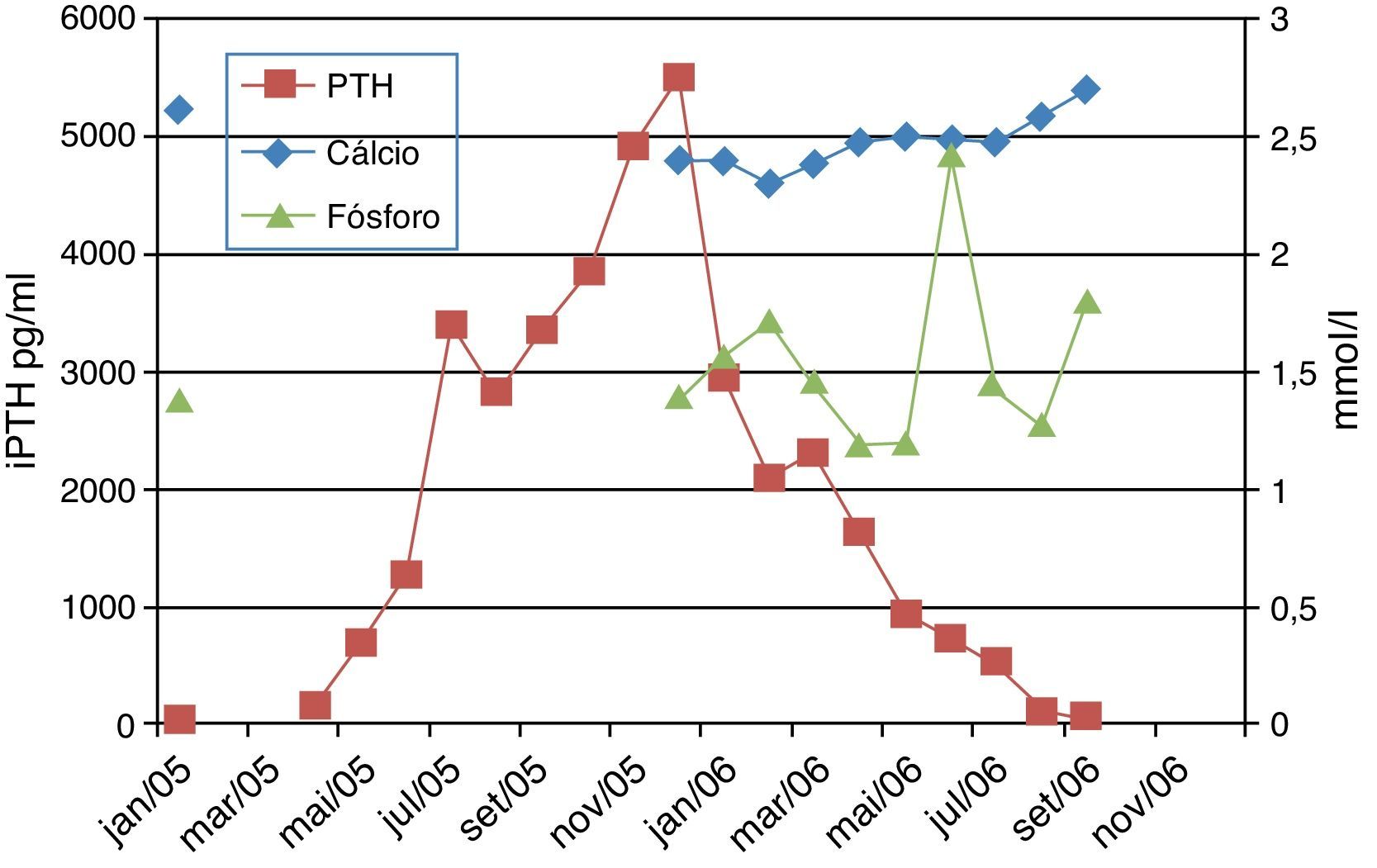
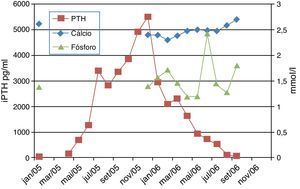
Aos 24 meses, os níveis de hormona paratiroideia intacta (iPTH), determinados pelo método de eletroquimioluminescência (ECLIA), atingiram valores superiores aos estabelecidos para crianças com doença renal crónica estadio 5em diálise. Apesar dos ajustes na terapêutica, com aumento da dose de 1‐α‐hidroxicolecalciferol até um valor máximo de 0,2μg/kg/dia, não foi possível tratar o hiperparatiroidismo secundário, assistindo‐se ao aumento progressivo da iPTH, que atingiu valores de 5500 pg/ml aos 31 meses de idade.
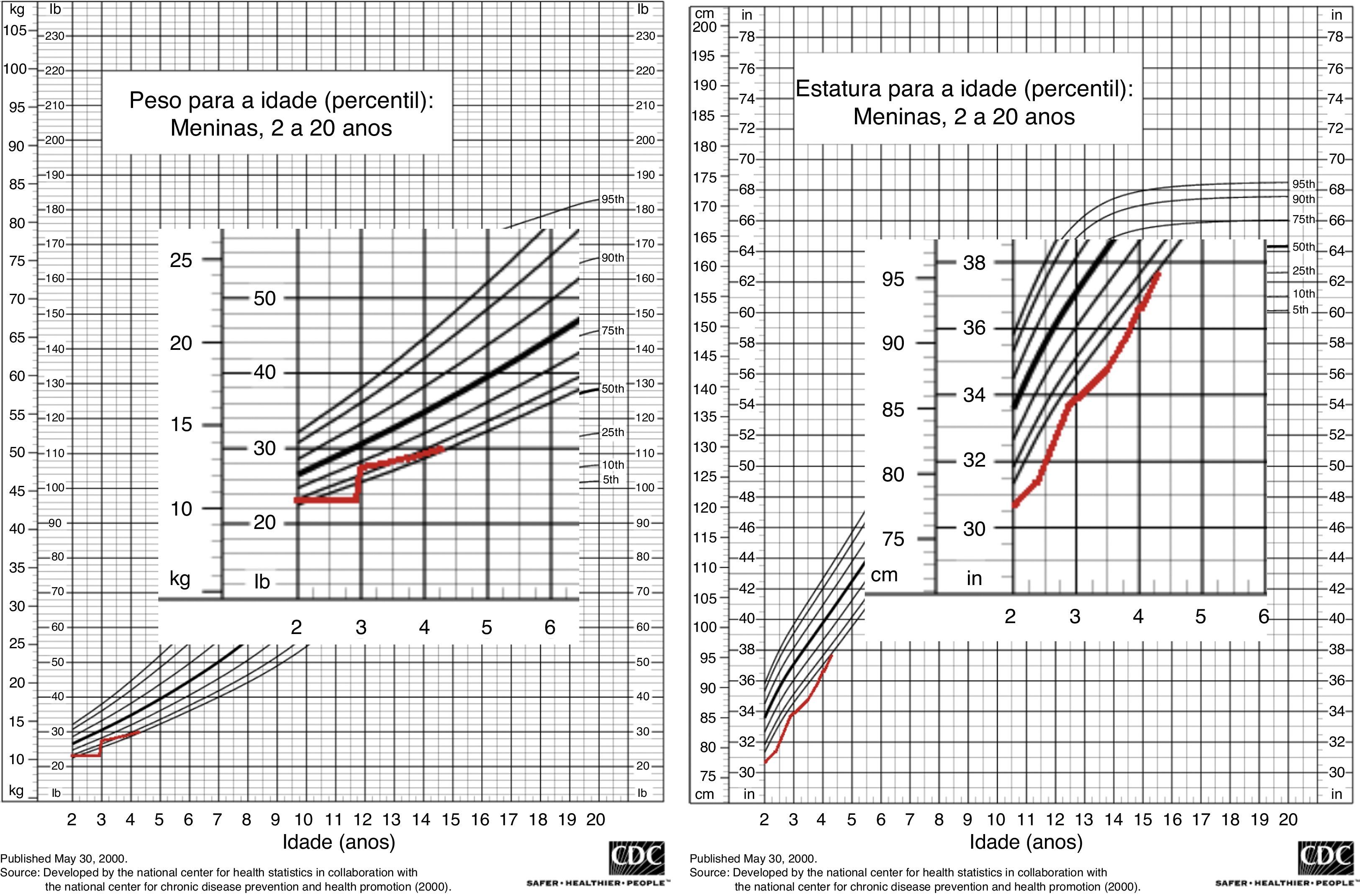
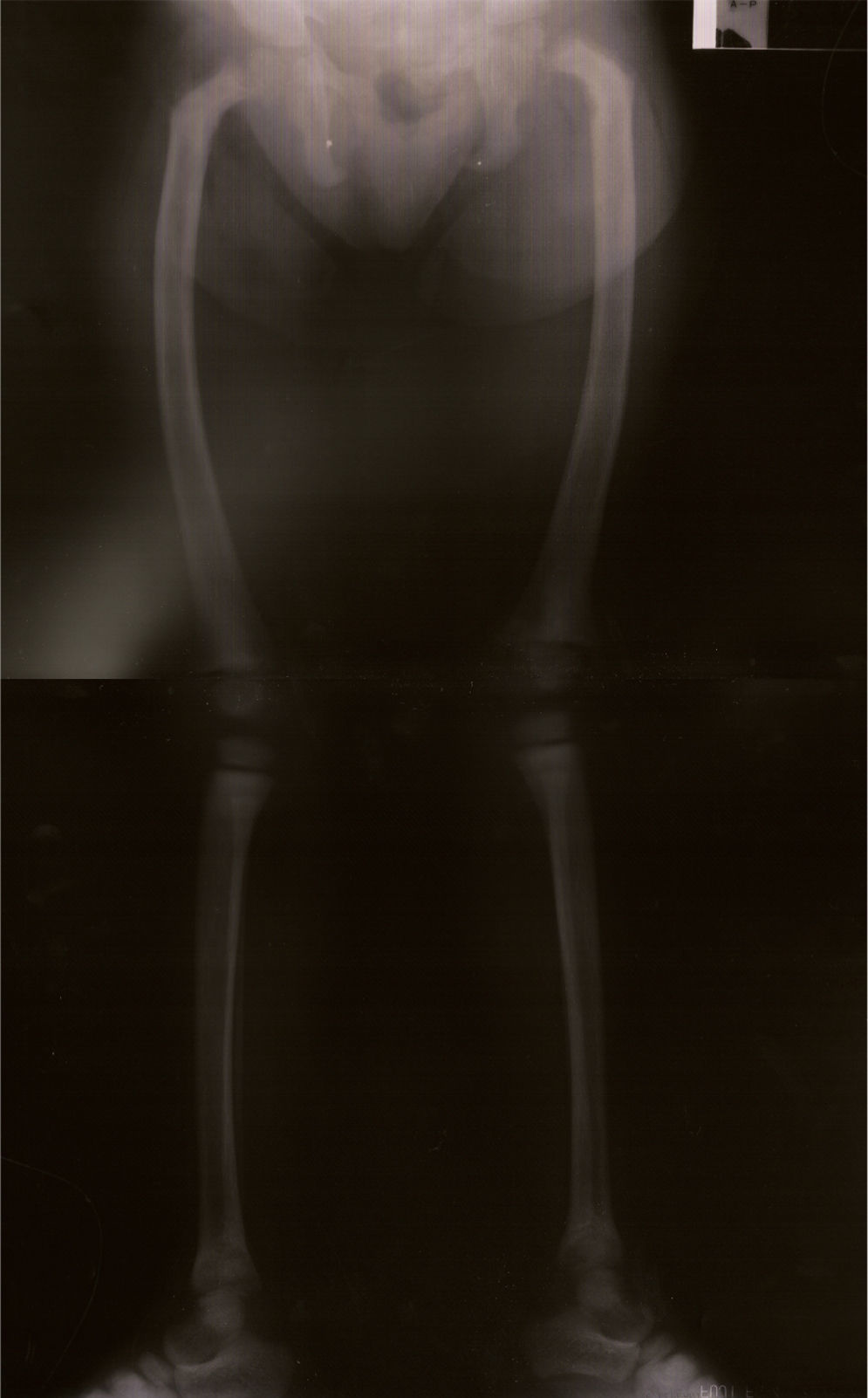
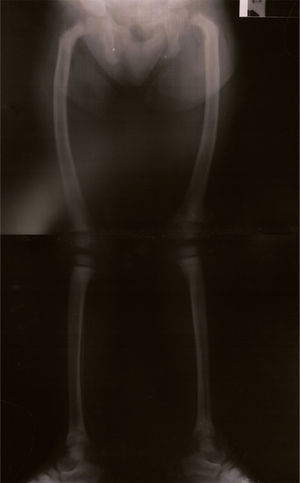
Notória a má evolução estaturo‐ponderal, com peso e estatura abaixo do percentil três, apesar de nutrição entérica nocturna contínua por sonda nasogástrica (figura 1). Ao exame objetivo apresentava sinais de raquitismo, com arqueamento dos fémures e joelhos valgos (figura 2).
A radiografia dos membros inferiores e a biopsia óssea revelaram sinais de osteodistrofia de elevado turnover, compatíveis com hiperparatiroidismo secundário, confirmado histologicamente: «osso lamelar com trabéculas de espessura e contorno muito irregulares, limitando locas preenchidas por tecido conjuntivo fibroso e sem representação de tecido hematopoiético. Constata‐se marcada atividade osteoblástica e osteoclástica. Conclusão: o quadro morfológico observado no contexto clínico é compatível com o diagnóstico de osteodistrofia renal».
Na ecografia das glândulas paratiróides, foi identificada uma pequena imagem focal com 4,7mm de diâmetro, que poderia traduzir hiperplasia ou adenoma.
Analiticamente, observava‐se anemia (hb 8,4g/dl) refratária ao tratamento com eritropoietina, ferro e ácido fólico.
Perante este quadro de HPT grave, resistente a um tratamento agressivo, com a criança em programa de hemodiálise otimizada, com 4 sessões semanais, foi decidido iniciar tratamento com paricalcitol.
Após aprovação pela Comissão de Ética e pela Comissão de Farmácia e Terapêutica da instituição hospitalar, e com o consentimento informado dos pais, com dose inicial de 0,25μg/kg três vezes por semana, por via endovenosa, aos 31 meses.
Observou‐se uma boa resposta, com descida dos níveis de iPTH (figura 3), mas ainda com valores muito elevados, pelo que ao fim de cerca de quatro semanas, se aumentou a dose para 0,5μg/kg três vezes por semana e posteriormente para 1μg/kg três vezes por semana (oito semanas depois).
A descida manteve‐se constante, com atingimento dos valores alvo cerca de oito meses após o início do tratamento com paricalcitol, altura em que foi interrompida a administração deste fármaco.
Não se registaram efeitos secundários durante este período. O cálcio sérico manteve‐se dentro dos valores recomendados nas KDOQI2 (8.8‐9.7mg/dl), tendo sido utilizada uma solução de diálise com concentração 1.25 mmol/L durante o período de tratamento com paricalcitol.
O valor do fósforo sérico foi controlado através da manipulação dietética, associada a administração de quelantes (carbonato de cálcio) e intensificação da diálise, com valores dentro dos limites recomendados (1.29 – 1.93 mmol/L)2.
Posteriormente, houve melhoria dos sinais clínicos e radiológicos esqueléticos de hiperparatiroidismo secundário e ligeira recuperação do crescimento (figura 1).
Repetiu ecografia cervical que revelou ausência de alterações sugestivas de traduzirem lesões expansivas/hiperplasia das glândulas paratiróides.
Entretanto a criança efetuou um transplante de dador cadavérico.
ComentáriosO hiperparatiroidismo secundário ocorre frequentemente em crianças com insuficiência renal crónica terminal, em diálise, podendo acarretar, nesta fase da vida consequências graves a nível do crescimento, se não for adequadamente tratado. Em casos muito graves, a estimulação prolongada das glândulas paratiroideias, pode conduzir ao crescimento desregulado destas, com libertação autónoma de hormona paratiroideia, sendo necessária a ressecção cirúrgica.
O tratamento inclui medidas dietéticas, quelantes do fósforo e vitamina D, sendo por vezes difícil e limitado pelos efeitos sobre o nível de cálcio e fósforo séricos, podendo levar a calcificação dos tecidos moles, nomeadamente a nível dos vasos sanguíneos, com consequente aumento do risco cardiovascular. A doença cardiovascular constitui actualmente a principal causa de morte em crianças e adultos jovens, que iniciaram o tratamento precoce habitual2.
A vitamina D utilizada em crianças é geralmente o calcitriol ou o 1‐α‐hidroxicolecalciferol. O paricalcitol está aprovado para utilização em adultos e crianças a partir dos cinco anos, mostrando‐se ser um fármaco muito promissor, com elevado índice de eficácia na diminuição dos valores da iPTH e bom perfil de segurança. A dose recomendada é 0,04 a 0,1μg/kg em dias alternados por via endovenosa, com aumentos de 2 a 4μg cada duas a quatro semanas, se necessário. Nas crianças mais pequenas, parecem ser necessárias doses relativamente mais elevadas2,3,9.
A experiência em pediatria é ainda reduzida, com dois estudos publicados, um estudo prospetivo duplamente cego, controlado por placebo, envolvendo 29 doentes com idade igual ou superior a 5 anos e outro estudo retrospectivo com 49 doentes com idades compreendidas entre os 18 meses e 20 anos, tratados com paricalcitol ou calcitriol9,10. Ambos os estudos mostraram que o paricalcitol foi muito eficaz e não condicionou efeitos secundários significativos a curto prazo. O segundo estudo mostrou ainda uma menor incidência de efeitos secundários, nomeadamente o aumento do produto cálcio‐fósforo, com significância estatística, no grupo tratado com paricalcitol.
No caso descrito, o hiperparatiroidismo mostrou‐se resistente ao tratamento com 1‐α‐hidroxicolecalciferol, apesar do aumento progressivo da dose até níveis supraterapêuticos. Observou‐se a subida não controlada iPTH para valores muito elevados (5500 pg/ml), associada a alterações esqueléticas importantes. Dada a gravidade deste quadro, com necessidade de intervenção imediata, e a inexistência de outras opções terapêuticas médicas, foi decidido o tratamento com um fármaco com bons resultados em adultos, mas em utilização «off‐label» em crianças.
O início do tratamento com paricalcitol numa dose elevada (0,25μg/kg, três vezes por semana) levou a uma diminuição da iPTH, embora lenta inicialmente, com melhoria da resposta à medida que a dose foi aumentada até 1μg/kg, três vezes por semana. Durante o período de tratamento intensivo com paricalcitol, a frequência da monitorização da iPTH, cálcio e fósforo séricos foi aumentada e, apesar das doses utilizadas, não se observaram efeitos secundários. A evolução clínica posterior foi também favorável.
Deste modo, o paricalcitol em altas doses foi mais eficaz que o 1‐α‐hidroxicolecalciferol no tratamento de um caso de hiperparatiroidismo grave numa criança pequena, sem efeitos secundários significativos, permitindo evitar a possível ressecção cirúrgica das glândulas paratiroideias, e mais importante que tudo, parar e reverter as alterações ósseas observadas.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflitos de interessesOs autores declaram não haver conflito de interesses.