Actualmente en España se comercializan 4 antipsicóticos depot: flufenazina, pipotiazina, zuclopentixol y risperidona. Los objetivos del presente estudio son: a) evaluar la eficacia de las formas depot y las orales de los antipsicóticos típicos y atípicos comercializados en España en pacientes diagnosticados de esquizofrenia; b) comparar la eficacia de los diferentes antipsicóticos depot, y c) evaluar el coste-efectividad de los antipsicóticos típicos y atípicos depot frente a los orales.
MétodosRevisión sistemática de la evidencia entre enero de 1980 y marzo de 2007. También se contactó con las empresas farmacéuticas que comercializan las formas depot con el objetivo de incluir los trabajos aún no publicados.
ResultadosSe incluyeron 15 trabajos (13 artículos publicados y 2 póster facilitados por farmacéuticas). La concordancia entre evaluadores fue moderada-alta. La calidad de los trabajos fue moderada-baja. No hubo diferencias en la eficacia de la risperidona depot frente a la oral. La risperidona depot sería más eficaz que la olanzapina oral (pero no habría diferencias respecto de su tolerabilidad) y más eficaz y mejor tolerada que el zuclopentixol oral. La evidencia es contradictoria al comparar la eficacia de la flufenazina depot y la oral. No habría diferencias en la eficacia de flufenazina depot frente a pimozida oral. El zuclopentixol depot sería más efectivo que el oral en el tratamiento de los pacientes con esquizofrenia y conducta violenta. Finalmente, no se encuentran diferencias en la eficacia y la tolerabilidad de la pipotiazina depot y la flufenazina depot y entre clopentixol depot y flufenazina depot.
ConclusionesHay poca evidencia científica de calidad en que se comparen antipsicóticos depot y orales o diferentes antipsicóticos depot entre sí comercializados en España. La evidencia seleccionada no permite concluir que los antipsicóticos depot sean superiors a los orales en cuanto a eficacia y tolerabilidad.
Currently in Spain, 4 depot antipsychotics are available: flufenazine, pipotiazine, zuclopentixol and risperidone. The objectives of the present study are: a) to evaluate the efficacy of depot vs. oral forms of typical and atypical antipsychotics available in Spain for treating patients with schizophrenia; b) to compare the efficacy of different depot antipsychotics; c) to evaluate cost-effectiveness of typical and atypical depot and oral antipsychotics.
MethodsSystematic review of the literature between January 1980 and March 2007. Pharmaceutical companies of depot preparations were contacted aiming to include unpublished material.
ResultsA total of 15 studies were included (13 journal manuscripts and 2 posters provided by the industry). Concordance between evaluators was moderate-high. The quality of selected studies was moderate-low. There were no differences in the efficacy between depot and oral risperidone. Efficacy of depot risperidone was higher than oral olanzapine (there were no differences regarding tolerability) and higher and better tolerated than oral zuclopentixol. The evidence was controversial when comparing the efficacy of depot and oral flufenazine. There were no differences when comparing the efficacy between depot flufenazine and oral pimozide. Depot zuclopentixol was more efficient than the oral preparation for treating patients with schizophrenia and violent behaviour. Finally, there were no differences regarding the efficacy and tolerability between depot pipotiazine and depot flufenazine and between depot clopentixol and depot flufenazine.
ConclusionsThere is few high-quality scientific evidence comparing depot and oral antipsychotics or different depot antipsychotics available in Spain. Selected evidence does not allow to conclude that depot antipsychotics are more effective and better tolerated than oral ones.
La esquizofrenia es un trastorno mental grave que genera importantes costes económicos ya que su curso es crónico y puede tener un gran impacto en la capacidad de adaptación social y la personalidad del paciente1–5. Aproximadamente una de cada cien personas sufrirá esquizofrenia a lo largo de su vida, aunque la mayor incidencia se observa en personas con edades cercanas a los 20 años6. Pese a que hay muchos factores implicados en su tratamiento, los fármacos antipsicóticos son, sin duda, un elemento clave. Además de reducir los síntomas propios del trastorno, los antipsicóticos también se utilizan como tratamiento de continuidad con el objetivo de prevenir las recaídas7. Los pacientes con esquizofrenia que no toman antipsicóticos presentan una tasa de recaídas de aproximadamente el 10% por mes8,9. Si esta tasa persiste a lo largo del tiempo, la recaída es un hecho al cabo de un año. Contrariamente, las tasas de recaída en pacientes que toman antipsicóticos son de aproximadamente un 1,5% mensual para los hospitalizados y entre un 3 y un 4% mensual para los ambulatorios9. A medida que aumenta el número de recaídas y los periodos sin tomar antipsicóticos, empeora el pronóstico y los resultados a largo plazo. Los pacientes que experimentan una recaída no recuperan su condición previa de ajuste social10.
Las presentaciones de antipsicóticos tradicionales de acción retardada (depot) fueron desarrolladas en los años sesenta en un intento de mejorar el tratamiento a largo plazo de la esquizofrenia. La principal ventaja de las presentaciones depot sobre los antipsicóticos orales es que facilitan el cumplimiento del tratamiento prescrito11. Los antipsicóticos depot aseguran concentraciones plasmáticas del principio activo más predecibles, ya que se evita la variabilidad relacionada con la absorción y la biotransformación hepática12. Además, el clínico tiene mejor control sobre el manejo del antipsicótico y, por lo tanto, está en una mejor posición para ajustarlo hasta valores óptimos. Otra ventaja, es que si el paciente pierde una inyección, por la razón que sea, no hay una discontinuación abrupta. Por lo anterior, se hace menos probable una recaída12. Entre las desventajas de los antipsicóticos depot se encuentran el dolor en el lugar de la inyección, el rechazo del paciente a ser pinchado y la sensación de estar siendo controlado13.
A pesar de que está ampliamente aceptado que las preparaciones depot favorecen el cumplimiento, el paciente puede presentar recaídas incluso cuando el cumplimiento está asegurado por la inyección; hay un gran debate sobre qué antipsicótico depot disminuye más las recaídas y los reingresos hospitalarios al compararlo con los antipsicóticos orales.
Los antipsicóticos de segunda generación o atípicos fueron desarrollados en los años ochenta, entre otras razones, para brindar un tratamiento más efectivo y tolerable para los pacientes con esquizofrenia. Estos antipsicóticos han mostrado ser, al menos, igual de efectivos que los típicos para el tratamiento de los síntomas positivos14. Además, algunos estudios han mostrado ligeras mejorías de los síntomas negativos y alguna mejoría de aspectos cognitivos15,16 que podrían reducir la posibilidad de suicidio17 y también el abuso de sustancias18. Más aún, se ha indicado que los antipsicóticos atípicos podrían ayudar a estabilizar el ánimo, tendrían propiedades ansiolíticas19 y podrían proteger contra las recaídas en mayor medida que los antipsicóticos típicos20. Sin embargo, comparado con los antipsicóticos convencionales, los atípicos son más caros.
A finales de los años noventa comienza a desarrollarse el primer antipsicótico atípico en presentación depot (risperidona) y, a la fecha, se ha establecido que resulta igual de eficaz que en su preparación oral y bien tolerado por los pacientes con esquizofrenia21–23.
Actualmente en España se comercializan 4 fármacos en forma depot: Modecate (principio activo flufenazina), Lonseren (principio activo pipotazina), Clopixol (principio activo zuclopentixol) y Risperdal (principio activo risperidona).
La siguiente revisión sistemática tiene por objetivos: a) evaluar la eficacia de las formas farmacéuticas de liberación retardada (depot) y las formas farmacéuticas orales de los antipsicóticos (típicos y atípicos) comercializados en España en pacientes con un diagnóstico de esquizofrenia; b) comparar la eficacia de los diferentes antipsicóticos depot comercializados en España entre sí en pacientes con un diagnóstico de esquizofrenia, y c) evaluar el coste-efectividad de las formas farmacéuticas depot frente a las formas farmacéuticas orales de los antipsicóticos (típicos y atípicos) comercializados en España en pacientes con un diagnóstico de esquizofrenia.
MétodosSe realizó una revisión sistemática de la literatura en las siguientes bases de datos: MEDLINE (PubMed), PSYCINFO, ISI Web of Knowledge (haciendo una búsqueda transversal en MEDLINE, Current Contents Connect, Web of Science, Zoological Records, BIOSIS Previews, Derwent Innovations Index, ISI Proceedings), Biblioteca Cochrane Plus (base de datos Cochrane de Revisiones sistemáticas, Registro de Ensayos Clínicos Aleatorizados, Health Technology Assessment Database [HTA] y NHS Economic Evaluation Database [NHS EED]) y Biological Sciences.
Además, se contactó con las empresas farmacéuticas que comercializan las formas depot en España con el fin de revisar los trabajos aún no publicados.
Se revisaron los trabajos publicados entre enero de 1980 y marzo de 2007. La estrategia de búsqueda fue la siguiente: ("Phenothiazines" [MeSH] [Phenotiazine es palabra MESH que incluye el principio activo flupenazine. Se incluyeron los dos términos para asegurar que este principio activo entrase por las dos palabras] OR "pipothiazine" [substance name] OR Clopenthixol [MeSH] [Clopenthixol es el término MESH del principio activo zuclopentixol] OR "Fluphenazine" [MeSH] OR "Risperidone" [MeSH]) AND ("Randomized Controlled Trials" [MeSH]) AND ("Schizophrenia" [MeSH]) AND ("Delayed-Action Preparations" [MeSH] OR depot).
Como análisis de sensibilidad, se realizó la misma búsqueda excluyendo el término MESH randomized controlled trial de modo de evitar perder artículos que fueran ensayos clínicos aleatorizados que no incluyesen este término como MESH.
Como medida de control, se realizó una segunda búsqueda que contaba con la supervisión de un documentalista de la entidad financiadora (AATRM). Esta estrategia de búsqueda se aplicó sólo a las bases de dato PubMed y PSYCINFO. Tras la búsqueda, no se detectó ningún trabajo no observado en la primera.
Una vez realizada la búsqueda, y tras la lectura del título y el resumen, 3 investigadoras (AF, AP y CB) seleccionaron los artículos relevantes. Para esta revisión se limitó la evaluación de la evidencia científica a los artículos que:
- 1.
Fueran ensayos clínicos aleatorizados o revisiones de coste-efectividad.
- 2.
Comparasen una forma farmacológica depot comercializada en España con cualquier otro fármaco antipsicótico oral típico o atípico.
- 3.
Incluyesen la comparación entre diferentes fármacos depot comercializados en España. Por esto, se excluyeron los artículos que, por ejemplo, comparan cualquiera de los 4 principios activos comercializados en España con el principio activo haloperidol en su forma depot o bien con flupentixol o perfenazina, ya que ninguno de los dos está aprobado por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS).
- 4.
Estuviesen escritos en inglés, francés, castellano, italiano o portugués.
- 5.
Considerasen una muestra de pacientes adultos.
- 6.
Contemplasen alguna de las siguientes medidas de resultados: uso de servicios (hospitalizaciones, visitas a urgencias), mejoría de la sintomatología (evaluada mediante cuestionarios validados como PANSS o GCI) o de los costos económicos. También se consideraron estudios que evaluasen calidad de vida, cumplimiento terapéutico o efectos secundarios como medida principal.
Como medida de control de la búsqueda realizada, se revisaron manualmente las referencias incluidas en las revisiones sistemáticas recogidas de la base de datos Cochrane.
Los artículos seleccionados fueron enmascarados (se eliminó nombre de la revista, autores, instituciones y cualquier otra información que permitiera identificarlos) y enviados a 3 expertos en metodología y esquizofrenia (JMH, VP, JB) que, de forma independiente, evaluaron la calidad de los artículos mediante la escala de 3 ítems de Jadad24. Los ítems se relacionan con la descripción de asignación aleatoria (valorada con 2 puntos), doble ciego (2 puntos) e inclusión de datos sobre abandonos y pérdidas de seguimiento (1 punto).
Además de evaluar la calidad de los artículos, los evaluadores también recogieron otros datos de los artículos utilizando un listado elaborado por el equipo investigador con el objetivo de aumentar la objetividad, la fiabilidad y la precisión. El listado incluyó lo siguiente:
- –
Referencia del artículo (número asignado para su identificación, pues estaba enmascarado).
- –
Tipo de diseño.
- –
Muestra.
- –
Media de edad.
- –
Sexo (%).
- –
Tamaño de la muestra.
- –
Principio activo, forma de administración y dosis de cada uno por separado.
- –
Medidas de resultado.
- –
Tiempo de seguimiento.
- –
Resultados (con indicadores de variabilidad y significación estadística).
- –
Escala de Jadad de evaluación de la calidad.
- –
Comentarios.
Cada evaluador experto recibió el material junto con un ejemplo completado. En caso de discrepancia entre expertos se buscó el consenso.
ResultadosLa primera búsqueda en PubMed (incluido el término MESH randomized controlled trial) dio 11 artículos como resultado. Al excluir este término MESH, la búsqueda se amplió a 135. La búsqueda en PSYCINFO dio como resultado 190 documentos. Por su parte, la búsqueda en la Librería Cochrane dio como resultado 130 documentos entre revisiones sistemáticas, ensayos clínicos y evaluaciones económicas. La búsqueda en la ISI Web of Knowledge permitió recuperar 175 documentos. La búsqueda en Biological Sciences no generó ningún resultado relevante. Finalmente, las empresas farmacéuticas consultadas nos facilitaron 21 trabajos presentados a congresos que aún no estaban publicados.
El total de documentos detectados fue 651. Tras excluir duplicados entre bases de datos y eliminar los trabajos que, por el título y el resumen, no cumplían los criterios de inclusión, se seleccionó un total de 34 documentos que claramente cumplían los criterios o que era necesario el texto completo para decidir si los cumplían o no. Estos 34 trabajos fueron enviados a los evaluadores expertos independientes.
De los 34 trabajos preseleccionados, se incluyeron 15 en esta revisión, pues cumplían con los criterios de inclusión (eran ensayos clínicos o estudios de coste-efectividad y las comparaciones contemplaban principios activos y formas de administración comercializadas en España). De estos 15 trabajos, 13 son artículos publicados en revistas científicas y 2 son póster facilitados por farmacéuticas presentados en congresos científicos que aún no están publicados. De los 13 artículos, 11 son ensayos clínicos aleatorizados y 2 son artículos de coste-efectividad. En la tabla 1 se resumen los trabajos seleccionados y la evaluación de calidad.
Trabajos seleccionados y evaluación de su calidad
| Autor (año) | Formato | Puntuación en la escala de Jadad (0-5) |
| Risperidona depot frente a oral | ||
| Bai et al26 (2006) | Artículo | 3 |
| Bai et al27 (2006) | Trabajo en forma de póster | 2 |
| Chue et al28 (2004) | Artículo | 4 |
| Risperidona depot frente a olanzapina oral | ||
| Rabinowitz et al29 (2006) | Trabajo en forma de póster | 1 |
| Flufenazina depot frente a oral | ||
| Levine et al30 (1980) | Artículo | 3 |
| Schooler et al31 (1980) | Artículo | 4 |
| Flufenazina depot frente a pimozida oral | ||
| McCreadie et al33 (1982) | Artículo | 4 |
| McCreadie et al32 (1980) | Artículo | 4 |
| Zuclopentixol depot frente a oral | ||
| Arango et al25 (2006) | Artículo | 2 |
| Depot frente a depot | ||
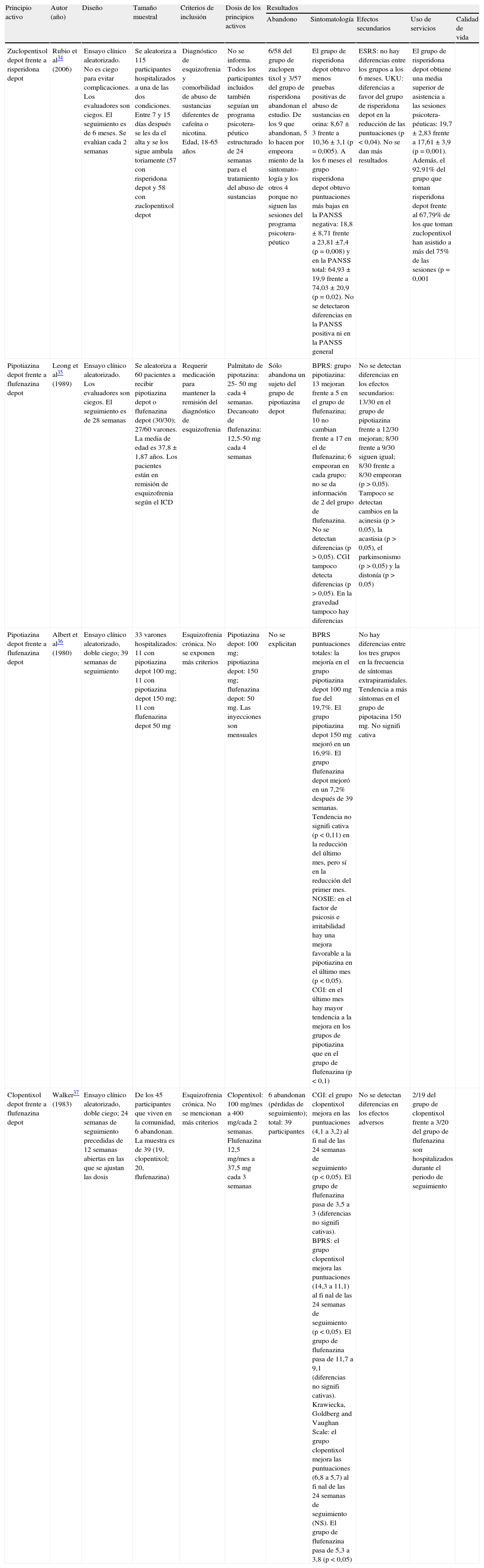
| Rubio et al34 (2006) | Artículo. Compara zuclopentixol depot con risperidona depot | 3 |
| Leong et al35 (1989) | Artículo. Compara pipotiazina depot con flufenazina depot | 2 |
| Albert et al36 (1980) | Artículo. Compara pipotiazina depot con flufenazina depot | 3 |
| Walker37 (1983) | Artículo. Compara clopentixol* depot con flufenazina depot | 3 |
| Estudios de coste-efectividad | ||
| De Graeve et al38 (2005) | Artículo. Compara risperidona depot con olanzapina oral y haloperidol depot | — |
| Yang et al39 (2005) | Artículo. Compara risperidona depot con olanzapina oral y haloperidol depot | — |
La concordancia entre los evaluadores expertos resultó moderada-alta; 12 de los 13 ensayos clínicos fueron evaluados por los 3 expertos (el artículo de Arango et al25 fue evaluado sólo por uno pues fue incluido en un momento posterior al envío de la documentación a los otros expertos). De los 12 evaluados por todos, 7 obtuvieron la misma puntuación en la escala Jadad.
De los 13 ensayos clínicos, 9 superan o igualan la puntuación mínima de calidad (3 puntos). Los 2 trabajos de costeefectividad se basaron en paneles de expertos y en revisiones sistemáticas de la literatura.
Estudios que comparan presentaciones depot con oralesEn la tabla 2 se resume la evidencia detallada recogida por los diferentes trabajos que comparan antipsicóticos depot con orales.
Tabla de evidencia. Antipsicóticos depot frente a antipsicóticos orales comercializados en España
| Principio activo | Autor (año) | Diseño | Tamaño muestral | Criterios de inclusión | Dosis de los principios activos | Resultados | ||||
| Abandono | Sintomatología | Efectos secundarios | Uso de servicios | Calidad de vida | ||||||
| Risperidona depot frente a oral | Bai et al26 (2006a) | Ensayo clínico aleatorizado. Evaluador ciego. Después de 3 meses de estabilización de la enfermedad con risperidona oral se aleatoriza a los pacientes a continuar con el tratamiento oral o cambiar a depot. Seguidos durante 12 semanas | 50 participantes; 25 risperidona oral (52%, varones; edad, 48,1 ± 14,1); 25 risperidona depot (48%, varones; edad, 44,7 ±9,2) | Pacientes hospitalizados estabilizados con un diagnóstico de esquizofrenia según el DSM- IV | Risperidona oral: se mantienen en la dosis original. Risperidona depot: se administra cada 2 semanas una dosis equivalente a la que tomaban en la forma oral (25, 37,5 o 50 mg) | Abandona 1 participante del grupo de la risperidona depot por dolor abdominal | PANSS total: diferencia antes- después. Risperidona oral, -2,4 ± 10,4. Risperidona depot, -0,16 ± 9,04). No hay diferencias. Sólo hay diferencias en la escala positiva. El grupo de risperidona depot incrementó en 0,72 ± 3,52 puntos, incremento estadísticamente significativo más grande que el cambio del grupo oral (-1,24 ± 3,8; p = 0,022). No hay diferencias en el cambio que se produce en el grupo depot y en el oral evaluado con el GAF y el CGI | UKU: diferencia antes-después El grupo de risperidona depot (-2,12 ± 3,46) disminuye más que el de risperidona oral (-0,13 ±2,17; p = 0,037). Las concentraciones de prolactina también se reducen en el grupo depot en las semanas 4 y 12 (-13,4 ± 24,5 frente a 6,7 ± 27,9 ng/ mi; p = 0,009, y -19,3 ± 19,1 frente a 3,1 ± 26,6 ng/ml; p = 0,001). AIMS: NS. BARN: NS. ESP: NS | – | Evaluado con la escala SF-36. El grupo depot muestra una mejora en el dominio función social. Los autores no muestran los datos |
| Risperidona depot frente a oral | Bai et al27 (2006). Póster | Ensayo clínico aleatorizado. Evaluador ciego. Después de 3 meses de estabilización de la enfermedad con risperidona oral se aleatoriza a los pacientes a continuar con el tratamiento oral o cambiar a depot. Seguidos durante 48 semanas (segunda parte del artículo anterior) | 50 participantes; 25 risperidona oral (el 52%, varones; edad, 48,1 ± 14,1); 25 risperidona depot (el 48%, varones; 44,7 ± 9,2) | Pacientes hospitalizados estabilizados con un diagnóstico de esquizofrenia según el DSM- IV | Risperidona oral: se mantienen en la dosis original. Risperidona depot: se administra cada 2 semanas una dosis equivalente a la que tomaban en la forma oral (25, 37,5 o 50 mg) | Abandonan 5 partici pantes. Todos del grupo risperidona depot: 2 por empeo ramiento de los síntomas, 2 por los efectos secundarios y 1 retira el consenti miento | Grupo en risperidona depot incrementa la puntuación de la escala positiva de la PANSS (0,1 frente a -1,4; p = 0,039). No se dan más resultados | UKU: el grupo depot reduce la puntuación total (-2,3 frente a -0,6; p = 0,002). El grupo depot presenta concentraciones de prolactina menores (-17,4 frente a 8,8; p < 0,001). No se dan más resultados | ||
| Risperidona depot frente a oral | Chue et al28 (2004) | Ensayo clínico aleatorizado. Doble ciego, multicéntrico. De no inferioridad (se explícita el cálculo del tamaño muestral con una potencia del 90%). Tras un periodo de 8 semanas de estabilización con risperidona oral, se aleatorizan a depot u oral. Se realiza un seguimiento de 12 semanas | 642 aleatorizados. Se pierden 2 participantes antes de comenzar el estudio; 321 con risperidona oral (el 63,3%, varones; edad, 39,9 ±0,6 años); 319 con risperidona depot (el 65,6%, varones; edad, 40,1 ± 0,6 años) | Diagnóstico de esquizofrenia según DSM-IV. PANSS > 49. Valores bioquímicos normales | Grupo risperidona oral: misma dosis que tomaban + inyección placebo cada 2 semanas. Grupo risperdiona depot: dosis oral placebo diaria + inyección de 25, 50 o 75 mg cada 2 semanas | Del grupo oral, finalizan 271 (84%); el 4,7% no finaliza por efectos adversos; un 4% no da el consenti miento. Respuesta inadecuada: un 2,5%. Del grupo risperidona depot, finalizan 256 (80%). Un 5,6% no finaliza por efectos adversos. Un 5,3% no da el consenti miento. Respuesta inadecuada: un 3,8% | PANSS total: diferencia antes- después. Risperidona oral: -6,3 ± 0,7; p < 0,001. Risperidona depot: -5,4 ± 0,7; p < 0,001. Comparación (IC del 95%, -0,9- 2,78): intervalo superior no supera el 6. No hay diferencias. CGI: antes-después. Risperidona oral: la tasa de pacientes evaluados levemente enfermos pasa del 46,9 al 57,8%. Risperidona depot: la tasa de pacientes evaluados levemente enfermos pasa del 49,2 al 57,9% | Del grupo de risperidona oral: el 59,9% informa de efectos adversos, del de risperidona depot, el 61,1%. No hay cambios en las medidas bioquímicas ni en el incremento de peso. No hay diferencias en la puntuación de ESRS (datos no disponibles). Los dos grupos presentan concentraciones de prolactina de referencia y finales elevadas. Sólo se observa una disminución signifi cativa de los valores en el grupo risperidona depot, pero ésta no se considera signifi cativa desde el punto de vista clínico. No hay diferencias en la percepción del dolor | ||
| Risperidona depot frente olanzapina oral | Rabino- witz et al29 (2006). Póster | Ensayo clínico aleatorizado. No informan sobre enmas caramiento. Explícita que es un diseño de no inferioridad, pero no hay ninguna reflexión sobre el error beta ni la potencia estadística. Son seguidos durante 53 semanas | 618 participantes. Sólo se informa que tomaban olanzapina o risperidona oral y que son aleatorizados a continuar con olanzapina o con risperidona depot | Diagnóstico de esquizofrenia o esquizoafec- tivo | Grupo olanzapina oral: 5-20 mg diarios. Grupo risperidona depot: 25-50 mg cada 2 semanas | No se explicitan | Los pacientes en el grupo risperidona depot mejoran más en la PANSS (> 20% de reducción) al mes, a las 12 semanas (OR = 2,36; IC del 95%, 1,63-3,43) y a las 53 semanas (OR = 1,46; IC del 95%, 1,09-1,95). Grupo depot mejora en los factores de la PANSS hostilidad y pensamientos desorganizados. No se dan más resultados | No hay diferencias en efectos extrapira- midales. Los pacientes en el grupo olanzapina oral subían de peso. No se dan más resultados | ||
| Flufenazina depot frente a oral | Levine et al30 (1980) | Ensayo clínico aleatorizado, doble ciego. La variable principal es la continuación o la discontinuación del tratamiento y, en segundo lugar, el tipo de medicación: depot u oral | 67 participantes son aleatorizados a discontinuar o continuar con la medicación. De los 67 participantes, 33 toman flufenazina oral y 34 flufenazina depot. De los que toman oral, el 82% (n = 23) discontinúa la medicación, mientras que de los que están en el grupo depot discontinúa el 68% (n = 27) | Diagnóstico de esquizofrenia (es la continuación de un estudio previo, de 1979) | Grupo flufenazina oral: 24 mg/ dia. Grupo flufenazina depot: 30,9 mg/3 semanas | — | — | AIMS: el grupo que discontinúa presenta más efectos secundarios. El grupo que continúa con flufenazina oral presenta más efectos secundarios que el que continúa con depot | El grupo que discontinúa recae más que el que continúa. El grupo que toma flufenazina oral (el 33% de 6 participantes) recae más que el que toma flufenazina depot (el 18% de 11 participantes) | |
| Flufenazina depot frente a oral | Schooler et al31 (1980) | Ensayo clínico aleatorizado, doble ciego. Seguimiento de 1 año. Multicéntrico. Los pacientes se estabilizan con flufenazina oral durante una semana; después se los aleatoriza | 290 pacientes: 147 grupo flufenazina oral; 143 flufenazina depot | Pacientes nuevos hospitalizados, de 18-55 años; con diagnóstico de esquizofrenia realizado por 2 psiquiatras; con una puntuación como mínimo de moderada en la escala BPRS | Grupo flufenazina oral: inyección placebo cada 3 semanas y la dosis oral (2,5 a 60 mg/día). Grupo flufenazina depot: placebo diario oral + inyección cada 3 semanas (12,5 a 100 mg) | Se excluye a 76 del estudio durante la fase intensiva. Finalmente 214 entran en la fase de mantenimiento | No hay diferencias en la sintomatología | No hay diferencias en las rehospitaliza ciones (el 35% del grupo oral frente al 26% en el grupo depot) | ||
| Flufenazina depot frente a pimozida | McCreadie et al33 (1982) | Ensayo clínico aleatorizado, doble ciego. Seguimiento durante 9 meses | 29 varones hospitalizados: 14 con pimozida oral; 15 con flufenazina depot | Estar físicamente bien. Cumplir los criterios de Feighner para el diagnóstico de esquizofre nia. Estar estabilizado según la opinión del médico y las enfermeras. Dar el consentimien to | Grupo flufenazi na depot: dosis depot equiva lente a la que tomaba + pastillas placebo. Grupo pimozida oral: inyecciones placebo + pimozida oral. El fármaco (activo o placebo) oral se administraba diariamente durante la primera semana, 4 días durante la segunda, 2 veces durante la tercera y una vez en la cuarta | Se excluye a 1 participan te antes de empezar el estudio sin exp licitarse por qué. De los 28 restantes: 5 de 13 abandonan el grupo de pimozida; 6 de 15 abandonan el grupo de flufenazina depot | Estado mental: Hamilton-Lorr Scale: sin diferencias. Depresión y ansiedad: Krawiecka Scale: sin diferencias. Wing Ward Behaviour Scale: sin diferencias | Más discinesias (evaluada por los médicos) en el grupo de pimozida (p < 0,05). Los pacientes en el grupo de pimozida perdieron más peso que los del grupo de flufenazina depot (p < 0,008). No hay diferencias en las concentra ciones de prolactina | ||
| Flufenazina depot frente a pimozida | McCrea- die et al32 (1980) | Ensayo clínico aleatorizado, doble ciego. Seguimiento durante 9 meses | 35 pacientes (9 hospitalizados y 26 en hospital de día), todos varones: 17 con pimozida oral y 18 con flufenazina depot | Estar físicamente bien. Cumplir los criterios de Feighner para el diagnóstico de esquizofre nia. Estar estabilizado según la opinión del médico y las enfermeras. Dar el consentimien to | Grupo flufenazi na depot (12,5 mg): una vez a la semana + placebo oral. Grupo pimozi da: 9 mg/4 días semana + inyección placebo | 1 participante del grupo de pimozida se excluye del estudio porque rechazó la medicación | 3/16 en el grupo de pimozida y 3/18 en el grupo de flufenazina depot tuvieron una recaída en la sintomatología positiva (evaluada por los médicos). Estado mental: Hamilton-Lorr Scale: no hay datos. Depresión y ansiedad: Krawiecka Scale: no hay datos. Wing Ward Behaviour Scale: los dos grupos empeoran en relación con el pretratamiento. No hay diferencias | Grupo pimozida: antes del tratamiento sólo 1 partici pante tomaba antiparkinsonianos, y al fi nal, 8 (p < 0,02). Grupo flufenazina depot: antes del tratamiento 5 tomaban antiparkinsonianos; luego, 6 (sin diferencias) | ||
| Zuclopentixol depot frente a oral | Arango et al25 (2006) | Ensayo clínico aleatorizado. El evaluador en ciego. Seguimiento de 1 año | 46 participan tes cumplían los criterios y son aleatorizados a oral o depot; 38/46 son varones (20, oral y 26, depot) | Criterios DSM-IV de diagnóstico de esquizofrenia. Al menos un episodio violento con una puntuación > 3 en la subescala de agresión física del cuestionario MOAS. Presencia de un familiar dispuesto a participar en la investigación y que conviva con el paciente. Consentimiento informado | Grupo zuclo pentixol depot: dosis flexible cada 2 semanas. Grupo zuclopentixol oral: flexible diaria. Los participantes toman Biperidol (oral o inyectable). Se permite tomar benzodiacepinas placebo oral. | El artículo comenta que abandonan 5 de los 46, pero se sigue mostrando n = 46. No hay diferencias en la tasa de abandono entre los dos grupos (2 del depot y 3 del oral) | 8/20 en el oral y 12/26 en eldepot tuvieron un episodio violento en el seguimiento (NS) 12/2/6 en el oral y 14/6/6 en el depot fueron evaluados como episodios no aplicables/ moderados/ graves, respecti vamente (NS). Entre los pacientes violentos (MOAS > depot tuvieron 2 durante el seguimiento: oral, n = 8 y depot, n = 12), los del grupo oral tuvieron más episodios de media al mes: 1,63 ± 1,46 frente a 0,44 ± 0,3; p = 0,034. Los pacientes del grupo depot tardaron más en tener el primer episodio violento: 2,38 ± 1,73 frente a 4,71 ± 1,73 meses (p = 0,012), y cumplieron más con el tratamiento: 6,2 ± 3,11 frente a 8,62 ± 3,43 meses (p = 0,011). No se detectan diferencias en la PANSS | 10/26 en el grupo depot y 6/20 en el grupo oral fueron hospitalizados (p = 0,55; sin diferencias) | ||
Tres trabajos comparan risperidona depot con la oral. Uno de ellos es un póster. El primer trabajo, de Bai et al26, comparó a 49 individuos hospitalizados con un diagnóstico de esquizofrenia según criterios del DSM-IV que fueron aleatorizados a las dos presentaciones de risperidona y seguidos durante 12 semanas. La medida de resultado es la reducción de síntomas (eficacia), los efectos secundarios (seguridad) y la calidad de vida (tolerabilidad). Las conclusiones de los autores son que, comparando las medidas al inicio y al final del seguimiento, la risperidona depot es más segura, pues disminuye los efectos secundarios evaluados con la escala Udvalg for Kliniske Undergolser (UKU) (-2,12 ± 3,46 frente a —0,13 ± 2,17; p = 0,037). El grupo que tomó risperidona depot también mostró una disminución de las concentraciones de prolactina a las 4 (—13,4 ± 24,5 frente a 6,7 ± 27,9 ng/ml; p = 0,009) y 12 semanas (—19,3 ± 19,1 frente a 3,1 ± 26,6 ng/ml; p = 0,001). Los pacientes que tomaron risperidona depot presentaron cambios significativos en el dominio social de la escala de calidad de vida SF-36 y aumentaron las puntuaciones (7,5 ± 20,1 frente a —11 ± 31,1; p = 0,017). No se detectaron cambios en el resto de los dominios de la SF-36. Respecto de la eficacia, los pacientes que tomaron risperidona depot presentaron empeoramiento de los síntomas positivos evaluados con la Positive and Negative Symptoms Scale (PANNS) (0,72 ± 3,52 frente a — 1,24±3,81; p=0,022). No se detectaron diferencias en el resto de las escalas.
El segundo trabajo de Bai et al27 fue realizado con 45 sujetos hospitalizados con un diagnóstico de esquizofrenia y seguidos por 48 semanas. Es el seguimiento del trabajo antes descrito. Estos datos, presentados en forma de póster, mostraron que la risperidona depot continúa mostrando una reducción de los efectos secundarios evaluados con la UKU (—2,3 frente a —0,6; p = 0,002) y de las concentraciones de prolactina (—17,4 frente a 8,8; p < 0,001). Del mismo modo, tras 48 semanas de seguimiento, el grupo que tomaba risperidona depot mostró un empeoramiento de la sintomatología positiva evaluada con la PANSS (0,1 frente a —1,4; p = 0,039).
El trabajo de Chue et al28 incluyó a 640 pacientes con esquizofrenia que, tras ser estabilizados con risperidona oral, fueron aleatorizados a la presentación oral o depot. Las medidas de resultado utilizadas evaluaron la sintomatología (eficacia) y los efectos secundarios (seguridad). Fue diseñado como un estudio de no inferioridad, donde el objetivo es no encontrar diferencias entre grupos. No se encontraron diferencias entre los grupos; ambos grupos mostraron una mejora con respecto a la medición basal. Los autores concluyen que se puede cambiar de risperidona oral a depot ya que no hay diferencias respecto de la eficacia y la tolerabilidad. Además, el dolor causado por la inyección es percibido como bajo (18-20 sobre 100 en una escala analógica).
Risperidona depot frente a olanzapina oralEl trabajo de Rabinowitz et al29, presentado como póster, es un diseño de no inferioridad donde 618 pacientes diagnosticados de esquizofrenia o trastorno esquizoafectivo que tomaban olanzapina oral fueron aleatorizados a continuar con ese tratamiento o a risperidona depot. Las medidas de resultado incluían sintomatología (eficacia) y efectos secundarios (tolerabilidad). Los autores concluyen, tras 12 meses, que había más pacientes del grupo risperidona depot que mostraban una reducción > 20% de la sintomatología evaluada con la PANSS (odds ratio [OR] = 2,36; intervalo de confianza [IC] del 95%, 1,63-3,43). Esta tendencia se mantuvo hasta el final del estudio (semana 53) (OR = 1,46; IC del 95%, 1,09-1,95). No se detectaron diferencias significativas respecto de efectos secundarios. Los autores concluyen que la risperidona depot no es inferior a la olanzapina oral a corto plazo.
Flufenazina depot frente a flufenazina oralEl trabajo de Levine et al30 es un artículo que evalúa a 67 pacientes con esquizofrenia en que se compara la descontinuación del tratamiento y su continuación en forma oral o con placebo. Las medidas de resultado son recaídas (eficacia) y efectos secundarios (tolerabilidad). Las conclusiones de los autores son que las recaídas son más frecuentes en el grupo que descontinúa que en el grupo que continúa el tratamiento. Al comparar los grupos que continúan el tratamiento (n = 27), el grupo que continúa con medicación depot recae menos que el que continúa con medicación oral (el 67,65 frente al 81,81%). El grupo que tomaba flufenazina depot presentó menor proporción de movimientos involuntarios que el grupo que tomaba flufenazina oral.
El trabajo de Schooler et al31 es un artículo que evaluó a 214 participantes aleatorizados, tras un periodo de tratamiento con flufenazina oral, a flufenazina oral o depot. Las medidas de resultado eran efectos secundarios (tolerabilidad) y la probabilidad de recaídas (eficacia). Los autores concluyen que no hay diferencias en estas dos medidas de resultado.
Flufenazina depot frente a pimozida oralEn el primer trabajo de McCreadie et al32, se comparó a 35 varones a tratamiento con flufenazina depot o pimozida oral. Para asegurar el doble ciego, los pacientes que tomaban pimozida oral recibieron una inyección placebo y los del grupo flufenazina depot, una pastilla placebo. Las medidas de resultado fueron el estado mental del paciente (eficacia), la conducta prosocial (eficacia) y los efectos secundarios (tolerabilidad). Los autores concluyen que no se observaron diferencias entre los dos grupos en la proporción de recaídas. Al realizar comparaciones intragrupo se observó que los pacientes que tomaban pimozida oral requirieron de un fármaco antiparkinsoniano (1 comparado con 8; p < 0,02). No se detectó este cambio en el grupo de flufenazina depot (5 comparado con 6). Tampoco se detectaron cambios en la conducta prosocial.
En el segundo trabajo de McCreadie33, se comparó a 29 varones estabilizados previamente con neurolépticos que luego fueron aleatorizados a tomar pimozida de manera intermitente o flufenazina depot. Para asegurar el doble ciego, los pacientes que tomaban pimozida oral recibieron una inyección placebo y los del grupo flufenazina depot, una pastilla placebo. Las medidas de resultado fueron el estado mental, los efectos secundarios y las recaídas. Los autores no observaron diferencias entre los grupos en cuanto a recaídas. Sin embargo, el grupo que tomaba pimozida oral presentó un aumento de discinesias (p < 0,05) y más pérdida de peso (p < 0,05).
Zuclopentixol depot frente a zuclopentixol oralEl trabajo de Arango et al25 fue realizado en 46 pacientes con esquizofrenia e historia previa de violencia aleatorizados a tratamiento con zuclopentixol depot u oral. La medida de resultado principal fue la reducción de episodios de violencia informados por un familiar que completaba un autorregistro diario con las conductas violentas del paciente. Además, la violencia fue evaluada con la Modification Overt Agression Scale (MOAS). También se consideraron, como medidas de resultado, la sintomatología (eficacia) y los efectos secundarios (tolerabilidad). Los autores concluyen que no se observaron diferencias respecto de la sintomatología, los episodios de violencia (gravedad y frecuencia). Sin embargo, observaron diferencias a favor del grupo que recibía zuclopentixol depot, en el subgrupo con puntuación > 2 en la subescala de agresión física de la MOAS. En este subgrupo, los que recibían zuclopentixol depot tenían una media de episodios violentos mensuales menor que los que tomaban zuclopentixol oral (0,44 ± 0,3 frente a 1,63 ± 1,46; p = 0,034). En la muestra total, se observaron diferencias a favor de los que recibían zuclopentixol depot en el número de meses transcurridos desde el inicio del estudio hasta el primer episodio violento (4,71 ± 1,73 frente a 2,83 ± 1,75; p = 0,012) y en el número de meses de cumplimiento terapéutico (8,62 ± 3,43 frente a 6,2 ± 3,11; p = 0,011). Respecto de la eficacia, no se observaron diferencias entre grupos en la puntuación de la subescala de síntomas positivos de la PANSS. Los autores no mencionan datos de otras subescalas. Con respecto a la tolerabilidad, los autores sólo describen el porcentaje de participantes de ambos grupos que fueron hospitalizados y el número de hospitalizaciones. No detectaron diferencias entre grupos en estas medidas (p = 0,55 y p = 0,98 respectivamente).
Comparación entre formas depotEn la tabla 3 se resume la evidencia de los 4 estudios que comparaban dos fármacos depot entre sí y que cumplieron los criterios de selección (ensayo clínico aleatorizado y comercializados en España).
Tabla de evidencia. Antipsicóticos depot frente a antipsicóticos depot comercializados en España
| Principio activo | Autor (año) | Diseño | Tamaño muestral | Criterios de inclusión | Dosis de los principios activos | Resultados | ||||
| Abandono | Sintomatología | Efectos secundarios | Uso de servicios | Calidad de vida | ||||||
| Zuclopentixol depot frente a risperidona depot | Rubio et al34 (2006) | Ensayo clínico aleatorizado. No es ciego para evitar complicaciones. Los evaluadores son ciegos. El seguimiento es de 6 meses. Se evalúan cada 2 semanas | Se aleatoriza a 115 participantes hospitalizados a una de las dos condiciones. Entre 7 y 15 días después se les da el alta y se los sigue ambula toriamente (57 con risperidona depot y 58 con zuclopentixol depot | Diagnóstico de esquizofrenia y comorbilidad de abuso de sustancias diferentes de cafeína o nicotina. Edad, 18-65 años | No se informa. Todos los participantes incluidos también seguían un programa psicotera- péutico estructurado de 24 semanas para el tratamiento del abuso de sustancias | 6/58 del grupo de zuclopen tixol y 3/57 del grupo de risperidona abandonan el estudio. De los 9 que abandonan, 5 lo hacen por empeora miento de la sintomato- logía y los otros 4 porque no siguen las sesiones del programa psicotera- péutico | El grupo de risperidona depot obtuvo menos pruebas positivas de abuso de sustancias en orina: 8,67 ± 3 frente a 10,36 ± 3,1 (p = 0,005). A los 6 meses el grupo risperidona depot obtuvo puntuaciones más bajas en la PANSS negativa: 18,8 ± 8,71 frente a 23,81 ±7,4 (p = 0,008) y en la PANSS total: 64,93 ± 19,9 frente a 74,03 ± 20,9 (p = 0,02). No se detectaron diferencias en la PANSS positiva ni en la PANSS general | ESRS: no hay diferencias entre los grupos a los 6 meses. UKU: diferencias a favor del grupo de risperidona depot en la reducción de las puntuaciones (p < 0,04). No se dan más resultados | El grupo de risperidona depot obtiene una media superior de asistencia a las sesiones psicotera- péuticas: 19,7 ± 2,83 frente a 17,61 ± 3,9 (p = 0,001). Además, el 92,91% del grupo que toman risperidona depot frente al 67,79% de los que toman zuclopentixol han asistido a más del 75% de las sesiones (p = 0,001 | |
| Pipotiazina depot frente a flufenazina depot | Leong et al35 (1989) | Ensayo clínico aleatorizado. Los evaluadores son ciegos. El seguimiento es de 28 semanas | Se aleatoriza a 60 pacientes a recibir pipotiazina depot o flufenazina depot (30/30); 27/60 varones. La media de edad es 37,8 ± 1,87 años. Los pacientes están en remisión de esquizofrenia según el ICD | Requerir medicación para mantener la remisión del diagnóstico de esquizofrenia | Palmitato de pipotazina: 25- 50 mg cada 4 semanas. Decanoato de flufenazina: 12,5-50 mg cada 4 semanas | Sólo abandona un sujeto del grupo de pipotiazina depot | BPRS: grupo pipotiazina: 13 mejoran frente a 5 en el grupo de flufenazina; 10 no cambian frente a 17 en el de flufenazina; 6 empeoran en cada grupo; no se da información de 2 del grupo de flufenazina. No se detectan diferencias (p > 0,05). CGI tampoco detecta diferencias (p > 0,05). En la gravedad tampoco hay diferencias | No se detectan diferencias en los efectos secundarios: 13/30 en el grupo de pipotiazina frente a 12/30 mejoran; 8/30 frente a 9/30 siguen igual; 8/30 frente a 8/30 empeoran (p > 0,05). Tampoco se detectan cambios en la acinesia (p > 0,05), la acastisia (p > 0,05), el parkinsonismo (p > 0,05) y la distonía (p > 0,05) | ||
| Pipotiazina depot frente a flufenazina depot | Albert et al36 (1980) | Ensayo clínico aleatorizado, doble ciego; 39 semanas de seguimiento | 33 varones hospitalizados: 11 con pipotiazina depot 100 mg; 11 con pipotiazina depot 150 mg; 11 con flufenazina depot 50 mg | Esquizofrenia crónica. No se exponen más criterios | Pipotiazina depot: 100 mg; pipotiazina depot: 150 mg; flufenazina depot: 50 mg. Las inyecciones son mensuales | No se explicitan | BPRS puntuaciones totales: la mejoría en el grupo pipotiazina depot 100 mg fue del 19,7%. El grupo pipotiazina depot 150 mg mejoró en un 16,9%. El grupo flufenazina depot mejoró en un 7,2% después de 39 semanas. Tendencia no signifi cativa (p < 0,11) en la reducción del último mes, pero sí en la reducción del primer mes. NOSIE: en el factor de psicosis e irritabilidad hay una mejora favorable a la pipotiazina en el último mes (p < 0,05). CGI: en el último mes hay mayor tendencia a la mejora en los grupos de pipotiazina que en el grupo de flufenazina (p < 0,1) | No hay diferencias entre los tres grupos en la frecuencia de síntomas extrapiramidales. Tendencia a más síntomas en el grupo de pipotacina 150 mg. No signifi cativa | ||
| Clopentixol depot frente a flufenazina depot | Walker37 (1983) | Ensayo clínico aleatorizado, doble ciego; 24 semanas de seguimiento precedidas de 12 semanas abiertas en las que se ajustan las dosis | De los 45 participantes que viven en la comunidad, 6 abandonan. La muestra es de 39 (19, clopentixol; 20, flufenazina) | Esquizofrenia crónica. No se mencionan más criterios | Clopentixol: 100 mg/mes a 400 mg/cada 2 semanas. Flufenazina 12,5 mg/mes a 37,5 mg cada 3 semanas | 6 abandonan (pérdidas de seguimiento); total: 39 participantes | CGI: el grupo clopentixol mejora en las puntuaciones (4,1 a 3,2) al fi nal de las 24 semanas de seguimiento (p < 0,05). El grupo de flufenazina pasa de 3,5 a 3 (diferencias no signifi cativas). BPRS: el grupo clopentixol mejora las puntuaciones (14,3 a 11,1) al fi nal de las 24 semanas de seguimiento (p < 0,05). El grupo de flufenazina pasa de 11,7 a 9,1 (diferencias no signifi cativas). Krawiecka, Goldberg and Vaughan Scale: el grupo clopentixol mejora las puntuaciones (6,8 a 5,7) al fi nal de las 24 semanas de seguimiento (NS). El grupo de flufenazina pasa de 5,3 a 3,8 (p < 0,05) | No se detectan diferencias en los efectos adversos | 2/19 del grupo de clopentixol frente a 3/20 del grupo de flufenazina son hospitalizados durante el periodo de seguimiento | |
Rubio et al34 presentan los resultados de un estudio que evaluó la eficacia de la risperidona depot comparada con el zuclopentixol depot en un total de 115 participantes con esquizofrenia en comorbilidad con abuso de sustancias. La medida de resultado principal fue la presencia de sustancias en la orina y un cuestionario de complicaciones debidas al abuso de sustancias. Otras medidas de resultado fueron la sintomatología (eficacia) y los efectos secundarios (tolerabilidad). Todos los sujetos recibieron, además, tratamiento psicológico. Los autores concluyeron que los individuos del grupo risperidona presentaron menos tests de orina positivos que los del grupo zuclopentixol (8,67 ± 3 frente a 10,36 ± 3,1; p = 0,005), una mejoría mayor en la subescala de sintomatología negativa de la PANSS (18,80 ± 8,71 frente a 23,81 ± 4,7; p = 0,008), en la subescala general (32,02 ± 9,71 frente a 37,62 ± 11,82; p = 0,05) y en la subescala total (64,93 ± 19,9 frente a 74,03 ± 20,9; p = 0,02). Además, un 89% de los que recibían risperidona frente a un 50% de los que recibían zuclopentixol presentaban una reducción del 20% en la escala PANSS (p < 0,0001). Es decir, la risperidona depot se mostró más eficaz en la reducción de síntomas que el zuclopentixol depot.
El grupo que recibía risperidona también mostró menos efectos secundarios evaluados con la escala UKU (p = 0,04) y requirió menos fármacos antiparkinsonianos (p < 0,01). Además, los pacientes que recibieron risperidona cumplieron más con el tratamiento psicológico; asistieron a una media de 19,7 ± 2,83 sesiones frente a 17,6 ± 3,9 del grupo de zuclopentixol (p = 0,001). El total de sesiones previstas era 24. Por otro lado, un 92,9% del grupo risperidona asistió a más del 75% de las sesiones frente a una asistencia del 67,8% del grupo zuclopentixol (p = 0,001).
El trabajo de Leong et al35 comparó pipotiazina con flufenazina (ambas depot) administradas a una muestra de 60 pacientes, asignados aleatoriamente al tratamiento, con esquizofrenia según la International Classification of Diseases (ICD). Las medidas de resultado fueron la sintomatología (eficacia) y los efectos secundarios (tolerabilidad). Los autores no encontraron diferencias significativas entre grupos.
Albert et al36 realizaron un estudio en una muestra de 33 varones hospitalizados con diagnóstico de esquizofrenia y estabilizados con clorpromazina durante 2 meses y luego aleatorizados a pipotiazina o flufenazina (ambas depot). Las medidas de resultado fueron la sintomatología (eficacia) y los efectos secundarios (tolerabilidad). Los autores no encontraron diferencias en la sintomatología general evaluada con la Brief Psychiatric Rating Scale (BPRS), la Nurses Observation Scale for Inpatient Evaluation (NOSIE) y la Clinical Global Impression (CGI). Pese a estas conclusiones, el grupo que recibía pipotiazina mostró una tendencia superior a la mejoría. Tampoco se encontraron diferencias entre grupos en la presencia de síntomas secundarios evaluados con la Extrapyramidal Evaluation Scale y analíticas.
Finalmente, el trabajo de Walker37 comparó clopentixol depot con flufenazina depot en una muestra de 45 pacientes diagnosticados de esquizofrenia crónica seguidos durante 24 semanas y aleatorizados al tratamiento. Las medidas de resultado fueron la sintomatología (eficacia) y los efectos secundarios (tolerabilidad). Los autores no encontraron diferencias entre estos grupos.
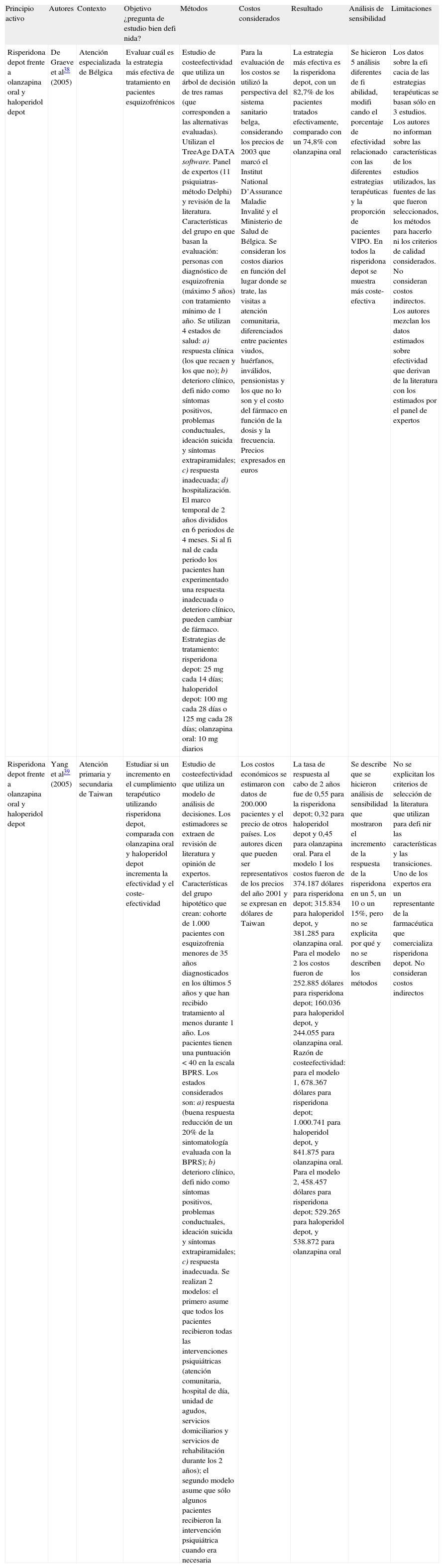
Los estudios farmacoeconómicosEn la tabla 4 se resume la evidencia de los 2 estudios de coste-efectividad seleccionados y que evaluaron el costeefectividad de la risperidona depot frente a otros fármacos orales y depot.
Tabla de evidencia. Estudios farmacoeconómicos
| Principio activo | Autores | Contexto | Objetivo ¿pregunta de estudio bien defi nida? | Métodos | Costos considerados | Resultado | Análisis de sensibilidad | Limitaciones |
| Risperidona depot frente a olanzapina oral y haloperidol depot | De Graeve et al38 (2005) | Atención especializada de Bélgica | Evaluar cuál es la estrategia más efectiva de tratamiento en pacientes esquizofrénicos | Estudio de costeefectividad que utiliza un árbol de decisión de tres ramas (que corresponden a las alternativas evaluadas). Utilizan el TreeAge DATA software. Panel de expertos (11 psiquiatras-método Delphi) y revisión de la literatura. Características del grupo en que basan la evaluación: personas con diagnóstico de esquizofrenia (máximo 5 años) con tratamiento mínimo de 1 año. Se utilizan 4 estados de salud: a) respuesta clínica (los que recaen y los que no); b) deterioro clínico, defi nido como síntomas positivos, problemas conductuales, ideación suicida y síntomas extrapiramidales; c) respuesta inadecuada; d) hospitalización. El marco temporal de 2 años divididos en 6 periodos de 4 meses. Si al fi nal de cada periodo los pacientes han experimentado una respuesta inadecuada o deterioro clínico, pueden cambiar de fármaco. Estrategias de tratamiento: risperidona depot: 25 mg cada 14 días; haloperidol depot: 100 mg cada 28 días o 125 mg cada 28 días; olanzapina oral: 10 mg diarios | Para la evaluación de los costos se utilizó la perspectiva del sistema sanitario belga, considerando los precios de 2003 que marcó el Institut National D’Assurance Maladie Invalité y el Ministerio de Salud de Bélgica. Se consideran los costos diarios en función del lugar donde se trate, las visitas a atención comunitaria, diferenciados entre pacientes viudos, huérfanos, inválidos, pensionistas y los que no lo son y el costo del fármaco en función de la dosis y la frecuencia. Precios expresados en euros | La estrategia más efectiva es la risperidona depot, con un 82,7% de los pacientes tratados efectivamente, comparado con un 74,8% con olanzapina oral | Se hicieron 5 análisis diferentes de fi abilidad, modifi cando el porcentaje de efectividad relacionado con las diferentes estrategias terapéuticas y la proporción de pacientes VIPO. En todos la risperidona depot se muestra más coste-efectiva | Los datos sobre la efi cacia de las estrategias terapéuticas se basan sólo en 3 estudios. Los autores no informan sobre las características de los estudios utilizados, las fuentes de las que fueron seleccionados, los métodos para hacerlo ni los criterios de calidad considerados. No consideran costos indirectos. Los autores mezclan los datos estimados sobre efectividad que derivan de la literatura con los estimados por el panel de expertos |
| Risperidona depot frente a olanzapina oral y haloperidol depot | Yang et al39 (2005) | Atención primaria y secundaria de Taiwan | Estudiar si un incremento en el cumplimiento terapéutico utilizando risperidona depot, comparada con olanzapina oral y haloperidol depot incrementa la efectividad y el coste-efectividad | Estudio de costeefectividad que utiliza un modelo de análisis de decisiones. Los estimadores se extraen de revisión de literatura y opinión de expertos. Características del grupo hipotético que crean: cohorte de 1.000 pacientes con esquizofrenia menores de 35 años diagnosticados en los últimos 5 años y que han recibido tratamiento al menos durante 1 año. Los pacientes tienen una puntuación < 40 en la escala BPRS. Los estados considerados son: a) respuesta (buena respuesta reducción de un 20% de la sintomatología evaluada con la BPRS); b) deterioro clínico, defi nido como síntomas positivos, problemas conductuales, ideación suicida y síntomas extrapiramidales; c) respuesta inadecuada. Se realizan 2 modelos: el primero asume que todos los pacientes recibieron todas las intervenciones psiquiátricas (atención comunitaria, hospital de día, unidad de agudos, servicios domiciliarios y servicios de rehabilitación durante los 2 años); el segundo modelo asume que sólo algunos pacientes recibieron la intervención psiquiátrica cuando era necesaria | Los costos económicos se estimaron con datos de 200.000 pacientes y el precio de otros países. Los autores dicen que pueden ser representativos de los precios del año 2001 y se expresan en dólares de Taiwan | La tasa de respuesta al cabo de 2 años fue de 0,55 para la risperidona depot; 0,32 para haloperidol depot y 0,45 para olanzapina oral. Para el modelo 1 los costos fueron de 374.187 dólares para risperidona depot; 315.834 para haloperidol depot, y 381.285 para olanzapina oral. Para el modelo 2 los costos fueron de 252.885 dólares para risperidona depot; 160.036 para haloperidol depot, y 244.055 para olanzapina oral. Razón de costeefectividad: para el modelo 1, 678.367 dólares para risperidona depot; 1.000.741 para haloperidol depot, y 841.875 para olanzapina oral. Para el modelo 2, 458.457 dólares para risperidona depot; 529.265 para haloperidol depot, y 538.872 para olanzapina oral | Se describe que se hicieron análisis de sensibilidad que mostraron el incremento de la respuesta de la risperidona en un 5, un 10 o un 15%, pero no se explicita por qué y no se describen los métodos | No se explicitan los criterios de selección de la literatura que utilizan para defi nir las características y las transiciones. Uno de los expertos era un representante de la farmacéutica que comercializa risperidona depot. No consideran costos indirectos |
De Graeve et al38 realizaron un análisis de coste-efectividad comparando risperidona depot, olanzapina oral y haloperidol depot desde la perspectiva del sistema sanitario de Bélgica durante un periodo de 2 años. Los autores concluyen que la risperidona depot es más coste-efectiva que los otros dos fármacos.
Por último, el trabajo de Yang et al39 estudió cómo el uso de risperidona depot frente a olanzapina oral y haloperidol depot mejoraba el cumplimiento y, en consecuencia, la eficacia y el coste-efectividad del fármaco. Los autores concluyen que la risperidona depot es más coste-efectiva que la olanzapina oral y el haloperidol depot en el tratamiento de la esquizofrenia en el grupo de pacientes cuya enfermedad se encontraba estabilizada y el diagnóstico tenía entre 1 y 5 años de evolución. Es importante señalar que en este trabajo se detecta un posible conflicto de intereses, ya que uno de los expertos que participó en el estudio trabajaba para la industria farmacéutica que fabrica la risperidona depot.
Resumen de las conclusiones de las revisiones sistemáticas de la colaboración CochraneComo medida de control, se seleccionaron y revisaron 4 metaanálisis de la colaboración Cochrane que contemplaban los 4 principios activos objeto de esta revisión en su forma depot.
La revisión de David et al40: "Decanoato y enantato de flufenazina de depósito para la esquizofrenia" (2004; traducción al castellano, 2007) comparó cualquiera de estas dos formas con el placebo, otro antipsicótico depot o bien una forma oral. Además, comparó diferentes dosis de flufenazina depot. Respecto de las conclusiones sobre la comparación depot-oral y depot-depot de los fármacos comercializados en España, encontramos que los autores compararon la forma depot de flufenazina con antipsicóticos orales utilizando mayoritariamente trabajos publicados con anterioridad a 1980 (nuestra revisión no consideró publicaciones anteriores a enero de 1980). Además, cuando los autores analizaron trabajos que compararon flufenazina depot con otro fármaco depot, básicamente lo hicieron comparando con haloperidol depot, que no se comercializa en España. Las conclusiones respecto de la flufenazina depot son que parece no tener ninguna ventaja sobre la preparación oral o sobre otros fármacos depot en la utilización de servicios o en la sintomatología. Pese a esto, parece causar menos efectos adversos que los antipsicóticos orales.
La revisión de Dinesh et al41 (2004; traducción al castellano, 2007): "Palmitato y undecilenato de pipotiazina de depósito para la esquizofrenia" comparó cualquiera de estos dos con otro antipsicótico depot, o bien una forma oral y entre diferentes dosis de pipotiazina. Cabe destacar la utilización de trabajos anteriores a 1980. Respecto de las conclusiones relativas a la comparación entre depot-oral y depot-depot de los principios activos comercializados en España, los autores concluyen que la pipotiazina depot no es estadísticamente diferente de otras preparaciones depot. Las comparaciones con fármacos orales tampoco informan si la pipotiazina depot tiene alguna ventaja o desventaja.
La revisión sobre la risperidona depot realizada por Hosalli et al42 (2003; traducción al castellano de 2007) se centró en evaluar la evidencia de risperidona depot frente a placebo o su presentación oral. Respecto de este último grupo, cabe destacar que la mayoría de los trabajos incluidos al respecto son comunicaciones realizadas en congresos científicos publicadas como suplementos de revistas o bien material cedido por farmacéuticas implicadas en la comercialización del fármaco. Los autores concluyen que no hay evidencia suficiente para apoyar la superioridad de la risperidona depot sobre la oral.
Por último la revisión "Decanoato de zuclopentixol para la esquizofrenia y otras enfermedades mentales graves", de Coutinho et al43 (1999; traducción al castellano, 2007), sólo considera estudios que comparan zuclopentixol con placebo o bien con haloperidol depot o flupentixol depot (que no se comercializan en España).
DiscusiónLa revisión realizada ha constatado que no hay suficiente evidencia científica que apoye el hecho de que los antipsicóticos depot tengan una eficacia mayor que los antipsicóticos orales. Además, la calidad de los trabajos seleccionados es baja-moderada; la principal limitación de los artículos es que no se describe en detalle el proceso de aleatorización o bien que la comparación de la forma depot con la oral no es a doble ciego.
Por otro lado, hay dos artículos que explicitan que el tipo de diseño es de "no inferioridad". En este sentido, hace falta una nota metodológica: al realizarse un diseño de no inferioridad o de equivalencia el punto clave del estudio es la potencia, es decir la diferencia entre 1 y el error beta o de tipo II. El error beta se relaciona con no rechazar la hipótesis nula cuando realmente es falsa y, por eso, si el objetivo del estudio es no encontrar diferencias, se ha de intentar minimizar. Los estudios que explicitan que se trata de un diseño de no inferioridad deberían hacer explícita esta reflexión. Teniendo en cuenta que los errores alfa y beta están relacionados, si se ha marcado un alfa de 0,05, todo hace pensar que no se ha realizado esta reflexión. Igualmente, los artículos que no encuentran diferencias, pero que se han centrado en el error alfa, lo único que pueden afirmar con certeza es que no pueden rechazar la hipótesis nula, lo que, metodológicamente, no quiere decir que se acepte. Tan sólo en uno de los estudios seleccionados se realiza esta reflexión28. El estudio de Rabinowitz et al29 no lo explicita. A pesar de todo, el formato del estudio, comunicación en forma de póster, ha podido condicionar esta reflexión.
Risperidona depotHay poca evidencia en lo que se refiere a la risperidona depot y la que existe es contradictoria. Dos de los estudios concluyen que el fármaco depot se ha mostrado más seguro que el fármaco oral en la reducción de los efectos secundarios, pero ambos artículos presentan datos del mismo estudio, pero en dos momentos temporales diferentes, a las 12 y las 48 semanas. El primero de ellos, explicita que la risperidona depot sería más segura en la prevención de la laxitud, la sequedad de boca y el incremento de las concentraciones de prolactina. El segundo, en forma de póster, no explicita en qué efectos secundarios se muestra más efectiva la risperidona depot. Por otro lado, el trabajo de Chue et al28 no detecta diferencias entre las formas depot y oral. El trabajo de Rabinowitz que compara la risperidona depot con la olanzapina oral tampoco detecta diferencias. Los dos trabajos de Bai et al26,27 apuntan hacia una superioridad de la forma depot, aunque también detectan que la forma depot conlleva un incremento de la sintomatología positiva evaluada con la PANSS.
La revisión realizada por la Cochrane concluye lo mismo que nosotros: hay pocos estudios rigurosos y la evidencia disponible hasta el momento no nos permite afirmar que, en el caso de la risperidona, una forma sea mejor que la otra.
Sólo un trabajo compara la risperidona depot con otro antipsicótico en forma depot: el zuclopentixol34. Ese estudio apunta que la risperidona se muestra superior al zuclopentixol cuando la medida de resultado es la reducción del abuso de sustancias. De todos modos, la calidad de ese trabajo es moderada-baja, ya que no es un estudio a doble ciego ni describe el proceso de aleatorización. Además, los participantes en el estudio también recibían tratamiento psicológico, lo que puede estar confundiendo los resultados.
En lo que se refiere al coste-efectividad, la risperidona depot se ha mostrado superior a la risperidona oral, el haloperidol depot y la olanzapina oral. Sin embargo, es necesario destacar que se trata de evaluaciones basadas en paneles de expertos y revisiones sistemáticas, con importantes limitaciones: básicamente no explicitan cómo se ha realizado la revisión de la literatura y no tienen en cuenta los costes indirectos. Además, están realizados en contextos de sistemas sanitarios muy diferentes del español. La generalización a nuestro contexto no está aconsejada.
Flufenazina depotLos dos trabajos que comparan las formas depot y oral de flufenazina presentan, metodológicamente, una calidad moderada-alta. Sin embargo, son inconsistentes. Mientras que el trabajo de Levine et al30 concluye que la forma depot es superior que la oral cuando se trata de prevenir recaídas, el trabajo de Schooler et al31 concluye que no hay diferencias. De todos modos, el estudio de Levine no tenía como objetivo comparar las formas depot y oral, sino los efectos de la discontinuación del tratamiento. Además, la muestra final se reduce a 27 sujetos (10 frente a 17), con lo cual es difícil extraer conclusiones. Por su parte, la revisión realizada por la Cochrane concluye que la forma depot es más segura cuando se trata de prevenir efectos secundarios.
Los estudios que comparan la flufenazina depot con la pimozida oral intermitente han quedado desfasados ya que actualmente la pimozida no se recomienda por los efectos secundarios que produce.
Comparada con otros principios activos también en presentación depot, como el clopentixol o la pipotiazina, la flufenazina no ha mostrado su superioridad en la reducción de sintomatología o la prevención de efectos secundarios o recaídas.
Resumiendo, no hay suficiente evidencia científica para afirmar que la flufenazina depot sea superior a otros antipsicóticos, orales o depot.
Pipotiazina depotNo se ha seleccionado ningún trabajo que compare la pipotiazina depot con otro antipsicótico oral, ya que éstos eran anteriores a 1980.
Los dos artículos incluidos en esta revisión que comparan la pipotiazina depot con la flufenazina depot no han encontrado diferencias significativas.
Zuclopentixol depotLos tres artículos seleccionados que evalúan el zuclopentixol tienen una calidad moderada-baja. El trabajo de Arango et al25 que compara el zuclopentixol oral con el depot tiene como objetivo ver cuál es más eficaz cuando el resultado principal es reducir conductas violentas. A pesar de que la forma depot presenta una ligera superioridad comparada con la forma oral, la manera de valorar la conducta violenta, mediante autorregistros realizados por un familiar, puede adolecer de falta de validez. De todos modos, los pacientes que tomaban la forma depot se adhirieron más a la medicación, lo que puede suponer una ventaja y su recomendación en pacientes con un diagnóstico de esquizofrenia y conducta violenta.
El estudio que compara la forma depot de zuclopentixol con la forma depot de flufenazina no detecta diferencias. Como ya se ha comentado, la comparación entre las formas depot de zuclopentixol y de risperidona apunta hacia una mayor eficacia de la risperidona cuando el objetivo es la reducción del abuso de sustancias.
Como en los casos anteriores, se dispone de poca evidencia de calidad que nos permita afirmar que el zuclopentixol depot se muestra claramente superior a la forma oral o a otras formas depot.
AgradecimientosLos autores agradecemos la valiosa colaboración de Cecilia Bustos, Beatriz del Pino, Ana Merino, Antoni Parada, Víctor Pérez y Jordi Blanch.
FinanciaciónAgencia de Evaluación de Tecnologías e Investigación Médica (AATRM).