El trastorno bipolar es considerado, al igual que la mayoría de los trastornos psiquiátricos, una enfermedad del neurodesarrollo. Durante dicho período, existe una marcada tasa de nacimiento y muerte neuronal. En el caso particular de los procesos que determinan la muerte neuronal, es sabido que aquellas neuronas que establecen conexiones sinápticas aberrantes deben ser eliminadas del sistema nervioso central. El trastorno bipolar cursa con un déficit de interneuronas GABAérgicas en la corteza cerebral, acompañado de una sobreexpresión de genes proapoptóticos, así como una alteración en la expresión de moléculas que median la migración de dichas neuronas y su inclusión en sinapsis funcionales durante el estadío fetal. Aquí será revisado el rol de dichas moléculas sobre las vías de muerte neuronal por apoptosis en la procura de establecer hipótesis biológicas de la génesis del trastorno bipolar.
Bipolar disorder, like the majority of psychiatric disorders, is considered a neurodevelopment disease of neurodevelopment. There is an increased rate of neuronal birth and death during this development period. In the particular case of the processes that determine neuronal death, it is known that those neurons that establish connections have to be removed from the central nervous system. There is a deficit of GABAergic interneurons in the cerebral cortex in bipolar disorder, accompanied by overexpression of proapoptic genes. There is also an alteration in the expression of molecules that mediate in the migration of these neurons and their inclusion in functional synapsis during the foetal stage. The role of these molecules in the neuronal death pathways by apoptosis will be reviewed here in an attempt to establish biological hypotheses of the genesis of bipolar disorder.
El trastorno bipolar es considerado en la actualidad una enfermedad del neurodesarrollo1,2, que cursa con una considerable pérdida de calidad de vida y facultades cognitivas a mediano plazo. Las teorías que sustentan esta hipótesis representan las aproximaciones más acertadas en la búsqueda de los orígenes moleculares de los trastornos psiquiátricos,3,4 luego de haber sido identificadas la alteración en la expresión de diferentes genes que promueven la migración de interneuronas GABAérgicas desde su sitio de origen hasta su localización final en circuitos corticales específicos. En el trastorno bipolar, existe un déficit de 27% de interneuronas en la corteza cerebral5 e hipocampo6,7, además de una alta expresión de genes proapoptóticos8,9 como Bax, BAD, caspasa-9 y caspasa-3; y un descenso en la expresión de genes antiapoptóticos como BDNF y Bcl-29. Las interneuronas al momento de migrar requieren de la señalización de moléculas extracelulares que mediarán de forma sinérgica el traslado y la posterior incorporación de estas a circuitos neuronales específicos. La hipótesis del protomapa plantea que una neurona desde su nacimiento cuenta con instrucciones genéticas definidas referentes al lugar exacto de migración y conexiones sinápticas que establecerá al incluirse en circuitos funcionales10, de tal manera que al incorporarse erráticamente a dichos circuitos establecerán conexiones sinápticas anormales que procurarán su muerte11,12. La muerte neuronal representa un fenómeno necesario en el sistema nervioso central que determina el número exacto de células que conformarán circuitos neuronales específicos. A pesar que la muerte neuronal está presente a lo largo de la vida en un sujeto normal, en el neurodesarrollo se multiplica su intensidad debido a la alta tasa de neurogénesis suscitada en este período. Existen al menos 3 tipos de muerte neuronal conocidos, a saber, apoptosis, autofagia y necrosis. Al referirnos a la enfermedad mental y a la presencia de muerte neuronal en la misma, nos adentramos en un intenso debate donde finalmente prevalece la incertidumbre de investigaciones aisladas y reduccionistas, carentes de una visión global. Recientemente ha sido identificada la activación de elementos proapoptóticos como la caspasa 3 en algunas formas neuronales posterior a la abolición de conexiones sinápticas a través de la axotomía13, haciendo de la apoptosis la forma de muerte neuronal más atractiva a la hora de justificar el déficit de interneuronas en la corteza cerebral del sujeto bipolar. De cualquier manera, las interneuronas en su proceso de migración requieren de la acción de moléculas que promueven la supervivencia celular, presentando estas una alteración en su expresión que confieren riesgo a padecer la enfermedad (ver más adelante). En este artículo de revisión serán analizados tres de los elementos involucrados en la migración de interneuronas GABAérgicas que han sido vinculadas con el trastorno bipolar, a saber, el BDNF, Nrg1 y Reelina; además de las vías proapoptóticas que desencadenan su anormal expresión.
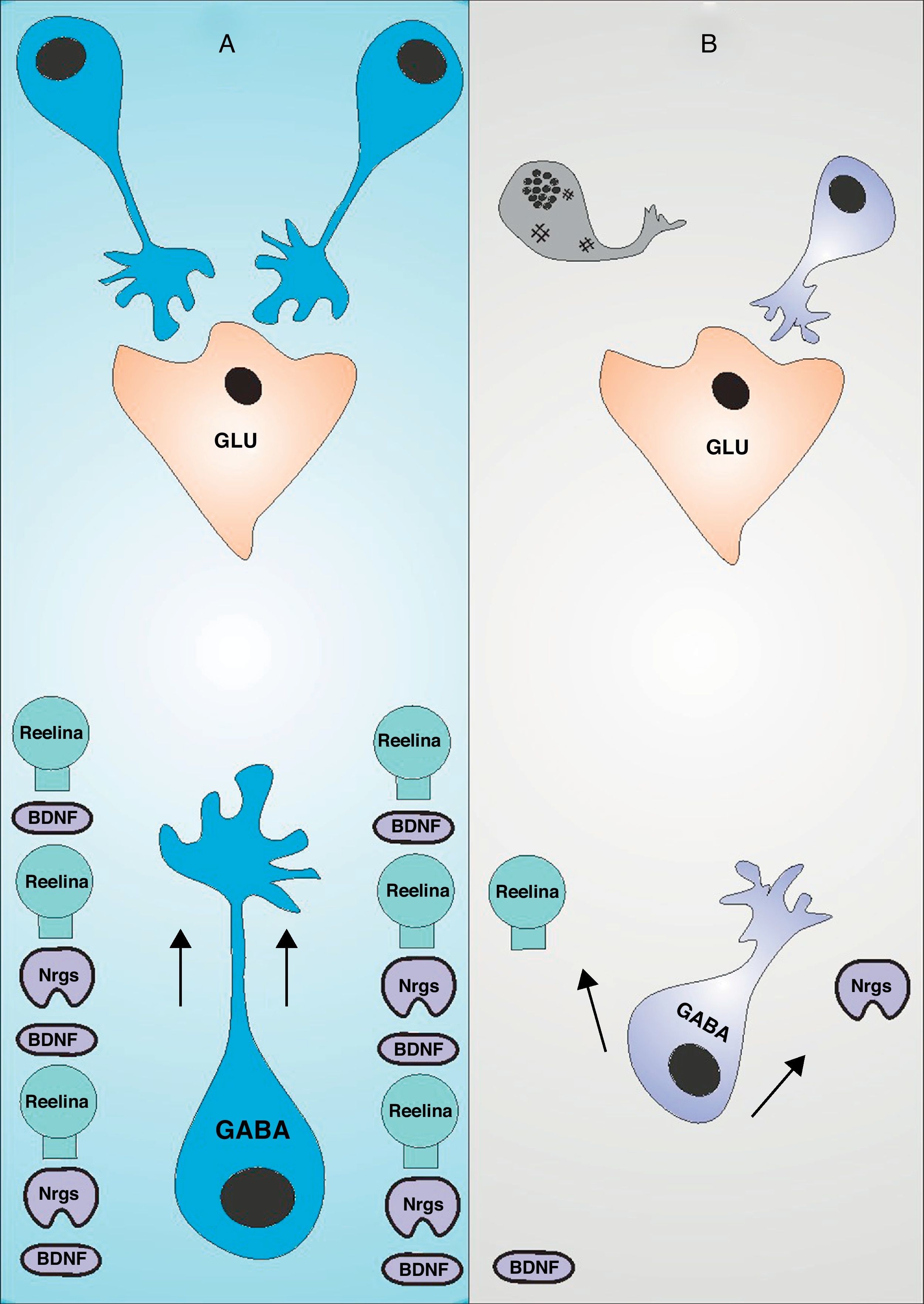
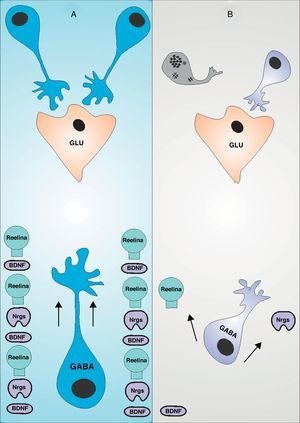
Migración de interneuronas GABAérgicas y trastorno bipolarLa migración de interneuronas GABAérgicas es un complejo proceso mediado por la expresión de cientos de genes de forma sinérgica, ejecutando un fino control que no solo garantiza la correcta migración, sino la completa maduración en la procura de alcanzar una apropiada inclusión en un circuito inhibitorio específico (fig. 1 A). El BDNF (Brain Derived Neurotrophic Factor) juega un rol cardinal en la migración a la corteza de las interneuronas GABAérgicas durante el neurodesarrollo, una molécula que se presenta en déficit en el trastorno bipolar14. En roedores con expresión nula del receptor del BDNF, el TrkB, presentan una reducción de la migración tangencial en el período embrionario15. La producción de BDNF está sujeta a la expresión de moléculas de naturaleza sináptica como la Calcium-dependent activator protein for secretion 2 (CAPS2)16, de tal manera que en la medida en que se establezcan conexiones sinápticas eficaces se aumentará la producción de CAPS32 y consecuentemente de BDNF17. Una vez realizada la migración tangencial a la corteza cerebral, las interneuronas requieren de la señalización de moléculas extracelulares para llevar a cabo la migración radial. La Reelina es una glicoproteína secretada por las células de Cajal Retzius que se une a receptores específicos en la membrana de la interneurona para promover la migración radial18. Los estudios de roedores con expresión nula para el gen de la Reelina ponen en evidencia su importancia en la configuración laminar de la corteza cerebral. Usualmente las neuronas más jóvenes detienen su proceso migratorio en las láminas más profundas, mientras que las neuronas adultas lo hacen en las láminas superficiales. En modelos de expresión nula para Reelina este proceso se invierte19, por lo tanto, a pesar que no se afecta directamente la migración tangencial y radial, las interneuronas llegan a un lugar incorrecto debido a que las láminas corticales están invertidas20–22. Algunas variantes del gen de la Reelina han sido identificadas como factor de riesgo para desarrollar trastorno bipolar en el sexo femenino23, y un descenso de su expresión conllevaría al mismo resultado en ambos sexos24, además, algunos antidepresivos y antipsicóticos, fármacos de uso frecuente en el trastorno bipolar, aumentan la expresión de Reelina en la corteza prefrontal25. Recientemente fue identificada una relación directa entre alteraciones en la expresión del gen de la Reelina y el déficit de interneuronas GAD positivas26 (Glutamic Acid Decarboxylase), alcanzando hasta un 40% de déficit los pacientes bipolares27. La Neuregulin 1 (Nrg1) es una familia de factores de crecimiento extracelular que requiere de la expresión de su receptor ErbB sobre la superficie de la membrana celular de la interneurona durante la migración28, activando un amplio espectro de segundos mensajeros que culminan en la activación de factores de transcripción en el núcleo neuronal. Algunas variantes polimórficas de Nrg1 predisponen a la aparición de trastorno bipolar con síntomas psicóticos29 y en estudios de roedores con mutación para este gen, se evidencia una reducción de la migración de interneuronas a la corteza cerebral28.
Migración de interneuronas en el trastorno bipolar: (A) Muestra la influencia del BDNF, la reelina y la Nrg1 sobre la migración de interneuronas GABAérgicas, de tal manera que su correcta expresión determinará la correcta inclusión a un circuito inhibitorio, compuesto en su mayoría por neuronas piramidales glutamaérgicas15,20,28. (B) La reducción en la expresión de dichas moléculas no solo procuran alteraciones en la dirección de la migración de las interneuronas GABAérgicas, sino una maduración insuficiente de las mismas, que traducirá una inclusión aberrante al circuito inhibitorio y consecuentemente la muerte por apoptosis12.
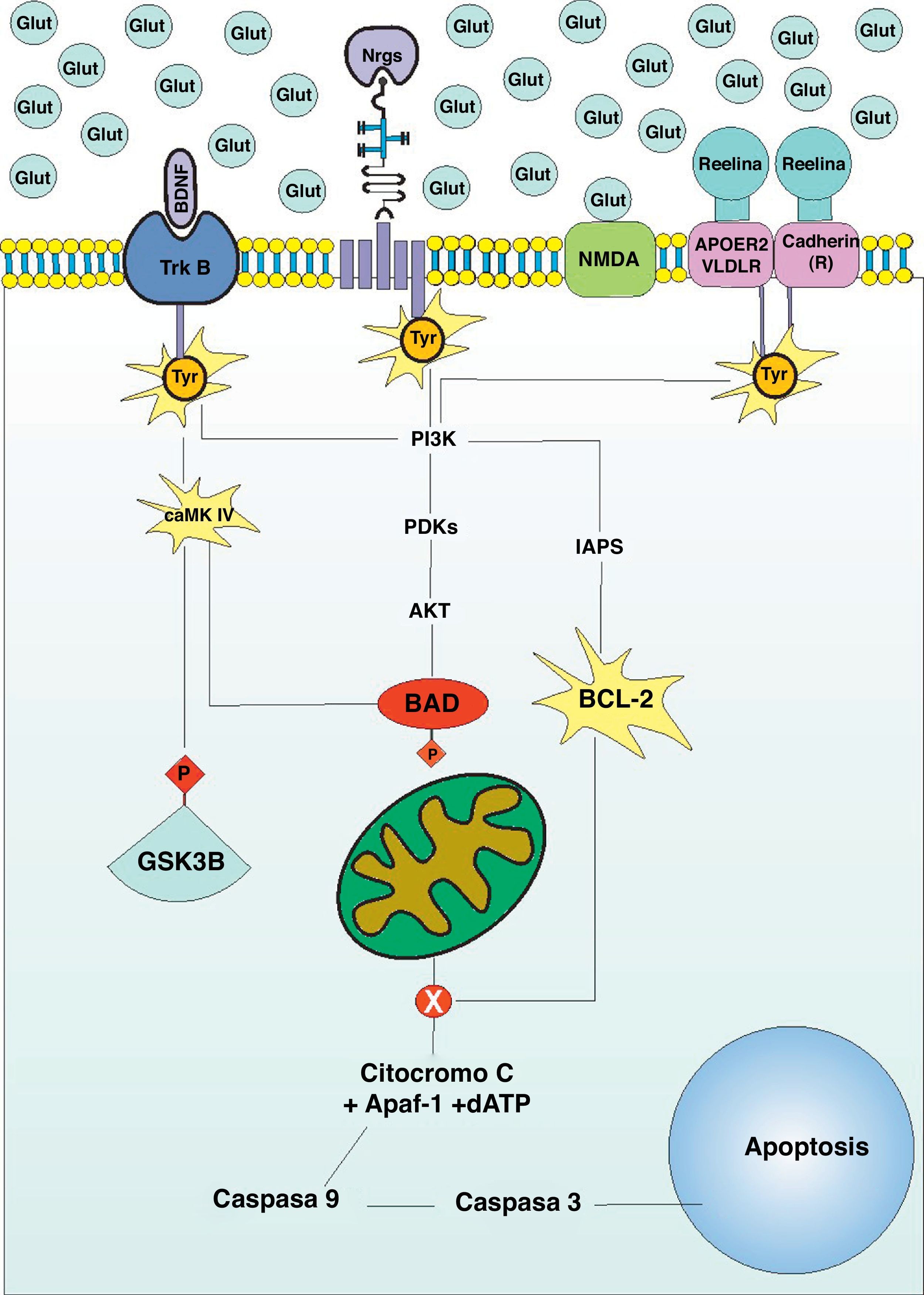
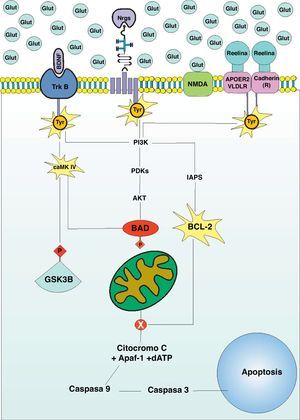
Luego del proceso migratorio, las interneuronas GABAérgicas deben incorporarse a circuitos neuronales para llevar a cado un rol determinado. Debido a que los procesos moleculares que median la migración promueven también la maduración de las interneuronas, y que algunas de estas moléculas se encuentran en déficit en el cerebro del sujeto bipolar, al incorporarse a dicho circuito no dispondrá de la diferenciación necesaria para establecer conexiones sinápticas funcionales. Cualquiera sea el caso, que la interneurona llegue a un lugar incorrecto o que llegue al lugar correcto y establezca conexiones sinápticas aberrantes, dichas neuronas deben ser eliminadas del cerebro en desarrollo, como parte de un proceso normal de refinamiento sináptico (fig. 1B). Debido a que la corteza prefrontal del paciente bipolar presenta una expresión alta de moléculas proapoptóticas como BAD, Bax, caspasa 3 y 9, y de una reducción de la expresión de moléculas antiapoptóticas como Bcl-28, proponemos a la apoptosis como el modelo de muerte celular durante el neurodesarrollo del sujeto bipolar, justificando así el déficit de interneuronas existente en estos pacientes. La apoptosis es desencadenada a través de dos vías, la vía extrínseca, que es activada por ligandos de la familia del factor de necrosis tumoral, que al unirse a su receptor en la superficie neuronal promueve la activación de la caspasa 8, que activará sucesivamente a las caspasas 3, 6 o 7, induciendo finalmente la apoptosis. La vía intrínseca o mitocondrial es activada por la salida de varias moléculas del espacio intermembranoso mitocondrial al citoplasma neuronal. La principal de estas moléculas es el Citocromo C, quien forma un complejo con Apaf-1 y el nucleosoma dATP denominado apoptosoma. Una vez formado, este complejo activa a la caspasa 9, quien finalmente activará a la caspasa 3 para desencadenar apoptosis (fig. 2). El trastorno bipolar tiene relación con la vía intrínseca de la apoptosis luego de haber identificado anormalidades en la estructura mitocondrial en pacientes portadores de la enfermedad30, además de una alteración en la cadena de transporte electrónico31. El BDNF, Nrg1 y Reelin, no solo toman partida en la migración de interneuronas GABAérgicas a la corteza cerebral, sino que inducen la maduración de dichas neuronas para promover su inclusión a circuitos neuronales específicos. Una vez ahí, estas moléculas ejecutan funciones diversas en la mediación de conexiones sinápticas y su señalización intracelular culmina en la promoción de la supervivencia neuronal a través de vías antiapoptóticas. Además, la señalización intracelular de estas tres moléculas depende de la correcta actividad sináptica en la neurona en que se encuentran. El BDNF no solo promueve el trofismo dendrítico y axonal32, sino que el grado de actividad sináptica mediada por receptores NMDA favorece el desarrollo dendrítico mediado por BDNF a través de un efecto sinérgico33, promoviendo finalmente la conectividad entre neuronas34. El BDNF promueve la actividad de calmodulin-dependent protein kinase ii (CaMKII)35, una proteína que induce plasticidad sináptica, favoreciendo la supervivencia celular a través de mecanismos antiapoptóticos36. La CaMKII promueve la fosforilación e inhibición de la Glycogen synthase kinase-3 (GSK-3), así como la inactivación de BAD, ambos mediadores de la apoptosis, reacción dependiente de la despolarización neuronal37,38. Además, recientemente se determinó que el cerebro del paciente bipolar presenta una alta expresión de BAD y una baja expresión de BDNF8, así como una disminución de mRNA CaMKII en la corteza prefrontal39. La Reelina, a pesar de ser una proteína de la matriz extracelular, posee un rol determinante en la maduración sináptica durante el neurodesarrollo40,41. Además, su activación promueve la supervivencia neuronal al desencadenar la vía intracelular AKT/PI3-K, fosforilando e inactivando finalmente a BAD, una molécula inductora de apoptosis42. Recientemente fue demostrado que la inhibición de AKT/PI3-K produce apoptosis dependiente de caspasas43, una vía común para las tres moléculas en estudio que presentan una expresión anormal en el cerebro del sujeto bipolar (ver arriba). Finalmente, la Nrg 1 y su receptor ErbB-4 interactúan directamente con estructuras sinápticas como PSD-95 y algunas subunidades del receptor NMDA favoreciendo su activación44,45, y el grado de actividad neuronal determina su expresión predominantemente durante el neurodesarrollo46, requiriendo de la despolarización eléctrica para el clivaje proteolítico de su precursor localizado en la membrana neuronal47. Al agonizar su receptor, la Nrg1 promueve la señalización intracelular de segundos mensajeros que culminan en la activación de factores de trascripción que mediarán la supervivencia celular a través de PI3K/AKT y Bcl-248,49 (fig. 2), siendo esta última una molécula antiapoptótica por naturaleza, cuya expresión se encuentra reducida en cerebros de pacientes bipolares50.
Vías antiapoptóticas deficientes en el trastorno bipolar: los receptores para el BDNF, Nrg1 y Reelina son moléculas transmembrana asociadas a un residuo de tirosina. La activación del TrkB induce la fosforilación de GSK-B y su consecuente salida del complejo de destrucción, así como la fosforilación e inactivación de BAD, una molécula que promueve la vía intrínseca de la apoptosis. Tanto el TrkB como el receptor de la Nrg1 promueven la activación del PI3K, que culmina en la inactivación de BAD48,49. Por su parte, la actividad del receptor de la reelina promueve la activación de BCL-2, quien evita la salida del Citocromo C de la mitocondria42.
Aproximadamente un 75% del total de las neuronas existentes durante el neurodesarrollo mueren como parte de un proceso normal de refinamiento sináptico. La evidencia científica apunta a la apoptosis como la forma de muerte neuronal más atractiva para sustentar dicho fenómeno. Las interneuronas GABAérgicas han sido objeto de estudio en diversas patologías psiquiátricas como el trastorno depresivo mayor, el trastorno bipolar y la esquizofrenia. En el caso particular del trastorno bipolar, existe una reducción acentuada de dichas interneuronas en la corteza prefrontal e hipocampo, un déficit que no se acompaña de hallazgos anatomopatológicos de muerte neuronal en el cerebro adulto, lo que sugiere que dichas neuronas murieron durante el neurodesarrollo, tratándose de la exacerbación anormal de un proceso normal de muerte neuronal masiva.
El trastorno bipolar cursa con un debut típico al inicio de la adultez, momento en el que el cerebro está siendo sometido a cambios estructurales y funcionales determinados en su mayoría por la actividad hormonal. El déficit de interneuronas GABAérgicas en la corteza cerebral del sujeto bipolar representaría entonces un elemento que se originó en el estadío fetal con una traducción clínicamente relevante al inicio de la adultez, pasando inadvertida durante la infancia y parte de la adolescencia. Es sabido que el trastorno bipolar genera deterioro cognitivo, el cual persiste incluso en estado de eutimia51,52 y quien parece tener una vinculación directamente proporcional al tiempo de duración del episodio maniaco53 y al curso crónico de la enfermedad54. Si bien es cierto, estos hallazgos sugieren que el trastorno bipolar es una enfermedad neurodegenerativa, sus bases neurofisiológicas pudieran originarse en alteraciones del neurodesarrollo, generando un déficit de interneuronas GABAérgicas que desencadenará un estado deshinibitorio a largo plazo, con la consiguiente exitotoxicidad neuronal55.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.