La esquizofrenia es una enfermedad crónica que suele ir acompañada de trastornos metabólicos como la diabetes, la obesidad y problemas cardiovasculares asociados muchas veces a estilos de vida poco saludables, así como a problemas neuroendocrinos ocasionados por la propia enfermedad. Los cambios en el estilo de vida, como la práctica de ejercicio físico regular, tienen un efecto positivo sobre los trastornos metabólicos y la salud mental. Sin embargo, se desconocen los cambios moleculares y su consecuente repercusión en los pacientes diagnosticados con esquizofrenia. Con este estudio se pretenden analizar los cambios moleculares inducidos por el ejercicio físico en pacientes crónicos con esquizofrenia.
MétodosVeintiún pacientes con esquizofrenia crónica fueron sometidos a un programa de entrenamiento aeróbico diario durante 6 meses. El grupo de pacientes se dividió en 2 subgrupos: un subgrupo que completó en su totalidad el programa de entrenamiento (12 pacientes) y un segundo subgrupo que abandonó el programa el primer día (9 pacientes). Se analizaron los datos bioquímicos y clínicos de cada paciente y se estudió el perfil proteómico del plasma mediante ESI-LC-MS/MS de tipo shotgun.
ResultadosEl análisis proteómico reconoció 21.165 proteínas y péptidos diferentes en el plasma de los pacientes. Concretamente, 4.657 proteínas sufrieron variaciones significativas, de las cuales fueron identificadas 1.812 proteínas relacionadas con las vías metabólicas y de regulación biológica. Tras el análisis de los parámetros clínicos en estos pacientes, se encontraron diferencias significativas en el peso, el IMC, el perímetro abdominal, la presión arterial diastólica y los niveles de colesterol HDL. La puntuación en la Escala de Autoevaluación de Anhedonia fue el cambio más significativo, siendo más elevada en el subgrupo que abandonó el programa de entrenamiento en comparación con el subgrupo activo.
ConclusiónLos beneficios del ejercicio físico son claros en pacientes crónicos con esquizofrenia, ya que mejoran sustancialmente su IMC, así como sus parámetros clínicos y bioquímicos. Además, este estudio desvela las vías biológicas y moleculares afectadas por el ejercicio físico en la esquizofrenia. A nivel molecular, se identificaron las proteínas ApoE y ApoC, que están implicadas en vías metabólicas; la tenascina y las neurotrofinas, asociadas a la regulación neuronal; la lipocalina 2 y la proteína 14-3-3, involucradas en las vías de regulación neuroinflamatorias, y las proteínas espectrinas y anexinas del citoesqueleto de las células. La comprensión de estos mecanismos moleculares abre la puerta al estudio de estas proteínas asociadas a la cronicidad de la esquizofrenia.
Schizophrenia is a chronic illness often accompanied by metabolic disorders, diabetes, obesity and cardiovascular problems often associated with unhealthy lifestyles, as well as neuroendocrine problems caused by the disease itself. Lifestyle changes, such as regular physical exercise, have a positive effect on metabolic disorders and mental health, although the molecular changes that occur in this type of patient and how they explain the changes in their response are unknown. This study wants to analyze in a novel way the proteins and molecular pathways involved in critical plasmatic proteins in plasma to reveal the pathways involved in the implementation of physical exercise and the changes that occur among patients who participate in such programs with those who leave.
MethodsTwenty-one patients with chronic schizophrenia underwent a daily, 6-month aerobic training program. We divided them into a group that completed the program (12 patients) and a second group that left the training program (9 patients). The biochemical and clinical data of each patient were analyzed and the proteomic profile of the plasma was studied using ESI-LC-MS/MS.
ResultsProteomic analysis recognizes 21.165 proteins and peptides in each patient, of which we identified 1,812 proteins that varied between both groups linked to the metabolic and biological regulation pathways. After clinical analysis of each patient we found significant differences in weight, BMI, abdominal perimeter, diastolic blood pressure, and HDL cholesterol levels. The main change that vertebrates both groups is the Self-Assessment Anhedonia Scale, where we detected higher levels in the dropout group (no physical activity) compared to the active group.
ConclusionThe benefits of physical exercise are clear in chronic patients with schizophrenia, as it substantially improves their BMI, as well as their clinical and biochemical parameters. However, our study reveals the biological and molecular pathways that affect physical exercise in schizophrenia, such as important metabolic proteins such as ApoE and ApoC, proteins involved in neuronal regulation such as tenascin and neurotrophins, neuroinflammatory regulatory pathways such as lipocalin-2 and protein 14-3-3, as well as cytoskeleton proteins of cells such as spectrins and annexines. Understanding these molecular mechanisms opens the door to future therapies in the chronicity of schizophrenia.
La esquizofrenia es una enfermedad mental grave caracterizada por trastornos de la percepción y el pensamiento1. Los pacientes diagnosticados con esquizofrenia tienen una menor esperanza de vida debido a la mortalidad prematura asociada a las comorbilidades somáticas intrínsecas de este trastorno2,3. Además, el deterioro cognitivo es muy significativo entre estos pacientes, involucrando varios dominios como la función ejecutiva, el lenguaje, la cognición social, la memoria y la atención1. Las intervenciones dinámicas, como la actividad física regular, generan un efecto positivo sobre los trastornos metabólicos (síndrome metabólico, riesgo cardiovascular, obesidad y diabetes) y la salud mental (depresión y funcionamiento social y cognitivo)4. Sin embargo, los pacientes crónicos con esquizofrenia tienden a llevar estilos de vida muy sedentarios, muchas veces debido a la falta de confianza en sí mismos, los cambios de humor, las comorbilidades y el poco apoyo social5,6, así como a los propios cambios neuronales subyacentes a la esquizofrenia. Además, los fármacos antipsicóticos, terapia de referencia en la esquizofrenia, a menudo se asocian con una variedad de efectos secundarios metabólicos asociados a su propio mecanismo de acción, esto es, al bloqueo de los receptores dopaminérgicos7,8.
En los pacientes con esquizofrenia, el ejercicio físico induce pequeñas mejoras en la memoria de trabajo y en la cognición social, aunque no induce mejoras significativas en otras funciones afectadas, como la velocidad de procesamiento y la memoria verbal y visual9. El éxito de estos programas de ejercicios aplicados a pacientes crónicos con esquizofrenia se logra manteniendo la rutina, asegurando que los pacientes disfruten de la actividad y estimulando su motivación10. La actividad física regular induce cambios funcionales, estructurales y neurobiológicos en el cerebro que mejoran no solo la cognición social, sino también los síntomas negativos (anhedonia, aislamiento social, apatía y abolición)11–13. Recientemente se ha identificado la irisina, una molécula liberada en el músculo bajo actividad física y que se correlaciona con beneficios en el cerebro14. La liberación de irisina se produce tras el corte proteolítico extracelular de la proteína FNDC5. Esto significa que el perfil proteico que hay en el medio extracelular es crucial para alcanzar efectos beneficiosos sobre el cerebro, justificando las diferencias que hay entre pacientes cuando se les aplica un mismo programa de neurorrehabilitación basado en la actividad física. Aunque es muy difícil relacionar cambios plasmáticos con las funciones del cerebro, dada la complejidad estructural y la permeabilidad selectiva de la barrera hematoencefálica, esta es una línea de investigación que está adquiriendo una gran relevancia. Asimismo, determinar si los cambios en los perfiles proteómicos plasmáticos provocan diferentes respuestas moleculares permitiría entender las diferentes respuestas de los pacientes a programas similares15,16.
Los pacientes crónicos con esquizofrenia presentan cambios metabólicos y moleculares característicos y anexos a la propia enfermedad. Estos cambios moleculares son a menudo los culpables de los muchos problemas cardiometabólicos que se han observado a lo largo de los años en esta población de pacientes, tales como la reducción de su esperanza de vida media en 10 años y los altos porcentajes de obesidad, diabetes y problemas cardíacos graves. Es por ello que, basándonos en el análisis mediante cromatografía líquida en tándem de espectrometría de masas (LC-ESI-MS/MS) de tipo shotgun, queremos analizar la expresión global de proteínas plasmáticas en pacientes crónicos con esquizofrenia17,18 y, con ello, establecer cuáles son las vías biológicas y moleculares afectadas por la actividad física en estos pacientes.
En este contexto, el objetivo principal del estudio fue caracterizar la dinámica molecular y metabólica de los pacientes crónicos con esquizofrenia bajo un programa de ejercicio físico. El estudio fue realizado con base en una técnica novedosa de análisis masivo del proteoma (LC-ESI-MS/MS) en combinación con un estudio clínico exhaustivo, con el objetivo de proporcionar información integral del efecto de la actividad física en la biología de la esquizofrenia. Es importante destacar que es altamente complejo combinar el estudio proteómico con la ejecución de un programa de actividad física durante 6 meses en pacientes con un curso crónico de esquizofrenia, lo que repercute en el tamaño muestral (21 participantes en total).
Dado que 9 de los 21 pacientes con esquizofrenia seleccionados para el ensayo no se presentaron nunca a ninguna sesión de entrenamiento, fueron tomados como grupo control.
Tanto al grupo de estudio como al control se les evaluó la anhedonia con la Escala de Autoevaluación de Anhedonia (SAAS). Por ello añadimos como objetivo secundario comparar el perfil molecular de los 12 pacientes del programa con el de los 9 pacientes control.
Material y métodosSe realizó un estudio longitudinal en 21 pacientes crónicos diagnosticados de esquizofrenia, 12 realizaron el programa de entrenamiento y 9 fueron el grupo control. Durante el programa de entrenamiento físico los participantes tuvieron que caminar una hora al día durante 5 días a la semana, aumentando progresivamente la distancia y el ritmo para alcanzar una distancia diaria de 4km, manteniendo esta rutina de entrenamiento hasta el sexto mes (fin del programa). Los otros 9 pacientes, sin entrenamiento físico, componen el grupo control.
Todos los participantes fueron seleccionados en el Hospital Nicolás Peña (Vigo, España) y se les diagnosticó esquizofrenia según el Manual diagnóstico y estadístico de los trastornos mentales, quinta edición. Según los criterios de inclusión del estudio, se incluyeron en este pacientes mayores de 18 años de edad que firmaron el consentimiento informado. El estudio cumple con la Declaración de Helsinki y con la aprobación del Comité de Ética de Galicia. Los sujetos con otros trastornos psiquiátricos o neurológicos, o con una lesión cerebral traumática fueron excluidos del estudio. También se excluyeron las mujeres embarazadas o en período de lactancia. Se administró un cuestionario demográfico a todos los participantes y se les aplicó la SAAS, que evalúa la capacidad de los pacientes esquizofrénicos de experimentar placer o interés.
Preparación de la muestra de plasmaLa sangre venosa fue recogida en 2 tubos de vacío que contienen K2EDTA (BD Vacutainer®; Becton, Dickinson & Co., NJ, EE. UU.) entre las 7:00 y las 9:00 horas en el Hospital Nicolás Peña y seguidamente centrifugada a 1.000rpm durante 10min para separar el plasma sanguíneo. Posteriormente, las alícuotas fueron almacenadas a −80°C. Para el análisis del proteoma, una alícuota de 450μl de plasma se centrifugó a 16.000rpm durante 15min y a 4°C, y el sobrenadante resultante se recogió y se almacenó a −80°C. Las proteínas totales se midieron mediante un ensayo de ácido bicinchonínico (Pierce Chemicals, Rockford, IL, EE. UU.). Además, se utilizó un kit comercial de enriquecimiento de proteínas (ProteoMiner®, Bio-Rad, Hercules, CA, EE .UU.) de acuerdo con las instrucciones del fabricante, para igualar proteínas en una muestra con un contenido total de estas de 10μg. Las fracciones eluidas (10μl) preparadas con Laemmli 2× (10μl de muestra+10μl de tampón de carga 2X) fueron cargadas en un gel de poliacrilamida (10×). Se inició la electroforesis y se paró una vez que las muestras entraron en el gel separador, lo que les permitió apilarse y entrar en el gel de resolución, pero no separarse. Posteriormente, las piezas de gel seccionadas se sometieron a la digestión en gel, que consistió en lavar las piezas de gel secuencialmente con bicarbonato de amonio 25mM y acetonitrilo al 50%/bicarbonato de amonio 25mM en un baño ultrasónico. Posteriormente, las proteínas se redujeron con ditiotreitol 10mM durante una hora y se alcalinizaron con ácido indolacético 55mM durante 30min. Finalmente, las proteínas fueron digeridas durante la noche con 40ng de tripsina a 37°C, y los péptidos trípticos fueron extraídos de la matriz del gel en 2 pasos con 0,5% de ácido trifluoroacético y 100% de bicarbonato de acetonitrilo.
Cromatografía líquida con espectrometría de masas en tándemLas muestras se analizaron por triplicado (3 fracciones). Los péptidos trípticos se secaron en un concentrador de velocidad y vacío a 45°C (Concentrator plus, Eppendorf, Hamburgo, Alemania), reconstituidos en agua de grado LC/MC con un contenido de 0,1% (v/v) de ácido fórmico, y analizado mediante espectrometría de ionización por electrospray en tándem de masa en un espectrómetro híbrido LTQ-Orbitrap ELITE® de alta resolución (Thermo Fisher Scientific, Waltham, MA, EE. UU.) acoplado a un sistema Proxeon EASY-nLC 1000® UHPLC (Thermo Fisher Scientific, Waltham, MA, EE. UU.). Posteriormente se transfirieron a una columna de fase inversa (PepMap® RSLC C18, 2μm, 100Å, 75μm×500mm, Thermo Fisher Scientific, Waltham, MA, EE. UU.) y se eluyeron con un gradiente de acetonitrilo del 5-30% con un contenido de ácido fórmico del 0,1% durante 240min y a un caudal de 0,3μl/min. Los analitos eluidos resultantes fueron transferidos directamente al espectrómetro de masas, el cual fue adaptado a un ajuste de iones positivos en un modo dependiente de los datos. Se realizó un escaneo de espectrometría de masas completo, con un rango de relación masa/carga de 350-1.600m/z y una resolución de 120.000. Finalmente, se realizó un barrido de espectrometría de masas en tándem con los 15 mejores a un 18% de la energía de colisión normalizada, con un tiempo de exclusión dinámico de 30s, un umbral de señal mínimo de 1.000, una resolución de 30.000 y un ancho de aislamiento de 1,50Da.
Análisis de datosPara la identificación de proteínas utilizamos los programas de software Proteome Discoverer 2.1.0.81 (Thermo Fisher Scientific, Waltham, MA, EE. UU.), y PEAKS® Studio v7.0 (Bioinformatics Solutions Inc., Waterloo, ON, Canadá) para realizar una búsqueda de proteínas «humanas» en la base de datos del Centro Nacional de Información sobre Biotecnología, que no es redundante, así como para la cuantificación relativa sin etiquetas. También hicimos la búsqueda de proteínas comparándola con la base de datos de UniProt. Se incluyó una base de datos de secuencias de señuelos en el análisis para calcular la tasa de falsos descubrimientos (FDR). Las identificaciones positivas de proteínas solo se aceptaron cuando el número de secuencias de péptidos emparejados fue>2, las coincidencias únicas de péptidos fueron>1, las coincidencias del espectro de péptidos fueron<0,5% del FDR y la puntuación máxima de identificación de proteínas fue>20 (FDR: 0,0%). Para la cuantificación relativa sin etiqueta, la tolerancia de error de masa y el tiempo de retención se ajustaron a 20,0ppm y 20,0min, respectivamente.
Cuantificación ELISAPara estudiar los cambios neuroendocrinos medimos mediante un ensayo inmunoenzimático sándwich los niveles plasmáticos de leptina (ab100581, Abcam, Cambridge, Reino Unido) y adiponectina (ab99968, Abcam, Cambridge, Reino Unido), que son neurohormonas estrechamente relacionadas con la obesidad y el síndrome metabólico, así como con los cambios en el propio sistema nervioso central. También se midió la hormona concentradora de melanina (MBS9328009, MyBiosource), según las instrucciones del fabricante. Se realizaron pruebas por duplicado y un lector automático de microplacas (Biochrom Asys UVM 340, Cambridge, Reino Unido) midió la densidad óptica a 450nm con el software MikroWin 2000 (Berthold Technologies, Bad Wildbad, Alemania).
Análisis estadísticoEl software GraphPadPrism 7 (GraphPad Software Inc., San Diego, CA, EE. UU.) fue utilizado para manejar los datos resultantes y para realizar el análisis estadístico. La edad media de ambos grupos se comparó con la prueba U de Mann-Whitney y las diferencias entre las proporciones de sexos se analizaron con la prueba exacta de Fisher. Se realizó la prueba t de muestras emparejada para determinar las diferencias de medias entre la medición de la variable (línea de base y 6 meses), y se utilizó una prueba t de muestras no emparejadas para analizar las diferencias entre los datos de línea de base (grupo de participantes) y los datos de anhedonia (pacientes que habían abandonado el programa). Los resultados con un valor p≤0,05 se consideraron estadísticamente significativos.
ResultadosSe realizó un estudio longitudinal que comparó cómo un programa aeróbico de actividad física puede mejorar la salud general de los pacientes crónicos con esquizofrenia. Las características clínicas y demográficas de los participantes del estudio se muestran en la tabla 1.
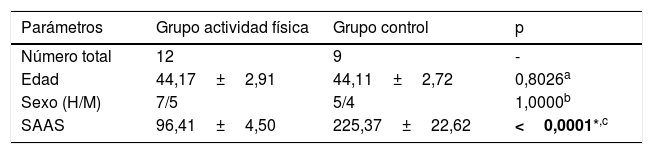
Características demográficas y clínicas de los participantes
| Parámetros | Grupo actividad física | Grupo control | p |
|---|---|---|---|
| Número total | 12 | 9 | - |
| Edad | 44,17±2,91 | 44,11±2,72 | 0,8026a |
| Sexo (H/M) | 7/5 | 5/4 | 1,0000b |
| SAAS | 96,41±4,50 | 225,37±22,62 | <0,0001*,c |
Rango de la escala SAAS: 0-810.
Se resalta en negrita el valor con significación estadística.
La comparación de los datos demográficos de 12 pacientes del grupo de actividad física y 9 pacientes del grupo sin actividad física (grupo control) no reveló diferencias significativas entre ambos grupos en términos de edad (p=0,8026, prueba U de Mann-Whitney) y sexo (p=1,0000, test de Fisher) (tabla 1). Por el contrario, las puntuaciones de anhedonia según la escala SAAS difirieron considerablemente, ya que el grupo control presentó puntuaciones significativamente más altas que los pacientes que participaron en el programa de entrenamiento (225,37±22,62 vs. 96,41±4,50; p<0,0001) (tabla 1). Por otro lado, en la tabla 2 se presentan las mediciones de los diferentes parámetros clínicos que componen el perfil metabólico de los pacientes al inicio y tras finalizar el programa de 6 meses de entrenamiento. Todos los pacientes estaban tratados con antipsicóticos (por ejemplo, olanzapina, clozapina o risperidona).
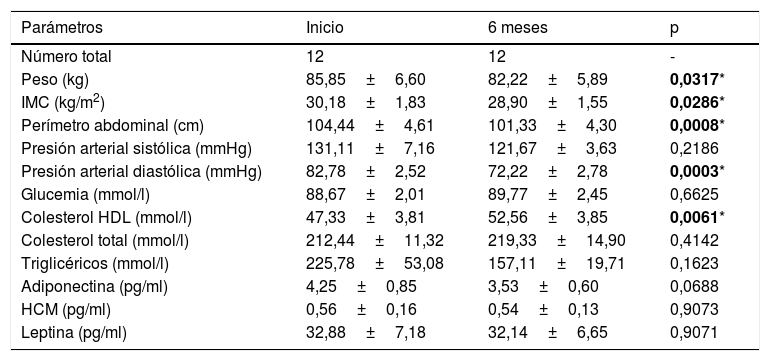
Descripción de los parámetros clínicos de los pacientes que participaron en el estudio antes y después del programa de actividad física
| Parámetros | Inicio | 6 meses | p |
|---|---|---|---|
| Número total | 12 | 12 | - |
| Peso (kg) | 85,85±6,60 | 82,22±5,89 | 0,0317* |
| IMC (kg/m2) | 30,18±1,83 | 28,90±1,55 | 0,0286* |
| Perímetro abdominal (cm) | 104,44±4,61 | 101,33±4,30 | 0,0008* |
| Presión arterial sistólica (mmHg) | 131,11±7,16 | 121,67±3,63 | 0,2186 |
| Presión arterial diastólica (mmHg) | 82,78±2,52 | 72,22±2,78 | 0,0003* |
| Glucemia (mmol/l) | 88,67±2,01 | 89,77±2,45 | 0,6625 |
| Colesterol HDL (mmol/l) | 47,33±3,81 | 52,56±3,85 | 0,0061* |
| Colesterol total (mmol/l) | 212,44±11,32 | 219,33±14,90 | 0,4142 |
| Triglicéricos (mmol/l) | 225,78±53,08 | 157,11±19,71 | 0,1623 |
| Adiponectina (pg/ml) | 4,25±0,85 | 3,53±0,60 | 0,0688 |
| HCM (pg/ml) | 0,56±0,16 | 0,54±0,13 | 0,9073 |
| Leptina (pg/ml) | 32,88±7,18 | 32,14±6,65 | 0,9071 |
Se resaltan en negrita los valores con significación estadística.
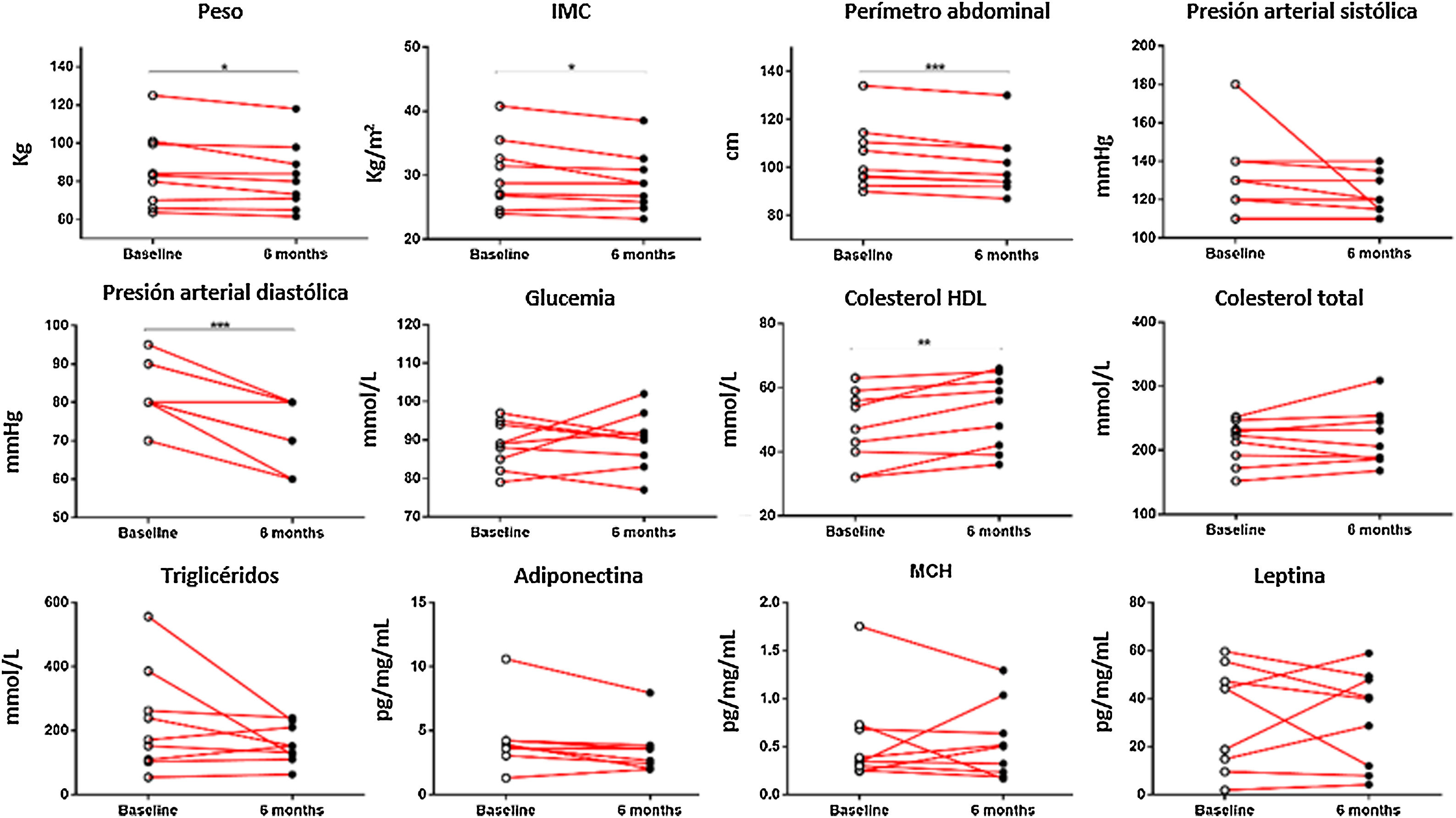
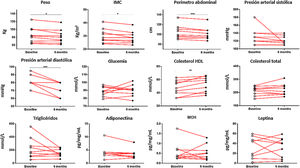
Cuando se analizaron los datos clínicos entre el grupo control y el grupo que realizó el programa de actividad física, se observaron resultados significativos entre ambos grupos en relación con su peso (p<0,05), IMC (p<0,05), perímetro abdominal (p<0,001), presión arterial diastólica (p<0,001) y colesterol HDL (p<0,001). El análisis de los cambios que suceden dentro del grupo de actividad física antes y después de 6 meses reveló resultados significativos con respecto a la reducción del peso de los pacientes (85,85±6,60 vs. 82,22±5,89 kg; p<0,05), del IMC (30,18±1,83 vs. 28,90±1,55; p<0,05), del perímetro abdominal (104,44±4,61 vs. 101,33±4,30 cm; p<0001), de la presión arterial diastólica (82,78±2,52 vs. 72,22±2,78 mmHg; p<0,001) y de los niveles de colesterol HDL (47,33±3,81 vs. 52,56±3,85 mm/dL; p<0,001) (fig. 1).
Datos clínicos de los pacientes crónicos con esquizofrenia medidos al inicio del programa de actividad física y al terminarlo a los 6 meses. Se encontraron resultados significativos en el peso de los pacientes (p=0,0317), el IMC (p=0,0317), el perímetro abdominal (p=0,0008), la presión arterial diastólica (p=0,0003) y el colesterol HDL (p=0,0061). *p≤0,05; **p≤0,01; ***p≤0,001.
Para comprobar la homogeneidad de ambos grupos, se estudió si existían diferencias entre el grupo control (que no realizó actividad física) y los datos iniciales del grupo que realizó el programa de entrenamiento (Tabla suplementaria 1). No se observaron diferencias significativas en ningún parámetro.
Nos interesaba averiguar si existía alguna diferencia clínica entre ambos grupos que pudiera explicar por qué un grupo de pacientes acepta y se compromete con el programa de actividad física mientras otro grupo acepta participar pero lo rechaza antes de dar comienzo, para así encontrar una forma de predecir en un futuro si un paciente es buen candidato o no para este tipo de programas. Para ello se midieron los niveles de anhedonia con la escala SAAS. Se verificó que el grupo control tenía una puntuación de 217 (puntuación SAAS>150), lo que significa que estos pacientes tenían anhedonia marcada. La anhedonia es uno de los síntomas negativos asociados con la esquizofrenia, que implica un comportamiento ausente o reducido, falta de energía e interés, y aplanamiento o abolición afectiva. Esto permitió plantear que los cambios moleculares que pudiésemos encontrar entre ambos grupos serían debidos a la anhedonia en la esquizofrenia, aunque determinar esta causalidad requerirá estudios con mayor número de pacientes. Los datos clínicos de ambos grupos se especifican en la Tabla suplementaria 1.
Perfiles proteómicosPara determinar y crear un perfil molecular de los cambios causados por la actividad física en los pacientes crónicos con esquizofrenia, se analizaron muestras de plasma obtenidas de los participantes de ambos grupos de estudio utilizando LC-ESI-MS/MS de tipo shotgun. Dentro del grupo que realizó el programa de actividad física se compararon los cambios entre los niveles al inicio del programa y los obtenidos tras 6 meses de entrenamiento. Además, se estudiaron las diferencias entre el grupo que completó el programa de actividad física y el grupo control.
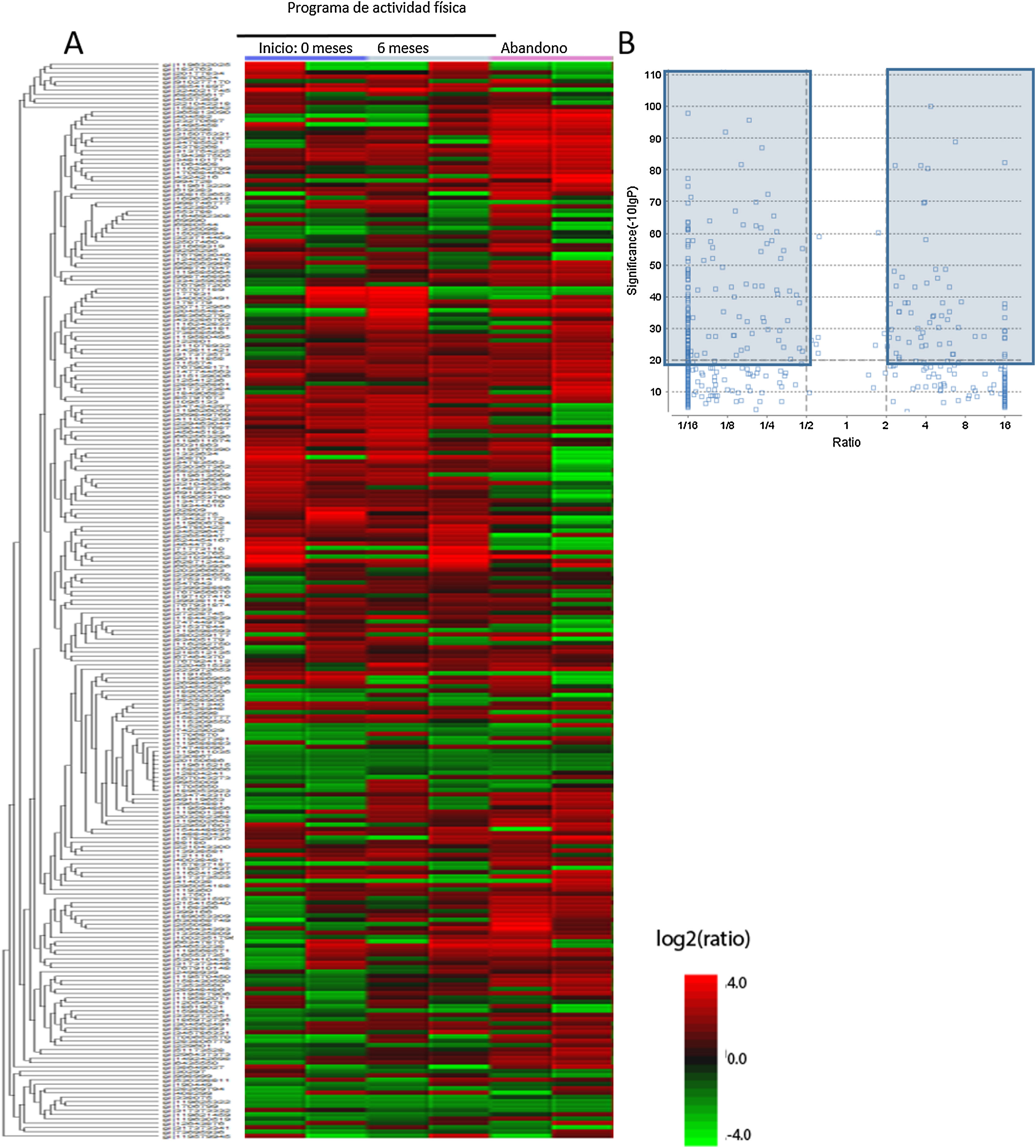
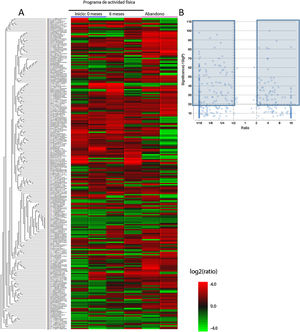
En primer lugar, se analizaron las muestras de plasma consiguiendo perfiles plasmáticos completos de 21.165 proteínas y péptidos diferentes. Se compararon con las bases de datos del Centro Nacional de Información sobre Biotecnología y UniProt, y después de realizar los análisis bioinformáticos mediante el MaxQuant y el PEAKS, se identificaron 4.657 proteínas candidatas, llamadas proteínas maestras, que diferían significativamente entre los grupos de estudio y que se pueden observar en el gráfico de tipo heatmap (fig. 2A). Como es difícil analizar los cambios de tantas proteínas, a partir de las 4.657 proteínas del heatmap se realizó un segundo análisis donde se incrementa el poder de significación y se obtiene el gráfico volcano plot. En este gráfico se observa que hay 194 proteínas identificadas del heatmap que varían significativamente entre los 3 grupos de muestras (grupo inicio, 6 meses y control). Estas proteínas están marcadas en los cuadros oscuros, las proteínas con una FDR>2 o una FDR<0,5 (fig. 2B).
Proteínas diferenciales obtenidas tras el análisis del LC-ESI-MS/MS en los diferentes grupos de pacientes crónicos con esquizofrenia: 1) grupo que participó en el programa de actividad física, valor basal; 2) grupo que participó en el programa de actividad física, valor a los 6 meses, y 3) grupo de pacientes que abandonaron el programa. A) Gráfico tipo heatmap del perfil proteómico de los 3 grupos. B) Volcano plot con las proteínas seleccionadas como significativas a partir de los datos del heatmap. En los cuadrados azules se marcan las proteínas que significativamente se diferencian.
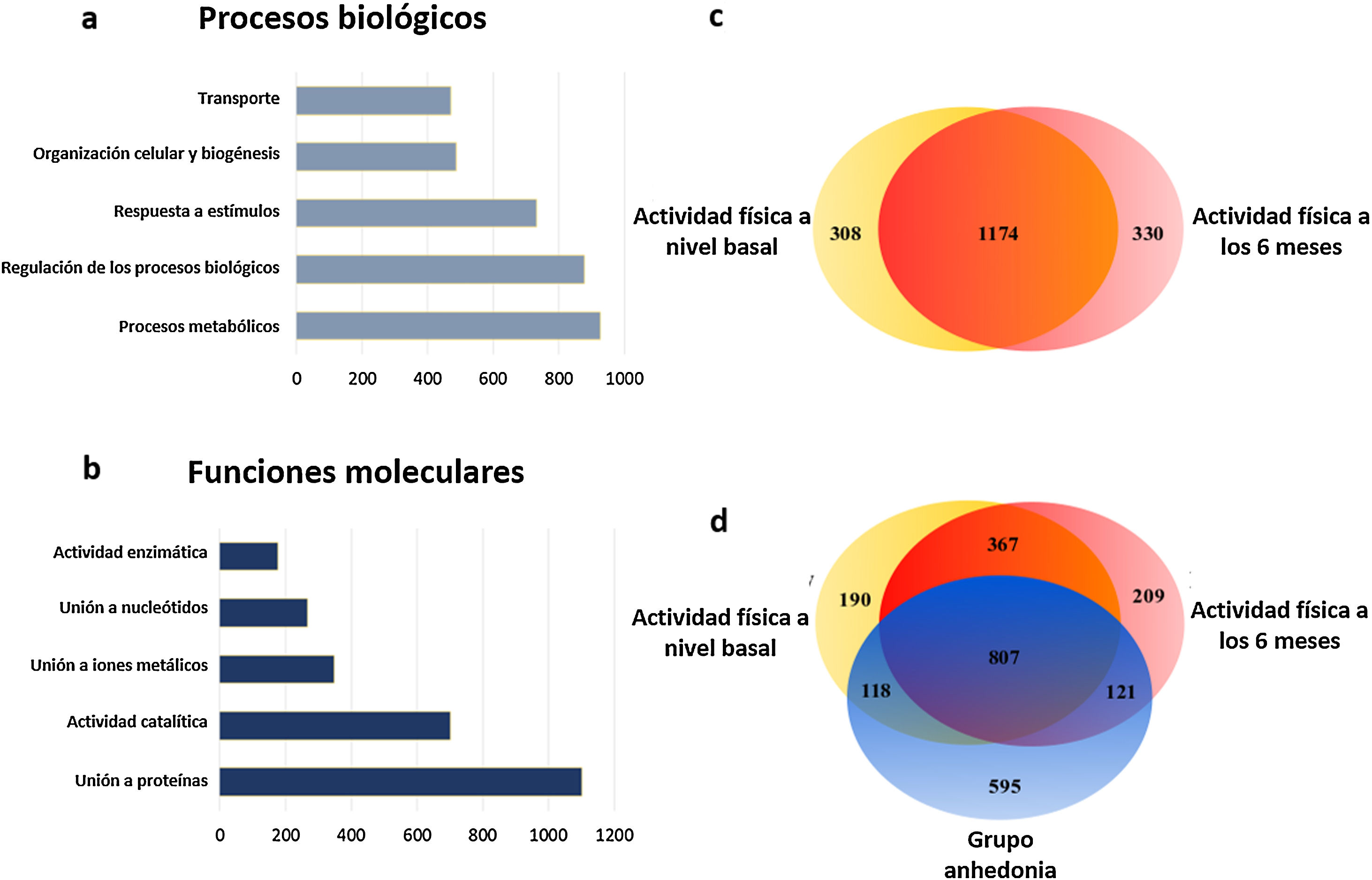
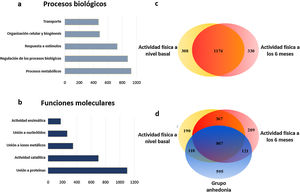
A continuación, a partir del grupo de proteínas seleccionadas a través del heatmap se hace un análisis de agrupamiento jerárquico y se clasifican por categorías de procesos biológicos basados en la ontología génica (fig. 3). Con este análisis observamos como el programa de actividad física en pacientes con esquizofrenia afecta principalmente a las proteínas implicadas en los procesos metabólicos y en procesos de regulación biológicos (21,77 y 20,59%, respectivamente), seguidas de la respuesta a los estímulos (fig. 3A). Cuando clasificamos estos datos según los procesos moleculares observamos que la actividad física en pacientes con esquizofrenia modifica principalmente las proteínas de unión (34,13%) y las enzimas ligadas a la actividad catalítica (21,74%) (fig. 3B).
Principales procesos biológicos y moleculares inducidos por el programa de actividad física en los pacientes crónicos con esquizofrenia. A) Diagrama de barras de los principales cambios en los procesos biológicos. B) Diagrama de barras de los principales cambios en las funciones moleculares. C) Diagrama de Venn de las proteínas totales identificadas y moduladas por la actividad física. El diagrama muestra la distribución de las proteínas y el 64,79% de las proteínas son comunes a ambas condiciones. D) Diagrama de Venn de las proteínas totales identificadas y moduladas por la actividad física y el grupo que abandonó. El diagrama muestra la distribución de las proteínas y el 33,51% de las proteínas son comunes a las 3 condiciones.
Posteriormente, se realizaron los análisis basados en las teorías de conjuntos a través de diagramas de Venn, analizando las proteínas plasmáticas de cada grupo. Cuando se analizaron los cambios que sucedieron en los pacientes crónicos con esquizofrenia desde el inicio del programa y hasta su conclusión, se observó que en la etapa final aparecen 330 proteínas únicas y en cambio desaparece la expresión de otras 308 proteínas (fig. 3C). Cuando se comparó el grupo control, que resultaron ser pacientes con anhedonia, se verificó que sus perfiles moleculares en el diagrama de Venn diferían significativamente de los del grupo que realizó el programa. Aunque el cambio en el número de proteínas fue similar, su clase cambió considerablemente, ya que 595 proteínas únicas aparecieron exclusivamente entre el grupo de pacientes del programa de actividad física, mientras que la expresión de 766 proteínas desapareció del plasma de los pacientes control (fig. 3D). Estos cambios moleculares se produjeron principalmente en proteínas implicadas en los procesos metabólicos, lo que da una idea de las grandes diferencias moleculares que hay entre estos grupos de pacientes y que repercuten directamente en las diferencias clínicas observables y de respuesta a los programas de neurorrehabilitación.
A continuación, se realizó un análisis STRING para seleccionar las interacciones entre las proteínas maestras cuya presencia o ausencia en el plasma modificaba los perfiles moleculares de los pacientes que participaban en el programa de actividad física. A partir de este análisis, se identificaron un total de 87 proteínas maestras candidatas, de las cuales se seleccionaron 42 relacionadas con los diferentes procesos metabólicos (tabla 3).
Lista de proteínas seleccionadas como candidatas que modulan a nivel molecular la actividad física en los pacientes crónicos con esquizofrenia
| Número de acceso | Nombre de la proteína |
|---|---|
| 119573202 | Alfa-espectrina eritrocítica 1 |
| 412141 | Alfa-1 antitripsina |
| 47678583 | MYH9 |
| 18490850 | Lactotransferrina |
| 37182316 | SERPINA10 |
| 7767178 | Apolipoproteína E3 |
| 386854 | Proteína tipo ii de la subunidad de la queratina |
| 119617033 | Queratina 6B |
| 22538467 | Subunidad del proteasoma beta tipo 4 |
| 83754699 | Cadena A, 14-3-3 proteína Eta |
| 119608112 | Adenilato quinasa 1 |
| 119619569 | Subunidad del proteasoma tipo 4 |
| 31874085 | Subunidad del proteasoma tipo 5 |
| 30047108 | Proteína ABHD14B |
| 119580430 | Proteína F-box 7 |
| 18307851 | Angiogenina |
| 219555707 | Factor de iniciación de la traducción eucariota 5A-1 |
| 119577528 | Factor activador de las plaquetas acetilhidrolasa |
| 567112 | Proteína OMM |
| 116496911 | Inhibidor del proteasoma subunidad 1 |
| Q2KIS7 | Tetranectina |
| 298557 | Factor reumatoide |
| 119619893 | Proteína surfactante pulmonar tipo B |
| 767979880 | Catepsina G |
| 119626498 | Alcohol deshidrogenasa 1A |
| 119608154 | Lipocalina 2 |
| 119597942 | Lipasa hepática |
| 116241320 | IGFBP-8 |
| 957948916 | Apolipoproteína C-II |
| 119609989 | Glucosidasa alfa |
| 261473 | Mieloperoxidasa 38kDa |
| 37649 | Proteína precursora de la adhesión vascular |
| P17690 | Beta-2-glucoproteína 1 |
| 15012091 | Proteína inductora de la prolactina |
| 119582950 | Anexina A1 |
| 7012712 | Proteína iniciadora de la transcripción del megacariocito 1 |
| 578817432 | Tenascina |
| 18073906 | Receptor scavenger de cisteína |
| 767917494 | Sushi, nidogen y proteína que contiene dominios EGF-1 |
| 767923052 | Histona-lisina N-metiltransferasa SETD2 |
| 119615114 | Unión al calcio y dominio bobina en espiral 2 |
| 444732979 | Proteína alternativa NSD1 |
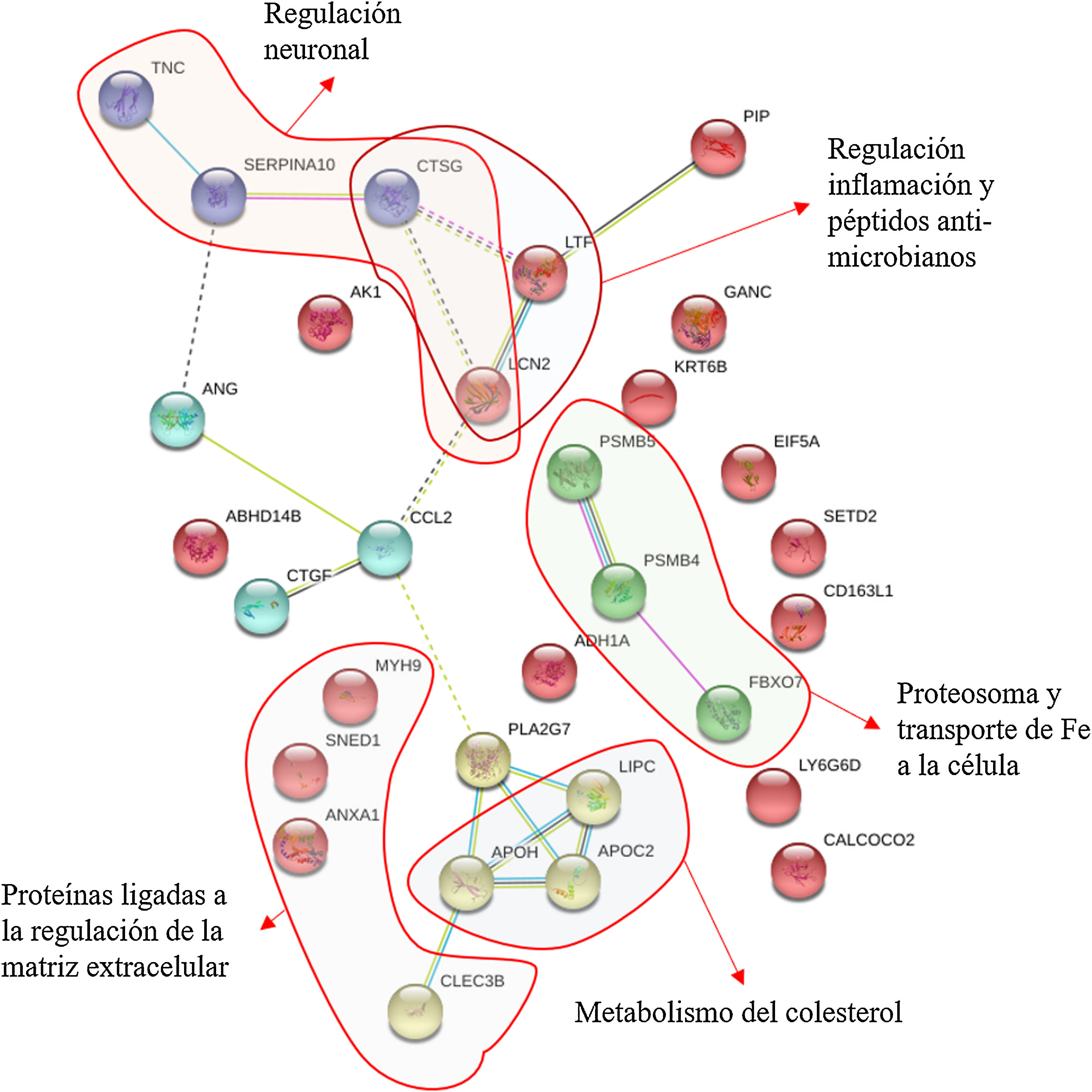
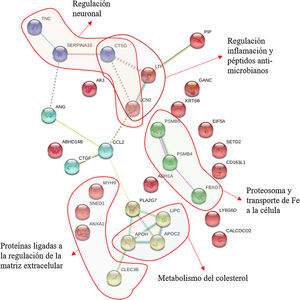
En la figura 4 podemos observar cómo interaccionan estas proteínas obteniendo 30 nodos significativos (p<0,0001). Este análisis confirma la importancia de las proteínas neurometabólicas, como las apolipoproteínas E, C y H, donde la mayor parte de los nodos significativos se hacen en la regulación de las lipoproteínas o de proteínas implicadas en la regulación neuronal, como es el caso de la tenascina o la PAFAH1B3; de proteínas neuroinflamatorias, como la lipocalina 2 y la 14-3-3; de proteínas reguladoras del citoesqueleto, como la espectrina, la lactotransferrina y la anexina A1; o de proteínas reguladoras neuroendocrinas, como la proteína inducida por la prolactina (fig. 4). En la figura 4 se puede observar cómo se agrupan las proteínas basadas en las interacciones descritas en bases de datos tras aplicar un programa de minería de datos (k-clustering). Se observa que se agrupan significativamente en 6 clústeres, ligados a la regulación neuronal, la regulación de la inflamación y péptidos antimicrobianos, al proteasoma y transporte de hierro, al metabolismo del colesterol y a la regulación de la matriz extracelular (Tabla suplementaria 2).
DiscusiónLa esquizofrenia es una de las enfermedades más incapacitantes en la actualidad, cuya esperanza de vida en pacientes crónicos es entre 12 y 15 años menor que la de la población general20,21. A la pérdida de calidad de vida que provoca esta enfermedad se suma la alta tasa de comorbilidad, como enfermedades cardiovasculares, siendo estas la primera causa de muerte entre los pacientes con esquizofrenia22. A nivel general, el estado físico de estos pacientes es particularmente deficiente12. Con el objetivo de mejorar la calidad de vida de estos pacientes, las unidades de salud mental promueven programas de estilos de vida saludable para prevenir los factores de riesgo cardiovascular y reducir la mortalidad prematura entre ellos23. Dentro de estos programas de hábitos de vida saludable, al igual que con la población general, se busca mejorar la calidad de la nutrición y la realización de programas de actividad física. Los beneficios de la actividad física en pacientes esquizofrénicos son claros, ya que resulta en una mejora tanto de su función cognitiva como de su salud física general24. Sin embargo, el apoyo social, la sintomatología y los efectos secundarios relacionados con el tratamiento (fármacos antipsicóticos) son barreras complejas que tienen un gran impacto en la motivación de los pacientes con esquizofrenia y en el cumplimiento de un régimen de actividad física20,23.
El ejercicio aeróbico mantenido en el tiempo es capaz de regular el conectoma de diferentes regiones cerebrales, como la corteza frontal, la temporal, la parietal y el córtex cerebelar25. Sin embargo, se desconoce cómo ocurren estos cambios en la corteza cerebral de los pacientes con esquizofrenia, pudiendo plantearse que, al poseer un conectoma diferente, los beneficios esperados también lo sean. Se sabe que cuando se introducen este tipo de programas de actividad física en pacientes con enfermedad mental grave, la respuesta es heterogénea. De forma general, la respuesta varía según el tipo de enfermedad o la clase de tratamiento pautado, además de la variabilidad genética interindividual. Aplicar este tipo de programas a pacientes con esquizofrenia es costoso tanto por las horas como por la necesidad de personal especializado, así que entender cómo suceden estos cambios podría ayudar a optimizar el sistema sanitario, permitir ofertar programas adecuados a cada paciente y ayudar a comprender mejor la biología de la propia esquizofrenia. Es por ello que se planteó estudiar en profundidad el perfil proteómico plasmático de pacientes con esquizofrenia y cómo influye la actividad física en ellos. Con estos datos, se pretende obtener un perfil común que asocie la respuesta clínica a los cambios moleculares en plasma.
En un primer momento se seleccionaron 21 voluntarios para participar en este programa de actividad física con una duración de 6 meses y se evaluaron clínicamente las siguientes variables de todos ellos: peso, IMC, perímetro abdominal, niveles de presión arterial, glucemia, triglicéridos, colesterol total y colesterol HDL. Los 21 participantes fueron citados para iniciar el programa de ejercicios, pero 9 de ellos rechazaron comenzar los entrenamientos, aunque sí aceptaron continuar en el estudio como grupo control.
A los 21 voluntarios se les tomó una muestra de sangre al inicio del programa y otra al finalizar este. A partir de esta muestra se analizó el plasma por LC-ESI-MS/MS y, por primera vez, se consiguió un perfil completo del proteoma plasmático compuesto por21.165 proteínas y péptidos. De este análisis, se destacaron 4.657 proteínas totales en plasma. En otros estudios se obtuvieron números similares, oscilando entre 200 y 4.500 proteínas plasmáticas26–29. Cuando se analizaron las diferencias significativas entre los 2 grupos se observó que, del total de 4.657 proteínas, 1.812 habían sufrido alteraciones significativas y más del 50% de ellas están implicadas en funciones metabólicas y procesos biológicos.
Dentro del grupo que realizó el programa de actividad física, se compararon los cambios de expresión proteica al inicio y final del programa y se observó que cambiaba solo un grupo de proteínas muy específico. De las 1.812 proteínas que cambiaron su expresión de un modo significativo, 330 se expresaron y 308 tenían su expresión inhibida al final del programa de ejercicio físico, siendo constante la expresión de 1.174 proteínas. Teniendo en cuenta los aspectos clínicos de todos los pacientes que completaron el programa, se constató una mejoría en su condición general, mejorando su síndrome metabólico con la consecuente bajada del IMC, y una optimización de sus niveles de presión arterial, así como de la glucemia, la colesterolemia y la lipidemia. Esta mejoría clínica se correlaciona con los aspectos moleculares, ya que la mayor parte de las proteínas implicadas en estos cambios están correlacionadas con el metabolismo, el sistema inmune y los cambios ligados a la matriz extracelular.
Los principales cambios en los patrones moleculares se detectaron cuando se hizo la comparación entre los niveles de inicio del grupo que terminó el programa de actividad física y los del grupo control.
En este análisis de detectaron cambios significativos en 2.217 proteínas, de las cuales 576 son específicas del grupo que terminó el programa y 713 del grupo control. Con el objetivo de comprender las diferencias intergrupales, se compararon los parámetros clínicos de ambos grupos y se observó que no había diferencias en cuanto a los parámetros antropométricos y bioquímicos (peso, IMC, glucemia, colesterolemia o lipidemia), pero sí en la anhedonia. El grupo control, compuesto por pacientes que rechazaron el programa, presentó una puntuación en la SAAS>15030, lo que significa que tienen una anhedonia marcada comparativamente con el grupo que completó el programa (SAAS<150). Este resultado nos lleva a una doble interpretación. Por una parte, ambos grupos de pacientes, que son aparentemente similares desde el punto de vista bioquímico y clínico, son molecularmente muy diferentes. Esto podría ayudar a comprender las razones moleculares y biológicas de por qué muchos pacientes no son capaces de completar los programas de neurorrehabilitación. Los cambios moleculares detectados no solo afectan a los procesos metabólicos y al sistema inmune, sino también a la regulación del sistema nervioso y a las proteínas de la matriz extracelular, como la tenascina y las serpinas. Por otra parte, este resultado abre la puerta a conocer los mecanismos moleculares subyacentes a la anhedonia.
Desde el punto de vista clínico, sin realizar un estudio previo, estos pacientes crónicos con esquizofrenia son indistinguibles. Un hecho que lo demuestra es que cuando se midieron los niveles plasmáticos de leptina y adiponectina, 2 neurohormonas ligadas a la regulación de la obesidad y del metabolismo de la ingesta en general31–33, no se encontraron diferencias significativas entre los 2 grupos. No obstante, de cara a establecer una medicina personalizada cuando los pacientes inician diferentes programas de neurorrehabilitación, sería muy importante que se pudiese conocer previamente qué tipo de respuesta van a tener en cuanto a la adherencia34. Sin embargo, este estudio evidencia que existen diferencias moleculares a nivel plasmático entre ambos grupos. En la actualidad, hacer estudios por LC-ESI-MS/MS a cada paciente es inviable, pero partiendo de los resultados del presente trabajo, se obtuvo un patrón de 4.657 proteínas que se expresan en el plasma de un modo significativo. Obviamente, no todas las proteínas detectadas necesitan de un estudio íntegro, pero a partir de análisis bioinformáticos se estructuró un listado de proteínas (tabla 3) que sí podrían medirse en arrays en poblaciones mayores. Este listado comprende proteínas con una importancia metabólica, neuronal, inmunológica o estructural muy grande, como es el caso del IGFBP-8, lipocalina 2, tenascina, anexinas, lactotransferrinas, proteína inductora de la prolactina y apolipoproteínas, entre otras.
Después de los análisis moleculares y bioinformáticos, las proteínas seleccionadas fueron comparadas dentro del grupo que participó en el programa de actividad física antes y después de completarlo. Esta comparación reveló 87 proteínas que podrían explicar los cambios detectados en estos pacientes, incluyendo las apolipoproteínas E y C, la tenascina, la espectrina, la proteína B asociada al surfactante pulmonar, la anexina A1, la proteína inducida por la prolactina y la proteína neuroinflamatoria lipocalina 2. Estas proteínas en concreto son de extremada relevancia en el desarrollo de diferentes enfermedades neurodegenerativas y neurológicas, como es el caso de las apolipoproteínas E y C en la biología de la enfermedad de Alzheimer35,36, o el caso de la tenascina, las proteínas implicadas en la regulación de la matriz extracelular (espectrinas, serpinas), la proteína precursora de la adhesión vascular y las anexinas, que son cruciales para el mecanismo de comunicación celular entre la glía y la neurona37,38.
Un hecho interesante que encontramos en nuestro estudio es que el programa de actividad física en los pacientes crónicos con esquizofrenia regula el sistema de proteasoma de ubiquitina. Este sistema es un importante regulador del procesamiento, tráfico y degradación de proteínas39. Se ha demostrado que este sistema está desregulado en pacientes con esquizofrenia40,41, y se pueden detectar estos cambios tanto en la sangre como en el cerebro42,43. Nuestros hallazgos evidencian que este sistema proteasoma de ubiquitina está regulado en pacientes con esquizofrenia que siguen un programa de actividad física. Resultados similares fueron obtenidos en un modelo animal (rata), donde se comprobó que el ejercicio físico aeróbico mejoraba los niveles de oxidación y reducía los niveles de ubiquitinación de las proteínas44.
Aunque es imperativo realizar más investigaciones para determinar qué significan estos cambios, la actividad física apunta a una regulación de sistemas moleculares.
Los perfiles proteómicos de los pacientes activos demostraron ser muy diferentes a los de los pacientes que rechazaron el programa y formaron el grupo control.
Otro aspecto importante es comprobar cómo los programas de entrenamiento físico aeróbico actúan frente a la terapia farmacológica con antipsicóticos administrada a los pacientes. Lograr perfiles moleculares que sean capaces de explicar los profundos cambios que se observan desde la clínica sería uno de los primeros pasos para poder instaurar la medicina personalizada en la psiquiatría.
Limitaciones del estudioLa principal limitación del estudio es el pequeño tamaño muestral. Este número reducido de participantes se debe a la dificultad inherente a la manutención de un programa de entrenamiento diario durante 6 meses en pacientes con esquizofrenia, al alto coste del análisis proteómico para obtener perfiles completos del proteoma plasmático y a la variabilidad interindividual, que se traduce en la necesidad de trabajar con grupos muy homogéneos. A pesar de ello, el objetivo final de este proyecto es partir de este pequeño estudio piloto para que en el futuro se pueda ampliar el estudio molecular utilizando un mayor número de pacientes. De esta manera, se obtendrán perfiles moleculares ampliados y validados con otras técnicas, pudiendo clasificar a los pacientes con esquizofrenia según esos perfiles.
Otra limitación del estudio es que no analizamos los efectos de los antipsicóticos. Todos los pacientes estaban a tratamiento con olanzapina, clozapina o risperidona, lo que puede constituir una limitación que deberá ser estudiada para identificar el potencial efecto de los antipsicóticos sobre los cambios moleculares.
ConclusiónCon este estudio se consiguió obtener un perfil del proteoma plasmático compuesto por 21.165 proteínas y péptidos, de los cuales 4.657 son proteínas. A partir de estos perfiles nos propusimos diferenciar 2 grupos de pacientes crónicos con esquizofrenia que son indistinguibles a nivel clínico: un primer grupo, que respondió y mejoró con un programa de actividad física aeróbica, y un segundo grupo, que rechazó el programa de actividad física. Para poder llevar a cabo este trabajo se estableció una metodología que unía el trabajo diario con pacientes crónicos durante 6 meses con la tecnología avanzada para el análisis proteómico de tipo LC-ESI-MS/MS shotgun, altamente compleja y costosa, lo que limitó el tamaño de la muestra.
A pesar de ello, fue posible abordar diferentes aspectos. En primer lugar, la gran diferencia molecular existente entre los pacientes de ambos grupos ya antes de iniciarse el programa. Hay que tener en cuenta que esta primera toma de muestras a los 21 participantes se realizó antes de que el grupo de 12 iniciase el programa de entrenamientos aeróbicos y, por tanto, en ese momento, los 21 participantes eran indistinguibles a nivel clínico. Esto significa que podría desarrollarse un panel de proteínas plasmáticas que fuesen capaces de predecir si el paciente se va a adherir a un programa de neurorrehabilitación o no, con el consiguiente ahorro económico para el sistema y el redireccionamiento del paciente hacia otro tipo de intervenciones.
En segundo lugar, este estudio profundiza en los cambios moleculares que sufre un paciente crónico con esquizofrenia cuando realiza un programa de entrenamiento aeróbico. Conocemos los efectos beneficiosos de la actividad física sobre el cerebro sano, y cada vez se va averiguando más sobre los mecanismos moleculares de cómo la actividad física regula el cerebro. Sin embargo, poco se conoce sobre cómo el entrenamiento aeróbico puede afectar el cerebro de un paciente con esquizofrenia, y cuyo principal problema neurobiológico es un conectoma incorrecto. Nuestro estudio evidencia que las principales vías que se modifican en estos pacientes son las metabólicas, del sistema inmune y de regulación biológica de la matriz extracelular. Sería interesante estudiar con más profundidad cómo se pueden modular estos mecanismos, de modo que la efectividad de las terapias de neurorrehabilitación y sociales puedan ser más eficientes.
A pesar de las dificultades intrínsecas asociadas a la práctica de la actividad física por parte de los individuos con enfermedades mentales graves, nuestro estudio reveló un perfil metabólico y proteómico dinámico característico de los pacientes con esquizofrenia crónica, lo que aumenta nuestros conocimientos actuales sobre las vías fisiopatológicas subyacentes a la esquizofrenia.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación para la Ciencia y la Tecnología, Portugal (FCT SFRH/BD/135623/2018); el ISCIII, España (P16/00405); el Ministerio de Sanidad, Igualdad y Política Social - Delegación del Gobierno para el Plan Nacional sobre Drogas (2017I054), y la Agencia de Innovación (GAIN) de la Xunta de Galicia (IN607C-2017/02, IN607B 2018/17).
Conflicto de interesesTodos los autores declaran que no tienen ningún conflicto de intereses.
19.
Los autores agradecen el apoyo del Instituto de Investigación Sanitaria Galicia Sur y a Paula Álvarez Chaver, del Servicio de Proteómica del CACTI de la Universidad de Vigo. Además, los autores agradecen especialmente la ayuda de los servicios de Enfermería del Hospital Álvaro Cunqueiro y del Hospital Nicolás Peña, así como del Servicio de Psiquiatría de la EOXI-Vigo.