La heredabilidad en la esquizofrenia llega hasta el 80% y el riesgo en familiares es 5-10 veces mayor que en la población general. La gran contribución genética en este trastorno ha llevado a dedicar un interés creciente a su estudio.
ObjetivosRevisar los hallazgos de los estudios genéticos conocidos como Genomewide Association Studies (GWAS) en esquizofrenia.
MétodoBúsqueda sistemática a través de Pubmed con las palabras clave GWAS and (psicosis) or (schizophrenia). Se han revisado las páginas http://www.szgene.org/largescale.asp y www.genome.gov/gwastudies/.
ResultadosLos GWAS se han centrado en aspectos biológicos causales como el complejo de histocompatibilidad, el metabolismo de glutamato, el proceso de apoptosis, inflamatorio y el sistema inmunológico (TNF-beta, TNFR1). También se han focalizado en la búsqueda de genes que modulen la aparición de efectos secundarios metabólicos, cardíacos y efectos secundarios en personas con esquizofrenia y tratamiento antipsicótico. En neurocognición se ha asociado la sobreexpresión del proto-oncogen MET (MET) con una baja susceptibilidad para la esquizofrenia y mejor rendimiento cognitivo, así como a menor susceptibilidad para la incidencia de cáncer. También se apuntado a diversos genes que medien en el funcionamiento cognitivo en función del tratamiento antipsicótico recibido.
ConclusionesLos principales intereses de los GWAS durante los últimos años han sido los recorridos neurobiológicos involucrados en la esquizofrenia. Los descubrimientos derivados de estos estudios han sido limitados. Esto ha conducido a un planteamiento innovador en el estudio etiológico del trastorno a través del estudio de las interacciones gen-ambiente.
Heritability in schizophrenia can reach up to 80% and the risk in families is 5-10 times higher than in the general population. The large contribution of genetics in this disorder has led to a growing interest in its study.
ObjectivesTo review the findings of genetic studies known as Genomewide Association Studies (GWAS) on schizophrenia.
MethodSystematic search using Pubmed with the key words GWAS and (psychosis) or (schizophrenia). The following web pages have been reviewed: http://www.szgene.org/largescale.asp and www.genome.gov/gwastudies/.
ResultsThe GWAS have focused on causal biological aspects, such as the histocompatibility complex, glutamate metabolism, apoptosis and inflammatory processes, and the immune system (TNF-β, TNFR1). Also focused in the search were the genes that modulate the appearance of secondary metabolic and cardiac effects and secondary effects in subjects with schizophrenia and on anti-psychotic treatment. In neurorecognition, over-expression of the MET proto-oncogene (MET) has been associated with a low susceptibility for schizophrenia and a better cognitive performance, as well as a lower susceptibility for the incidence of cancer. Mention is also made of the different genes that mediate in cognitive functioning depending on the anti-psychotic treatment received.
ConclusionsThe main interests of the GWAS during the last few years have been the neurobiological pathways involved in schizophrenia. The discoveries arising from these studies have been limited. This has led to an innovative approach on the aetiological study of the disorder by studying gene-environment interactions.
Desde 2005 hasta la actualidad se han desarrollado múltiples estudios genéticos que han rastreado a gran escala la mayoría de los genes que conforman el genoma humano. Estos estudios genéticos son conocidos como Genome-wide Association Studies (GWAS) y su objetivo es relacionar ciertos genes con diversas patologías o trastornos, habiendo relacionado hasta la actualidad ciertas secuencias comunes de ADN con la susceptibilidad para más de 40 enfermedades comunes1. Estos hallazgos han permitido elaborar nuevas hipótesis patofisiológicas, pero aún no se han podido establecer relaciones causales directas entre marcadores genéticos y patologías comunes2.
Los primeros reportes GWAS aparecieron para trastornos psiquiátricos y en la actualidad existen casi 100 GWAS en psiquiatría para el TDAH, autismo, trastorno bipolar, esquizofrenia, trastorno depresivo mayor, trastornos ansiosos, trastornos de personalidad y neurocognición.
A pesar del interés creciente de los estudios GWAS en relacionar diversos genes con el riesgo de esquizofrenia, no se ha podido encontrar una significación clara para ninguno de ellos, aunque se han asociado alrededor de unos 1.000 genes con susceptibilidad a padecerla3.
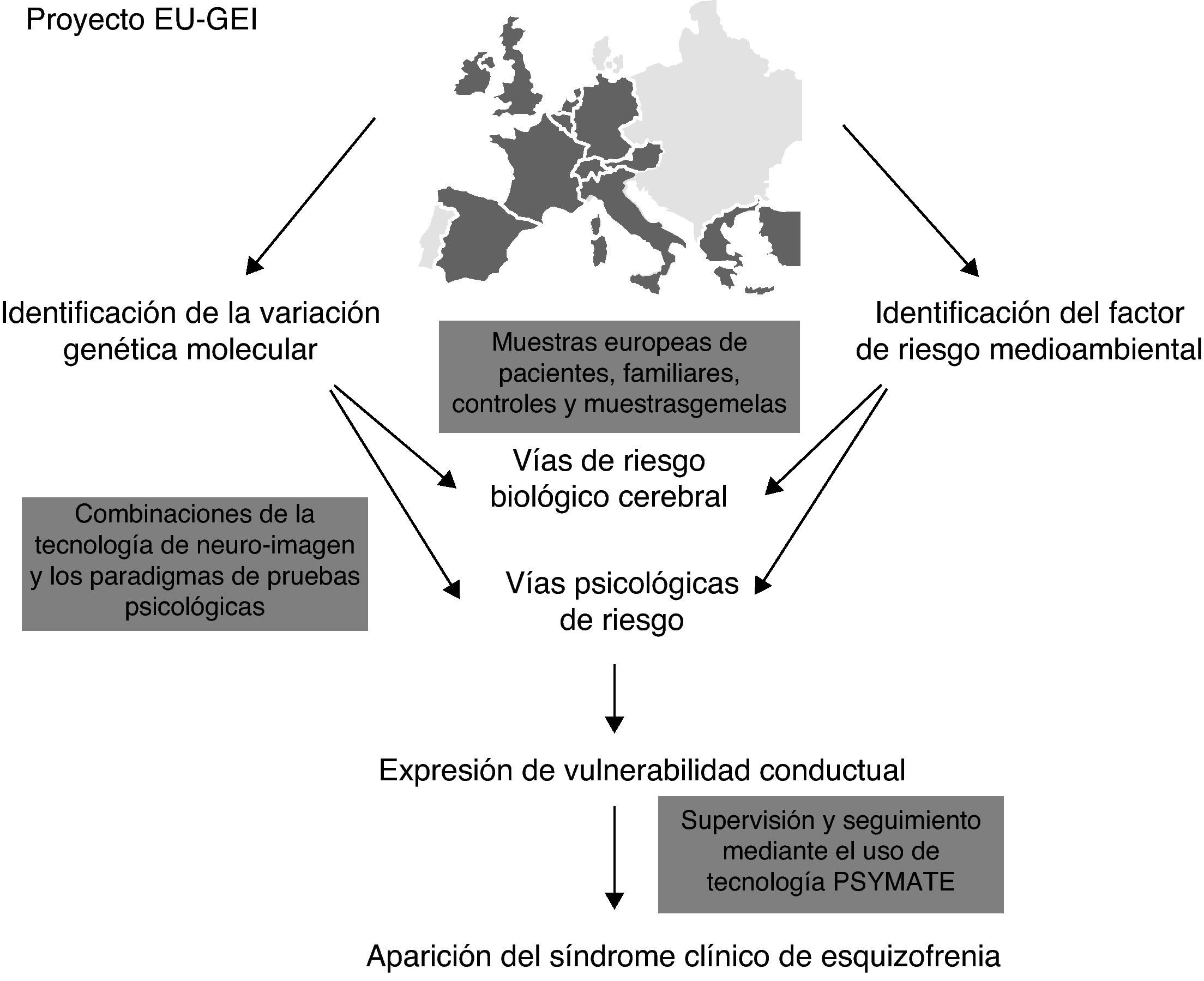
Con el objetivo de establecer nuevas relaciones causales-ambientales se ha planteado una fusión de los estudios ambientales epidemiológicos con los estudios genéticos (GWAS). En Europa, desde el año 2010 se está llevando a cabo un proyecto multicéntrico elaborado por una red de expertos multidisciplinares que recibe el nombre de European Network of Schizophrenia Networks for the Study of Gene Environment Interaccions (EU-GEI)4. Se estudia el desarrollo, severidad y curso de la esquizofrenia con el fin de identificar determinantes e interacciones entre ellos que permitan indagar y conocer más profundamente las interacciones gen-ambiente. Entre otros países, existe una participación española en este proyecto desde ciudades como Barcelona, Madrid, Oviedo, Santiago de Compostela y Valencia.
La figura 1 muestra la ejecución del proyecto EU-GEI.
A propósito de la revisión de los GWAS realizada por el Psychiatric GWAS Consortium Coordinating Committee5 en 2009, se plantea una revisión sistemática de los estudios GWAS y de sus novedades en el campo de la esquizofrenia desde su inicio hasta el momento actual.
Antes de describir los resultados hallados en los estudios GWAS haremos una sencilla descripción de los términos genéticos que se utilizarán a lo largo de esta revisión con el objetivo que el contenido esté lo más claro posible.
Un gen es una secuencia lineal de nucleótidos en la molécula de ADN que contiene la información necesaria para la síntesis de una macromolécula con función celular específica, normalmente proteínas, pero también ARNm, ARNr y ARNt. El genoma es la totalidad de la información genética que posee un organismo. Por lo general, al hablar de genoma nos referimos solo al ADN contenido en el núcleo organizado en cromosomas.
Se denomina cromosoma a cada uno de los pequeños cuerpos en forma de bastoncillos en que se organiza la cromatina del núcleo celular durante las divisiones celulares (mitosis y meiosis). La cromatina es un material microscópico que lleva la información genética de los organismos eucariotas y está constituida por ADN.
Una deleción o supresión, en genética, es un tipo especial de anomalía estructural cromosómica que consiste en la pérdida de un fragmento de ADN de un cromosoma. Puede ser en el extremo (terminal) o a lo largo de uno de los brazos del cromosoma (intersticial). Una duplicación es la repetición de un fragmento de cromosoma a continuación del fragmento original. Un polimorfismo de un solo nucleótido o SNP (Single Nucleotide Polymorphism, pronunciado esnip) es una variación en la secuencia de ADN que afecta a una sola base (adenina [A], timina [T], citosina [C] o guanina [G]) de una secuencia del genoma. Sin embargo, algunos autores consideran que cambios de unos pocos nucleótidos como pequeñas inserciones y deleciones (indels) pueden ser consideradas SNP, donde el término polimorfismo de nucleótido simple es más adecuado. Una de estas variaciones debe darse al menos en un 1% de la población para ser considerada un SNP. Si no se llega al 1% no se considera SNP y sí una mutación puntual. Las Copy-number variations (CNV) son alteraciones del ADN del genoma que resulta de tener un número anormal de copias de una o más secciones del ADN. Las CNV corresponden a regiones relativamente amplias del genoma que han sido suprimidas o amplificadas en ciertos cromosomas.
MétodoEn esta revisión se describen de forma sistemática las publicaciones en GWAS en esquizofrenia. Se ha realizado una búsqueda a través de Pubmed con las palabras clave: GWAS and (psicosis) or (schizophrenia). Se ha consultado la página http://www.szgene.org/largescale.asp donde aparecen todas las publicaciones de estudios GWAS en esquizofrenia, además de otras publicaciones de estudios a gran escala no GWAS en esquizofrenia. También se ha consultado la página www.genome.gov/gwastudies/ para contrastar los resultados y estudios vinculados a los GWAS que se han citado en esta revisión.
Con las palabras clave GWAS and schizophrenia se han encontrado 55 publicaciones, de las cuales 12 eras revisiones y 43 publicaciones originales publicadas entre los años 2011 y 2009. Con las palabras clave GWAS and psychosis han resultado 8 publicaciones, 7 de ellas ya aparecían anteriormente.
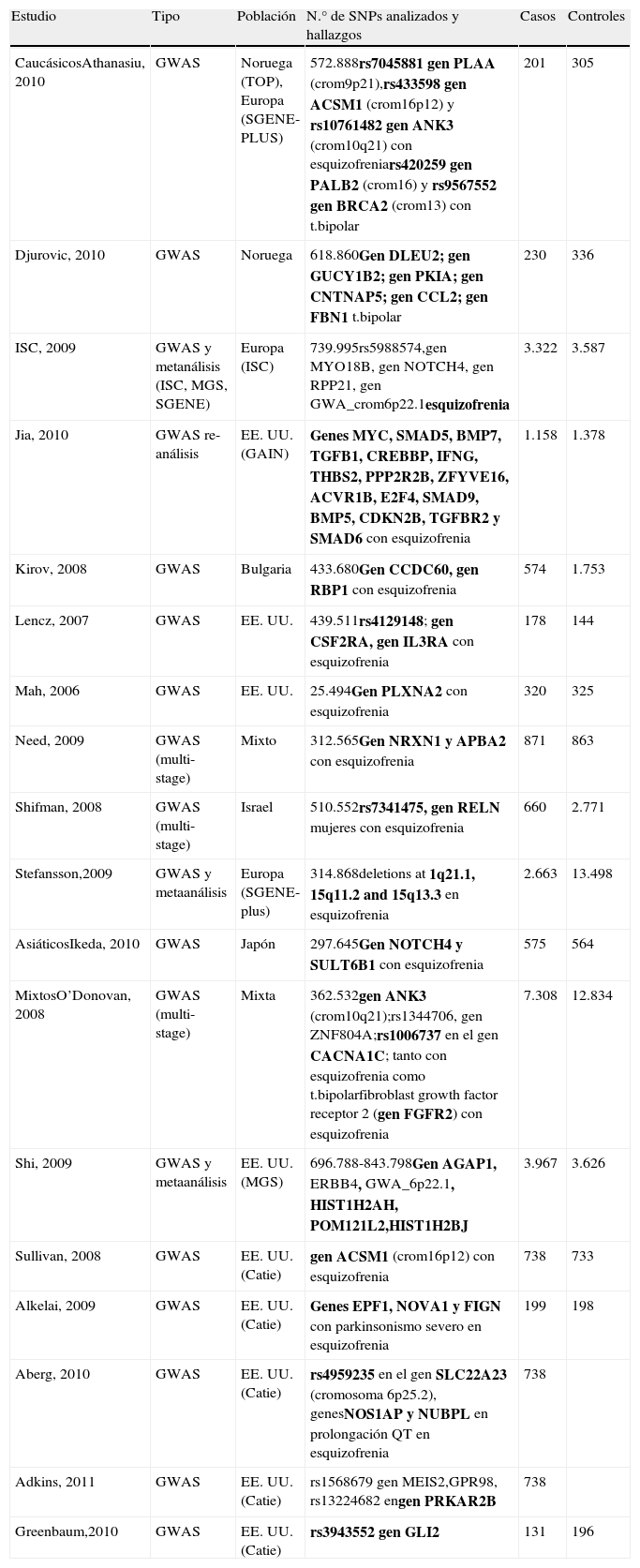
En la tabla 1 se resumen todos los GWAS en esquizofrenia publicados hasta la fecha.
Resumen de los GWAS en esquizofrenia
| Estudio | Tipo | Población | N.° de SNPs analizados y hallazgos | Casos | Controles |
| CaucásicosAthanasiu, 2010 | GWAS | Noruega (TOP), Europa (SGENE-PLUS) | 572.888rs7045881 gen PLAA (crom9p21),rs433598 gen ACSM1 (crom16p12) y rs10761482 gen ANK3 (crom10q21) con esquizofreniars420259 gen PALB2 (crom16) y rs9567552 gen BRCA2 (crom13) con t.bipolar | 201 | 305 |
| Djurovic, 2010 | GWAS | Noruega | 618.860Gen DLEU2; gen GUCY1B2; gen PKIA; gen CNTNAP5; gen CCL2; gen FBN1 t.bipolar | 230 | 336 |
| ISC, 2009 | GWAS y metanálisis (ISC, MGS, SGENE) | Europa (ISC) | 739.995rs5988574,gen MYO18B, gen NOTCH4, gen RPP21, gen GWA_crom6p22.1esquizofrenia | 3.322 | 3.587 |
| Jia, 2010 | GWAS re-análisis | EE. UU. (GAIN) | Genes MYC, SMAD5, BMP7, TGFB1, CREBBP, IFNG, THBS2, PPP2R2B, ZFYVE16, ACVR1B, E2F4, SMAD9, BMP5, CDKN2B, TGFBR2 y SMAD6 con esquizofrenia | 1.158 | 1.378 |
| Kirov, 2008 | GWAS | Bulgaria | 433.680Gen CCDC60, gen RBP1 con esquizofrenia | 574 | 1.753 |
| Lencz, 2007 | GWAS | EE. UU. | 439.511rs4129148; gen CSF2RA, gen IL3RA con esquizofrenia | 178 | 144 |
| Mah, 2006 | GWAS | EE. UU. | 25.494Gen PLXNA2 con esquizofrenia | 320 | 325 |
| Need, 2009 | GWAS (multi-stage) | Mixto | 312.565Gen NRXN1 y APBA2 con esquizofrenia | 871 | 863 |
| Shifman, 2008 | GWAS (multi-stage) | Israel | 510.552rs7341475, gen RELN mujeres con esquizofrenia | 660 | 2.771 |
| Stefansson,2009 | GWAS y metaanálisis | Europa (SGENE-plus) | 314.868deletions at 1q21.1, 15q11.2 and 15q13.3 en esquizofrenia | 2.663 | 13.498 |
| AsiáticosIkeda, 2010 | GWAS | Japón | 297.645Gen NOTCH4 y SULT6B1 con esquizofrenia | 575 | 564 |
| MixtosO’Donovan, 2008 | GWAS (multi-stage) | Mixta | 362.532gen ANK3 (crom10q21);rs1344706, gen ZNF804A;rs1006737 en el gen CACNA1C; tanto con esquizofrenia como t.bipolarfibroblast growth factor receptor 2 (gen FGFR2) con esquizofrenia | 7.308 | 12.834 |
| Shi, 2009 | GWAS y metaanálisis | EE. UU. (MGS) | 696.788-843.798Gen AGAP1, ERBB4, GWA_6p22.1, HIST1H2AH, POM121L2,HIST1H2BJ | 3.967 | 3.626 |
| Sullivan, 2008 | GWAS | EE. UU. (Catie) | gen ACSM1 (crom16p12) con esquizofrenia | 738 | 733 |
| Alkelai, 2009 | GWAS | EE. UU. (Catie) | Genes EPF1, NOVA1 y FIGN con parkinsonismo severo en esquizofrenia | 199 | 198 |
| Aberg, 2010 | GWAS | EE. UU. (Catie) | rs4959235 en el gen SLC22A23 (cromosoma 6p25.2), genesNOS1AP y NUBPL en prolongación QT en esquizofrenia | 738 | |
| Adkins, 2011 | GWAS | EE. UU. (Catie) | rs1568679 gen MEIS2,GPR98, rs13224682 engen PRKAR2B | 738 | |
| Greenbaum,2010 | GWAS | EE. UU. (Catie) | rs3943552 gen GLI2 | 131 | 196 |
La heredabilidad de la esquizofrenia llega hasta el 80% y los familiares de personas que la padecen presentan entre 5-10 veces más riesgo de presentarla respecto a la población general6. Los individuos con esquizofrenia presentan una probabilidad significativamente mayor de presentar delecciones y duplicaciones7 en su genoma.
En los últimos GWAS se han postulado orígenes genéticos comunes entre esquizofrenia, autismo y trastorno bipolar8. A través de tecnología de secuenciación de genoma se han unido estudios de variación genética estructural como los Copy Number variants (CNV) con las variaciones genéticas raras para complementar los estudios de interacciones gen-gen. La mayoría de las CNV son únicas en los cromosomas 1q21.1, 15q11.2, 15q13.3, 16p11.2, 17p12, 22q11.27,9–11, habiéndose visto implicadas también en el autismo y otros trastornos del desarrollo10. Duplicaciones y quizás también supresiones en el cromosoma 16p13.1, asociadas anteriormente a autismo y retraso mental, también se han relacionado con riesgo de esquizofrenia12.
En un estudio GWAS realizado en Noruega13 se incluyó una muestra de 210 casos y 305 controles y se asociaron con esquizofrenia los Simple Nucleotide Polimorfisms (SNP) rs7045881 en el cromosoma 9p21; rs433598 en el 16p12 y rs10761482 en el 10q21. Estos marcadores fueron localizados en los genes PLAA, ACSM1 y ANK3, respectivamente. El gen PLAA (en el cromosoma 9) no había sido descrito previamente como un gen de susceptibilidad, pero el cromosoma 9p21 ya se había implicado anteriormente como una región linkage para esquizofrenia. El gen ACSM1 (en el cromosoma 16) se había sido identificado previamente como gen de susceptibilidad para la esquizofrenia en el estudio CATIE14 y el gen ANK3 (en el cromosoma 10) ha sido asociado tanto con la esquizofrenia como con el trastorno bipolar, apoyando la hipótesis de susceptibilidad genética solapada entre estas entidades psicopatológicas8,15. También se han asociado el SNP rs1344706 en el gen ZNF804A (que codifica en la proteína 804A) y el SNP rs1006737 en el gen CACNA1C en el cromosoma 12 (que codifica en la subunidad alfa 1C) como regiones relacionadas tanto con la esquizofrenia como con el trastorno bipolar15, últimamente apuntando a una posible modulación del género en el riesgo de aparición de esquizofrenia16. Estos últimos resultados han vuelto a ser replicados por el mismo grupo de Cardiff durante el año 201017,18, pero recientemente el grupo de Schanze et al. no han podido replicar la asociación del gen ZNF804A con la esquizofrenia19.
A partir de la misma muestra noruega se investigó la relación entre variantes genéticas en los SNP rs420259 en el gen PALB2 (cromosoma 16) y rs9567552 en el gen BRCA2 (en el cromosoma 13), relacionadas con funciones intracelulares de proteínas expresadas en el cáncer de mama, con la esquizofrenia y el trastorno bipolar. Se analizó una muestra de 781 pacientes con esquizofrenia y 686 con trastorno bipolar y se observó relación entre estas variantes genéticas y el trastorno bipolar, pero no con la esquizofrenia20.
En otro estudio realizado en EE. UU. durante 201021 se combinaron datos GWAS con datos de tres grandes estudios de efectividad, incluyendo una muestra de personas con esquizofrenia (CATIE n=741), con trastorno bipolar (STEP-BD, n=1.575) y con trastorno depresivo mayor (STAR*D, n=1.204). Se asoció el SNP rs6484218, próximo al gen de la adrenomedulina en el cromosoma 11p15, con el trastorno bipolar II pero no con el resto de trastornos psiquiátricos. En un estudio GWAS europeo publicado recientemente22 también se han asociado variaciones en diversos genes del cromosoma 11 (AMBRA1, DGKZ, CHR y MDK) con la esquizofrenia. Se incluyó una muestra bien tipificada y homogénea de 1.169 pacientes (464 de Alemania, 705 de Holanda) y 3.714 controles apareados por etnia. Se hizo posteriormente un estudio de seguimiento en 2.569 personas con esquizofrenia y 4.088 controles (de Alemania, Holanda y Dinamarca). Estos hallazgos fueron replicados nuevamente en 23.206 muestras independientes de ascendentes europeos (p=0,0029, OR=1,11). En un estudio de neuroimagen realizado a partir de la muestra portadores sanos del alelo de riesgo presentaron una activación alterada en el córtex cingulado durante las tareas de control cognitivo. El área de interés correspondió a una interface entre la regulación emocional y cognición que resulta anormal tanto a nivel funcional como estructural en personas con esquizofrenia y con trastorno bipolar.
Los SNPs rs7683874 y rs10937823 en el gen SORCS2 del cromosoma 4p15-p16 también se han identificado en algunos estudios genéticos como regiones candidatas de riesgo para el trastorno bipolar y esquizofrenia23.
El metabolismo de glutamato, el proceso de apoptosis, el inflamatorio y el sistema inmunológico (TNF-beta, TNFR1) son vías de señalización que se han asociado a la esquizofrenia24. Un estudio GWAS realizado por O’Donovan et al.25 con una muestra procedente de EE. UU., Australia, Alemania, China, Japón, Israel y Suecia de 5.142 casos de esquizofrenia y 6.561 controles encontró evidencia de asociación entre esquizofrenia y el SNP rs17101921 cercano a la región genética que codifica para el receptor 2 del factor de crecimiento de fibroblastos (FGFR2). Este factor de crecimiento se asocia a un aumento del índice de actividad mitótica y síntesis de ADN facilitando la proliferación de varias células precursoras, como el condroblasto, colagenoblasto, osteoblasto, etc. que forman el tejido fibroso, de unión y soporte del cuerpo. Este factor también ha sido relacionado con la angiogénesis tumoral en los procesos oncogénicos.
Tanto la esquizofrenia como el trastorno bipolar, así como otros trastornos psiquiátricos como el autismo, trastornos específicos del lenguaje o problemas de aprendizaje se han relacionado con alteraciones en una serie de genes (NRXN1, CNTNAP2 y CASK) asociados a los circuitos de adhesión molecular (CAM) que serian responsables de la formación sináptica y de la transmisión celular normal26,27.
Se han realizado GWAS en poblaciones étnicas diferentes con el objetivo de buscar diferencias en la susceptibilidad genética para la esquizofrenia. Recientemente en un proyecto GWAS basado en las familias28, donde se incluyó una muestra de 107 familias judías-israelíes, se ha encontrado una asociación entre el gen DOCK4 (SNP rs2074127, p=1.134×10−7) y 6 asociaciones adicionales significativas (p<1×10−5). Uno de los SNP (rs4803480), localizado en el gen CEACAM21, fue replicado significativamente en una muestra basada en la familia de origen árabe-israelí (p=0,002). También se encontraron asociaciones significativas con los genes PGBD1, RELN y PRODH, replicando resultados previos obtenidos en otros estudios.
En un GWAS realizado en población asiática29 con una cohorte de población japonesa y china de 2.535 individuos el valor más significativo fue para un SNP en el gen ELAVL2 (embryonic lethal, abnormal vision, Drosophila-like 2) en el cromosoma 9p21,3 (p=0,00087).
Hallazgos en la inducción de efectos secundarios motores, cardíacos y metabólicosExiste una elevada tasa de efectos secundarios en las personas que reciben tratamiento antipsicótico. La presencia de parkinsonismo inducido por antipsicóticos es un efecto adverso severo del tratamiento neuroléptico. Factores como el tipo de tratamiento, edad avanzada y género femenino se han asociado a un mayor riesgo de presentar efectos secundarios, pero evidenciándose diferente susceptibilidad individual a padecerlos. Este hecho ha motivado que los GWAS se hayan focalizado en el estudio de algunos genes que puedan intervenir en la aparición de efectos secundarios.
En el estudio CATIE se incluyó un análisis GWAS centrado en este tipo de efectos secundarios30 y se analizó una muestra americana de 199 personas con esquizofrenia. Se aleatorizó al tratamiento antipsicótico en monoterapia y se hizo un seguimiento durante un periodo comprendido entre 2 semanas y 18 meses durante la primera fase del estudio CATIE. Se monitorizaron los efectos parkinsonianos y se identificaron los genes EPF1, NOVA1 y FIGN como genes candidatos asociados a parkinsonismo severo secundario al tratamiento.
También a partir del estudio CATIE se analizó una muestra de 738 personas con esquizofrenia para estudiar la relación de algunos antipsicóticos con la prolongación del intervalo cardíaco QT y riesgo de arritmias cardíacas. Se asoció la presencia del SNP rs4959235 en el gen SLC22A23 (cromosoma 6p25,2) con la prolongación del QT cardíaco en el caso de la quetiapina31.
Una submuestra de Israel del estudio CATIE32 se utilizó para analizar los posibles genes candidatos que influían en la presentación de discinesia tardía en personas con esquizofrenia crónica. Se incluyó una muestra de 327 personas con esquizofrenia en tratamiento antipsicótico procedente del estudio CATIE y analizaron unos 495.000 polimorfismos nucleótidos simples. Asociaron el SNPs rs3943552 en el gen GLI2 con la discinesia tardía, hecho que había sido ya observado en la submuestras de pacientes judíos de Ashkenazi.
Por último, se ha estudiado la variación genética que puede afectar la susceptibilidad a presentar efectos secundarios metabólicos. En la misma muestra del estudio CATIE33 se asociaron 21 polimorfismos con efectos secundarios de tipo metabólico, como la ganancia de peso inducida por medicación antipsicótica, perfil lipídico sanguíneo, glucemia y hemoglobina A1C, presión arterial y ratio cardíaco. El gen MEIS2, en el cromosoma 15q14, mediaba tanto en los efectos de la risperidona en la circunferencia de cadera (q=0,004) como en la circunferencia de cintura (q=0.055), además de tener asociaciones secundarias sobre el IMC y la presión diastólica y sistólica. Otro hallazgo significativo fue con el gen GPR98 (en el cromosoma 5q14.3) que actuaba de mediador en los efectos de la risperidona sobre los niveles de hemoglobina A1C. Otros genes mediadores de efectos metabólicos fueron el PRKAR2B, FHOD3, RNF144A, ASTN2, SOX5 y ATF7IP2.
Aunque el índice de masa corporal (IMC) ha sido ampliamente estudiado en los GWAS, se han asociado más de una docena de variantes pero que solo justifican individualmente una pequeña proporción de la varianza. Por este motivo se ha planteado calcular el genetic risk sum score (GRSS) que comprende el total de los alelos de riesgo detectados. Peterson et al.17 cogieron una muestra de 2,653 caucásicos y 973 afroamericanos correspondiente a 2 metaanálisis y calcularon el GRSS con covariables que influencian en el IMC (edad, sexo, ascendencia…). Se demostró una elevada asociación con el IMC (p=3,19 x10-6), pero que explicaba una parte limitada de la varianza (0,66%). El GRSS y las covariables predecían significativamente la clasificación de sobrepeso y obesidad pero con la máxima discriminación para la obesidad tipo III (AUC=0,697).
Hallazgos en neurocogniciónLos estudios GWAS en el campo de la neurocognición en esquizofrenia se han centrado sus esfuerzos en la identificación de variaciones genéticas implicadas en la modulación de la cognición. Han planteado el uso de técnicas que combinen la neuroimagen funcional como fenotipo cuantitativo en combinación con los estudios GWAS, representando un paso adelante para el mejor conocimiento de los aspectos cognitivos en la esquizofrenia. Estos estudios se basan en medir el consumo de oxigenación sanguínea (BOLD) en el córtex prefrontal dorsolateral durante la evaluación de una tarea de memoria de trabajo (con el paradigma de Stenberg) tanto en combinación con el escaneado genómico. Esta técnica puede proveer mayor poder estadístico que el que poseen ambas pruebas por separado34.
Hippisley-Cox et al.35 realizaron un GWAS en 2007 que estudió el riesgo de 6 cánceres comunes en personas con esquizofrenia. En una muestra de 40.441 individuos con cáncer se detectaron 107 individuos caucasianos con esquizofrenia y se compararon con 112 controles sanos, genotipando el efecto de la variación MET. Se exploró el funcionamiento cognitivo en una muestra de 191 personas con esquizofrenia y 188 controles sanos, reportándose una asociación importante entre el proto-oncogen MET y la susceptibilidad a padecer esquizofrenia. Se asoció la presencia de 2 o más copias del haplotipo GCAATACA con menor probabilidad de desarrollar esquizofrenia respecto a los sujetos que no presentaban copias. También se reportó que los portadores del genotipo METGCAATACA presentaban un impacto significativamente positivo en la neurocognición.
Varios polimorfismos del gen complexina 2 se han relacionado con una modificación en el rendimiento cognitivo en personas con esquizofrenia respecto a población control. En un estudio multicéntrico realizado en 23 centros psiquiátricos en Alemania36 se analizó una muestra de 1.037 pacientes con esquizofrenia y 2.265 sujetos controles sanos. Se valoraron los principales parámetros de rendimiento cognitivo, incluyendo la medida del funcionamiento ejecutivo, el razonamiento, el aprendizaje verbal y memoria. Seis polimorfismos distribuidos en el gen de la complexina 2 resultaron ser altamente asociados con la cognición actual de los sujetos esquizofrénicos, pero solo marginalmente con la inteligencia premórbida. Estos estudios dónde los sujetos fueron examinados por un equipo investigador único dieron lugar a la base de datos Göttingen Research Association for Schizophrenia (GRAS)37. Los GRAS, creados en Alemania a partir de la recogida de datos por un único equipo investigador, apuntan a ser el fundamento para estudiar las causas genéticas del fenotipo esquizofrénico en un «estudio de asociación genética basada en el fenotipo (PGA)». Es importante destacar que estos estudios no son estudios GWAS pero sus resultados son complementarios a los obtenidos por los estudios de asociación de genoma completo (GWAS) sobre esquizofrenia37.
En un estudio realizado con una muestra de 738 pacientes con esquizofrenia procedente del estudio CATIE38 se pasaron diversas baterías neurocognitivas para medir la velocidad de procesamiento, memoria verbal, vigilancia, razonamiento y varios dominios de la memoria de trabajo en función de 5 grupos de tratamientos antipsicóticos (olanzapina, perfenazina,quetiapina, risperidona y ziprasidona) que recibían los pacientes. Se localizaron 6 SNP localizados en la proximidad de los genes EHF, SLC26A9, DRD2, GPR137B, CHST8 e IL1A como mediadores de la cognición. Además, de manera más robusta, se asociaron las puntuaciones neurocognitivas con el SNP rs286913 en el gen EHF gene (p=6,99×10−8) mediando los efectos de la ziprasidona en la vigilancia, rs11240594 en el gen SLC26A9 (p=1,4×10−7) mediando los efectos de la olanzapina en la velocidad de procesamiento y el SNP rs11677416 en el gen IL1A (p=6,67×10−7) mediando los efectos de la olanzapina en la memoria de trabajo).
Por último destacar que la incorporación de los estudios de neuroimagen y de manipulación óptica a los estudios GWAS han permitido implicar a los genes que codifican para el FGF17 y el Glypican-1 en el desarrollo cerebral de los síntomas negativos de la esquizofrenia39.
Aspectos prácticos en la elaboración de GWASExisten artículos que analizan la metodología de los numerosos estudios GWAS5,40-42. En estos artículos se hace especial hincapié en la importancia de los estudios familiares ya que demuestran responsabilidad familiar compartida a través de los límites diagnósticos (tanto en la esquizofrenia como en el trastorno bipolar)40.
Sanders et al.43 proponen el uso de la tecnología a través de Internet para la creación de bases de datos de controles que permitan compartirlas entre investigadores y seleccionar correctamente controles para este tipo de estudios43.
Recientemente se ha realizado un metaanálisis44 según dos diferentes métodos, genome scan meta-analysis (GSMA) y Badner and Gershon's multiple scan probability method (MSP) aplicados a 13 y 16 bases de datos de trastorno bipolar y esquizofrenia, respectivamente. Los autores han encontrado que los dos métodos dan lugar a regiones genómicas diferentes sugiriendo que los comparative linkage meta-analysis (CLMA) podrían ser utilizados para optimizar los descubrimientos de variantes raras y de baja frecuencia en la era genómica moderna. Otra alternativa para mejorar los hallazgos derivados de los estudios GWAS es el SNP-based pathway enrichment method45. Este método sigue dos pasos: en el primero se utiliza un producto estadístico truncado para identificar todos los SNP representativos de cada gen, calculando la media de SNP representativos de los genes y seleccionando aquellos representativos en base a su posición. Posteriormente, se los ordena por significación de su asociación estadística con el rasgo de interés aplica un test de Kolmogorov-Smirnov.
Respecto a las técnicas utilizadas en los GWAS, se han propuesto el test de haplotipo que utiliza un modelo para el análisis de multimarcadores de variantes raras en regiones candidatas que podrían estar relacionadas con la aparición de esquizofrenia46.
DiscusiónLos descubrimientos de los estudios GWAS y estudios genéticos relacionados con los GWAS se centran en diversos aspectos de la esquizofrenia. En el ámbito puramente genético se han descrito variaciones genéticas en diversos cromosomas comunes entre diferentes patologías como la esquizofrenia, el trastorno bipolar y el autismo. Todos estos hallazgos apuntan a una posible etiología común para diversos trastornos psiquiátricos como la esquizofrenia y el trastorno bipolar2.
Muchos de los hallazgos en esquizofrenia se han relacionado con diferentes circuitos de desarrollo de proteínas (fibroblastos, condroblastos) que participan en funciones de soporte del cuerpo, en la angiogénesis tumoral de los procesos oncogénicos, así como con los circuitos de adhesión molecular (CAM) responsables de la formación sináptica y de la transmisión celular normal. Esto permite establecer nuevas hipótesis causales en la esquizofrenia planteando modelos de afectación multisistémica y no únicamente psiquiátrica como ya ha sido planteado por algún autor previamente47,48.
Conocer como modulan los genes la aparición de efectos adversos secundarios puede ayudar a su mejor tipificación, conocimiento y a prevenir su aparición. El mejor conocimiento de la neurocognición en la esquizofrenia y su filiación con alteraciones genéticas puede permitir conocer mejor el funcionamiento cognitivo de nuestros pacientes y orientar las terapias de rehabilitación cognitiva de manera más resolutiva.
Las limitaciones de los estudios GWAS están relacionadas básicamente con el rastreo genómico a gran escala. Estos estudios no permiten la búsqueda asociada a un único gen o cromosoma que se haya asociado a mayor susceptibilidad. Por este motivo, recientemente, el International Schizophrenia Consortium (ISC) ha buscado diversas alternativas. Han reportado que usar métodos de análisis como el polygenic score method podría detectar la presencia de asociaciones marginales entre los alelos de susceptibilidad para la esquizofrenia con otros SNP (eQTL) que afectan la expresión genética y que esta asociación podría conferir mayor riesgo a padecer esquizofrenia respecto a los que no presentan esta asociación marginal con SNP cis-eQTL49. Otra limitación de los estudios GWAS se relaciona con el elevado coste que conllevan. Su coste-beneficio es a veces dudoso y esto ha llevado a nuevos enfoques que fusionen los resultados genéticos de los estudios GWAS con los de estudios ambientales o epidemiológicos.
ConclusionesAunque se han abierto nuevas líneas de trabajo a través de los GWAS realizados en los últimos años no se ha podido concluir con un conocimiento específico que permita su aplicación directa en la práctica clínica diaria. Estas limitaciones han llevado a algunos investigadores a plantearse un trabajo multidisciplinar que fusione el estudio de genes y el de ambiente. Así surge el proyecto The European Network of Schizophrenia Networks for the Study of Gen-Environtment Interactions (EU-GEI)7 en el cual diversas disciplinas se complementan de manera imprescindible para el estudio de las interacciones gen-ambiente. De esta propuesta pueden surgir resultados prometedores.
En los próximos años se requerirá elaborar nuevos estudios que incluyan metanálisis de más de 10.000 sujetos2, que profundicen en la naturaleza de los factores ambientales, que permitan explicar la interacción gen-ambiente, la naturaleza de la variación genética y el mecanismo de las interacciones gen-ambiente50.
Este nuevo enfoque puede representar un paso adelante en el conocimiento de la esquizofrenia para redefinir mejor el trastorno, conocer su etiología y orientar nuevas dianas de tratamiento que permitan reducir las secuelas y mejorar el control sintomatológico en nuestros pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.