El trastorno depresivo mayor (TDM) es una enfermedad psiquiátrica grave cuyo tratamiento sigue siendo un reto en la actualidad. Vortioxetina es un nuevo fármaco antidepresivo con acción multimodal, lo que le confiere un perfil único. Su efectividad antidepresiva ha sido demostrada en varios estudios a corto y largo plazo, con 7 estudios aleatorizados positivos, 4 negativos y uno nulo. Además, su capacidad para modular varios neurotransmisores (serotonina, dopamina, noradrenalina, histamina, glutamato y GABA) le permite actuar sobre dominios como la cognición. Su perfil de efectos adversos es también distinto al de otros antidepresivos convencionales, dado que se relaciona con una baja incidencia de disfunción sexual, aumento de peso o alteraciones cardiovasculares. En esta revisión sistemática se describirán las características farmacológicas de vortioxetina y se detallará la evidencia disponible respecto a su eficacia clínica, su tolerabilidad y su prometedor efecto sobre los síntomas cognitivos.
Major Depressive Disorder (MDD) is a serious psychiatric condition. Its treatment remains a challenge nowadays. Vortioxetine is a novel antidepressant with a unique profile, as it acts as a multimodal serotoninergic agent. Its efficacy in MDD has been established in many short- and long-term studies, with 7 positive, 4 negative and 1 failed randomized controlled trials. Moreover, its ability to modulate a wide range of neurotransmitters (serotonin, dopamine, norepinephrine, histamine, glutamate or GABA) confers vortioxetine pro-cognitive effects. Side effects are also different from conventional antidepressants, according to its low incidence of sexual dysfunction, weight gain or cardiovascular alterations. The aim of this systematic review is to describe the pharmacology, clinical efficacy and safety profile of vortioxetine, as well as its potential effectiveness in improving cognitive symptoms.
La falta de respuesta a los tratamientos antidepresivos disponibles sigue siendo uno de los grandes retos en psiquiatría. Hasta 1/3 de los pacientes con trastorno depresivo mayor (TDM) no alcanza una respuesta completa e, incluso en pacientes en remisión, es frecuente observar síntomas cognitivos residuales1-4.
Con esta necesidad en mente, y gracias al avance en el conocimiento sobre los circuitos neuronales implicados en el TDM5, están surgiendo moléculas con un mecanismo de acción que va más allá de la acción serotoninérgica6. El sistema monoaminérgico, que incluye las vías serotoninérgicas, noradrenérgicas y dopaminérgicas, se encuentra ampliamente extendido en el cerebro y se sabe que este sistema y sus múltiples interconexiones juegan un papel importante en los trastornos del estado de ánimo. Este concepto más integrador ha motivado la búsqueda de fármacos que modulen neurotransmisores involucrados en la regulación del sistema monoaminérgico, como el glutamato o el ácido γ-aminobutírico (GABA)7. Así, recientemente se ha incorporado al mercado el antidepresivo vortioxetina, el cual se caracteriza precisamente por poseer un mecanismo de acción multimodal. En esta revisión sistemática se describirá el perfil farmacológico de vortioxetina, se detallará la información disponible respecto a su eficacia clínica y seguridad, y se ahondará en la evidencia existente centrada en su prometedor efecto sobre los síntomas cognitivos.
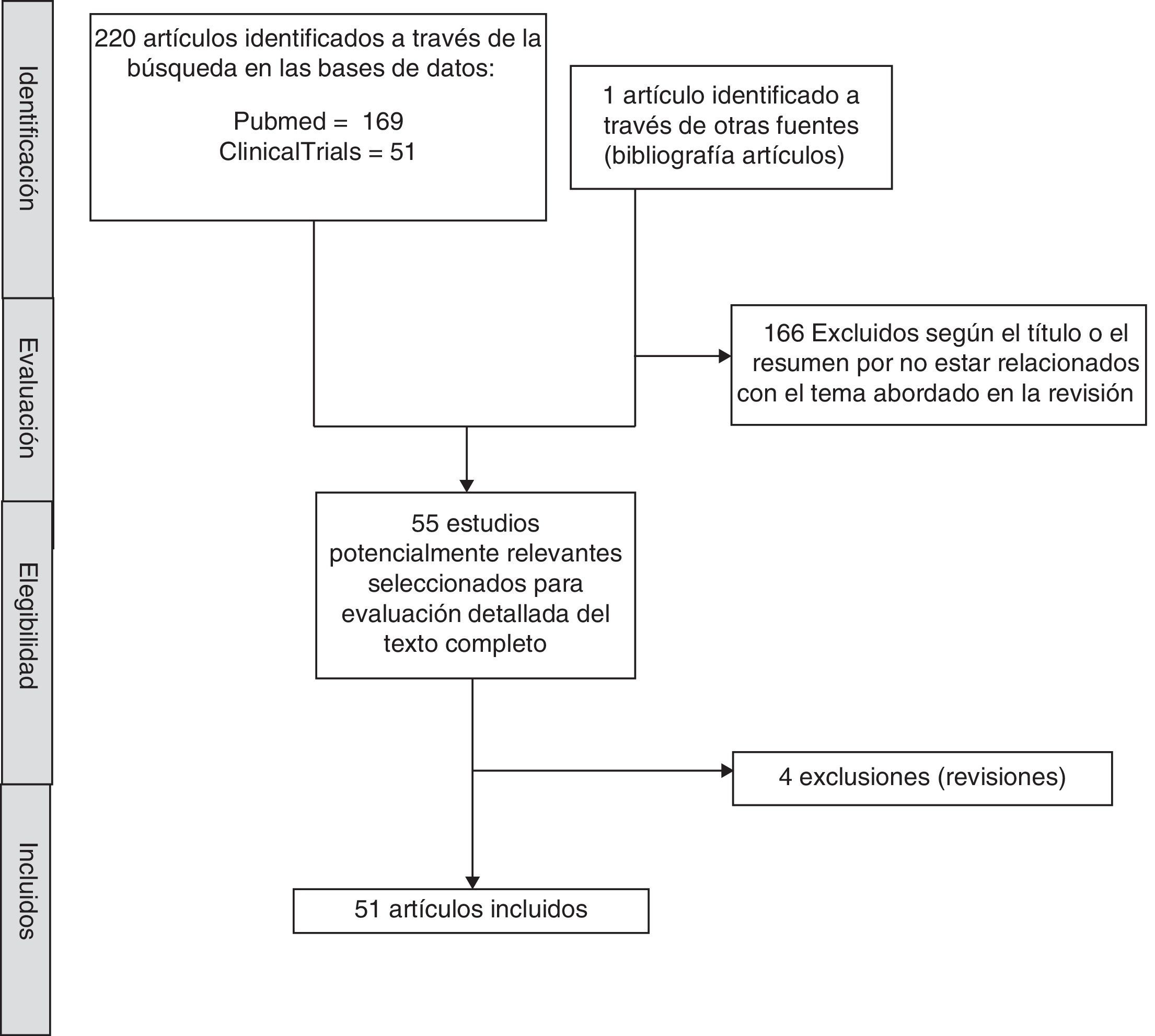
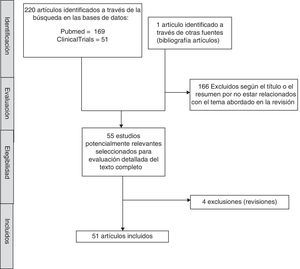
MétodosCon el objetivo de identificar estudios centrados en el antidepresivo vortioxetina se llevó a cabo una búsqueda sistemática de la literatura. La búsqueda se realizó en noviembre de 2016 en las bases de datos Pubmed y ClinicalTrials.gov. Los términos de búsqueda utilizados fueron «vortioxetine AND (“depression” or “depressive” or “action” or “effects” or “cognition”)» para la base de datos Pubmed y «vortioxetine AND depression» para ClinicalTrials.gov. Se incluyeron artículos preclínicos y que evaluasen el efecto de vortioxetina en adultos con TDM, publicados en lengua inglesa, sin límite de fecha. La búsqueda se completó revisando manualmente las referencias de los artículos primeramente seleccionados y de artículos de revisión sobre el tema, con lo que finalmente se identificaron 221 artículos de los cuales se han incluido 51. El proceso de selección se describe en detalle en la figura 1.
Perfil farmacológicoFarmacocinéticaVortioxetina se absorbe lentamente y presenta una biodisponibilidad absoluta del 75% tras la administración oral. Los alimentos no influyen en su farmacocinética. La concentración plasmática máxima se alcanza a las 7-11h y su vida media es de 57h8. Presenta una elevada tasa de unión a proteínas plasmáticas (96%)9 y se distribuye ampliamente en tejidos periféricos (volumen de distribución: 2.600l)10. Vortioxetina se metaboliza a nivel hepático a través de múltiples isoenzimas del citocromo P-450 (CYP450), como el CYP2D6, CYP3A4/5, CYP2C9, CYP2C19, CYP2A6, CYP2C8 y el CYP2B6, con una cinética linear9,11. Su principal metabolito es farmacológicamente inactivo y se excreta mayoritariamente a nivel renal8. Las concentraciones plasmáticas estables se alcanzan aproximadamente a las 2 semanas y no se requiere ajuste de dosis según edad, género, alteraciones renales o en caso de disfunción hepática leve-moderada12.
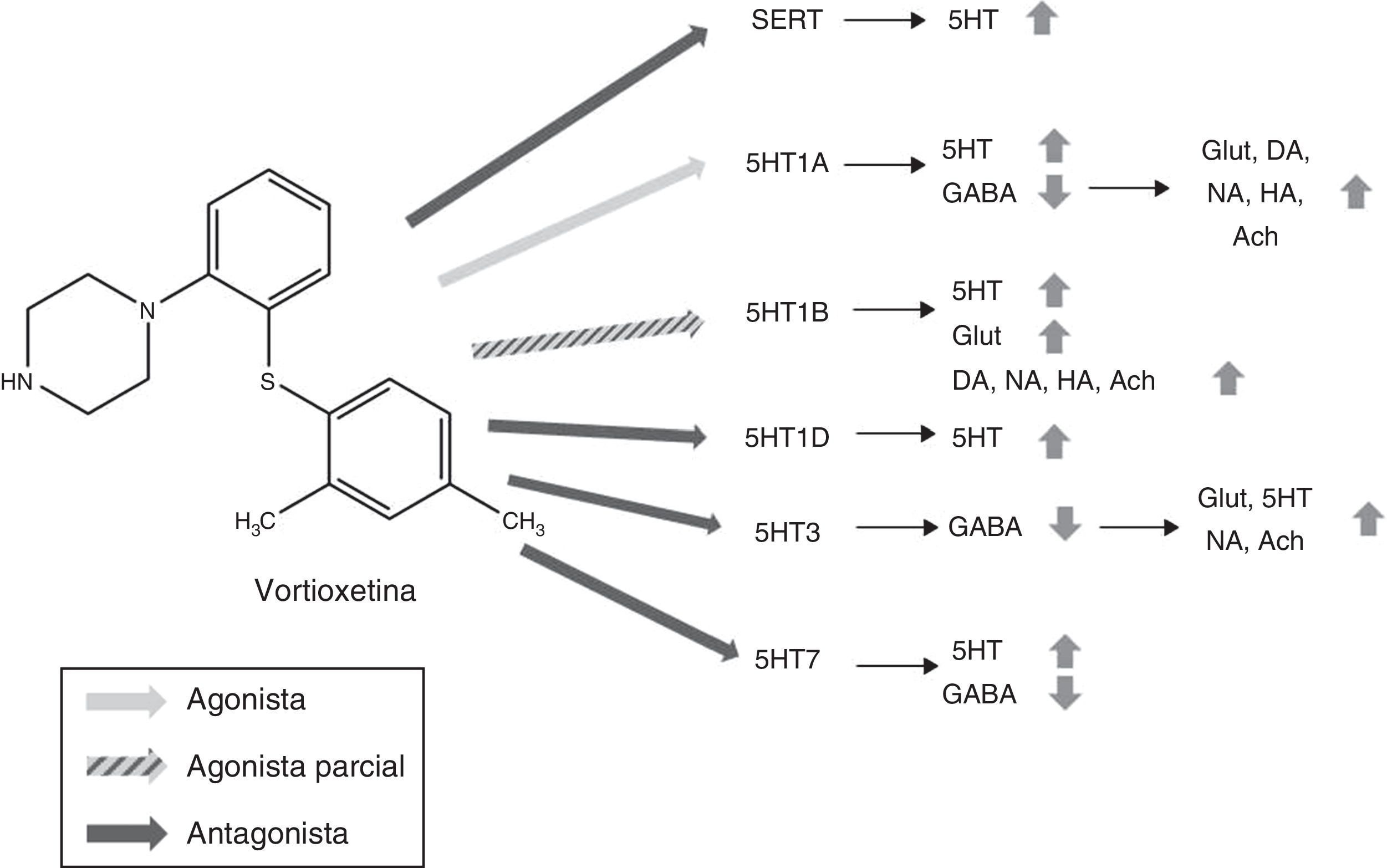
FarmacodinamiaVortioxetina actúa como inhibidor de los transportadores de serotonina (SERT) (Ki=1,6nM) y regula múltiples subtipos de receptores de serotonina (5HT): ejerce una acción agonista de los receptores 5HT1A (Ki=15nM), agonista parcial de los receptores 5HT1B (Ki=33nM) y antagonista de los receptores 5HT1D (Ki=54nM), 5HT3 (Ki=3,7nM) y 5HT7 (Ki=19nM)13-17. Tal y como reflejan las constantes de afinidad, vortioxetina presenta una elevada afinidad por los SERT18 y por los receptores 5HT3, por lo que hay que tener en cuenta que estos receptores se inhibirán con dosis bajas de vortioxetina pero se requerirán dosis altas para ocupar todos los receptores9.
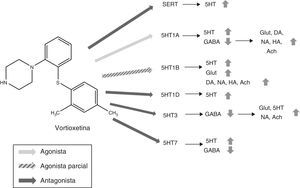
Mecanismo de acciónVortioxetina presenta un mecanismo de acción único y complejo. Al igual que los ISRS convencionales, es capaz de aumentar los niveles de serotonina a través de la inhibición de los SERT. No obstante, su acción sobre los diversos subtipos de receptores de 5HT le otorga unas propiedades características y hace que sea considerado un antidepresivo multimodal. En la figura 2 se resume el mecanismo de acción de vortioxetina y sus efectos sobre diversos neurotransmisores.
Mecanismo de acción propuesto para vortioxetina y sus efectos sobre diversos neurotransmisores.
(1) Antagonista SERT: el bloqueo de SERT provoca el aumento de los niveles de 5HT en todos los terminales presinápticos 5HT.
(2) Agonista 5HT1A: la estimulación de los autorreceptores presinápticos de 5HT1A provoca una desensibilización de los mismos, interrumpiendo el feedback negativo e induciendo por tanto un aumento de la liberación de serotonina. La estimulación de los receptores postsinápticos de 5HT1A, por su parte, inhibe interneuronas GABAérgicas lo cual favorece la liberación de Glut, NA, DA, Ach e HA en el córtex prefrontal.
(3) Agonista parcial 5HT1B: el bloqueo de los autorreceptores 5HT1B gracias a su acción como agonista parcial (o antagonista funcional) aumenta la concentración de 5HT. La acción agonista parcial de vortioxetina sobre los heterorreceptores postsinápticos 5HT1B localizados en las interneuronas GABAérgicas aumenta la liberación de Glut en hipocampo y córtex prefrontal. El bloqueo de estos heterorreceptores postsinápticos 5HT1B aumenta también la liberación de Ach, NA, DA y HA.
(4) Antagonista 5HT1D: el bloqueo de los autorreceptores de 5HT1D aumenta la liberación de 5HT.
(5) Antagonista 5HT3: el potente bloqueo de los receptores 5HT3 es el principal mecanismo por el cual se favorece la liberación de Glut en el hipocampo y córtex prefrontal gracias a la interrupción de una importante población de interneuronas GABA. Esto, a su vez, conlleva el aumento de los niveles de NA y Ach.
(6) Antagonista 5HT7: el bloqueo de los receptores 5HT7 localizados en las neuronas GABAérgicas de los núcleos del rafe aumenta la liberación de 5HT.
5HT: serotonina; Ach: acetilcolina; DA: dopamina; GABA: ácido γ-aminobutírico; Glut: glutamato; HA: histamina; NA: noradrenalina; SERT: transportadores de la recaptación de serotonina.
Fuente: Stahl17,19-21.
Las neuronas 5HT abundan en el cerebro, especialmente en el córtex prefrontal y el hipocampo —áreas cerebrales involucradas tanto en los síntomas afectivos como en los síntomas cognitivos del TDM22— e interactúan con un gran número de neuronas glutamatérgicas y GABAérgicas19. Se ha propuesto que vortioxetina inhibiría la liberación de GABA, el principal neurotransmisor inhibidor del organismo, a través de la estimulación de los receptores 5HT1A y esto provocaría de manera secundaria la liberación de dopamina (DA), noradrenalina (NA), histamina (HA) y acetilcolina (Ach) en el córtex prefrontal20. El bloqueo de los heterorreceptores 5HT1B se considera otro mecanismo a través del cual vortioxetina aumentaría la liberación de DA, NA, Ach e HA20. Estudios preclínicos apoyan estas hipótesis, ya que se ha observado que vortioxetina aumenta los niveles de Ach, HA, DA y NA en hipocampo y córtex prefrontal medial medidos por microdiálisis23-25.
Asimismo, el bloqueo del receptor 5HT3, que se expresa selectivamente en las interneuronas GABAérgicas26, interrumpe la inhibición GABAérgica y aumenta la liberación de glutamato y secundariamente de 5HT19,26, NA y Ach21. Por otro lado, vortioxetina bloquea sistemas autorreguladores (5HT1B, 5HT1D, 5HT7)17, lo que permite frenar el feedback negativo que sí padecen fármacos como los ISRS y que limita su acción9.
En resumen, los múltiples lugares de acción de vortioxetina lograrían incrementar los niveles de 5HT, DA, NA, Ach y HA en diversas redes neuronales cerebrales. Asimismo, su capacidad para aumentar la liberación de serotonina a través de la modulación de varios receptores, y no únicamente actuando sobre los SERT, permite que a dosis terapéuticas el bloqueo de los SERT pueda ser mucho menor que en el caso de los ISRS, lo que favorecería una mejor tolerancia.
EfectividadEstudios preclínicos han demostrado que vortioxetina produce efectos ansiolíticos y antidepresivos14,27, siendo este efecto más pronunciado que con fluoxetina27.
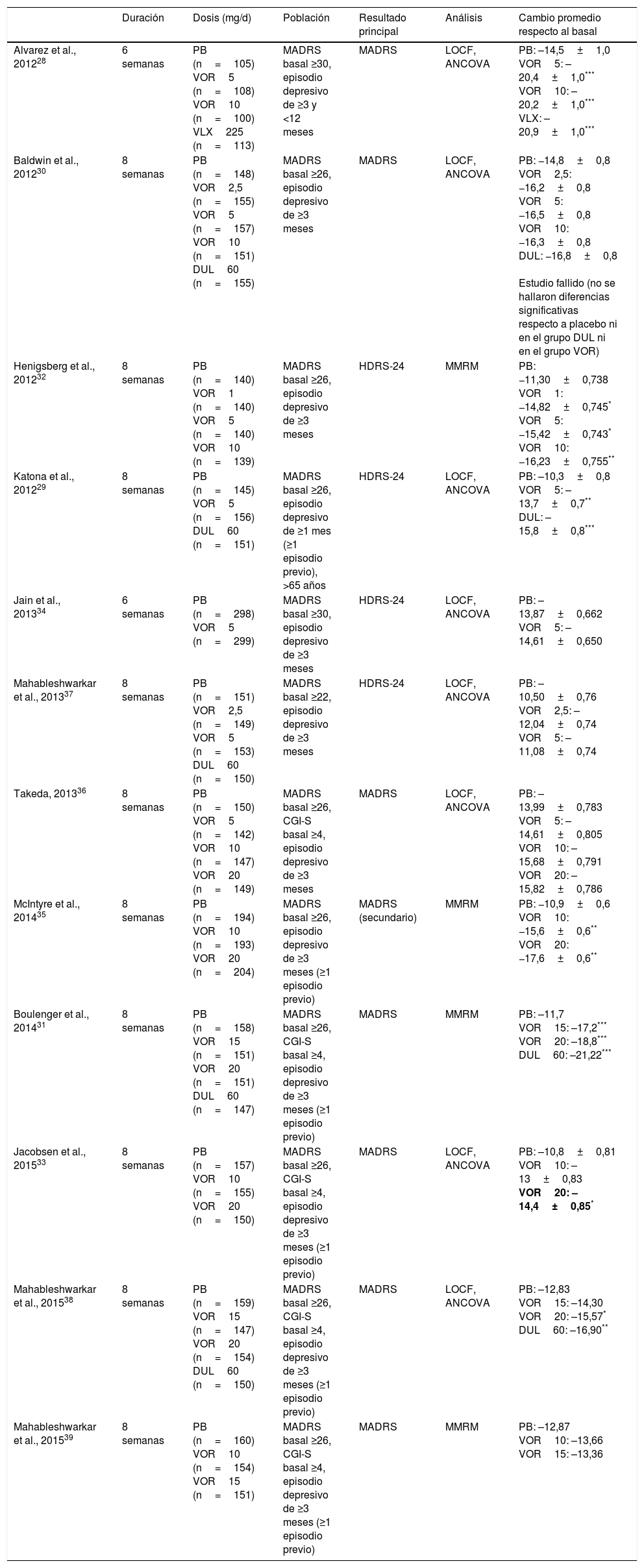
Hasta la fecha se han publicado 12 estudios aleatorizados, doble ciego, controlados por placebo que hayan valorado como resultado primario o secundario los cambios en los síntomas depresivos en pacientes adultos con TDM tratados con vortioxetina. Las principales características y resultados de estos estudios se resumen en la tabla 1. La duración media de estos estudios es de 6-8 semanas y el rango de dosis utilizado se sitúa entre 2,5-20mg/d28-39. En 8 de los 12 estudios el resultado principal escogido fue la diferencia en la puntuación final total de la Montgomery-Asberg Depression Scale (MADRS) respecto al basal28,30,31,33,35,36,38,39. Siete de los 12 estudios fueron positivos28,29,31-33,35,38 y 5 no hallaron diferencias significativas respecto a placebo30,34,36,37,39. De estos 5 estudios, uno se consideró fallido dado que ni vortioxetina ni duloxetina (comparador activo) mostraron diferencias significativas respecto a placebo en la reducción de la puntuación de la MADRS30. A la hora de interpretar estos datos, sin embargo, hay que tener en cuenta que es frecuente hallar resultados negativos en ensayos clínicos en TDM, incluso con fármacos considerados eficaces en el tratamiento de la depresión, tal y como indica el análisis llevado a cabo por Khin et al.40.
Efectividad de vortioxetina vs. placebo en ensayos clínicos aleatorizados, doble ciego, controlados por placebo en TDM
| Duración | Dosis (mg/d) | Población | Resultado principal | Análisis | Cambio promedio respecto al basal | |
|---|---|---|---|---|---|---|
| Alvarez et al., 201228 | 6 semanas | PB (n=105) VOR5 (n=108) VOR10 (n=100) VLX225 (n=113) | MADRS basal ≥30, episodio depresivo de ≥3 y <12 meses | MADRS | LOCF, ANCOVA | PB: –14,5±1,0 VOR5: –20,4±1,0*** VOR10: –20,2±1,0*** VLX: –20,9±1,0*** |
| Baldwin et al., 201230 | 8 semanas | PB (n=148) VOR2,5 (n=155) VOR5 (n=157) VOR10 (n=151) DUL60 (n=155) | MADRS basal ≥26, episodio depresivo de ≥3 meses | MADRS | LOCF, ANCOVA | PB: −14,8±0,8 VOR2,5: −16,2±0,8 VOR5: −16,5±0,8 VOR10: −16,3±0,8 DUL: −16,8±0,8 Estudio fallido (no se hallaron diferencias significativas respecto a placebo ni en el grupo DUL ni en el grupo VOR) |
| Henigsberg et al., 201232 | 8 semanas | PB (n=140) VOR1 (n=140) VOR5 (n=140) VOR10 (n=139) | MADRS basal ≥26, episodio depresivo de ≥3 meses | HDRS-24 | MMRM | PB: −11,30±0,738 VOR1: −14,82±0,745* VOR5: −15,42±0,743* VOR10: −16,23±0,755** |
| Katona et al., 201229 | 8 semanas | PB (n=145) VOR5 (n=156) DUL60 (n=151) | MADRS basal ≥26, episodio depresivo de ≥1 mes (≥1 episodio previo), >65 años | HDRS-24 | LOCF, ANCOVA | PB: –10,3±0,8 VOR5: –13,7±0,7** DUL: –15,8±0,8*** |
| Jain et al., 201334 | 6 semanas | PB (n=298) VOR5 (n=299) | MADRS basal ≥30, episodio depresivo de ≥3 meses | HDRS-24 | LOCF, ANCOVA | PB: –13,87±0,662 VOR5: –14,61±0,650 |
| Mahableshwarkar et al., 201337 | 8 semanas | PB (n=151) VOR2,5 (n=149) VOR5 (n=153) DUL60 (n=150) | MADRS basal ≥22, episodio depresivo de ≥3 meses | HDRS-24 | LOCF, ANCOVA | PB: –10,50±0,76 VOR2,5: –12,04±0,74 VOR5: –11,08±0,74 |
| Takeda, 201336 | 8 semanas | PB (n=150) VOR5 (n=142) VOR10 (n=147) VOR20 (n=149) | MADRS basal ≥26, CGI-S basal ≥4, episodio depresivo de ≥3 meses | MADRS | LOCF, ANCOVA | PB: –13,99±0,783 VOR5: –14,61±0,805 VOR10: –15,68±0,791 VOR20: –15,82±0,786 |
| McIntyre et al., 201435 | 8 semanas | PB (n=194) VOR10 (n=193) VOR20 (n=204) | MADRS basal ≥26, episodio depresivo de ≥3 meses (≥1 episodio previo) | MADRS (secundario) | MMRM | PB: −10,9±0,6 VOR10: −15,6±0,6** VOR20: −17,6±0,6** |
| Boulenger et al., 201431 | 8 semanas | PB (n=158) VOR15 (n=151) VOR20 (n=151) DUL60 (n=147) | MADRS basal ≥26, CGI-S basal ≥4, episodio depresivo de ≥3 meses (≥1 episodio previo) | MADRS | MMRM | PB: –11,7 VOR15: –17,2*** VOR20: –18,8*** DUL60: –21,22*** |
| Jacobsen et al., 201533 | 8 semanas | PB (n=157) VOR10 (n=155) VOR20 (n=150) | MADRS basal ≥26, CGI-S basal ≥4, episodio depresivo de ≥3 meses (≥1 episodio previo) | MADRS | LOCF, ANCOVA | PB: –10,8±0,81 VOR10: –13±0,83 VOR20: –14,4±0,85* |
| Mahableshwarkar et al., 201538 | 8 semanas | PB (n=159) VOR15 (n=147) VOR20 (n=154) DUL60 (n=150) | MADRS basal ≥26, CGI-S basal ≥4, episodio depresivo de ≥3 meses (≥1 episodio previo) | MADRS | LOCF, ANCOVA | PB: –12,83 VOR15: –14,30 VOR20: –15,57* DUL60: –16,90** |
| Mahableshwarkar et al., 201539 | 8 semanas | PB (n=160) VOR10 (n=154) VOR15 (n=151) | MADRS basal ≥26, CGI-S basal ≥4, episodio depresivo de ≥3 meses (≥1 episodio previo) | MADRS | MMRM | PB: –12,87 VOR10: –13,66 VOR15: –13,36 |
ANCOVA: análisis de la covarianza; CGI-S: Clinical Global Impressions-Severity of Illness Scale; DSST: Digit Symbol Substitution Test; DUL: duloxetina; HDRS: Hamilton Depression Rating Scale; LOCF: last observation carried forward; MADRS: Montgomery-Asberg Depression Scale; MMRM: modelo mixto para mediciones repetidas (mixed model for repeated measurements); PB: placebo; RAVLT: Rey Auditory Verbal Learning Test; TDM: trastorno depresivo mayor; VLX: venlafaxina; VOR: vortioxetina.
Un metaanálisis reciente de 11 de los 12 ensayos clínicos antes mencionados apoya la efectividad a corto plazo de vortioxetina vs. placebo, siendo el efecto del tratamiento mayor con dosis mayores41. Asimismo, se halló también una mayor tasa de respuesta y remisión en los pacientes tratados con vortioxetina comparado con placebo, así como una mejoría más pronunciada en escalas como la Clinical Global Impression Scale (CGI-I, CGI-S). Este mismo metaanálisis llevó a cabo un análisis exploratorio y demostró una respuesta significativa al tratamiento para todas las dosis de vortioxetina.
Existe un único ensayo clínico aleatorizado llevado a cabo en población anciana29, no incluido en el anterior metaanálisis, en el cual los pacientes recibieron vortioxetina 5mg/d durante 8 semanas. En línea con los resultados del metaanálisis de Thase et al.41, tanto la reducción en la puntuación de la MADRS como la tasa de remisión y de respuesta fueron significativamente superiores en el grupo tratado con vortioxetina que en el grupo tratado con placebo.
Vortioxetina también ha demostrado no ser inferior a otros fármacos activos de referencia42, como venlafaxina43, escitalopram44 o agomelatina45, si bien conviene interpretar estos datos con precaución debido al diseño de los estudios. En estudios de coste-efectividad ha sido superior a venlafaxina XR46 y en estudios de coste-utilidad ha mostrado superioridad respecto a agomelatina, bupropión, sertralina y venlafaxina47.
Respecto a la efectividad a largo plazo de vortioxetina, existen estudios abiertos en los cuales vortioxetina (2,5-20mg/d) ha demostrado mantener la efectividad tras 52 semanas de tratamiento48,49 y ser efectiva en la prevención de recaídas en TDM50.
Vortioxetina y cogniciónVortioxetina se presenta como una buena alternativa en el tratamiento de los déficits neurocognitivos en el TDM según estudios preclínicos y clínicos, sobre todo gracias a su acción antagonista de los receptores 5HT3 y 5HT7 y agonista del receptor 5HT1A mediante la cual modula la transmisión glutamatérgica51.
En estudios preclínicos, vortioxetina mejora las dificultades de aprendizaje y previene déficits en el aprendizaje inducidos por estrés52. Esto sugiere un efecto positivo de vortioxetina sobre los déficits en flexibilidad cognitiva, uno de los principales síntomas cognitivos en el TDM. También se ha observado un efecto positivo sobre la memoria23,53, mayor que con escitalopram o duloxetina54, a través de su acción agonista del 5HT1A y antagonista del 5HT353. Además, vortioxetina favorecería la neuroplasticidad55 y de manera más rápida que otros ISRS16,56,57.
En estudios clínicos vortioxetina ha demostrado no tener efectos negativos sobre la cognición58. Un estudio clínico aleatorizado evaluó como resultado principal el efecto de 8 semanas de tratamiento con vortioxetina 10mg, vortioxetina 20mg o placebo sobre la cognición en personas con un episodio depresivo mayor moderado-grave35. El grupo en tratamiento con vortioxetina, independientemente de la dosis, obtuvo puntuaciones significativamente superiores en el Digit Symbol Substitution Test (DSST), que evalúa velocidad de procesamiento, funciones ejecutivas y atención, y en el Rey Auditory Verbal Learning Test (RAVLT), que evalúa aprendizaje y memoria. De manera similar, en el estudio llevado a cabo por Mahableshwarkar et al.59 vortioxetina a dosis de 10-20mg/d fue superior a placebo en el DSST; además, el grupo en tratamiento con vortioxetina mostró una mejoría más marcada en la capacidad funcional. El fármaco activo de referencia, duloxetina, no mostró superioridad a placebo ni en el DSST ni en la escala de capacidad funcional.
En pacientes ancianos con TDM, vortioxetina fue igualmente superior a placebo en el DSST y el RAVLT. De nuevo duloxetina, usado como fármaco activo de referencia, no mostró diferencias respecto a placebo en las puntuaciones del DSST pero sí del RAVLT29.
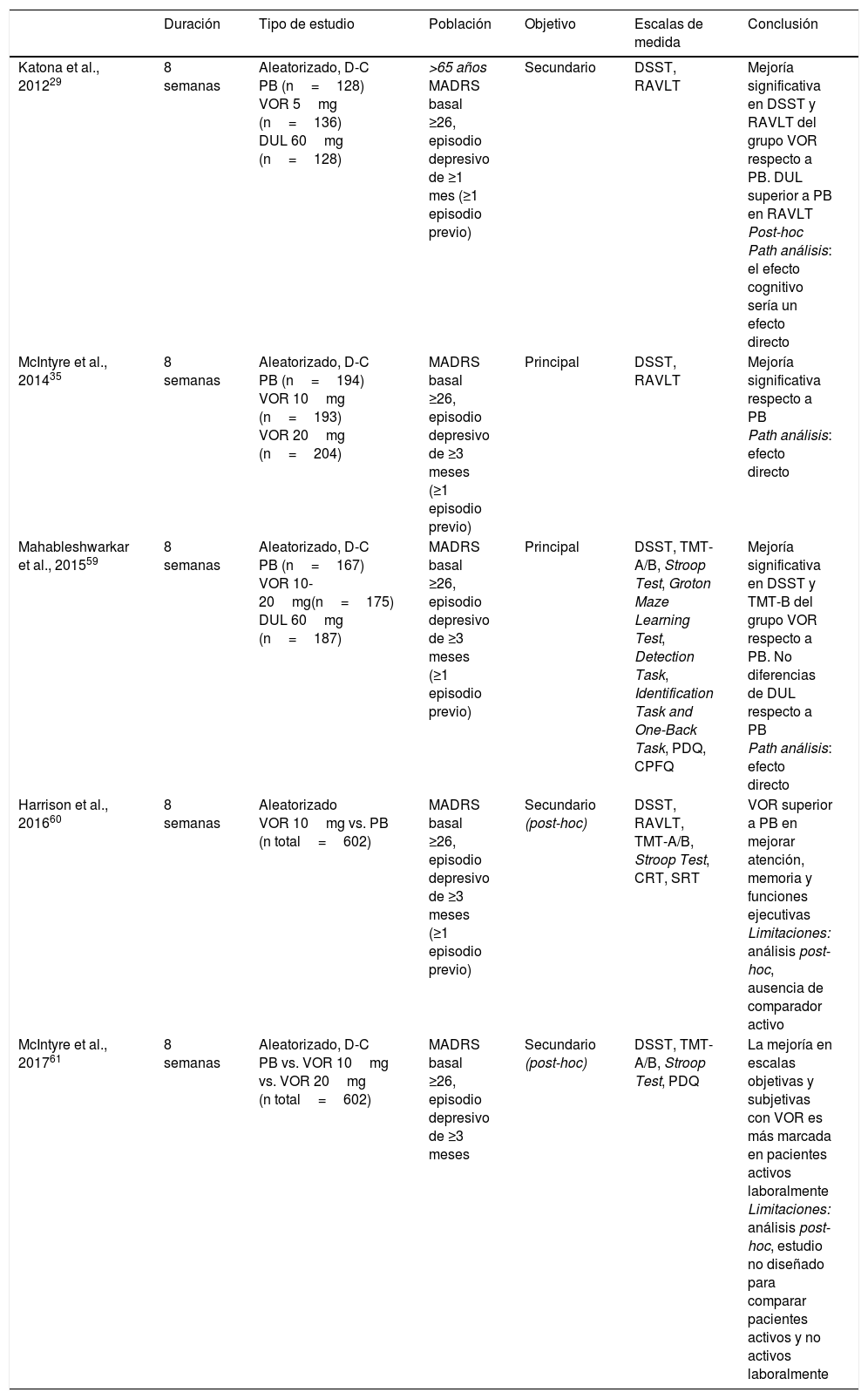
En vista de estos resultados, se ha sugerido que vortioxetina ejercería efectos positivos en más dominios cognitivos que otros antidepresivos8. De hecho, análisis post-hoc indican que vortioxetina no parece actuar sobre un dominio cognitivo específico sino sobre una amplia variedad60, y que es más útil en pacientes activos laboralmente61. Las principales características y resultados de los estudios que evalúan el efecto de vortioxetina sobre la cognición se resumen en la tabla 2. De manera importante, un metaanálisis reciente ha evidenciado que los efectos favorables de vortioxetina sobre la cognición son independientes de sus efectos antidepresivos62.
Efectividad de vortioxetina vs. placebo sobre dominios cognitivos en ensayos clínicos aleatorizados y controlados por placebo en TDM
| Duración | Tipo de estudio | Población | Objetivo | Escalas de medida | Conclusión | |
|---|---|---|---|---|---|---|
| Katona et al., 201229 | 8 semanas | Aleatorizado, D-C PB (n=128) VOR 5mg (n=136) DUL 60mg (n=128) | >65 años MADRS basal ≥26, episodio depresivo de ≥1 mes (≥1 episodio previo) | Secundario | DSST, RAVLT | Mejoría significativa en DSST y RAVLT del grupo VOR respecto a PB. DUL superior a PB en RAVLT Post-hoc Path análisis: el efecto cognitivo sería un efecto directo |
| McIntyre et al., 201435 | 8 semanas | Aleatorizado, D-C PB (n=194) VOR 10mg (n=193) VOR 20mg (n=204) | MADRS basal ≥26, episodio depresivo de ≥3 meses (≥1 episodio previo) | Principal | DSST, RAVLT | Mejoría significativa respecto a PB Path análisis: efecto directo |
| Mahableshwarkar et al., 201559 | 8 semanas | Aleatorizado, D-C PB (n=167) VOR 10-20mg(n=175) DUL 60mg (n=187) | MADRS basal ≥26, episodio depresivo de ≥3 meses (≥1 episodio previo) | Principal | DSST, TMT-A/B, Stroop Test, Groton Maze Learning Test, Detection Task, Identification Task and One-Back Task, PDQ, CPFQ | Mejoría significativa en DSST y TMT-B del grupo VOR respecto a PB. No diferencias de DUL respecto a PB Path análisis: efecto directo |
| Harrison et al., 201660 | 8 semanas | Aleatorizado VOR 10mg vs. PB (n total=602) | MADRS basal ≥26, episodio depresivo de ≥3 meses (≥1 episodio previo) | Secundario (post-hoc) | DSST, RAVLT, TMT-A/B, Stroop Test, CRT, SRT | VOR superior a PB en mejorar atención, memoria y funciones ejecutivas Limitaciones: análisis post-hoc, ausencia de comparador activo |
| McIntyre et al., 201761 | 8 semanas | Aleatorizado, D-C PB vs. VOR 10mg vs. VOR 20mg (n total=602) | MADRS basal ≥26, episodio depresivo de ≥3 meses | Secundario (post-hoc) | DSST, TMT-A/B, Stroop Test, PDQ | La mejoría en escalas objetivas y subjetivas con VOR es más marcada en pacientes activos laboralmente Limitaciones: análisis post-hoc, estudio no diseñado para comparar pacientes activos y no activos laboralmente |
CPFQ: Cognitive and Physical Functioning Questionnaire; CRT: Choice Reaction Time Test; D-C: doble ciego; DSST: Digit Symbol Substitution Test; DUL: duloxetina; MADRS: Montgomery-Asberg Depression Scale; PB: placebo; PDQ: Perceived Deficits Questionnaire; RAVLT: Rey Auditory Verbal Learning Test; SRT: Buschke Selective Reminding Test; TMT-A/B: Trail Making Test A/B; VOR: vortioxetina.
Baldwin et al.63 realizaron un metaanálisis para analizar la seguridad y tolerabilidad de vortioxetina en TDM, en el cual incluyeron un total de 11 estudios a corto plazo aleatorizados, doble ciego, controlados por placebo y 5 estudios abiertos con un tiempo de seguimiento de hasta 52 semanas.
En los estudios a corto plazo, los eventos adversos se clasificaron en general como «leves o moderados». Los más frecuentes fueron náuseas y vómitos, con un efecto transitorio y dosis-dependiente. La proporción de pacientes con efectos secundarios catalogados como severos fue de un 4,6% para el grupo placebo, un 5,8% para el grupo vortioxetina, un 8,2% para el grupo duloxetina y un 11,5% para el grupo venlafaxina XR. De manera similar, el número necesario para perjudicar (NNH, del inglés number needed to harm), basado en el número de pacientes que discontinuaron el tratamiento debido a un evento adverso, fue marcadamente mayor en el grupo de vortioxetina 5-10mg que para los comparadores activos duloxetina y venlafaxina XR.
Respecto a eventos adversos serios, la incidencia en los pacientes tratados con vortioxetina (5-20mg) resultó similar a la de placebo (0,6% vs. 0,5%), sin relación con la dosis. No se encontraron diferencias significativas en la incidencia de ideación o comportamientos suicidas en el grupo de vortioxetina respecto a placebo. El tratamiento con vortioxetina tampoco se asoció con un mayor aumento de peso o con una mayor incidencia de insomnio, acatisia, discinesia, hostilidad o comportamientos agresivos en comparación con placebo. La incidencia de disfunción sexual fue igualmente similar a la de placebo para todas las dosis de vortioxetina (5-20mg). Vortioxetina presentó un perfil de seguridad cardiovascular comparable al de placebo. La incidencia de síntomas de discontinuación también fue comparable a la de placebo, seguramente debido a la larga vida media de vortioxetina. Del total de 3.018 pacientes tratados con vortioxetina, un único paciente presentó síntomas hipomaníacos y ninguno un episodio maníaco franco.
En los estudios abiertos a largo plazo, los eventos adversos más comunes para ambos rangos de dosis fueron de nuevo náuseas (16,3 y 24,2%), seguidos de cefalea (13,0 y 12,5%), diarrea (6,4 y 7,3%), nasofaringitis (10,9 y 6,4%), aumento de peso (5,7 y 5,9%) e insomnio (5,0 y 7,1%). La proporción de pacientes con disfunción sexual fue del 1,7% en el grupo de vortioxetina 5-10mg y del 2,3% en el grupo de vortioxetina 15-20mg. Los cambios en parámetros cardiovasculares respecto al basal no fueron clínicamente relevantes. Tampoco se observaron eventos adversos de nueva índole. La incidencia de eventos adversos serios fue del 2,9% para vortioxetina 5-10mg y del 2,2% para vortioxetina 15-20mg.
InteraccionesVortioxetina se metaboliza principalmente a través de isoenzimas del CYP450, las cuales intervienen también en el metabolismo de otras muchas moléculas. Sin embargo, vortioxetina tiene un efecto pequeño o nulo sobre estas isoformas (es decir, no induce o inhibe su actividad), por lo que no se esperaría que interfiriera en las concentraciones plasmáticas de otros fármacos metabolizados por estas enzimas64.
Varios estudios han analizado las posibles interacciones de vortioxetina. Chen et al.65 demostraron que la coadministración de vortioxetina con etanol, diazepam o litio era bien tolerada y no presentaba interacciones farmacocinéticas o farmacodinámicas clínicamente relevantes. Tampoco se hallaron interacciones farmacocinéticas con los antifúngicos fluconazol o ketoconazol, ambos inhibidores de isoenzimas del CYP45066, o con aspirina, warfarina67, el anticonceptivo levonorgestrel/etinilestradiol u omeprazol66. Sin embargo, estos estudios sugieren que sí se podrían requerir ajustes de dosis al ser administrada con bupropión (inhibidor de CYP2D6 y sustrato de CYP2B6) o rifampicina (inductor de CYP)66.
ConclusionesEsta revisión, centrada en la evidencia disponible sobre vortioxetina, apoya su efectividad antidepresiva y tolerabilidad a corto y largo plazo, con un efecto antidepresivo dosis-dependiente. Estudios a largo plazo, además, demuestran que disminuye el número de recaídas respecto a placebo. A nivel de efectos secundarios, los más frecuentes son náuseas y vómitos, con un efecto transitorio y dosis-dependiente. Vortioxetina no parece producir alteraciones cardiovasculares ni inducir un aumento de peso significativo; además, se asociaría con menores efectos secundarios en la esfera sexual, al menos a dosis bajas, por lo que sería una alternativa a considerar en pacientes con inadecuada adherencia al tratamiento por quejas de disfunción sexual9. Por otro lado, la vida media prolongada de vortioxetina facilita la administración en una única dosis diaria y disminuye el riesgo de síndrome de discontinuación68.
Su acción combinada como inhibidor de la recaptación de serotonina y como modulador de una gran variedad de receptores serotoninérgicos le otorga un perfil farmacológico más amplio que el de otros antidepresivos, por lo que vortioxetina se presenta como una alternativa atractiva en caso de falta de respuesta a antidepresivos convencionales. Sin embargo, se requerirían más estudios en pacientes con TDM resistente para valorar su verdadera utilidad en esta población. De manera interesante, varios estudios preclínicos y clínicos apuntan a que vortioxetina posee además una acción procognitiva, la cual parece ser independiente de su efecto sobre los síntomas depresivos. Esto puede deberse a su acción indirecta sobre la liberación de glutamato, exclusivo de vortioxetina, que aumentaría la plasticidad neuronal y mejoraría la memoria19. Así, vortioxetina sería una opción terapéutica útil en aquellos pacientes con TDM y síntomas cognitivos marcados69, que suelen afectar al funcionamiento psicosocial del paciente70,71. Además, en los últimos años se están realizando estudios de coste-efectividad y coste-utilidad que apoyan la superioridad de vortioxetina en el incremento de años de vida ajustados por calidad de vida (AVAC) y la funcionalidad46,47.
A pesar de su acción prometedora sobre la cognición72 y sobre los efectos secundarios a nivel sexual73, son necesarios más estudios que confirmen los hallazgos disponibles y que evalúen los mecanismos a través de los cuales vortioxetina ejercería este efecto. Además, sería interesante disponer de estudios diseñados específicamente para comparar la eficacia de vortioxetina respecto a otros antidepresivos68. Futuros estudios arrojarán algo más de luz sobre la relación entre vortioxetina y cognición74,75, así como sobre su efectividad y tolerabilidad a corto y largo plazo76-81.
En conclusión, teniendo en cuenta el perfil receptorial y de efectos secundarios de vortioxetina, este fármaco se presenta como un gran aliado de la psiquiatría personalizada82,83. Así, vortioxetina estaría especialmente indicada en perfiles concretos de pacientes, como son pacientes con escasa respuesta a antidepresivos convencionales, pacientes con quejas de disfunción cognitiva o pacientes con mala tolerancia a otros tratamientos antidepresivos debido a efectos secundarios en la esfera sexual, tal y como se ha apuntado en revisiones anteriores9,68,69,84. Además, su acción procognitiva y la escasa incidencia de somnolencia o alteraciones cardiológicas la convierten en una alternativa a considerar en la población anciana68,84, si bien solo se ha realizado un ensayo clínico en esta población, con resultados positivos y buena tolerabilidad29. En un futuro, debería sin duda ensayarse en otras indicaciones, más allá del TDM y de los trastornos de ansiedad, y especialmente en indicaciones donde los efectos antidepresivos y eventualmente procognitivos puedan constituir una ventaja clave sobre las alternativas existentes, como en la depresión bipolar y en el trastorno por déficit de atención con hiperactividad.
Conflicto de interesesLa Dra. Íria Grande ha recibido un contrato de investigación Juan Rodés JR15/00012 y una beca/subvención Proyecto de Investigación en Salud PI16/00187 del Instituto de Salud Carlos III, Ministerio español de Economía, Industria y Competitividad y ha colaborado como consultora para Ferrer y como ponente para AstraZeneca, Ferrer y Janssen-Cilag.
El Dr. Eduard Vieta ha recibido ayudas y colaborado como asesor o ponente para las siguientes entidades: AB-Biotics, Actavis, Allergan, AstraZeneca, Bristol-Myers Squibb, Ferrer, Forest Research Institute, Gedeon Richter, Glaxo-Smith-Kline, Janssen, Lundbeck, Otsuka, Pfizer, Roche, Sanofi-Aventis, Servier, Shire, Sunovion, Takeda, Telefónica, la Brain and Behaviour Foundation, el Ministerio español de Ciencia e Innovación (CIBERSAM), el Seventh European Framework Programme (ENBREC), y el Stanley Medical Research Institute.
La Dra. Íria Grande expresa su agradecimiento al Instituto de Salud Carlos III, al Ministerio de Economía, Industria y Competitividad por el contrato de investigación Juan Rodés JR15/00012 y la beca Proyecto de Investigación en Salud PI16/00187, al Centro para la Investigación Biomédica en Red de Salud Mental (CIBERSAM), a los Grups Consolidats de Recerca 2014 (SGR 398) y al Seventh European Framework Programme (ENBREC).
El Dr. Eduard Vieta expresa su agradecimiento al Instituto de Salud Carlos III, al Ministerio de Economía, Industria y Competitividad, (PI 12/00912) integrado en el plan Nacional de I+D+I y cofinanciado por el ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER); al Centro para la Investigación Biomédica en Red de Salud Mental (CIBERSAM), a la Secretaria d’Universitats i Recerca del Departament d’Economia i Coneixement (2014_SGR_398), al Seventh European Framework Programme (ENBREC), al CERCA Programme/Generalitat de Catalunya y al Stanley Medical Research Institute por su apoyo.