Se presenta la primera descripción del estudio denominado Andalusian Bipolar Family (ABiF). Se trata de una investigación longitudinal con familias procedentes de Andalucía (España), que comenzó en 1997, con el objetivo de dilucidar las causas geneticomoleculares del trastorno afectivo bipolar. Desde entonces, esta cohorte ha contribuido a una serie de hallazgos clave, que han sido publicados en revistas internacionales. Sin embargo, el conocimiento sobre las bases genéticas del trastorno en estas familias sigue siendo limitado.
MétodoEl estudio consta de dos fases: en la fase inicial se reclutaron 100 familias con múltiples afectados de trastorno bipolar y otros trastornos del ánimo. La segunda fase del proyecto, actualmente en curso, comenzó en 2013 con el objetivo de realizar un seguimiento de la cohorte de familias reclutadas originalmente. Los objetivos del estudio de seguimiento son: i) recoger nuevos datos clínicos longitudinales; ii) realizar una evaluación neuropsicológica detallada, y iii) obtener una extensa colección de biomateriales para futuros estudios moleculares.
ResultadosEl estudio ABiF, por tanto, generará unos recursos valiosos para futuras investigaciones sobre la etiología del trastorno afectivo bipolar; particularmente con respecto a las causas de la alta carga genética del trastorno en las familias con múltiples afectados.
DiscusiónSe discute el valor de este enfoque en relación con las nuevas tecnologías para la identificación de factores genéticos de alta penetrancia. Estas nuevas tecnologías incluyen la secuenciación del exoma y del genoma completo, y el uso de células madre pluripotentes inducidas u organismos modelo para la determinación de consecuencias funcionales.
Here, we present the first description of the Andalusian Bipolar Family (ABiF) Study. This longitudinal investigation of families from Andalusia, Spain commenced in 1997 with the aim of elucidating the molecular genetic causes of bipolar affective disorder. The cohort has since contributed to a number of key genetic findings, as reported in international journals. However, insight into the genetic underpinnings of the disorder in these families remains limited.
MethodIn the initial 1997-2003 study phase, 100 multiplex bipolar disorder and other mood disorder families were recruited. The ongoing second phase of the project commenced in 2013, and involves follow-up of a subgroup of the originally recruited families. The aim of the follow-up investigation is to generate: i) longitudinal clinical data; ii) results from detailed neuropsychological assessments; and iii) a more extensive collection of biomaterials for future molecular biological studies.
ResultsThe ABiF Study will thus generate a valuable resource for future investigations into the aetiology of bipolar affective disorder; in particular the causes of high disease loading within multiply affected families.
DiscussionWe discuss the value of this approach in terms of new technologies for the identification of high-penetrance genetic factors. These new technologies include exome and whole genome sequencing, and the use of induced pluripotent stem cells or model organisms to determine functional consequences.
El trastorno bipolar (TB) se caracteriza por episodios recurrentes de manía y depresión1, y se sitúa entre los trastornos que más contribuyen a la carga de enfermedad global2,3. El TB tiene una prevalencia vida de entre un 0,5-1%4, y una heredabilidad estimada de aproximadamente un 70%5-7. Los estudios moleculares de genes candidatos y los recientes estudios de asociación de genoma completo (GWAS, por sus siglas en inglés), han identificado los primeros genes de susceptibilidad para el TB6,8-13. Todas las variantes genéticas de riesgo identificadas hasta la fecha son comunes en la población general, y confieren solamente un pequeño riesgo de forma individual. Aunque la identificación de los primeros genes de susceptibilidad es un logro destacado, los investigadores asumen que algunas variantes raras, todavía no identificadas, confieren un amplio riesgo en el desarrollo del trastorno6,14. Tales variantes pueden explicar, al menos en parte, la elevada carga familiar observada en algunas familias. La detección de estas variantes puede ser de particular importancia para la investigación de las consecuencias funcionales de las variantes genéticas. Estos estudios, a su vez, dilucidarán las vías biológicas que son disfuncionales en el TB. A nivel clínico, las familias que segregan variantes de alto riesgo son particularmente adecuadas para el estudio de los efectos pleiotrópicos, por ejemplo, examinando la diversidad de síntomas clínicos y endofenotipos que están asociados con una variante dada, y analizando las interacciones genes-ambiente. Sin embargo, debido a la disminución del tamaño medio familiar y al aumento de la movilidad de los miembros familiares, el reclutamiento de familias múltiples es problemático, particularmente en Europa y Norteamérica.
En 1997, nuestro grupo inició un estudio con familias múltiples procedentes de Andalucía (España), que supuso la recolección de detallados datos fenotípicos y de biomaterial. El presente informe describe el estudio, y cómo este ha contribuido a hallazgos geneticomoleculares claves en este ámbito. Así mismo, se discute el valor potencial de esta cohorte familiar para futuros estudios sobre la etiología del TB y el papel que jugarán las tecnologías de nueva generación.
MétodoInicio del estudioEl proyecto tuvo su inicio con la identificación de un paciente con TB de origen andaluz ingresado en el Departamento de Psiquiatría de la Universidad de Düsseldorf (Alemania), procedente de una familia con múltiples afectados de TB. Dada la importancia de este pedigrí, un neurólogo (GA), con conocimiento de español, confirmó la existencia de la historia familiar con múltiples afectados, y tras contactar con los genetistas psiquiátricos PP y MMN del Instituto de Genética Humana de Bonn (Alemania) y junto a la psiquiatra alemana, con conocimiento de español, MR, del Departamento de Psiquiatría de la Universidad de Bonn (actualmente en el Instituto Central de Salud Mental de la Universidad de Heidelberg, Alemania), se inició una colaboración con los psiquiatras FR y FM del Hospital Regional Universitario de Málaga (España) para iniciar el estudio. Posteriormente, para identificar un mayor número de familias múltiples, esta colaboración fue aumentada para incluir las unidades de salud mental de los siguientes 6 centros de Andalucía: el Hospital Universitario Reina Sofía, el Hospital Provincial de Jaén, el Hospital de Jerez de la Frontera (Cádiz), el Hospital de Puerto Real (Cádiz), el Hospital de Punta Europa de Algeciras (Cádiz), y el Hospital Universitario San Cecilio (Granada).
Cohorte original (fase inicial del estudio, 1997-2003)EvaluaciónEl reclutamiento comenzó con casos índices, tanto ambulatorios como ingresados, extendiéndose posteriormente al resto de miembros familiares. La evaluación diagnóstica se realizó mediante la Schedule for Affective Disorders and Schizophrenia (SADS)15; el Operational Criteria Checklist for Psychotic Illness (OPCRIT)16; una revisión de las historias clínicas, y entrevistas con los familiares de primer o segundo grado usando la Family Informant Schedule and Criteria (FISC)17. Se asignó el diagnóstico según la mejor estimación por consenso, de acuerdo con el criterio independiente de al menos dos psiquiatras y/o psicólogos, y de acuerdo con los Research Diagnostic Criteria18, y con el Diagnostic and Statistical Manual of Mental DisordersIV (DSM-IV)19. Se evaluó tanto a individuos afectados como a familiares sanos. Durante los primeros 6 años del estudio, el reclutamiento fue llevado a cabo por el mismo neurólogo (GOD) del Hospital Regional Universitario de Málaga. GOD fue entrenado y supervisado por 3 psiquiatras con experiencia (MR, FR y FM) y un genetista (MMN). Las muestras sanguíneas fueron recogidas de todos los participantes y enviadas al Instituto de Genética Humana de Bonn para la extracción de ADN de sangre completa.
Los protocolos del estudio para la evaluación clínica y la investigación genética fueron aprobados por los comités de ética locales de todos los centros participantes.
Entre 1997 y 2003, se evaluaron un total de 1.174 individuos de 100 familias con múltiples afectados. Se realizaron entrevistas en persona con el SADS en 758 individuos. En 655 de estos 758 individuos, se obtuvo información de hasta 7 de los mejores informantes familiares disponibles usando el FISC. Para 14 individuos solo los datos del OPCRIT estaban disponibles basados en varias fuentes de información. De los 402 individuos adicionales, la información fue obtenida únicamente de los mejores informantes: de 320 individuos con el FISC y de 76 individuos la información obtenida fue tan escasa que no se pudo completar de forma válida el FISC. De 6 miembros familiares adicionales, solo se pudo obtener información sobre el género, relación familiar y estado de la enfermedad. Así pues, había disponible información válida del FISC en 975 individuos. Se recogieron muestras sanguíneas de un total de 732 individuos. La figura suplementaria 1 muestra mediante un diagrama de flujo el reclutamiento de las familias múltiples.
Estudio de seguimiento (2013-en curso)Para la investigación de seguimiento, el protocolo del estudio se ha ampliado para incluir fenotipos neuropsicológicos y la recolección de biomaterial adicional.
Reevaluación de la muestraActualmente se está procediendo a contactar a aquellas familias que habían autorizado su contacto previamente, y así poder obtener su consentimiento informado para participar en el estudio ampliado de seguimiento. En el momento de la redacción de este documento, 4 familias (de entre 4 y 28 miembros) han sido nuevamente contactadas y están siendo evaluadas.
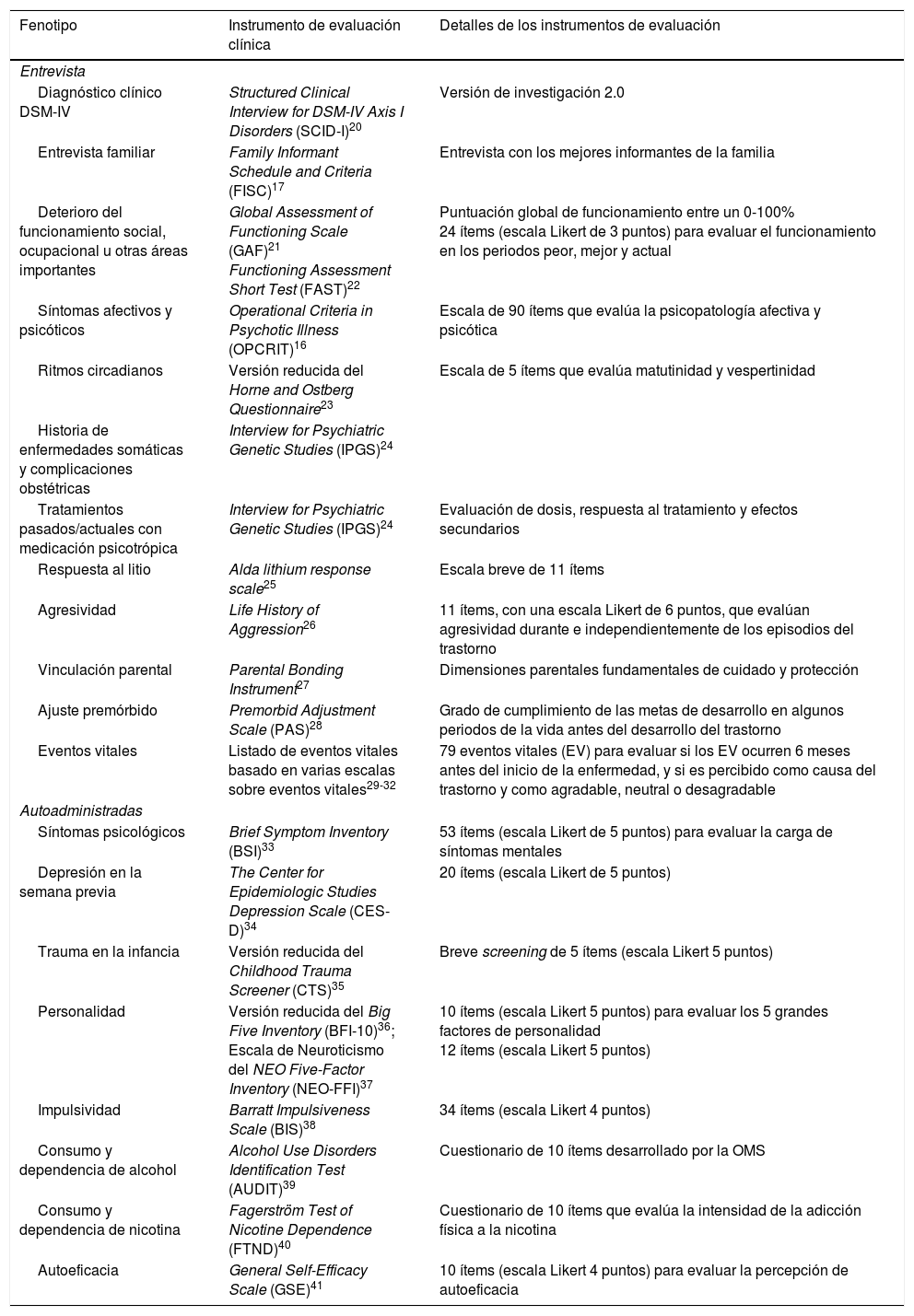
Reevaluación clínicaUna detallada caracterización fenotípica está siendo realizada para cada miembro familiar. Esto implica: i) la Interview for Psychiatric Genetic Studies (IPGS; Fangerau et al., 2004); (ii) un inventario exhaustivo para la caracterización del fenotipo, que incluye la Structured Clinical Interview for DSM-IV Axis I Disorders (SCID-I)20, y el OPCRIT; (iii) una revisión de todos los historiales clínicos, y (iv) entrevistas con los familiares. El diagnóstico clínico es realizado por dos clínicos entrenados por el procedimiento de mejor estimación por consenso. El IPGS permite una evaluación altamente reproducible y estructurada de los diagnósticos DSM-IV; las características sociodemográficas; los síntomas psicopatológicos a lo largo de la vida; la depresión actual; el nivel de funcionamiento previo al inicio del trastorno, en el peor episodio del trastorno a lo largo de la vida, y después de la remisión del último episodio del trastorno; el abuso y dependencia de nicotina y alcohol; el ajuste premórbido; la historia de complicaciones médicas y obstétricas; el tratamiento médico y los efectos secundarios; la personalidad, y los factores medioambientales, tales como la vinculación parental y los eventos vitales estresantes y traumáticos. Los fenotipos de interés y los instrumentos de evaluación clínica se muestran en la tabla 1.
Fenotipos e instrumentos de evaluación clínica empleados en el estudio de seguimiento
| Fenotipo | Instrumento de evaluación clínica | Detalles de los instrumentos de evaluación |
|---|---|---|
| Entrevista | ||
| Diagnóstico clínico DSM-IV | Structured Clinical Interview for DSM-IV Axis I Disorders (SCID-I)20 | Versión de investigación 2.0 |
| Entrevista familiar | Family Informant Schedule and Criteria (FISC)17 | Entrevista con los mejores informantes de la familia |
| Deterioro del funcionamiento social, ocupacional u otras áreas importantes | Global Assessment of Functioning Scale (GAF)21 Functioning Assessment Short Test (FAST)22 | Puntuación global de funcionamiento entre un 0-100% 24 ítems (escala Likert de 3 puntos) para evaluar el funcionamiento en los periodos peor, mejor y actual |
| Síntomas afectivos y psicóticos | Operational Criteria in Psychotic Illness (OPCRIT)16 | Escala de 90 ítems que evalúa la psicopatología afectiva y psicótica |
| Ritmos circadianos | Versión reducida del Horne and Ostberg Questionnaire23 | Escala de 5 ítems que evalúa matutinidad y vespertinidad |
| Historia de enfermedades somáticas y complicaciones obstétricas | Interview for Psychiatric Genetic Studies (IPGS)24 | |
| Tratamientos pasados/actuales con medicación psicotrópica | Interview for Psychiatric Genetic Studies (IPGS)24 | Evaluación de dosis, respuesta al tratamiento y efectos secundarios |
| Respuesta al litio | Alda lithium response scale25 | Escala breve de 11 ítems |
| Agresividad | Life History of Aggression26 | 11 ítems, con una escala Likert de 6 puntos, que evalúan agresividad durante e independientemente de los episodios del trastorno |
| Vinculación parental | Parental Bonding Instrument27 | Dimensiones parentales fundamentales de cuidado y protección |
| Ajuste premórbido | Premorbid Adjustment Scale (PAS)28 | Grado de cumplimiento de las metas de desarrollo en algunos periodos de la vida antes del desarrollo del trastorno |
| Eventos vitales | Listado de eventos vitales basado en varias escalas sobre eventos vitales29-32 | 79 eventos vitales (EV) para evaluar si los EV ocurren 6 meses antes del inicio de la enfermedad, y si es percibido como causa del trastorno y como agradable, neutral o desagradable |
| Autoadministradas | ||
| Síntomas psicológicos | Brief Symptom Inventory (BSI)33 | 53 ítems (escala Likert de 5 puntos) para evaluar la carga de síntomas mentales |
| Depresión en la semana previa | The Center for Epidemiologic Studies Depression Scale (CES-D)34 | 20 ítems (escala Likert de 5 puntos) |
| Trauma en la infancia | Versión reducida del Childhood Trauma Screener (CTS)35 | Breve screening de 5 ítems (escala Likert 5 puntos) |
| Personalidad | Versión reducida del Big Five Inventory (BFI-10)36; Escala de Neuroticismo del NEO Five-Factor Inventory (NEO-FFI)37 | 10 ítems (escala Likert 5 puntos) para evaluar los 5 grandes factores de personalidad 12 ítems (escala Likert 5 puntos) |
| Impulsividad | Barratt Impulsiveness Scale (BIS)38 | 34 ítems (escala Likert 4 puntos) |
| Consumo y dependencia de alcohol | Alcohol Use Disorders Identification Test (AUDIT)39 | Cuestionario de 10 ítems desarrollado por la OMS |
| Consumo y dependencia de nicotina | Fagerström Test of Nicotine Dependence (FTND)40 | Cuestionario de 10 ítems que evalúa la intensidad de la adicción física a la nicotina |
| Autoeficacia | General Self-Efficacy Scale (GSE)41 | 10 ítems (escala Likert 4 puntos) para evaluar la percepción de autoeficacia |
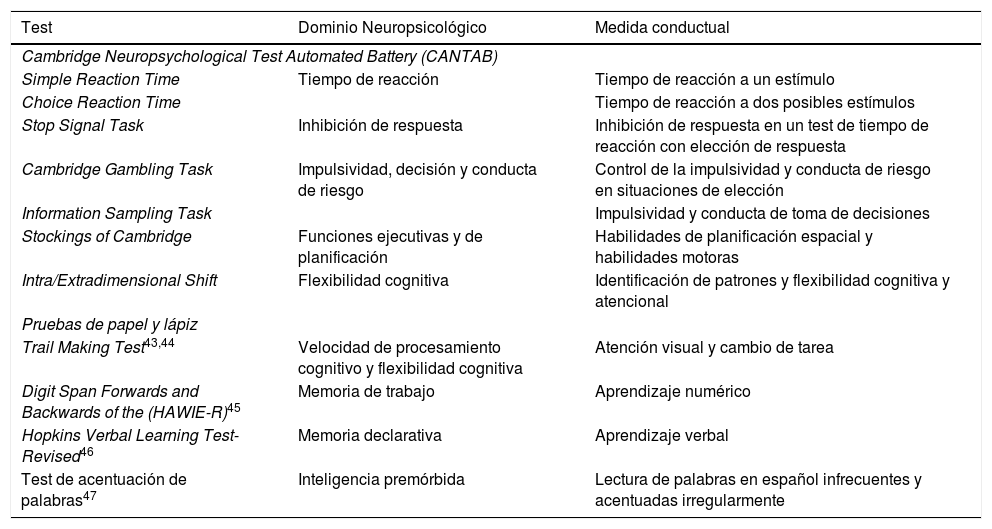
La evaluación neuropsicológica comprende pruebas seleccionadas de la Cambridge Neuropsychological Test Automated Battery (CANTAB)42, así como pruebas de papel y lápiz. Las pruebas utilizadas se detallan en la tabla 2.
Evaluación neuropsicológica en el seguimiento
| Test | Dominio Neuropsicológico | Medida conductual |
|---|---|---|
| Cambridge Neuropsychological Test Automated Battery (CANTAB) | ||
| Simple Reaction Time | Tiempo de reacción | Tiempo de reacción a un estímulo |
| Choice Reaction Time | Tiempo de reacción a dos posibles estímulos | |
| Stop Signal Task | Inhibición de respuesta | Inhibición de respuesta en un test de tiempo de reacción con elección de respuesta |
| Cambridge Gambling Task | Impulsividad, decisión y conducta de riesgo | Control de la impulsividad y conducta de riesgo en situaciones de elección |
| Information Sampling Task | Impulsividad y conducta de toma de decisiones | |
| Stockings of Cambridge | Funciones ejecutivas y de planificación | Habilidades de planificación espacial y habilidades motoras |
| Intra/Extradimensional Shift | Flexibilidad cognitiva | Identificación de patrones y flexibilidad cognitiva y atencional |
| Pruebas de papel y lápiz | ||
| Trail Making Test43,44 | Velocidad de procesamiento cognitivo y flexibilidad cognitiva | Atención visual y cambio de tarea |
| Digit Span Forwards and Backwards of the (HAWIE-R)45 | Memoria de trabajo | Aprendizaje numérico |
| Hopkins Verbal Learning Test-Revised46 | Memoria declarativa | Aprendizaje verbal |
| Test de acentuación de palabras47 | Inteligencia premórbida | Lectura de palabras en español infrecuentes y acentuadas irregularmente |
Se está recogiendo una muestra de 32,5ml de sangre para extracción de ADN (20ml); líneas celulares permanentes como base para células madre pluripotenciales inducidas (iPSCs, por sus siglas en inglés; 8ml); ARNm (2,5ml), y expresión de proteínas y metabolómica (2ml). También son recogidas muestras de cabello para la medida del cortisol en cabello y las hormonas testosterona, progesterona y deshidroepiandrosterona. Las muestras sanguíneas y de cabello son enviadas al laboratorio del Hospital Regional Universitario de Málaga, donde las muestras son procesadas y almacenadas de acuerdo con las guías del biobanco. Dependiendo de los experimentos planeados, las muestras son mandadas a los laboratorios que colaboran en el proyecto, como los laboratorios del Instituto Central de Salud Mental en Mannheim, y el Instituto de Genética Humana en Bonn.
Consentimiento informado y aprobación éticaEl protocolo del estudio de seguimiento ha sido aprobado por el comité de ética del Hospital Regional Universitario de Málaga (Málaga Nordeste) y la reevaluación ha comenzado en esta institución. Los otros centros obtendrán la aprobación por los comités de ética locales, cuando estén listos para el comienzo de la nueva evaluación. El consentimiento informado actualizado aborda con más detalle que el procedimiento original de consentimiento informado las cuestiones éticas que han surgido con los nuevos desarrollos y avances tecnológicos. Entre otros, estos avances permiten la secuenciación completa del genoma en contextos de investigación. Otras cuestiones importantes en términos del consentimiento informado se refieren a la protección de datos, la revelación de hallazgos incidentales o secundarios y la confidencialidad. La confidencialidad y el hecho de compartir información genética con familiares puede considerarse particularmente problemático en casos en los que la secuenciación a gran escala puede generar hallazgos secundarios48. Por ejemplo, si una mutación dominante heredada causante de cáncer es identificada como un hallazgo secundario en un miembro de la familia, el portador de la mutación puede no desear compartir esta información con su hijo, incluso aunque el cáncer pueda ser prevenible. Nosotros, por tanto, hemos seguido las guías y recomendaciones actualizadas hasta la fecha, tales como las procedentes del Ethical and Legal Aspects of Whole Genome Sequencing (EURAT) y de los debates regulares sobre cuestiones éticas entablados con los representantes de las comisiones de ética europeas, y con filósofos y expertos jurídicos internacionales. Durante el procedimiento de consentimiento informado y con anterioridad a su inclusión, los participantes del estudio ABiF deben indicar si quieren ser informados o no de potenciales hallazgos incidentales o secundarios. Los participantes deben indicar, también, si dan su permiso para ser nuevamente contactados para posteriores estudios de investigación, por ejemplo, para evaluaciones neuropsicológicas más extensas o pruebas de neuroimagen.
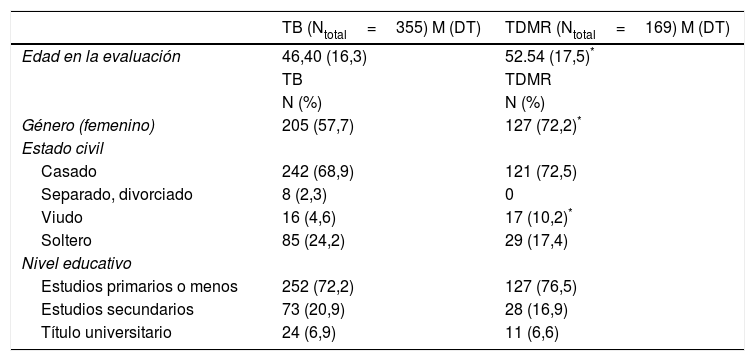
ResultadosCaracterísticas sociodemográficas y clínicasSe llevó a cabo un análisis de las variables sociodemográficas y clínicas de todos los miembros de las familias múltiples empleando: (i) información conjunta del SADS y del OPCRIT, n=426; (ii) información única del SADS, n=332; (iii) información única del OPCRIT, n=14, (iv) o información proveniente únicamente de los mejores informantes, n=402. En la tabla suplementaria 1 aparece un resumen del número total de miembros familiares y de afectados por familia con múltiples afectados y por centro de evaluación. La tabla 3 presenta las características sociodemográficas y clínicas de los miembros familiares, así como por grupos diagnósticos: trastorno depresivo mayor recurrente (TDMR, n=169) y TB (TB-I, n=258; TB-II, n=78; TB no especificado, n=18; trastorno esquizoafectivo tipo bipolar; n=1).
Características sociodemográficas de los individuos de las 100 familias múltiples de la cohorte original (1997-2003) que presentan TB (TB-I, TB-II, TB-NE, SCA-B) y TDMR
| TB (Ntotal=355) M (DT) | TDMR (Ntotal=169) M (DT) | |
|---|---|---|
| Edad en la evaluación | 46,40 (16,3) | 52.54 (17,5)* |
| TB | TDMR | |
| N (%) | N (%) | |
| Género (femenino) | 205 (57,7) | 127 (72,2)* |
| Estado civil | ||
| Casado | 242 (68,9) | 121 (72,5) |
| Separado, divorciado | 8 (2,3) | 0 |
| Viudo | 16 (4,6) | 17 (10,2)* |
| Soltero | 85 (24,2) | 29 (17,4) |
| Nivel educativo | ||
| Estudios primarios o menos | 252 (72,2) | 127 (76,5) |
| Estudios secundarios | 73 (20,9) | 28 (16,9) |
| Título universitario | 24 (6,9) | 11 (6,6) |
En Estado civil la categoría de referencia para las comparaciones es Casado y en Nivel educativo es Estudios primarios o menos.
DT: desviación típica; M: media; TB: trastorno bipolar; TDMR: trastorno depresivo mayor recurrente; TB-NE: trastorno bipolar no especificado; SCA-B: trastorno esquizoafectivo tipo bipolar.
La cohorte de familias múltiples evaluada entre 1997 y 2003 estaba compuesta, según grupos diagnósticos, por 355 casos con TB, 169 casos con TDMR y 650 individuos en la categoría otros (trastorno depresivo mayor episodio único, n=35; trastorno depresivo no especificado, n=12; dependencia o abuso de alcohol o drogas, n=31; esquizofrenia, n=2; agorafobia, n=2; y sanos, n=569). Comparados con los pacientes con TDMR, los pacientes con TB mostraron: una duración significativamente mayor de tratamiento ambulatorio continuado; una menor edad de inicio del trastorno psiquiátrico, del primer tratamiento y del primer episodio depresivo; más hospitalizaciones a lo largo de la vida y durante los episodios depresivos; más intentos de suicidio a lo largo de la vida y durante los episodios depresivos, y más delirios durante los episodios depresivos (para más detalles ver la tabla suplementaria 2). También, con mayor frecuencia los pacientes con TB fueron incapaces de trabajar, debido a problemas psicológicos, durante los 5 años precedentes a la entrevista en comparación con los pacientes con TDMR.
Los análisis de las dimensiones de los síntomas clínicos manía/excitación, depresión, desorganización, síntomas positivos y síntomas negativos mostraron que los pacientes con TB puntuaron más alto que los pacientes con TDMR en las dimensiones manía/excitación, depresión, síntomas positivos y negativos (para más detalles ver la información y tabla suplementarias 3). En la dimensión depresión los ítems ideación suicida y despertar temprano fueron más frecuentes en el TB que en el TDMR, mientras que pérdida de energía y enlentecimiento fueron más frecuentes en el TDMR que en el TB.
Hallazgos geneticomolecularesEn la investigación de los genes de riesgo para el TB, una hipótesis plausible es que en las familias múltiples existen variantes genéticas de alta penetrancia y los miembros afectados de las familias son portadores de estas variantes. Para investigar esto, inicialmente se realizó un análisis de ligamiento con las familias andaluzas más prometedoras. Esta información de ligamiento fue analizada en combinación con familias con múltiples afectados no procedentes de Andalucía.
En las familias andaluzas, los análisis de ligamiento hallaron pruebas de un nuevo locus susceptible en el cromosoma 1p35-p36, y suministraron apoyo a un locus establecido en el cromosoma 6q21-q2449. En análisis combinados con muestras familiares de otros países, se obtuvo evidencia de vinculación para la región pseudoautosómica 1 Xp22.3/Yp11.350. Usando una aproximación por covarianza, se generó evidencia sugestiva para la vinculación de los síntomas psicóticos incongruentes con el estado de ánimo en TB con los locus 1q32.3, 7p13 y 20q13.3151. En el primer estudio genético amplio de ligamiento en TB, en el cual se comprobó la interacción entre loci genómicos en familias de diferentes países —incluyendo pedigríes del estudio ABiF—, se generó evidencia de epistasis genética entre las regiones de los cromosomas 6q y 2q52. Lamentablemente, el paradigma de ligamiento no ha conducido a la identificación inequívoca de loci cromosómicos asociados con el TB. Incluso si existiera un efecto genético de alta penetrancia en familias individuales, la coincidencia de tales loci entre familias es probablemente demasiado baja para permitir una replicación consistente de los hallazgos de ligamiento entre las diferentes muestras.
Los primeros resultados genéticos moleculares consistentes para el TB han sido generados por los GWAS. Los pacientes índices de las familias andaluzas se sometieron a genotipado amplio de los polimorfismos de un solo nucleótido y estos datos fueron posteriormente incluidos en análisis internacionales a mayor escala. Estos GWAS han generado evidencia de la participación de regiones cromosómicas que albergan genes como el NCAN, ANK3, ODZ4, TRANK1, ADCY2 y una región entre MIR2113 y POU3F29,11.
DiscusiónEn este trabajo, se presenta la primera descripción del estudio ABiF y se proporciona un análisis sociodemográfico y clínico de la cohorte original de familias con múltiples afectados, un resumen de los estudios genéticos y de los hallazgos relevantes a los cuales esta cohorte ha contribuido y un amplio protocolo de reevaluación de las familias múltiples.
Con respecto a las diferencias sociodemográficas y clínicas entre TB y TDMR, otros autores previamente han informado de resultados similares. Dichos estudios encontraron que las siguientes características fueron más frecuentes en el TB en comparación con el TDMR: (i) menor edad de inicio53-58; (ii) conducta suicida57,59; (iii) síntomas psicóticos56,58,60,61; (iii) hospitalizaciones53,54,56,61; (iv) deterioro del funcionamiento social54; (v) abuso de alcohol53,54,57, y (vi) síntomas depresivos54. Los presentes hallazgos están, por tanto, alineados con los resultados obtenidos en otros estudios que comparan TB y TDMR en muestras de tipo no familiar. Sin embargo, el presente análisis no pudo replicar las siguientes diferencias observadas en estudios previos: (i) más episodios depresivos en el TB53,56-58,60,62; (ii) episodios depresivos más cortos en el TB53,55,60, y (iii) más ciclotimia en el TB57.
Con respecto a los hallazgos genéticos, a pesar del éxito de los GWAS, la mayoría de las variantes genéticas del TB todavía están a la espera de ser identificadas y la investigación con pedigríes extensos con múltiples miembros familiares afectados está experimentando un verdadero renacimiento en la investigación sobre mutaciones raras63-66. Actualmente, se están llevando a cabo esfuerzos de secuenciación para la identificación de estas variantes raras de alta penetrancia, y estos esfuerzos están siendo facilitados por el uso de nuevas tecnologías de secuenciación del ADN. Desde la finalización del proyecto genoma humano en 2003, se ha hecho un progreso extraordinario en el desarrollo de nuevas tecnologías de secuenciación, y la disponibilidad de las denominadas tecnologías de secuenciación de última generación (NGS, por sus siglas en inglés) hace más eficiente y asequible la secuenciación del exoma a gran escala (que contiene todas las secuencias que codifican proteínas) o la secuenciación amplia del genoma (genome-wide sequencing)67. Sin embargo, es una tarea desafiante confirmar una asociación definitiva con la enfermedad, debido a la rareza de las mutaciones individuales y a la general abundancia de variaciones raras neutrales en el genoma68. Más allá de la identificación de algunas mutaciones en un mismo gen, la investigación de la segregación familiar será un aspecto importante en este tipo de investigación, y la muestra del estudio ABiF proporcionará un recurso muy valioso para ello.
La observación de mutaciones implicadas en un número determinado de familiares también abre la posibilidad de explorar el espectro fenotípico asociado con una mutación particular. La evaluación de las funciones neuropsicológicas puede permitir la comprensión de los procesos funcionales subyacentes, como los conceptualizados en los Research Domain Criteria (RDoC)69, y puede, por lo tanto, generar hipótesis para futuros estudios funcionales. Una vez que las variantes raras han sido identificadas, su función puede ser testada de varias formas, incluyendo análisis bioinformáticos y el uso de modelos animales como, por ejemplo, el ratón. No obstante, la completa replicación en el ratón de la compleja constitución genética de un paciente particular es imposible. Aquí, las iPSCs de estos pacientes ofrecen un gran potencial70. En un estudio reciente, se generaron iPSCs de miembros familiares de un antiguo pedigrí Amish con y sin TB y se demostraron efectos funcionales y cambios de expresión65. La adquisición de células sanguíneas, que posteriormente pueden ser transformadas en iPSCs, es por lo tanto un aspecto importante del estudio de seguimiento ABiF. Además, la amplia colección de biomateriales, incluyendo ARNm, proteínas y cabello, permitirá la investigación de cambios funcionales a diversos niveles biológicos in vivo y la exploración de estos cambios como potenciales biomarcadores. En resumen, los datos fenotípicos y los biomateriales obtenidos dentro del estudio ABiF representan un recurso prometedor para futuras investigaciones sobre la etiología del TB.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.