El aumento de peso es un efecto secundario frecuente e importante de los antipsicóticos de segunda generación (ASG). Además, estos fármacos pueden inducir otros efectos secundarios que están asociados a un aumento de la morbimortalidad cardiovascular, tales como la resistencia a la insulina, la diabetes o el síndrome metabólico. Estudios preliminares indican que las diferencias genéticas interindividuales producen distintos grados de vulnerabilidad a los efectos secundarios inducidos por los ASG. El estudio SLiM (por sus siglas en inglés, Second-generation antipsychotic Long-term treatment Metabolic side effects) tiene como objetivo identificar en pacientes no tratados previamente con ASG (pacientes naive), aquellos factores clínicos, genéticos y ambientales que expliquen las diferencias interindividuales en relación con el aumento de peso y los cambios metabólicos generados tras 6 meses de tratamiento con estos fármacos.
Material y métodosEl estudio SLiM es un estudio farmacogenético multicéntrico, observacional, prospectivo, de 6 meses de duración, en el que se ha reclutado una cohorte de 307 pacientes pediátricos y adultos (rango de edad entre 8,8 a 90,1 años) naive a ASG y una cohorte de 150 controles sanos (rango de edad entre 7,8 y 73,2 años) emparejados por edad y sexo.
ResultadosEn este artículo se presentan la justificación, los objetivos y el diseño del estudio y se ofrece una descripción de la muestra al inicio del estudio.
ConclusionesLos resultados del estudio SLiM permitirán una mejor comprensión de los factores clínicos, ambientales y genéticos implicados en el aumento de peso y los trastornos metabólicos asociados al tratamiento con ASG.
Weight gain is an important and common side effect of second generation antipsychotics (SGAs). Furthermore, these drugs can induce other side effects associated with higher cardiovascular morbidity and mortality, such as insulin resistance, diabetes or metabolic syndrome. Preliminary studies show that inter-individual genetic differences produce varying degrees of vulnerability to the different SGA-induced side effects. The Second-generation antipsychotic Long-term treatment Metabolic side effects (SLiM) study aims to identify clinical, environmental and genetic factors that explain inter-individual differences in weight gain and metabolic changes in drug-naïve patients after six months of treatment with SGAs.
Materials and methodsThe SLIM study is a multicenter, observational, six-month pharmacogenetic study where a cohort of 307 drug-naïve paediatric and adult patients (age range 8.8-90.1 years) and a cohort of 150 age- and sex- matched healthy controls (7.8-73.2 years) were recruited.
ResultsThis paper describes the rationale, objectives and design of the study and provides a description of the sample at baseline.
ConclusionsResults from the SLiM study will provide a better understanding of the clinical, environmental, and genetic factors involved in weight gain and metabolic disturbances associated with SGA treatment.
La prescripción de antipsicóticos de segunda generación (ASG) ha incrementado de forma dramática en los últimos años, tanto en la población pediátrica como en la adulta y tanto para los trastornos psicóticos como los no psicóticos1,2. Si bien estos fármacos cuentan con un mejor perfil en cuanto a efectos secundarios extrapiramidales en comparación con los antipsicóticos clásicos, están asociados a una mayor prevalencia de trastornos metabólicos y endocrinos, tales como el aumento de peso, la dislipidemia y las anomalías glicémicas3,4. Estos trastornos aumentan el riesgo de desarrollar enfermedades cardiovasculares y la morbimortalidad en estos pacientes respecto a la población general5,6. Además, las complicaciones metabólicas están asociadas a una falta de adherencia al tratamiento y a un empeoramiento en la calidad de vida7–9.
En la actualidad, la optimización del tratamiento antipsicótico se ve limitada por la elevada variabilidad interindividual en cuanto a la respuesta y tolerabilidad a estos fármacos. Dicha variabilidad está relacionada con la heterogeneidad en factores clínicos, genéticos, ambientales y sociales10, lo cual ha dificultado el uso de pruebas farmacogenómicas (PGx) en la práctica clínica o la prescripción basada en el genotipo11,12. No obstante, las técnicas relacionadas con la PGx podrían ayudar a identificar a aquellos pacientes con mayor riesgo de desarrollar efectos secundarios inducidos por ASG a través de la identificación de biomarcadores genéticos13,14.
El objetivo del Estudio Farmacogenético del tratamiento a largo plazo con antipsicóticos de segunda generación y sus efectos adversos metabólicos (SLiM, por sus siglas en inglés, Second-generation antipsychotic Long-term treatment Metabolic side effects), un estudio PGx multicéntrico, longitudinal de 6 meses de seguimiento, fue identificar factores predictivos clínicos, ambientales y genéticos asociados al aumento de peso y a los cambios metabólicos en una muestra española de pacientes pediátricos y adultos naive a ASG y en una cohorte de controles sanos emparejados por sexo y edad. Los objetivos específicos del estudio fueron: 1) evaluar la prevalencia de cambios metabólicos y antropométricos tras 6 meses de tratamiento con ASG, 2) evaluar la asociación entre el aumento de peso/cambios metabólicos y la mejoría clínica/falta de adherencia al tratamiento/calidad de vida, 3) analizar polimorfismos en genes candidatos relacionados con el control del apetito, la regulación homeostática del sistema nervioso central y la obesidad, 4) evaluar la asociación entre los genotipos analizados, el aumento de peso y los cambios metabólicos y 5) identificar genotipos de riesgo que expliquen las diferencias interindividuales en el aumento de peso y los trastornos metabólicos inducidos por los ASG.
En este trabajo se presentan la justificación, los objetivos y el diseño del estudio SLiM, así como una descripción de la muestra reclutada al inicio del estudio.
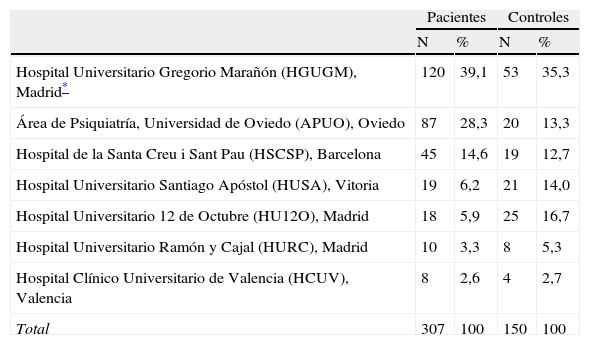
Sujetos y métodosProcedimiento de selecciónEntre enero de 2007 y diciembre de 2010, 7 centros pertenecientes al Centro de Investigación Biomédica en Red de Salud Mental (CIBERSAM) (www.cibersam.es) reclutaron 307 pacientes pediátricos y adultos atendidos consecutivamente en sus instalaciones clínicas a los que se les prescribía un ASG por primera vez o con una historia de prescripción pasada de ASG por un período no superior a 10 días. También se reclutó una cohorte de 150 controles sanos emparejados por edad y sexo con el grupo de pacientes. La tabla 1 muestra el número de pacientes y controles incluidos en el estudio por centro participante.
Pacientes y controles incluidos por centro participante
| Pacientes | Controles | |||
| N | % | N | % | |
| Hospital Universitario Gregorio Marañón (HGUGM), Madrid* | 120 | 39,1 | 53 | 35,3 |
| Área de Psiquiatría, Universidad de Oviedo (APUO), Oviedo | 87 | 28,3 | 20 | 13,3 |
| Hospital de la Santa Creu i Sant Pau (HSCSP), Barcelona | 45 | 14,6 | 19 | 12,7 |
| Hospital Universitario Santiago Apóstol (HUSA), Vitoria | 19 | 6,2 | 21 | 14,0 |
| Hospital Universitario 12 de Octubre (HU12O), Madrid | 18 | 5,9 | 25 | 16,7 |
| Hospital Universitario Ramón y Cajal (HURC), Madrid | 10 | 3,3 | 8 | 5,3 |
| Hospital Clínico Universitario de Valencia (HCUV), Valencia | 8 | 2,6 | 4 | 2,7 |
| Total | 307 | 100 | 150 | 100 |
Los pacientes se reclutaron en salas de urgencias, unidades de hospitalización y consultas externas. Los criterios de inclusión para los pacientes eran: a) presencia de un trastorno psiquiátrico según criterios DSM-IV15, b) capacidad para otorgar consentimiento informado por escrito (por parte de los participantes y de sus padres o tutores legales cuando procediese), y c) ser pacientes naive (prescripción por primera vez de un ASG, o, en caso de haber recibido tratamiento antipsicótico en el pasado, con una duración del tratamiento no superior a 10 días). El diseño inicial del estudio SLiM solo contemplaba la inclusión de pacientes con una primera prescripción de risperidona, olanzapina o quetiapina. Más adelante, este criterio fue ampliado y se permitió la inclusión de pacientes con una primera prescripción de cualquier otro ASG. El tratamiento concomitante con estimulantes, estabilizadores del ánimo, antidepresivos, agentes anticolinérgicos y benzodiacepinas/hipnóticos también estaba permitido. El único criterio de exclusión en los pacientes era la presencia de una enfermedad médica grave.
Los controles sanos se reclutaron entre el círculo de amigos, compañeros y vecinos de los pacientes. Los criterios de inclusión para controles eran: a) ausencia de un diagnóstico psiquiátrico según criterios DSM-IV15 y b) capacidad para otorgar consentimiento informado por escrito (por parte de los participantes y de sus padres o tutores legales cuando procediese). Los criterios de exclusión eran a) presencia de una enfermedad médica grave, y b) tratamiento actual o previo con algún medicamento antipsicótico. Los controles fueron compensados por su tiempo con una tarjeta regalo de 25 € en cada visita.
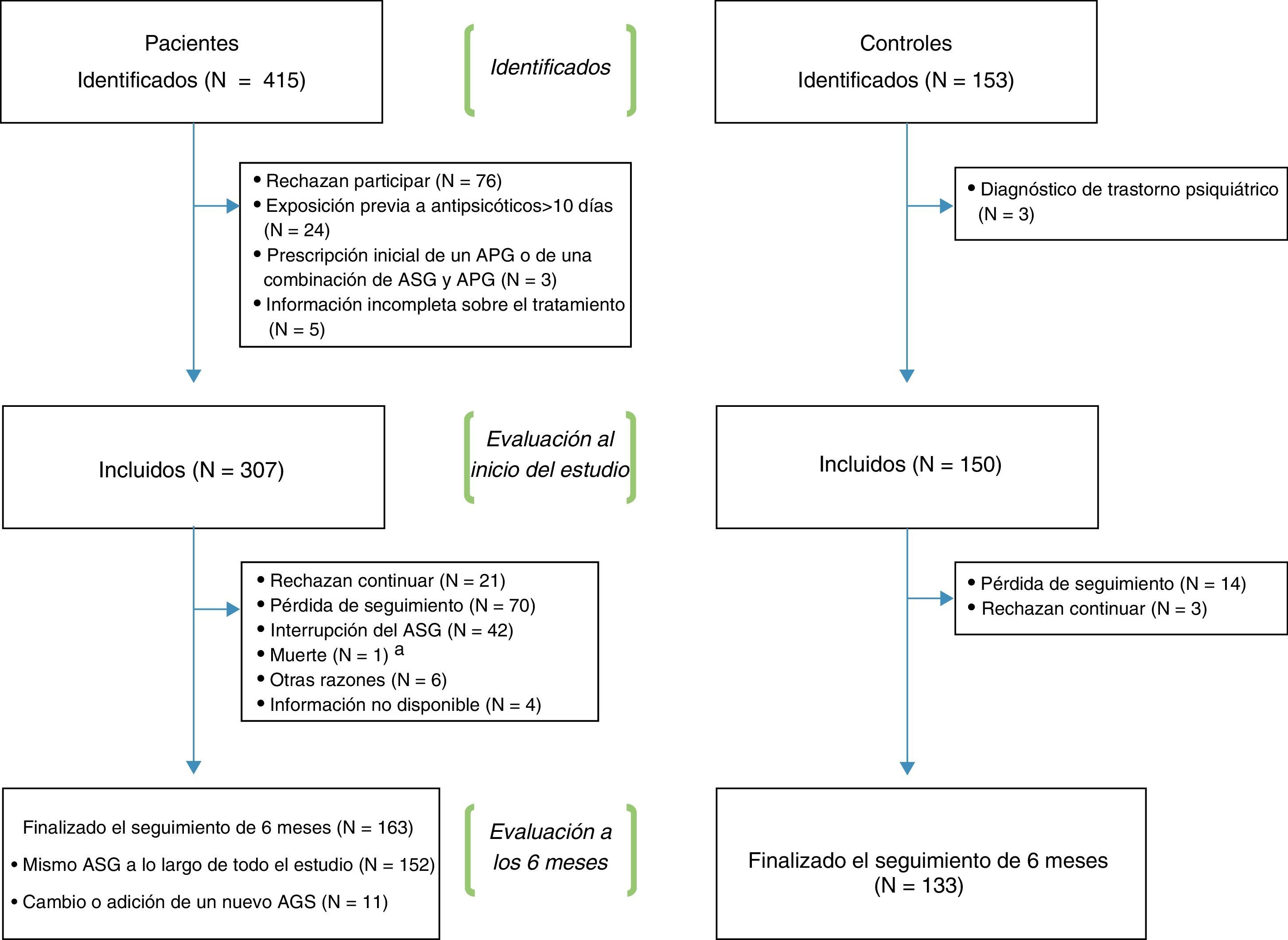
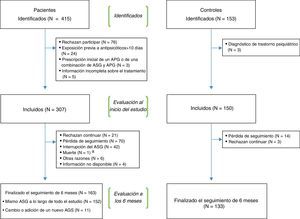
La figura 1 muestra un diagrama de flujo del procedimiento de reclutamiento. De los 415 pacientes y los 153 controles identificados inicialmente, un total de 307 pacientes y 150 controles cumplían los criterios de inclusión y completaron la evaluación inicial. De estos, 163 pacientes y 133 controles finalizaron el período de seguimiento de 6 meses. Los motivos de retirada del estudio fueron: negativa a continuar, pérdida de seguimiento, interrupción del ASG (solo en los pacientes), muerte y otras razones (se registraba la razón). El cambio o la adición de un nuevo ASG durante el seguimiento no se consideraron un motivo de retirada.
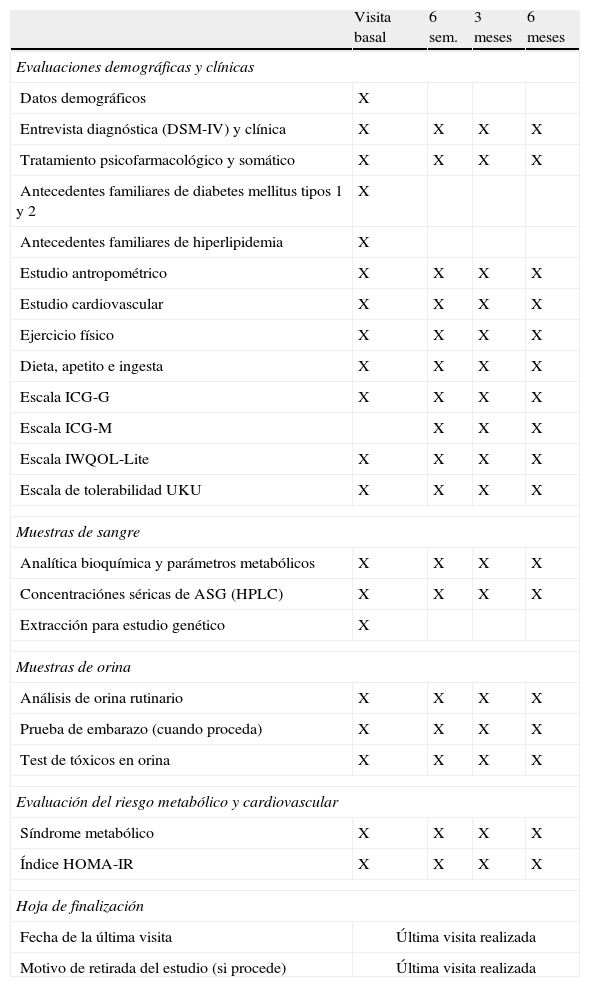
DiseñoEl estudio SLiM es un estudio observacional, prospectivo de 6 meses de duración en el que se realizaron 4 visitas de evaluación (al inicio del estudio, a las 6 semanas, a los 3 y a los 6 meses) tanto a los pacientes como a los controles. En el mismo centro/unidad que se reclutaba a cada paciente participante, se realizó al inicio del estudio una evaluación completa que incluía el registro de datos demográficos, clínicos y de diagnóstico; escalas clínicas, historia de tratamiento psicofarmacológico y efectos secundarios; un estudio antropométrico y cardiovascular y la recogida de muestras de sangre en ayunas y orina. Posteriormente, se estableció contacto telefónico con los sujetos y se realizaron las mismas evaluaciones a las 6 semanas, y a los 3 y 6 meses en un contexto psiquiátrico ambulatorio. En estas visitas se añadió una revisión del diagnóstico y del tratamiento farmacológico en curso, así como una evaluación de los cambios en psicopatología global. Teniendo en cuenta los datos antropométricos, cardiovasculares y analíticos, y basándose en criterios establecidos, se determinó en cada visita la presencia de resistencia a la insulina16 y de síndrome metabólico17–19. Se cumplimentó una hoja de finalización para cada participante una vez realizada la última consulta. En dicha hoja se registraba la fecha de la última consulta y los motivos de retirada (cuando procedía). La tabla 2 resume las evaluaciones realizadas y el organigrama de visitas y del estudio.
Cronograma del estudio SLiM
| Visita basal | 6 sem. | 3 meses | 6 meses | |
| Evaluaciones demográficas y clínicas | ||||
| Datos demográficos | X | |||
| Entrevista diagnóstica (DSM-IV) y clínica | X | X | X | X |
| Tratamiento psicofarmacológico y somático | X | X | X | X |
| Antecedentes familiares de diabetes mellitus tipos 1 y 2 | X | |||
| Antecedentes familiares de hiperlipidemia | X | |||
| Estudio antropométrico | X | X | X | X |
| Estudio cardiovascular | X | X | X | X |
| Ejercicio físico | X | X | X | X |
| Dieta, apetito e ingesta | X | X | X | X |
| Escala ICG-G | X | X | X | X |
| Escala ICG-M | X | X | X | |
| Escala IWQOL-Lite | X | X | X | X |
| Escala de tolerabilidad UKU | X | X | X | X |
| Muestras de sangre | ||||
| Analítica bioquímica y parámetros metabólicos | X | X | X | X |
| Concentraciónes séricas de ASG (HPLC) | X | X | X | X |
| Extracción para estudio genético | X | |||
| Muestras de orina | ||||
| Análisis de orina rutinario | X | X | X | X |
| Prueba de embarazo (cuando proceda) | X | X | X | X |
| Test de tóxicos en orina | X | X | X | X |
| Evaluación del riesgo metabólico y cardiovascular | ||||
| Síndrome metabólico | X | X | X | X |
| Índice HOMA-IR | X | X | X | X |
| Hoja de finalización | ||||
| Fecha de la última visita | Última visita realizada | |||
| Motivo de retirada del estudio (si procede) | Última visita realizada | |||
ASG: antipsicótico de segunda generación; DSM-IV: Manual diagnóstico y estadístico de trastornos mentales, cuarta edición; HOMA-IR: Evaluación del modelo de homeostasis-estimación de resistencia a la insulina; HPLC: Cromatografía líquida de alta resolución; ICG-M: Impresión Clínica Global de Mejoría; ICC-G: Impresión Clínica Global de Gravedad; IWQOL-Lite: Impacto del Peso en la Calidad de Vida; UKU: Udvalg for Kiniske Undersogelser.
Se diseñó un protocolo «ad hoc» para la recogida de datos demográficos. Se registraron la edad, el sexo, la raza, el estado civil, y el nivel educativo y ocupacional de cada participante (o de su padre/madre o tutor legal si se trataba de un menor de 18 años).
El diagnóstico fue realizado por psiquiatras experimentados siguiendo criterios DSM-IV15 a través de una entrevista clínica y de la revisión de la historia clínica de los participantes. Además, se registraron los antecedentes médicos de cada participante (incluyendo historia de diabetes mellitus tipos 1 y 2), antecedentes familiares de diabetes mellitus tipos 1 y 2 o hiperlipidemia, antecedentes personales y familiares de trastornos psiquiátricos, número y duración de las hospitalizaciones (para los pacientes), resultado de la prueba de embarazo y uso/abuso de sustancias. También se registró la historia de tratamiento psicofarmacológico y somático de cada participante, incluyendo las dosis, cambios de dosis y fechas de inicio e interrupción de cualquier tratamiento previo o actual. Las dosis de antipsicóticos se transformaron a equivalentes de clorpromazina y las dosis actuales y acumuladas se calcularon en cada visita20,21.
El estudio antropométrico fue realizado por profesionales de enfermería experimentados. El peso (en kg) y la altura (en m) se determinaron en cada visita con el mismo instrumental: báscula SECA GMBH & Co., modelo 797, en el Hospital General Universitario Gregorio Marañón (HGUGM) y en el Área de Psiquiatría Universidad de Oviedo (APUO); báscula de Año Sayol, modelo Atlántida, en el Hospital de la Santa Creu i Sant Pau (HSCSP) y en el Hospital Universitario Ramón y Cajal (HURC); báscula digital Soenhle 7831 en el Hospital Universitario de Santiago Apóstol (HUSA); analizador de composición corporal BF-350, Tanita Corporation, en el Hospital Universitario 12 de Octubre (HU12O); OMROM BF-500 en el Hospital Clínico Universitario de Valencia (HCUV). Con estos datos se calculó el índice de masa corporal (IMC) de la siguiente manera: peso (kg)/altura (m2). Puesto que el IMC varía en función de la edad y el sexo, su valor fue ajustado para dichas variables mediante una conversión a puntuaciones z (z-score). Para los niños y adolescentes, el IMC se ajustó por edad y sexo siguiendo gráficas normativas españolas22. Para los adultos, las puntuaciones crudas fueron transformadas a puntuaciones z basándose en el IMC del grupo de control del mismo sexo en cada visita. El perímetro abdominal se midió con una cinta métrica flexible, colocada por encima del borde superior de las crestas ilíacas. La masa grasa corporal total se midió en cada visita con el mismo dispositivo de impedancia bioeléctrica: OMRON BF-500 en HGUGM, APUO, HUSA, HURC y HCUV; OMRON BF-511 en HSCSP; Tanita BF-350 en HU12O. En cada visita, se preguntó a los participantes si estaban siguiendo un régimen dietético y si habían experimentado cambios en el apetito o en la ingesta de alimentos desde la última visita. También se registró información sobre la actividad física (horas semanales de ejercicio físico durante la semana anterior). Para la evaluación del ECG se utilizó un Cardioline Delta 1 Plus digital ECG, Versione Base (Renco, Italia) en HGUGM, un Cardioline AR600ADV ECG (Cavareno, Italia) en APUO, un Philips M1772A ECG (Andover, MA, EE. UU.) en HSCSP, un Philips Page Writer Trim I ECG (Eindhoven, Países Bajos) en HUSA, un Philips Page Writer TC30 ECG (Andover, MA, EE. UU.) en HURC, un Cardiovit ECG AT-2, Schiller AG (Baar, Suiza) en HU12O y un Nihon Kohden Cardio FAX V Ecaps 12 (Rosbach, Alemania) en HCUV. Por último, se midió la tensión arterial (TA) y la frecuencia cardíaca. Para niños y adolescentes, los valores de TA crudos fueron transformados a percentiles siguiendo las directrices de la International Task Force para TA23.
Las escalas de Impresión Clínica Global de Gravedad24 (ICG-G) y de Impresión Clínica Global de Mejoría (ICG-M)24 fueron cumplimentadas por psiquiatras experimentados. Estas escalas evalúan la gravedad y la mejoría, respectivamente, de la sintomatología global mediante una escala de 1 a 7. Son escalas especialmente útiles en estudios longitudinales, ya que proporcionan una medida ordinal repetida del estado clínico global del participante.
Dichos psiquiatras administraron asimismo la escala del Impacto del Peso sobre la Calidad de Vida (IWQOL-Lite)25 y la escala Udvalg for Kiniske Undersogelser (UKU)26 en todas las visitas del estudio. La escala IWQOL-Lite es una escala autoaplicada con 31 elementos que analizan el impacto del peso en la calidad de vida, y consta de una puntuación total y de una puntuación para cada una de las 5 subescalas (estado físico, autoestima, vida sexual, estrés en la comunidad/en público y trabajo). La escala UKU es una escala integral que consta de un total de 54 elementos (divididos en 4 categorías) que pueden ser puntuados del 0 al 3, y está diseñada para evaluar los efectos secundarios generales de los psicofármacos.
Determinaciones bioquímicasEl personal de enfermería extrajo muestras de sangre venosa en 7 tubos de polipropileno con EDTA y de suero, por la mañana (entre las 8:00 y las 10:00) en ayunas. Dichos tubos se almacenaron a una temperatura de 4°C. Una de las muestras de sangre fresca fue enviada al departamento de bioquímica de cada centro, donde se realizaron las determinaciones bioquímicas pertinentes, incluyendo determinado de perfil lipídico, glucosa, hemoglobina glicosilada A1 (HbA1c) y niveles de insulina. En todos los centros participantes, las determinaciones de glucemia, colesterol total, lipoproteína de alta densidad (HDL), lipoproteína de baja densidad (LDL) y triglicéridos fueron realizadas mediante procedimientos enzimáticos con un analizador químico automático. La determinación de HbA1c fue realizada mediante cromatografía líquida de alta resolución (HPLC). Los niveles de insulina fueron determinados mediante inmunoanálisis por detección de quimioluminiscencia. El departamento de bioquímica de cada centro participante registró los datos bioquímicos de acuerdo con los criterios preestablecidos de normalidad (mínimo y máximo) para cada parámetro. Los valores de referencia de cada centro fueron registrados y las determinaciones individuales fueron corregidas y homogeneizadas para su incorporación en una base de datos común.
Tanto para los pacientes como para los controles, otro de los tubos de sangre venosa fue centrifugado (2.000g × 10min, a temperatura ambiente) tras un tiempo de almacenamiento de una hora. Las muestras de suero resultantes fueron cuidadosamente trasladadas a tubos de suero y almacenadas a una temperatura ≤ −20°C hasta su envío al laboratorio de bioquímica del centro coordinador (HGUGM), donde se realizaron determinaciones (por duplicado) de niveles de adiponectina y leptina mediante técnicas de enzimoinmunoensayo ELISA (ELISA-leptina humana [ref: RD191001100], ELISA adiponectina humana [ref: RD195023100], de Biovendor Laboratorio Medicine Inc., Brno, República Checa). Todas las determinaciones bioquímicas fueron realizadas por un bioquímico experto del centro coordinador con entrenamiento previo en las diferentes técnicas.
Determinación de antipsicóticos de segunda generación en sueroEn cada visita y para cada paciente, una de las muestras de suero almacenadas fue enviada al laboratorio de bioquímica del centro coordinador (HGUGM), donde un bioquímico experto con entrenamiento previo en la técnica de HPLC llevó a cabo la determinación de antipsicóticos en suero mediante la utilización de un sistema de HPLC Waters 2695 (Alliance HPLC system, Waters Corp. Milford, MA, EE. UU.). Los analitos fueron separados en una columna Agilent Eclipse XDB C-18 (150 × 4,6mm i.d., 5μm) con una guarda-columna Eclipse XDB C-18 de 4,6 × 12,5mm, siguiendo el protocolo descrito en Zhang et al.27. Esta técnica semicuantitativa proporciona una medida indirecta de la adherencia del paciente al tratamiento con ASG en cada visita (a través de la obtención de un resultado «positivo» o «negativo» en la prueba HPLC).
Estudio de genotipaciónPara cada participante, una de las muestras de sangre recogidas fue almacenada a una temperatura de ≤ −20°C hasta su envío a la Facultad de Biología de la Universidad de Barcelona. Allí, un experto genetista previamente entrenado realizó tanto el procesamiento de ADN (codificación, almacenamiento y extracción, mediante la utilización de un kit de extracción comercial) como la genotipación. Los genes candidatos seleccionados para el estudio de farmacogenética del estudio así como sus SNP y MAF se muestran en el material complementario de la versión electrónica (anexo A). Dichos genes candidatos relacionados con los mecanismos de acción de los ASG, el control del apetito, la regulación homeostática y el aumento de peso y fenotipos relacionados (por ejemplo, la obesidad) fueron seleccionados en base a estudios previos de asociación y estudios GWAS (del inglés, Genome Wide Association Study)28–35. Los polimorfismos de un solo nucleótido (SNP) de dichos genes fueron seleccionados en base a la literatura previa disponible así como al programa SYSNPS (www.sysnps.org). Dichos SNP fueron únicamente seleccionados por el programa SYSNPS si eran considerados TagSNP del gen candidato y presentaban una frecuencia del alelo menor (MAF) > 0,2. Este criterio MAF fue elegido con objeto de aumentar el poder estadístico.
El genotipado fue enmascarado en cuanto a la pertenencia a grupo paciente o control y en cuanto al tipo de tratamiento ASG recibido. El polimorfismo 5-HTTLPR (gen SLC6A4) fue genotipado siguiendo un protocolo estándar36. Los SNP rs6265 (gen BDNF) y rs1049353 (gen CNR1) fueron genotipados mediante ensayo Taqman 5’-exonucleasa. El resto de SNP fueron genotipados mediante PCR cuantitativa competitiva, mediante la utilizacón de sondas aleloespecíficas con detección de señal FRET. En una submuestra de individuos seleccionada de forma aleatoria, se llevó a cabo un segundo estudio de genotipación para confirmar el patrón de reproducibilidad.
Recogida y análisis de muestras de orinaEn cada visita y para cada participante, se recogieron muestras de orina y se realizó un análisis de orina rutinario, además de una prueba de detección de tóxicos en orina y una prueba de embarazo (cuando procediese). La detección de anfetaminas, cannabis, cocaína, opiáceos, benzodiacepinas y barbitúricos se realizó mediante inmunoanálisis en HGUGM, HSCSP, HU12O, HUSA y HURC; mediante espectrofotometría (de punto final) con luz monocromática en APUO; y mediante cromatografía en capa fina en HCUV.
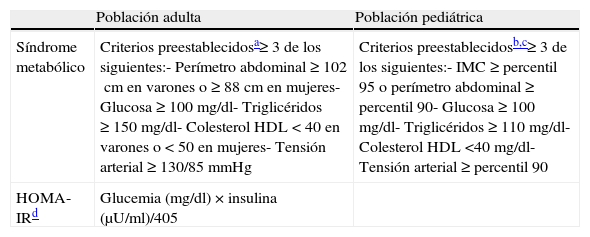
Evaluación del riesgo metabólico y cardiovascularTeniendo en cuenta los datos antropométricos y cardiovasculares, se estableció para cada participante y en cada visita la presencia o ausencia de síndrome metabólico. Para participantes adultos, la definición de síndrome metabólico fue establecida en base a la declaración conjunta de la AHA/NHLBI19. En el caso de niños y adolescentes, dicha definición se estableció siguiendo una adaptación de los criterios de Cook et al., 200317, y Correll y Carlson, 200618. Estos criterios agrupan los factores de riesgo más relevantes para el desarrollo de enfermedad cardiovascular: obesidad abdominal, glucemia en ayunas elevada y/o diabetes, alteraciones del perfil lipídico e hipertensión arterial (tabla 3).
Criterios diagnósticos de síndrome metabólico y resistencia a la insulina en población pediátrica y adulta
| Población adulta | Población pediátrica | |
| Síndrome metabólico | Criterios preestablecidosa≥ 3 de los siguientes:- Perímetro abdominal ≥ 102cm en varones o ≥ 88cm en mujeres- Glucosa ≥ 100 mg/dl- Triglicéridos ≥ 150 mg/dl- Colesterol HDL < 40 en varones o < 50 en mujeres- Tensión arterial ≥ 130/85 mmHg | Criterios preestablecidosb,c≥ 3 de los siguientes:- IMC ≥ percentil 95 o perímetro abdominal ≥ percentil 90- Glucosa ≥ 100 mg/dl- Triglicéridos ≥ 110 mg/dl- Colesterol HDL <40 mg/dl- Tensión arterial ≥ percentil 90 |
| HOMA-IRd | Glucemia (mg/dl) × insulina (μU/ml)/405 |
HDL: lipoproteína de alta densidad; HOMA-IR: Evaluación del modelo de la homeostasis–estimación de resistencia a la insulina; IMC: índice de masa corporal.
Tanto en los participantes niños y adolescentes como en los adultos, la resistencia a la insulina fue estimada mediante el índice HOMA-IR16, que se calcula fácilmente a partir de una sola determinación de niveles insulina y glucosa en ayunas (tabla 3).
Procesamiento y análisis de datosCon el fin de integrar toda la información disponible y facilitar la gestión y explotación de datos, se creó una base de datos común. Tanto la introducción de datos como el diseño y gestión de la base de datos fueron realizadas en el centro coordinador (HGUGM).
Para la descripción de las características de la muestra al inicio del estudio, las variables continuas se expresaron en forma de media, desviación estándar (DE) y rango; y las variables categóricas en forma de frecuencias y porcentajes. Se llevaron a cabo comparaciones de los datos demográficos y clínicos de los diferentes grupos participantes en la visita basal del estudio. Los grupos de comparación fueron: pacientes (toda la muestra) frente a controles (toda la muestra), pacientes pediátricos frente a adultos, y controles pediátricos frente a adultos. Para comparar variables categóricas discretas se empleó la prueba exacta de Fisher o la de Chi-cuadrado. Dado que todas las variables cuantitativas incluidas en el análisis (edad, días de exposición previa a ASG, dosis actuales y acumuladas de ASG al inicio del estudio) mostraban un patrón de distribución no normal, se emplearon pruebas no paramétricas (U de Mann-Whitney) para las comparaciones. Todos los análisis estadísticos fueron realizados con el programa SPSS 18.037 y se consideraron significativas aquellas diferencias con p < 0,05. Todas las pruebas fueron de dos colas.
ResultadosDescripción de la muestra al inicio del estudioLas características demográficas y clínicas basales de los 307 pacientes (71 pediátricos y 236 adultos) y de los 150 controles sanos (18 pediátricos y 132 adultos) que fueron incluidos en el estudio SLiM se muestran en la tabla 4. Dicha tabla incluye asimismo datos referentes a los ASG prescritos y a los tratamientos concomitantes, tanto para toda la muestra de pacientes en general como para cada grupo de edad en particular.
Características demográficas y clínicas basales de los pacientes y controles pediátricos y adultos
| Pacientes | Controles | ||||||||
| Total (N=307) | Pediátrico (N=71) | Adulto (N=236) | Ped frente a adultos* | Total (N=150) | Pediátrico (N=18) | Adulto (N=132) | Ped frente a adultos* | Pacientes frente a controles* | |
| Edad (años), media (DE) [rango] | 37,5 (19,9) | 15,9 (1,6) | 44,0 (18,4) | 0,001 | 34,1 (13,7) | 15,2 (2,8) | 36,7 (12,5) | 0,001 | 0,556 |
| [8,8-90,1] | [8,8-17,9] | [18,0-90,1] | [7,8-73,2] | [7,8-17,8] | [18,4-73,2] | ||||
| Sexo masculino, N (%) | 169 (55,0) | 49 (69,0) | 120 (50,8) | 0,007 | 71 (47,3) | 11 (61,1) | 60 (45,5) | 0,212 | 0,121 |
| Raza, N (%)a | |||||||||
| Caucásica | 260 (85,5) | 53 (75,7) | 207 (88,5) | 0,052 | 137 (91,9) | 13 (72,2) | 124 (94,7) | 0,001 | 0,172 |
| Hispana | 25 (8,2) | 8 (11,4) | 17 (7,3) | 10 (6,7) | 3 (16,7) | 7 (5,3) | |||
| Otros | 19 (6,2) | 9 (12,9) | 10 (4,3) | 2 (1,3) | 2 (11,1) | 0 (0) | |||
| Diagnóstico (DSM-IV), N (%)b | |||||||||
| Trastornos del espectro de la esquizofrenia | 42 (14,0) | 9 (12,9) | 33 (14,3) | 0,779 | --- | --- | --- | --- | --- |
| Trastorno bipolar | 28 (9,3) | 14 (20,0) | 14 (6,1) | 0,001 | |||||
| Otros trastornos psicóticos | 108 (36,0) | 26 (37,1) | 82 (35,7) | 0,772 | |||||
| Trastornos depresivos | 35 (11,7) | 1 (1,4) | 34 (14,8) | 0,003 | |||||
| TOC | 1 (0,3) | 0 (0) | 1 (0,4) | 0,999 | |||||
| Otros trastornos de ansiedad | 9 (3,0) | 0 (0) | 9 (3,9) | 0,124 | |||||
| Trastornos relacionados con consumo de sustancias | 9 (3,0) | 0 (0) | 9 (3,9) | 0,124 | |||||
| Trastornos de adaptación | 14 (4,7) | 3 (4,3) | 11 (4,8) | 0,999 | |||||
| Trastornos disociativos | 2 (0,7) | 1 (1,4) | 1 (0,4) | 0,410 | |||||
| Trastornos somatomorfos | 3 (1,0) | 2 (2,9) | 1 (0,4) | 0,135 | |||||
| Trastornos de la conducta alimentaria | 1 (0,3) | 0 (0) | 1 (0,4) | 0,999 | |||||
| Trastornos del sueño | 3 (1,0) | 0 (0) | 3 (1,3) | 0,999 | |||||
| Trastornos de personalidad | 16 (5,3) | 5 (7,1) | 11 (4,8) | 0,541 | |||||
| Retraso mental | 3 (1,0) | 0 (0) | 3 (1,3) | 0,999 | |||||
| Trastornos del espectro autista | 2 (0,7) | 1 (1,4) | 1 (0,4) | 0,410 | |||||
| TDAH | 5 (1,7) | 5 (7,1) | 0 (0) | 0,001 | |||||
| Trastorno de conducta/TND | 2 (0,7) | 2 (2,9) | 0 (0) | 0,053 | |||||
| Otros infancia/adolescencia | 1 (0,3) | 1 (1,4) | 0 (0) | 0,231 | |||||
| Delirium | 10 (3,3) | 0 (0) | 10 (4,3) | 0,124 | |||||
| Demencia | 6 (2,0) | 0 (0) | 6 (2,6) | 0,342 | |||||
| ICG-gravedad, N (%)c | --- | --- | |||||||
| Leve (1-3) | 26 (9,9) | 11 (15,9) | 15 (7,7) | 0,001 | |||||
| Moderada (4-5) | 201 (76,4) | 36 (52,2) | 165 (85,1) | ||||||
| Grave (6-7) | 36 (13,7) | 22 (31,9) | 14 (7,2) | ||||||
| Tiempo de exposición a antipsicóticos al inicio del estudio, N (%)d | - | ||||||||
| Completamente naive | 121 (39,4) | 27 (38,0) | 94 (39,8) | 0,785 | --- | --- | --- | --- | --- |
| Exposición previa a ASG ≤ 10 días | 186 (60,6) | 44 (62,0) | 142 (60,2) | ||||||
| Antes de la primera visita | 184 (59,9) | 43 (60,6) | 141 (59,7) | ||||||
| En el pasado | 2 (0,7) | 1 (1,4) | 1 (0,5) | ||||||
| ASG prescrito al inicio del estudio, N (%)e | |||||||||
| Risperidona | 126 (41,0) | 51 (71,8) | 75 (31,8) | 0,001 | --- | --- | --- | --- | --- |
| Olanzapina | 77 (25,1) | 3 (4,2) | 74 (31,4) | 0,001 | |||||
| Quetiapina | 88 (28,7) | 15 (21,1) | 73 (30,9) | 0,109 | |||||
| Otrof | 16 (5,2) | 2 (2,8) | 14 (5,9) | 0,378 | |||||
| Exposición previa a ASG (días), media (DE), mediana [rango] | 2,4 (2,7), 2,0 [0-10] | 2,1 (2,4), 2,0 [0-10] | 2,5 (2,8), 1,5 [0-10] | 0,372 | --- | --- | --- | --- | ---- |
| Dosis actual de ASG al inicio del estudio (mg), media (DE) [rango]g | 145,7 (185,7) [0-1.200] | 123,5 (142,1) [0-530,3] | 152,2 (196,5) [0-1.200] | 0,736 | --- | --- | --- | --- | --- |
| Dosis acumulada de ASG al inicio del estudio (mg), media (DE) [rango]g | 560,9 (859,7) [0-6.105,3] | 377,4 (545,8) [0-2.727,3] | 614,8 (926,1) [0-6.105,3] | 0,330 | --- | --- | --- | --- | --- |
| Tratamiento concomitante, N (%)h | |||||||||
| Antidepresivos | 78 (25,6) | 5 (7,2) | 73 (30,9) | 0,001 | --- | --- | --- | --- | --- |
| Litio | 3 (1,0) | 0 (0,0) | 3 (1,3) | 0,999 | |||||
| Otros estabilizadores del ánimo | 25 (8,2) | 3 (4,3) | 22 (9,3) | 0,185 | |||||
| Estimulantes | 5 (1,6) | 5 (7,0) | 0 (0) | 0,001 | |||||
| Benzodiazepinas | 142 (46,4) | 26 (37,1) | 116 (49,2) | 0,077 | |||||
| Agentes anticolinérgicos | 12 (3,9) | 8 (11,3) | 4 (1,7) | 0,001 | |||||
| Abandono previo a la evaluación de 6 meses, N (%)i | 144 (46,9) | 36 (50,7) | 108 (45,8) | 0,464 | 17 (11,3) | 3 (16,7) | 14 (10,6) | 0,432 | 0,001 |
| Rechazan continuar | 21 (6,8) | 1 (1,4) | 20 (8,5) | 0,034 | 3 (2,0) | 2 (11,1) | 1 (0,8) | 0,038 | 0,027 |
| Pérdidas de seguimiento | 70 (22,8) | 23 (32,4) | 47 (19,9) | 0,034 | 14 (9,3) | 1(5,6) | 13 (9,8) | 0,999 | 0,001 |
| Interrupción del ASG | 42 (13,7) | 10 (14,1) | 32 (13,6) | 0,950 | --- | --- | --- | --- | --- |
| Muertej | 1 (0,3) | 0 (0) | 1 (0,4) | 0,999 | 0 (0) | 0 (0) | 0 (0) | --- | 0,999 |
| Otras razones | 6 (2,0) | 2 (2,8) | 4 (1,6) | 0,628 | 0 (0) | 0 (0) | 0 (0) | --- | 0,185 |
| Desconocido | 4 (1,3) | 0 (0) | 4 (1,6) | 0,577 | 0 (0) | 0 (0) | 0 (0) | --- | 0,308 |
En todas las celdas, el % se refiere a porcentajes (en la columna) de participantes para los que se dispone de dicha información.
ASG: antipsicótico de segunda generación; ICG: impresión clínica global; Otros infancia/adolescencia: otros trastornos de la infancia o la adolescencia; Otros trastornos de ansiedad: trastorno de ansiedad generalizada, trastorno de ansiedad no especificado y trastorno por estrés postraumático; Otros trastornos psicóticos: psicosis reactiva breve, trastorno psicótico no especificado, trastorno depresivo mayor con síntomas psicóticos, psicosis inducida por sustancias y trastorno delirante; Ped: Pediátricos; TDAH: trastorno por déficit de atención e hiperactividad; TND: trastorno negativista desafiante; TOC: trastorno obsesivo-compulsivo; Trastornos del espectro de la esquizofrenia: esquizofrenia, trastorno esquizofreniforme y trastorno esquizoafectivo; Trastornos depresivos: trastorno depresivo mayor, distimia y trastorno depresivo no especificado.
Los valores de p estadísticamente significativos se muestran en negrita. Para las variables cualitativas, pruebas de Chi cuadrado (χ2) (Prueba exacta de Fisher cuando procediese). Para las variables cuantitativas, prueba U de Mann-Whitney.
Información disponible para 300 pacientes. El diagnóstico se refiere al trastorno psiquiátrico para el que se prescribe el ASG. Cuarenta y cinco pacientes presentaban un diagnóstico comórbido de eje I o II (datos disponibles en caso de solicitud).
Información disponible para 307 pacientes. Completamente naive se refiere a aquellos pacientes a los que se les prescribió un ASG por primera vez en la visita inicial (basal) del estudio. La exposición previa a ASG ≤ 10 días se refiere a aquellos pacientes que a lo largo de su vida habían tomado antipsicóticos durante un periodo que no superaba los 10 días, ya fuese porque se les había prescrito un ASG justo antes de la visita inicial (basal) o en el pasado.
Información disponible para 307 pacientes.
fOtros ASG: paliperidona (n=6 pacientes adultos); aripiprazol (n=2 pacientes pediátricos y 4 adultos); amisulprida (n=2 pacientes adultos); asenapina (n=1 paciente adulto); combinación de olanzapina+sulpirida (n=1 paciente adulto).
Un porcentaje significativamente mayor de pacientes (47%) que de controles sanos (11%) se retiró del estudio a lo largo del seguimiento. Los principales motivos de retirada del estudio se muestran en la figura 1 y en la tabla 4.
DiscusiónEl estudio SLiM es el primer estudio farmacogenético prospectivo, observacional, multicéntrico, de 6 meses de duración que incluye una amplia cohorte de pacientes naive a los ASG, con un amplio rango de edad (8 a 90 años) y una variedad de diagnósticos, así como una cohorte de controles sanos pareados por edad, sexo y raza con el grupo de pacientes. En nuestra muestra, el grupo de pacientes pediátricos estaba constituido por un porcentaje mayor de varones, un mayor porcentaje de sujetos diagnosticados de trastorno bipolar y un grado de psicopatología global más grave (definido como una puntuación CGI-S ≥ 6) que el grupo de pacientes adultos. Independientemente de la edad, al inicio del estudio, casi un 40% de los pacientes no había recibido nunca antes tratamiento con ASG. La risperidona fue el ASG más prescrito en ambos grupos de edad. Al inicio del estudio, los pacientes pediátricos presentaban un mayor procentaje de prescripción de risperidona, agentes anticolinérgicos y estimulantes que los adultos. Por otra parte, el porcentaje de prescripción de olanzapina y antidepresivos era superior en los pacientes adultos. La dosis media diaria de ASG prescrita en pacientes pediátricos era ligeramente inferior que en los adultos, aunque dicha diferencia no era estadísticamente significativa.
En nuestra muestra apenas se prescribieron ASG diferentes a la risperidona, olanzapina y quetiapina. Esta particularidad podría deberse en parte al diseño del estudio. Inicialmente, solo se incluyeron en el estudio SLiM aquellos pacientes a los que se les prescribía por primera vez uno de estos 3 ASG; más adelante, se ampliaron los criterios de inclusión y la prescripción de cualquier ASG fue permitida. Esto puede haber sesgado los resultados en relación con las tasas de prescripción observadas en ambos grupos de edad. No obstante, los datos observados son compatibles con los de estudios observacionales previos en contextos similares, en los que estos fármacos fueron los ASG más prescritos, tanto en población pediátrica38,39 como adulta40. Salvo por un paciente al que se le había prescrito risperidona por agresividad en el contexto de un trastorno de conducta y bajo cociente intelectual, el resto de los pacientes pediátricos incluidos en el estudio SLiM tomaban ASG para usos no aprobados por las agencias reguladoras de medicamentos a nivel nacional y europeo. No obstante, el hecho de que la olanzapina no se prescribiese apenas en el grupo pediátrico apunta a que los psiquiatras que atienden a niños y adolescentes son conscientes del perfil de efectos adversos metabólicos de este fármaco41. En cuanto a los tratamientos concomitantes, a pesar de que cada vez es más frecuente la prescripción de antidepresivos con antipsicóticos en niños y adolescentes42,43, la tasa de prescripción conjunta parece ser mayor en la población adulta40,44.
El estudio SLiM presenta una serie de limitaciones inherentes a su diseño naturalista. No se controló la prescripción de ASG y la elección del tipo de ASG y la dosis fue realizada por cada psiquiatra en función de criterios clínicos. Además, la muestra era heterogénea en cuanto a centro/lugar de procedencia (unidades de hospitalización, centros ambulatorios, etc.), diagnóstico, uso de medicamentos concomitantes o consumo de alcohol u otros tóxicos. Se tendrán en cuenta todos estos factores a la hora de examinar mediante futuros análisis los factores clínicos, ambientales y genéticos que pueden estar relacionados con el aumento de peso y los trastornos metabólicos. Las principales dificultades del estudio fueron el reclutamiento de pacientes que no hubiesen tomado ASG con anterioridad y la estrategia de pareamiento del grupo control. A pesar de ello, se consiguió reclutar una cohorte relativamente amplia de pacientes naive a ASG y de controles sanos. Durante el seguimiento, una de las principales dificultades fue la importante tasa de retirada del estudio (alrededor del 50% de los pacientes y el 11% de los controles). El principal motivo de retirada tanto en pacientes adultos como pediátricos fue la pérdida durante el seguimiento (19,9 y 32,4%, respectivamente), mientras que la negativa a continuar en el estudio fue más frecuente en la población adulta que en la infantil (8,5 frente al 1,4%, respectivamente). La interrupción del ASG prescrito fue el motivo de retirada del estudio en alrededor del 14% de los pacientes (en ambos subgrupos de edad). No obstante, la tasa de interrupción del tratamiento ASG en nuestra muestra podría ser superior al reportado, ya que dicha interrupción podría haber tenido lugar en algún caso de los que se perdieron durante el seguimiento o de los que rechazaron seguir participando. Por otra parte, los controles recibieron una compensación económica en forma de tarjeta regalo por su participación en el estudio SLiM. Esto puede haber ocasionado un «sesgo del voluntario» (es decir, el sesgo que se deriva del hecho de que una determinada muestra pueda contener una mayor proporción de participantes que estén realmente dispuestos a participar en el estudio o experimento45). Sin embargo, los autores intentaron controlar dicho sesgo mediante una cuidadosa estrategia de pareamiento del grupo control con el grupo de pacientes. Otra limitación importante se deriva de la técnica de determinación de ASG en suero en cada visita, la cual solo proporciona una medida indirecta de la adherencia al tratamiento. No obstante, las determinaciones se realizaron en un solo centro, donde un bioquímico experto previamente entrenado en la técnica realizó el análisis siguiendo un protocolo estandarizado.
Entre las principales fortalezas de este estudio se encuentran su diseño prospectivo, con 6 meses de seguimiento, la homogeneidad de la muestra de pacientes y controles, el amplio rango de edad de la muestra y el amplio tamaño muestral si tenemos en cuenta las características de la muestra mencionadas. Esta estrategia aumentará el poder del estudio PGx, con reducción del número de factores de confusión y de la probabilidad de efectos de arrastre.
Los resultados del estudio SLiM proporcionarán una mejor comprensión de los factores clínicos, ambientales y genéticos implicados en el aumento de peso y en los trastornos metabólicos asociados al tratamiento con ASG. Además, permitirá explorar el efecto de la edad en este tipo de cambios y el impacto del aumento de peso en la evolución clínica y la calidad de vida de los pacientes que inician un tratamiento con ASG. Por último, el estudio SLiM permitirá la identificación de posibles marcadores biológicos PGx predictores de tolerabilidad a los ASG. En un futuro próximo, todo ello podría ayudar a la individualización del tratamiento antipsicótico y facilitar el desarrollo de nuevas herramientas terapéuticas con un mejor perfil de seguridad y tolerabilidad para los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Fuentes de financiaciónEste estudio fue financiado por el Fondo de Investigaciones Sanitarias (FIS), Instituto de Salud Carlos III, Ministerio de Economía y Competitividad de España (PI 06/1165, PI 07/0815, PI 07/0163, y PI 07/0452), Beca Intramural CIBERSAM 2008 y Fundación Mutua Madrileña 2009.
Conflicto de interesesLP-C y CMD-C han recibido una beca ‘Río Hortega’ del Instituto de Salud Carlos III, Ministerio de Economía y Competitividad de España y de la Fundación Alicia Koplowitz.
JB ha asesorado o recibido honorarios o becas de Adamed, AstraZeneca, Bristol-Myers Squibb, CIBERSAM, D & A Pharma, Elan, Comisión Europea FP6 y FP7-, Forest, Instituto de Salud Carlos III, Janssen Cilag, Lilly, Lundbeck, Ministerio de Sanidad, Plan Nacional sobre Drogas, Otsuka, Pfizer, Roche, Servier y Shire.
IC ha recibido honorarios o becas de Lilly, Janssen y Otsuka.
RRJ ha asesorado o recibido honorarios o becas de CIBERSAM, Instituto de Salud Carlos III, Lundbeck, Otsuka y Pfizer.
JS ha asesorado o recibido becas de investigación del Ministerio de Economía y Competitividad, Conselleria de Sanidad, ISCIII, TV3, Lilly, Janssen, Otsuka, Roche, Pfizer, y Astra Zeneca.
AG-L ha recibido becas de investigación y ha asesorado o realizado ponencias en nombre de AstraZeneca, Eli Lilly, Boehringer Ingelheim, Lundbeck, Pfizer y Servier.
DF ha asesorado o recibido honorarios de Astra-Zeneca, Bristol-Myers-Squibb, Janssen, Lundbeck, Otsuka y Pfizer.
CA ha asesorado o recibido honorarios o becas de Abbot, Amgen, AstraZeneca, Bristol-Myers Squibb, Caja Navarra, CIBERSAM, la Fundación Alicia Koplowitz, Instituto de Salud Carlos III, Janssen Cilag, Lundbeck, Merck, Ministerio de Ciencia e Innovación, Ministerio de Sanidad, Ministerio de Economía y Competitividad, Mutua Madrileña, Otsuka, Pfizer, Roche, Servier, Shire, Takeda y Schering Plough.
PAS, EG, MF, CT-C, MA-B, MM y BA no tienen ningún conflicto de intereses que declarar.
Con el apoyo del Ministerio de Economía y Competitividad. Instituto de Salud Carlos III, CIBERSAM, Comunidad de Madrid (Ayudas I+D en Biomedicina S2010/BMD-2422 AGES) y Fondos Estructurales de la Unión Europea; Fundación Alicia Koplowitz, Fundación Mutua Madrileña y el Comissionat per a Universitats i Recerca del DIUE de la Generalitat de Catalunya (2009 SGR 827).