Valorar la eficacia de la ketamina administrada intraoperatoriamente a dosis bajas en infusión continua (8μg/kg/min) en la analgesia postoperatoria y en reducir el consumo de morfina en las primeras 24h del postoperatorio de cirugía de derivación coronaria tras anestesia basada en remifentanilo.
Material y métodoEstudio prospectivo, aleatorio y doble ciego en 60 pacientes, ASA III–IV, programados para ser sometidos a cirugía de revascularización miocárdica sin circulación extracorporea. Técnica anestésica estándar con propofol y remifentanilo entre 0,5–1μg/kg/min, tras la inducción anestésica, el grupo K (n=30) recibió una infusión de ketamina constante de 8μg/kg/min y el grupo P (n=30) suero salino 0,9% al mismo ritmo de infusión por vía intravenosa. Antes de finalizar la cirugía se administró 0,15mg/kg de morfina vía intravenosa. La analgesia postoperatoria se realizó con morfina 3mg cada 5min cuando la escala verbal simple (1). Valoramos el consumo de remifentanilo propofol intraoperatorio, tiempo hasta administrarse el primer analgésico, consumo de morfina en las primeras 24h, intensidad del dolor mediante escala verbal simple y escala visual analógica, parámetros hemodinámicos, respiratorios, nivel de sedación y efectos adversos.
ResultadosNo hemos encontrado diferencias estadísticamente significativas en las características demográficas, así como en el consumo e infusiones medias de remifentanilo y propofol de ambos grupos. Los pacientes del grupo K retrasaron significativamente el momento de solicitar la primera dosis de analgésico con respecto al grupo P (p<0,03), el consumo de morfina en la reanimación y el consumo total en las primeras 24h no mostró diferencias significativas entre ambos grupos de estudio.
Los parámetros hemodinámicos, respiratorios y nivel de sedación permanecieron estables durante todo el periodo de estudio sin diferencias estadísticamente significativas entre ambos grupos. El control del dolor postoperatorio fue adecuado en ambos grupos (escala visual analógica <30, escala verbal simple <2) sin diferencias significativas durante las 24h de estudio. En la incidencia de efectos adversos no hubo diferencias significativas entre ambos grupos, la incidencia de nauseas y vómitos postoperatorios fue del 20% en el grupo K y del 30% en el grupo P. Ningún paciente presentó alucinaciones o disforia.
ConclusionesDosis bajas de ketamina en infusión continua durante el periodo intraoperatorio de cirugía coronaria prolongan el tiempo de demanda de la primera dosis de morfina, sin reducir el consumo de remifentanilo intraoperatorio, ni el consumo total de morfina durante en las primeras 24h de postoperatorio.
To assess the efficacy of ketamine in low doses by continuous infusion (8μg/kg/min) given during surgery and the reduction in morphine use in the first 24h after coronary bypass surgery with remifentanil based anaesthesia.
Material and methodRandomised, prospective, double blind study on 60 patients, ASA III–IV, scheduled to have off-pump myocardial revascularisation surgery. A standard anaesthetic technique with propofol and remifentanil between 0.5−1μg/kg/min, after induction of anaesthesia, the ketamine (K) group (n=30) received a continuous infusion of 8μg/kg/min and the propofol and remifentanil (P) group (n=30) received 0.9% physiological saline intravenously at the same infusion rate. Before the end of the surgery 0.15mg/kg of morphine was given intravenously. Post-operative analgesia consisted of 3mg of morphine every 5min when the simple verbal scale was <1 (SVS<1). The intra-operative use of remifentanil–propofol was determined, as well as, the time to giving the first analgesic, pain intensity using the SVS and visual analogue scale (VAS), haemodynamic and respiratory parameters, level of sedation and adverse effects.
ResultsNo statistically significant differences were found between the demographic parameters, or in the mean use and infusions of remifentanil and propofol by both groups. The patients from the K group significantly delayed the time of requesting the first analgesic dose compared to the P group (P<0.03). There were no significant differences between both study groups in the use of morphine in recovery and the total use in the first 24h.
The haemodynamic and respiratory parameters, and the sedation level remained stable during the whole period of the study, with no statistically significant differences between both groups. Post-operative pain control was adequate in both groups VAS<30, SVS<2), with no significant differences during the 24h of the study. There no significant differences between groups, in the incidence of adverse effects. The incidence of nausea and post-operative vomiting was 20% in group K and 30% in group P. None of the patients had hallucinations or dysphoria.
ConclusionsLow doses of ketamine in continuous infusion during the intra-operative period of coronary surgery prolongs the time of demanding the first morphine dose, without reducing the use of intra-operative remifentanil, or the total use of morphine in the first 24h after surgery.
Una inadecuada analgesia asociada a la falta de control de la respuesta al estrés quirúrgico durante el periodo postoperatorio de los pacientes intervenidos tras cirugía cardiaca, puede desencadenar respuestas adversas de tipo hemodinámico, metabólico, inmunológico y alteraciones en la hemostasia, además de complicaciones respiratorias, las cuales pueden comprometer aún más el curso postoperatorio de pacientes con función miocárdica deteriorada1. El dolor postoperatorio es causante de numerosos efectos fisiopatológicos indeseables con aumento de la morbimortalidad, y la necesidad del tratamiento adecuado del dolor postoperatorio está actualmente fuera de toda discusión2.
El uso de anestesia basada en la analgesia es una técnica segura en cirugía cardiaca. Remifentanilo es un agonista opiáceo que proporciona estabilidad hemodinámica en pacientes de alto riesgo cardiaco3, debido a sus características farmacocinéticas es un opiáceo adecuado en cirugía de derivación coronaria en programas de extubación precoz. Estudios recientes refieren que los pacientes que reciben dosis elevadas de remifentanilo durante el periodo intraoperatorio presentan más dolor postoperatorio y unos requerimientos de morfina mas elevados que los que reciben dosis bajas, induciendo tolerancia aguda a opiáceos e hiperalgesia en el postoperatorio4. La tolerancia a opiáceos es un fenómeno farmacodinámico y los mecanismos moleculares responsables permanecen desconocidos, aunque se involucran múltiples sistemas, uno de los más aceptados implica a los receptores N-metil-D-aspartato (NMDA)5,6. La ketamina es un antagonista no competitivo de los receptores NMDA, y su uso intraoperatorio podría atenuar los fenómenos de tolerancia aguda a opiáceos e hiperalgesia, reducir los requerimientos de opiáceos en el periodo postoperatorios y prolongar la demanda de analgesia postoperatoria7. Estudios recientes han demostrado que el uso de ketamina a dosis bajas durante el intraoperatorio de cirugía abdominal mayor reduce las necesidades intraoperatorias de remifentanilo y el consumo postoperatorio de morfina8, sin embargo, esto no ha sido estudiado en el postoperatorio de cirugía cardiaca.
El objetivo de este estudio es valorar la eficacia de la ketamina administrada intraoperatoriamente a dosis bajas en reducir el consumo de morfina en las primeras 24h del postoperatorio de cirugía de derivación coronaria tras anestesia basada en remifentanilo.
Material y métodoHemos realizamos un estudio prospectivo, aleatorio y doble ciego en 60 pacientes, ASA III–IV, con edades comprendidas entre 40–75 años, programados para ser sometidos a cirugía de revascularización miocárdica sin circulación extracorporea.
Los criterios de exclusión fueron: fracción de eyección ventricular izquierda inferior al 35%, hipertensión arterial no controlada, insuficiencia renal, hepatopatía, obesidad (índice de masa corporal superior a 35), trastornos psiquiátricos, y el tratamiento crónico con analgésicos, sedantes o antidepresivos.
El estudio fue aprobado por el comité ético del hospital y todos los pacientes firmaron el consentimiento para participar en el estudio.
Los pacientes fueron premedicados con 3mg de bromacepam 1h antes de la intervención quirúrgica. Todos los pacientes recibieron anestesia general en la que se procedió con una técnica anestésica estándar. En la inducción anestésica se administró remifentanilo 0,5μg/kg/min, propofol 1mg/kg y atracurio 0,5mg/kg, asociando posteriormente una infusión continua de propofol a 75μg/kg/min y remifentanilo entre 0,5−1μg/kg/min durante todo el procedimiento quirúrgico y atracurio a demanda. Tras la inducción anestésica se administró de forma aleatoria en función del grupo de estudio una infusión de ketamina constante de 8μg/kg/min (grupo K) o placebo (suero salino 0,9%) al mismo ritmo de infusión (grupo P) vía intravenosa, las infusiones fueron preparadas previamente por un investigador «ciego». La infusión de remifentanilo durante el mantenimiento anestésico fue reducida o incrementada en 0,1μg/kg/min ante aumentos o descensos en la presión arterial media en un 20% durante mas de 1min o ante incrementos en la frecuencia cardiaca en un 15% respecto a los valores preinducción. La bradicardia o hipotensión persistente fue tratada con atropina o efedrina en bolos respectivamente. Quince minutos antes de finalizar la cirugía, la infusión de propofol fue reducida a la mitad, y se procedió a revertir el bloqueo neuromuscular cuando fue preciso. Al finalizar la cirugía, se suspendió la infusión de propofol, remifentanilo y de ketamina o placebo según el grupo de estudio. Cuarenta y cinco minutos antes de finalizar la cirugía se administró 0,15mg/kg de morfina vía intravenosa. Todos los pacientes fueron extubados cuando se obtuvo adecuada respiración espontanea y respuesta a la orden verbal, ningún paciente recibió naloxona.
Posteriormente fueron trasladados a la unidad reanimación (URPA), al ingreso en reanimación, se monitorizó la frecuencia y ritmo cardíaco, presión arterial invasiva, frecuencia respiratoria, y pulsioximetría. Todos los pacientes recibieron oxigenoterapia suplementaria a 3l/min mediante mascarilla facial. Los pacientes permanecieron en la unidad de reanimación durante 24h, como analgésico postoperatorio se administró morfina a dosis de 3mg vía intravenosa cada 5min hasta control del dolor a requerimientos del paciente y cuando la intensidad del dolor en la escala verbal simple fuese superior a 1 en escala verval simple (EVS>1).
Se registró el consumo de remifentanilo, propofol y ketamina intraoperatorio, el tiempo trascurrido hasta la demanda del primer analgésico y el consumo de morfina en la URPA y el consumo total en las primeras 24h.
Hemos valorado al ingreso en la URPA, a los 15min y cada 30min durante las 2 primeras horas y a las 4, 6, 8,12 y 24h tras el ingreso, los parámetros hemodinámicos (frecuencia cardiaca y presión arterial sistólica, diastólica y media), respiratorios (frecuencia respiratoria y saturación de oxígeno), grado de sedación mediante la escala de Ramsay9 (1–6 puntos). La intensidad del dolor postoperatorio fue valorada mediante la EVS de 4 grados (0=ningún dolor, 1=dolor leve, 2=dolor moderado, 3=dolor severo) y la escala analógica visual (EVA) de 0–100mm (0=ausencia de dolor, 100=peor dolor imaginable). Se registró la incidencia de nauseas, vómitos, disforia y alucinaciones a las primeras 24h.
Los resultados están expresados como media±desviación estándar o porcentajes. La valoración estadística se ha realizado mediante la prueba de la U de Mann- Whitney (variables cuantitativas), la prueba de la ji al cuadrado (variables cualitativas) y el análisis de la varianza para el resto de las variables. Se consideró significación estadística cuando p<0,05.
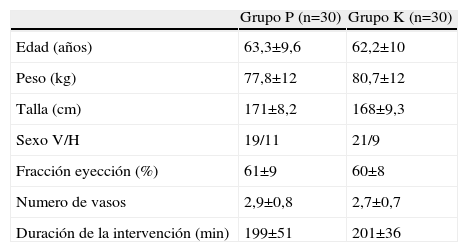
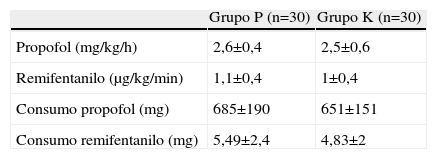
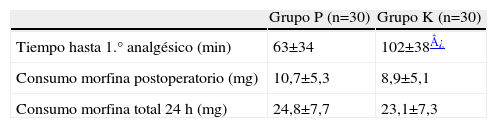
ResultadosNo hemos encontrado diferencias estadísticamente significativas en las características demográficas (edad, peso talla, sexo o duración de la anestesia), función ventricular y numero de vasos (tabla 1), así como en el consumo e infusiones medias de remifentanilo y propofol de los dos grupos (tabla 2). El consumo de ketamina fue de 0,9±0,2mg/kg. Los pacientes del grupo K retrasaron significativamente el momento de solicitar la primera dosis de analgésico con respecto al grupo P (p<0,03), el consumo de morfina en la URPA y el consumo total en las primeras 24h no mostró diferencias significativas entre ambos grupos de estudio (tabla 3).
Datos demográficos
| Grupo P (n=30) | Grupo K (n=30) | |
| Edad (años) | 63,3±9,6 | 62,2±10 |
| Peso (kg) | 77,8±12 | 80,7±12 |
| Talla (cm) | 171±8,2 | 168±9,3 |
| Sexo V/H | 19/11 | 21/9 |
| Fracción eyección (%) | 61±9 | 60±8 |
| Numero de vasos | 2,9±0,8 | 2,7±0,7 |
| Duración de la intervención (min) | 199±51 | 201±36 |
Valores expresados como media±DE o valores absolutos.
Requerimiento de analgesia y consumo de morfina
| Grupo P (n=30) | Grupo K (n=30) | |
| Tiempo hasta 1.° analgésico (min) | 63±34 | 102±38¿ |
| Consumo morfina postoperatorio (mg) | 10,7±5,3 | 8,9±5,1 |
| Consumo morfina total 24h (mg) | 24,8±7,7 | 23,1±7,3 |
Valores expresados como media±DE.
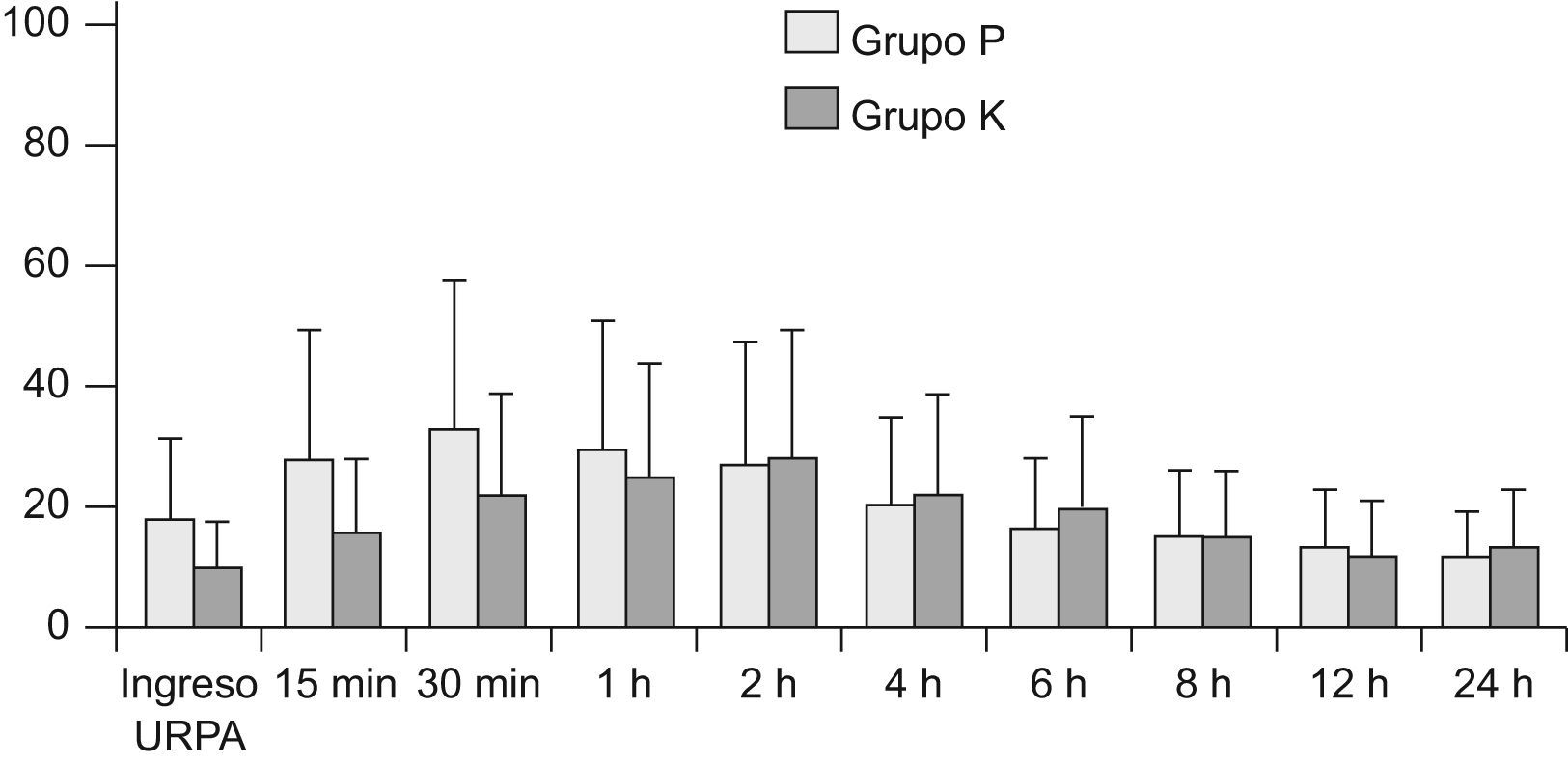
Los parámetros hemodinámicos (frecuencia cardiaca, presión arterial sistólica y diastólica) permanecieron estables durante todo el periodo de estudio sin diferencias estadísticamente significativas entre ambos grupos y con respecto a los valores hemodinámicos basales. Ambos grupos mostraron frecuencias respiratorias similares a las basales sin que se apreciaran diferencias significativas entre grupos, igualmente, las saturaciones de oxígeno por pulsioximetría se mantuvieron en un rango de normalidad clínica, entre el 95–98% durante las 24h de estudio. El nivel de sedación fue similar en ambos grupos de estudio, no se evidenció ningún caso de depresión respiratoria postoperatoria. El control del dolor postoperatorio fue adecuado en ambos grupos (EVA<30, EVS<2) sin diferencias significativas durante las 24h de estudio (fig. 1). En cuanto a la incidencia de efectos adversos no hubo diferencias significativas entre ambos grupos, la incidencia de nauseas y vómitos postoperatorios fueron: grupo K 6 (20%), grupo P 9 (30%). Un paciente del grupo K presento diaforesis. Ningún paciente presentó alucinaciones o disforia.
DiscusiónLa elección de una técnica anestésica basada en remifentanilo propofol en pacientes sometidos a cirugía de revascularización miocárdica sin circulación extracorpórea, aporta seguridad, estabilidad hemodinámica, adecuada profundidad anestésica y permite una extubación precoz de los pacientes10. Remifentanilo es un opiáceo de acción ultracorta, agonista selectivo de los receptores μ, el cual presenta características farmacocinéticas y farmacodinámicas óptimas para ser utilizado en infusión continua en el periodo perioperatorio11,12. Su principal inconveniente radica en la ausencia total de analgesia residual postoperatoria, en este sentido, se considera la morfina a dosis de 0,15mg/kg administrada 30–40min previos al final del procedimiento quirúrgico como una pauta analgésica inicialmente adecuada dentro de una analgesia balanceada, dosis mayores no evitan la necesidad de administrar dosis repetidas en el postoperatorio inmediato y si podrían inducir depresión respiratoria en pacientes de riesgo13. Estudios recientes han propuesto la posible aparición de tolerancia aguda a los efectos antinociceptivos de remifentanilo; en voluntarios con modelos de dolor experimental en los cuales la existencia de tolerancia al efecto analgésico de remifentanilo se pone de manifiesto a partir de la 3.a hora de infusión14, y también en estudios clínicos4 tras anestesias basadas en analgesia, refieren un incremento en el consumo de morfina en el postoperatorio de pacientes en los cuales se utilizan infusiones de remifentanilo superiores a 0,3μg/kg/min. Sin embargo, otros estudios en modelo de dolor experimental en voluntarios15 como tras anestesias basadas en remifentanilo16 o durante el empleo de remifentanilo en el tratamiento del dolor postoperatorio17, no evidencian la existencia de tolerancia aguda a los efectos antinociceptivos de remifentanilo. La tolerancia aguda a opiáceos es un tema de controversia actualmente y los mecanismos moleculares implicados no han sido esclarecidos en su totalidad, aunque se involucran diversos sistemas, uno de los más aceptados implica a los receptores NMDA18. De hecho, se ha sugerido que tanto la hiperalgesia aparecida tras una agresión tisular como la aparición de tolerancia aguda a opiáceos implican la activación del receptor NMDA, lo que puede generar cambios neuroplásticos en el sistema nervioso central, englobados sobre el concepto de sensibilización central. Ambos fenómenos, hiperalgesia y tolerancia comparten la activación de los mismos receptores, lo que implica que los antagonistas de estos receptores, como la ketamina, podrían prevenir dichos fenómenos e intensificar la analgesia inducida por los opiáceos.
La ketamina puede producir antinocicepción mediada por diversos mecanismos: antagonismo con los receptores NMDA, interacción con receptores μ a nivel espinal y activación de vías monoaminérgicas descendentes inhibidoras del dolor19. La ketamina es un antagonista no competitivo de los receptores NMDA que ha mostrado capacidad para potenciar la analgesia inducida por opiáceos, reducir la hiperalgesia y prevenir la tolerancia inducida por estos20. La interacción de ketamina sobre el receptor NMDA es más selectiva cuanto menor es la dosis administrada. Su administración mediante infusión intravenosa o epidural asociado a opiáceos permitiría reducir el consumo de estos y disminuir la intensidad del dolor postoperatorio21.
La atenuación de la tolerancia ocurre con el empleo de ketamina a dosis bajas, con su uso a dosis subanestésicas o subanalgésicas puede reducirse también el consumo de opioides7. Dosis bajas de ketamina se han definido como no más de 1mg/kg cuando se administras en bolo intravenoso y no más de 20μg/kg/min cuando se administra en infusión continua22. La mayoría de los estudios relacionados con la administración de dosis bajas de ketamina se basan en el concepto de analgesia preventiva, en este aspecto, la evidencia clínica resulta aun controvertida23. La dosificación más frecuentemente utilizada es de 0,15mg/kg intravenoso en bolo único, administrados como analgesia preventiva, dosis superiores no han mejorado los resultados. Otros estudios comparan dosis de 0,15mg/kg administración pre y postoperatoriamente, evidenciando que no resulta importante el momento de administración de la ketamina en su repercusión sobre la analgesia postoperatoria24. Los estudios en los que se utiliza ketamina en infusión continua perioperatoriamente, utilizan dosis bolo inicial de 0,5 o 0,15mg/kg asociado a infusión continua de 2μg/kg/min bien durante el periodo intraoperatorio, bien durante las primeras 24h del postoperatorio, proporcionado reducción en consumo de morfina postoperatorio y de los requerimientos de remifentanilo intraoperatorio8,25, sin embargo, estas ventajas sobre la analgesia postoperatoria no las pone de relieve la utilización de S(+)-ketamina en infusión continua22.
En nuestro estudio, dosis bajas de ketamina en infusión continua durante el periodo intraoperatorio de cirugía coronaria prolongaron el tiempo de demanda de la primera dosis de morfina, sin reducir el consumo de remifentanilo intraoperatorio, ni el consumo total de morfina durante en las primeras 24h de postoperatorio, ni el consumo de morfina en el periodo postoperatorio en la unidad de reanimación con respecto al grupo control. Se deduce de nuestros resultados que la ketamina a dosis bajas no previene la tolerancia aguda a opiáceos inducida por remifentanilo a pesar de su utilización a dosis elevadas, infusiones medias de 1μg/kg/min durante mas de 3 horas-las cuales inducen, según se han publicado, tolerancia e hiperalgesia postoperatoria4-, al igual que ha sido descrito en cirugía de columna26 y en contra de lo que refieren otros autores en el contexto de cirugía abdominal mayor con dosificaciones media de remifentanilo muy inferiores8. Las escalas de dolor en nuestros pacientes se situaron con EVS<2 y EVA<35 durante el periodo postoperatorio, lo que implica un control del dolor adecuado; con puntuaciones tan bajas en las escalas de dolor, es cuestionable que las diferencias que pudieran presentarse tuvieran relevancia clínica27.
Una posible explicación a la obtención de resultados diferentes a otros estudios, es el tipo de procedimiento quirúrgico, posiblemente no todos los tipos de cirugía inducen el mismo grado de sensibilización central. El dolor postoperatorio tras cirugía cardiaca es de intensidad moderado-severo en función de la vía de abordaje, tras una esternotomía media, la intensidad del dolor se considera que es moderada28 y puede este modelo no proporcionar diferencias significativas entre ambos grupos en el consumo de opiáceos. Otra posible explicación radicaría en la dosis de ketamina administrada, 8μg/kg/min en perfusión continua, aunque son dosis bajas, otros estudios utilizan perfusiones aun inferiores, 2μg/kg/min, las cuales serian más selectivas sobre el receptor NMDA. Nuestro estudio pone de relieve un retraso en los requerimientos del primer analgésico superior a lo referido en otros trabajos8, posiblemente el mantenimiento de la infusión de ketamina hasta el final de la intervención, nos ha proporcionado un periodo postoperatorio inmediato con escaso dolor, mas prolongado que lo referido en otros estudios que suele ser inferior a los 30min. La incidencia de efectos adversos han sido similares a la referida en la literatura, sobre todo en la incidencia de nauseas y vómitos (20–30%)8,25. La aparición de efectos psicomiméticos a las dosis utilizadas son poco frecuentes, en nuestro estudio no se detectó ningún caso de alucinaciones o disforia.
En conclusión, la utilización de ketamina a dosis bajas en infusión continua (8μg/kg/min) durante el periodo intraoperatorio de cirugía de revascularización miocárdica sin circulación extracorporea, prolongan el tiempo de demanda de la primera dosis de analgesia postoperatoria, sin reducir el consumo de remifentanilo intraoperatorio, ni el consumo total de morfina durante en las primeras 24h de postoperatorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.