En los últimos años, el síndrome doloroso regional complejo (SDRC) ha sido foco de múltiples controversias entre sus estudiosos1,2. La ausencia de lesión nerviosa demostrable en el SDRC tipo I ha creado incertidumbre acerca de la naturaleza neuropática o inflamatoria de éste, aunque recientemente se demostró el daño mínimo persistente de las terminaciones nerviosas, predominante en las de pequeño diámetro responsables del dolor y de las funciones autonómicas3,4. Por otra parte, las manifestaciones clínicas del SDRC agudo mimetizan los síntomas cardinales de la inflamación5,6. Además, se ha demostrado facilitación de la inflamación neurogénica tras la estimulación transcutánea de las fibras C y concentraciones elevadas del péptido relacionado al gen de la calcitonina (PRGC) en el suero de pacientes con SDRC7-9. Mientras que en un modelo de SDRC tipo I inducido por fractura tibial en ratas y de SDRC tipo II por sección del nervio ciático, se demostró que el edema, los cambios vasculares y óseos de la pata trasera, el dolor y la alodinia mecánica eran dependientes, al menos en parte, de la vía de la sustancia P9,10. Al parecer, los pacientes que desarrollan este síndrome poseen dificultad para detener la cascada inflamatoria, y la presencia de concentraciones sistémicas elevadas de citocinas proinflamatorias puede ser un factor predisponente para su desarrollo; de hecho, la facilitación de la inflamación neurogénica se ha observado no sólo en el miembro afectado, sino también en el contralateral11. Algunas investigaciones demostraron la presencia de concentraciones hemáticas de ARNm del factor de necrosis tumoral alfa (TNFα) e interleucina 2 (IL-2) elevadas y de IL-8, IL-6, IL-10 reducidas en estos pacientes12. Con anterioridad, se había publicado la presencia de concentraciones elevadas de IL-1β e IL-6 y de IL-4 e IL-10 reducidas en el líquido cerebroespinal, también de TNFα e IL-6 elevadas en el fluido del miembro afectado13,14. Las nuevas evidencias han permitido un mejor diseño de las investigaciones básicas y clínicas dirigidas a esclarecer la fisiopatología y la introducción de un nuevo enfoque terapéutico, con especial atención al control del dolor neuropático. Recientemente, por la relevancia que han adquirido el estrés oxidativo, la neuroinflamación y la activación glial en sus mecanismos de producción, la Asociación Internacional para el Estudio del Dolor (IASP) propone dirigir los nuevos candidatos terapéuticos hacia estas dianas15,16; también por la efectividad parcial de los fármacos dirigidos a neurotransmisores, canales y receptores clásicamente utilizadas. En correspondencia con estos hallazgos, estudios en modelos animales de constricción crónica del ciático y de ligadura del nervio espinal demostraron el papel del microambiente inflamatorio en la hiperalgesia neuropática, así como en los modelos de neuroinflamación sin daño axonal franco17. La certeza de que el TNFα administrado intraciático induce descargas ectópicas en fi bras Aβ y C18,19 y el hallazgo de mecanosensibilidad en el 10% de las fi bras Aβ, proporción similar a la observada en los modelos de lesión física, podrían esclarecer algunos fenómenos observados en el SDRC20. Además, estudios en roedores han demostrado el papel de las especies reactivas de oxígeno (ERO), citocinas proinflamatorias y algunos elementos del sistema del complemento en el cuerno dorsal espinal (CDE) para el establecimiento de las imágenes en espejo que en muchas ocasiones aparecen en estos pacientes21. De manera similar, existen antecedentes de la utilización de fármacos antiTNFα (infliximab) en el SDRC con alivio del dolor y reducción de las concentraciones de TNFα e IL-6 en el miembro afectado, así como se ha documentado el alivio considerable del dolor, con el uso de inhibidores de la producción de esta citocina (talidomida y lenalidomida)12,13,22.
Los estudios de daño neuropático e inflamación en modelos animales, que demuestran el protagonismo de las ERO en la generación del dolor, han ido en ascenso23-26. En un modelo de ligadura del nervio espinal tras la administración sistémica de vitamina E, se establecieron evidencias robustas de su efecto desensibilizante sobre el mecanismo de hiperexcitabilidad del CDE, correlacionadas entre sí a través de pruebas conductuales, electrofisiológicas e inmunohistoquímicas26. Este experimento demostró el incremento de los umbrales mecánicos en relación con la reducción de la actividad y los campos receptivos de las neuronas de amplio rango dinámico en CDE. Al mismo tiempo, se constató la reducción de la fosforilación del receptor N-metil-D-aspartato (NMDA) en las láminas I-II y III-VI26. También se pudo determinar que la administración intratecal de PBN, un secuestrador de estas especies, reduce la hiperalgesia neuropática en estos modelos a través de mecanismos espinales27. Específicamente, en el SDRC la terapia con secuestradores se basa en la presunción de que éste es inducido, al menos en parte, por una respuesta inflamatoria exagerada al daño tisular, mediada por la excesiva producción de estas especies7,21,27. Se ha descrito la participación de las ERO en el SDRC tipo I, así como que la hipoxia y la reperfusión incrementan la permeabilidad vascular y la actividad de la fosfatasa ácida7,27. En estudios clínicos se ha documentado la utilización de secuestradores de ERO, como el dimetilsulfóxido (DMSO) y la N-acetilcisteína en el SDRC tipo I27. La crema DMSO al 50% mostró mayor efectividad en un ensayo clínico con relación al grupo placebo y se ha publicado el valor profiláctico de la vitamina C en pacientes con fractura de Colles27,28.
El Vimang® es una marca comercial registrada que cubre varios tipos de formulaciones a partir del extracto de la corteza del árbol de mango (ECAM), con propiedades antioxidantes, analgésicas, antiinflamatorias e inmunomoduladoras29-32. Químicamente se caracteriza como una mezcla de polifenoles, terpenoides, esteroides, ácidos grasos, azúcares, polialcoholes y microelementos. Desde el punto de vista farmacológico, su efecto inhibidor de la activación del factor de transcripción nuclear κB (NFκB), promotor de la expresión de mediadores y sistemas enzimáticos involucrados en la inflamación y el dolor, el estrés oxidativo y la plasticidad sináptica, lo hacen un candidato para su introducción en este síndrome33-35. Basándonos en los antecedentes expuestos, el objetivo del presente estudio fue determinar la actividad analgésica del Vimang® en pacientes portadores de SDRC y la posible mejoría de la capacidad funcional postratamiento.
Material y métodosEn el estudio participaron 15 pacientes de la Clínica del Dolor 10 de Octubre, y se desarrolló de noviembre de 2006 a diciembre de 2007. El protocolo fue aprobado por el comité científico y de ética de investigación de la institución, y los pacientes dieron su consentimiento informado por escrito. El diseño del estudio se realizó de acuerdo a las Directrices de las Buenas Prácticas Clínicas y la Declaración de Helsinski en lo relativo al consentimiento informado de los pacientes. Los criterios de inclusión consideraron a pacientes de ambos sexos y de edad adulta, que presentaran diagnóstico clínico de SDRC (tipo I o II) según los criterios de la IASP, que para uso investigativo requiere 4 síntomas y 2 o más signos presentes en cada categoría: anormalidades sensoriales positivas (dolor espontáneo, hiperalgesia mecánica, hiperalgesia térmica, hiperalgesia somática profunda); anormalidades vasculares (vasodilatación, vasoconstricción, asimetrías de la temperatura de la piel, cambios del color de la piel); edema (anormalidades de la sudoración, tumefacción, hiperhidrosis, hipohidrosis); cambios motores/tróficos (debilidad motora, temblor, distonía, deficiencia de coordinación, cambios en el pelo y las uñas, atrofia de la piel, rigidez articular, cambios de los tejidos blandos)36. Además, los pacientes debían presentar puntuaciones diarias medias del dolor (PDMD) ≥ 4 la semana anterior al inicio del tratamiento. Para estos fines se utilizó una escala de Likert de 11 puntos, donde se consideró 0 no dolor y 10 el peor soportable, apoyado en una escala análoga visual37. Los criterios de exclusión fueron el consumo de esteroides u opioides como parte de su tratamiento el mes previo. Todos los pacientes recibieron el mismo tratamiento:
— Para miembro superior: bloqueos anestésicos del ganglio estelar (lidocaína 0,5% 10 ml por vía paratraqueal) y del plexo braquial (mezcla de lidocaína 0,5% y bupivacaína 0,25% 20 ml por vía axilar) 1 sesión semanal en número de 10 sesiones.
— Para miembro inferior: bloqueo anestésico de la cadena simpática lumbar (lidocaína 0,5% 10 ml por vía paravertebral) 1 sesión semanal en número de 10 sesiones. Férula estática-dinámica si es necesaria. Vimang® (300 mg) 2 tabletas cada 8 h por 4 meses, aplicación local 3 veces al día de la crema Vimang® al 1,2 % en el miembro afectado.
Al mes y medio de iniciar el tratamiento se asoció la fisioterapia (técnicas de magnetoterapia, ejercicios de destreza y estímulo eléctrico con corriente interferencial, esta última técnica en los SDRC tipo II).
Se realizó el interrogatorio y el examen físico correspondiente en las consultas para la evaluación sistemática y la búsqueda de complicaciones.
Además de las PDMD, otras variables evaluadas en este estudio fueron el área e intensidad de la alodinia mecánica dinámica, la intensidad de la alodinia mecánica somática profunda al movimiento articular, también la intensidad de la alodinia al frío, la frecuencia del dolor paroxístico al día y la funcionabilidad del miembro afectado. Los pacientes efectuaron por sí mismos una valoración diaria del dolor de las 24 h previas al levantarse en la mañana. El cambio de la PDMD entre la semana basal y la semana final del tratamiento se consideró como criterio de efectividad terapéutica37. La puntuación inicial consistió en la media de los registros del diario de dolor de los últimos 7 días previos a la asignación aleatoria. La puntuación final fue la media de los registros del diario de dolor de los últimos 7 días antes de la consulta a los 4 meses. Se evaluó a los pacientes semanalmente en consulta hasta los 4 meses. Para todos los grupos se recogió, como dato adjunto en la planilla de diario de dolor, la necesidad de asociar otro fármaco y su dosis/día, como una variable de control. Se examinó la extensión del área de alodinia mecánica dinámica, mediante la aplicación de una mota de algodón en la piel afectada, que previamente se había dividido y dibujado con un plumón en un enrejado a intervalos de 2 cm38. La mota de algodón se aplicó suavemente a 2-3 cm/s y secuencialmente desde la zona sana hacia la más irritada, y se le preguntó al paciente si la sensación era normal o molesta hasta delimitar la zona afectada en cm2. La medición se efectuó en 2 momentos diferentes y el valor de ésta se promedió. Además, se determinó la intensidad de esta sensación desagradable en 2 puntos de esta área, se le dio un valor por el paciente según una escala numérica de 0-10, ambos valores también se promediaron. Para la determinación de la sensación desagradable al frío, se utilizó una bolsa de tela para cubos de hielo, que se aplicó por pocos segundos en la piel del miembro afectado36. La medición de la intensidad de esta sensación se efectuó con una escala numérica. En el caso de la evaluación de la alodinia somática profunda, se exploró la intensidad del dolor provocado mediante la misma escala, ante la movilización suave pasiva de la articulación afectada, dentro de su rango normal de movimiento, el cual era limitado por la aparición del dolor36. Para cada miembro se tomó la articulación más dolorosa en cada caso. Se aplicó la escala de Enneking et al. para pacientes amputados, modificada para evaluar la funcionalidad a partir de factores específicos para miembro superior (posición de la mano, destreza y fuerza contra la gravedad) y para miembro inferior (habilidad para caminar, defectos de la marcha)39. A cada factor se le asignaron valores de 0 a 5 sobre criterios establecidos. Valores específicos (0, 1, 3 o 5) se igualaron con ciertos niveles de alcance o realización. Los valores intermedios de 2 y 4 se asignaron según el juicio del examinador cuando la realización del paciente se ubicó entre los valores específicos. El resultado se expresa como una proporción de la funcionabilidad normal que se espera para el paciente. La puntuación final puede expresarse en los términos descriptivos anteriormente descritos, o en términos de porcentajes sobre la puntuación final (tabla 1). Las evaluaciones de todas las variables se realizaron antes de iniciar el tratamiento, 7, 14 y 21 días y mensualmente hasta los 4 meses.
Tabla 1 Escala de Enneking et al para pacientes amputados modificada
EstadísticaPara el procesamiento de los datos se utilizó el paquete estadístico Graph Pad Prism con Windows XP. Para la evaluación de la evolución de los pacientes se consideraron las medias elaboradas a partir de los valores categóricos para la escala de Likert. En cada caso, se realizó la estadística descriptiva de las variables mediante el cálculo de las medias, desviación estándar y el error estándar de la media (EEM). Para evaluar la diferencia entre las medias de cada variable en 8 consultas se utilizó la prueba de análisis de varianza de una vía y la de Bonferroni a posteriori según el tamaño de la muestra por grupos. En la variable funcionabilidad del miembro afectado se aplicó la prueba no paramétrica de Mann-Whitney. Se consideraron valores del estadígrafo significativos de p < 0,05. Los resultados fueron presentados como medias ± EEM.
ResultadosEn la tabla 2 se muestran las características individuales de los 15 pacientes. En este estudio 9 pacientes (60%) eran portadores del SDRC tipo II y 6 (40%) del SDRC tipo I. El ran-go de edades promedio más afectado fue entre los 50 y los 59 años (26,6%), seguido del rango entre 70 y 79 años (20%). La frecuencia de presentación fue mayor en el sexo femenino (60%) y en el miembro superior (86,6%), respectivamente. La mayoría de los pacientes (60%) fue remitida por las especialidades correspondientes con un tiempo de evolución de 3 meses y más desde el inicio de los síntomas. No obstante, 40% de ellos fue remitido con 1 y 2 meses de evolución. Las lesiones traumáticas del plexo braquial y sus ramas como factor desencadenante del síndrome fueron las más frecuentes (40%), seguidas de las fracturas (33,3%). Otras causas fueron: postherpes zóster y tras la cirugía del síndrome del túnel del carpo, un solo caso (6,6%) no mostró causa aparente. Las enfermedades asociadas de mayor incidencia en estos pacientes fueron la diabetes mellitus (33,3%) y la hipertensión arterial (26,6%). El promedio de las PDMD iniciales fue de 6 y el de la funcionalidad del miembro afectado de 1,13/5; es decir, con tendencia a la discapacidad ocupacional total.
Tabla 2 Características individuales de los pacientes
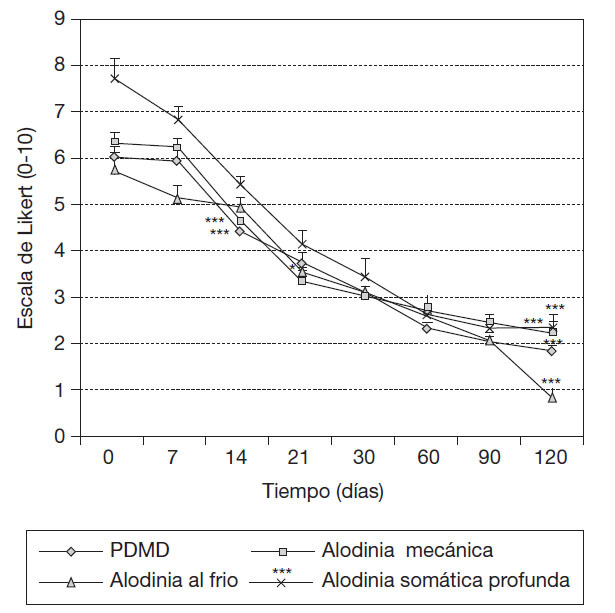
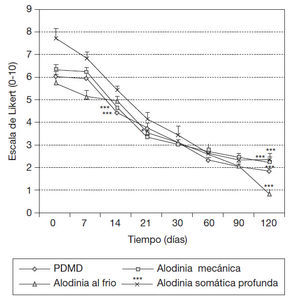
Comportamiento de las puntuaciones diarias medias de dolor, la intensidad de la alodinia mecánica dinámica, al frío y somática profunda, según escala numérica de Likert en pacientes con SDRC que asociaron las formulaciones Vimang® en su tratamiento integral. En este estudio se observó la reducción significativa de las PDMD desde la semana 2 de tratamiento con la suplementacifin de las 2 formulaciones Vimang® (tableta y crema) (p < 0,001) respecto a los valores iniciales; este efecto se mantuvo hasta la última evaluación, a los 120 días (4 meses). El cambio también fue significativo entre la evaluación a los 14 y 21 días (p < 0,05), entre los 21 y 30 días (p < 0,05) y entre los 30 y 60 días (p < 0,001).
La intensidad de la alodinia mecánica dinámica se redujo significativamente también a partir de los 14 días respecto a los valores iniciales (p < 0,001). Este efecto se fue incrementando significativamente durante todas las evaluaciones hasta los 120 días respecto a los valores iniciales, sin cambio significativo respecto a las evaluaciones precedentes (p < 0,001). En cambio, la reducción significativa de la alodinia al frío se observó a partir de los 21 días con respecto a los valores iniciales (p < 0,05). El efecto se incrementó gradualmente durante el resto de las evaluaciones hasta los 120 días (p < 0,001). Esta modalidad de alodinia térmica se presentó en 100% de los pacientes. La intensidad de la alodinia somática profunda se redujo significativamente a partir de los 14 días, de manera similar a las PDMD y a la intensidad de la alodinia mecánica dinámica, respecto a los valores iniciales (p < 0,001). Este efecto se fue incrementando signifi cativamente durante todas las evaluaciones hasta los 120 días (p < 0,001), sin cambio significativo respecto a las evaluaciones precedentes (fig. 1).
Figura 1 Comportamiento de las puntuaciones diarias medias de dolor, intensidad de la alodinia mecánica dinámica, al frío y somática profunda, según escala de Likert en 15 pacientes con síndrome del dolor regional complejo que asociaron Vimang® tabletas (300 mg) y crema 1,2% en su tratamiento integral. En la figura se expresan los valores de la media ± error estándar de la media. *p < 0,05. ***p < 0,001 indican diferencias signifi cativas con respecto a los valores iniciales, sólo se representan los valores en el momento inicial de la signifi cación estadística y a los 120 días. PDMD: puntuaciones medias diarias de dolor.
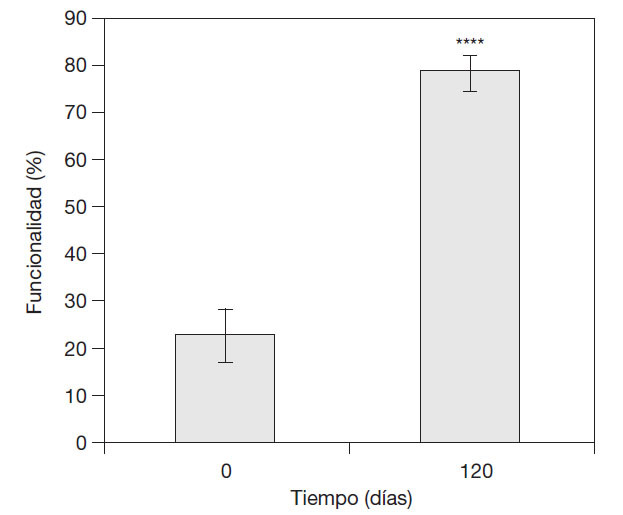
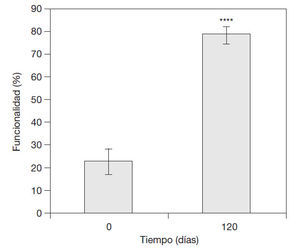
Comportamiento de la funcionalidad del miembro afectado según la escala de Enneking et al. para pacientes amputados modificada en pacientes con SDRC que asociaron formulaciones Vimang®en su tratamiento integral. A la captación de estos pacientes, la media de funcionalidad del miembro afectado en términos descriptivos y de porcentaje fue de 1,1 y 22,7%, respectivamente. Después del tratamiento a los 120 días, ésta se incrementó significativamente a 3,9 (78,7%) (p < 0,0001) (fig. 2).
Figura 2 Comportamiento de la funcionalidad en pacientes con síndrome regional complejo que asociaron Vimang® tabletas (300 mg) y crema 1,2% en su tratamiento integral, según la escala de Enneking et al. para pacientes amputados modifi cada. En la fi gura se expresan los valores de la media ± error estándar de la media. ****p < 0,0001 indica diferencias signifi cativas respecto a los valores iniciales.
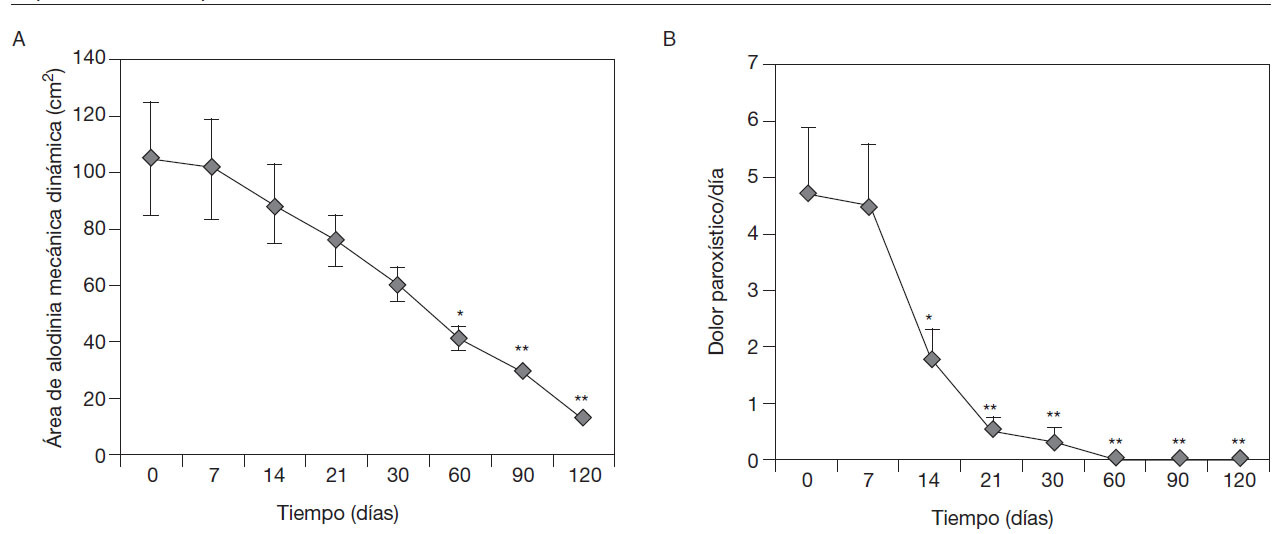
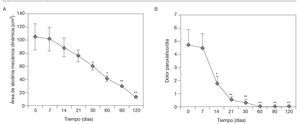
Comportamiento del área de alodinia mecánica dinámica en pacientes con SDRC que asociaron Vimang®(crema y tabletas) a su tratamiento integral. La reducción significativa del área de alodinia mecánica dinámica respecto a los valores iniciales se observó a partir de los 60 días (p < 0,01), efecto también constatado y en incremento a los 90 y a los 120 días (p < 0,001) (fig. 3A).
Figura 3 A) Comportamiento del área de alodinia mecánica dinámica. B) Comportamiento del dolor paroxístico al día en pacientes con síndrome de dolor regional complejo que asociaron Vimang® tabletas (300 mg) y crema 1,2% en su tratamiento integral. En la fi gura se expresan los valores de la media ± error estándar de la media. *p < 0,01, **p < 0,001 indican diferencias signifi cativas con respecto a los valores iniciales.
Comportamiento del dolor paroxístico al día en pacientes con SDRC que asociaron formulaciones Vimang®en su tratamiento integral. La frecuencia del dolor paroxístico al día se redujo significativamente desde los 14 días de iniciado el tratamiento, respecto a los valores iniciales y al valor de los 7 días (p < 0,01). Este efecto se intensificó mensualmente respecto a los valores iniciales (p < 0,001) (fig. 3B).
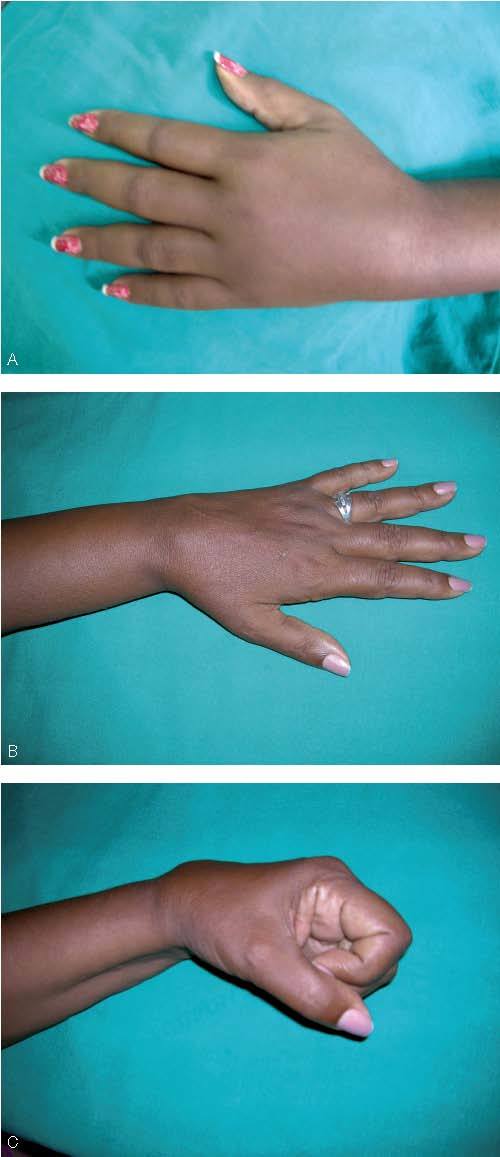
DiscusiónLos 15 pacientes redujeron sus PDMD, indicadoras del dolor global, así como la intensidad de la alodinia mecánica dinámica, al frío y somática profunda respecto a sus valores iniciales. Además, aunque no fue objeto del presente estudio, clínicamente se observó la disminución del edema y la mejoría del trofismo de la piel, la cual recupera prácticamente su textura normal (figs. 1 y 4). Sólo 4 pacientes necesitaron asociar amitriptilina a bajas dosis (18,75 a 37,5 mg/día) al Vimang® para controlar su dolor durante los primeros 15 días de iniciado el estudio y se retiró lentamente a partir de esta fecha al día 21. Los bloqueos simpáticos secuenciales, que se utilizan de forma clásica en el tratamiento del SDRC, en estos pacientes fueron reducidos a una frecuencia semanal. Estos elementos podrían sugerir el posible efecto favorecedor de las formulaciones Vimang® en su evolución clínica. La idea se sustenta en evidencias experimentales que demostraron la habilidad del ECAM para inhibir exclusivamente la fase II en la prueba de la formalina 1% (DE50 de 8,4 mg/kg), que refleja los cambios de plasticidad espinal aguda tras la inflamación inducida por el irritante32. Éste, a baja concentración (< 2%), muestra actividad predominante sobre el componente capsaicina-sensitivo-neurogénico, al cual se atribuye gran importancia en los cambios periféricos observados en el SDRC y que son dependientes de la liberación de neuropéptidos por actividad antidrómica de las fibras C40. Recientemente, se ha demostrado el papel de los receptores de aminoácidos excitatorios periféricos en la regulación del dolor inflamatorio en este modelo, ellos están presentes en los axones sensoriales y en las fibras eferentes simpáticas posganglionares y son sobrerregulados en estas condiciones40,41. Además de los neuropéptidos, las citocinas proinflamatorias están implicadas experimentalmente y en los estados dolorosos exagerados tras el traumatismo; de hecho, su incremento en estas condiciones es un mecanismo fisiológico15-17. Ellas pueden inducir hiperalgesia por mecanismos directos, como la sensibilización de los nociceptores que incrementan la transmisión nociceptiva espinal, e indirectos a través de la inducción de la expresión de otras sustancias algógenas17. El TNFα se encuentra sobreexpresado en los modelos de dolor neuropático y su receptor TNFα-R1 se ha considerado por algunos en la causa de la hiperalgesia experimental18,19. Esta citocina es la principal iniciadora de la cascada de activación de otras (IL-1, IL-2, IL-6, IL-8 e interferón gamma [IFNγ]), neuropéptidos y factores de crecimiento en la respuesta inflamatoria15. Conjuntamente con el IFNγ, el TNFα amplifica la producción de aniones superóxido por los neutrófilos y la biosíntesis de óxido nítrico (NO)16,42. En pacientes con SDRC se ha establecido la participación primordial de esta citocina en los mecanismos periféricos y centrales de la hiperalgesia en correspondencia con sus valores elevados en plasma, líquido cerebroespinal y fluido tisular del miembro afectado12-14. En torno al TNFα se demostró que el ECAM redujo sus concentraciones plasmáticas en modelos in vivo de inflamación43. Otros estudios in vitro demostraron que el extracto inhibió su producción conexamente con la de NO en líneas celulares de macrófagos RAW264.7 y de microglia (N9), además de la liberación de prostaglandina E2 y leucotrieno B4 (PGE2 y LTB4) 44,45. Del mismo modo, en macrófagos murinos después de la estimulación con LPS e IFNγ, el ECAM disminuyó los valores de NOS-2 ARNm y NOS2, y de COX-2 ARNm y COX-2 (sin efectos sobre COX-1), así como de PGE2, que posee un reconocido papel como mediador de la hiperalgesia46. No obstante, uno de los hallazgos más importantes referente a sus mecanismos antiinflamatorios fue el efecto preventivo de este producto sobre la activación del NFκB inducida por TNFα sin afectación de la expresión de su inhibidor citoplasmático, IκB33,46. Con anterioridad la bibliografía había descrito la utilización de salicilatos en el tratamiento del SDRC, y en la actualidad los esteroides están incluidos en el algoritmo terapéutico para las fases agudas con componente inflamatorio, ambos conocidos inhibidores de la activación de este factor transcripcional47.
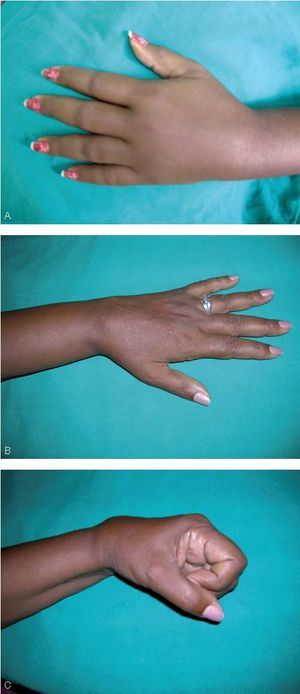
Figura 4 Paciente 9. A. Imagen dorsal de la mano al inicio del tratamiento, se observa edema severo y la paciente refi ere dolor con limitación a la flexión de las articulaciones interfalángicas y el carpo. B. Imagen dorsal de la mano al concluir el tratamiento (4 meses). C. Se observa la recuperación de la función articular de los dedos con limitación leve del carpo. Paciente peluquera de profesión, incorporada a su actividad laboral.
Por otra parte, se demostró que el TNFα induce potenciación a largo plazo de fibras C a nivel espinal mediado por la activación del NFκB34. Además, en cultivos de astrocitos se ha observado el efecto supresor de esta citocina y la IL-1β sobre la actividad de los transportadores de glutamato, hecho que sugiere que las citocinas liberadas por las glías podrían incrementar la alteración de sus concentraciones extracelulares16,17. Múltiples evidencias soportan la participación de la vía postsináptica glutamato-receptor NMDA-NO-GMPc en el proceso de hiperexcitabilidad del CDE que promueve el establecimiento de la hiperalgesia observada en el SDRC3,15,41. La activación del receptor NMDA induce la fosforilación del NFκB, el cual, además de promover la expresión de citocinas proinflamatorias, COX-2 y NOS-2, también promueve la expresión de preprodinorfina35,48. La alodinia en modelos de dolor neuropático se ha relacionado con la interacción receptor NMDA-dinorfina48. Estudios con el ECAM en un modelo in vitro de excitotoxicidad en oligodendrocitos y en neuronas (no publicados) demostraron la disminución de las concentraciones de glutamato y la prevención de la muerte neuronal excitotóxica inducida por receptores NMDA. Muchas de ellas podrían ser interneuronas inhibitorias que participan en el balance inhibición-excitación del CDE49. Estos elementos sugieren que el Vimang® podría reducir la biodisponibilidad del neurotransmisor para interactuar con sus receptores, en especial el NMDA, deprimir estas reacciones en cadena y favorecer el restablecimiento del equilibrio inhibición-excitación del CDE.
El tamaño del área de alodinia o hiperalgesia se ha usado extensivamente en modelos experimentales de dolor en humanos y animales, así como en pacientes con dolor neuropático, y se considera un parámetro que refleja el nivel de sensibilización central mantenido por los impulsos periféricos38,49. En este estudio se redujo no sólo la intensidad, sino también el área de la alodinia mecánica dinámica, como un indicador de que el ECAM puede poseer actividad sobre algunas dianas moleculares de este proceso (fig. 3A).
En el presente estudio la mayoría de los pacientes eran portadores del SDRC tipo II, y la alodinia al frío, que se presentó en 100% de ellos, mostró reducción gradual significativa a partir del día 21. Ésta se ha considerado un signo de dolor mantenido por el simpático (DMS), aunque el planteamiento se ha cuestionado y se asume como un signo sensible, pero no específico, de su participación1,5. En este sentido, se ha publicado el papel de la degeneración walleriana en la génesis del dolor neuropático a través de la invasión de macrófagos que producen citocinas y factores de crecimiento derivados de la célula de Schwann que, además, favorecen la regeneración axonal17,21. Los brotes de fibras simpáticas perivasculares hacia el GRD en condiciones de daño neural parcial podrían ser el substrato anatómico del DMS, y algunas de las citocinas que pueden actuar sobre las neuronas simpáticas e inducir sus brotes son la IL-1, IL-2, IL-6 y el TNFα49,50.
El dolor independiente del estímulo de tipo paroxístico puede ser mediado por la actividad espontánea de las fibras C o de la neurona de proyección en CDE, que se encuentra sensibilizada15,49,50. Éste comenzó a disminuir a partir de los 14 días de iniciado el tratamiento con las formulaciones Vimang® (fig. 3B). Estudios en roedores sanos demostraron que el TNFα aplicado periciático produce descargas ectópicas y mecanosensibilidad en aferentes primarias Aβ y C17-20. Esta evidencia sugiere su papel en la génesis de dichas alteraciones en las neuritis; es decir, como resultado de la inflamación epineural sola, sin daño franco axonal, como podría suceder en el SDRC tipo I20. Recientemente, se ha establecido en un modelo de fractura tibial para el SDRC tipo I la importancia de la vía de la señalización del TNFα en la sensibilización nociceptiva51. Sin embargo, esta citocina también media estas alteraciones del procesamiento nociceptivo en francas condiciones de lesión neural15,49,50. En un modelo murino de lesión del plexo braquial se demostró que las hiperalgesias mecánica y térmica eran dependientes del TNFα, pues las respuestas conductuales fueron abolidas tras la administración de anticuerpos anti-TNFα, talidomida y no se observaron en ratones knockout para el receptor TNFα p5552,53. En el presente estudio, 9 pacientes presentaban diagnóstico de SDRC tipo II y su evolución fue satisfactoria (tabla 2).
Por otra parte, en pacientes con SDRC se ha demostrado la presencia de altas concentraciones de lactato y baja oxigenación de la hemoglobina en los capilares de la piel. La atrofia de fibras musculares y la microangiopatía observada en éstas se han relacionado con el estrés oxidativo y la isquemia7,15,27. Además, la actividad de las fi bras simpáticas puede exacerbarse bajo estas condiciones, fenómeno que puede explicar su contribución al síndrome7. Uno de los modelos más utilizados para estudiar in vivo el SDRC tipo I es el modelo de dolor postisquemia crónica de la pata de la rata, precisamente porque la isquemia-reperfusión prolongada de la pata de la rata produce una cascada de episodios infl amatorios en los que las ERO son protagónicas. Además, se reproducen las condiciones clínicas del síndrome y los signos de alodinia mecánica son reducidos en este modelo mediante la utilización de secuestradores de estas especies7. La actividad neuroprotectora del ECAM se demostró en un modelo de isquemia-reperfusión en cerebro de gerbil y se evidenció la reducción del daño de capas de células de hipocampo CA130. El efecto se atribuyó a la reducción de las ERO y a la inhibición del proceso de muerte neuronal. El ECAM previene, repara y protege el daño por radicales libres29-31. Estas capacidades se relacionan, en gran medida, a la cualidad de sus componentes para unirse a metales (hierro), de forma que evita la catálisis de una especie tan lesiva como el radical hidroxilo54. La comparación de la actividad antioxidante de ECAM con otros productos antioxidantes reconocidos, como las vitaminas C y E, así como el beta-caroteno, demostró que éste era similar (inhibición de la peroxidación lipídica) o superior (protección al daño oxidativo) a dichos productos31. La respuesta favorable de estos pacientes suplementados con formulaciones Vimang® podría estar facilitada, al menos en parte, por estas cualidades del ECAM.
El efecto antihiperalgésico observado en estos pacientes permite la introducción precoz de las técnicas de rehabilitación que promueven la recuperación funcional del miembro afectado en 78,5% y la mejoría de la calidad de vida (fig. 2). La suplementación con las formulaciones de Vimang® podría ser beneficiosa por sus efectos antioxidantes y, en especial, por su actividad inhibidora de la producción de TNFα, citocina bien establecida preclínica y clínicamente en la fisiopatología de este síndrome. Es necesario desarrollar investigaciones básicas y ensayos clínicos controlados para su introducción justificada en el tratamiento del SDRC.
AgradecimientosLos autores de este trabajo agradecen a la empresa Laboratorios Farmacéuticos “Oriente”, Cuba, especialmente a la MSc. Ing. Zoe Lemus, por el suministro de las tabletas Vimang®. Este trabajo fue financiado parcialmente por el proyecto n.o 00403238 (CITMA, Cuba).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
*Autor para correspondencia. Correo electrónico: beatriz.garrido@infomed.sld.cu (B. Garrido-Suárez).
Recibido el 14 de enero de 2009; aceptado el 15 de febrero de 2009