Introducción
En el pasado, la mayoría de la profesión médica ha sido reticente a la prescripción de fármacos opioides en el tratamiento del dolor crónico no maligno1. Esta controversia ha persistido hasta bien entrada la década de los años noventa, a pesar de que se disponía de estudios que avalaban su eficacia y seguridad en cuadros de dolor de tipo osteoarticular, miofascial o neuropático2. No obstante, una reciente revisión afirma que los efectos a largo plazo beneficiosos sobre el alivio del dolor no oncológico, como son la mejora de la capacidad funcional y calidad de vida global, no están todavía demostrados, pero sí en cambio aquellos efectos deletéreos, como la adicción, la hiperalgesia, los trastornos cognitivos y la disminución de la función inmunitaria y reproductora3. En la actualidad, el número de pacientes que en la práctica diaria está recibiendo un tratamiento prolongado con opioides es grande y cada vez mayor, y ha experimentado un gran aumento en la última década. Se estima, sólo en Europa, que un 23% de pacientes con dolor crónico consume un fármaco opioide débil (tramadol, codeína) y el 5% un opioide fuerte (morfina, fentanilo, oxicodona), y se ha popularizado el uso de formulaciones orales de liberación retardada o la vía transdérmica en el dolor de origen no maligno, lo que aumenta las probabilidades de ser sometidos a alguna intervención quirúrgica durante su vida4. A esto debemos añadir el porcentaje de pacientes en tratamientos de desintoxicación, habitualmente con metadona5, y el que realiza un uso abusivo de analgésicos opioides, estimado en un 1,8% entre la población norteamericana, según datos de la National Survey on Drug Use and Health, de 2002.
Se estima que un 19-37% de la población española experimenta dolor crónico de intensidad moderada a severa y que aumenta su prevalencia en mujeres y personas ancianas. Sin embargo, en la mayoría de las ocasiones este dolor no es simplemente un síntoma de una afección subyacente, sino una enfermedad en sí misma que requiere un tratamiento específico prolongado6. Asimismo, es común la presencia de depresión, ansiedad, insomnio y astenia, que se acompañan de regímenes farmacológicos muy complejos que pueden tener interacciones con los fármacos administrados durante su estancia hospitalaria, lo que supone una dificultad añadida para conseguir un adecuado manejo de estos pacientes en el período perioperatorio7.
En este artículo, hemos revisado las publicaciones en Medline, en inglés y español, durante el período 1990-2008, con las palabras clave "anaesthesia, chronic opioid therapy, chronic pain, opioid dependency, perioperative management". Se discutirá la actitud terapéutica global desde la valoración preoperatoria hasta el alta médica de los pacientes en tratamiento crónico y, por tanto, dependientes de fármacos opioides.
Repercusiones de la terapia opioide crónica en el control del dolor postoperatorio
El paso más importante que debemos dar para conseguir un adecuado enfoque es la correcta identificación de los pacientes consumidores habituales de opioides y conseguir un resumen detallado de la causa por la que toman su medicación, vía de administración, tipo de fármaco, duración de tratamiento, dosificación, pauta de rescate, efectos secundarios, especialista médico que se lo prescribió, así como si acude a revisiones periódicas, y si lo hubiera, uso incorrecto o abusivo de éstos. Esta historia no es fácil de elaborar, ya que este tipo de pacientes tienden a subestimar su tratamiento analgésico, especialmente el de tipo opioide, y no lo suelen reflejar en las entrevistas médicas, lo que puede inducir un cuadro de deprivación en el período perioperatorio8.
Por otro lado, existen similitudes pero también diferencias que se deben tener en cuenta entre los pacientes que siguen un tratamiento crónico de manera correcta y aquellos que lo hacen de manera abusiva o compulsiva; la principal es el progresivo empeoramiento de la calidad de vida en estos últimos. Es difícil determinar la prevalencia de pacientes adictos a opioides entre los sujetos que los toman como parte de un tratamiento crónico; no obstante, Fishbain et al9 constataron que un 3-19% de los pacientes presentaba un trastorno de adicción, porcentaje que no difiriere de la prevalencia global estimada durante la vida para la población general. Asimismo, suelen coexistir enfermedades psiquiátricas, que abarcan desde ansiedad extrema y trastornos de personalidad hasta las psicosis habituales en consumidores de heroína y coexisten adicciones cruzadas con otras sustancias, como nicotina, alcohol, cocaína, marihuana o benzodiacepinas, detectadas en el 70% de adictos a opioides en EE. UU. Este uso ilícito conlleva a una predisposición del personal sanitario a reducir la prescripción de opioides (opiofobia), lo que hace a este tipo de pacientes especialmente vulnerables a no conseguir un adecuado control del dolor postoperatorio10.
Existen múltiples variables que pueden influir en un peor control del dolor y en un aumento de los requerimientos analgésicos postoperatorios. Entre ellas se incluyen factores demográficos, como el sexo femenino y la edad joven; psicológicos, como la ansiedad y la depresión; la presencia de dolor previo a la intervención; la cirugía compleja y de repetición, y las grandes incisiones11, así como la anestesia general, las dosis altas de opioides intraoperatorios y el consumo preoperatorio de analgésicos12. Con respecto a esto último, De León-Casasola et al13 comprobaron, en 116 pacientes con dolor oncológico, que aquellos que consumían opioides (dosis diaria 90-360 mg de morfina oral) necesitaban 3 veces más morfina epidural o 4 veces más morfina en bolos por vía intravenosa (iv) para el tratamiento del dolor irruptivo postoperatorio, que los no habituados a opioides, y se multiplicaba por 3 el tiempo necesario del catéter epidural (9 frente a 3 días). Asimismo, Rapp et al14 realizaron un estudio retrospectivo sobre 360 pacientes, con dolor crónico tanto benigno como maligno, en que constataron un requerimiento de opioides postoperatorios 3 veces mayor en el grupo de consumidores habituales. Weinrieb et al15 estudiaron retrospectivamente los requerimientos opioides en 56 pacientes sometidos a transplante hepático y encontraron un mayor consumo tanto intraoperatorio (↑ fentanilo × 2,5) como postoperatorio (morfina 67 mg frente a 12 mg/día-1) en el grupo en tratamiento crónico con metadona. Walid et al16, en un estudio prospectivo, constataron una prevalencia de pacientes dependientes de opioides del 20% entre aquellos que se sometían a cirugía correctora de raquis (60 fijaciones cervicales, 48 discectomías lumbares y 42 fijaciones lumbares), que presentaron una mayor intensidad del dolor postoperatorio y del consumo analgésico. Estos estudios coinciden con las revisiones de los expertos en dolor en afirmar que los pacientes en tratamiento crónico con opioides presentan un fenómeno de tolerancia que conlleva un aumento del consumo de analgésicos en el período postoperatorio8,17,18.
Consecuencias de la dependencia, tolerancia e hiperalgesia opioide
Dependencia opioide
El término dependencia física opioide describe las alteraciones en la respuesta fisiológica resultantes de la adaptación de la unión opioide-receptor debido al consumo crónico, caracterizado por la presencia de abstinencia tras su abandono y que se revierte parcial o totalmente tras reiniciar su administración. Esto implica la necesidad de no suspender el fármaco bruscamente en el período preoperatorio para no desencadenar un síndrome de deprivación opioide, caracterizado por el inicio de una constelación de signos y síntomas debidos a la hiperactividad tanto del sistema simpático como parasimpático, mediados por el plexo mientérico y los núcleos vagal e hipotalámicos cerebrales, consistente en hipertensión, taquicardia, diaforesis, diarrea, temblores, mioclonías y trastornos del comportamiento, como sacudidas de las piernas y movimientos de giro del cuerpo, generalmente muy desagradable pero no mortal. El inicio de los síntomas es variable, depende del tipo de opioide y oscila entre 2-6 h para meperidina o fentanilo y entre 6-18 h para morfina o heroína, con una duración de entre 5-10 días; la metadona es el fármaco cuyo pico de intensidad es más tardío: puede aparecer 3-21 días tras la suspensión, con una duración de la sintomatología de 6-7 semanas18.
Es importante diferenciar este término de la adicción, que describe un desorden neurobiológico crónico que conlleva un uso aberrante del opioide y un comportamiento social inadaptado que implica una pérdida de autocontrol que conduce a un uso compulsivo y muchas veces autodestructivo8.
Tolerancia opioide
La tolerancia opioide se produce debido a un mecanismo de adaptación farmacológica predecible, cuya principal consecuencia implica un aumento de la dosis requerida para conseguir el mismo efecto analgésico. Este efecto se desarrolla en relación con la analgesia, la euforia, la sedación, las náuseas y la depresión respiratoria, pero no para la miosis o el estreñimiento, y conlleva un desplazamiento hacia la derecha de la curva dosis-respuesta del tratamiento opioide debido a una pérdida progresiva de actividad sobre su receptor específico por una exposición prolongada al agonista. La implicación clínica directa ante una pérdida de potencia analgésica que conlleve la necesidad de realizar una escalada en el curso de un tratamiento opioide consiste en realizar un buen diagnóstico diferencial, ya que es importante descartar siempre una progresión de la enfermedad de base. Asimismo, deberemos esperar un mayor consumo analgésico opioide perioperatorio8.
El grado de tolerancia está generalmente en concordancia con el tipo y el uso del opioide, y es mayor si lo son el tiempo de exposición y la dosis diaria requerida, y está en relación con la cinética asociación/disociación del fármaco sobre su receptor ya que se ha observado que los pacientes tratados con sufentanilo, un agonista con una actividad intrínseca alta por el receptor opioide y que, por tanto, requiere una ocupación menor para conseguir el efecto analgésico, la presenta más tardíamente que aquellos con una actividad intrínseca baja sobre los receptores específicos y que necesitan una mayor ocupación de éstos, como la morfina; en este caso puede iniciarse tras 1-2 semanas de iniciado el tratamiento19,20. A pesar de que no existe una guía de graduación específica, si el aumento de los requerimientos de morfina equivale a 1 mg/h-1 iv o 3 mg/h-1oral por un período mínimo de 1 mes, la tolerancia es definida como de alto grado, aunque en el período inicial de tratamiento este efecto también puede atribuirse al necesario ajuste de la dosis efectiva18.
Además puede aparecer una resistencia a conseguir un adecuado efecto analgésico con otro fármaco opioide en los pacientes habituados a fármacos del mismo grupo, denominada tolerancia cruzada, como ocurre al administrar morfina21 o remifentanilo22 en pacientes habituados a metadona, así como entre las diferentes vías de administración, como la sistémica y epidural, aunque este último punto es motivo de controversia17.
Hiperalgesia opioide
La hiperalgesia se podría definir como una desviación hacia la izquierda de la curva que relaciona la intensidad del estímulo con el grado de dolor observado, de tal manera que uno habitualmente doloroso se percibe como un dolor de mayor intensidad y asimismo otro estímulo no doloroso se percibe molesto (alodinia). La aparición de este fenómeno tras un proceso quirúrgico puede deberse tanto a una sensibilización del sistema nervioso por la lesión tisular y nerviosa (hiperalgesia nociceptiva), como al efecto de fármacos utilizados durante la anestesia o a tratamientos crónicos (hiperalgesia farmacológica), y están involucrados principalmente los opioides. Ambos efectos pueden compartir mecanismos fisiopatológicos y son potencialmente indeseables23. La importancia clínica de la hiperalgesia postoperatoria radica, por una parte, en el aumento de la intensidad del dolor, del consumo de analgésicos, de la morbilidad y del discomfort en el período postoperatorio, así como en la mayor presencia de dolor crónico, e incluso se ha sugerido una mayor probabilidad de desarrollar un síndrome de dolor regional complejo24.
Las evidencias clínicas disponibles en la actualidad, en estudios en animales o en humanos, sugieren que los opioides, incluso con una exposición al fármaco de corta duración, tienen la capacidad tanto de aumentar como de disminuir el umbral de sensibilidad frente al estímulo doloroso, de tal manera que su efecto global será determinado por la interacción de los dos sistemas, anti y pronociceptivo, según la denominada "teoría de los procesos opuestos"25. Basados en la observación de que los opioides pueden modular y activar los sistemas inhibitorios y facilitadores de las vías del dolor, los fenómenos de hiperalgesia y tolerancia opioide podrían atribuirse al predominio de los mecanismos pronociceptivos. Entre éstos se encuentran una disociación aguda de la unión opioide-receptor de la proteína-G, que conduce a una desensibilización e internalización de los receptores mediado por fosforilación de la proteincinasa C; una regulación al alza de la vía mediada por la adenil-ciclasa (↑ cAMP), que provoca un aumento de neurotransmisores excitadores presinápticos medulares, la facilitación de las vías descendentes en las neuronas del asta posterior medular tras una exposición prolongada con agonista-μ y la liberación de péptidos con propiedades antagonistas opioides como la colecistocinina, el neuropéptido FF o la nociceptina (orfanina FQ)26.
Entre las opciones terapéuticas para disminuir la hiperalgesia opioide en el período postoperatorio se ha comprobado la efectividad de la ketamina, principalmente por su mecanismo de acción antagonista N-metil-D-aspartato (NMDA), tras el uso intraoperatorio de fentanilo27, remifentanilo28 o morfina29. Asimismo, se ha recomendado la utilización del α-2 agonista clonidina, inhibidores de la ciclooxigenasa y la rotación de opioides, ya que en comparación con los agonistas κ, los agonistas μ exhiben una mayor actividad pronociceptiva26.
Manejo perioperatorio
Existen muy pocos estudios científicos rigurosos que aproximen de manera práctica el manejo del paciente consumidor habitual de opioides en el período perioperatorio, limitándose a artículos con casos clínicos, estudios retrospectivos o revisiones que reflejan principalmente la experiencia previa de los autores.
Período preoperatorio
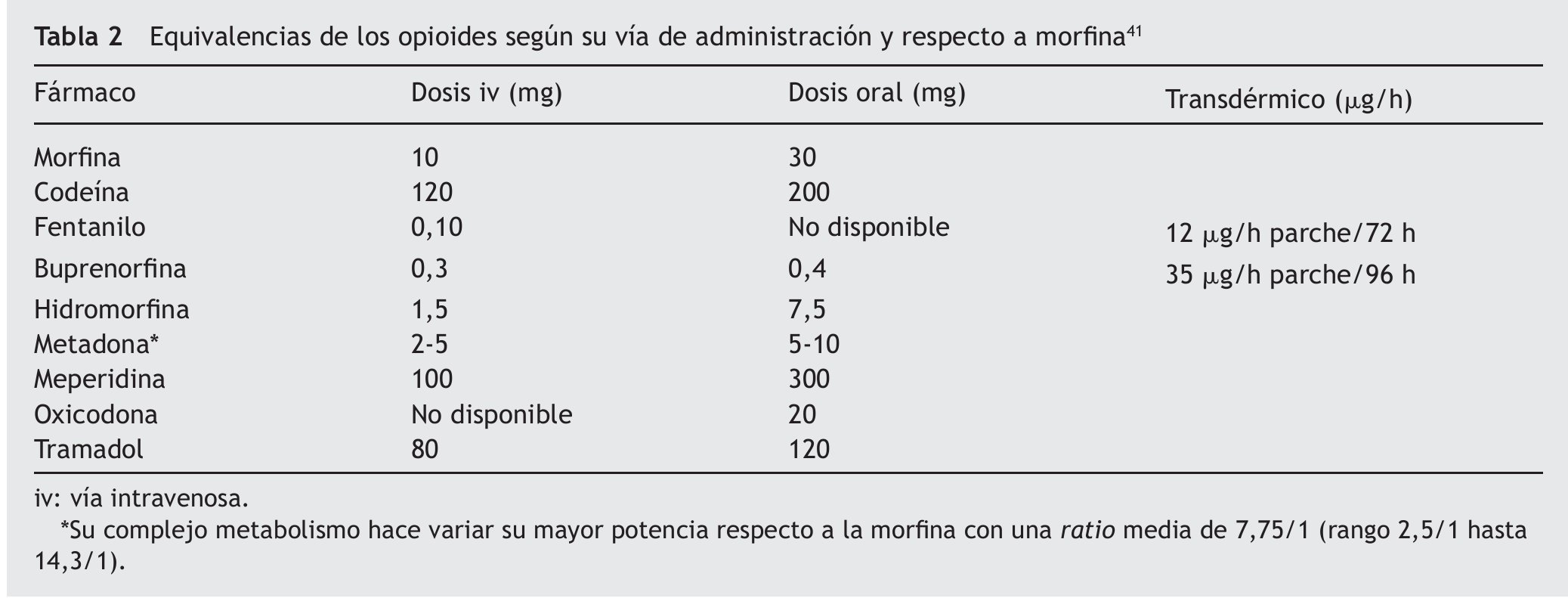
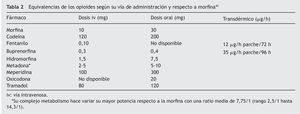
El adecuado manejo perioperatorio debe comenzar con el diseño de un plan analgésico global desde la consulta preanestésica, con el fin de disminuir la ansiedad y aumentar la confianza de estos pacientes, transmitiéndoles que su terapia crónica opioide no será un impedimento para la obtención de un adecuado confort analgésico (tabla 1). La primera recomendación es la administración de su medicación habitual la misma mañana de la intervención quirúrgica, se vaya a someter tanto a una anestesia local como regional o general. Debe ser instruido de cómo ingerir su opioide por vía oral con un poco de agua (morfina, oxicodona, metadona), así como mantener la colocación del parche transdérmico (fentanilo, buprenorfina), durante todo el proceso quirúrgico30. Estos sistemas de liberación prolongada mantendrán al menos durante 12 h el efecto analgésico durante el intraoperatorio en las pautas orales y durante 72 h en la forma transdérmica (13 a 25 h como vida media terminal de fentanilo una vez retirado el parche); en caso de no ser posible su mantenimiento, deberán sustituirse por una dosis equivalente iv (tabla 2). Incluso es útil aplicar un nuevo parche antes de la cirugía, aunque no conseguiremos niveles terapéuticos hasta pasadas 6-12 h (rango 1,2-40 h para fentanilo), por lo que a veces es necesario mantener una infusión basal iv de opioide iniciada desde el mismo período preanestésico y convertirla después en forma de administración en analgesia controlada por el paciente (ACP)18.
Todos los sistemas implantados de infusión continua de opioides epidurales o intratecales se mantendrán durante el período perioperatorio; la excepción a esta regla es la administración intratecal del relajante muscular antiespasmódico baclofeno, y es prudente su reducción o suspensión debido a la potenciación del bloqueo neuromuscular y sus efectos centrales, como hipotensión y sedación excesiva31.
En los pacientes consumidores de heroína, se deberá administrar una dosis basal equianalgésica de morfina o metadona oral o iv, y a veces es necesario canalizar una vía central por la imposibilidad de hacerlo en una periférica. En los tratados habitualmente con el agonista parcial buprenorfina, también se mantendrá su dosis habitual por vía transdérmica o se administrará su dosis diaria total, por vía sublingual, dividida en tomas cada 6-8 h. Si se interrumpe su tratamiento, es necesario complementar una dosis equivalente de morfina o metadona oral preoperatoria, vigilando la posibilidad de depresión respiratoria, debido a la gran afinidad y la lenta disociación del receptor μ de este opioide. También es posible la aparición de un síndrome de abstinencia tras reanudar el tratamiento con buprenorfina al suspender los agonistas opioides puros en el período postoperatorio32.
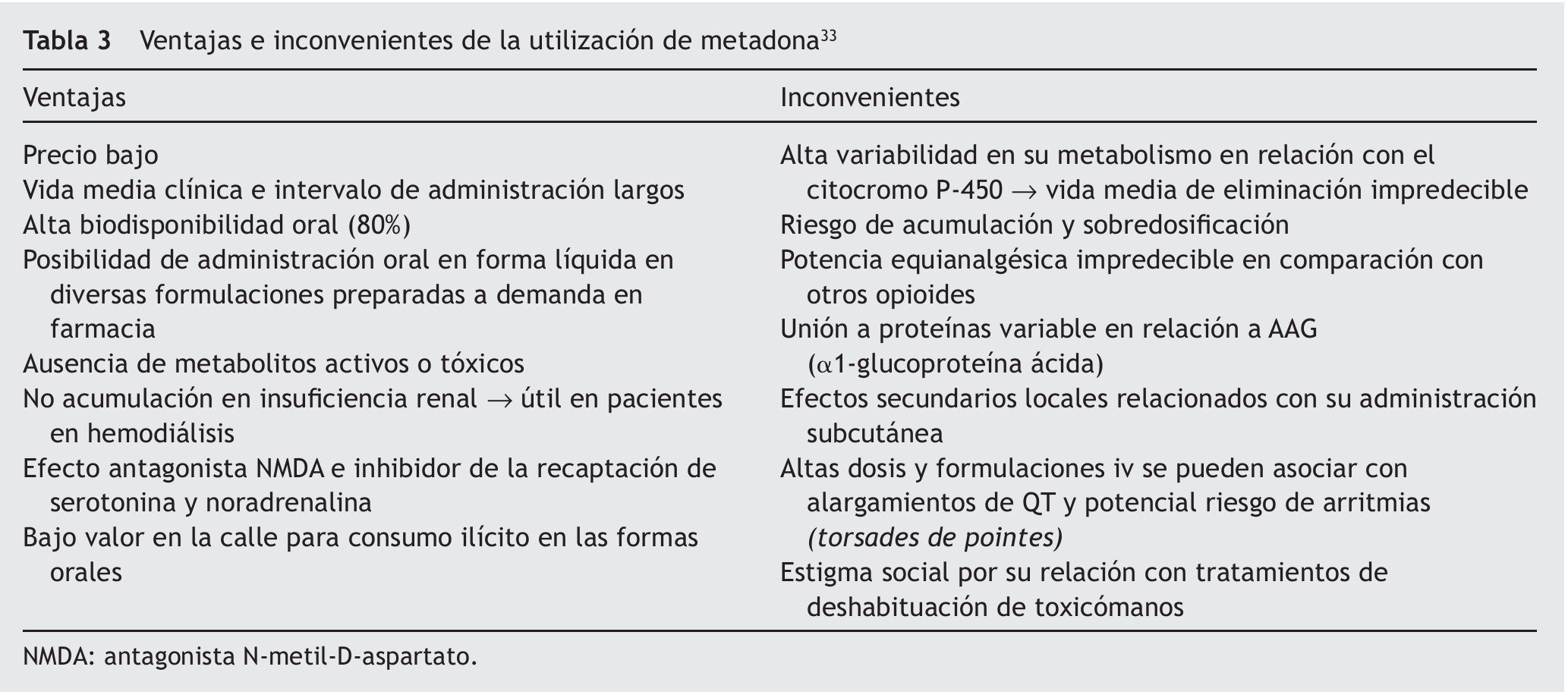
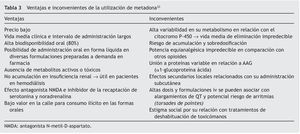
En los casos de tratamientos de deshabituación con metadona, se mantendrá también la toma matinal preoperatoria y es conveniente reseñar su farmacocinética compleja, ya que presenta una gran variabilidad individual debida especialmente a su metabolismo por el citocromo P-450 y a su eliminación bifásica. La fase inicial α es de 8-12 h de duración, que se corresponde con el efecto analgésico, y la fase tardía β es de 30-60 h, durante la cual es posible su acumulación. Los riesgos y los beneficios de la metadona se resumen en la tabla 333.
Los tratamientos con antagonistas opioides como naloxona deben evitarse y si el paciente toma habitualmente naltrexona, un antagonista opioide oral de vida media larga, se deberá suspender por lo menos 24 h antes de la cirugía, que sensibilizará el receptor μ frente a los fármacos opioides, por lo que deben manejarse con cuidado en estos pacientes para evitar una sedación excesiva34.
Asimismo, en este tipo de pacientes se recomienda la administración de fármacos analgésicos no opioides, como son el paracetamol (4 g/día) y los antiinflamatorios (antiinflamatorios no esteroideos [AINE] no selectivos o preferiblemente selectivos de ciclooxigenasa 2, como el celecoxib, debido a su nula acción antiagregante plaquetaria) desde el día de la intervención, y fármacos neuromoduladores, como la gabapentina o la pregabalina35, para disminuir el consumo de opioides en el postoperatorio. Esta práctica se extrapola de estudios en pacientes no dependientes de opioides, como un metaanálisis donde se ha demostrado correlación directa entre el uso de AINE perioperatorios y un menor consumo de morfina, junto con una menor incidencia de sedación, náuseas y vómitos, pero no así de prurito, retención urinaria ni depresión respiratoria36. De igual manera, en una revisión reciente, se ha observado que una dosis única de 600 mg de gabapentina preoperatoria disminuye la intensidad del dolor y el consumo de opioides en las primeras 24 h. También se han probado dosis diarias entre 300-1.800 mg durante períodos variables de 1-10 días postoperatorios, por lo que todavía está por determinar la pauta de dosificación correcta, ya que su uso está limitado por la necesidad de la vía oral y de sus efectos adversos, como somnolencia, vértigos o mareos. La pregabalina se ha utilizado con la misma finalidad en dosis que oscilan entre 150 y 600 mg/día37.
Finalmente, existen dos temas en controversia: el riesgo de aspiración de contenido gástrico y el de arritmias cardíacas. El retraso en el vaciado gástrico puede ser causado por la disminución de la motilidad y el tono estomacal, así como por el aumento del tono del esfínter pilórico; en él están implicados o mecanismos de acción tanto central como periférica. Aunque no existen estudios concluyentes al respecto, sería prudente considerar a los pacientes consumidores crónicos de opioides de alto riesgo de aspiración pulmonar en la inducción anestésica38. Se ha postulado que los pacientes en tratamiento con metadona presentan un riesgo mayor de arritmias ventriculares y de torsade de pointes debido a la prolongación en el electrocardiograma del intervalo QT (alto riesgo > 500 ms), especialmente en varones y en el período inicial de tratamiento (< 1 año). En estudios retrospectivos, los pacientes con arritmias presentaban además otros factores de riesgo añadidos, como anomalías cardíacas estructurales y electrolíticas, como hipocaliemia e hipomagnesemia, fármacos potenciadotes del alargamiento del QT, como pregabalina o inhibidores del metabolismo de la metadona como nelfinabir; los factores determinantes son dosis orales diarias de metadona > 200 mg o la administración iv del fármaco39,40.
Período intraoperatorio
El manejo intraoperatorio del paciente consumidor crónico y, por tanto, tolerante a los opioides está habitualmente determinado por el tipo de fármaco, la dosis diaria requerida, la interacción con el resto de las medicaciones, la naturaleza y el estadio de la enfermedad de base y, por supuesto, en el tipo de cirugía propuesto. Sin embargo, a pesar de que no existe una técnica anestésica ideal, es necesario mantener una dosis basal de opioide (oral, transdérmica, iv) y esperar un aumento de los requerimientos analgésicos41. También es muy útil la realización de anestesia regional, tanto neuroaxial (epidural, intratecal) como periférica (plexos nerviosos), o la infiltación de la herida quirúrgica mantenida de manera continua en el período postoperatorio8. En caso de realizar una anestesia general, se recomienda una técnica anestésica balanceada utilizando fármacos neuromoduladores, como ketamina (0,25 mg/kg-1) y el óxido nitroso, ambos con acción anti-NMDA, analgésicos no opioides y una infusión continua de opioides como fentanilo en su dosis efectiva mínima, ya que se ha comprobado en pacientes no dependientes de opioides que las perfusiones intraoperatorias en dosis altas de remifentanilo o fentanilo pueden producir un fenómeno de rápida tolerancia e hiperalgesia postoperatoria, junto con un aumento del consumo de analgésicos postoperatorios42.
Existen diversos factores que pueden alterar las concentraciones plasmáticas obtenidas de un parche transdérmico de fentanilo, como la temperatura corporal, el tipo de anestesia y sobre todo el calentamiento directo o indirecto del sistema de administración. Los cambios de temperatura alteran la perfusión y la permeabilidad capilar cutánea, la liberación del fármaco y el aclaramiento corporal total de fentanilo. Se ha comprobado que la hipotermia disminuye las concentraciones plasmáticas y en voluntarios sanos se ha estudiado el efecto de una corriente de calor hasta una temperatura cutánea de 41 ºC aplicada sobre un parche de 25 μg/h-1 durante 240 min, y se advirtió una concentración de fentanilo plasmática 4 veces mayor (0,39 ng/ml-1 frente a 0,11 ng/ml-1) en el grupo de calentamiento del parche43. Por ello, en la cirugía mayor en que se prevea una gran alteración de la temperatura corporal o grandes aportes de fluidoterapia se recomienda sustituir el parche por una dosis de opioide equivalente iv. La elección del agente halogenado para el mantenimiento de la anestesia también puede influir debido a la vasodilatación cutánea producida, así como la alteración sobre el flujo sanguíneo hepático arterial y sinusoidal. En un estudio experimental se comprobó que el isofluorano en condiciones de normo e hipotermia (35 ºC) producía unas concentraciones plasmáticas menores de fentanilo que el halotano, debido a una mayor reducción en el flujo sanguíneo cutáneo y, por tanto, una menor extracción del opioide de su reservorio subcutáneo44.
Swenson et al45 han presentado un sistema empírico para hacer cuantificable los requerimientos individuales intra y postoperatorios de opioides. En su estudio sobre 20 pacientes en tratamiento crónico con opioides, administraron una perfusión continua preoperatoria de fentanilo iv a 2 μg/ kg-1/min-1 y midieron la dosis total acumulada hasta la aparición de depresión respiratoria, definida como una frecuencia respiratoria < 5 resp/min. Utilizando un programa farmacocinético calcularon la concentración de fentanilo en el compartimento efecto en el momento de iniciarse la depresión respiratoria. Basándose en la teoría de que la concentración plasmática efectiva mínima analgésica de fentanilo es aproximadamente un 25-30% de la necesaria para producir depresión respiratoria en el mismo paciente, se programó un sistema de ACP-iv de fentanilo personalizado para cada individuo para alcanzar un 30% de la concentración previamente estimada. Únicamente fue necesario modificarla en un 16% de los pacientes durante el período postoperatorio. Este procedimiento tiene sus limitaciones y está resumido en la tabla 4.
Otra técnica que puede ayudarnos consiste en revertir el bloqueo neuromuscular para permitir respirar espontáneamente al paciente cuando finalice la anestesia general y vigilar la frecuencia respiratoria, de tal manera que aquellas por encima de 20 resp/min-1 y con pupilas medias o dilatadas necesitarán un aporte extra de opioides iv (morfina, fentanilo) hasta conseguir una frecuencia respiratoria óptima de 12-14 resp/min-1 [38].
Período postoperatorio
Debemos recordar que el hecho de administrar opioides en un paciente habituado a su consumo no está exento de riesgos de sobredosificación y sedación, como ha demostrado alguna revisión10, por lo que es indispensable una correcta monitorización, así como una valoración periódica, para obtener una adecuada pauta analgésica. No existe ningún sustitutivo de una estricta vigilancia clínica que incluya las frecuencias respiratoria y cardíaca, la saturación de O2, el grado de dilatación pupilar y de sedación e indispensablemente una escala de valoración del dolor.
Como en el resto de la población general, la recomendación en este subgrupo de pacientes, al carecer de estudios específicos, requiere un abordaje multimodal8 del manejo del dolor postoperatorio, que debe incluir una técnica regional continua, en sus múltiples variantes (periincisional, bloqueo nervioso periférico o central) para desaferenciar la zona quirúrgica siempre que sea posible, junto con la asociación de antiinflamatorios de acción periférica, analgésicos no opioides de acción central y una titulación adecuada de fármacos opioides, según el grado de evidencia clínica referida a cada proceso46. En relación con esto último, un reciente metaanálisis ha demostrado la ventaja de la analgesia perineural periférica continua frente a los opioides parenterales en términos de una mejor analgesia postoperatoria, con menores efectos secundarios47, y los resultados de otro metaanálisis indicaron que la analgesia epidural continua o en forma de analgesia epidural controlada por el paciente consiguió una mejoría en la calidad analgésica postoperatoria frente a la administración sistémica de opioides en forma de ACP-iv48.
La administración neuroaxial de opioides produce una analgesia de mayor calidad, con menores efectos adversos que su administración sistémica, aunque debe de ser titulada de forma exquisita, especialmente cuando se combina con opioides por vía parenteral. La práctica habitual consiste en pautar una dosis baja de opioide junto a un anestésico local, y es de especial interés para mejorar la eficacia del tratamiento, ya que la actividad del fármaco anestésico no se afecta en el paciente con tolerancia opioide8. La morfina es el fármaco más utilizado porque probablemente es el opioide con mayor acción selectiva medular tras su administración epidural (5-10 mg/día-1) o intradural (100-500 μg/día-1), ya que la capacidad de unión a los receptores espinales parece ser inversamente proporcional a la liposolubilidad, y por tanto, es mayor que para fentanilo o sufentanilo49.
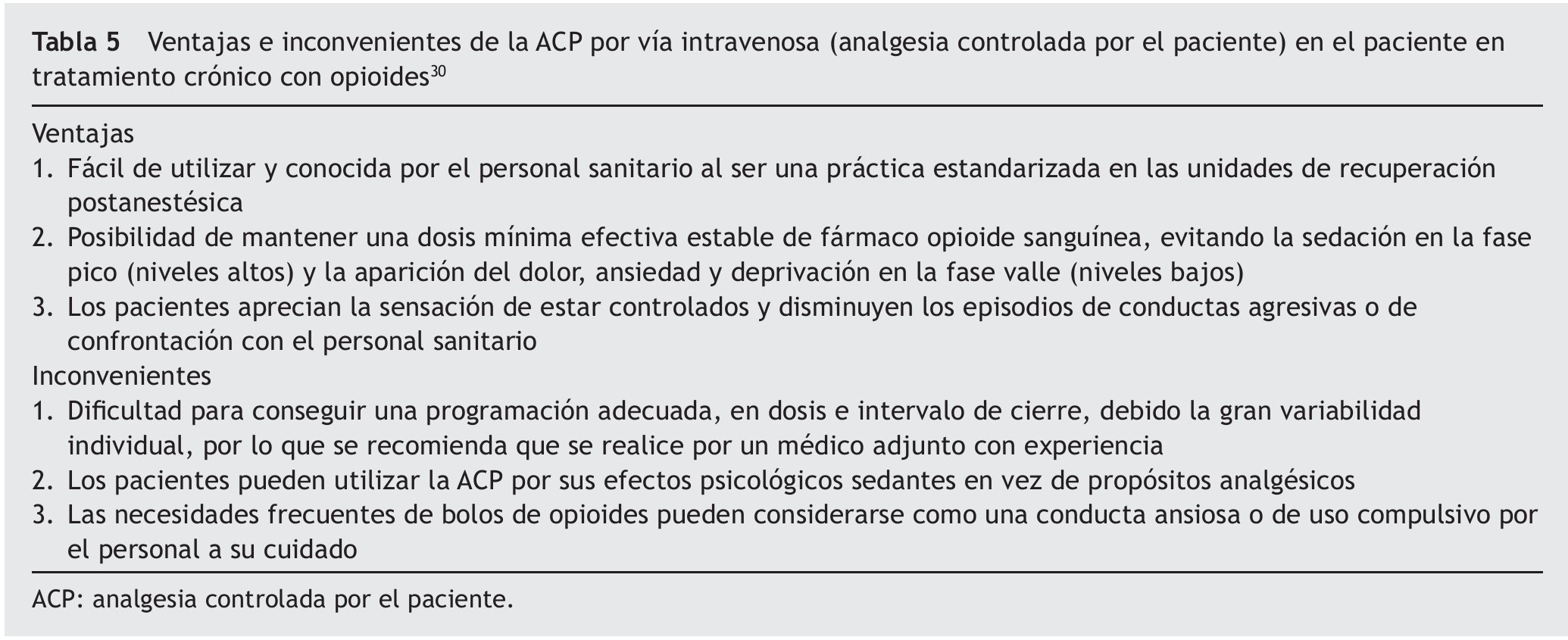
En los casos en que no es posible realizar una anestesia regional, o ésta no consiga un alivio suficiente del dolor, la posibilidad de administrar opioides iv en forma de ACP es de gran utilidad y su uso está ampliamente extendido, a pesar de las reticencias del pasado50 a utilizarla en pacientes habituados al tratamiento opioide consiguiendo una analgesia adecuada y permitiendo un ajuste personalizado8. De forma habitual es necesario programar una perfusión basal (morfina 0,5-2 mg/h-1), similar a la dosis horaria de consumo habitual, salvo que el paciente mantenga su medicación en forma transdérmica o en sistemas implantados espinales, junto con un número necesario de bolos extra de 1-2 mg de morfina con un cierre de 10 min para control del dolor irruptivo51. En caso de optar por la opción de ACP-iv sólo con bolos, es previsible la necesidad de realizar reajustes periódicos con dosis más altas e intervalos más cortos30. Las ventajas y los inconvenientes de este sistema se resumen en la tabla 5.
Los pacientes en que no es posible conseguir un adecuado control del dolor a pesar de todas las recomendaciones anteriores, y de la administración de altas dosis de opioides, son susceptibles de tratamiento, denominado rotación de opioides, con otro tipo de fármacos (metadona, oxicodona, fentanilo) con la finalidad de actuar sobre otros subtipos del receptor μ, para evitar la tolerancia desarrollada frente a morfina45.
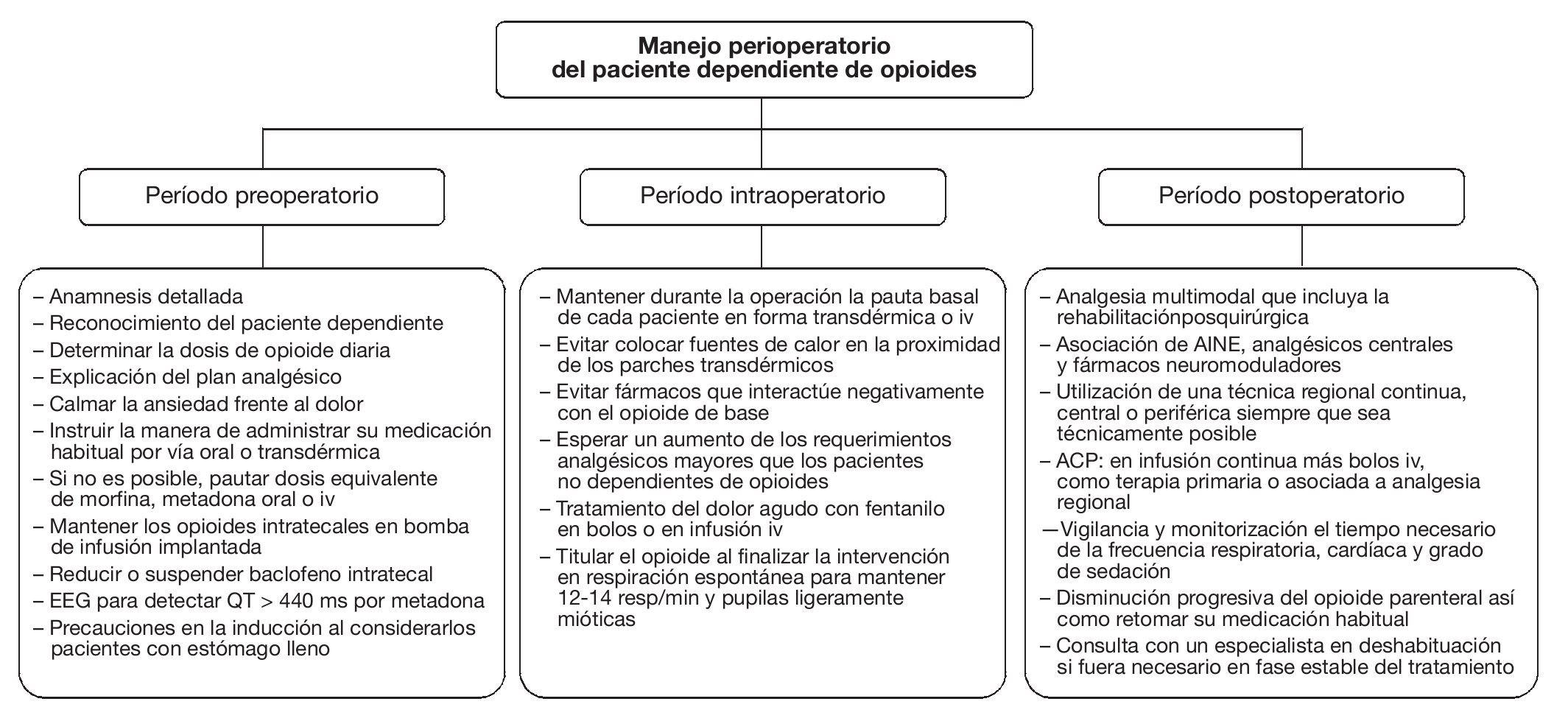
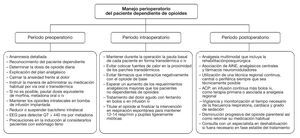
Finalmente, si el proceso quirúrgico consigue un alivio parcial o total del dolor, se recomienda una pauta descendente de medicación, en coordinación con la unidad de dolor, y se propondrá tras el alta una consulta a un especialista en deshabituación de opioides, si fuera necesario. El proceso global perioperatorio se resume en la figura 1.
Figura 1 Actitud global durante el período perioperatorio. ACP: analgesia controlada por el paciente; AINE: antiinflamatorio no esteroideo; iv: intravenoso.
Conclusiones
El control adecuado del dolor agudo postoperatorio se puede considerar como uno de los derechos fundamentales de los pacientes. Aquellos en tratamiento habitual con opioides están predispuestos a presentarlo con una mayor intensidad debido a la complejidad de su manejo global en el período perioperatorio y al estigma sanitario que en ocasiones conlleva su tratamiento. Deberemos utilizar un abordaje multimodal del tratamiento del dolor que implique la asociación de antiinflamatorios, analgésicos opioides y no opioides, junto con la utilización de técnicas regionales continuas. La elección del tipo de combinación farmacológica, la dosis adecuada y la duración del tratamiento deberán evaluarse de manera individual para optimizar su eficacia y minimizar los efectos adversos8.
Los anestesiólogos de las unidades de dolor debemos ser la piedra angular sobre la que se base el abordaje multidisciplinar y los encargados de instruir al resto del personal sanitario para que se cumpla la pauta analgésica prevista, así como el protocolo de vigilancia necesario para el correcto manejo de estos pacientes que siempre suponen un reto en nuestra práctica clínica asistencial.
Conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico:mugabure@yahoo.es (B. Mugabure Bujedo).
Recibido el 21 de mayo de 2009;
aceptado el 1 de junio de 2009