Revisar qué efectos fisiológicos tiene la aplicación de la técnica de estimulación nerviosa eléctrica transcutánea (TENS) sobre los pacientes, de modo que pueda servir de orientación para su correcta aplicación en la práctica clínica. La técnica TENS consiste en la aplicación de corriente eléctrica pulsada, tradicionalmente empleada con finalidad analgésica. A la hora de su utilización, los diferentes parámetros de programación del TENS deben ajustarse teniendo en cuenta que las diferentes posibilidades de programación van a activar diferentes mecanismos fisiológicos. En los últimos tiempos, se han venido realizando importantes estudios con animales y en sujetos sanos, con el fin de dilucidar qué efectos fisiológicos son los que se producen en el organismo al aplicarse TENS.
Material y métodosSe llevó a cabo una revisión exhaustiva de la literatura científica publicada sobre la utilización de la técnica TENS y sus efectos fisiológicos. Los estudios relevantes fueron identificados a través de una búsqueda en las diversas bases de datos, así como de libros de referencia en la materia, procedentes de la Biblioteca de la Universidad CEU-Cardenal Herrera de Valencia.
ResultadosSe localizaron 97 referencias que cumplieron con los criterios de inclusión.
ConclusionesEl TENS produce su efecto analgésico por la activación de las aferencias de los tejidos profundos por estimulación de las fibras aferentes primarias de gran diámetro Aβ. Los mecanismos de acción fisiológicos del TENS de alta y baja frecuencia son distintos, aunque ambos se producen a nivel periférico, espinal y supraespinal, y se basan primordialmente en la activación de distintos receptores opioides. Con la combinación de parámetros adecuada, el TENS reduce el dolor desde el primer minuto de aplicación. Respecto a la duración del efecto analgésico tras una sesión de tratamiento, se ha demostrado la importancia de emplear intensidades elevadas para conseguir una mayor duración del efecto postsesión. La aplicación repetida diariamente de TENS con los mismos parámetros produce el desarrollo de tolerancia. Aunque se ha especulado respecto a un efecto vascular de la aplicación de TENS, éste sólo tiene efecto sobre la circulación periférica aplicado a una intensidad suficiente para conseguir contracciones musculares importantes; en todo caso, el efecto es local sobre la zona de aplicación. La aplicación de TENS puede influir positivamente en la actividad muscular de pacientes con déficits motores en accidentes cerebrovasculares y otros desórdenes neurológicos.
To analyze the physiological effects of the application of the transcutaneous electrical nerve stimulation (TENS) technique on patients, to provide guidance for successful implementation in clinical practice. TENS technique involves the application of a pulsed electric current, traditionally used for pain control. Different TENS programming parameters should be adjusted, taking into account that the different programming options will activate various physiological mechanisms. Extensive studies in animals and in healthy subjects have been conducted recently, in order to elucidate the physiological effects produced in the body when TENS is applied.
Material and methodsWe conducted a comprehensive review of published scientific literature on the use of the TENS technique and its physiological effects. Relevant trials were identified through a search of various databases and reference books on the subject, from the Library of the CEU-Cardenal Herrera University of Valencia.
ResultsWe found 97 references that met the inclusion criteria.
ConclusionsTENS produces its analgesic effect by activation of afferents of deep tissues by stimulation of primary Aβ large diameter afferent fibers. The physiological mechanisms of action of TENS at low and high frequency are different, although both occur at peripheral, spinal and supraspinal level, and are based primarily on the activation of different opioid receptors. With the proper combination of parameters, TENS reduces pain from the first minute of application. Regarding the duration of analgesic effect after a treatment session, it is known the importance of using higher intensities for greater duration of post-session effect. The daily repeated application of TENS with the same parameters will lead to the development of tolerance. Although there has been speculation about a vascular effect of the application of TENS, it only has an effect on peripheral circulation when applied at intensity sufficient to achieve significant muscle contractions; in any case the effect is reduced in the area of application. The application of TENS can positively influence muscle activity in patients with motor deficits in stroke and other neurological disorders.
El acrónimo TENS, del inglés transcutaneous electrical nerve stimulation, se utiliza en la actualidad para denominar a la aplicación mediante electrodos de superficie de corriente eléctrica pulsada con finalidad analgésica1. Así, técnicamente cualquier equipo que emita corriente eléctrica a través de la piel, mediante un par o múltiples pares de electrodos de superficie, puede recibir la denominación de TENS2. Por consenso, sin embargo, el término TENS se usa cuando el principal objetivo terapéutico es la analgesia, habiéndose utilizado tanto para el tratamiento del dolor crónico3,4 como del dolor agudo5–8, incluso del dolor procedente de órganos viscerales9–11. Actualmente, se puede afirmar que junto con las interferenciales, el TENS es la técnica de estimulación eléctrica más empleada como alternativa a los tratamientos analgésicos tradicionales, tales como los farmacológicos o quirúrgicos12.
Desde los años setenta se han venido desarrollando numerosos estudios clínicos respecto al TENS, encontrándose efectos analgésicos positivos en algunos13–15 y en otros no14,16,17. Las revisiones y metaanálisis más recientes han venido a señalar que la falta de resultados concluyentes puede deberse a los problemas para diseñar ensayos clínicos aleatorizados del TENS y/o a la dificultad de definir los parámetros precisos de programación18 (frecuencia, duración del impulso, intensidad o lugar de aplicación) que van a producir efectos fisiológicos distintos5,19.
La evidencia proveniente de estudios sobre estimulación axonal in vitro sugiere que la excitabilidad de las fibras nerviosas, y consecuentemente la activación de los mecanismos analgésicos endógenos, dependen de las características del patrón de estimulación20. Históricamente, la teoría más extendida para explicar los efectos fisiológicos del TENS se basa en la conocida como teoría de la puerta de entrada o gate control21. Según la teoría del gate control, la estimulación de las fibras aferentes de gran diámetro, como la producida por el TENS, inhibiría la respuesta producida por las fibras nociceptivas, al activarse las interneuronas situadas en la sustancia gris del asta posterior de la médula espinal. Numerosos estudios avalan que el efecto analgésico del TENS se produce por una inhibición a nivel espinal22–27. Además de a nivel espinal, la teoría del gate control sugería la implicación de vías supraespinales descendentes inhibitorias que modularían a las neuronas espinales. Ya en 1980, Woolf, estudiando el efecto analgésico del TENS en ratas, comprobó que tras una sección medular completa, por tanto sin influencias de vías descendentes supraespinales, aunque el TENS continuaba parcialmente produciendo analgesia, se había producido una disminución considerable de su efecto, sugiriendo que el TENS produciría su efecto inhibitorio en ambos niveles, espinal y supraespinal28. Posteriormente, numerosos estudios avalan la participación de estructuras supraespinales en el mecanismo fisiológico de acción del TENS29–37. No obstante, la teórica relación entre las distintas modalidades de programación y la activación selectiva de diferentes fibras nerviosas no ha podido quedar demostrada de forma consistente en los estudios experimentales22; posiblemente porque esta relación puede verse alterada en la práctica debido a la naturaleza no homogénea de los tejidos situados bajo los electrodos20. Por todo ello, en los últimos tiempos ha habido un mayor esfuerzo investigador, con la realización de importantes estudios en animales y en sujetos sanos con el fin de dilucidar qué efectos fisiológicos son los que se producen en el organismo al aplicar TENS38–40.
ObjetivoA través de una revisión exhaustiva de la literatura científica publicada, determinar qué efectos fisiológicos tiene la aplicación de la técnica TENS sobre los pacientes, de modo que pueda servir de orientación para su correcta aplicación en la práctica clínica.
Material y métodosA nivel metodológico, para la revisión bibliográfica se siguieron los siguientes pasos:
Criterios de inclusión y exclusiónSe incluyeron todos aquellos estudios que trataban sobre la utilización de la técnica TENS y sus efectos fisiológicos, aparecidos en artículos o congresos científicos. Se incluyeron en la revisión trabajos experimentales, observacionales o experiencias clínicas, tanto en humanos como en animales. Fueron excluidos, por no ser ni fisiológica ni metodológicamente comparables, los estudios basados en otras técnicas de electroterapia (microcorrientes, interferenciales, etc.).
Estrategia de búsqueda y extracción de datosLos estudios relevantes fueron identificados a través de una búsqueda en las bases de datos Academic Search Complete, Biomedical Reference Collection, Fuente Académica Premier, MedicLatina, Medline, Cinahl, Nursing & Allied Health Collection, ISI Web of Knowledge, Embase y SportDiscus, desde la primera fecha disponible hasta enero de 2010. La estrategia de búsqueda usada para todas las bases de datos fue TENS y TRANSCUTANEOUS ELECTRIC NERVE STIMULATION combinadas mediante los operadores booleanos AND y OR con cada uno de los siguientes términos: PAIN, EXPERIMENTAL PAIN, ANALGESIA, HYPOALGESIA, HYPERALGESIA, PAIN THRESHOLD. No se impuso ninguna restricción en el lenguaje, siendo por ello que los trabajos no escritos en español o inglés también fueron incluidos. Todos los trabajos seleccionados por medio de esta estrategia de búsqueda fueron analizados por los autores, validando la elegibilidad de los estudios seleccionados. Todas las ambigüedades fueron resueltas existiendo un total acuerdo entre los autores. De los diferentes estudios experimentales incluidos se extrajeron de forma independiente los principales datos (sujetos, intervención, resultados) usando formatos de extracción de datos estandarizados. Por otra parte, se consultaron libros de referencia en la materia, procedentes de la Biblioteca de la Universidad CEU-Cardenal Herrera de Valencia, identificados como importantes y actualizados, teniendo que haber sido publicados con posterioridad al año 20001,2.
ResultadosTras la revisión de la literatura científica se localizaron finalmente 97 referencias que cumplieron con los criterios de inclusión.
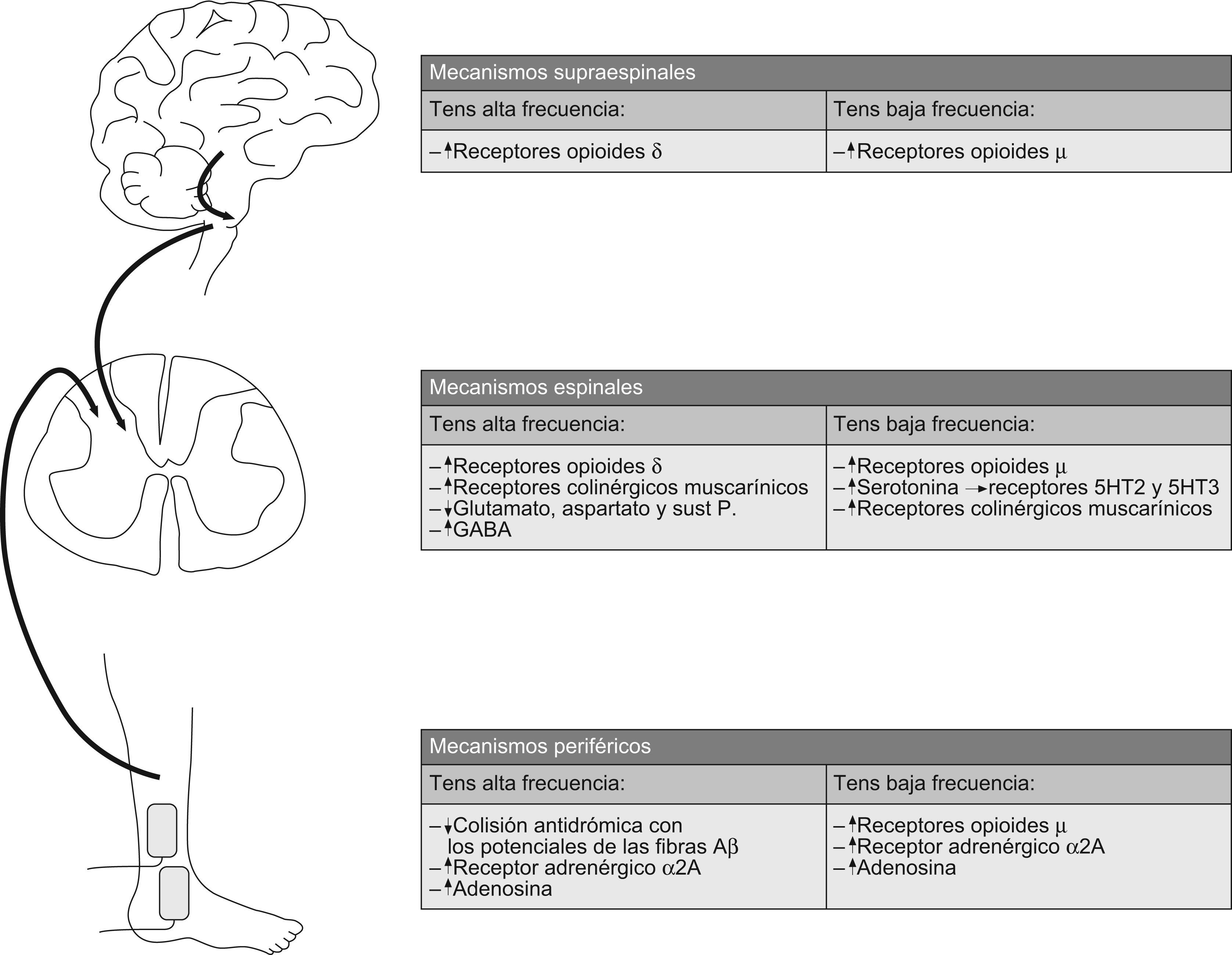
La evidencia proveniente de los estudios, tanto en modelos con animales como con sujetos sanos, nos indica que la frecuencia elegida es el parámetro que determinaría la activación de diferentes mecanismos fisiológicos periféricos y centrales19,33,41–43. Según la literatura, en la elección de la frecuencia básicamente se presentan dos posibilidades: baja frecuencia (menor de 10Hz) y alta frecuencia (mayor de 50Hz), con efectos fisiológicos y terapéuticos distintos2. No obstante, la evidencia disponible más recientemente confirma que en ambos casos la secreción de opioides endógenos es el principal mecanismo fisiológico responsable de la analgesia producida por la aplicación de TENS27,29,30,35,38,39,44–47. Existen tres tipos de receptores opioides, μ, λ, κ, que están situados periféricamente, en la médula espinal y en áreas supraespinales relacionadas con las vías de inhibición descendente19,29,48. En cada uno de estos tres niveles, el TENS presenta mecanismos de acción fisiológicos diferenciados (fig. 1).
Tradicionalmente, respecto al tipo de aferencias que son estimuladas por una aplicación de TENS, la interpretación más extendida apuntaba a que el TENS produciría su efecto analgésico por la activación de las fibras nerviosas aferentes cutáneas superficiales en el emplazamiento de la aplicación. Sin embargo, en un estudio de 2005 empleando anestésicos locales para bloquear selectivamente diferentes fibras aferentes, se comprobó el papel fundamental de las aferencias de los tejidos profundos en la analgesia producida por el TENS34. Otro aspecto ampliamente difundido sobre los mecanismos fisiológicos del TENS apuntaba a que existe una especificidad en cuanto a la activación de distintos tipos de fibras aferentes según la modalidad TENS empleada. De este modo, el TENS de alta frecuencia activaría selectivamente las fibras aferentes de mayor diámetro Aβ, mientras que el TENS de baja frecuencia, aplicado a intensidades por encima del umbral motor, activaría selectivamente las fibras Aλ. No obstante, mediante la evaluación de potenciales de acción en la médula espinal se ha demostrado que sólo las fibras aferentes primarias de gran diámetro Aβ, situadas en los tejidos profundos, se activan al aplicar TENS, tanto de alta como de baja frecuencia, con las intensidades empleadas en la práctica clínica48.
A nivel periférico, en un principio se sugirió que el TENS, particularmente el de alta frecuencia, podía producir su efecto analgésico al fatigar o incluso interrumpir la conducción nerviosa de las fibras aferentes Aλ procedentes de la zona del dolor49. Recientemente, en un estudio con sujetos sanos a los que se les aplicó TENS sobre el dorso del antebrazo, se constató una disminución de la amplitud de los potenciales evocados, así como de los umbrales de percepción provocados por la excitación de la gran mayoría de las fibras Aβ del nervio radial. Los autores afirman que esta disminución es debida a la colisión antidrómica de los potenciales de acción producidos por el TENS en las fibras Aβ, que bloquean las aferencias procedentes del dorso de la mano50. No obstante, con la aplicación de TENS se consigue una duración del efecto analgésico posterior a su aplicación estimado entre 8 y 24h, señalando hacia mecanismos de acción distintos al simple bloqueo sensorial periférico48.
En un estudio de 2005, King et al comprobaron en ratas que tanto el TENS de alta frecuencia, como el de baja frecuencia, veían disminuido su efecto analgésico en aquellos animales manipulados genéticamente a los que les faltaba el receptor adrenérgico α2A. Además, en los ratones control, la administración de un antagonista del receptor adrenérgico α2A revertía el efecto analgésico del TENS si era administrado periféricamente intraarticularmente, no produciéndose este efecto al ser administrado de forma intratecal o supraespinal51.
Los receptores opiodes periféricos desempeñan un papel importante en la analgesia producida por el TENS de baja frecuencia. Sabino et al demostraron, en un estudio en ratas, que los receptores opiodes μ situados periféricamente en el lugar de la aplicación, mediaban en el efecto analgésico producido por el TENS de baja frecuencia, no siendo así en el de alta frecuencia52.
Por otro lado, se cree que la adenosina puede estar implicada en el mecanismo de acción del TENS, ya que en un estudio en humanos se demostró que la administración de cafeína (que bloquea a los receptores de adenosina) en una cantidad de 200mg, previamente a la aplicación del TENS, reducía significativamente la analgesia, al compararse con un placebo53. Sin embargo, con una dosis más reducida de cafeína (100mg, cantidad equivalente a una taza de café) no se producen diferencias significativas detectables sobre los efectos del TENS al compararse con el café descafeinado54.
En cuanto a la proporción entre los mecanismos fisiológicos centrales y los periféricos en el efecto del TENS, ésta no ha quedado determinada, y debe ser objeto de futuras investigaciones50.
Mecanismos fisiológicos espinalesA nivel medular se ha constatado que los efectos del TENS están asociados a la activación de receptores, al menos, de cuatro tipos: opioides, serotoninérgicos, colinérgicos y GABAérgicos25,27–29,32,39.
La activación de distintos receptores opioides está asociada a la aplicación de TENS a distintas frecuencias. De este modo, según la estimulación se produzca mediante TENS de alta o de baja frecuencia, se activarán receptores opioides distintos. En un estudio de 1991, Han et al analizaron el fluido cerebroespinal de la zona lumbar en pacientes tras un tratamiento tanto con TENS de alta frecuencia, como de baja frecuencia55. Concretamente, al aplicar TENS de baja frecuencia se produjo un aumento en la concentración de metionina-encefalina, un agonista de los receptores opiodes λ; mientras que en el caso del TENS de alta frecuencia, se encontró aumentada la concentración de dinorfina A, agonista de los receptores κ. Posteriormente, en 1999 Sluka et al, investigaron el papel de los distintos receptores opioides, μ, λ y κ en el mecanismo de analgesia del TENS de alta y baja frecuencia25. Usando un modelo de inflamación en animales, mediante la inyección de caolín y carragenina en la cápsula articular de la rodilla en ratas, se midió el tiempo de respuesta de retirada del miembro ante un estímulo térmico. Mediante microdiálisis se les administró en la médula espinal antagonistas para cada tipo de receptor opiode: naloxona (μ), naltrindol (λ) o norbinaltorfimina (κ). Dosis bajas de naloxona, específicas de los receptores μ, bloqueaban el efecto del TENS de baja frecuencia. Mientras que el bloqueo de los receptores opioides λ previno el efecto del TENS de alta frecuencia. Por contra, el bloqueo de los receptores opioides κ no produjo ningún efecto sobre la analgesia ni del TENS de alta, ni de baja frecuencia25. Así, se pudo constatar que a nivel de la médula espinal el TENS de baja frecuencia produce su efecto mediado por los receptores opioides μ, mientras que los receptores oipodes λ median en el efecto fisiológico del TENS de alta frecuencia25,29,39,41,43,45,52,56,57. Por otro lado, en un estudio en 2005 de Sluka et al, se examinó si existía liberación de glutamato y aspartato en el asta posterior de la médula como respuesta a dos tipos de estímulos TENS, baja frecuencia y alta frecuencia, aplicados en animales a los que se les provocó una inflamación articular y a otros animales sanos38. Está demostrado que como consecuencia de una inflamación articular, hay un aumento fisiológico en los niveles de glutamato y aspartato. Al mismo tiempo, es sabido que los opioides disminuyen la secreción de glutamato y aspartato. El TENS de alta frecuencia, pero no el de baja frecuencia, redujo significativamente la liberación de glutamato y aspartato en los animales con inflamación articular, comparado con aquellos sin inflamación articular. La disminución de glutamato y aspartato por el TENS de alta frecuencia no se produjo si previamente se había suministrado naltrindol, antagonista del receptor opioide λ. De todo esto, se confirma que el TENS tiene en los receptores opiodes uno de sus sustratos fisiológicos de actuación.
En 2006 se llevó a cabo un estudio con el modelo de inflamación articular en ratas para determinar si la serotonina y la noradrenalina intervenían en el mecanismo de actuación del TENS57. En este estudio se comprobó que los niveles de serotonina en el asta posterior de la médula espinal aumentaban durante, e inmediatamente después, de una aplicación de TENS de baja frecuencia aplicado sobre la rodilla inflamada, no habiendo cambios si la aplicación era de alta frecuencia57. Concordando con estos resultados, previamente se había comprobado que el bloqueo de los receptores serotoninérgicos 5-HT2 y 5-HT3 evitaba el efecto analgésico del TENS de baja frecuencia, pero no el de alta frecuencia32. En el caso de los niveles de noradrenalina, no se han encontrado cambios en el asta posterior de la médula espinal asociados ni a la aplicación de TENS de alta frecuencia, ni a la de baja frecuencia57; en este sentido también se ha comprobado que los receptores noradrenérgicos no ejercen ningún papel en el mecanismo de acción del TENS32.
Otro de los tipos de receptores a nivel medular que están implicados en el mecanismo de acción del TENS son los colinérgicos. Estos receptores se localizan en el asta posterior de la médula y pueden ser de dos tipos: muscarínicos y nicotínicos58. En un estudio de 2003, Radhakrishnan et al, empleando el modelo de inflamación articular en ratas, comprobaron que el efecto producido tanto por el TENS de alta como el de baja frecuencia estaba relacionado en gran medida con los receptores colinérgicos muscarínicos, ya que al administrarse intratecalmente un antagonista de este tipo de receptores (atropina) se producía una disminución en los efectos de ambas modalidades del TENS; no siendo así en los receptores nicotínicos27.
Recientemente, se ha comprobado la implicación del ácido gamma-aminobutírico (GABA) en la acción del TENS a nivel espinal. El GABA es el principal neurotransmisor inhibitorio cerebral, segregándose a nivel de la médula espinal por las células gabaérgicas; asimismo, hay neuronas gabaérgicas en regiones supraespinales. Otro neurotransmisor situado en las interneuronas de la médula espinal es la glicina, que tiene una acción similar al GABA58. Pues bien, Maeda et al, demostraron en un estudio con animales que el TENS de alta frecuencia incrementa las concentraciones de GABA en la médula espinal en ratas con y sin inflamación articular. El aumento de GABA no se produjo si la aplicación era de TENS de baja frecuencia. Sin embargo, si se bloqueaban en la médula los receptores GABAA con un antagonista, la bicuculina, se producía una disminución del efecto tanto del TENS de baja como de alta frecuencia39. Más recientemente, Somers et al realizaron un estudio para determinar el efecto de tres modalidades de TENS (alta frecuencia, baja frecuencia y una combinación de ambas) en un modelo de dolor neuropático en fase crónica en ratas tras una constricción del nervio ciático. El tratamiento de TENS se aplicó contralateralmente al nervio afectado y se valoró la concentración de neurotransmisores en el asta posterior de la médula. El TENS de alta frecuencia produjo un aumento significativo de GABA bilateral en el asta posterior; la combinación de alta y baja frecuencia produjo un aumento de la concentración de aspartato, glutamato y glicina bilateralmente, no incrementándose la concentración de GABA; confirma la existencia de neurotransmisores diferentes involucrados en el efecto fisiológico de la aplicación de TENS a distintas frecuencias47.
Finalmente, se ha constatado la relación del TENS con cambios en la concentración de sustancia P en el asta posterior de la médula espinal. La sustancia P endógena funciona como un neurotransmisor en las aferencias sensoriales primarias de la médula espinal. La sustancia P está relacionada con los mecanismos dolorosos, y se ha comprobado que si se inyectan antagonistas de la sustancia P en la médula espinal sobreviene una acción analgésica58. Así, en un estudio de 2002 se comprobó, empleando un modelo de inflamación en animales, cómo el TENS de alta frecuencia reducía la sustancia P en los ganglios de las raíces dorsales y en el asta posterior medular59.
Mecanismos fisiológicos supraespinalesLos primeros estudios señalando el posible efecto de la aplicación del TENS sobre estructuras supraespinales se remontan a los años ochenta, comprobándose un aumento de la concentración de β-endorfinas en el torrente sanguíneo y en el líquido cefalorraquídeo60,61.
Posteriormente, se estudió el efecto del TENS sobre las vías inhibitorias descendentes, que incluyen el núcleo rafe magno, situado en la médula rostral ventral, y la sustancia gris periacueductal en el mesencéfalo. La sustancia gris periacueductal envía proyecciones a la médula rostral ventral que, a su vez, envía proyecciones a la médula espinal62. La estimulación de la sustancia gris periacueductal o de la médula rostral ventral produce inhibición de las neuronas del asta posterior medular, estando comúnmente aceptado que los efectos inhibidores de los opioides se producen por la activación de estas dos zonas62. Es por ello que se ha estudiado el efecto del TENS en los mecanismos fisiológicos de estas dos zonas. Así, Desantana y Sluka han demostrado, en un estudio en el que se bloqueó mediante clorhidrato de cobalto la sustancia gris periacueductal, que ésta también contribuye al mecanismo fisiológico del TENS48. Por otro lado, en un estudio sobre un modelo de inflamación articular en animales de 2001 en el que se emplearon microinyecciones en la médula rostral ventral de diversos antagonistas de receptores opioides, se constató que los receptores opioides situados en la médula rostral ventral mediaban en el efecto del TENS; concretamente los receptores opioides μ sobre el TENS de baja frecuencia, y los receptores opioides λ sobre el TENS de alta frecuencia29. Estos datos sugieren que a nivel supraespinal, al igual que sucede a nivel medular, diferentes receptores opioides son activados específicamente por frecuencias distintas de TENS19.
Mecanismos fisiológicos periféricos no analgésicosSegún algunos autores, el TENS potencialmente podría tener un efecto local sobre el riego sanguíneo y la resistencia vascular periférica63–65. No obstante, parece claro que los efectos del TENS sobre la circulación estarían asociados a una intensidad suficiente para conseguir contracciones musculares importantes, y no a un efecto sobre los nervios simpáticos postganglionares o sobre el sistema vascular a nivel general64,66–69.
Otra hipótesis respecto a los efectos del TENS sería que su aplicación pudiera inducir alteraciones en la conducción nerviosa70–72. No obstante, los resultados no son consistentes ya que otros estudios no encontraron cambios significativos ni en las latencias ni en las amplitudes de las aferencias nerviosas18,35,73.
Respecto al efecto sobre la actividad muscular el TENS, también puede ser usado para estimulación neuromuscular con el objetivo de producir eléctricamente contracciones musculares, conociéndose con el acrónimo NMES (neuromuscular electrical stimulation)2. No obstante, de los estudios sobre el TENS también parece deducirse que la aplicación a intensidades que no superan el umbral motor, es decir solo estímulos sensitivos, podría condicionar la respuesta motora. Los efectos de la estimulación somatosensorial aplicada de diversas formas sobre la excitabilidad neuromuscular y, por tanto, sobre la respuesta muscular, han sido objeto de estudio tanto en animales74 como en humanos. Midiendo la actividad electromiográfica (EMG) y la fuerza mediante dinamometría antes y después de la aplicación de TENS se ha constado un efecto facilitador de la actividad muscular, concluyéndose que esta técnica puede influir positivamente en la actividad muscular de pacientes con déficits motores en accidentes cerebrovasculares y otros desórdenes neurológicos35,75–79.
Consideraciones fisiológicas sobre la aplicación de TENSAl usarse el TENS muy frecuentemente de forma repetida para el tratamiento del dolor crónico, un fenómeno importante que hay que tener en cuenta es la potencial aparición del fenómeno de tolerancia. Como ya se ha explicado en párrafos anteriores, la analgesia que proporciona el TENS está relacionada con la secreción de péptidos opioides en el sistema nervioso27,29,30,35,38,39,44–47,80,81. Por otro lado, es conocido que la administración repetida de opioides desarrolla una disminución en su efecto analgésico que puede ser transitoria o crónica, y que es conocida como tolerancia; asimismo, la tolerancia a un opioide disminuye la respuesta a otros opioides, un fenómeno conocido como tolerancia cruzada56. Así, como el efecto del TENS es básicamente de naturaleza opioide, se ha estudiado si la administración repetida de TENS conduce al desarrollo de tolerancia. Pacientes en tratamiento con dosis elevadas de fármacos opioides, o que recibieron tratamientos prolongados con este tipo de fármacos, posteriormente se ha comprobado que no responden a los tratamientos con TENS82. En un estudio en ratas, en un modelo inflamatorio articular, se comprobó cómo la administración repetida de TENS durante seis días (tanto de alta como de baja frecuencia) disminuía su efecto analgésico a causa del desarrollo de tolerancia y también provocaba tolerancia cruzada a agonistas opioides μ y λ56. En el caso de estudios en humanos, Liebano et al han constatado, comparando con un placebo, que la aplicación repetida diariamente de TENS con los mismos parámetros produce una disminución de la efectividad del TENS a partir del cuarto día de tratamiento83. Es por ello que a nivel clínico es importante tener presente la posible aparición de tolerancia a la hora de prescribir sesiones consecutivas de TENS, por ejemplo a pacientes con dolor crónico. Por otro lado, es conocido que el bloqueo del receptor N-Metil-D-Aspartato (NMDA) o del receptor de colecistocinina CCK previenen la aparición de la tolerancia a los opioides. En este sentido, en dos estudios en ratas se demostró que administrando un antagonista del receptor NMDA se prevenía la aparición de la tolerancia a la administración diaria repetida de TENS84; y que el bloqueo tanto sistémico como intratecal de los receptores CCK prevenía la aparición de la tolerancia al TENS, además de la tolerancia cruzada a agonistas de los receptores opioides85. Desde una perspectiva clínica, se ha sugerido que la administración a dosis bajas de fármacos antagonistas del receptor NMDA (por ejemplo, ketamina, dextrometorfano) podría servir para incrementar la eficacia del TENS84.
Respecto al tiempo de aparición de la analgesia de una aplicación de TENS, parece haber un consenso en que este tiempo es corto. Esto se ha demostrado tanto en modelos de experimentación en animales86, como en sujetos sanos87–89, así como en pacientes reales con dolor90. No obstante, hay mucha variabilidad en los resultados; algunos autores hablan de que el efecto analgésico es relevante clínicamente a los 10min de iniciada la aplicación88, mientras que otros afirman que, con la combinación de parámetros adecuada, el TENS reduce el dolor desde el primer minuto de aplicación11,89,91.
Respecto a la duración del efecto analgésico tras finalizar una sesión de tratamiento, se ha estimado entre 8 y 24h48,92,93. Recientemente se ha abundado en la importancia de emplear intensidades elevadas para conseguir una mayor duración del efecto del TENS postratamiento94.
Finalmente, respecto a posibles diferencias en los efectos del TENS entre sexos, aunque existen diferencias en cuanto a los umbrales y la tolerancia al dolor entre hombres y mujeres12,95,96, no se han encontrado diferencias en cuanto al grado de respuesta al TENS90,97.
ConclusionesTras realizar una revisión exhaustiva de la literatura científica publicada hasta el momento, respecto a los efectos fisiológicos que se producen por la aplicación de TENS, se pueden extraer una serie de conclusiones sobre los mecanismos fisiológicos implicados en dicha técnica, que pueden servir de orientación para su aplicación en la práctica clínica:
- •
El TENS, para producir su efecto analgésico, necesita de la estimulación fundamental de las aferencias de los tejidos profundos por estimulación de las fibras aferentes primarias de gran diámetro Aβ. De ahí, la necesidad de emplear intensidades elevadas que alcancen los tejidos profundos para asegurar la efectividad de la aplicación del TENS.
- •
Los mecanismos de acción fisiológicos del TENS de alta y baja frecuencia son distintos, aunque ambos se producen a nivel periférico, espinal y supraespinal, y se basan primordialmente en la activación de distintos receptores opioides.
- •
La aplicación de TENS sólo tiene efecto sobre la circulación periférica aplicado a una intensidad suficiente para conseguir contracciones musculares importantes; en todo caso, el efecto es local sobre la zona de aplicación.
- •
De la revisión realizada podemos extrapolar que la aplicación de TENS puede facilitar la actividad muscular de pacientes con déficits motores en accidentes cerebrovasculares y otros desórdenes neurológicos.
- •
Con la combinación de parámetros adecuada hay evidencias de que el efecto analgésico del TENS tendría un tiempo de instauración muy breve desde el inicio de la sesión.
- •
Respecto a la duración del efecto analgésico tras una sesión de tratamiento, se ha demostrado la importancia de emplear intensidades elevadas para conseguir una mayor duración del efecto postsesión.
- •
La aplicación repetida diariamente de TENS con los mismos parámetros produce una disminución de la efectividad del TENS a partir del cuarto día de tratamiento, provocada por el desarrollo de tolerancia. Desde una perspectiva clínica, se ha sugerido que la administración a dosis bajas de distintos fármacos que pudieran disminuir la tolerancia opioide podría servir para incrementar la eficacia del TENS en pacientes con dolor crónico.
Los autores declaran no tener ningún conflicto de intereses.