En las últimas décadas ha habido un gran avance en el tratamiento de las vasculitis sistémicas, aunque persiste una significativa morbilidad y mortalidad en estas enfermedades, a menudo relacionadas con la terapia inmunosupresora. El éxito de la terapia biológica en la artritis reumatoide y otras enfermedades autoinmunes ha dado lugar a la investigación de estos agentes en las vasculitis sistémicas. Los fármacos anti-TNF han demostrado ser útiles en el tratamiento de la arteritis de Takayasu, refractaria al tratamiento convencional. No hay ninguna prueba de su eficacia en otros tipos de vasculitis. La terapia anti-CD20 (rituximab) ha demostrado ser eficaz en la vasculitis ANCA refractaria a la ciclofosfamida. Dos ensayos clinicos recientemente publicados, han demostrado que rituximab no es inferior a la ciclofosfamida como tratamiento de inducción de la remisión en Vasculitis ANCA, así que en el futuro, podría considerarse un tratamiento de primera línea en estos pacientes.
In recent decades, there has been a breakthrough in the treatment of systemic vasculitis, although substantial morbidity and mortality are still associated with these diseases, often related to immunosuppressive therapy. The success of biologic therapy in rheumatoid arthritis and other autoimmune diseases has led to research into these agents in systemic vasculitis. Anti-tumor necrosis factor (TNF) agents have proven useful in the treatment of Takayasu arteritis refractory to conventional treatment but there is no evidence of their effectiveness in other types of vasculitis. Anti-CD20 therapy (rituximab) has proven effective in ANCA vasculitis refractory to cyclophosphamide. Two recently published clinical trials have shown that rituximab is not inferior to cyclophosphamide as induction therapy of remission in ANCA Vasculitis, so in the future, could be considered a first line treatment in these patients.
Las vasculitis sistémicas son un grupo heterogéneo de enfermedades caracterizadas por inflamación y lesión de las paredes vasculares con la consiguiente isquemia y necrosis de los tejidos irrigados por dichos vasos.
Las vasculitis pueden clasificarse de acuerdo a la Conferencia de Consenso de Chapel Hill1 y a los criterios del Colegio Americano de Reumatologia (ACR)2. Los criterios de Chapel Hill están basados en los hallazgos histológicos observados en la biopsia y sirven como criterios diagnósticos de la enfermedad. Los formulados por el ACR son criterios de clasificación que sirven para diferenciar las distintas entidades, una vez que se ha realizado el diagnóstico.
El tratamiento de las vasculitis se basa en la terapia con corticosteroides e inmunosupresores, que han conseguido un importante aumento de la supervivencia de estos pacientes. A pesar de los avances terapéuticos de las últimas décadas, las vasculitis sistémicas siguen siendo procesos graves, con una importante morbilidad y mortalidad.
Debido a la toxicidad conocida de los inmunosupresores, entre ellos la ciclofosfamida, en el tratamiento de las vasculitis sistémicas, existe un creciente interés en la búsqueda de otras terapias. Los agentes biológicos se han propuesto como una alternativa para estos trastornos, por su reciente éxito en el tratamiento de otras enfermedades reumáticas.
Esta revisión se centrará en los resultados logrados con las terapias biológicas en tratamiento de las vasculitis sistémicas.
Vasculitis de gran vasoArteritis de células gigantesLa arteritis de células gigantes (ACG) es la vasculitis de gran vaso más frecuente en nuestro medio y afecta principalmente a pacientes mayores de 50 años. El tratamiento con altas dosis de corticosteroides, 40-60mg/día de prednisona o equivalente, produce una rápida mejoría en los pacientes con ACG y es una de las características más típicas de la enfermedad. Tras el tratamiento inicial de la enfermedad se requiere una reducción lenta y progresiva de la dosis de corticosteroides hasta alcanzar una dosis de mantenimiento, generalmente entre 5 a 7,5mg/día de prednisona durante varios años. En un 10-15% de los pacientes no es posible disminuir la dosis de prednisona por debajo de 10-15mg/día sin provocar una recidiva3. Por otra parte, el 40-50% de los pacientes en los que ha podido disminuirse la terapia de corticosteroides a niveles fisiológicos no toleran la suspensión total de ellos después de 2-3 años de tratamiento3,4.
Más del 80% de los pacientes con ACG experimentan complicaciones derivadas del tratamiento con corticosteroides5, por lo que hay un especial interés en utilizar terapias que permitan un adecuado control de la enfermedad, con menores dosis y menor tiempo de exposición a estos fármacos.
Recientemente se han publicado los resultados de un estudio multicéntrico, aleatorio, doble ciego y controlado de infliximab (INF), versus placebo en pacientes con ACG. Se incluyeron 44 pacientes diagnosticados recientemente de ACG y se aleatorizaron para recibir INF (5mg/kg) o placebo en una relación 2:1, añadida a la terapia con corticosteroides. A las 22 semanas de seguimiento, el número de pacientes sin recaídas fue similar en el grupo de tratamiento con INF que en el grupo con placebo, 43 frente al 50%, respectivamente. Además, la proporción de pacientes que disminuyeron la prednisona a 10mg/día sin recaídas, fue similar entre ambos grupos (61% en el grupo de INF, 75% en el grupo placebo, p=0,31). La incidencia de infecciones fue mayor en el grupo tratado con IFN (71%) que el de placebo (56%), aunque las diferencias no fueron estadísticamente significativas. Las conclusiones de este estudio han sido que es improbable que el INF tenga una eficacia sustancial en el tratamiento de ACG6.
La eficacia de otros anti-TNFα no ha podido ser probada de forma consistente. Martínez-Taboada et al7 han llevado a cabo un ensayo clínico aleatorizado sobre el uso de etanercept (ETN) en el tratamiento de pacientes con ACG con toxicidad secundaria a la terapia esteroidea. Se incluyeron 17 pacientes con una mediana de duración de la enfermedad de 10 meses. Ocho pacientes recibieron ETN (n=8) y 9 placebo durante un año, junto a la terapia con corticosteroides. El objetivo primario fue el control de la enfermedad, suspendiendo la terapia esteroidea al año. Tras 12 meses, el 50% de los pacientes en el grupo de ETN y el 22% en el grupo placebo controlaban la enfermedad sin tratamiento corticoideo, aunque no hubo diferencias significativas. Los pacientes que recibieron ETN habían consumido una menor dosis acumulativa de corticosteroides (p=0,03).Los efectos adversos fueron similares en los dos grupos. Desgraciadamente, el número limitado de pacientes incluidos no permitió extraer conclusiones definitivas.
Arteritis de TakayasuVarios investigadores han comunicado efectos favorables del tratamiento con anti-TNFα en la arteritis de Takayasu (AT), tanto en adultos8–15 como en niños16,17, la mayoría con INF y ETN. Molloy15 realizó un estudio retrospectivo de 25 pacientes con AT refractarias tratados con INF (n=21) o ETN (n=9) y seguidos una mediana de 28 meses. De los 9 pacientes tratados con ETN, 4 consiguieron una remisión completa y 2 pacientes una remisión parcial. Tres pacientes que no consiguieron la remisión con ETN fueron tratados con INF y alcanzaron una remisión completa. De los 21 pacientes tratados con INF, 12 alcanzaron una remisión completa y 6 una remisión parcial. Doce de estos pacientes tuvieron recaídas y requirieron tratamiento con dosis más altas de INF y a menores intervalos. Este estudio sugiere que los anti-TNFα, especialmente el INF, pueden ser de utilidad en el tratamiento de AT refractaria, sin embargo se necesita comprobar estos resultados en ensayos clínicos más amplios.
Vasculitis asociadas a ANCALas vasculitis asociadas a anticuerpos anticitoplasma del neutrófilo (ANCA) comprenden la granulomatosis de Wegener (GW), la poliangeítis microscópica (PAM) y el síndrome de Churg Strauss (SCS). Se trata de vasculitis necrosantes de pequeño vaso, con diferentes expresiones clínicas, que se asocian en mayor o menor medida a la presencia de ANCA. La GW se asocia a ANCA dirigidos contra la proteinasa 3 (PR3), mientras que la diana antigénica en el caso de la PAM y SCS es la mieloperoxidasa (MPO). En cuanto a las manifestaciones clínicas de estas vasculitis, la GW y el SCS pueden presentarse como enfermedades granulomatosas localizadas, mientras que la PAM es una vasculitis pura, sin formación de granulomas.
Evidencias in vivo e in vitro demuestran que los ANCA juegan un papel central en la patogenia de estas enfermedades y se asocian con la actividad de la enfermedad, así como con las recaídas.
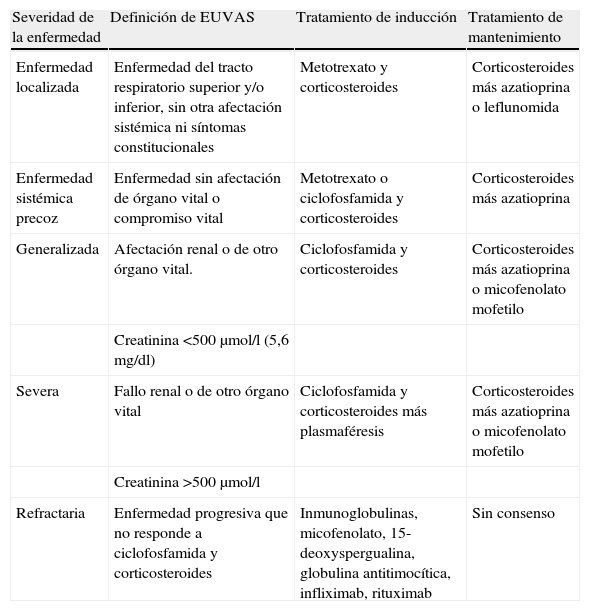
El tratamiento de las vasculitis actualmente se realiza de acuerdo al estadio de la enfermedad y a la actividad de ésta. Recientemente, la Liga Europea contra el Reumatismo (EULAR) ha formulado unas recomendaciones para el manejo de este grupo de enfermedades18. En estas recomendaciones se ha propuesto la definición y la clasificación de los niveles de severidad de la enfermedad, con el fin de adaptar el tratamiento a estos niveles. La clasificación está especialmente diseñada para la GW, pero puede utilizarse también para la PAM y el SCS. Esta clasificación distingue entre enfermedad sin compromiso orgánico, que puede ser localizada y sistémica precoz, y la enfermedad con afectación orgánica, que puede clasificarse en generalizada, severa y refractaria (tabla 1).
Severidad y manejo de las vasculitis-ANCA (EULAR).
| Severidad de la enfermedad | Definición de EUVAS | Tratamiento de inducción | Tratamiento de mantenimiento |
| Enfermedad localizada | Enfermedad del tracto respiratorio superior y/o inferior, sin otra afectación sistémica ni síntomas constitucionales | Metotrexato y corticosteroides | Corticosteroides más azatioprina o leflunomida |
| Enfermedad sistémica precoz | Enfermedad sin afectación de órgano vital o compromiso vital | Metotrexato o ciclofosfamida y corticosteroides | Corticosteroides más azatioprina |
| Generalizada | Afectación renal o de otro órgano vital. | Ciclofosfamida y corticosteroides | Corticosteroides más azatioprina o micofenolato mofetilo |
| Creatinina <500μmol/l (5,6 mg/dl) | |||
| Severa | Fallo renal o de otro órgano vital | Ciclofosfamida y corticosteroides más plasmaféresis | Corticosteroides más azatioprina o micofenolato mofetilo |
| Creatinina >500μmol/l | |||
| Refractaria | Enfermedad progresiva que no responde a ciclofosfamida y corticosteroides | Inmunoglobulinas, micofenolato, 15-deoxyspergualina, globulina antitimocítica, infliximab, rituximab | Sin consenso |
Además, para la realización de estudios o ensayos clínicos, los pacientes con vasculitis-ANCA deben ser clasificados en estadios según el grado de actividad de la enfermedad, estableciendo definiciones claras y consensuadas de los términos: remisión, respuesta, enfermedad refractaria y recaída19.
La estrategia habitual para el tratamiento de estas vasculitis-ANCA está dividida en dos fases: el tratamiento de inducción de la remisión y el tratamiento de mantenimiento. Para la inducción, se recomienda una combinación de ciclofosfamida y corticosteroides en pacientes con enfermedad generalizada, definida por afectación renal o de otro órgano mayor y una creatinina menor de 5,6mg/dl. En pacientes con enfermedad leve-moderada, en la que la creatinina en menor de 2mg/dl y no hay fallo renal, puede utilizarse el metotrexato como alternativa18.
La gran mayoría de los pacientes con vasculitis-ANCA alcanzan la remisión con estas terapias en 3 a 6 meses. La terapia de mantenimiento se realiza posteriormente con metotrexato o azatioprina, durante un tiempo no inferior a 18 meses (especialmente en la GW). Los expertos consideran también la opción de tratamiento con leflunomida en esta etapa, aunque los datos son limitados.
Es evidente que en los últimos años, y debido a la terapia inmunosupresora, ha disminuido de forma considerable la mortalidad de los pacientes con vasculitis-ANCA; sin embargo, estas terapias tienen importantes efectos adversos tanto a corto como a largo plazo. Un reciente estudio ha evaluado la evolución y los efectos adversos en 524 pacientes diagnosticados recientemente de vasculitis-ANCA, reclutados en 4 ensayos europeos, demostrando una mortalidad en el primer año del 11,1%. El 59% de estas muertes se debían a efectos adversos, y sólo el 14% a actividad de la enfermedad20. Este estudio demuestra claramente que es necesario explorar nuevas pautas o nuevos tratamientos con menores efectos adversos.
Agentes biológicos en el tratamiento de las vasculitis asociadas a ANCAANTI-TNFαLa mayoría de los estudios que han evaluado el potencial terapéutico de los anti-TNFα se han realizado en pacientes con GW, aunque algunos estudios han incluido pacientes con PAM y SCS21–23.
El estudio de ETN en la GW (WGET) fue un ensayo multicéntrico controlado con placebo, para determinar si el ETN era efectivo para el mantenimiento de la remisión en pacientes con GW. Se incluyeron 180 pacientes con GW, que se aleatorizaron para recibir ETN o placebo, añadido al tratamiento inmunosupresor estándar con ciclofosfamida o metotrexato. No se obtuvieron diferencias significativas en la tasa de remisión entre los grupos de ETN y placebo (69,7 vs 75,3%, p=0,39). Un hallazgo importante fue el aumento de tumores sólidos en el grupo de ETN (6 tumores sólidos frente a ninguno en el grupo placebo), persistiendo un mayor riesgo 3,5 años después de la conclusión del estudio24.
No se ha realizado ningún ensayo clínico sobre la eficacia de otros anti-TNFα en el tratamiento de las vasculitis-ANCA. Se han publicado varias series de casos y un ensayo abierto con INF, con diferentes regímenes de tratamiento y diferentes medidas de desenlace, lo que dificulta su interpretación. En general, la mayoría de los pacientes responden al tratamiento de forma parcial o completa, aunque algunos experimentaron brotes de la enfermedad y se observaron infecciones severas21,22,25–27.
En resumen, el papel de la terapia anti-TNFα en el tratamiento de las vasculitis-ANCA es incierto. El tratamiento con ETN no puede recomendarse a la vista de los resultados del estudio WGET y en cuanto a que otros anti-TNFα, como el INF, podrían considerarse como terapia alternativa en pacientes que no alcanzan la remisión o recaen con máximas dosis de terapia estándar, según las recomendaciones de EULAR18.
Terapia anti-CD20 (rituximab)El rituximab (RTX) es un anticuerpo monoclonal quimérico dirigido contra el CD20, un marcador de las células B que se expresa desde la fase de células pre-B hasta la fase de células B maduras. El RTX produce depleción de células B periféricas pero no de células plasmáticas, ya que el CD20 no se expresa en las células plasmáticas secretoras de anticuerpos.
Los ANCA están estrechamente relacionados con la patogénesis y la actividad de las vasculitis-ANCA, por lo que el RTX podría tener un efecto beneficioso en estas vasculitis, disminuyendo la producción de estos anticuerpos.
Rituximab en vasculitis-ANCA refractariasVarios estudios, la mayoría series de casos y ensayos clínicos piloto, han demostrado eficacia del RTX en el tratamiento de las vasculitis-ANCA que eran en su mayoría refractarias a tratamiento convencional28–38. Recientemente, un estudio retrospectivo ha analizado los datos de 65 pacientes que han recibido RTX por vasculitis-ANCA refractarias de 4 centros de Gran Bretaña39. Se consiguió la remisión completa en el 75% de los pacientes y la remisión parcial en el 23%, consiguiendo suspender la terapia inmunosupresora en el 62% de los pacientes. El 57% de los pacientes que habían alcanzado la remisión completa experimentaron una recaída a los 11,5 meses de media. Un nuevo tratamiento con RTX fue eficaz en la mayoría de los pacientes. Aunque los niveles de ANCA disminuyeron tras el tratamiento con RTX, las recaídas no se asociaron a positividad o un aumento de los niveles de anticuerpos. No se observaron diferencias significativas en los resultados según la pauta de tratamiento (4 dosis semanales de 375mg/m2 o perfusión de 1.000mg, 2 semanas).
La utilidad del tratamiento con RTX en las manifestaciones granulomatosas refractarias, como granuloma retroorbitario o estenosis subglótica, es más controvertido. Se han publicado series con buena respuesta a RTX40,41 y otros que no demuestran utilidad del fármaco28,36. Recientemente se han publicado los resultados de un estudio sobre la utilización del RTX en una cohorte de GW de cabeza y cuello refractarias41. Se incluyeron 34 pacientes en el análisis. A los 6 meses del tratamiento, 21 pacientes (62%) alcanzaron la remisión, 9 pacientes (26%) alcanzaron una respuesta parcial y 4 pacientes (12%) no obtuvieron respuesta. Estos últimos respondieron tras una segunda administración de RTX. De los 5 pacientes en esta cohorte que tenían afectación retroorbitaria, 4 respondieron al tratamiento, aunque presentaron recaídas 2 pacientes que inicialmente habían respondido al tratamiento. Los autores concluyen que el RTX era beneficioso en el tratamiento de estos pacientes, permitiendo una reducción de inmunosupresores y de la dosis de corticosteroides con pocos efectos adversos, destacando la respuesta de los pacientes con granuloma retroorbitario.
Rituximab como terapia de inducción de remisión en vasculitis-ANCAEl estudio RAVE (Rituximab versus Cyclophosphamide for ANCA-associated Vasculitis)42 es un ensayo clínico multicéntrico, doble ciego, controlado con placebo, que estudia la terapia con RTX en la inducción de remisión en vasculitis-ANCA graves. El ensayo es un estudio de no inferioridad, que compara RTX (375mg/m2, 4 semanas) con ciclofosfamida oral (2mg/kg/día). Una vez alcanzada la remisión, la ciclofosfamida es sustituida por azatioprina. Se utiliza un mismo régimen de corticosteroides en los dos brazos: 1-3g de metilprednisolona intravenosa, seguida de prednisona oral 1mg/kg/día, reduciendo a 40mg/día en un mes y disminuyendo posteriormente la dosis hasta suspenderla en 6 meses. El objetivo primario es la remisión de la enfermedad, definida por un score de 0 en la Birminghan Vasculitis Activity Score para la granulomatosis de Wegener (BWAS/WG), a los 6 meses en ausencia de corticosteroides. El estudio ha incluido 197 pacientes con GW severa o PAM (3:1). A los 6 meses, el objetivo primario se alcanzó en el 64% de los pacientes con RTX y en el 53% de los pacientes con ciclofosfamida (p=0,10). Un BVAS/WG de 0 y una dosis de prednisona de menos de 10mg/día se alcanzó en el 71% de los pacientes con RTX y en el 62% de los pacientes con ciclofosfamida (p=0,22). La frecuencia de brotes y los efectos adversos fueron similares en los dos brazos de tratamiento. No hubo diferencias significativas entre los dos tratamientos, pero el RTX fue superior en los pacientes con enfermedad severa al inicio. Los autores concluyen que el RTX no es inferior a la ciclofosfamida como tratamiento de inducción a la remisión en vasculitis-ANCA severas y que por lo tanto, podría constituir una alternativa al tratamiento en estas vasculitis.
Los datos a 6 meses de tratamiento son esperanzadores, aunque habrá que esperar a la conclusión del estudio para extraer conclusiones más claras.
El estudio RITUXVAS (Rituximab Comparable to Standard Cyclophosphamide Regimen for ANCA-Associated Renal Vasculitis)43 es un ensayo realizado por el grupo EUVAS, (grupo europeo de estudio de las Vasculitis), publicado recientemente.. Se incluyeron 44 pacientes recientemente diagnosticados de GW o PAM, que fueron aleatorizados para recibir RTX (33 pacientes) o ciclofosfamida (11 pacientes) como terapia de inducción. El grupo de RTX recibió 4 perfusiones de 375mg/m2 más 2 dosis de 15mg/kg de ciclofosfamida. El grupo de ciclofosfamida recibió de 6 a 10 perfusiones de ciclofosfamida, a dosis de 15mg/kg. Ambos grupos recibieron un régimen estándar de prednisolona por vía intravenosa u oral. El objetivo primario —llegar a una remisión sostenida a los 12 meses— se consiguió en el 76% de los pacientes con RTX y en el 82% de los pacientes con ciclofosfamida (diferencias ni significativas). Ocurrieron efectos adversos en el 42% del grupo de RTX y en el 36% del grupo de ciclofosfamida. Hubo un 36% de infecciones frente a 27% en los dos grupos. Ocho pacientes murieron durante el ensayo (18% en los dos grupos). Los autores concluyen que el tratamiento con Rituximab no fué superior al tratamiento con Ciclofosfamida en Vasulitis ANCA severas, alcanzándose buenas respuestas con ambos regímenes de tratamiento.
Los resultados de estos dos estudios sobre el uso de RTX en el tratamiento de inducción a la remisión en vasculitis-ANCA son esperanzadores y es posible que pueda sustituir a la ciclofosfamida en un futuro cercano. Con los datos actuales, podría recomendarse el tratamiento con RTX como alternativa a la ciclofosfamida en pacientes jóvenes con vasculitis-ANCA, mujeres premenopáusicas o en pacientes con alto riesgo de infección44.
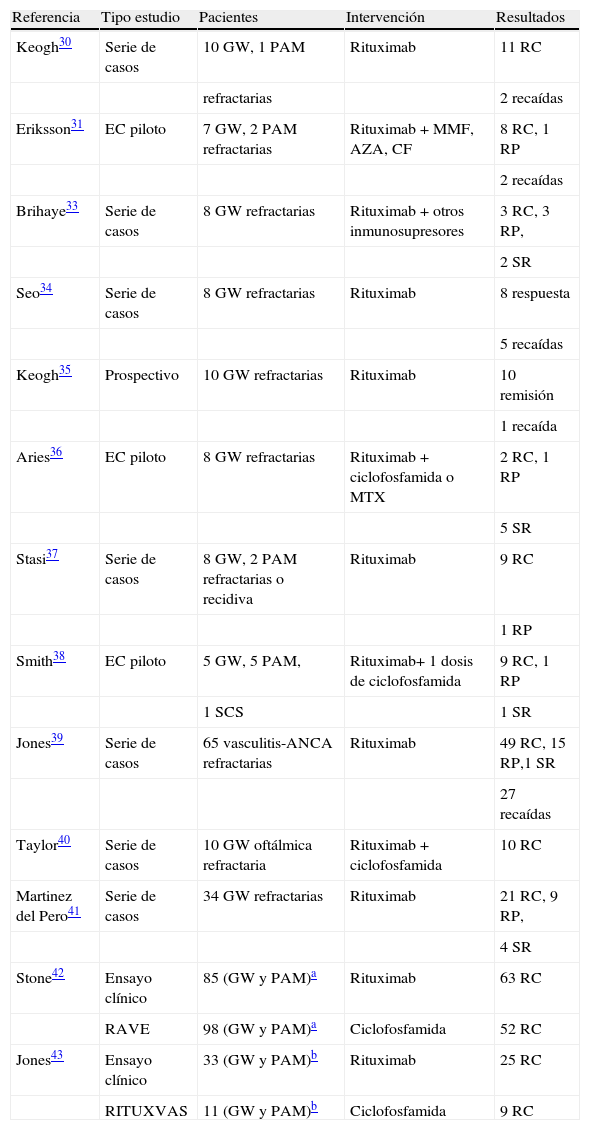
En la tabla 2 se muestran algunos de los estudios realizados con RTX en el tratamiento de vasculitis-ANCA.
Estudios de rituximab en las vasculitis-ANCA.
| Referencia | Tipo estudio | Pacientes | Intervención | Resultados |
| Keogh30 | Serie de casos | 10 GW, 1 PAM | Rituximab | 11 RC |
| refractarias | 2 recaídas | |||
| Eriksson31 | EC piloto | 7 GW, 2 PAM refractarias | Rituximab + MMF, AZA, CF | 8 RC, 1 RP |
| 2 recaídas | ||||
| Brihaye33 | Serie de casos | 8 GW refractarias | Rituximab + otros inmunosupresores | 3 RC, 3 RP, |
| 2 SR | ||||
| Seo34 | Serie de casos | 8 GW refractarias | Rituximab | 8 respuesta |
| 5 recaídas | ||||
| Keogh35 | Prospectivo | 10 GW refractarias | Rituximab | 10 remisión |
| 1 recaída | ||||
| Aries36 | EC piloto | 8 GW refractarias | Rituximab + ciclofosfamida o MTX | 2 RC, 1 RP |
| 5 SR | ||||
| Stasi37 | Serie de casos | 8 GW, 2 PAM refractarias o recidiva | Rituximab | 9 RC |
| 1 RP | ||||
| Smith38 | EC piloto | 5 GW, 5 PAM, | Rituximab+ 1 dosis de ciclofosfamida | 9 RC, 1 RP |
| 1 SCS | 1 SR | |||
| Jones39 | Serie de casos | 65 vasculitis-ANCA refractarias | Rituximab | 49 RC, 15 RP,1 SR |
| 27 recaídas | ||||
| Taylor40 | Serie de casos | 10 GW oftálmica refractaria | Rituximab + ciclofosfamida | 10 RC |
| Martinez del Pero41 | Serie de casos | 34 GW refractarias | Rituximab | 21 RC, 9 RP, |
| 4 SR | ||||
| Stone42 | Ensayo clínico | 85 (GW y PAM)a | Rituximab | 63 RC |
| RAVE | 98 (GW y PAM)a | Ciclofosfamida | 52 RC | |
| Jones43 | Ensayo clínico | 33 (GW y PAM)b | Rituximab | 25 RC |
| RITUXVAS | 11 (GW y PAM)b | Ciclofosfamida | 9 RC |
GW: granulomatosis de Wegener; PAM: poliangeítis microscópica; RC: remisión completa; RP: remisión parcial; SCS: síndrome de Churg Strauss; SR: sin respuesta.
La mayoría de las crioglobulinemias mixtas (CM) se asocian a infección por el virus de la hepatitis C (VHC). El tratamiento combinado con interferón α-2b (IFN α-2b) y ribavirina ha demostrado ser superior para alcanzar la remisión que el tratamiento con IFN α-2b solo44–47, sin embargo son frecuentes las recaídas al interrumpir el tratamiento. El RTX podría ser una terapia alternativa en estos casos. Una reciente revisión48 analiza la evolución de 57 pacientes con CM asociada a VHC, en su mayoría resistentes o intolerantes a tratamientos previos. Se observó una remisión completa o parcial tras la administración del RTX en el 80% de los pacientes con afectación cutánea, en el 79% de los pacientes con artralgias, en el 93% de los que tenían neuropatía y en el 83% de los pacientes con glomerulonefritis. Después de una media de 6,7 meses, 14 pacientes recayeron y 8 de ellos alcanzaron una remisión completa tras un segundo ciclo de RTX.
El RTX parece ser más efectivo cuando se asocia al tratamiento antiviral con IFN y ribavirina, ya que las recaídas ocurren con más frecuencia cuando no hay un adecuado control virológico49. Otro factor que se ha asociado a la efectividad de la terapia con RTX en la CM es el tiempo de evolución de la enfermedad. Saadoun et al50, en un estudio piloto sobre la efectividad del RTX combinado con IFN y ribavirina en 16 pacientes con CM refractaria, observa que los pacientes que no respondían al tratamiento o que respondían de forma parcial tenían una duración de la enfermedad 3,6 veces superior a los pacientes que respondían de forma completa. Este hallazgo sugeriría que el tratamiento con RTX-IFN-ribavirina debería comenzarse en fases precoces de la enfermedad, sobre todo cuando hay una afectación orgánica importante.
En cuanto a la tolerancia al tratamiento con RTX en la CM, recientemente se ha publicado algunos casos de reacciones sistémicas severas en relación al tratamiento, como brotes severos de vasculitis y enfermedad del suero51. El RTX podría formar un complejo con las crioglobulinas con actividad factor reumatoide, conduciendo a un rápido crioprecipitado con reacciones sistémicas graves. Los autores recomiendan administrar el RTX con precaución en la vasculitis CM, siguiendo la pauta de 375mg/m2 y con plasmaféresis previa a la perfusión, en pacientes con títulos elevados de crioglobulinas.
Otras terapiasActualmente se están investigando una serie de nuevas terapias biológicas en el tratamiento de las vasculitis sistémicas, dirigidas a mecanismos patogénicos clave en el desarrollo de estas entidades. La mayoría de estas nuevas terapias se están ensayando en pacientes con vasculitis-ANCA refractarias, especialmente en la GW.
15-DeoxyspergualinaLa 15-deoxyspergualina (DSG) es un análogo sintético de la espergualina, que es un antibiótico producido por Bacillus laterosporus. Posee efectos inmunomoduladores sobre los linfocitos T, inhibiendo su proliferación, inhibe la activación de los monocitos y la producción de citoquinas. Varios estudios52–55 han demostrado su utilidad en el tratamiento de las GW refractarias, con un buen perfil de toxicidad, a pesar de la frecuente aparición de leucopenia. Los efectos parecen ser, sin embargo, pasajeros, con recaídas tras suspender el tratamiento, por lo que algunos autores opinan que su administración debería ser prolongada55.
La DSG podría ser una terapia prometedora en el tratamiento de las GW refractarias, aunque se necesitan estudios controlados para recomendar su uso.
Globulina antitimocíticaLa globulina antitimocítica (GAT) es una terapia que causa una rápida depleción de linfocitos T. Ha sido utilizada en un estudio prospectivo, no controlado, diseñado por el grupo EUVAS, que incluía 15 pacientes con GW refractarias o intolerantes a ciclofosfamida. Trece de estos pacientes respondieron al tratamiento, con una remisión completa (n=4) o parcial (n=9); sin embargo, se produjeron recaídas en 7 de estos pacientes a los 8 meses del tratamiento. Se produjeron 2 muertes tras la administración de la primera dosis de GAT, una debido a hemorragia pulmonar y otra debida a infección. Se observaron infecciones en 5 casos y enfermedad del suero en 2 casos56.
AlemtuzumabEl anticuerpo monoclonal humanizado anti-CD52, alemtuzumab (CAMPATH-1H), produce depleción selectiva de linfocitos T. Walsh et al57 han publicado los resultados a 5 años del tratamiento con alemtuzumab en 71 pacientes con vasculitis-ANCA refractarias. Aunque se consiguió una importante tasa de remisión (85%), la mayoría de ellos experimentaron recaídas. Hubo una alta mortalidad (31 muertes), así como una importante tasa de efectos adversos.
AbataceptEl abatacept es una proteína de fusión que bloquea la señal coestimuladora que interviene en la activación de los linfocitos T. En la GW, el linfocito T tiene un papel importante en la formación del granuloma, por lo que el abatacept podría ser de utilidad en esta entidad. En modelos animales, la Ig-CTLA4ha demostrado que puede prevenir la progresión de la glomerulonefritis autoinmune experimental58. Hasta el momento no se dispone de datos sobre su utilidad en el tratamiento de la GW.
ConclusionesSe están produciendo importantes avances en el tratamiento de las vasculitis sistémicas. Los agentes biológicos, dirigidos contra algunos de los mecanismos patogénicos implicados en estas enfermedades, pueden representar una aproximación más específica y menos tóxica al tratamiento de estos procesos. Es necesario seguir ampliando nuestro conocimiento sobre estos agentes, sobre su eficacia y sus posibles efectos a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.