Los tratamientos biológicos pueden ser el heraldo de la curación de la artritis reumatoide. Estos tratamientos dirigidos a dianas terapéuticas han cambiado el pronóstico de la enfermedad. El tocilizumab es un anticuerpo monoclonal humanizado contra el receptor de la interleucina 6. El tocilizumab se ha aprobado en diferentes países para el tratamiento de la artritis reumatoide moderada o grave. Se han publicado diferentes trabajos que han puesto de manifiesto la eficacia de tocilizumab en el tratamiento de la artritis reumatoide activa. Esta revisión versa sobre la seguridad y la dosificación del tocilizumab.
Biological therapies may herald the cure for rheumatoid arthritis. Targeted biologic therapies have changed the outcome of this disease. Tocilizumab is a humanized monoclonal antibody against the interleukin-6 receptor and has been approved in many countries for the treatment of moderate to severe rheumatoid arthritis. A number of clinical trials have demonstrated the efficacy of tocilizumab in active rheumatoid arthritis. This review summarizes the data on the safety and dosage of this drug.
La artritis reumatoide (AR) es una enfermedad inflamatoria sistémica crónica autoinmune que cursa con inflamación de la membrana sinovial y conduce a la destrucción de las articulaciones1,2. Para el desarrollo de la enfermedad se requiere una predisposición genética y múltiples factores ambientales no del todo definidos hasta la fecha. La AR afecta al 1% de la población, la mayoría mujeres, y generalmente entre la tercera y cuarta década de la vida. Esta enfermedad implica en la mayoría de ocasiones dolor crónico y discapacidad, con la consecuente disminución de la calidad de vida. Para prevenir el daño articular y la discapacidad, los médicos especialistas tienden a optar cada vez por tratamientos más específicos, dirigidos a dianas terapéuticas, siempre instaurados precozmente y con el objeto de alcanzar la remisión de la enfermedad1–7.
Actualmente se dispone de un gran abanico de opciones en el tratamiento de la AR. Sin embargo, el índice de fracaso terapéutico continúa siendo importante. Por esta razón existe una demanda continua de nuevos tratamientos. Hoy en día, para frenar la progresión de la AR disponemos de fármacos antirreumáticos modificadores de la enfermedad (FAME) tales como el metotrexato (MTX) y la leflunomida. Asimismo, también se cuenta con los fármacos biológicos. Se recomienda no iniciar un agente biológico hasta el fracaso terapéutico de un FAME no biológico. El primer agente biológico puede ser un antagonista del factor de necrosis tumoral alfa (TNF-α) o tocilizumab y abatecept. A pesar de los diferentes consensos de las Sociedades científicas de Reumatología, la elección de un tratamiento biológico recae en el facultativo responsable del paciente. En la práctica clínica se tiende a elegir en función de la experiencia previa, el perfil del paciente, la tolerabilidad, la disponibilidad, el precio y la seguridad del fármaco3–7.
Los tratamientos biológicos actúan sobre diversas dianas terapéuticas. Una de estas dianas terapéuticas es la interleucina-6 (IL-6), que promueve la activación de las células T y la diferenciación de las células B en células plasmáticas secretoras de inmunoglobulinas. Esta interleucina proinflamatoria es producida por múltiples células, y su importancia en la AR yace en su capacidad para estimular la diferenciación del osteoclasto que podría ser responsable de la destrucción articular3,8–12. La actividad de la AR se correlaciona con niveles aumentados de IL-6 en líquido sinovial y en el suero de pacientes enfermos11. Recientemente se dispone en el arsenal terapéutico del tocilizumab (TCZ), un nuevo fármaco biológico que actúa como anticuerpo contra los receptores de la IL-6, bloqueando su unión12.
El TCZ es el primer tratamiento biológico que actúa contra esta diana terapéutica. Es un anticuerpo monoclonal inhibidor del receptor de la IL-6. Se han realizado varias revisiones sistemáticas a partir de estudios multicéntricos aleatorizados que han demostrado la eficacia terapéutica del TCZ en la AR,3,12–22. El TCZ demostró disminuir la actividad de la enfermedad y aumentar la calidad de vida de los pacientes afectos de AR. El TCZ es superior en monoterapia al MTX en aquellos pacientes sin fracaso terapéutico, y más efectivo que los FAME en los pacientes con fracaso terapéutico previo. Al comparar el TCZ con el MTX en monoterapia resulta ser más eficaz en múltiples escalas de pronóstico y evaluación clínica, como la respuesta ACR20, ACR50, DAS28, HAQ. Por otro lado, la combinación de TCZ con FAME resultó más eficaz que los FAME en monoterapia. También es eficaz en pacientes con fracaso terapéutico a otros tratamientos biológicos12–22. El TCZ demostró en combinación con el MTX inhibir la progresión del daño radiológico. En España el tratamiento con TCZ está autorizado en pacientes con AR y fracaso terapéutico a FAME, y también como primer tratamiento biológico6.
Las limitaciones más comentadas en estos estudios son el corto seguimiento de los pacientes y la ausencia de resultados a largo plazo de seguridad23. Por ello, esta revisión pretende centrarse en aspectos de seguridad y dosificación de este nuevo fármaco.
Dosificación del tocilizumabLa dosis recomendada es de 8mg/kg de peso corporal, con un mínimo de 480mg, administrados una vez cada 4 semanas. Se administra como perfusión intravenosa durante una hora. La dosis de TCZ fue objeto de debate, dado que los trabajos iniciales fueron diseñados con dosis de 2mg/kg, de 4mg/kg y de 8mg/kg. Los trabajos pivotales evidenciaron que la dosis con la que se obtiene mejor respuesta es la de 8mg/kg. Los pacientes con AR tratados con esta dosis tienen 3,2 veces más posibilidades de alcanzar un ACR50: porcentaje absoluto, 39% versus 10% en el grupo placebo. Si se pondera con el índice DAS, tienen 8,7 veces más de alcanzar la remisión (31% versus 3%)3.
En efecto en el estudio RADIATE el índice ACR20 se alcanzó a las 24 semanas en un 50, 34 y 10,1% de pacientes tratados con 8mg/kg, 4mg/kg y el grupo control, respectivamente. Es más, los pacientes respondieron, sin tener en cuenta el tratamiento con anti-TNF-α previo. El índice DAS28 de remisión (DAS28=2,6) a la semana 24 estaba claramente relacionado con la dosis: 30,1, 7,6 y 1,6% en los grupos tratados con 8mg/kg, 4mg/kg y control, respectivamente14. El estudio LITHE evidenció a las 52 semanas un ACR20 del 56, 47 y 25% en los pacientes tratados con 8mg/kg, 4mg/kg y placebo. El ACR70 fue asimismo de 20, 16 y 4% en los grupos tratados con 8mg/kg, 4mg/kg y placebo, respectivamente. El índice DAS28 de remisión fue del 47, 30 y 8% a la semana 5222.
En el estudio OPTION, 632 pacientes con AR con enfermedad activa (moderada o severa) se asignaron aleatoriamente a TCZ 4mg/kg, 8mg/kg y placebo. Los pacientes reclutados tenían una duración media de la enfermedad de 7,5 años y un índice DAS28 con 6,8 articulaciones tumefactas y 32 articulaciones dolorosas. A las 24 semanas se observó que el 59% de pacientes tratados con TCZ a dosis de 8mg/kg alcanzaban un ACR20. Por el contrario, el 48% de pacientes tratados con 4mg/kg y el 26% en el grupo control alcanzaron el ACR20. Finalmente, si se ponderaba con el índice EULAR, la respuesta a las 24 semanas fue del 79,5% con 8mg/kg, del 61,9% con 4mg/kg y del 34,8% con placebo. Un trabajo reciente, abierto, en una población japonesa con AR tratados con TCZ a dosis de 8mg/kg evidenció una remisión del 80%20. El estudio SATORI —en el que los pacientes fueron tratados a dosis de 8mg/kg— puso de manifiesto que a la semana 24 el 80% de los pacientes tratados con esta dosis alcanzaban un ACR20, mientras que en el grupo placebo eñ 20% alcanzaron dicha respuesta19. Una revisión reciente de trabajos aleatorizados mostró la efectividad del TCZ, 4-8mg cada 4 semanas, con o en combinación con MTX. No obstante, los porcentajes de alcanzar la remisión con dosis de 8mg/kg eran mayores que con 4mg/kg, y las reacciones adversas eran similares12.
Así pues, la dosis de TCZ más efectiva para el control de la AR es de 8mg/kg. La seguridad del fármaco biológico no disminuye con estas dosis.
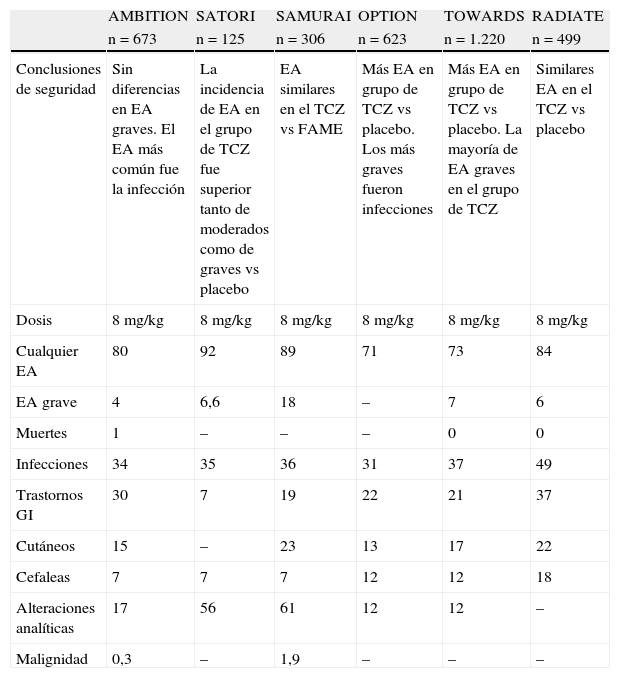
SeguridadEl desarrollo del TCZ se basa en 7 estudios pivotales que reclutaron a más de 3.446 pacientes. En la tabla 1 se resumen los efectos adversos descritos en estos estudios completos. El estudio LITHE no se incluye en la tabla, ya que es un estudio cuyo objetivo principal es la inhibición de la progresión radiológica y la seguridad no está tan pormenorizada como en el resto de estudios. LITHE es un estudio aleatorizado de 2 años de duración, doble ciego, con grupo control placebo que comparaba pacientes tratados con MTX y que recibían simultáneamente TCZ a dosis de 4 u 8mg/kg o placebo22. AMBITION es un estudio internacional de fase III, de 24 semanas de duración, aleatorizado, doble ciego, con grupo placebo, que evaluaba la eficacia y seguridad del TCZ en monoterapia versus MTX en pacientes con AR activa que no habían recibido previamente tratamiento con MTX y/o agentes biológicos21. SATORI es un estudio multicéntrico de 24 semanas de duración, aleatorizado, doble ciego, con grupo control placebo, que comparaba la eficacia y la seguridad del TCZ en monoterapia en pacientes que habían recibido MTX con fracaso terapéutico19. SAMURAI es un estudio de 52 semanas de duración de fase III, multicéntrico, aleatorizado y controlado, que evaluaba la capacidad del TCZ en monoterapia de inhibir la progresión del daño estructural en pacientes con AR precoz18. OPTION es un estudio de 24 semanas de duración, fase III, internacional, aleatorizado, doble ciego, con grupo control placebo y estudio paralelo que comparaba la eficacia y la seguridad del TCZ en pacientes con AR activa que recibían como tratamiento de fondo MTX20. TOWARDS es un estudio de 24 semanas de duración, internacional, doble ciego, con grupo placebo control, que estudia la eficacia y la seguridad del TCZ combinado con FAME en pacientes con AR activa15. Y por último, RADIATE es un trabajo de 24 semanas de duración, internacional, aleatorizado y doble ciego, con grupo placebo control, fase III, que evaluaba la eficacia y la seguridad del TCZ en pacientes con AR refractaria a tratamiento con agentes biológicos inhibidores del TNF-α14. La ficha técnica del TCZ incluye información de 5 de estos estudios. En la evaluación de seguridad se han incluido todos los pacientes que recibieron al menos una dosis de TCZ (n=3.577). El 82% de la población en estudio eran mujeres, con una media de edad de 52 años.
Resumen de efectos adversos (EA) descritos en varios estudios controlados aleatorizados. El número de EA es el porcentaje sobre el valor total de pacientes
| AMBITION | SATORI | SAMURAI | OPTION | TOWARDS | RADIATE | |
| n=673 | n=125 | n=306 | n=623 | n=1.220 | n=499 | |
| Conclusiones de seguridad | Sin diferencias en EA graves. El EA más común fue la infección | La incidencia de EA en el grupo de TCZ fue superior tanto de moderados como de graves vs placebo | EA similares en el TCZ vs FAME | Más EA en grupo de TCZ vs placebo. Los más graves fueron infecciones | Más EA en grupo de TCZ vs placebo. La mayoría de EA graves en el grupo de TCZ | Similares EA en el TCZ vs placebo |
| Dosis | 8 mg/kg | 8 mg/kg | 8 mg/kg | 8 mg/kg | 8 mg/kg | 8 mg/kg |
| Cualquier EA | 80 | 92 | 89 | 71 | 73 | 84 |
| EA grave | 4 | 6,6 | 18 | – | 7 | 6 |
| Muertes | 1 | – | – | – | 0 | 0 |
| Infecciones | 34 | 35 | 36 | 31 | 37 | 49 |
| Trastornos GI | 30 | 7 | 19 | 22 | 21 | 37 |
| Cutáneos | 15 | – | 23 | 13 | 17 | 22 |
| Cefaleas | 7 | 7 | 7 | 12 | 12 | 18 |
| Alteraciones analíticas | 17 | 56 | 61 | 12 | 12 | – |
| Malignidad | 0,3 | – | 1,9 | – | – | – |
FAME: fármacos antirreumáticos modificadores de la enfermedad; GI: gastrointestinales; TCZ: tocilizumab.
Los efectos secundarios más frecuentes descritos en los estudios controlados fueron infecciones del aparato respiratorio, nasofaringitis, cefalea, hipertensión y aumento de las transaminasas. Las infecciones graves y la hipertransaminemia fueron las dos causas más frecuentes para interrumpir el tratamiento. La causa más frecuente de muerte en pacientes en tratamiento con TCZ fue la sepsis3,12–22.
InfeccionesLa IL-6 es estimulada por componentes de virus y bacterias, y es uno de los mediadores más importantes de la respuesta innata. Por lo tanto, era previsible que el TCZ tuviese un papel inmunosupresor en el desarrollo de la inmunidad contra infecciones víricas y bacterianas. En los estudios revisados, el grupo de pacientes tratados con TCZ presenta un mayor número de infecciones y de mayor gravedad que el grupo placebo. No obstante los datos son similares al compararlos con el grupo tratado con MTX. Las infecciones más frecuentes fueron las respiratorias. Las infecciones graves fueron neumonías, infecciones del tracto urinario, celulitis, herpes zoster, gastroenteritis, diverticulitis y artritis infecciosa. Por todo ello, el TCZ no debe ser administrado en pacientes con infecciones activas, en los que hayan estado expuestos a tuberculosis o en los que tengan antecedentes de infecciones graves u oportunistas. Se debe instruir a los pacientes de la necesidad de acudir a un centro médico cuando tengan fiebre3,12.
Reacciones perfusionalesLos efectos adversos relacionados con la perfusión se describen en un 8% de los pacientes. En su mayoría se presentan en la primera y segunda perfusión. La cefalea y las reacciones cutáneas fueron las más comunes en las primeras 48h después de la perfusión. La hipertensión arterial y las reacciones de hipersensibilidad fueron menos frecuentes. El 2% de los pacientes desarrollaron anticuerpos contra el TCZ, pero sólo el 10% de ellos tuvieron que abandonar el tratamiento por reacciones de hipersensibilidad3,12–22. En los estudios pivotales se han descrito 9 reacciones perfusionales, 5 con dosis de 4mg/kg y 4 con dosis de 8mg/kg. Ninguna de ellas se consideró grave y se resolvieron. Tal como se ha comentado, las reacciones perfusionales se suelen presentar durante las primeras perfusiones. Recientemente se ha comunicado un caso de anafilaxia grave. Se recomienda que los hospitales de día estén provistos de fármacos para tratar las reacciones perfusionales.
Alteraciones gastrointestinalesLas alteraciones de tracto gastrointestinal fueron más frecuentes en los pacientes tratados con TCZ. Las perforaciones gastrointestinales resultaron aparentemente ser superiores a las esperadas en pacientes con AR. Cabe destacar que la mayoría de los pacientes que desarrollaban esta complicación estaban tomando además antiinflamatorios no esteroideos, glucocorticoides y/o MTX. A pesar de que recientemente se ha demostrado que el TCZ no aumenta la frecuencia de perforaciones gastrointestinales, es aconsejable aleccionar a los pacientes que ante cualquier episodio de dolor abdominal se solicite valoración médica3,12–22.
NeutropeniaSe ha descrito la disminución del número de neutrófilos sin disminución de otros parámetros hematológicos. Se ha observado después de la primera dosis, y en algunos casos se mantiene hasta la siguiente. Sin embargo, las neutropenias graves por debajo de 0,5×109/l son infrecuentes. En la mayoría de casos son descensos transitorios y no requieren tratamiento. Hasta la fecha no se ha demostrado asociación entre la disminución de neutrófilos y el riesgo de infección3,12–22. En el caso de neutropenias por encima de 1,0×109 se recomienda mantener la dosis. Si la neutropenia se sitúa entre 0,5-1,0×109, se interrumpe el tratamiento y se reinicia a dosis de 4mg/kg cuando la cifra de neutrófilos es superior a 1,0×109, y según la evolución clínica puede instaurarse una dosis de 8mg/kg. En el caso de neutropenias por debajo de 0,5×109, se interrumpe el tratamiento.
Aumento de transaminasasEn algunos pacientes fue necesaria la disminución de la dosis o la retirada del TCZ por hipertransaminemia. Este efecto adverso fue superior en el grupo de pacientes tratados de forma simultánea con TCZ y MTX. Los parámetros hepáticos se corregían al retirar o disminuir la dosis del fármaco3,12–22. En el caso de aumento de las transaminasas se recomienda: si el aumento es de 3 veces el límite superior de la normalidad, se debe ajustar o retirar el tratamiento con FAME asociados que puedan ser hepatotóxicos. Si el incremento continúa en estas cifras, se reduce la dosis de TCZ a 4mg/kg o se interrumpe temporalmente el fármaco hasta que los valores de las transaminasas se normalicen. Según criterio clínico y cuando las transaminasas muestren cifras normales, se reintroduce a dosis de 4 u 8mg/kg. Si las transaminasas están de 3 a 5 veces por encima de lo normal, hay que interrumpir el tratamiento hasta que las cifras de transaminasas estén sólo 3 veces por encima de lo normal. Puede entonces reiniciarse a dosis de 4 u 8mg/kg. Si continúan los valores 3 veces por encima de la normalidad, debe interrumpirse. Si el aumento de transaminasas persiste, se interrumpe el tratamiento. En el caso de aumento de transaminasas 5 veces por encima de la normalidad, se interrumpe el tratamiento.
DislipidemiaLa enfermedad cardiovascular prematura es característica de la afectación extraarticular de la AR. Ésta conlleva un mayor riesgo de infarto de miocardio, insuficiencia cardíaca y enfermedad vascular cerebral. En los estudios preliminares el riesgo de infarto de miocardio resultó superior en el grupo tratado con TCZ. Sin embargo, el mejor control de la actividad inflamatoria de la AR con TCZ podría contribuir a la disminución del riesgo cardiovascular a largo plazo. Por otro lado, en la semana 6 se observó una elevación de los lípidos, pero los niveles se estabilizaban en este punto y respondían al tratamiento con hipolipemiantes. Los pacientes con enfermedades inflamatorias crónicas tienen valores de lípidos inferiores a los de la población general. Un incremento en los lípidos se ha asociado con otros agentes biológicos, como los anti-TNF. La recomendación actual es realizar un control de la lipidemia a los 6 meses, pero podría ser recomendable un control más estricto en pacientes con otros factores de riesgo cardiovascular, como diabetes o hipertensión. Cabe destacar que la IL-6 podría ser un marcador de arteriosclerosis carotídea24, y que valores elevados son un factor de riesgo de ictus en pacientes con fibrilación auricular25. En este campo sería recomendable la realización de estudios de mayor duración para comprobar si tiene más peso el aumento de los factores de riesgo cardiovascular del TCZ, o su efecto cardioprotector al controlar la cascada inflamatoria3,12–22.
NeoplasiasLas neoplasias son más frecuentes en pacientes con AR, y más aún si realizan tratamiento concomitante con algunos FAME. El riesgo es alto en enfermedades linfoproliferativas. La IL-6ha demostrado ser un potente factor de crecimiento en la patogénesis de algunas neoplasias en modelos experimentales. Sin embargo, también parece tener un papel como agente antitumoral. En los estudios realizados por el momento las neoplasias no parecen estar aumentadas en comparación con grupos placebo o con grupos tratados con MTX, pero todos ellos son estudios de escasa duración3,12–22.
ConclusionesEl TCZ es el primer fármaco biológico para la AR que inhibe la IL-6. No existen hasta la fecha comparaciones directas del TCZ con otros agentes biológicos en el tratamiento de la AR. La frecuencia de administración mensual lo convierte en una opción atractiva para los pacientes y los médicos. Así mismo, es una opción en los pacientes que han presentado un fracaso terapéutico con FAME u otros fármacos biológicos. Se requieren más estudios de mayor duración y con un mayor número de pacientes, con especial atención en las infecciones y el riesgo cardiovascular. La dosis más efectiva de TCZ es de 8mg/kg. También se deberían incluir pacientes con más comorbilidad, y centrarse en la seguridad como primer objetivo. No obstante, los efectos adversos descritos por el momento son leves o moderados, y comparables con placebo. Por todo ello, los estudios realizados hasta la fecha apoyan el uso del TCZ en los pacientes con AR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.