La osteoporosis (OP) es una enfermedad sistémica que se caracteriza por aumento del riesgo de fractura. Generalmente se produce por una alteración del metabolismo óseo de diferentes causas patogénicas. Los factores exógenos son importantes, fundamentalmente los fármacos. A continuación se revisan diferentes fármacos que se utilizan frecuentemente y que pueden inducir OP.
Osteoporosis is a systemic disease characterized by an increased risk of fracture and is usually provoked by an alteration of bone metabolism of multiple pathogenic causes. Exogenous risk factors are important, mainly drugs. The present article reviews several commonly used drugs that can induce osteoporosis.
La osteoporosis (OP) es una enfermedad sistémica del esqueleto que se caracteriza por una disminución de la resistencia del hueso que aumenta el riesgo de fractura1.
La OP se produce debido a una alteración del metabolismo óseo resultado de múltiples causas y mecanismos patogénicos. Entre los diferentes factores de riesgo exógenos, los fármacos juegan un papel muy importante.
El fármaco del que más conocemos su influencia sobre el hueso es el glucocorticoide, pero también pueden alterar el metabolismo óseo muchos otros (tabla 1).
Fármacos que pueden disminuir la densidad mineral ósea
| Glucocorticoides orales |
| L-tiroxina |
| Heparina |
| Antiepilépticos |
| Neurolépticos |
| Quimioterapia |
| GnRH |
| Inhibidores de la aromatasa |
| Metotrexato |
| Ciclosporina A |
| Vitamina A y retinoides sintéticos |
| Teofilina |
| Inhibidores de la bomba de protones |
| Antidepresivos: tricíclicos e inhibidores selectivos de la serotonina |
| Litio |
| Diuréticos de asa |
| Tiazolidinadionas |
GnRH: hormona liberadora de gonadotropinas.
En esta revisión intentaremos conocer los fármacos de los que hay más evidencia científica sobre su influencia en el hueso y qué estrategia seguir ante un enfermo que inicie o ya esté tomando estos fármacos.
GlucocorticoidesLa OP inducida por glucocorticoides (GC) es la causa más frecuente de OP secundaria.
Los GC por vía oral se utilizan en el 0,5–1% de la población y su administración aumenta con la edad y en las mujeres de más de 55 años2.
Muchas veces la enfermedad por la cual se administran los GC también influye en la pérdida de densidad mineral ósea (DMO).
Los especialistas que utilizan los GC para enfermedades crónicas son los neumólogos, para tratar el asma bronquial y la enfermedad pulmonar obstructiva crónica, los reumatólogos, para tratar las artritis inflamatorias crónicas, los digestólogos y los nefrólogos. Otros especialistas que utilizan dosis altas de GC pero con duración más limitada son los dermatólogos, los hematólogos, los endocrinólogos y los oftalmólogos.
La OP inducida por GC se produce por un rápido aumento de la resorción y una fase más lenta de disminución de la formación ósea.
La combinación de un aumento del RANK-L (ligando de unión al receptor activador de NF-kB) y una disminución de la osteoprotegerina es la causa del rápido aumento de la resorción. Paralelamente, se produce una inhibición de la maduración y de la función de los osteoblastos que provoca una disminución de la formación ósea y de la mineralización de la matriz. Otro efecto que producen los GC es la inhibición de los factores de crecimiento análogos de la insulina que también intervienen en la formación de la matriz; esta acción puede ser revertida con la hormona paratiroidea (PTH) in vitro, lo que podría explicar la eficacia del tratamiento con PTH3.
De forma sistémica, la resorción ósea se encuentra aumentada debido a una situación de hiperparatiroidismo y de hipogonadismo secundario. Los GC disminuyen la absorción de calcio intestinal y la reabsorción tubular renal de calcio, y este balance negativo produce la elevación de la PTH3.
En la morfometría de los huesos con OP inducida por los GC observamos un predominio del adelgazamiento de las trabéculas óseas4.
Durante el primer año de tratamiento, la pérdida de masa ósea es de más de un 5% en aquellos que requieren dosis superiores a 7,5mg/día de prednisona, a expensas sobre todo del hueso trabecular que es el que predomina en los cuerpos vertebrales, y en este período tienen lugar el 50% de las fracturas.
Entre un 50–80% de los pacientes tratados con GC va a presentar OP y entre un 30–50% va a desarrollar fracturas5,6.
La intensidad de la pérdida de la DMO depende de la dosis diaria de GC, del tiempo de administración y, sobre todo, de la dosis acumulada. La disminución de la DMO no es uniforme, es más rápida en las primeras semanas o meses de tratamiento. No hay diferencia entre sexos, aunque la pérdida es más rápida en ancianos y mujeres posmenopáusicas. Se ha observado una tendencia a la recuperación de la DMO al dejar los GC7. La administración a días alternos no previene la pérdida8.
El riesgo de fractura a diferencia de la pérdida de DMO se relaciona sobre todo con la dosis diaria y en menor proporción con la dosis acumulada. Aparece entre los 3 y 6 meses del inicio del tratamiento y es independiente de la DMO6.
Los huesos esponjosos son los que más se afectan: las vertebras y las costillas, por tanto, son los más susceptibles a fracturas.
No se puede establecer con exactitud la dosis mínima por debajo de la cual no se produce pérdida de DMO, pero la mayoría de los autores consideran que dosis iguales o superiores a 7,5mg de prednisona administradas durante como mínimo 3 meses disminuyen la DMO y aumentan el riesgo de fractura7. El riesgo también aumenta en los casos de corticoterapia crónica a dosis equivalentes a 5mg de prednisona diaria.
Los efectos de los GC parenterales intermitentes y los GC inhalados no están tan claros9.
A pesar de ello, diversos estudios muestran que los facultativos recomiendan profilaxis en la mitad de los pacientes que reciben tratamiento con GC y tan sólo el 15% recibe tratamiento antirresortivo10. Esto sugiere que muchos facultativos desconocen el problema o la estrategia por realizar en estos casos.
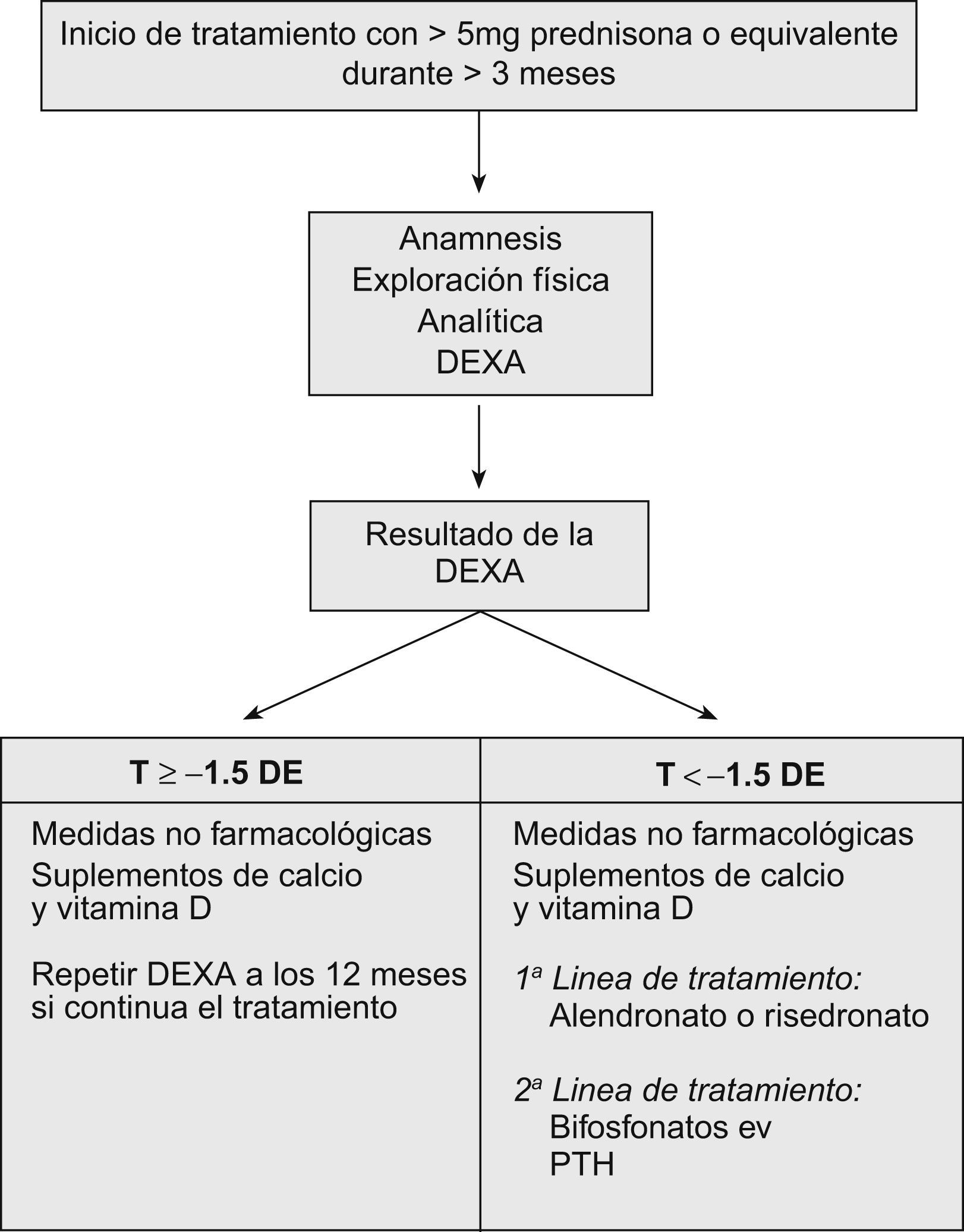
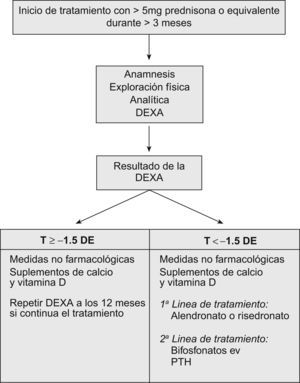
Estrategia (fig. 1)9,11–13Ante todo paciente en tratamiento con GC deberemos realizar una anamnesis, una exploración física, una analítica básica y la valoración de la DMO mediante densitometría ósea.
La anamnesis recoge los factores de riesgo independientes de los GC que aumenten el riesgo de fractura: edad, presencia de fracturas previas, historia familiar de OP y fracturas. También recogeremos las enfermedades que puedan cursar con disminución de la masa ósea, fármacos, tóxicos (tabaco, alcohol), vida sedentaria, dieta pobre en calcio e insolación y la historia ginecológica.
La exploración física debe incluir el peso y la talla para poder calcular el índice de masa corporal.
La DMO se valorará con una densitometría dual con fuente de rayos X, que en la actualidad es la única técnica validada para el diagnóstico de la OP y determinación del riesgo de fractura. La Organización Mundial de la Salud (OMS) ha establecido unos criterios diagnósticos (tabla 2).
Criterios diagnósticos según la Organización Mundial de la Salud
| Normal: DMO superior o igual a -1 DE de la T-score |
| Osteopenia: DMO entre -1 y -2,5 DE de la T-score |
| Osteoporosis: DMO inferior o igual a -2,5 de la T-score |
| Osteoporosis establecida: osteoporosis+fracturas |
Ginebra: WHO; 1994. p. 2–25.
DE: desviación estándar; DMO: densidad mineral ósea.
En caso de presentar valores densitométricos de OP, también se realizarán radiografías de la columna dorsal y lumbar para valorar fracturas asintomáticas.
La analítica debería incluir un hemograma, función renal y hepática, calcemia y fosfatemia, fosfatasas alcalinas totales, proteínas totales y albúmina, calcio en orina de 24h, vitamina D (25OH), PTH, hormona tirotropa (TSH) y testosterona en el varón. De forma rutinaria no se aconseja realizar marcadores de recambio óseo.
La estrategia por seguir ante la prevención o el tratamiento de la OP inducida por GC debe incluir: utilizar la dosis mínima necesaria de GC, cambiar hábitos de vida y, en casos concretos, introducir fármacos que inhiban la resorción o estimulen la formación ósea.
Dentro de las medidas no farmacológicas se recomienda realizar ejercicio físico de forma regular, este ejercicio debe implicar una actividad de carga, como caminar o correr; eliminar tóxicos, como el tabaco o el alcohol, y asegurar una ingesta de 1.500mg de calcio al día y derivados de la vitamina D (800U/día de colecalciferol), ya sea mediante la dieta o con suplementos.
Los bifosfonatos son el tratamiento de elección y los fármacos más estudiados para la OP inducida por GC. Los estudios más importantes se han realizado con risedronato (5mg/día) y alendronato (10mg/día), que han demostrado un aumento de la DMO lumbar y femoral y una reducción del riesgo de fractura vertebral14–19. La limitación de estos fármacos viene dada por los efectos secundarios que pueden producir en la mucosa esofagogástrica y la absorción variable. La posología semanal20, mensual o los bifosfonatos endovenosos reducen estos problemas. El ibandronato (2mg endovenoso cada 3 meses) también ha demostrado un aumento de la DMO lumbar y femoral y una reducción del riesgo de fracturas vertebrales en pacientes con OP inducida por GC21,22. El pamidronato (90mg endovenoso en dosis única o una primera infusión de 90mg seguido de infusiones de 30mg cada 3 meses) también ha demostrado un aumento de la DMO lumbar y femoral al año de tratamiento, aunque en este estudio no se valoraron las fracturas23. El último bifosfonato que ha demostrado su eficacia en la OP inducida por GC es el ácido zoledrónico; una única infusión endovenosa de 5mg es igual de eficaz que el risedronato (5mg/día) en el aumento de la DMO vertebral y femoral24.
El risedronato, el alendronato y el ibandronato son los únicos fármacos asociados a una reducción de la incidencia de fracturas vertebrales.
La PTH administrada de forma intermitente estimula la formación ósea más que la resorción. La teriparatida (1-34) PTH parece tener un papel beneficioso en la OP secundaria a GC. Un reciente estudio compara la teriparatida (20mg/día s.c.) con el alendronato (5mg/día v.o.) en pacientes con OP que inician tratamiento con un mínimo de 5mg de prednisona al día durante al menos 3 meses. A los 12 meses de tratamiento el grupo de la teriparatida presenta un aumento de la DMO lumbar y femoral superior al grupo del alendronato. El grupo de la teriparatida también presentó menos fracturas vertebrales que el grupo del alendronato, pero el número de fracturas fue demasiado pequeño para obtener conclusiones25.
Los estudios realizados con calcitonina muestran un aumento de la DMO en la columna lumbar, pero no disminuye el riesgo de fracturas vertebrales, por lo que no se considera un tratamiento de primera elección26.
No se han realizado estudios con raloxifeno ni con ranelato de estroncio.
Los últimos estudios se han realizado en modelo murino con denosumab (anticuerpo monoclonal humano contra el RANK-L) con resultados esperanzadores27.
Según las guías9,11, se recomienda realizar tratamiento antirresortivo a los pacientes con al menos osteopenia (T-score<-1,5 DE), según los criterios de la OMS, que tengan que realizar tratamiento durante más de 3 meses con dosis igual o superior a 5mg de prednisona o equivalente.
El tratamiento de elección son los bifosfonatos (alendronato o risedronato) para mujeres posmenopáusicas y hombres. Se recomienda utilizar los bifosfonatos con prudencia en las mujeres premenopáusicas, porque no se conoce el efecto sobre el fetus en caso de embarazo.
Tratamiento oncológicoLos pacientes oncológicos tienen un riesgo aumentado de padecer OP debido a los efectos de la quimioterapia, la radioterapia, el tratamiento hormonal y el tratamiento no hormonal.
La quimioterapia adyuvante se asocia a una amenorrea temporal o permanente debido a la toxicidad directa sobre el ovario. La incidencia de la insuficiencia ovárica depende del tipo de quimioterapia, la dosis acumulada y la edad de la paciente. Mujeres con cáncer de mama presentan al año de tratamiento con quimioterapia adyuvante una disminución de la DMO lumbar (6–7,5%) y del cuello femoral (2–4,5%)28–30.
La introducción de la terapia hormonal coadyuvante para el cáncer de mama ha supuesto un aumento de la supervivencia y un descenso de las recidivas.
Durante muchos años el tratamiento estándar de las pacientes posmenopáusicas con cáncer de mama y receptores estrogénicos positivos ha sido el tamoxifeno (modulador selectivo de los receptores de estrógenos). Éste preserva la DMO y reduce el riesgo de fracturas en mujeres posmenopáusicas. En mujeres premenopáusicas el tamoxifeno se asocia a una disminución de la DMO en la columna lumbar y la cadera, esto es debido a que no tiene el mismo efecto que los estrógenos31.
La llegada de los inhibidores de la aromatasa (IA) ha cambiado las pautas terapéuticas oncológicas. Actualmente, el tratamiento de las pacientes con cáncer de mama hormonodependiente es con los IA, ya sea de inicio durante 5 años o tras dos o tres años de tratamiento con tamoxifeno.
Los IA bloquean la conversión de andrógenos a estrógenos en los tejidos periféricos de mujeres menopáusicas. Se clasifican en no esteroideos, como el anastrazol y el letrozol, y esteroideos, como el exemestano32. Estos fármacos han demostrado superioridad frente al tamoxifeno para la supervivencia en el cáncer de mama hormonodependiente, pero también contribuyen de forma importante en la pérdida del hueso. Esta pérdida de DMO es más rápida que en la menopausia y empeora con la duración del tratamiento. Los estudios muestran un aumento de los marcadores de remodelado óseo y una disminución de la DMO, pero faltan estudios para confirmar su efecto sobre el riesgo de fracturas30,31.
Los análogos de la hormona liberadora de gonadotropinas (GnRH) tienen un efecto antigonadotrópico en hombres y mujeres. Se utilizan para el tratamiento del cáncer de próstata y la endometriosis. Éstos producen a los 6–12 meses de tratamiento un rápido aumento de la resorción ósea, pérdida del hueso de predominio trabecular y aumento del riesgo de fracturas. Un estudio realizado para valorar el riesgo de fracturas de pacientes con cáncer de próstata muestra cómo el tratamiento con análogos de la GnRH y la dosis recibida son los principales factores de riesgo33.
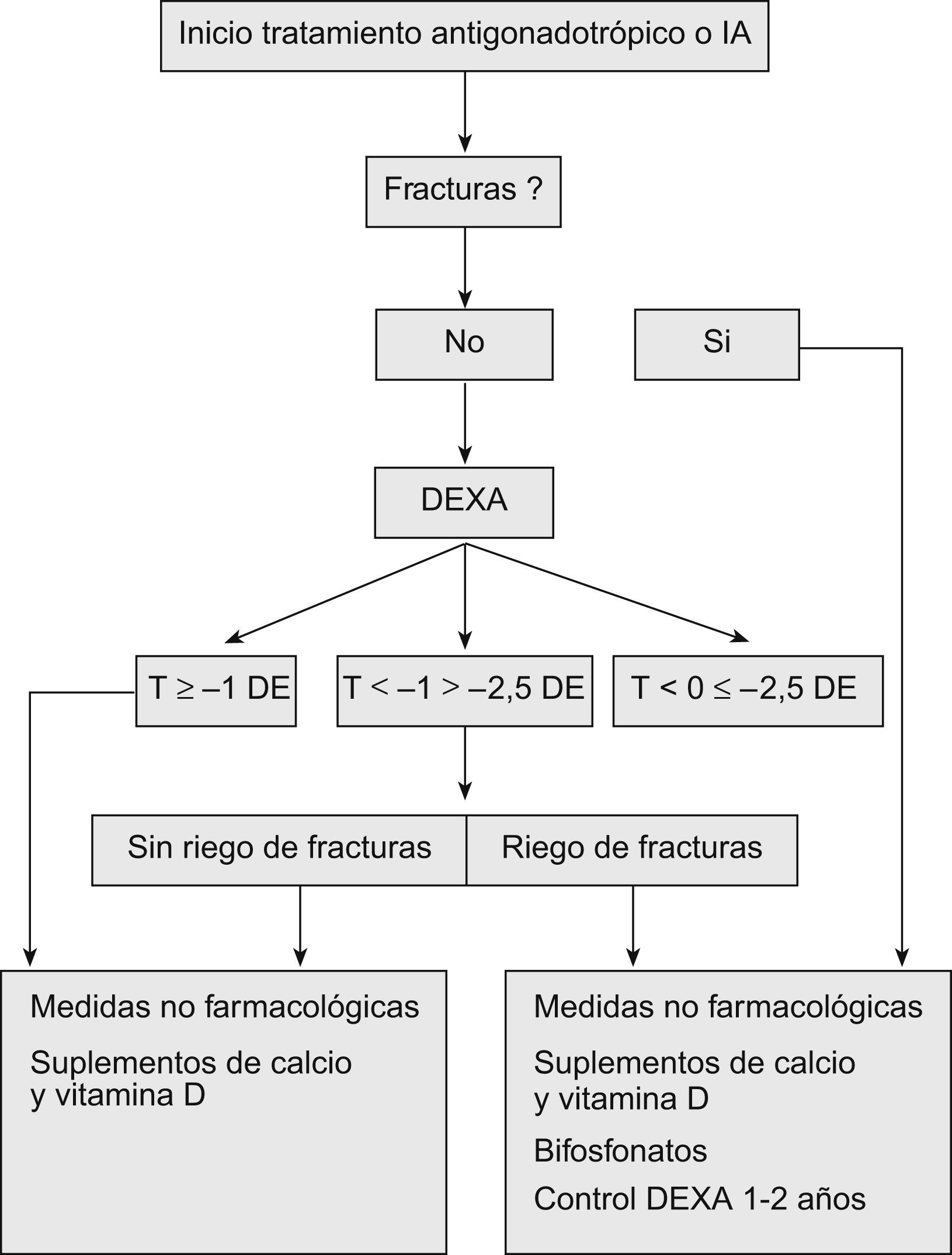
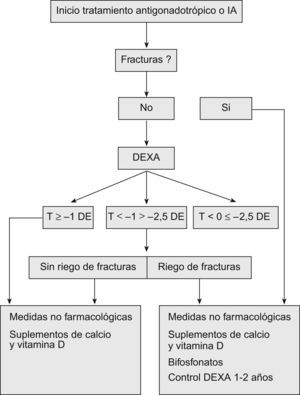
La Sociedad Americana de Oncología recomienda realizar una valoración del riesgo de fracturas y una densitometría dual con fuente de rayos X a todos los pacientes que empiecen un tratamiento que produzca hipogonadismo o con IA (fig. 2).
Se recomiendan medidas no farmacológicas para todos los pacientes así como una ingesta adecuada de calcio y vitamina D. El tratamiento de elección son los bifosfonatos (alendronato, risedronato, ibandronato, pamidronato o ácido zoledrónico), que se iniciará en el caso de presentar valores de T-score ≤−2,5 DE, fracturas por fragilidad o en pacientes con osteopenia y factores de riesgo para fracturas34.
Estudios en pacientes posmenopáusicas con cáncer de mama en tratamiento con IA y tratamiento con risedronato (35mg semanal) o ácido zoledrónico (4mg endovenoso cada 6 meses) han demostrado una disminución de los marcadores de remodelaje óseo y un aumento de DMO en la columna35,36.
Los bifosfonatos orales (alendronato y risedronato) en pacientes con cáncer de próstata no metastásicos y deprivación andrógena muestran resultados variables30. El ácido zoledrónico y el pamidronato endovenoso previene la pérdida de DMO, pero el ácido zoledrónico, además, aumenta la DMO en la columna y la cadera37,38. Desafortunadamente estos estudios no tienen un seguimiento suficiente para detectar cambios en la incidencia de fracturas.
La monitorización se recomienda cada 1–2 años para los pacientes osteopénicos u osteoporóticos y cada 2–5 años para los pacientes con valores normales de DMO.
L-tiroxinaEs conocido que el hipertiroidismo produce un aumento del remodelado óseo a favor de la resorción, pero menos conocido es el efecto del hipertiroidismo subclínico sobre el metabolismo óseo.
Actualmente, la hormona tiroidea se utiliza a dosis fisiológicas para suplir un hipotiroidismo de cualquier etiología o a dosis que inhibe la secreción de la TSH. Las dosis inhibidoras están indicadas en pacientes con tiroidectomía total debido a un carcinoma tiroideo, para disminuir el tamaño del bocio multinodular o difuso y para prevenir la recidiva después de la cirugía. Para conseguir la inhibición de la TSH se necesitan dosis suprafisiológicas de L-tiroxina39.
La disminución de la DMO es un posible efecto adverso de este tratamiento. Los estudios realizados muestran resultados contradictorios. Mientras unos concluyen que la terapia con L-tiroxina a dosis supresivas puede producir una disminución de la DMO, sobre todo del hueso cortical (la cadera y el radio) y especialmente en mujeres posmenopáusicas (disminución no uniforme y más rápida a los 6 meses de haber iniciado el tratamiento)39, otros no muestran diferencias significativas con el grupo control40.
En el 2004 la guía americana para el diagnóstico y tratamiento de las enfermedades subclínicas del tiroides concluyó que el hipertiroidismo subclínico exógeno en mujeres posmenopáusicas puede ocasionar una pérdida significativa de DMO, mientras que en las mujeres premenopáusicas y los hombres no se ha demostrado41.
La baja DMO es un importante factor de riesgo para fracturas, por lo que se recomienda a las mujeres posmenopáusicas que inicien tratamiento con L-tiroxina a dosis supresivas estudiar la DMO mediante una densitometría ósea que incluya sobre todo el hueso cortical (la cadera o el radio) para facilitar una rápida intervención terapéutica si fuera necesario39–41.
El tratamiento hormonal a dosis fisiológicas para suplir el hipotiroidismo, que mantiene TSH y T4 libre dentro de la normalidad, parece que tiene un mínimo efecto sobre el hueso.
AntiepilépticosLa epilepsia es una enfermedad crónica que requiere tratamiento con anticomiciales para prevenir las crisis. Estudios recientes muestran que los pacientes epilépticos tienen un riesgo de fractura del cuello del fémur 4 veces mayor que la población42.
Los fármacos más utilizados son la carbamazepina, la fenitoína (F), el fenobarbital (FB), el valproato sódico, la lamotrigina, la primidona y las benzodiazepinas.
Fármacos como la carbamazepina, FB, primidona y la F son inductores enzimáticos que activan el citocromo p-450 del hígado, de manera que pueden influir en el metabolismo óseo de dos formas: la primera, aumentando el metabolismo de la vitamina D causando una deficiencia; la segunda, actuando directamente sobre las células óseas aumentando la resorción y la formación ósea. Los dos mecanismos pueden asociarse a una reducción de la DMO43.
Durante muchos años se ha conocido la situación de hipovitaminosis D que conduce a una osteomalacia más biológica que clínica en estos pacientes. Entre el 20–60% de enfermos que realizan tratamiento con antiepilépticos, especialmente enfermos con edad avanzada e institucionalizados, presenta hipovitaminosis D43.
Estudios recientes con pacientes jóvenes con seguimiento en consultas externas muestran una disminución de la DMO en la columna lumbar y el fémur, pero que no se correlaciona con los niveles bajos de vitamina D. Estos resultados sugieren un efecto directo de los antiepilépticos sobre el remodelado óseo42–44. No pueden identificar si hay algún fármaco más osteopenizante que otro, pero sin ser significativo encuentran que la DMO del cuello del fémur está más disminuida en los pacientes que toman FB y que la prevalencia de fracturas en los consumidores de F es más elevada43.
Otros antiepilépticos, como el valproato sódico, la lamotrigina, las benzodiazepinas, la gabapentina, el topiramato y la etosuximida, que no actúan sobre el hígado no alteran el metabolismo de la vitamina D y no disminuyen la DMO como los anteriores44.
Aunque no existan recomendaciones publicadas, es lógico realizar dosificaciones de calcio, fósforo y vitamina D y una densitometría ósea en enfermos tratados con antiepilépticos durante más de 5 años.
Un tratamiento preventivo podría ser el calcio y la vitamina D, sobre todo en pacientes jóvenes para obtener un buen pico de masa ósea43.
NeurolépticosMuchos de los neurolépticos producen una elevación patológica de la prolactina. La hiperprolactinemia puede inhibir la producción de la GnRH en el hipotálamo y ésta a la vez inhibir las gónadas produciendo un hipogonadismo.
Algunos trabajos han estudiado los efectos de la hiperprolactinemia secundaria a los neurolépticos sobre el metabolismo óseo. Hombres y mujeres presentaban hiperprolactinemia y medidas de osteopenia u OP (sobre todo lumbar) en el 57 y el 32%, respectivamente45. Los principales factores que determinan la disminución de la DMO son la duración del tratamiento, el tipo de neuroléptico y las elevadas dosis del fármaco.
Neurolépticos como la olanzapina, que no producen hiperprolactinemia, no muestran una disminución relevante de la DMO46.
Los pacientes en tratamiento crónico con neurolépticos tienen un riesgo elevado de presentar OP, por lo que es conveniente valorar la DMO y otros factores de riesgo asociados, como son las enfermedades psiquiátricas (esquizofrenia), los tóxicos y el sedentarismo, entre otros, ya que éstos están muy presentes en este tipo de enfermos.
AntidepresivosLos antidepresivos tricíclicos y los inhibidores selectivos de la recaptación de la serotonina están asociados a un aumento del riesgo de fracturas del fémur en gente de edad avanzada47.
Estudios recientes muestran una asociación entre el uso diario de inhibidores selectivos de la recaptación de la serotonina y una disminución de la DMO de cadera en mujeres y hombres de edad avanzada y una disminución de la DMO lumbar en los hombres48,49. También se ha relacionado con un aumento del doble del riesgo a padecer fracturas osteoporóticas50.
No se conoce el mecanismo, aunque hay varias hipótesis. Una de ellas son los efectos secundarios de los propios fármacos, como la hipotensión postural o el sedentarismo, que podrían aumentar el riesgo de caídas. La depresión por sí misma también puede ser un factor asociado a baja DMO. También por un efecto directo sobre el metabolismo óseo; los receptores funcionales de la serotonina y los transportadores están localizados en los osteoblastos y osteocitos y parece que tienen un papel importante en la densidad y en la arquitectura ósea48–50.
En este tipo de pacientes tenemos que insistir en la prevención de las caídas y en la ingesta adecuada de calcio y vitamina D.
HeparinaLa OP es una complicación del tratamiento crónico con heparina. Los efectos sobre el hueso de tratamientos de corta duración son insignificantes.
Estudios recientes han observado que el riesgo de padecer OP es más bajo cuando se utiliza heparina de bajo peso molecular en comparación a la heparina no fraccionada. Estudios con animales sugieren que la heparina no fraccionada causa pérdida de la DMO, porque produce una disminución de la formación y un aumento de la resorción ósea, mientras que la heparina de bajo peso molecular solamente produce una disminución de la formación51,52.
Los casos y series de pacientes en tratamiento crónico con heparina son con mujeres embarazadas. La heparina afecta tanto al hueso cortical como al trabecular y se han observado fracturas vertebrales y de las costillas tanto durante el tratamiento como después del cese. La incidencia de las fracturas es baja, pero afecta a mujeres jóvenes53.
Los anticoagulantes orales son antagonistas de la vitamina K y ésta interviene en el metabolismo óseo, pero los estudios son contradictorios.
Inhibidores de la bomba de protonesLos inhibidores de la bomba de protones (IBP) se utilizan para el tratamiento de la úlcera péptica y el reflujo gastroesofágico y de forma preventiva en pacientes de alto riesgo.
Los IBP reducen la secreción de ácido en el estómago. Suplementos de calcio insolubles, como el carbonato cálcico (la forma más frecuente de administración de suplementos de calcio), requieren un medio ácido para la absorción óptima. Estudios con omeprazol han demostrado que la absorción de carbonato cálcico está reducida en comparación con la absorción del calcio de la dieta, esto puede ser debido a que la comida estimula una secreción de ácido suficiente para la absorción del calcio20.
Estudios recientes sugieren un aumento del riesgo de fractura osteoporótica en pacientes en tratamiento crónico con IBP54–56. Estos estudios son observacionales y son necesarios estudios aleatorizados para relacionar de forma causal la disminución de la absorción de calcio con la disminución de la DMO y el aumento de fracturas.
De todas formas, se recomienda que en caso de enfermos en tratamiento crónico con IBP, se revalore la indicación del tratamiento, aumenten el calcio de la dieta y si se requieren suplementos de calcio, que sean con calcio que no requiera un medio ácido para su absorción, como el citrato o el pidolato cálcico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.