El fenómeno de la globalización afecta también al ámbito de la patología. Por ello se observa hoy un aumento de la prevalencia de enfermedades que hace unos años raramente se veían en nuestro medio. Se trata de enfermedades, infecciosas o no, que pueden cursar con manifestaciones musculoesqueléticas que encaminen al enfermo a las consultas de Reumatología. En muchos casos los tratamientos específicos de cada una de ellas son curativos, mientras que fracasan las terapias habituales de las artropatías. En otros casos pueden ocasionar importantes complicaciones en enfermos inmunodeprimidos. Por todo ello es necesario que el clínico esté familiarizado con la patología importada y sus manifestaciones reumatológicas.
Globalization also affects pathology. Diseases that were previously uncommon in our clinics are becoming more and more prevalent. These kinds of diseases, whether infectious or not, may have rheumatic manifestations leading the patient to rheumatological clinics. Specific treatments for these diseases can often be curative whereas therapies commonly used for arthropathies do not work. On the other hand such diseases can cause serious complications in immunosuppresed patients. Thus, there is a need for greater awareness of tropical diseases and their rheumatic manifestations among clinicians.
El auge de los viajes a zonas tropicales y subtropicales y el creciente número de emigrantes y de adopciones procedentes de aquellas zonas han dado lugar a la aparición en nuestro medio de enfermedades, la mayor parte de ellas de naturaleza infecciosa, poco prevalentes previamente, que pueden tener manifestaciones musculoesqueléticas (ME) y que constituyen un reto diagnóstico y terapéutico (tabla 1).
Enfermedades víricas y parasitarias, importadas, más frecuentemente relacionadas con artropatía
| Virus |
|
| Parásitos |
| Helmintos |
|
| Protozoos |
|
Según datos del Instituto Nacional de Estadística, el 1 de enero del año 2008 la población española era de 46.157.822 habitantes, de los que, según las mismas fuentes, casi el 10% (4.526.522 habitantes según la encuesta de inmigración del año 2007) son inmigrantes. De ellos, casi 1.800.000 proceden de América Central o del Sur, unos 770.000 de África y más de 200.000 de Asia y Oceanía. Por países, Marruecos es el origen del mayor número de emigrantes, seguido por Rumanía y Bulgaria y más atrás por Ecuador.
Por otra parte, el posible contacto en áreas endémicas con patógenos que pueden permanecer en el organismo durante años y acabar causando cuadros graves en pacientes inmunodeprimidos, es otra razón para conocer, descartar y eliminar este tipo de agentes antes de iniciar tratamientos inmunosupresores.
Además, el estudio de la distribución y la prevalencia de las enfermedades ME en distintas y remotas partes del mundo permite la búsqueda de factores genéticos y/o ambientales que expliquen las diferencias encontradas. En este sentido, algunos autores se han planteado el posible papel paradójico de las infecciones respecto a las enfermedades autoinmunes, ya que, por una parte, es bien conocido que actúan como desencadenantes y, por otro, podrían tener un posible papel protector frente a ellas, teniendo en cuenta la prevalencia inversamente proporcional que se da entre ambas en los países en vías de desarrollo. Esto podría ser debido a que las infecciones víricas, bacterianas y parasitarias podrían, a través de mecanismos todavía no bien conocidos (p. ej. la competencia antigénica o la estimulación de células reguladoras), intervenir en la respuesta inmune1,2.
Se ha investigado así el papel antiinflamatorio de una proteína derivada de las filarias, la ES-622. Se trata de una glucoproteína de 62kD, que ha demostrado tener un efecto antiinflamatorio, tanto in vitro, en cultivos de líquido sinovial procedente de pacientes con artritis reumatoide (AR) en los que deprime la activación macrofágica, como in vivo, en un modelo de artritis inducida por colágeno en ratones, asociada a una disminución de los niveles de TNF-α, interleuquina-6 e interferón-γ3.
Patología importada de origen bacterianoEntre los agentes infecciosos causantes de patología reumatológica, los más frecuentes son las bacterias. Originan cuadros de artropatía séptica o reactiva.
El espectro etiológico no cambia por el hecho de proceder de una zona tropical o subtropical, pero en los pacientes emigrantes procedentes de zonas deprimidas hay que tener en cuenta ciertas circunstancias, como por ejemplo la posibilidad de una artritis séptica por Haemophilus influenzae en lactantes que no han recibido la vacuna contra este microorganismo, la mayor relevancia de la tuberculosis (TBC), de la Brucella o de la fiebre reumática, así como el mayor riesgo de lepra.
LepraSe trata de una enfermedad rara en nuestro medio, pero que causa más de un millón de casos en Sudamérica, África, Asia y Oceanía. Causada por el Mycobacteryum leprae, origina formas clínicas que difieren según sea la respuesta inmunológica del paciente. Si es adecuada, se desarrolla la lepra tuberculoide, confinada a la piel y al sistema nervioso periférico. Si es débil, se desarrolla un cuadro crónico, progresivo y diseminado, la lepra lepromatosa, en la que se desarrollan las manifestaciones ME. Se originan por invasión directa, por la reacción granulomatosa secundaria, como consecuencia de la neuropatía, los traumas de repetición secundarios a la anestesia y las infecciones de las lesiones cutáneas vecinas.
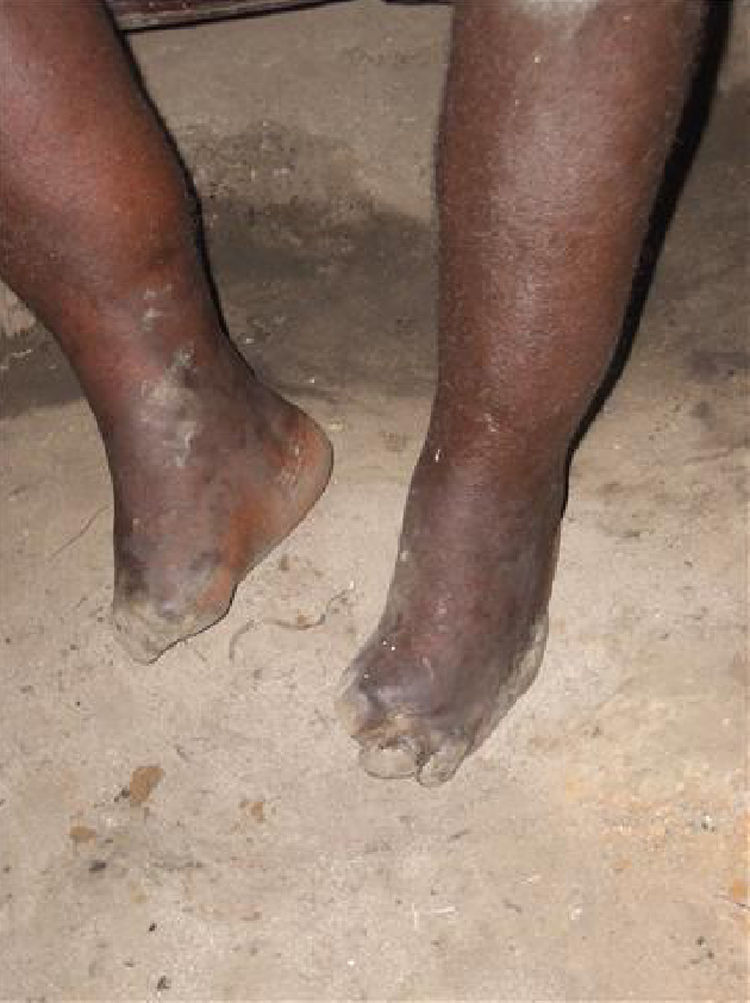
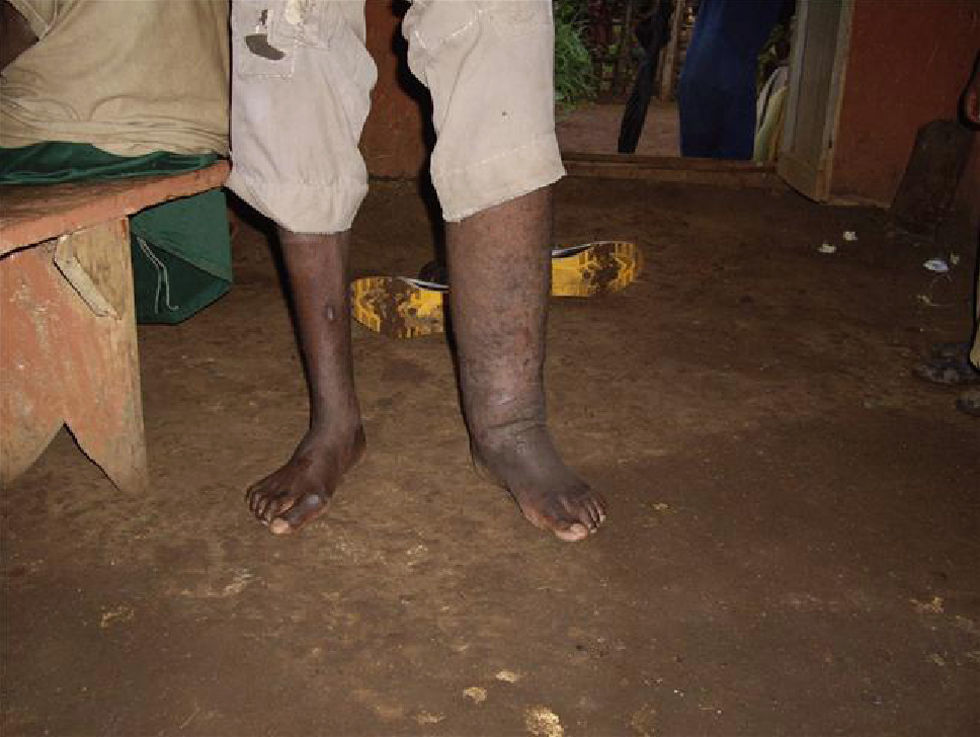
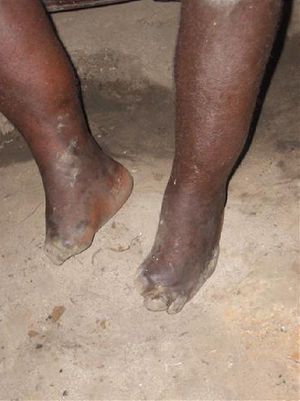
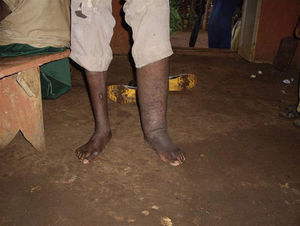
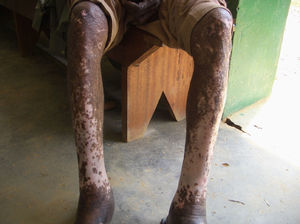
Se han descrito edemas en los brazos y en las piernas, de origen vasomotor por la afectación del sistema nervioso periférico, una infiltración cutánea generalizada, que recuerda a la esclerodermia, artritis, tenosinovitis, poliartritis simétrica erosiva con afectación de pequeñas articulaciones, artropatía destructiva con resorción ósea y un cuadro denominado “eritema nodoso de la lepra”, que aparece tras el tratamiento y que se caracteriza por fiebre, poliartritis, síndrome constitucional y por la aparición de nódulos subcutáneos dolorosos (a veces difíciles de distinguir de las lesiones lúpicas o de la sarcoidosis) y que generalmente precisa tratamiento corticoideo (figs. 1 y 2).
Hasta el 20% de los pacientes puede tener serología falsamente positiva para sífilis y anticuerpos antinucleares (ANA) positivos.
Los casos más avanzados raramente llegarán a la consulta de Reumatología, pero sí podrían llegar enfermos con lesiones cutáneas con ANA y reagina plasmática rápida positivos (RPR+), con un supuesto cuadro lúpico, o por parestesias mal definidas en antebrazos y manos, remedando un síndrome del túnel carpiano, con lesiones cutáneas acompañantes.
El diagnóstico comienza por la sospecha en los pacientes procedentes de zonas endémicas. La confirmación se realiza por la demostración de los bacilos y el tratamiento es prolongado, al menos un año, y debe realizarse con varias drogas, nunca en monoterapia. Las más usadas son la dapsona, la clofacimina y rifampicina4.
Patología importada de origen víricoExisten varios tipos de viriasis importadas relacionadas con la clínica ME, en especial las causadas por alfavirus, pertenecientes a la familia de los arbovirus, que son aquellos virus que realizan parte de su ciclo en el interior de un artrópodo, el cual actúa de vector transmitiendo la infección al huésped humano. Generalmente, se manifiestan con la triada de fiebre, rash y artralgias y, en ocasiones, con artritis. Tienen un período de incubación relativamente corto, por lo que se diagnostican más en viajeros que regresan de países con alta prevalencia de estas enfermedades y también en inmigrantes que han visitado su país de origen. Al tratarse de una clínica tan inespecífica, es fundamental para el diagnóstico el conocimiento por parte del médico del antecedente de exposición en una zona endémica.
Desde un punto de vista práctico podríamos dividir las viriasis en dos grupos:
- •
Las que producen fundamentalmente artralgias: la fiebre amarilla y el dengue.
- •
Las que producen artritis: fiebre de Chikungunya, O’nyong-nyong, enfermedad de Ross River, fiebres por virus Sindbis, fiebre del Bosque de Barmah, de Semiliki y de Mayaro5.
Se trata de dos arbovirus endémicos, en el caso del dengue en el Sudeste Asiático, África Subsahariana y Centro y Sudamérica, y en el caso de la fiebre amarilla en los bosques tropicales de África y Sudamérica. Son arbovirus, por lo tanto, transmitidos por artrópodos, de la familia de los flavivirus. Generalmente producen artralgias que, sobre todo en el caso del dengue, pueden ser severas. Los pacientes se recuperan espontáneamente o bien desarrollan complicaciones hemorrágicas y fallo multiorgánico, que relegan a un segundo plano la clínica articular.
Fiebre de ChikungunyaEn los dialectos locales de Mozambique y Sudáfrica, chikungunya quiere decir “lo que te dobla, hombre encorvado”. Se trata de un alfavirus transmitido a los humanos a través de la picadura del mosquito infectado, Aedes aegyti y en ocasiones también por el Aedes albopictus o mosquito tigre.
Es endémica en África y Asia. En Italia en el año 2007 se declaró un brote epidémico con transmisión local por A. albopictus, a partir de un viajero que regresó de India infectado. El brote cursó con 160 casos confirmados, de los cuales falleció un anciano de 83 años de edad. El resto de los casos descritos en Europa han sido importados. En España en el año 2006 se diagnosticaron siete casos en personas procedentes de Guinea Ecuatorial, Camerún, Mauricio e India.
La enfermedad tiene un período de incubación de entre 2 y 12 días. Se caracteriza por fiebre, conjuntivitis y rash en los primeros días y por astenia persistente, artralgias, tenosinovitis y artritis, muchas veces incapacitantes, con una respuesta lenta al tratamiento sintomático, que pueden persistir durante semanas o meses e incluso recidivar posteriormente. El diagnóstico es serológico.
En una serie de 6 pacientes descrita en Italia, todos ellos experimentaron poliartralgias de curso subagudo o crónico6 y en una serie francesa de 47 pacientes, todos desarrollaron manifestaciones articulares agudas (afectando sobre todo a pequeñas y medianas articulaciones) y tuvieron un curso subagudo o crónico en el 80% de los casos, con una respuesta lenta al tratamiento sintomático con AINE en la mayor parte de los casos y con corticoides en los casos más rebeldes7.
O’nyong-nyongSe trata de un cuadro similar al producido por el virus de Chikungunya, con el que de hecho se relaciona antigénicamente, descrito en países africanos (Senegal, Uganda, Kenia y el sur de Sudán), con un patrón de afectación articular similar, pero de menor severidad y persistencia.
Enfermedad por virus de Ross RiverInicialmente descrita en los militares estadounidenses que sirvieron en el Pacífico Sur durante la Segunda Guerra Mundial y denominada “poliartritis epidémica”. Se trata de una viriasis causada por el virus de Ross River, endémico en Australia, Nueva Guinea y otras islas del Pacífico sur. En Australia causa unos 5.000 casos al año.
Clínicamente, cursa como un cuadro gripal acompañado de artritis generalmente simétrica, con compromiso predominante de tobillos, rodillas, carpos e interfalángicas proximales de las manos. El pronóstico final es bueno8.
El diagnóstico, de nuevo, se basa fundamentalmente en la sospecha por los antecedentes epidemiológicos. La infección aguda se confirma mediante la demostración de la seroconversión serológica. El tratamiento es sintomático.
Enfermedad de PogostaLos virus llamados sindbis se han aislado en diferentes puntos geográficos, muy distantes, como Egipto, Sudáfrica o el norte de Europa. Actúan como reservorio las aves domésticas o migratorias y como vector los mosquitos. La enfermedad de Pogosta se comporta de forma similar a las viriasis ya descritas, pero se caracteriza por aparecer fundamentalmente en Finlandia, en forma de brotes epidémicos periódicos, cada siete años, en los meses de verano y otoño9.
El resto de los arbovirus descritos en relación con la artritis, de menor relevancia por su baja prevalencia, pero a tener en cuenta en caso de pacientes procedentes de zonas endémicas son los siguientes:
- •
Mayaro: en Venezuela y Brasil.
- •
Similiki: en Uganda.
- •
Bosque de Barmah: en Oceanía.
En general, las infecciones de origen bacteriano, viral o incluso fúngico son buscadas sistemáticamente en el estudio de la patología reumatológica, en especial en los casos de artritis. No así los parásitos, que son los grandes olvidados, tanto a la hora de hacer el diagnóstico diferencial como en la literatura médica.
Esto podría explicarse porque se trata de una entidad infrecuente, pero la realidad es que normalmente no se piensa en estos agentes etiológicos a pesar de que aumenta el número de parásitos implicados en casos de artropatía.
EtiopatogeniaSon varios los mecanismos por los cuales los distintos parásitos pueden producir patología articular:
- 1.
Por invasión local desde los huesos (como el caso de Echinococcus granulosus) o músculos vecinos (Dracunculus medinensis) o por vía hematógena o linfática (como por ejemplo en el caso de las filarias), con presencia de los individuos adultos, larvas o huevos en la cavidad articular.
- 2.
Puede tratarse de una reacción inflamatoria reactiva a la presencia del parásito en los tejidos adyacentes, pero sin que haya invasión articular propiamente dicha.
- 3.
Puede darse un cuadro inflamatorio, sin la presencia del parásito en la articulación ni en su vecindad, probablemente desencadenado por un mecanismo inmunológico. Es en este último caso en el que algunos autores utilizan el término “reumatismo parasitario”10.
Se trata de una artropatía inflamatoria inmunológicamente mediada, en pacientes con una carga genética favorable, que característicamente responden de forma espectacular al tratamiento antiparasitario y no a las terapias convencionales. Los parásitos jugarían su papel como desencadenante de la respuesta inmune, como las bacterias en las artropatías reactivas.
Se han descrito varios casos que apoyan la existencia del mecanismo inmunológico:
- •
Un caso de poliartritis aguda febril, resuelto con la expulsión de un Ascaris lumbricoides11.
- •
Un caso de poliartritis en un paciente que además aquejaba náuseas y dolor abdominal. Se le realizó una endoscopia y se extirpó un granuloma gástrico, tras lo cual desapareció la poliartitis. Posteriormente se demostraron larvas de Anisakis en el granuloma11.
- •
Una poliartritis crónica, de más de 8 años de evolución, curada tras la extirpación de un quiste hidatídico hepático12.
La existencia de una predisposición genética para desarrollar un reumatismo parasitario está avalada por dos argumentos. El primero es que no existe un patrón clínico específico dependiente del tipo de parásito, es decir, cada agente no produce un cuadro articular característico, sino que éste parece depender más bien del huésped, de su trasfondo genético. El segundo es que las parasitosis son una enfermedad con altísima prevalencia mundial, mientras que los reumatismos parasitarios son raros.
Se ha buscado el posible papel del antígeno HLA B27. La revisión de 13 casos de reumatismo parasitario en los que se investigó la presencia o no del antígeno HLA B 27 demostró que en la mayor parte de los casos, nueve, fue negativo, de los cuales más de dos tercios, siete, presentaban clínicamente una poliartritis simétrica. Los 4 casos en los que el antígeno HLA B27 fue positivo se presentaron como una oligoartritis asimétrica. Por lo tanto, la presencia del antígeno HLA B27 se relacionaba con un patrón oligoarticular asimétrico y la ausencia de éste se relacionaba con una distribución poliarticular simétrica. Los autores no extraen conclusiones dado el limitado número de pacientes, pero animan a determinar el antígeno HLA B27 en los casos en los se sospeche o se diagnostique una artropatía por parásitos10.
Clínicamente, se trata de pacientes que presentan un cuadro articular inflamatorio, en los que las manifestaciones típicas de las parasitosis (abdominales, cutáneas, etc.) suelen estar ausentes o ser muy leves. Cuando se presentan son de gran ayuda para llegar al diagnóstico. Casi siempre existe aumento de la VSG. La eosinofilia y el aumento de inmunoglobulina E no son constantes, suelen estar ausentes cuando el parásito permanece intraluminal. El líquido sinovial es estéril, de características inflamatorias y cuando se visualizan eosinófilos son altamente sugestivos. La identificación del parásito se realiza por su aislamiento en muestras de heces, esputo, orina y por técnicas serológicas cuando se dispone de ellas. No presentan daño articular radiológico y no responden al tratamiento convencional con AINE, mientras que mejoran con los corticoides pero recidivan al suspenderlos. El tratamiento específico normalmente es curativo (tabla 2).
Características del reumatismo parasitario
|
Ig: inmunoglobulina; VSG: velocidad de sedimentación globular.
Los parásitos se pueden clasificar morfológicamente en protozoos (que son seres unicelulares) y en metazoos (que son pluricelulares), y dentro de éstos en helmintos (que a su vez se clasifican según su forma en tres categorías) y en artrópodos. Es el grupo de los helmintos donde encontramos mayor cantidad de agentes causantes de artropatía, algunos de ellos con capacidad para originar cuadros muy graves, incluso fatales.
El objeto de esta revisión no es el de la artropatía por parásitos en general sino el de la patología importada, por lo que no nos vamos a referir a aquellas parasitosis que pueden considerarse endémicas en nuestro medio.
HelmintosStrongyloides stercoralisEs un nematodo que se encuentra fundamentalmente en las zonas tropicales, pero que también se ha descrito en el sur de EE. UU. y en la cuenca mediterránea, incluyendo la española. Román Sánchez et al publicaron en el año 2001 una serie con 156 pacientes con estrongiloidiasis, diagnosticados a lo largo de 8 años y que constituían casi el 1% de todos los ingresos realizados en el área médica del hospital en ese mismo período. Se identificó como factor de riesgo para infectarse, el hecho de trabajar descalzo en contacto con la tierra húmeda, y como factor para sufrir complicaciones, la presencia de enfermedades concomitantes debilitantes13.
El hombre se infecta por la penetración de la larva infectiva, llamada larva filariforme, a través de la piel, generalmente de los pies descalzos, en contacto con terreno húmedo. Alcanza los vasos venosos y viaja hasta el corazón, de ahí a los pulmones donde abandona el torrente sanguíneo e invade el parénquima pulmonar pasando al árbol bronquial y ascendiendo hasta la laringe. Desde ahí pasan a la faringe donde son deglutidas y finalmente se asientan en el intestino delgado, donde maduran a individuos adultos. Las hembras producen huevos que dan lugar a nuevas larvas que avanzan por el intestino y o bien son eliminadas con las heces, iniciando su ciclo libre en el suelo, donde podrían infectar a otros individuos, o bien atraviesan la mucosa intestinal o la piel del periné y autoinfectan al mismo sujeto. Este hecho es de gran importancia, pues permite que un individuo se continúe reinfectando a pesar de haber abandonado la zona endémica muchos años atrás.
Clínicamente, la infestación permanece silente en la mayor parte de los individuos. En algunos casos se producen manifestaciones agudas cutáneas en el lugar de la penetración como prurito, pápulas, eritema, urticaria, o la llamada larva currens provocada por el desplazamiento del parásito en el tejido celular subcutáneo. Varios días o semanas después pueden aparecer síntomas respiratorios o digestivos debidos al paso del parásito por estos sistemas (tos, sibilancias, dolor abdominal, diarrea, nauseas o vómitos). En ocasiones, persisten síntomas inespecíficos e intermitentes durante años, fundamentalmente digestivos14.
Se han descrito casos de oligoartritis reactiva, de sacroileitis o de poliartritis con vasculitis leucocitoclástica en un paciente en el que se demostró la presencia del parásito en la membrana articular y en el líquido sinovial de un tobillo15. Van Kuijk et al publicaron en el año 2003 el caso de un paciente que tras volver de un viaje a Sudamérica comenzó con un cuadro de poliartritis simétrica con afectación de manos, con aumento de reactantes de fase aguda y eosinofilia del 20%. Tras la búsqueda de parásitos en heces en repetidas muestras se identificó la presencia de larvas de S. stercoralis, que no se aislaron en el líquido sinovial obtenido por artrocentesis. El tratamiento con albendazol solucionó el cuadro16.
En los individuos inmunodeprimidos se puede desarrollar un síndrome de hiperinfección, con complicaciones graves en los órganos que el parásito atraviesa en su ciclo vital, u ocurrir una diseminación con aparición de manifestaciones en otros sistemas, con frecuencia con meningitis y septicemia por gramnegativos que acompañan al helminto adulto en su invasión del organismo. Se ha descrito este tipo de complicaciones en pacientes con neoplasias hematológicas, infección por VIH, hipogammaglobulinemia, transplantes y en enfermos con tratamiento inmunosupresor, incluyendo terapia esteroidea.
Hay publicados varios casos de infección en pacientes con terapia biológica. Boatright publicó en el año 2005 un caso de un paciente de 60 años con AR, que había participado en la guerra de Vietnam 40 años antes. El enfermo desarrolló un cuadro abdominal con dolor y diarrea que se inició a las 4 semanas de comenzar un tratamiento con etanercept. Los síntomas empeoraban durante las 24h siguientes a la inyección y mejoraban de forma progresiva hasta la siguiente dosis. En el estudio destacó la existencia de hipereosinofilia y la presencia de larvas de Strongyloides stercolaris en las heces. Se suspendió la terapia biológica y se instauró tratamiento con ivermectina, con resolución del cuadro digestivo17.
Krishnamurthy et al publicaron un caso de hiperinfección con complicaciones digestivas, respiratorias y sepsis sobreañadida por gramnegativos, en un paciente con AR que había comenzado terapia con adalimumab tres meses antes. Se demostró la presencia de larvas de SS en muestras obtenidas a través de lavado broncoalveolar y en las heces. La serología para SS fue altamente positiva. El paciente respondió al tratamiento con ivermectina y tiabendazol asociado a la terapia de la sepsis por Escherichia coli18.
Revuelta et al publicaron en el año 2008 un caso de un paciente ecuatoriano con una AR tratado con etanercept suspendido por un cuadro de varicela zóster. Tres meses después, estando sin terapia biológica, ingresó por una hemorragia digestiva aguda duodenal por infestación por SS que se trató con albendazol (400mg/12h). Tras un viaje a su país y coincidiendo con un empeoramiento de la clínica articular presentó un cuadro digestivo diarreico, objetivándose de nuevo la presencia de larvas de SS en las heces. Se instauró tratamiento con ivermectina con buena respuesta19.
En ninguna de las publicaciones se recoge que se reintrodujera la terapia biológica, probablemente ante la imposibilidad de descartar completamente la persistencia de la infestación, dada la baja sensibilidad de la técnica diagnóstica (demostración en heces).
Mora et al presentaron 2 casos de hiperinfección por SS en pacientes con lupus eritematoso sistémico y síndrome antifosfolípido asociado y revisaron otros 9 casos publicados, todos con manifestaciones abdominales y/o pulmonares. En todos los casos, inicialmente, se interpretó la aparición de los síntomas como una exacerbación lúpica, lo que llevó a un incremento de la terapia inmunosupresora. Sin embargo, se trataba de cuadros de hiperinfección por SS. La mitad de los pacientes no presentaba eosinofilia, que hubiera podido orientar hacia la existencia de una parasitosis. Se identificaron las larvas de SS en muestras intestinales, alveolares o pulmonares. La mortalidad total de los 11 casos fue del 55 y del 100% en el subgrupo que no fue tratado con antihelmínticos20.
Por lo tanto, debemos descartar la presencia de SS en pacientes que se hayan expuesto a él, aunque haya sido muchos años atrás, antes de comenzar un tratamiento inmunosupresor. También deberemos sospecharlo en enfermos procedentes de áreas endémicas que desarrollen complicaciones digestivas o respiratorias graves.
Para el diagnóstico es fundamental la sospecha del cuadro. La hipereosinofilia no siempre está presente. La confirmación se realiza mediante la detección de las larvas, generalmente en las heces, o en otras muestras en caso de complicaciones (lavado broncoalveolar o duodenal). El valor de la serología es controvertido pues aunque tiene una alta sensibilidad (90%) presenta reactividad cruzada con otros helmintos (filarias o esquistosomas) y puede ser falsamente negativa en inmunodeprimidos.
El tratamiento consiste en ivermectina en dosis de 200μg/kg durante 2 días, que puede repetirse a las dos semanas, y como alternativa, albendazol en dosis de 400mg/12h durante 7 días.
Por la baja sensibilidad de la técnica diagnóstica y la posibilidad de desarrollar complicaciones graves, muchos autores recomiendan realizar tratamiento profiláctico a todos los pacientes que hayan estado en una zona de riesgo más de tres meses, aunque no se demuestre la presencia del parásito y que vayan a recibir inmunosupresión.
En el caso de un cuadro de hiperinfección, el tratamiento con ivermectina es parenteral, durante 5 días, asociado a albendazol y antibióticos de amplio espectro.
FilariasLas filarias son parásitos del grupo de los nematodos, trasmitidos a los humanos por la picadura de mosquitos o de moscas, con una distribución geográfica que afecta fundamentalmente a África y a Asia, según la especie de la que hablemos21.
Las filariasis linfáticas son producidas por la especies Wuchereria bancrofti, Brugia malayi y Brugia timori. Ocasionan cuadros de linfangitis agudas o crónicas con elefantiasis secundarias y complicaciones en otros órganos (fig. 3). Se han descrito casos de artritis quilosas en pacientes con filariasis por W. bancrofti, con un debut clínico remedando una artritis séptica, con gran dolor e impotencia, así como casos de miositis, pero siempre acompañando a casos de linfangitis crónica por lo que el diagnóstico, teniendo además en cuenta la procedencia de los pacientes, es fácil de orientar21. Se basa en la demostración de las microfilarias en sangre. El éxito del tratamiento depende del curso de la enfermedad de manera que cuando se han desarrollado fenómenos crónicos, éstos son difícilmente reversibles. Se utiliza la ivermectina y, en ocasiones, la dietilcarbamacina (DEC). En este último caso es necesario descartar la coexistencia de Onchocerca volvulus, ya que se ha descrito un cuadro de hipersensibilidad, con secuelas oftalmológicas graves, llamado reacción de Mazzotti, debido a la muerte masiva de las microfilarias por efecto de la DEC. Para evitarla, se suele comenzar por dosis bajas o asociar corticoides.
La artritis suele mejorar con medidas físicas como vendajes compresivos22.
Las filarias tisulares son Dirofilarias, Loa loa y O. volvulus. La primera es un parásito generalmente del perro que infecta al humano por error, puede producir nódulos pulmonares cutáneos y, en alguna ocasión, manifestaciones articulares inflamatorias. El diagnóstico generalmente requiere biopsia y demostración del parásito y el tratamiento es sintomático, pudiendo ser necesaria la exéresis de los nódulos.
La infección por L. loa suele ser asintomática, pero en ocasiones puede ocasionar edema de partes blandas (edema de Calabar), paso subconjuntival del gusano adulto, ocasionando un cuadro de conjuntivitis aguda, o manifestaciones articulares como artritis, generalmente en grandes articulaciones de los miembros inferiores, con o sin demostración del parásito en la articulación. El diagnóstico se realiza por la demostración de las microfilarias en sangre y, en ocasiones, por la extirpación del gusano adulto. El tratamiento se hace con DEC o con ivermectina.
La oncocercosis es producida por O. volvulus. La enfermedad también se conoce como la “ceguera de los ríos”, porque es allí donde se encuentra la mosca que actúa de vector y porque una de sus complicaciones más temidas es la ceguera secundaria a la coriorretinitis crónica. Se da fundamentalmente en África Subsahariana. La mosca negra Simulium Damnosum transmite al humano las larvas infectivas, que migran al tejido celular subcutáneo, donde maduran y en aproximadamente doce meses se convierten en sujetos adultos, que se agrupan en nódulos (oncocercomas) y pueden persistir durante años. Las hembras adultas producen microfilarias que migran por la piel pudiendo alcanzar el torrente sanguíneo y desde ahí distintos tejidos, produciendo los diferentes síntomas. Si el humano infectado es picado de nuevo por la mosca vector, ésta puede aspirar las microfilarias, las cuales madurarán, en el interior del insecto, a larvas infectivas, completando así el ciclo.
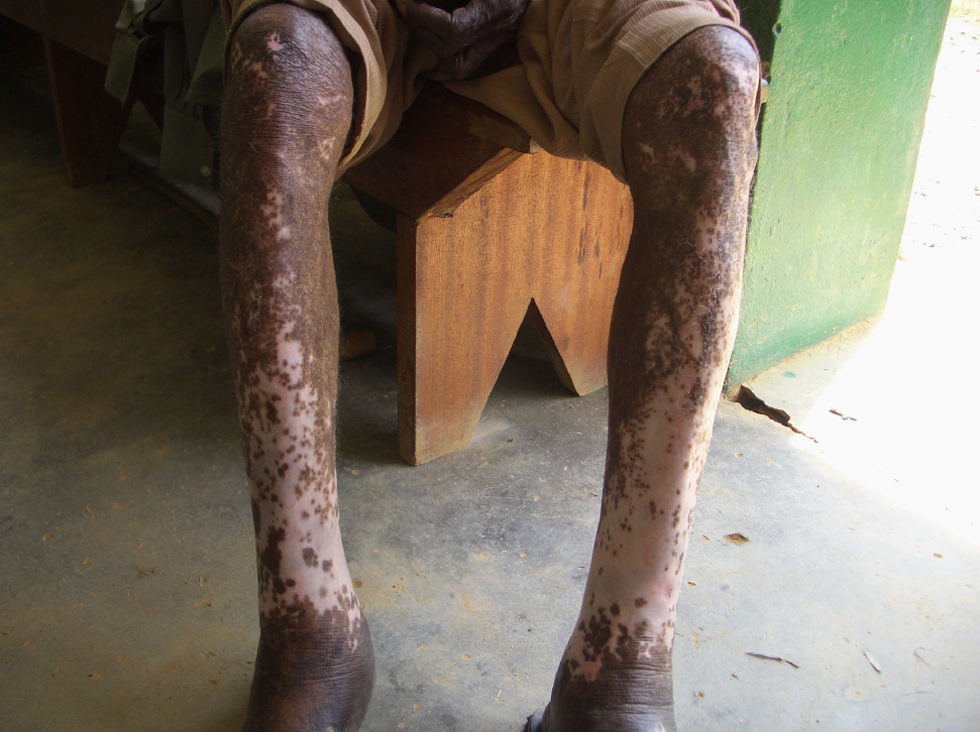
Clásicamente, se ha relacionado la oncocercosis con las manifestaciones cutáneas (depigmentación y atrofia) (fig. 4) y oftalmológicas, de manera que sin la presencia de éstas no se consideraba el diagnóstico de esta enfermedad. Sin embargo, hay diferentes autores que han llamado la atención sobre la prevalencia de los síntomas ME y la necesidad de pensar en esta parasitosis en pacientes que se hayan expuesto y que presenten artralgias o lumbalgia con mala respuesta a tratamiento sintomático convencional. De hecho, algunos autores han propuesto llamar a la oncocercosis “lumbalgia tropical”.
En distintos trabajos realizados en diferentes países africanos se objetivó que los síntomas ME eran los más frecuentes como forma de presentación. En una serie realizada en Nigeria en la que se realizó el estudio de oncocercosis con detección de microfilarias en pliegues cutáneos, a todos los pacientes que acudieron a la consulta, bien por síntomas ME o bien por síntomas clásicos de oncocercosis (cutáneos u oftalmológicos), resultó que de todos los pacientes en los que se confirmó la parasitosis, el 70% había debutado con artromialgias, fundamentalmente con lumbalgia. En general, se trataba de pacientes jóvenes, menores de 30 años, muchos de ellos con prurito e insomnio asociados23.
Pearson presentó en el año 1988 el caso de una expatriada británica en África, que tras vivir en zonas de oncocercosis y regresar a su país de origen desarrolló un cuadro de lumbalgia, artralgias, prurito, dermatitis e insomnio, que no fue bien diagnosticado hasta que doce años después del inicio de estos síntomas, comenzó con afectación ocular. Tras realizar el diagnóstico, el tratamiento con ivermectina eliminó los síntomas articulares23.
El diagnóstico de oncocercosis se hace por la demostración de las microfilarias en muestras de piel. El tratamiento con ivermectina, en dosis de 150μg/kg, mata a las microfilarias, no a los individuos adultos, por lo que el tratamiento debe repetirse cada 6–12 meses, hasta que el individuo esté asintomático. En caso de la existencia de oncocercomas accesibles, deben extirparse.
AnquilostomasConstituyen otro subgrupo de nematodos que, aunque raramente, también se han relacionado con cuadros articulares.
Las dos especies que infectan a los humanos son el Ancylostoma duodenale y el Necator americanus (de forma accidental alguna otras especies que parasitan animales pueden infectar a los hombres). Se localizan en zonas cálidas de América, Asia y África. El hombre se infecta por la penetración de la larva infectiva a través de la piel. Ésta alcanza el torrente sanguíneo y realizando el mismo periplo descrito para el S. stercoralis alcanza la mucosa gástrica e intestinal, donde se ancla.
La clínica fundamental es la derivada de la anemia. Se han descrito casos de oligoartritis asimétrica. Podríamos sospecharlo en un paciente procedente de zonas endémicas, con artropatía resistente a tratamientos convencionales y con anemia ferropénica. El estudio de heces demostrará la presencia de huevos. El tratamiento consiste en albendazol en dosis de 400mg en una única dosis o, con lo que es más fácil de obtener en nuestro medio, mebendazol en dosis de 200mg/día durante tres días, o en dosis única de 500mg.
TriquinosisAunque su distribución es mundial puede considerarse dentro del grupo de la patología importada, dado que su prevalencia es mayor en los países en los que no existe un adecuado control de los productos cárnicos. Se adquiere por la ingestión de carne, generalmente de cerdo, contaminada con las larvas enquistadas de la Trichinella, de las cuales, la Trichinella spiralis es la más común. Las larvas se liberan en el estómago del humano, invaden la mucosa del intestino delgado y maduran a individuos adultos, los cuales generan nuevas larvas. Son éstas las que, una semana después de la primoinfección, migran y se establecen en los músculos estriados, pudiendo dar lugar a fiebre, edema periorbitario, hemorragias ungueales, mialgias, eosinofilia y, en los casos graves, complicaciones cardíacas o neurológicas. Las larvas se enquistan en el músculo estriado, donde pueden calcificarse. En algunas ocasiones se ha confundido con cuadros de polimialgia reumática y polimiositis/dermatomiosistis. Para el diagnóstico será útil conocer el antecedente epidemiológico de la ingestión de carne sin garantías sanitarias y poco cocinada. La serología y la biopsia muscular lo confirmarán. En la mayor parte de los casos, los síntomas son autolimitados. Cuando no es así, puede ser necesario el tratamiento con corticoides y mebendazol en dosis de 200–400mg/8h durante 3 días, seguidos de 400–500mg/8h durante 10 días más o bien albendazol.
EsquistosomasHelmintos del grupo trematodos, los esquistosomas se han relacionado con manifestaciones ME, que, aunque no son frecuentes, sí se están bien documentadas.
Los más importantes (por su prevalencia) son Schistosoma haematobium que se localiza en África, Schistosoma mansoni en África y áreas costeras de Brasil y Venezuela, y Schistosoma japonicum en el Sudeste Asiático. Comparten el mismo ciclo vital, en el que los huevos son eliminados con la orina en el primer caso y con las heces en los otros dos. Los huevos maduran en el agua dulce e infectan a moluscos, en los que continúan evolucionando hasta dar lugar a formas infectivas que se liberan de nuevo al agua y que contaminan al hombre atravesando la piel, alcanzando el torrente sanguíneo, hasta llegar al sistema venoso mesentérico en el caso de S. mansoni y S. japonicum y vesical en el del S. haematobium. Ahí se establecen y los machos y las hembras inician su ciclo sexuado, originando huevos que alcanzan la luz del intestino o la vejiga y son eliminados al exterior.
Clínicamente, se presentan como tres síndromes característicos. El primero es una dermatitis en la zona de penetración que se produce al ser infectado (llamado “picor del bañista”). El segundo, conocido como “fiebre de Katayama”, es un cuadro agudo con fiebre, lesiones cutáneas y esonofilia, que se desencadena en las personas que han sido infectadas por primera vez, en el momento de la primera puesta de huevos por el esquistosoma hembra. Generalmente, se trata de viajeros y para su tratamiento suele ser necesario el uso de corticoides. El tercero consiste en la enfermedad fibroobstructiva secundaria a la presencia de los parásitos adultos y de los huevos, que originan una reacción inflamatoria granulomatosa y fibrosis, con sus manifestaciones clínicas en forma de hematuria, cistitis, uretritis, progresión a carcinoma vesical, hipertensión portal y sus complicaciones, etc., dependiendo de la especie.
Se han descrito diferentes formas de afectación articular. Greenfield et al presentaron el caso de un paciente con un cuadro clínico similar al de un reumatismo palindrómico, factor reumatoide negativo, de larga evolución sin respuesta a AINE, en el que se demostró la presencia de huevos de S. mansoni, así como la existencia de inmunocomplejos circulantes contra antígenos de esquistosoma. Con el tratamiento seriado con praziquantel, los síntomas desaparecieron y los títulos de inmunocomplejos se negativizaron24.
Bassiouni et al llaman la atención sobre las manifestaciones reumatológicas de la esquistosomiasis. Estudiaron a 124 pacientes con esquistosomiasis con una duración media de 9 años, que además mostraron clínica ME. La lumbalgia y la gonalgia, sin datos inflamatorios acompañantes, fueron las principales quejas. Había, en general, una leve elevación de la VSG y el factor reumatoide fue negativo en la mayoría de los enfermos. Los estudios radiológicos mostraron alteraciones sugestivas de sacroileitis en más del 40% de los sujetos (sin embargo, los autores no investigaron la existencia de una espondiloartropatía subyacente). Se realizó biopsia sinovial a tres pacientes, encontrando huevos de esquistosoma en dos de las muestras, con fenómenos vasculíticos asociados en una de ellas y sinovitis crónica sin presencia del parásito en la tercera25.
La presencia de síntomas de afectación visceral (hematuria, signos de hipertensión portal, etc.) en pacientes procedentes de zonas endémicas facilitará el diagnóstico, que se realizará por la identificación de los huevos (cada especie tiene una forma característica) en muestras frescas (heces u orina). El tratamiento se realiza con praziquantel de 40mg/kg repartido en dos dosis un solo día para el caso de S. haematobium y S. mansoni y de 60mg/kg en 3 tomas, también un sólo día para S. japonicum.
Otros parásitos, pero todos ellos de distribución mundial, que se han relacionado con clínica ME de forma excepcional son Toxocara canis, A. lumbricoides y Anisakis. En el caso de las tenias tisulares, del Echinococcus, causante del quiste hidatídico y de la Taenia solium en su fase de larva, o cisticercosis, son bien conocidas las complicaciones osteomusculares que pueden provocar, con miositis y con formación de quistes óseos que pueden desembocar en fracturas patológicas.
ProtozoosLos protozoos son parásitos unicelulares.
Giardia lambliaSe trata de un parásito intestinal flagelado, de distribución mundial, pero con mayor prevalencia en los países en vías de desarrollo. El contagio se produce por la ingestión de los quistes del parásito que se encuentran en el agua contaminada. Los sujetos infectados pueden convertirse en portadores asintomáticos o desarrollar, en una media de 7 días, un cuadro digestivo de entre 2 y 4 semanas de duración.
Se ha relacionado a este agente con cuadros de artritis reactiva, con oligoartritis crónica refractaria al tratamiento convencional con buena respuesta a antiparasitarios26. Algunos autores, sin embargo, considerando la alta prevalencia de la giardiasis intestinal frente a la escasa incidencia de artritis reactiva, se plantean que la giardia no actúe realmente como un desencadenante de la artropatía, sino como un facilitador de ésta al alterar la permeabilidad de la barrera intestinal y favorecer el paso de agentes ya bien conocidos como causantes de artritis reactiva27.
El diagnóstico requiere la visualización directa en heces. La serología puede ser útil en pacientes viajeros procedentes de zonas endémicas, pero no en emigrantes. El tratamiento de la giardiasis consiste en metronidazol en dosis de 250mg/8h o tinidazol en una dosis única de 2g.
PlasmodiumEl Plasmodium es el causante del paludismo o malaria y es el de mayor relevancia por su prevalencia. Existen 4 especies (falciparum, ovale, vivax y malariae). Entre sus manifestaciones son frecuentes las artromialgias, que pueden ser severas, pero que no son las de mayor gravedad. Se ha descrito algún caso de poliartritis simétrica y un caso de poliarteritis nodosa (PAN) con manifestaciones exclusivamente cutáneas en una niña de 2 años que precisó tratamiento con corticoides y citotóxicos28. De cualquier manera las manifestaciones articulares inflamatorias no son frecuentes.
AmebasSon protozoos de distribución mundial, pero con una clara predilección por los lugares con condiciones higienicosanitarias deficientes.
La más patógena es Entamoeba histolytica. El contagio se produce por la ingestión de los quistes infectivos. En el tubo digestivo del hombre evolucionan a formas que pueden permanecer intraluminales, invadir la mucosa y llegar al torrente sanguíneo o ser eliminadas con las heces. Las manifestaciones intestinales son las más frecuentes, pero también pueden darse extraintestinales, con formación de abscesos hepáticos, pulmonares o cerebrales. Se han descrito casos de artritis infecciosa, artritis reactiva, púrpura de Schonlein-Henoch y glomerulonefritis por inmunocomplejos. Otras amebas, que suelen considerarse huéspedes no agresivos, como Endolimax nana, Iodamoeba bütschlii y Blastocystis hominis y que de hecho no suelen tratarse, han sido implicadas en cuadros de artritis infecciosa y de artritis reactiva.
En un paciente con AR, en tratamiento con dosis medias de prednisona, que desarrolló diarrea y un aumento marcado de la artritis en una rodilla se demostró la presencia de B. hominis en las heces y en el líquido sinovial. La respuesta a metronidazol, tanto de la diarrea como de la artritis infecciosa, fue completa29. Este caso pone de manifiesto que B. hominis puede diseminarse en pacientes inmunodeprimidos, por lo que es planteable descartarlo y, en su caso, erradicarlo en los pacientes que vayan a recibir tratamiento inmunosupresor.
El diagnóstico se realiza generalmente por identificación del parásito en las heces, aunque en ocasiones es necesaria la toma de biopsia, como puede ser en el caso de la existencia de manifestaciones no digestivas, entre ellas la artritis. En las zonas no endémicas el empleo de la serología mediante ELISA, con una alta especificidad y sensibilidad, facilitan el diagnóstico.
El tratamiento antibiótico debe incluir un agente que mate los parásitos que han invadido las mucosa digestiva (metronidazol en dosis de 500/8h durante 7 días) y a continuación uno que elimine los quistes intraluminales (como la paramomicina en dosis de 500/8h durante 7 días).
LeishmaniasisLa leishmaniasis representa un complejo abanico de formas clínicas, de manera que según la especie y el estado inmunológico del paciente pueden dar lugar a la forma cutánea o a la visceral. Se trata de una zoonosis transmitida al hombre por un mosquito que actúa de vector. El diagnóstico se realiza por la identificación mediante tinción giemsa en las muestras tisulares adecuadas. La serología tiene inmunidad cruzada con Trypanosoma cruzi, por lo que sería útil en pacientes sospechosos no provenientes de las áreas endémicas para la tripanosomiasis. El tratamiento de elección consiste en anfotericina liposomal o antimoniales.
Resulta especialmente interesante, por el hecho de que ya se ha publicado un caso de leishmaniasis en un paciente en tratamiento prolongado con anti-TNF-α30. Por ello, algunos autores recomiendan su búsqueda periódica, mediante test serológicos, no de forma sistemática, sino en pacientes sometidos a estos tratamientos que vivan en zonas endémicas (Centroamérica, Sudamérica, menos Chile y Uruguay, y Europa del Sur, incluyendo algunas áreas de España).
CoccidiosLos coccidios son protozoos de distribución mundial, la Isospora belli es la única del grupo con un claro predominio en países subdesarrollados. En general producen cuadros de enteritis de gravedad inversamente proporcional al estado de inmunocompetencia del portador. Se ha asociado de forma infrecuente a manifestaciones articulares, en especial artritis reactiva. González Domínguez et al presentaron un caso de una paciente son sida, diarrea y poliartritis seronegativa, en la que se aisló I. belli en las heces. Tanto el cuadro digestivo como el articular respondieron al tratamiento con trimetoprim-sulfametoxazol31.
TripanosomiasisHay dos tipos de tripanosomiasis, la africana o enfermedad del sueño, originada por el Trypanosoma brucei gambiense o por el Trypanosoma rhodesiense y la tripanosomiasis americana o enfermedad de Chagas, endémica en América Latina, producida por Trypanosoma cruzi. En ambos casos se han asociado complicaciones ME, en forma de polimiositis, pero de nuevo son poco frecuentes.
Patología importada no infecciosaAnemia de anemia de células falciformesSe trata de una hemoglobinopatía hereditaria autosómica dominante, en la que los heterocigotos sólo presentan clínica en caso de hipoxemia y los homocigotos sufren una anemia hemolítica crónica, infecciones de repetición y crisis venooclusivas dolorosas con dolor abdominal, óseo, etc., según el territorio afectado. La persistencia del dolor más de 2 semanas orienta hacia la aparición de complicaciones, en nuestro campo, de necrosis avasculares, o de artritis u osteomielitis séptica, generalmente por Salmonella.
El diagnóstico se realiza con la demostración de la hemoglobina S por electroforesis. La terapia consiste en el alivio de los síntomas y el tratamiento de las complicaciones que puedan aparecer.
Michel et al estudiaron un grupo de pacientes con conectivopatía y falciformación. Investigaron el curso de la conectivopatía a lo largo de una media de 4,5 años tras el diagnóstico. Se trató de pacientes con AR, lupus eritematoso sistémico (en algunos casos incompleto, pero con necesidad de tratamiento de fondo), síndrome de Sjogren primario o esclerosis sistémica. Observaron que el curso de la conectivopatía no empeoraba por la coexistencia de la anemia de células falciformes, pero aquellos pacientes que recibieron corticoterapia e inmunosupresión experimentaron infecciones graves con mayor frecuencia. Por ello, los autores propusieron valorar muy bien el balance riesgo–beneficio en estos enfermos, así como realizar un seguimiento más riguroso32.
Enfermedad de Kashin-BeckSe trata de una osteoartropatía caracterizada por alteraciones del cartílago de crecimiento y epifisarias, con alteración del crecimiento, deformidad, destrucción ósea y fenómenos degenerativos secundarios, de etiología no bien definida, pero que parece asociada a déficit de yodo y selenio y al consumo de cereales contaminados con hongos. Afecta a niños y adolescentes de Siberia, China, Tibet y África Central. Son cuadros poco frecuentes, pero por los que podrían consultar padres con hijos adoptados provenientes de aquellas zonas.
ConclusionesExiste un nuevo grupo de enfermedades, antes poco conocidas en nuestro medio, de prevalencia creciente, que constituyen un reto diagnóstico y terapéutico. El clínico debe considerar estos nuevos diagnósticos en pacientes que se hayan expuesto a los agentes causantes. El diagnóstico certero permite un tratamiento curativo en muchos casos, mientras que el uso de inmunosupresores puede desencadenar importantes complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Al personal y a los enfermos del Hospital Divina Providencia de Luanda, por su acogida y ayuda.
Al Dr. Eduardo Malmierca por su colaboración y sus fotografías.
Al Servicio de Reumatología del Hospital Infanta Sofía por su apoyo.