El proceso del envejecimiento comporta una serie de cambios fisiológicos a nivel de los diversos órganos y sistemas del cuerpo humano. A nivel del tejido muscular esquelético se produce una pérdida progresiva de masa y fuerza que se conoce como sarcopenia.
Diversas actuaciones contribuyen a su aparición, como la menor actividad física, la malnutrición, la comorbilidad y la existencia de diversos cambios hormonales (hormonas sexuales, hormona de crecimiento, insulin-like growth factor, vitamina D), bioquímicos (interleucinas, miostatina) y genéticos (gen de la miostatina, gen de la enzima angioconvertasa).
Su diagnóstico se basa en la medición de la masa y fuerza muscular, determinando unos puntos de corte que se correlacionan con el riesgo de aparición de complicaciones.
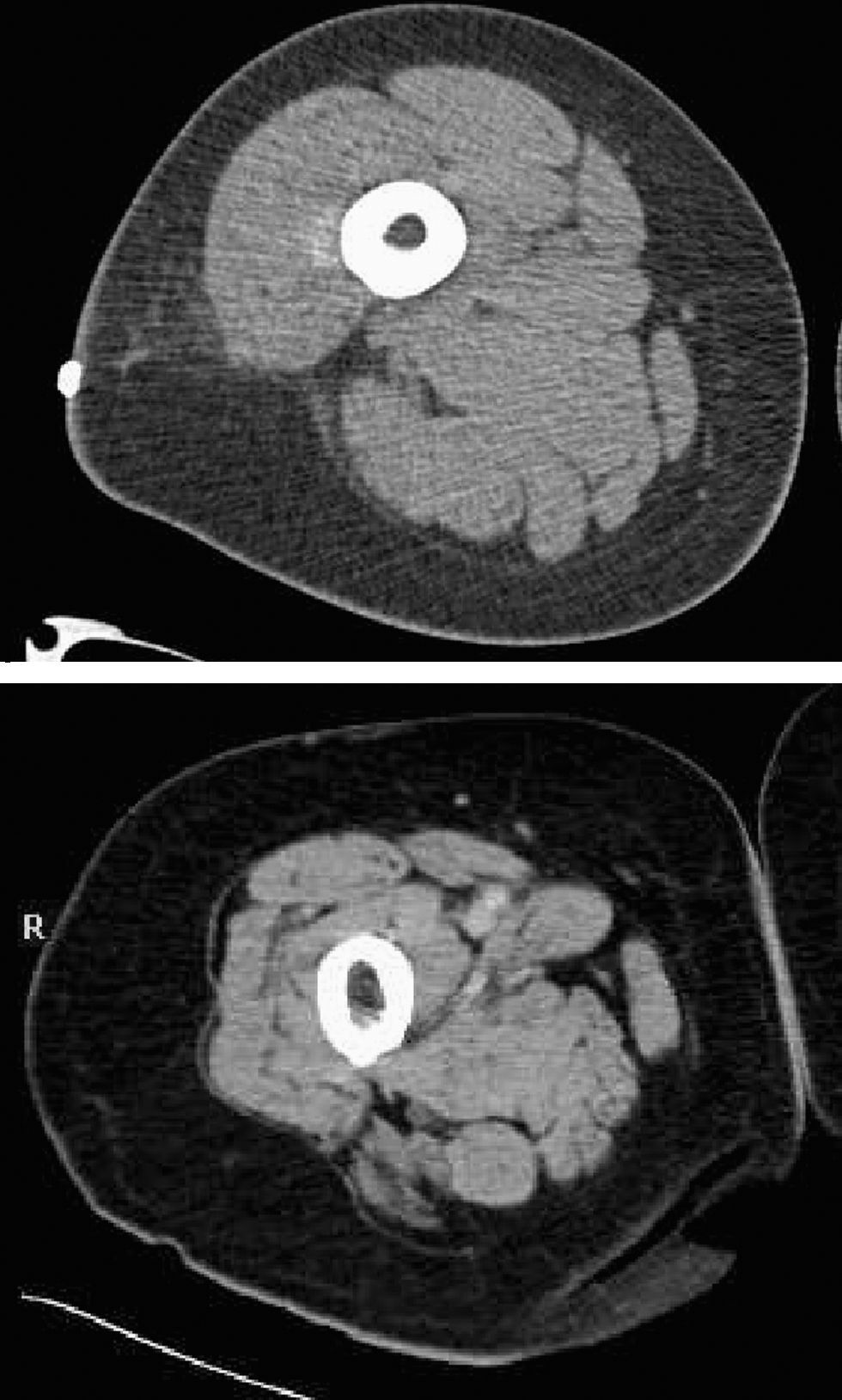
Para su estudio se utilizan la resonancia magnética nuclear, la tomografía axial computadorizada, la absorciometría dual de energía de rayos X, el análisis de bioimpedancia eléctrica, la valoración de la excreción urinaria de creatinina y la antropometría.
La presencia de sarcopenia en el anciano comporta una disminución de la capacidad funcional, con el consecuente desarrollo de discapacidad secundaria, que contribuye de manera decisiva en la génesis del denominado síndrome de fragilidad.
Su enfoque terapéutico es múltiple, aunque se basa principalmente en su prevención, destacando por su mayor utilidad el entrenamiento físico y las medidas nutricionales.
Aging involves a series of physiological changes in the various organs and systems of the human body. Sarcopenia is characterized by loss of muscle mass and strength. Several factors contribute to the development of this entity, such as decreased physical activity, malnutrition, comorbidity and the existence of a variety of hormonal (sex hormones, growth hormone, insulin-like growth factor, vitamin D), biochemical (interleukins, myostatin) and genetic changes (myostatin gene, angiotensin-converting enzyme gene). The diagnosis of sarcopenia is based on measurement of muscle mass and strength, and there are certain cut points correlated with the risk of complications. Among the diagnostic methods used are magnetic resonance imaging, dual energy X-ray absorptiometry, electrical bioimpedance analysis, assessment of urinary creatinine excretion, and anthropometry. Sarcopenia decreases functional capacity and leads to secondary disability in the elderly, making it a key element in the development of what is known as frailty syndrome. The therapeutic approach to this entity is multifaceted and largely focuses on prevention. Physical training and nutritional measures are particularly useful.
El proceso de envejecimiento humano comporta una serie de cambios a nivel de los diferentes sistemas del organismo que se traducen en una pérdida progresiva de diferentes funciones. Uno de los cambios bien descritos es el que se produce en la composición corporal y que se caracteriza por una disminución de la masa magra junto con un incremento paralelo de la masa grasa (fig. 1).
El sistema muscular esquelético a partir de la tercera década de la vida sufre una lenta pero progresiva pérdida de la masa y fuerza muscular, circunstancia que se acentúa a partir de los 65–70 años1–3. A partir de los 50 años la masa muscular disminuye entre un 1–2% anualmente y la fuerza muscular lo hace entre un 1,5–3% a partir de los 60 años. En los varones el proceso es más progresivo, mientras que las mujeres presentan un brusco descenso coincidiendo con la menopausia4–7.
Descrito a finales de la década de los 80 por Rosenberg, a este proceso se lo denomina con el nombre de sarcopenia (término derivado del griego “sarco” [músculo] y “penia” [pérdida]). Se considera consecuencia del envejecimiento normal, aunque si coexiste con otro proceso patológico, puede acentuarse8,9.
También se ha estudiado en otros mamíferos, como ratones o primates, y también en otros animales más primitivos, como el de un tipo de nemátodos (Caenorhabditis elegans). Dado que se trata de un proceso generalizado entre las diferentes especies y siempre ligado al envejecimiento, incluso se podría definir la sarcopenia como un biomarcador de este proceso10.
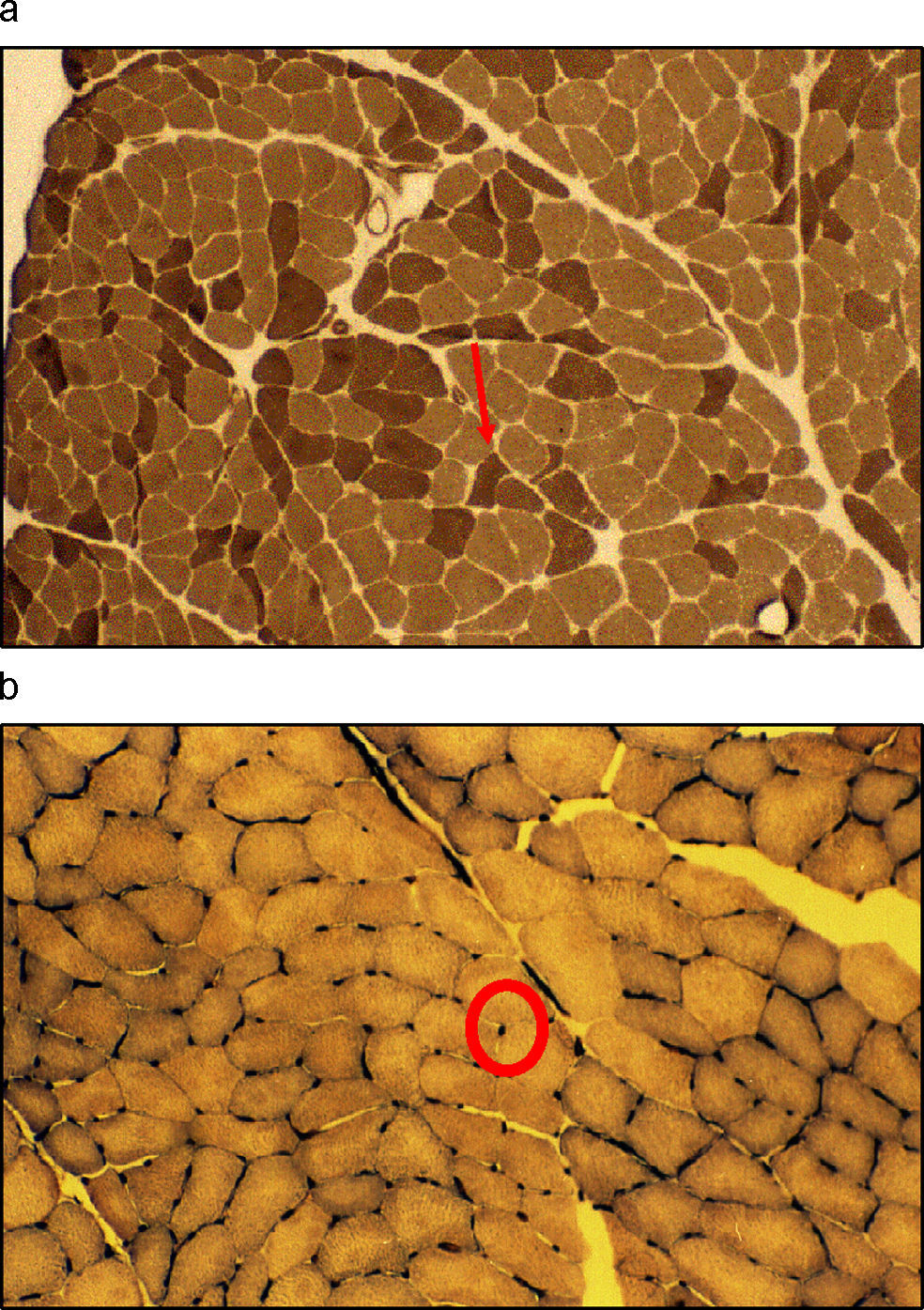
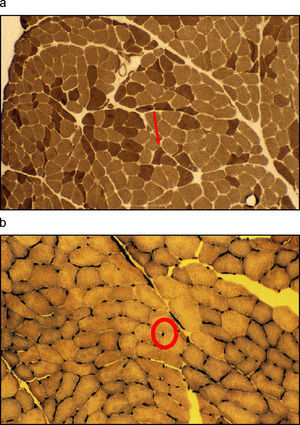
Cambios musculares en relación con el envejecimientoLos cambios a nivel muscular que se observan en el proceso del envejecimiento incluyen tanto alteraciones macroscópicas, que se traducen en una disminución de la cantidad total de masa muscular, como microscópicas a nivel estructural con una traducción funcional. De este modo, los efectos observados tienen una doble vertiente: cuantitativa y cualitativa. Se han descrito alteraciones bioquímicas, disminución de la actividad metabólica, cambios en la distribución del tamaño de las fibras musculares, pérdida de motoneuronas periféricas y denervación selectiva de fibras de tipo ii (tabla 1).
Cambios producidos en el tejido muscular con el envejecimiento
|
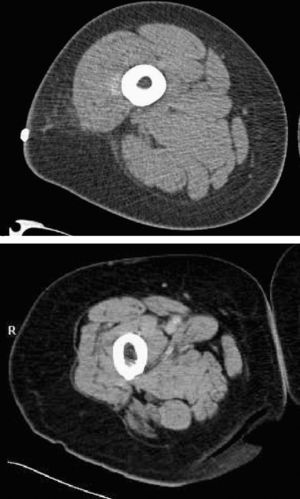
Con el envejecimiento, el músculo esquelético disminuye en volumen debido a una reducción de las unidades motoras que afecta tanto a las fibras nerviosas (menor número, en torno al 50%, y diámetro de las motoneuronas alfa) como a las musculares, en especial por la pérdida de fibras de tipo ii (menor porcentaje —20–60%— y área seccional) y que se traduce en una alteración de la capacidad contráctil. También se observa una disminución en el número de capilares11–15 (fig. 2).
A nivel bioquímico, se observa un incremento del estrés oxidativo que parece comportar modificaciones a nivel del ADN (nuclear y mitocondrial), que a su vez podrían ser la base de las alteraciones macroscópicas y microscópicas presentes. También se observan cambios moleculares tanto en las cadenas de miosina como en las de actina16.
Debido a que el gasto metabólico en un adulto sano está condicionado entre un 70–75% por el tejido muscular existente, la disminución de la masa muscular comporta una disminución del gasto metabólico basal y del recambio proteico global.
PrevalenciaLa gran variabilidad observada en la prevalencia de sarcopenia observada en la población anciana se debe a diferentes factores, pero esencialmente depende de las características de la población estudiada (general, sana, enferma) y de la metodología empleada.
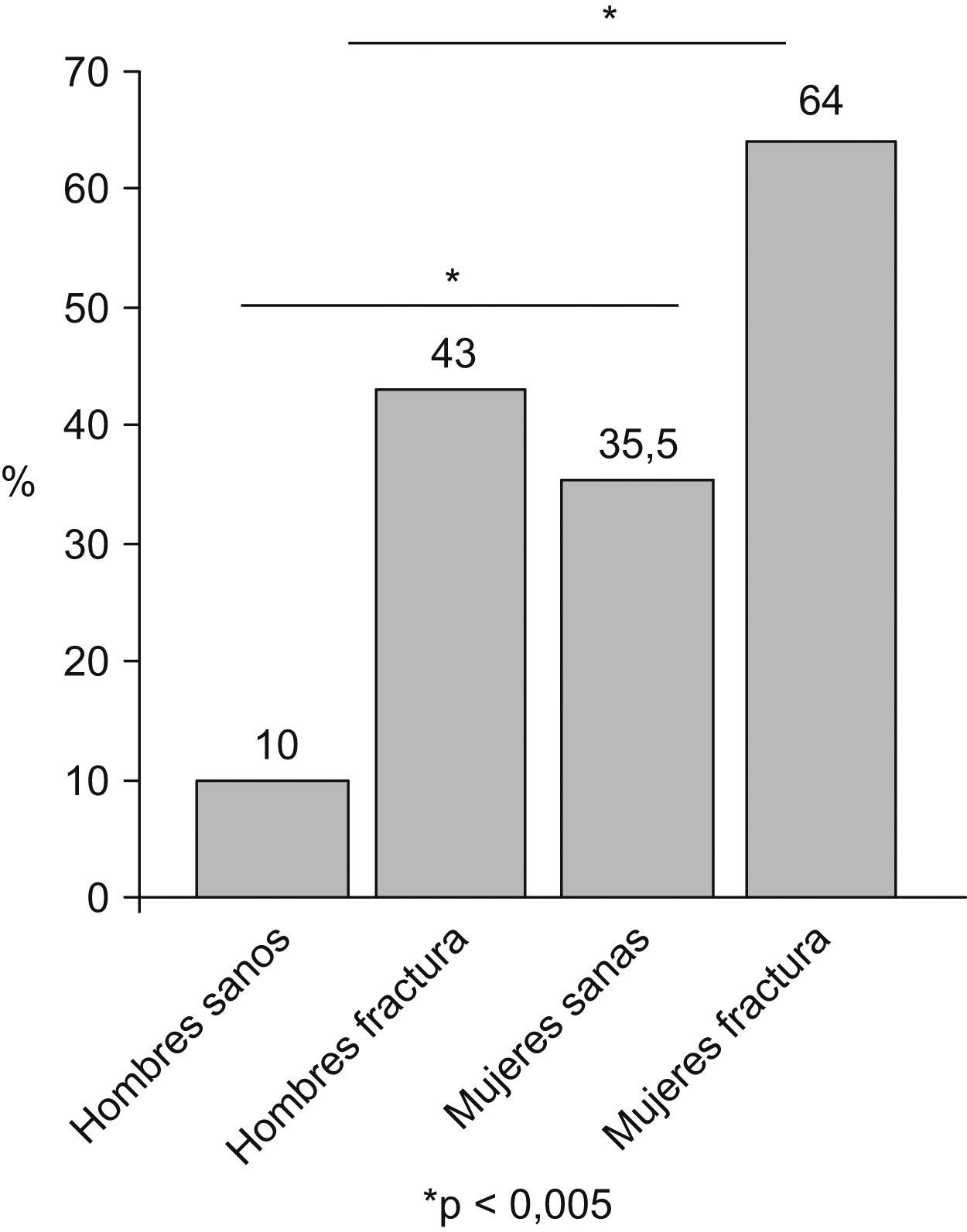
En los estudios con población anciana sana de la comunidad se observa una elevada prevalencia, por lo general mayor en el sexo femenino y que se incrementa con la edad. En uno de los primeros estudios realizados en EE. UU. hace ya una década, se describe una prevalencia de un 20% en los varones de entre 70 y 75 años que alcanza hasta el 50% de los mayores de 80 años, y en las mujeres las cifras descritas fueron del 25 y del 40%, respectivamente17. Un trabajo más reciente efectuado en Francia ha mostrado unos datos de prevalencia en ancianos del 12,5% en varones y del 23,6% en mujeres18. Por el contrario, otros estudios similares realizados en Taiwán muestran cifras del 23 y del 18,6%, respectivamente19. En un estudio con población anciana sana de la ciudad de Barcelona, nuestro grupo ha encontrado una prevalencia del 10% en varones y del 35,5% en mujeres20.
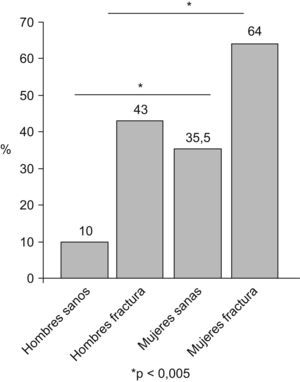
Cuando se realizan trabajos en los que la población diana presenta algún tipo de patología, por ejemplo una fractura del fémur, las cifras de prevalencia son muy superiores. Así, un trabajo realizado en Australia revela una prevalencia total de sarcopenia en ancianos con fractura del fémur del 75%21. En otro estudio realizado por nuestro grupo en ancianos con fractura del fémur, hemos observado una prevalencia del 43% en varones y del 64% en mujeres, es decir, prácticamente el doble de la detectada en ancianos sanos de la comunidad22 (fig. 3).
Prevalencia de sarcopenia en dos cohortes, una de ancianos sanos y otra con fractura del fémur22.
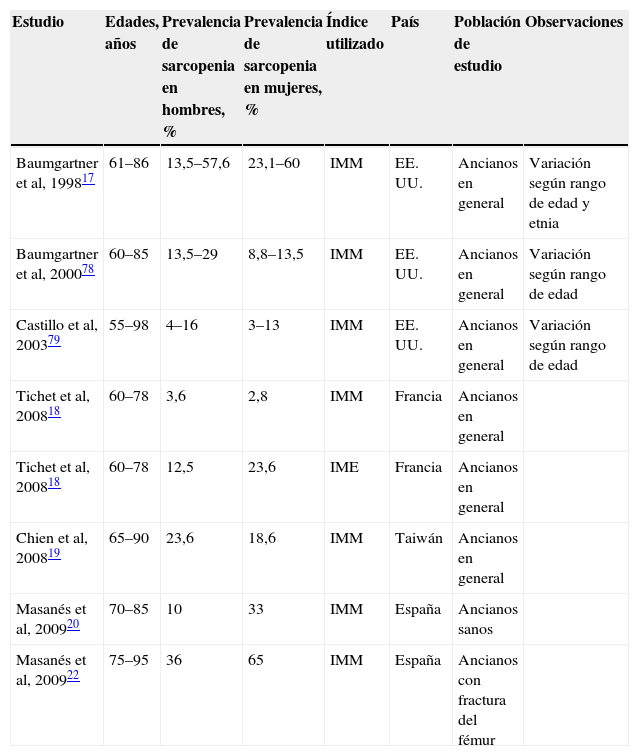
En la tabla 2 se presenta un resumen con los datos de prevalencia de sarcopenia más relevantes publicados hasta la actualidad.
Prevalencia de sarcopenia
| Estudio | Edades, años | Prevalencia de sarcopenia en hombres, % | Prevalencia de sarcopenia en mujeres, % | Índice utilizado | País | Población de estudio | Observaciones |
| Baumgartner et al, 199817 | 61–86 | 13,5–57,6 | 23,1–60 | IMM | EE. UU. | Ancianos en general | Variación según rango de edad y etnia |
| Baumgartner et al, 200078 | 60–85 | 13,5–29 | 8,8–13,5 | IMM | EE. UU. | Ancianos en general | Variación según rango de edad |
| Castillo et al, 200379 | 55–98 | 4–16 | 3–13 | IMM | EE. UU. | Ancianos en general | Variación según rango de edad |
| Tichet et al, 200818 | 60–78 | 3,6 | 2,8 | IMM | Francia | Ancianos en general | |
| Tichet et al, 200818 | 60–78 | 12,5 | 23,6 | IME | Francia | Ancianos en general | |
| Chien et al, 200819 | 65–90 | 23,6 | 18,6 | IMM | Taiwán | Ancianos en general | |
| Masanés et al, 200920 | 70–85 | 10 | 33 | IMM | España | Ancianos sanos | |
| Masanés et al, 200922 | 75–95 | 36 | 65 | IMM | España | Ancianos con fractura del fémur |
IME: índice de masa esquelética; IMM: índice de masa muscular.
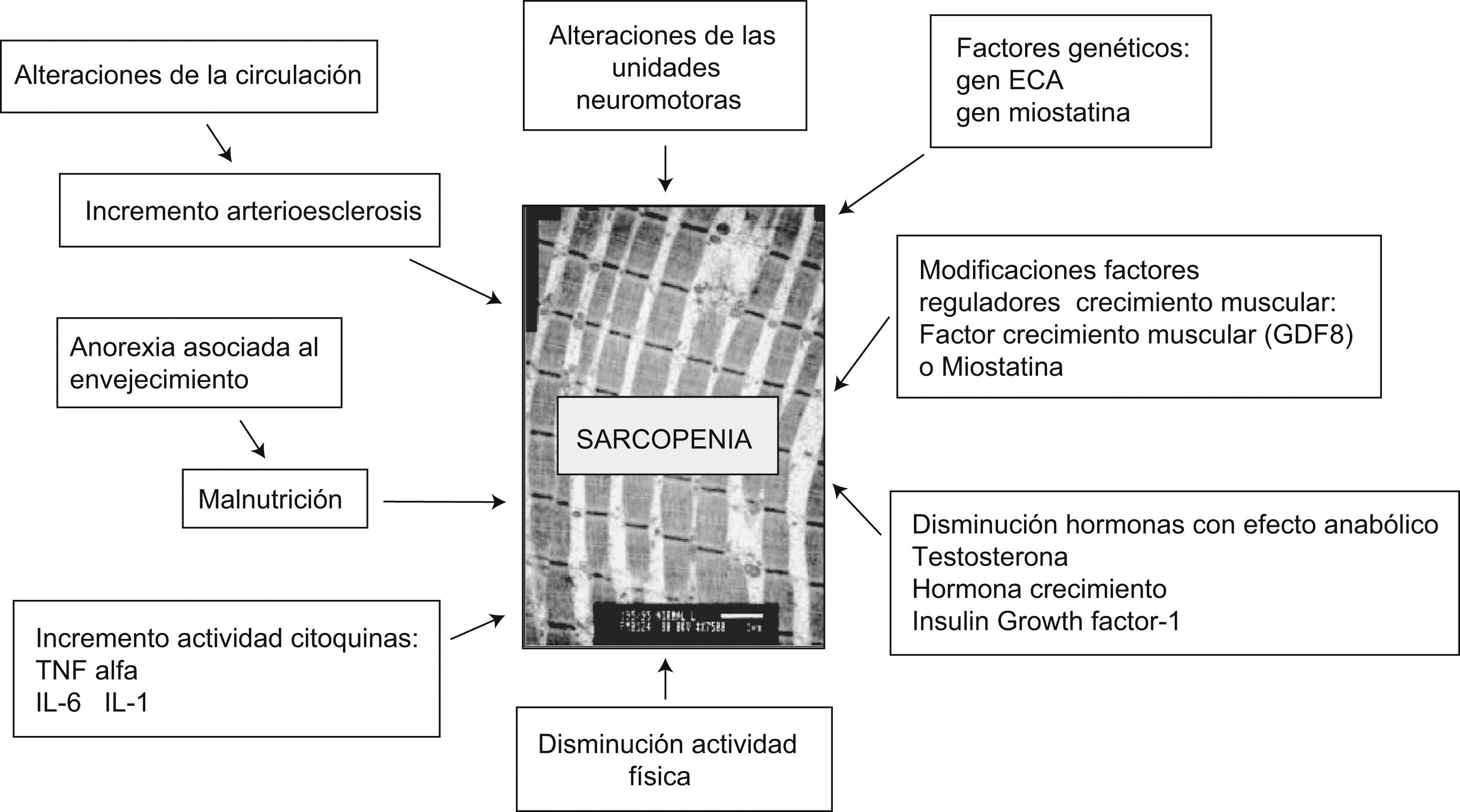
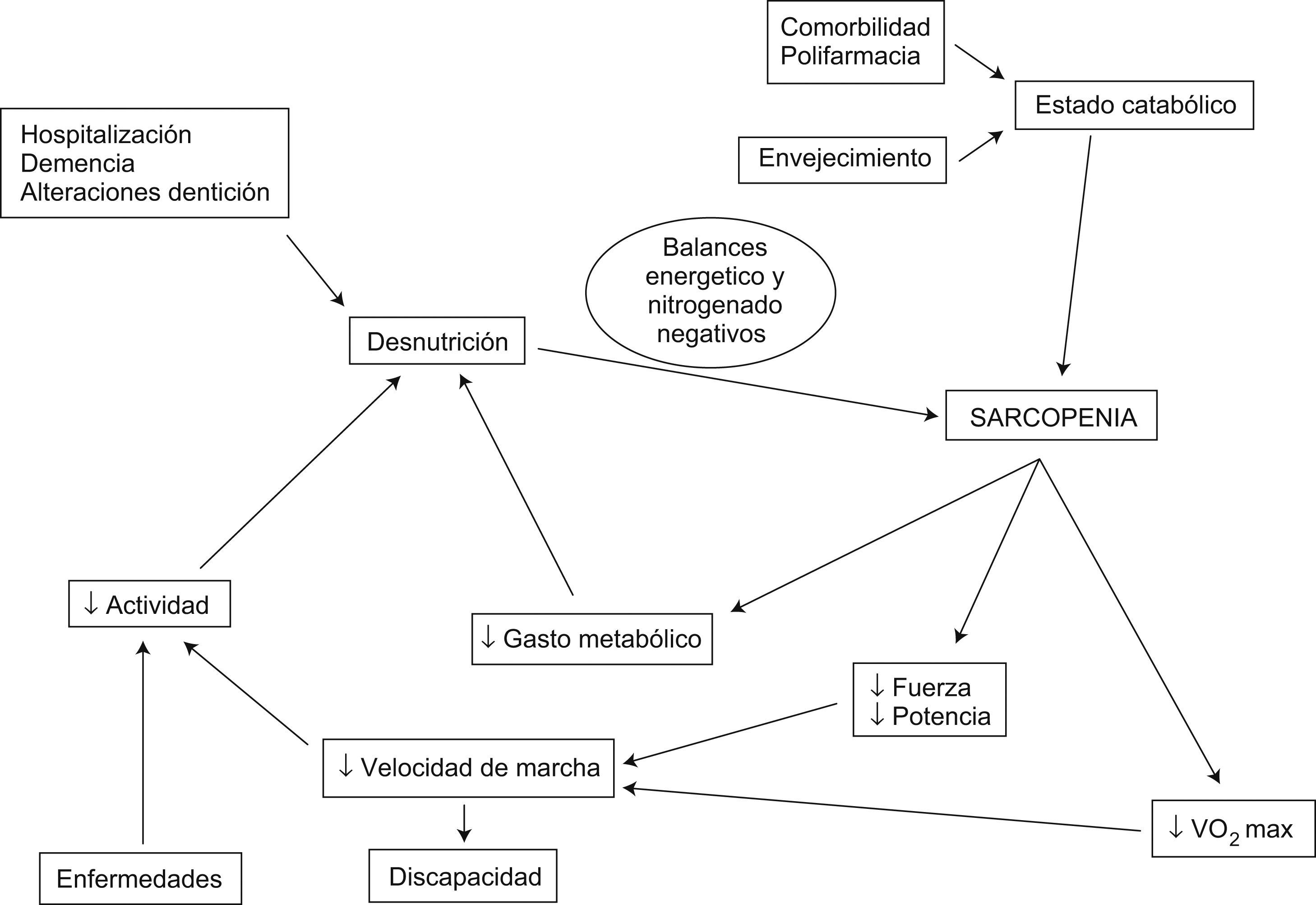
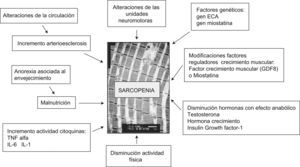
Al igual que en el proceso fisiológico del envejecimiento, en el desarrollo de la sarcopenia intervienen múltiples factores que con diferente intensidad modulan su evolución. Su conocimiento es de gran utilidad dado que nos permitirá conocer aquellos factores implicados que nos expliquen su mayor o menor intensidad. Entre estos factores destacan el grado de ejercicio físico, el estado nutricional, ciertos cambios hormonales, alteraciones bioquímicas secundarias a cambios en la respuesta inflamatoria, el incremento de ciertos factores moduladores, como la miostatina, y una base genética predisponente6 (fig. 4).
Los factores citados anteriormente, por otra parte, se encuentran interrelacionados y pueden potenciar el efecto negativo sobre la masa y fuerza muscular de los ancianos.
Influencia genéticaLa influencia genética parece ser uno de los factores que más contribuyen en la variabilidad interindividual existente tanto de la masa muscular como de la función muscular, y por ello parece lógico pensar que deben contribuir al desarrollo de la sarcopenia.
Diversos estudios epidemiológicos concluyen que parte de la fuerza muscular o de la capacidad para realizar las actividades básicas de la vida diaria son debidas a factores hereditarios. No obstante, el número de estudios sobre qué genes pueden determinar las características del músculo esquelético es todavía relativamente escaso.
En los últimos años se han descrito alteraciones genéticas que condicionan modificaciones en el metabolismo proteico y en la función muscular. Algunas de estas alteraciones se describen en los genes del factor de crecimiento/diferenciación 8 (miostatina), en el gen de la enzima conversora de la angiotensina (ECA) y en los genes relacionados con la vitamina D6.
Recientemente se han descubierto los genes relacionados con la miostatina, que se sitúan en el cromosoma 2 q y son responsables de la producción de la miostatina. La existencia de modelos animales homocigóticos para estos genes con un desarrollo muscular excepcional o la descripción de mutaciones raras a nivel humano (niño Hércules)23 explicarían su papel en el desarrollo de sarcopenia. La presencia de polimorfismos de dicho gen son difíciles de valorar dada su baja incidencia poblacional (2%), hay pocos trabajos realizados y además presentan un número escaso de individuos. Parece ser que el polimorfismo K153R está asociado a una mayor prevalencia de sarcopenia24–28.
El gen de la ECA es uno de los más estudiados en relación con la actividad física, y se relaciona con la sarcopenia por la actividad del sistema renina angiotensina a nivel muscular. Así, un incremento en la actividad de la ECA produce mayores niveles de angiotensina ii y menores de bradicinina, ambas con acción sobre este tejido. Los polimorfismos del gen ECA se dividen en tres según exista o no ausencia de 287 pares de bases (delección/delección, inserción/delección o inserción/inserción). La presencia de delección se traduce en mayor actividad de la ECA tanto a nivel tisular como plasmático. Los polimorfismos de inserción (presencia de dichas bases) se asocian a mayor capacidad de resistencia muscular, a un mayor ahorro del almacenamiento graso durante el entrenamiento y en conjunto a una mayor eficacia de la acción muscular28–31, siendo también conocido su efecto protector sobre la miocardiopatía enólica32.
Ciertos polimorfismos en el gen del receptor de la vitamina D tienen efecto sobre el músculo estriado y alguno de éstos se han asociado a la aparición de sarcopenia en los ancianos6.
Influencia del desarrolloLa plasticidad del desarrollo se define como la capacidad de un determinado genotipo en producir más de una forma de estructura, estado fisiológico o conducta en respuesta a unas condiciones ambientales, dicho fenómeno parece producirse, en especial, en fases tempranas de la vida. Diversos modelos animales demuestran la plasticidad del desarrollo a nivel muscular.
Según esta teoría, la sarcopenia también se ha asociado al bajo peso al nacer en ambos sexos y de forma independiente al peso y a la altura alcanzados en la edad adulta. Este hecho podría explicar un riesgo adicional para el desarrollo de sarcopenia en ancianos si existe una predisposición genética33.
Factores bioquímicosCiertas enfermedades altamente prevalentes en los ancianos (cáncer, enfermedad pulmonar obstructiva crónica o insuficiencia cardíaca) se asocian a un incremento sérico de los niveles de citocinas que pueden explicar la pérdida de peso corporal (incluyendo también masa muscular) que se conoce como caquexia. Incluso en ausencia de enfermedades caquectizantes, el propio proceso de envejecimiento se asocia a un incremento crónico y gradual de la producción de citocinas proinflamatorias, en concreto la interleucina 1, el factor de necrosis tumoral y la interleucina 6, que condicionan un estado inflamatorio subclínico. Esta situación crea un efecto catabólico directo junto con un efecto anorexigénico y a la vez favorece la disminución de otros factores anabólicos (hormona de crecimiento [HC] o insulin-growth factor [IGF] 1)34–36.
Estas alteraciones bioquímicas tienen una influencia sobre el balance muscular global provocando cambios en el recambio proteico y favoreciendo el desarrollo de sarcopenia.
Recientemente se ha descrito la existencia de una proteína, la miostatina o factor 8 de crecimiento y diferenciación, que forma parte del grupo de proteínas conocidas como transforming growth factor beta y que actúa como regulador negativo de la masa muscular esquelética, determinando el número y tamaño de las fibras musculares. Esta proteína está formada por 376 aminoácidos y consta de una secuencia señal, un péptido N terminal y un terminal activo. A lo largo de la embriogénesis se expresa en las células del miotomo y regula el número final de fibras por formar. Durante la vida adulta se produce en el propio tejido muscular, circula por el torrente sanguíneo y limita el crecimiento muscular. En algunos estudios se han demostrado niveles séricos más elevados en proporción directa a mayor edad y relacionados con menor masa muscular26,37–41.
Factores hormonalesEl proceso de envejecimiento se acompaña de una disminución en los niveles de diversas hormonas, algunas de las cuales están relacionadas claramente con el metabolismo muscular: la insulina, la HC, el IGF-1, el cortisol, la vitamina D y las hormonas sexuales esteroideas (testosterona y estrógenos).
Los cambios en la composición corporal y, en especial, el incremento del tejido graso que acompañan al envejecimiento se asocian a un incremento del riesgo de presentar insulinorresistencia. La insulina estimula selectivamente la síntesis proteica a nivel muscular, pero en los ancianos dicho efecto parece estar algo disminuido en comparación con las personas más jóvenes, por lo que su papel predisponente en el desarrollo de sarcopenia no está bien establecido.
Los estrógenos disminuyen de forma progresiva con la edad, pero tampoco está bien definido su papel en la génesis de la sarcopenia. Aunque estudios epidemiológicos y de intervención sugieren su participación en la prevención de la pérdida de masa muscular, recientes trabajos sobre terapia de sustitución hormonal no demuestran su posible efecto beneficioso sobre ésta, quizás porque su administración se acompaña de un aumento de la globulina transportadora de hormonas sexuales (GTHS) y esto comporta una disminución de la testosterona libre6.
Los niveles de testosterona disminuyen en el varón anciano a un ritmo de un 1% anual, junto con un incremento de los niveles de GTHS, por lo que la testosterona libre presenta una mayor disminución. La testosterona es uno de los factores reguladores más importantes de la función de las células satélite musculares. Se han publicado diversos estudios que concluyen que la administración de testosterona ha contribuido a mejorar la cantidad de masa muscular y la capacidad funcional de los ancianos4,42–45.
La HC, que puede actuar por efecto directo o mediante el IGF-1, también disminuye con el proceso de envejecimiento y, asimismo, tiene un potencial papel sobre el desarrollo de sarcopenia debido a la disminución de la función anabólica. Algunos de estos cambios tienen similitudes con los producidos en personas jóvenes con déficit de HC. No obstante, parecen tener un papel mayor sobre la cantidad de masa que sobre la fuerza muscular. Además, los estudios publicados presentan resultados contradictorios, ya que la propia actividad física parece ser un regulador de este eje hormonal35,38,42,46–48.
Una hormona cuya secreción aumenta con la edad es el cortisol, que tiene un papel catabólico bien conocido y que, por tanto, podría tener un hipotético efecto sobre el desarrollo de sarcopenia.
Recientemente, se ha relacionado la disminución de los niveles de vitamina D que se produce con el envejecimiento con el desarrollo de sarcopenia. La presencia de receptores de vitamina D a nivel muscular parece relacionarse con un correcto desarrollo y crecimiento muscular. Asimismo, la vitamina D juega un papel en la activación de la proteincinasa C, que tiene efecto sobre la síntesis proteica, y en el paso de calcio al citosol. Sin embargo, una vez más los estudios realizados muestran resultados contradictorios49–51.
En un trabajo realizado por nuestro grupo en ancianos sanos de la comunidad, a nivel hormonal, sólo hemos encontrado asociación entre sarcopenia y los niveles de testosterona libre y GTHS (datos no publicados).
Alteraciones mitocondriales y apoptosisUna de las consecuencias del estrés oxidativo que se produce en el proceso del envejecimiento es la acumulación de mutaciones a nivel del ADN mitocondrial muscular que se traduce en una reducción de la síntesis proteica, la de ATP, y finalmente provoca la muerte de la fibra muscular. No obstante, parece que su causa principal es más la baja actividad física que el propio avance de la edad.
El acúmulo progresivo de mutaciones a nivel del ADN mitocondrial se asocia a una aceleración de la apoptosis de los miocitos que conlleva una pérdida de masa muscular, en especial de las fibras tipo ii6.
Actividad físicaEs conocida la relación entre el nivel de actividad física y la pérdida de masa, composición (relación tipo de fibras) y fuerza muscular a cualquier edad. Diversos estudios sobre el efecto del encamamiento prolongado indican que incluso se pierde la fuerza antes que la masa muscular. Debido a la asociación entre el envejecimiento y la disminución de la actividad física, en muchas ocasiones condicionada por diversos tipos de comorbilidad, el nivel de actividad física parece jugar un papel importante tanto en el desarrollo como en la prevención de la sarcopenia.
Así, pues, el ejercicio físico tiene un efecto protector frente al desarrollo de la sarcopenia. No obstante, múltiples publicaciones indican que dicho efecto viene condicionado por el tipo de ejercicio realizado y, en concreto, aquellas actividades aeróbicas (caminar, correr, bicicleta o nadar) que incrementan el consumo máximo de O2 son las que se acompañan de una mejora en la calidad muscular y a la vez se asocian a menor morbimortalidad. Este tipo de ejercicio no contribuye a la hipertrofia muscular a diferencia de los ejercicios de resistencia, pero estimulan la síntesis proteica muscular. Los ejercicios de resistencia también se relacionan con una mejor función muscular y se ha descrito un incremento de la fuerza incluso en personas muy mayores que los realizan6,34,41,43.
Cabe destacar que la actividad física derivada de actividades lúdicas no es suficiente para prevenir la sarcopenia y debe ser un programa de ejercicios, tanto aeróbicos como de resistencia, el que nos permita su prevención.
Aspectos nutricionalesLa síntesis proteica muscular disminuye en un tercio en las personas ancianas, pero no está bien establecido si ello es debido al propio envejecimiento, a trastornos nutricionales, a la comorbilidad o a la reducción de la actividad física.
Diferentes factores, intrínsecos y extrínsecos, suelen conllevar en el anciano una disminución en la ingesta, lo que suele traducirse en niveles importantes de desnutrición (en especial proteica). Entre la segunda y la octava década de vida la ingesta energética total disminuye entre 800 y 1.200Kcal/día y paralelamente también lo hace la ingesta proteica. Por consiguiente, se produce una pérdida de masa muscular al producirse un catabolismo negativo5,43,52–54.
Deben considerarse aquellos aspectos que potencian la anorexia (problemas dentales, polifarmacia, depresión), ya que ésta es “per se” más prevalente en el anciano y por ello su correcto tratamiento puede evitar una situación de malnutrición.
Influencia de la comorbilidad y la polifarmaciaComorbilidad y polifarmacia son dos conceptos íntimamente relacionados con el envejecimiento y aunque no son causa primaria de sarcopenia pueden actuar como potenciador.
La enfermedad obstructiva crónica y la insuficiencia cardíaca son dos patologías con alta prevalencia en los pacientes geriátricos que se asocian a conocidas alteraciones en el tejido muscular, bien por efecto inflamatorio directo, malnutrición, disminución en la capilaridad muscular, alteraciones en el aporte capilar de O2 o por alteraciones de la función mitocondrial. Por ello, un correcto abordaje en su diagnóstico y tratamiento puede ayudar a prevenir su efecto sobre la sarcopenia55,56.
Múltiples fármacos utilizados en el paciente anciano tienen efectos secundarios a nivel muscular, como la atrofia, las alteraciones mitocondriales o la toxicidad directa. Debe prestarse una especial atención al uso de glucocorticoides, betabloqueantes, inhibidores de la hidroxi-metil-glutaril-CoA reductasa o a los antiinflamatorios no esteroides57.
DiagnósticoSe utilizan dos indicadores para estandarizar la masa muscular: el índice de masa muscular (IMM) y el índice de masa esquelética (IME). El IMM, de forma similar al índice de masa corporal, se define como la cantidad de masa muscular en relación con la estatura (peso total de la masa muscular/altura2: kg/m2), mientras que el IME es el porcentaje de masa muscular en relación con el peso corporal (peso total de la masa muscular/peso corporal×100: %).
La cuantificación de la masa muscular total de una persona no es sencilla, ya que todos los métodos existentes tienen ventajas e inconvenientes. Disponemos de la resonancia magnética nuclear (RMN), la tomografía axial computadorizada, la absorciometría dual de energía de rayos X (DEXA), el análisis de impedancia bioeléctrica, la determinación de la excreción urinaria de creatinina y la antropometría6,58 (tabla 3).
Métodos utilizados para el diagnóstico de sarcopenia
| Técnica | Ventajas | Inconvenientes | Coste |
| TAC o RMN |
|
| Muy elevado |
| DEXA |
|
| Elevado |
| BIA |
|
| Barato |
| Excreción de creatinina |
|
| Barato |
| Antropometría |
|
| Muy barato |
BIA: análisis de impedancia bioeléctrica; DEXA: absorciometría dual de energía de rayos X; RMN: resonancia magnética nuclear; TAC: tomografía axial computadorizada.
Las técnicas radiológicas de diagnóstico por imagen (RMN y tomografía axial computadorizada) permiten una valoración precisa de la masa muscular total mediante la realización de diversos cortes del cuerpo que permiten conocer el volumen total de cada componente. Basándose en la diferencia de densidad del tejido muscular (1,04kg/l), permiten calcular la masa total con gran exactitud, por lo que son el método de referencia o patrón oro, pero su escasa accesibilidad y elevado coste hacen poco viable su uso de forma generalizada.
La DEXA permite estimar la composición corporal mediante el uso de DEXA, y ayudado por un programa específico, calcula la masa del tejido graso, óseo y magro. El cálculo se realiza sobre medidas realizadas en las extremidades y con estos datos se realiza la estimación de la masa muscular total. La correlación con la RMN es buena (R2=0,96) y tiene un menor coste, pero para ciertos pacientes resulta poco accesible y la valoración puede distorsionarse según la cantidad del tejido graso que infiltra el músculo59,60.
En los últimos 20 años se ha extendido el uso del análisis de impedancia bioeléctrica. Se basa en la medida de la conductividad eléctrica de los tejidos, lo que permite la cuantificación de la masa muscular a partir de fórmulas predictivas. Las alteraciones extremas del metabolismo hídrico (deshidratación o edema generalizado) pueden alterar los resultados obtenidos. Es fácil de realizar en cualquier lugar a un coste asequible, lo que la convierte en una herramienta útil en trabajos de campo. Su correlación con la RMN es buena (R2=0,95), pero muestra mayor variabilidad en los resultados respecto a las técnicas anteriormente citadas19,61,62.
La determinación de la excreción urinaria de creatinina es una medida directamente relacionada con la masa muscular total, pero requiere un control estricto de la dieta realizada y los resultados obtenidos presentan una gran variabilidad en un mismo individuo.
Por último, las técnicas basadas en la antropometría sólo dan una aproximación muy indirecta y son dependientes del observador.
Aquellos estudios en los que se ha valorado la fuerza muscular medida mediante dinamómetro a nivel de la mano o de las extremidades, también han demostrado una progresiva pérdida de fuerza con el propio envejecimento, por lo que su uso es apropiado para valorar la función muscular6.
Otra medida indirecta de la función muscular es la valoración de la velocidad de movimiento (p. ej. test de los 6 minutos, test de los pasos) que junto con la fuerza muscular nos permite conocer la potencia muscular.
Dadas las múltiples y diversas consecuencias clínicas derivadas de la sarcopenia, es fundamental definir cuándo se considera clínicamente significativa. Por consenso, de forma similar a la osteoporosis, se define la sarcopenia como un IMM o IME por debajo de 2 desviaciones estándar de la media de un grupo de referencia joven del mismo sexo6,34.
Se debe realizar un correcto diagnóstico diferencial con la desnutrición proteicocalórica y la caquexia, ya que son procesos que pueden compartir alguna característica, pero que responden a mecanismos fisiopatológicos diferentes.
Los datos de prevalencia obtenidos, según esta definición, se correlacionan con un mayor riesgo de aparición de discapacidad y/o complicaciones (caídas, dificultad para levantarse o caminar).
Sobre la base de esta definición se establecen unos puntos de corte que nos permiten diagnosticar la presencia de sarcopenia o no en una persona anciana. En la última década se han utilizado como referencia los datos publicados por Baugmgartner en 1998, que definen sarcopenia si el IMM era menor a 7,26kg/m2 en los varones y a 5,45kg/m2 en las mujeres17. Sin embargo, trabajos recientes han observado pequeñas discrepancias en dichos valores que pueden ser debidas tanto a diferencias raciales como a la técnica de medición o incluso a las distintas características de las poblaciones estudiadas. Por ello, resulta recomendable disponer de datos de referencia propios que permitan realizar una correcta estimación del problema. En un estudio realizado recientemente por nuestro grupo20 los puntos de corte para nuestra población son de 8,31kg/m2 en los varones y 6,68kg/m2 en las mujeres.
En un interesante estudio realizado en EE. UU. se identificaron los puntos de corte en función del valor, en el que el riesgo de presentar discapacidad funcional estaba incrementado de forma significativa, y se obtuvieron unas cifras muy similares a las propuestas inicialmente (8,50kg/m2 para los varones y 5,75kg/m2 para las mujeres)63.
Probablemente, en un futuro cercano sería necesario un nuevo consenso sobre la definición de sarcopenia que incluya no sólo la cuantificación de la masa muscular total, sino también aspectos funcionales, como la fuerza o el rendimiento muscular.
Consecuencias clínicas de la sarcopeniaDada la importancia que el sistema muscular esquelético tiene en la movilidad, la presencia de sarcopenia se traduce en una disminución de la capacidad funcional que conduce a la aparición de diversos síndromes geriátricos (inmovilidad, caídas) y a un incremento de la discapacidad que presenta el anciano, de ahí el interés clínico de su conocimiento.
La relevancia clínica de la sarcopenia depende fundamentalmente del nivel de masa muscular inicial y de la velocidad de la pérdida, hechos que a su vez están modulados por múltiples factores intrínsecos y extrínsecos.
Múltiples trabajos epidemiológicos relacionan la menor cantidad de masa muscular con la discapacidad, incrementando su riesgo en 2–5 veces64.
Una menor cantidad de masa muscular comporta una disminución en la capacidad aeróbica máxima. Dado que la sensación disneica se produce al alcanzar el 80% de ésta, la presencia de sarcopenia facilita que la fatiga aparezca más precozmente y a la vez disminuye la resistencia física9.
No obstante, disponemos de pocos estudios longitudinales publicados que demuestren que su valor predictivo está incrementado (riesgo de discapacidad física o de movilidad) entre 1,3 y 1,9 veces65,66. En un estudio realizado hace 5 años en EE. UU. el riesgo relativo para presentar discapacidad física, al comparar mujeres ancianas con valores de masa muscular de bajo riesgo para presentar discapacidad con aquellas que presentaban riesgo medio, fue de 1,41 y de 3,65 para los varones, mientras que si el riesgo era alto fue de 3,31 y 4,71 respectivamente63. En algunos trabajos el riesgo incrementado se observa no sólo por la propia sarcopenia, sino también por la relación existente entre masa grasa y masa muscular6.
Se ha descrito que la sarcopenia se asocia a un aumento en el riesgo de presentar ciertas enfermedades crónicas, como son la osteoporosis y la diabetes, infecciones nosocomiales o con la peor recuperación tras una enfermedad aguda. Incluso, algunos autores lo han relacionado con mayor mortalidad (es probable que dicho efecto esté relacionado con la coexistencia de una disminución de la reserva nutricional)6.
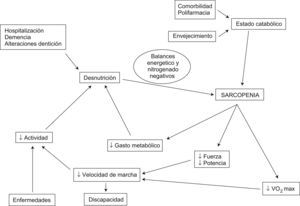
La sarcopenia desempeña un papel clave en el desarrollo del síndrome clínico de fragilidad, que es altamente predictivo de la aparición de eventos adversos en el anciano y se asocia a mayor morbimortalidad9,67 (fig. 5).
La pérdida de la capacidad funcional es especialmente relevante en aquellos ancianos mayores en los que la aparición de algún grado de discapacidad comporta enormes consecuencias sanitarias y socioeconómicas18 que incluso han sido valoradas en unos 18 billones de dolores anuales en EE. UU., lo que supone aproximadamente el 1,5% del gasto sanitario anual68.
A tenor de las futuras perspectivas demográficas que implican un envejecimiento poblacional progresivo, en especial en los países desarrollados, las implicaciones economicosanitarias de la sarcopenia serán cada vez mayores.
Enfoque terapéuticoUna vez conocidos los mecanismos fisiopatológicos implicados en el desarrollo de la sarcopenia, y dado que existe evidencia considerable de que puede ser reversible, es importante conocer qué tipo de intervenciones pueden emplearse para su prevención y tratamiento.
Entre las diversas aproximaciones terapéuticas se incluyen medidas farmacológicas, como tratamientos hormonales, bioquímicos o biológicos, y no farmacológicas, nutricionales o de entrenamiento físico.
Entrenamiento físicoEl entrenamiento físico mediante ejercicios de resistencia es la medida terapéutica más eficaz para la prevención y tratamiento de la sarcopenia, ya que produce una mejora de la masa, fuerza y resistencia muscular.
Los ejercicios pautados deben alcanzar entre un 70–80% de la capacidad física máxima y deben repetirse al menos 2 días no consecutivos cada semana. De esta forma, se consiguen resultados a partir de las 2 semanas y se observa un mayor aumento de la fuerza (entre un 15 y más del 150% de la basal) que de la masa muscular (un 5–10% más). La pauta de ejercicios debe prolongarse en el tiempo y puede indicarse incluso en ancianos muy mayores.
Los efectos secundarios son escasos siempre que se valore correctamente la capacidad física máxima6,69,70.
Para que el entrenamiento sea totalmente efectivo, debe asegurarse una ingesta proteica suficiente, y si no es posible con la dieta habitual debe recurrirse al uso de suplementos enterales.
Aspectos nutricionalesEn las personas ancianas, la malnutrición, en especial a partir de los 70 años, se asocia a un incremento de la morbimortalidad, por lo que debe mantenerse una correcta ingesta tanto cuantitativa como cualitativa. Las recomendaciones generales de una ingesta proteica de 0,8g/kg de peso pueden no ser suficientes en las personas ancianas, en especial en aquéllas con criterios de fragilidad, probablemente debido a la situación de balance energético negativo. La administración de suplementos de nutrientes específicos, como los aminoácidos esenciales ramificados del tipo leucina, parece tener un efecto antianorexígeno, estimulando además el anabolismo proteico.
Estos suplementos proteicos se recomienda que se administren una vez al día, no de forma fragmentada y tras el ejercicio físico, para que sean más efectivos.
Debe valorarse la necesidad de dar suplementos de vitamina D en caso de existir hipovitaminosis dada la implicación de esta vitamina en el desarrollo de sarcopenia6.
A lo largo de toda la vida debe mantenerse una dieta equilibrada para afrontar el envejecimiento en las mejores condiciones y así poder aminorar el proceso de la sarcopenia.
Tratamientos hormonalesUna vez conocidos los diversos factores que se encuentran implicados en el desarrollo de sarcopenia, los tratamientos hormonales han sido uno de los más estudiados en los últimos años.
La evidencia de la asociación de la testosterona con el desarrollo de la sarcopenia ha comportado la publicación de estudios dirigidos a valorar su uso en esta patología. Así, el tratamiento sustitutivo en varones jóvenes que presentan hipogonadismo comporta un incremento de la masa magra junto con una disminución de la masa grasa, aunque no está claro que su administración en varones eugonadales tenga el mismo efecto71.
Debido a que no es una terapia exenta de efectos secundarios en los ancianos (incremento del riesgo cardiovascular y aparición de neoplasia de próstata) y a la falta de estudios rigurosos, actualmente no se recomienda su prescripción.
El uso de otros esteroides androgénicos en la sarcopenia, como son la dehidroepiandrosterona, la oxandrolona o la androstendiona con efecto anabolizante, se encuentra en fase de estudio, así como el empleo de moduladores de los receptores androgénicos, que parecen tener el mismo efecto anabólico que la testosterona pero sin sus efectos secundarios y que ya se encuentran en estudios de fase i y ii72.
El uso de estrógenos en mujeres posmenopáusicas, ampliamente utilizados en la prevención de la osteoporosis, no parece modificar la masa muscular ni su función.
La administración de HC en personas jóvenes que presentan hipopituitarismo se ha asociado a un incremento de la masa y fuerza muscular, pero la prescripción de suplementos en ancianos con déficit de GH no se acompaña de dicha mejoría y, además, la incidencia de efectos secundarios en ancianos es mayor (hiperglucemia, retención de líquidos, hipotensión arterial), por lo que su administración tampoco es recomendable71.
Dada la relación que esta hormona tiene con el IGF-1, la administración del último factor podría ser útil. Actualmente existe un fármaco (rinfabato de mecasermina) formado por un complejo recombinante de IGF-1 y de la proteína transportadora de IGF que ya se ha utilizado para el tratamiento de la lipodistrofia y en algún tipo de distrofia muscular72.
Inhibidores de la enzima conversora de la angiotensinaActualmente existe gran evidencia científica sobre la utilidad de los inhibidores de la ECA para el tratamiento de la sarcopenia. Su mecanismo de acción deriva de la reducción de los niveles de angiotensina ii que se producen a nivel de las células vasculares del músculo, lo que mejora el flujo sanguíneo a nivel de la microcirculación junto con un efecto sobre el estrés oxidativo y los mecanismos de activación de la inflamación. Diversos estudios, tanto experimentales como clínicos, avalan su uso, habiéndose descrito una mejor tolerancia al ejercicio tras su administración73–76.
Bloqueantes de la acción de la miostatinaEl bloqueo de la acción de la miostatina, inhibiendo el gen promotor de ésta o su acción a nivel de receptores (estamulunab), así como el uso de drogas antagonistas de ésta (folistatina, caveolina) representan una nueva aproximación terapéutica que puede aportar nuevos beneficios en un futuro próximo. Alguno de estos tratamientos se encuentra ya en estudios de fase i y ii72,77.
Otras terapias en fase experimentalAlgunas terapias en fase experimental van dirigidas a la preservación de la neurotransmisión a nivel de las unidades motoras, como son los inhibidores de la tripsina (neurotune) y el factor ciliar neurotrófico (dapidermina). Otras incluyen algún tipo de terapia génica que modula la actividad de los genes implicados en el desarrollo de sarcopenia72.
ConclusionesLos cambios demográficos de nuestra sociedad a lo largo del último siglo presentan una característica clave que es el progresivo envejecimiento poblacional. Este hecho se traduce en un incremento del número de personas ancianas, tanto en números absolutos como relativos, con un incremento cada vez mayor de las personas muy mayores.
Un factor íntimamente ligado al proceso de envejecimiento es el desarrollo de una pérdida progresiva de la capacidad funcional que acaba desembocando en un proceso de dependencia con las múltiples implicaciones sanitarias, sociales y económicas que ello comporta. Por ello, en los últimos años, el estudio del proceso del envejecimiento y el desarrollo de fragilidad que lo acompaña se han incrementado de forma exponencial.
Uno de los factores ligados al desarrollo de fragilidad en el anciano es la sarcopenia, que deriva de una aceleración exagerada del proceso fisiológico que comporta una pérdida de masa muscular con el envejecimiento.
Dicho proceso es claramente multifactorial y a su vez existen múltiples procesos intercurrentes que pueden acelerarlo.
Debe conocerse bien esta patología dado que su correcto diagnóstico permite iniciar medidas terapéuticas dirigidas fundamentalmente a prevenir su aparición o a frenar su avance (en especial medidas nutricionales y de ejercicio físico) y de esta manera disminuir la fragilidad en los ancianos, en especial en aquéllos con mayor riesgo.
Dada la relevancia del estado muscular basal en que se llega a la vejez, es primordial recordar la importancia de iniciar las medidas preventivas ya citadas en etapas precoces y mantenerlas durante el resto de la edad adulta.
Necesitamos más estudios que profundicen tanto en la etiología como en las estrategias terapéuticas que permitan reducir la sarcopenia para conseguir mayores tasas de envejecimiento saludable.
Conflicto de interesesLos autores no refieren tener algún tipo de conflicto en la elaboración de este manuscrito.
FinanciaciónFinanciado en parte con beca FIS PI 050098.
Al Dr. J.M. Grau (Servicio de Medicina Interna, Hospital Clínic) por la cesión de las imágenes histológicas.