INTRODUCCIÓN
Denominamos nefritis lúpica (NL) al diagnóstico que se aplica a los pacientes con una enfermedad renal inflamatoria en el contexto del lupus eritematoso sistémico (LES). De entre todos los pacientes con LES, más del 60% desarrollarán afectación renal, bien como única manifestación del proceso, o bien acompañada de otros tipos de clínica1,2.
La gravedad de la NL varía desde una enfermedad subclínica leve hasta una NL proliferativa difusa, enfermedad grave que puede manifestarse con proteinuria, hematuria y deterioro de la función renal. La naturaleza y la gravedad de las características clínicas no siempre predicen la gravedad histológica subyacente, y es preciso disponer de una biopsia renal para un diagnóstico preciso.
En 1982, la OMS clasificó a la enfermedad a partir de sus características histológicas (tabla 1). Las clases I y II de la OMS presentan un pronóstico excelente y no requieren tratamiento específico. La enfermedad proliferativa (III-IV) es la más grave, y constituye la principal causa de fallo renal y mortalidad en pacientes con LES. Requiere tratamiento inmunosupresor intensivo con el objetivo de inducir la remisión y prevenir la morbimortalidad asociada a esta patología. La clase IV es la que presenta el peor pronóstico, con una supervivencia a 5 años sin tratamiento del 17%3.
Los datos referentes al tratamiento de la clase V pura son escasos. Cuando ésta se combina con la clase III o la IV se aplica el tratamiento de estas últimas.
La clase VI refleja un daño crónico sobre el riñón, por lo que no estaría indicado utilizar inmunosupresores. El pronóstico es pobre y sólo debería procederse a un control estricto de la presión arterial.
TRATAMIENTO
El tratamiento ideal de la NL debe tener una serie de características:
Disminuir la mortalidad, ya que la NL tiene un impacto significativo en la supervivencia de los pacientes con LES4.
Evitar la insuficiencia renal terminal a largo plazo, ya que del 5 al 22% de estos pacientes sin tratamiento desarrollarán insuficiencia renal terminal 10 años tras el diagnóstico5-9.
Inducir una respuesta temprana, ya que se ha visto que una disminución precoz e importante de la proteinuria de 24 h se acompaña de un mejor pronóstico10.
Inducir la remisión y disminuir el número de recaídas, ya que esto se relaciona con un mejor pronóstico renal11.
No ha de comprometer la fertilidad. Éste es un punto importante, porque muchos pacientes con LES son jóvenes en edad fértil.
Ser activo en todos los grupos étnicos, ampliamente disponible y coste-efectivo.
¿Cumple la ciclofosfamida (CYC), el fármaco más utilizado en esta patología, todos estos requisitos? Para responder a esta pregunta analizaremos las evidencias recogidas tras 30 años de su uso en LES.
La primera fase del estudio de la CYC comienza en la década de 1970, cuando Donadio et al12 demostraron la superioridad de la asociación CYC oral más prednisona sobre prednisola sola (p = 0,04).
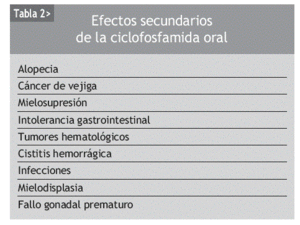
Los clínicos, sin embargo, quedaron muy consternados ante la gran cantidad de efectos secundarios relacionados con la CYC oral (tabla 2), y como resultado el National Institutes of Health (NIH) promulgó la investigación de la CYC intravenosa (i.v.).
En el primer ensayo del NIH, Austin et al5 demostraron que la CYC i.v. a altas dosis tenía una mayor eficacia que la prednisona y la azatioprina (AZA) comparadas por separado. Sin embargo, este trabajo pionero tenía muchas limitaciones, entre ellas, el pequeño tamaño muestral y el hecho de no ser un estudio aleatorizado.
En el segundo ensayo del NIH, la metilprednisolona i.v. (6 pulsos mensuales durante 6 meses; n = 25) fue comparada con cursos cortos de CYC i.v. (pulsos mensuales durante 6 meses; n = 20) y cursos largos de CYC i.v. (pulsos mensuales durante 6 meses seguidos por pulsos trimestrales hasta 24 meses; n = 20). Todos los pacientes recibieron prednisona oral.
La probabilidad de doblar los valores basales de creatinemia fue mayor en los pacientes con metilprednisolona (n = 12; 48%) y curso corto de CYC (n = 7, 35%) que en los que recibieron el ciclo largo de CYC (n = 3; 15%) (p < 0,04 para ciclo largo de ciclofosfamida frente a metilprednisolona, no significativa para ciclo largo de CYC frente a ciclo corto). La probabilidad de recaídas fue significativamente mayor en el régimen corto de CYC con respecto al de 24 meses (p < 0,01)6.
El tercer ensayo del NIH aleatoriza a 82 pacientes para recibir 12 pulsos mensuales de metilprednisolona, 6 pulsos mensuales más 6 trimestrales de CYC i.v. o su combinación.
Como se esperaba, los pacientes que recibieron metilprednisolona sola tenían una mayor probabilidad de doblar la creatinemia (p = 0,057 frente a terapia combinada) y una menor probabilidad de alcanzar la remisión (p = 0,028 frente a terapia combinada)13.
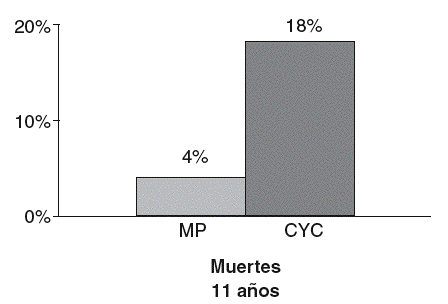
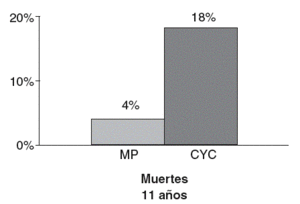
El pronóstico de esta cohorte fue reevaluado a los 11 años. El fallo del tratamiento fue significativamente menor con la terapia combinada. Sólo un paciente dobló sus valores de creatinemia, mientras que en los grupos de metilprednisolona y CYC fueron 15 y 13 pacientes, respectivamente. Sin embargo, hubo más muertes con CYC (18%) que con metilprednisolona (4%)7 (fig. 1).
Figura 1 Número de muertes con CYC y con metilprednisolona. MP: metilprednisolona; CYC: ciclofosfamida. (De Illei et al, 20017.)
Las conclusiones que se extraen de los ensayos de la NIH son, por tanto, que las dosis altas de CYC i.v. son superiores a los esteroides solos en cuanto a estabilizar la función renal, probabilidad de doblar la creatinemia y disminuir las recurrencias. Sin embargo, no mejoran la mortalidad global, son menos efectivas en pacientes de raza negra y tienen más efectos secundarios (sobre todo, insuficiencia gonadal prematura).
Este régimen de CYC i.v. (6 pulsos mensuales más 6 trimestrales) fue utilizado en un ensayo holandés para compararlo con AZA, un inmunosupresor menos tóxico que se había mantenido en un segundo plano ensombrecido por los grandes resultados de la CYC. De hecho, hubo que esperar hasta el año 2006 para disponer del primer ensayo aleatorizado que los comparase. Se aleatorizaron un total de 87 pacientes en 2 grupos. El primero de ellos recibió AZA 2 mg/kg/día, y el segundo, CYC i.v. según el régimen popularizado por el NIH. Todos recibieron pulsos de metilprednisolona i.v. A los 2 años de tratamiento todos los pacientes recibieron terapia de mantenimiento con AZA 2 mg/kg/día más 10 mg de prednisona oral. Los resultados a los 2 años no arrojaron diferencias entre ambos grupos. Las tasas de respuesta parcial y completa fueron similares, lo que sugiere una eficacia similar entre AZA y CYC14.
Sin embargo, los resultados son bien distintos tras 5 años de seguimiento, ya que el número de recaídas, el empeoramiento de la función renal y la tasa de muertes e insuficiencia renal terminal fue significativamente menor en el grupo de CYC15.
Por lo tanto, los datos en conjunto indicaron que la CYC disponía de una mayor eficacia que la AZA.
Por razones genéticas, la evolución de la NL es peor en la raza negra y en los hispanos. El porcentaje de esta población en los ensayos estadounidenses fue muy significativo. La población europea, principalmente caucasiana (85%), tiene a priori un mejor pronóstico, por ello los clínicos europeos creyeron que con menores dosis de CYC se obtendrían los mismos resultados que en los ensayos de la NIH pero con un menor número de efectos secundarios. De aquí nació el Eurolupus Nephritis Trial.
La población de estudio estaba compuesta por 90 pacientes con función renal conservada. Un primer grupo recibió un régimen similar al del NIH (un total de 9 g de CYC), mientras que el segundo grupo recibió 6 ciclos quincenales con un total de 3 g de CYC. Al término de estas pautas ambos grupos recibieron AZA 2 mg/kg/día como terapia de mantenimiento.
Los resultados obtenidos a 41 meses no ofrecieron diferencias significativas en cuanto a tasa de remisiones, recaídas o fracasos de tratamiento. Aunque no alcanzó significación estadística, el número de infecciones graves fue más frecuente en el grupo de CYC 9 g8.
En el seguimiento a 73 meses tampoco aparecieron diferencias significativas en cuanto a la probabilidad de doblar la creatinemia o al número de pacientes que alcanzaron insuficiencia renal terminal16. Por tanto, se pudo concluir que las dosis bajas de CYC i.v. fueron al menos tan efectivas como las altas y proporcionaron menos efectos secundarios. Las limitaciones de este estudio fueron, por una parte, una función renal relativamente conservada de la población estudiada, y, por otra, su origen exclusivamente europeo.
La CYC es el único fármaco del que se dispone de información a largo plazo. Las ventajas que ofrece son su buena adherencia, la alta disponibilidad y el buen precio. Los inconvenientes, la alta tasa de efectos secundarios, la menor eficacia que alcanza en la raza negra y, sobre todo, que no disminuye la mortalidad.
Por ello, la fase final de la investigación en NL se basa en los regímenes sin CYC. En este punto, la pregunta que se plantea es: "¿Puede el micofenolato de mofetilo (MMF) sustituir a la CYC como terapia de inducción en NL?".
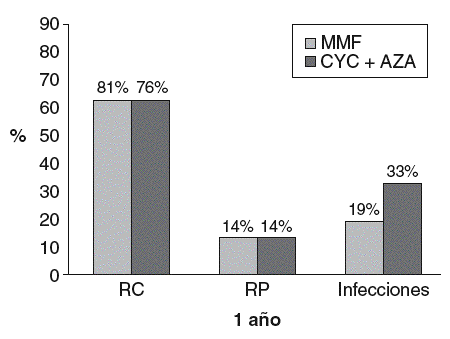
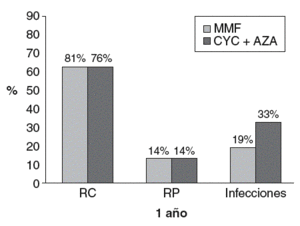
Este concepto fue presentado por Chan et al17,18, quienes compararon MMF 2 g/día durante 6 meses más 1 g/día otros 6 meses con CYC oral 2,5 mg/kg/día 6 meses más AZA 1,5 mg/kg/día 6 meses. Todos los pacientes recibieron prednisolona. En los resultados arrojados tras 12 meses de seguimiento no aparecieron diferencias virtuales entre los 2 grupos, aunque hubo más infecciones con CYC (fig. 2)17. Tras 84 meses no hubo diferencias estadísticamente significativas en cuanto a la tasa de recaídas18.
Figura 2 Resultados tras 12 meses de seguimiento. AZA: azatioprina; CYC: ciclofosfamida; MMF: micofenolato de mofetilo; RC: remisión completa; RP: remisión parcial. (De Chan et al, 200517,18.)
El estudio más amplio que compara CYC con MMF fue el llevado a cabo por Ginzler et al19. En este ensayo, 140 pacientes fueron aleatorizados en 2 grupos: 71 pacientes recibieron 3 g/día de MMF y 69 recibieron CYC según el régimen de la NIH. Todos los pacientes recibieron corticoides.
La tasa de respuesta completa fue significativamente superior con MMF (16; 22,5%) que con CYC (4; 5,8%) (p = 0,005). Como se esperaba, los efectos secundarios, particularmente las infecciones graves, fueron mayores con la CYC (n = 6) que con el MMF (n = 1).
Por lo tanto, el MMF puede ser una buena opción alternativa a la CYC como tratamiento de inducción en NL, al menos en pacientes con función renal conservada.
Más del 20% de las NL son resistentes al tratamiento de inducción inicial20. Los factores de riesgo se exponen en la tabla 3.
Llegados a este punto, podría repetirse la biopsia renal para descartar otras causas de deterioro de la función renal, como trombosis de la vena renal, infecciones, hipertensión mal controlada, fármacos como los antiinflamatorios no esteroideos, etc. La biopsia adquiere mayor importancia cuando los marcadores serológicos se mantienen persistentemente positivos. Los objetivos serían objetivar una posible transformación histológica, ver el grado de actividad residual o la progresión de los cambios histológicos irreversibles desde la instauración de la terapia inmunosupresora.
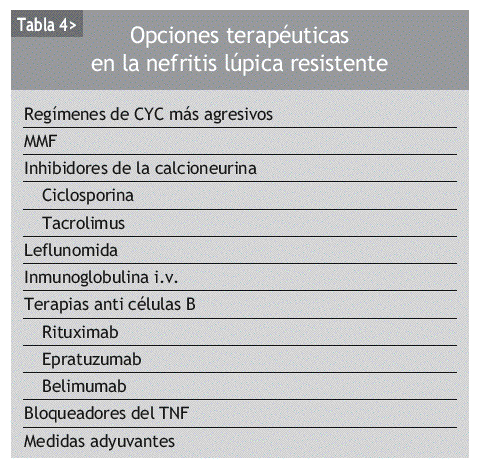
Las opciones terapéuticas en el caso de NL resistente son diversas y se exponen en la tabla 4. De entre todas ellas, están tomando mayor auge las terapias biológicas, concretamente el rituximab (RTX), un anticuerpo monoclonal dirigido contra un componente de la membrana celular de los linfocitos B (CD20) y con el que ya se dispone de experiencia en el campo de los linfomas.
Uno de los estudios más relevantes con este fármaco es el llevado a cabo por Vigna-Perez et al21. Se reunieron un total de 22 pacientes con NL clase III y IV de la OMS en los que fracasó la terapia convencional. Se les administraron 2 perfusiones de RTX a dosis entre 0,5 y 1 g, separadas entre sí por 15 días, y fueron evaluados a los 90 días. Al cabo de este tiempo pudo comprobarse una disminución significativa de la proteinuria de 24 h y del índice SLEDAI, que marca la actividad de la enfermedad. En total, más del 50% de los pacientes alcanzaron la remisión, 7 la remisión parcial y 5 la remisión completa.
Aparte de instaurar una terapia inmunosupresora agresiva, también es necesario instaurar otra serie de medidas de igual relevancia. Entre ellas se encuentran: un control adecuado de la presión arterial, especialmente con inhibidores de la enzima de conversión de la angiotensina y antagonista del receptor de la angiotensina II que además de disminuir los valores de presión arterial también son capaces por sí solos de disminuir los valores de proteinuria, abstención del tabaco, tratamiento adecuado de los trastornos lipídicos con estatinas y asociar ácido acetilsalicílico en el caso de que coexistan signos de síndrome antifosfolípido.
CONCLUSIONES
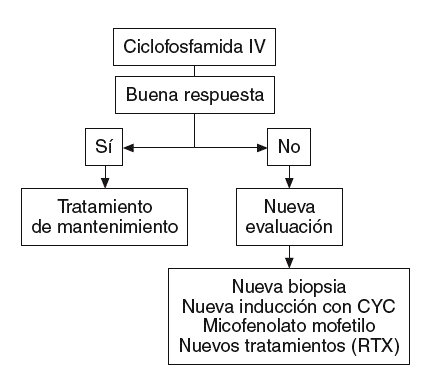
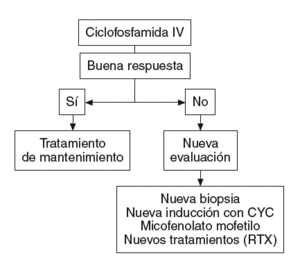
Ante una NL proliferativa, la CYC en bolos i.v. constituye la primera opción terapéutica. Puede utilizarse siguiendo el régimen clásico del NIH o bien el propuesto en el ensayo europeo. Junto a este citotóxico se administran conjuntamente bolos de metilprednisolona i.v. y prednisona oral a dosis altas.
Si hay una buena respuesta terapéutica, se inicia el tratamiento de mantenimiento.
Por el contrario, si no se ha obtenido éxito o bien aparece una recaída tras una buena respuesta inicial, podría plantearse una nueva biopsia para determinar qué cambios histológicos se han producido en el riñón.
Las principales alternativas se basan en una nueva inducción con CYC, el MMF o las nuevas terapias biológicas como el RTX (fig. 3).
Figura 3 Esquema terapéutico en la nefritis lúpica. CYC: ciclofosfamida; RTX: rituximab.