Los fármacos modificadores de enfemerdad o FAME son un conjunto heterogéneo de fármacos ampliamente usados en el tratamiento de la artritis reumatoide. En cuanto a su uso en las espondiloartropatías, la evidencia científica es limitada y poco concluyente. Examinaremos en esta revisión el papel de este conjunto de fármacos en el tratamiento de la afectación axial de las espondiloartropatías y más concretamente de su paradigma, la espondilitis aquilosante. Revisaremos los datos publicados hasta la fecha en cuanto a eficacia y tolerancia de salazopirina, mesalacina, metotrexato, leflunomida y otros tratamientos empleados de manera más anecdótica como pamidronato o talidomida. Adherido a las conclusiones acerca de su escaso papel en la afectación axial, irán algunos datos sobre su efecto en la expresión periférica y otras afectaciones frecuentes tales como la uveítis.
Disease-modifying antirheumatic drugs (DMARDs), a heterogeneous group of drugs, are widely used in rheumatoid arthritis management. The scientific evidence on the management of spondyloarthropathy with DMARDs is limited and the results are inconclusive. In this article, we review the role of DMARDs in the management of axial involvement in spondyloarthropathies, emphasizing its paradigm, ankylosing spondylitis. We review the data published to date on the efficacy and tolerability of salazopyrin, mesalazine, methotrexate, and leflunomide, as well as those of other drugs used on specific occasions such as pamidronate and thalidomide. Data on the effects of this management on peripheral symptoms and organic disease-like uveitis are also included.
El grupo de enfermedades clasificadas bajo el término espondiloartropatías o espondiloartritis (Esp) engloba una serie de entidades nosológicas de distinta naturaleza y características clínicas. Comparten como grupo conceptos tales como la asociación con el antígeno de histocompatibilidad HLA-B27 y la seronegatividad para el factor reumatoide, la afectación axial con predominio en las articulaciones sacroilíacas, la artritis periférica que afecta con mayor frecuencia a las extremidades inferiores, las entesitis y otras más específicas según el subtipo de Esp, como por ejemplo la afección de la piel y mucosas, síntomas digestivos y la uveítis. Las Esp se dividen en los subgrupos espondilitis anquilosante (EA), artritis psoriásica, artritis reactiva, artropatías asociadas a enfermedad inflamatoria intestinal y algunas formas de artritis idiopática juvenil. Aquellas formas con características de Esp que no se pueden incluir en ninguno de los subgrupos anteriores, en la actualidad se les denomina Esp indeferenciadas.
El eje que conducirá estar revisión del papel de los fármacos modificadores de enfermedad (FAME) en las Esp será la afectación axial, lo que podríamos llamar la espondiloartritis axial, aportando a raíz de esto a lo largo del texto, inevitablemente, datos referentes a otros síntomas periféricos e incluso extraarticulares, como la uveítis. Con esto, será la EA, paradigma de la afectación axial, la que guiará la revisión, sin perder de vista lo que se nos aporta en la literatura científica hoy día sobre otras Esp.
El tratamiento de las Esp en su amplio espectro clínico, tanto en su vertiente axial como en la afectación periférica, se basa hoy día en el uso de AINE como punto de partida en la mayoría de las ocasiones. Cuando fracasa dicho tratamiento, se postula el cambio a tratamientos biológicos como los anti-TNF. A mitad de camino entre estas 2 opciones terapéuticas, en la actualidad bien contrastada en su eficacia clínica, aparecen los llamados, no sin controversia, fármacos «modificadores» de enfermedad. Este grupo de FAME está formado por un conjunto de fármacos de naturaleza muy heterogénea y entre los que se encuentran habitualmente salazopirina (SSZ) y derivados, metrotexato (MTX), leflunomida (LFN), antipalúdicos y otros menos habituales como los bifosfonatos o la talidomida.
Heredado directamente de su origen en la artritis reumatoide (AR), el concepto de FAME en las Esp pudiera no ser tan adecuado como sí lo es en la AR y, pese a su amplio uso hoy día, la eficacia demostrada en la literatura científica que aquí resumiremos, es muy escasa. Para empezar, ninguno de los llamados «modificadores de enfermedad» ha demostrado con evidencia científica «modificar» el propio curso de la enfermedad. Las opciones terapéuticas que por su modo de acción logran controlar el curso evolutivo de la AR no tienen por qué actuar como FAME en las Esp, teniendo en cuenta que sus mecanismos patogénicos son diferentes. Mientras que en la AR el tejido donde ocurre eminentemente el proceso inflamatorio es la membrana sinovial, en las Esp predominan la entesitis y la osteitis, además de la sinovitis asociada. A esto se debe añadir la diferente afectación ósea, predominando en la AR la erosión y la pérdida de cartílago frente a la neoformación ósea y la anquilosis propias de las Esp.
Para hacernos una idea del uso cada vez más controvertido de los FAME en el tratamiento de las Esp, podemos referirnos a las recomendaciones de tratamiento de la EA de los grupos ASAS y EULAR de 2006, en las cuales se concluye que no hay evidencia de la eficacia de los FAME, incluidos SSZ y MTX, para el tratamiento de la afectación axial y que tan sólo SSZ podría ser considerada en pacientes con artritis periférica1.
El papel de los distintos instrumentos de los que disponemos para definir si un fármaco es «modificador» de síntomas marca también la diferencia entre AR y Esp y dificultan aún más la adaptación del concepto de FAME a las Esp. Mientras que en la AR la radiografía simple nos ayuda para el control estrecho de evolución radiográfica en los primeros años de la enfermedad, los cambios óseos en las Esp son mucho más lentos y tardíos, lo que imposibilita la correcta definición de «modificador» de un fármaco. El avance en la definición de «espondiloartritis precoz» mediante técnicas prometedoras como la resonancia magnética podría modificar en un futuro este concepto.
SalazopirinaFármaco compuesto por un salicilato (5-aminosalicilato) y un antibiótico (sulfapiridina), cuyo mecanismo de acción es aún controvertido y que actúa como probable inmunomodulador. Es el fármaco más estudiado de todos los FAME en el tratamiento de las Esp. En 2006, J Chen y C Liu, agrupan 11 estudios randomizados controlados contra placebo, 8 de ellos doble ciego, de una considerable calidad metodológica, en un metanálisis sobre la eficacia de salazopirina (SSZ) en la EA (tabla 1)2. Este metanálisis engloba 5 de los estudios ya agrupados en un metanálisis previo de 1990 llevado a cabo por MB Ferraz et al3. El metanálisis de J Chen y C Liu presenta un total de 895 pacientes con una media de seguimiento de 6 meses (12 semanas–3 años) agrupados en 469 tratados con SSZ frente a 426 con placebo. La definición de EA activa es muy variable entre los estudios incluidos en el metanálisis. Se lleva a cabo la evaluación de hasta 30 diferentes variables de desenlace, de las cuales las únicas que se presentan con cambios significativos respecto a placebo son la velocidad de sedimentación glomerular (VSG) y la severidad de la rigidez matutina medida en una escala visual analógica (EVA). Los resultados son expresados usando la diferencia de medias ponderadas, la cual expresa la superioridad de SSZ sobre placebo: respecto a la VSG, el resultado es de -4,79mm/h, con intervalo de confianza del 95% entre 8,80 y -0,78, mientras que para la EVA es de -13,89 con un intervalo del 95% entre −22,54 a −5,24 en una escala de 0–100mm. En cuanto al resto de variables, no se demostró evidencia de la eficacia de SSZ en parámetros como la modificación de la función física, el dolor, la movilidad espinal, la entesitis y la evaluación global del paciente y el médico entre otros. De los estudios incluidos en este metanálisis pueden extraerse de manera individual algunas conclusiones importantes. El estudio de Nissila et al destaca en el metanálisis por presentar una cohorte algo diferente al resto de los estudios incluidos4. Son 85 pacientes con una menor duración media de la enfermedad (3,8 años +/−4,3 en el grupo de SSZ) y una VSG media mayor (42mm/h +/−20 en el grupo de SSZ) en relación al resto de estudios incluídos, además de una afectación periférica muy frecuente (68% del total de pacientes). El grupo de SSZ presenta mejoría significativa en el control del dolor lumbar, la expansión torácica, distancia nuca pared y bienestar general del paciente a las 26 semanas de seguimiento, aunque frente a placebo solo son estadísticamente significativas la severidad de la rigidez matutina medida en EVA y la expansión torácica. La VSG mejora significativamente en el grupo de SSZ frente a placebo, no así la proteína C reactiva (PCR).
Estudios controlados de SSZ en espondiloartropatías
| Autores, año publicación, duración | Características pacientes | Variables de desenlace | Resultados | Retirada por efectos secundarios |
| Feltelius et al, 1986,12 semanas45 | SSZ: 18 |
| EVA rigidez matutina, expansión torácica, alteraciones del sueño mejoran significativamente más con SSZ que con P | SSZ: 4/18 |
| P: 19 | P: 4/19 | |||
| A. periférica: 5% | ||||
| Duración enf: | ||||
| SSZ: 12,1 años | ||||
| P: 10,4 años | ||||
| Dougados et al, 1987, 24 semanas46 | SSZ: 30 |
|
| SS: 7/30 |
| P: 30 | P: 6/30 | |||
| A. periférica: 0 | ||||
| Duración enf: 10 años | ||||
| Nissila et al, 1988, 26 semanas4 | SSZ: 43 |
| Mejoría significativa con SSZ en EVA rigidez matutina, expansión torácica, VSG | SSZ: 5/43 |
| P: 42 | P: 5/42 | |||
| A. periférica: 68% | ||||
| Duración enf | ||||
| SSZ: 3,8±4,3 | ||||
| P: 5,4±7,3 | ||||
| Davis et al, 1989, 12 semanas47 | SSZ: 15 |
| SSZ superior a P en todas las variables | SSZ: 0/15 |
| P: 15 | P: 2/15 | |||
| A. periférica: 23% | ||||
| Duración enf: | ||||
| SSZ: 8,6 años | ||||
| P: 8,4 años | ||||
| Winkler et al, 1989, 24 semanas48 | SSZ: 31 |
| Mejoría significativa con SSZ en duración rigidez matutina y store alteraciones del sueño, ambas con p<0,05 | SSZ: 5/31 |
| P: 32 | Análisis subgrupo forma axial, presentan los mismos resultados | P: 9/32 | ||
| A. periférica: 33% | Análisis subgrupo forma periférica (n=15), índice articular mejoró com SSZ | |||
| Duración enf: | ||||
| SSZ: 10,8 | ||||
| P: 11,2 | ||||
| Corkill, 1990, 48 semanas49 | SSZ: 32 |
| No diferencias significativa entre grupos | SSZ: 12/32 |
| P: 30 | P: 9/30 | |||
| A. periférica: 19% | ||||
| Duración enf. | ||||
| SSZ:12.3±8,2años | ||||
| P: 16,1±11,4años | ||||
| Krajnc et al, 1990, 24 semanas50 | SSZ: 71 |
| Mejoría significativa con SSZ en duración de rigidez matutina, expansión torácica, NAT/NAD y VSG | SSZ: 8/71 |
| P: 24 | P: 5/24 | |||
| A. periférica: 66% | ||||
| Duración enf: no disponible | ||||
| Taylor et al, 1991, 1 año51 | SSZ: 20 |
| Diferencias significativa a favor de SSZ en EVA dolor lumbar (p<0,05) | SSZ: 4/20 |
| P: 20 | No hay diferencias significativa en las otras variables estudiadas | P: 3/20 | ||
| A. periférica: 36% | ||||
| Duración enf: | ||||
| SSZ: 11±1,6 | ||||
| P: 10,7±1,6 | ||||
| Kirwan et al, 1993, 3 años5 | SSZ: 44 | 3 primarias: | Episodios de A. periférica: | SSZ: 19/44 |
| P: 45 |
| SSZ: 0,3 episodios/año | P: 8/45 | |
| A. periférica: 28% | P: 0,4 episodios/año | |||
| Duración enf: | ||||
| SSZ: 19±12 años | ||||
| P: 21,9±11,7 años | ||||
| Dougados et al, 1995, 24 semanas*8 | 351 pacientes |
| Solo mejoría estadísticamente significativa en VGP a favor de SSZ (p=0,007). | SSZ 16% |
| EA: 134 | Disminución de VSG en SSZ (p<0,001 | P 5% | ||
| A. Pso: 136 | ||||
| A. reactiva: 81 | ||||
| Clegg et al, 1996, 36 semanas6 | SSZ: 131; |
|
| SSZ: 11/131 |
| P: 133 | P: 6/133 | |||
| A. periférica: 29% | ||||
| Duración enf: | ||||
| 18,5±11,6 años | ||||
| Schmidt et al, 2002, 26 semanas52 | SSZ: 34 |
| No hay diferencias entre grupos en ninguna de las variables estudiadas | SSZ: 16/34 |
| P: 36 | La tasa de abandonos en SSZ (38%) es superior a la de placebo (11%) | P: 7/36 | ||
| A. periférica: 36% | ||||
| Duración enf: | ||||
| SSZ: 16,7±7,2 | ||||
| P: 16,3±7,8 | ||||
| Braun et al, 2006*9 | SSZ: 112 |
| Menor necesidad AINE en grupo SSZ | SSZ: 17/112 |
| P: 118 | Pacientes con dolor lumbar sin artritis periférica: mejoría de BASDAI mayor con SSZ que con P. (p=0,003), menos dolor lumbar (p=0,03) y rigidez matutina (p=0,05) | P: 17/118 | ||
| A. perif: 47% | ||||
| Duración enf: | ||||
| todos < 5años, no especifica más |
A. perif: artritis periférica; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; BASFI: Bath Ankylosing Spondylitis Functional Index; EVA: escala visual analógica; HAQ: Health Assessment Questionnaire; NAD: número articulaciones dolorosas; NAT: número articulaciones tumefactas; O-P: distancia occipucio-pared; P:placebo; SSZ: salazopirina; VGP: valoración general del paciente; VGM: valoración general del médico. *No incluidos en metanálisis de Chen J, Liu C. Is sulfasalazine effective in ankylosing spondylitis? A systematic review of randomized controlled trials. J Rheumatol. 2006;33:722–31.
Los estudios con mayor número de pacientes incluidos en el metanálisis confirman el perfil de uso de la SSZ como opción en el control de pacientes con predominio de afectación periférica. Así, en Kirwan et al el número de episodios de artritis periférica es significativamente menor en el grupo de SSZ, así como en el estudio de Clegg destaca una mejoría estadísticamente significativa en la afectación periférica5,6 Por otro lado, los datos de pacientes con artritis periférica solamente han sido facilitados de manera aislada en un ensayo7, con un tamaño muestral muy pequeño (15 pacientes).
M Dougados et al presentaron en 1995 un estudio doble ciego, multicéntrico, controlado contra placebo, no incluido en metanálisis posteriores, para valorar la eficacia de SSZ en Esp, incluyendo pacientes con 81 artritis reactivas, 136 APs y 134 EA8. Tanto la valoración general del paciente (VGP) como la VSG tuvieron diferencia estadísticamente significativa a favor de SSZ, con p=0,007 y p<0,001 respectivamente. La heterogeneidad de los pacientes del estudio hace que las conclusiones sean muy controvertidas y probablemente por esto y otros motivos de metodología no fue incluido en el metanálisis de J Chen.
En 2006 J Braun et al presentan una cohorte de pacientes también muy heterogénea, lo que dificulta extraer conclusiones firmes acerca de la eficacia de la SSZ en dicha cohorte9. Los pacientes presentan tanto Esp indiferenciada como EA de reciente comienzo sin datos de anquilosis en el estudio radiológico. La única variable de desenlace estadísticamente significativa fue la menor necesidad de AINEs en el grupo de SSZ. Lo destacable de este estudio controlado frente a placebo son en realidad los resultados en el subgrupo de pacientes con síntomas axiales y sin molestias periféricas que presentan mayor disminución del BASDAI con SSZ que con placebo con significación estadística, haciendo aún más confusos los resultados de los estudios de SSZ en las Esp.
Finalmente merece la pena destacar los escasos datos que sugieren la disminución del número de brotes de uveítis y de la intensidad de los mismos con el tratamiento de SSZ y su posible utilidad en pacientes que presentan 3 o más episodios de uveítis al año10–12.
Como conclusión del papel de la SSZ en la EA, podríamos afirmar que la evidencia para su uso es muy limitada pese a ser el FAME más estudiado en el grupo de las Esp. Si en la expresión axial de la enfermedad no hay datos firmes que sugieran su uso hoy día, en la afectación periférica la SSZ podría tener cierto papel como opción previa al cambio a terapia biológica. En cuanto a su uso en uveítis, los datos son alentadores pero insuficientes.
MesalacinaLa mesalacina, uno de los componentes de la SSZ, también llamado 5-aminosalicilato (5-ASA), ha sido muy escasamente estudiada en el tratamiento de las Esp con resultados muy poco esperanzadores en cuanto a su eficacia. Dos estudios abiertos y uno controlado son lo más destacable en la literatura científica acerca de este compuesto. GT Thomson et al presentan un grupo de 30 pacientes tratados con 5-ASA en su forma comercial Pentasa® en un estudio abierto a 16 semanas, con mejoría significativa en 29 de los 30 pacientes con EA activa, en parámetros como rigidez matutina, índice funcional de Dougados, VGP, valoración general del médico (VGM) y VSG13. Variables de desenlace secundarias tales como severidad de la rigidez matutina, calidad del sueño, recuento de articulaciones periféricas y entesis también presentaron resultados favorables a 5-ASA. A su vez, BJ Dekker-Saeys et al propusieron una cierta superioridad de 5-ASA sobre SSZ en una cohorte muy pequeña (39 pacientes en total) en la cual 20 pacientes eran tratados con 5-ASA tras haber sido tratados previamente con SSZ frente a otro grupo de 19 que iniciaban 5-ASA sin SSZ previa14. En este segundo grupo la disminución de VSG fue estadísticamente significativa mientras que el grupo con SSZ previa no lo fue, además de presentar una mejoría de la VGM en el segundo grupo ligeramente superior a la presentada en el grupo con SSZ previa. Un estudio abierto con Salofalk®, otra forma comercial de 5-ASA, muestra resultados menos alentadores en un grupo de 20 pacientes en los que ninguna variable de desenlace muestra mejoría con el tratamiento15.
El único estudio controlado a destacar con 5-ASA, enfrenta a salazopirina frente a sus 2 componentes, sulfapiridina y la propia 5-ASA16. El estudio incluye un total de 90 pacientes con EA activa y muestra a SSZ y sulfapiridina como superiores a 5-ASA, con una mejoría relevante en parámetros subjetivos como la VGP y la VGM. A esto se añaden más retiradas por ineficacia en el grupo de 5-ASA que los de SSZ o sulfapiridina.
Con estos datos podemos concluir que mesalacina no ofrece resultados concluyentes y firmes que apoyen su uso en las Esp.
MetotrexatoSiendo metotrexato el FAME por excelencia en el tratamiento de la AR, en la cual su eficacia y seguridad están ampliamente probadas, su uso en la EA está escasamente discutido en la literatura científica y son muy pocos los estudios disponibles hasta la fecha. Al igual que hicieran con SSZ, J Chen y C Liu publicaron en 2006 un metanálisis englobando los 3 estudios controlados hasta la fecha, aportando los datos de un total de 116 pacientes17. El primero de ellos es de 2001, en el cual L Altan et al presentan un estudio enfrentando MTX más naproxeno a naproxeno solo en un total de 51 pacientes con EA seguidos durante un año18. Las dosis empleadas de MTX en este estudio, como en la mayoría de los estudios llevados a cabo con este FAME en EA, son muy bajas, concretamente 7,5–10mg/semana, lo que podría ser una de las causas de los escasos resultados positivos de MTX en su uso en las Esp. J Chen y C Liu critican de este estudio la falta de homogeneidad entre ambos grupos comparados, así como la escasez de detalles sobre la randomización de los mismos, además de otros errores metodológicos que restan fiabilidad a los resultados obtenidos por L Altan et al Las conclusiones de L Altan et al difieren mucho de los resultados del análisis posterior de los datos por parte de J Chen y C Liu. Mientras que los primeros concluyen que solo la VGM es superior en MTX a naproxeno, estos afirman que ni VGM ni ninguna otra variable de desenlace (rigidez matutina, dolor diurno y nocturno, VGP, VSG, PCR entre otros) resulta estadísticamente significativa entre ambos grupos. Es más, afirman que naproxeno solo es superior en los llamados índices de espondilitis, entesitis y función física usados en este estudio. El segundo estudio controlado de B Roychowdhury et al publicado en 2002, incluye a un total de 30 pacientes randomizados en 2 grupos, uno con MTX a dosis de 10mg/semana y otro con placebo, evaluando como variables de desenlace PCR, BASFI (Bath Ankylosing Spondylitis Functional Index), BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) y EVA de dolor19. Ninguna de las variables estudiadas muestra diferencia significativa entre ambos grupos. Probablemente, tanto la baja dosis usada de MTX como la larga evolución de la enfermedad, con hasta 23 de los 30 pacientes con más de 10 años de enfermedad, contribuyeron a que las conclusiones no fueran más positivas. El tercer estudio analizado por J Chen y C Liu incluye a 35 pacientes randomizados a placebo o MTX a dosis una vez más muy bajas, de 7,5mg/semanal20. Los resultados en esta ocasión son algo más alentadores que en los estudios previos. Los autores incluyen 7 variables (severidad de la rigidez matutina, estado general del paciente, BASDAI, BASFI, HAQ, VGM y VGP) en un índice compuesto y definen el objetivo primario como la mejoría del 20% o más en al menos 5 de las 7 variables descritas sin empeoramiento del 20% o más en al menos una de dichas variables. Con esto, los resultados fueron favorables al grupo de MTX con un 53% de los pacientes de este grupo cumpliendo los requisitos de respuesta terapéutica frente a un 17% del placebo (p=0,03). Destacar que en las recomendaciones ASAS/EULAR se concluye que uniendo en la medida de lo posible los datos de estudios controlados hasta la fecha de MTX en EA, no hay evidencia de utilidad en control de dolor axial y funcionalidad del paciente1.
En cuanto a los estudios abiertos, son escasos y de ellos se pueden sacar conclusiones con una significación clínica insuficiente. PD Sampaio-Barros et al presentan una cohorte de tan solo 34 pacientes en los cuales se observa una disminución de uso de AINE, así como de los niveles de VSG hasta en el 53% de los pacientes del grupo estudiado21. A considerar es que estos pacientes tenían una EA de predominio periférico. Destacable es también el estudio llevado a cabo por D Biasi et al de 17 pacientes con fracaso a tratamiento con SSZ, en el cual, una vez más a dosis de 7,5–10mg/semanal, MTX muestra una mejoría en los pacientes con EA de predominio axial, tanto en medidas subjetivas como EVA del dolor nocturno, como en datos objetivos de metrología tales como test de Schober, distancia occipucio pared o distancia dedo suelo, así como disminución en los niveles de VSG y PCR22. En contraste a los datos esperados, los pacientes con artritis periférica no perciben mejoría a los 3 años de seguimiento final, aunque el escaso número de pacientes no permite sacar conclusiones determinantes.
En conclusión, a favor de metotrexato aparecen datos a lo largo de estos estudios presentados de su buena tolerancia y sus escasos efectos secundarios aunque su eficacia como FAME es controvertida y serían necesarios estudios con mayor número de pacientes y probablemente dosis más elevadas para esclarecer su verdadero papel en las Esp.
LeflunomidaSi escasos son los estudios de MTX en su uso en la EA y en las Esp en general, mucha menos información podremos encontrar acerca del papel de leflunomida (LFN), otro de los fármacos esenciales como FAME en el tratamiento de la AR. Un estudio abierto y otro ensayo controlado contra placebo son los datos que la literatura científica arroja acerca de LFN. Son resumidos apenas en un párrafo en la última de las revisiones al respecto, llevada a cabo en 200923. El estudio abierto incluye tan solo a 20 pacientes con EA activa definida como BASDAI > 3, seguidos durante 6 meses y LFN aparece como tratamiento efectivo en la afectación periférica de la EA mientras que BASFI, BASDAI, VGP y VGM no muestran diferencias significativas24. Este estudio marcó como objetivo primario una disminución de BASDAI de más del 25%, obtenido tan solo en 5 pacientes. Por otro lado, el estudio controlado enfrenta a 30 pacientes con LFN contra 15 pacientes tratados con placebo, todos ellos con una EA activa definida como un BASDAI mayor de 425. El objetivo primario, alcanzar una respuesta de ASAS20, es, de partida, bastante poco ambicioso y ni siquiera esto aparece como estadísticamente significativo. Las variables secundarias (índices de metrología, número de articulaciones dolorosas, VSG, PCR) tampoco muestran datos a favor de LFN.
Así, con estos resultados, pocas son las conclusiones que se pueden sacar para recomendar el uso de leflunomida en el tratamiento de la EA a día de hoy.
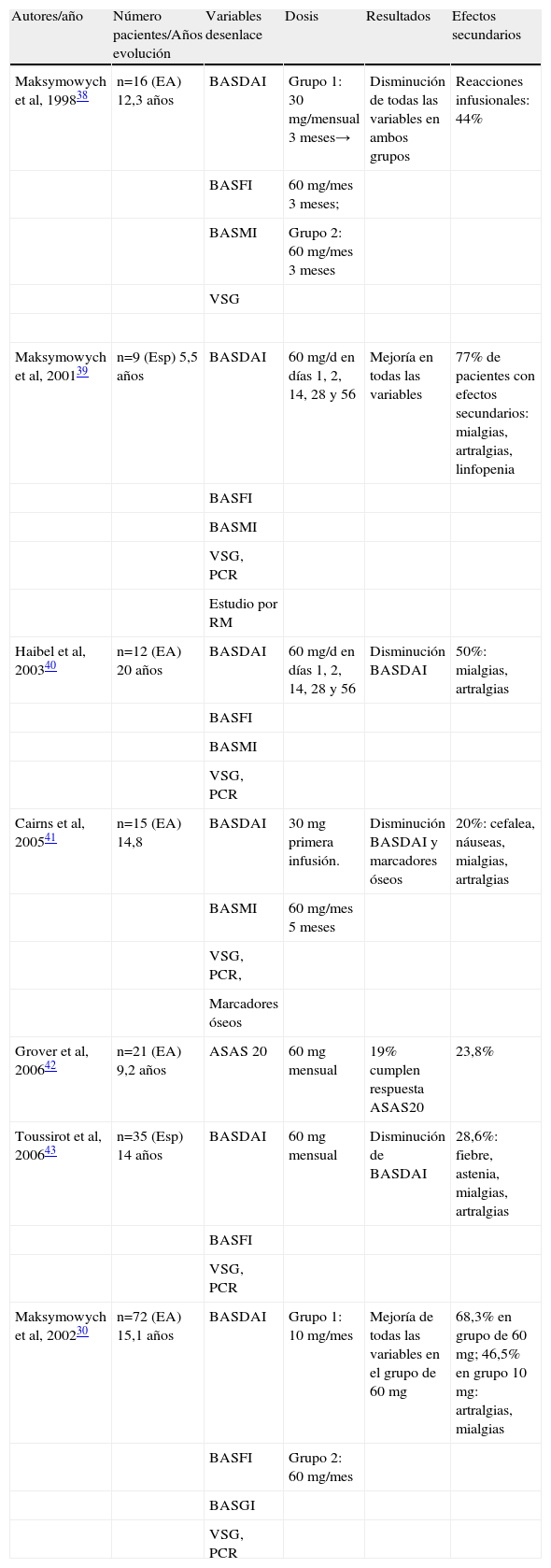
BifosfonatosEscasos y poco concluyentes son los estudios que han sido llevados a cabo para evaluar la eficacia y la seguridad de los bifosfonatos en el tratamiento de la EA. El pamidronato es el más estudiado hasta la fecha. Usados ampliamente en la prevención de fractura secundaria a osteoporosis como inhibidores de la acción de los osteoclastos, sus propiedades antiinflamatorias han sido demostradas en diversos estudios asociados a AR, con disminución de moléculas esenciales en la cascada de la inflamación tales como IL-1β, IL-6 y TNF-α26,27. Diversos trabajos han demostrado la eficacia de pamidronato, clodronato y etidronato en el control de parámetros tanto clínicos como analíticos en pacientes con AR27,28. E Toussirot y D Wendling llevaron a cabo en 2007 una revisión sobre el uso de bifosfonatos en EA, presentando conjuntamente todos los estudios tanto abiertos como controlados realizados hasta la fecha29 Todos son llevados a cabo con pamidronato, presentando en total 6 estudios abiertos y otro controlado comparando distintas dosis de infusión (tabla 2). Los autores de la revisión concluyen que el pamidronato podría ser una alternativa en pacientes en los cuales los anti-TNF estén contraindicados. Los datos sugieren un cierto predominio de su efectividad en pacientes con predominio axial en su clínica, sin otros resultados que sugieran un perfil de paciente concreto en el cual pamidronato sea más efectivo. De todos modos los datos son escasos y deberían llevarse a cabo más estudios para aclarar el papel de esta prometedora opción terapéutica en la EA.
Resumen de estudios del uso de pamidronato en espondilitis anquilosante y otras espondiloartropatías
| Autores/año | Número pacientes/Años evolución | Variables desenlace | Dosis | Resultados | Efectos secundarios |
| Maksymowych et al, 199838 | n=16 (EA) 12,3 años | BASDAI | Grupo 1: 30mg/mensual 3 meses→ | Disminución de todas las variables en ambos grupos | Reacciones infusionales: 44% |
| BASFI | 60mg/mes 3 meses; | ||||
| BASMI | Grupo 2: 60mg/mes 3 meses | ||||
| VSG | |||||
| Maksymowych et al, 200139 | n=9 (Esp) 5,5 años | BASDAI | 60mg/d en días 1, 2, 14, 28 y 56 | Mejoría en todas las variables | 77% de pacientes con efectos secundarios: mialgias, artralgias, linfopenia |
| BASFI | |||||
| BASMI | |||||
| VSG, PCR | |||||
| Estudio por RM | |||||
| Haibel et al, 200340 | n=12 (EA) 20 años | BASDAI | 60mg/d en días 1, 2, 14, 28 y 56 | Disminución BASDAI | 50%: mialgias, artralgias |
| BASFI | |||||
| BASMI | |||||
| VSG, PCR | |||||
| Cairns et al, 200541 | n=15 (EA) 14,8 | BASDAI | 30mg primera infusión. | Disminución BASDAI y marcadores óseos | 20%: cefalea, náuseas, mialgias, artralgias |
| BASMI | 60mg/mes 5 meses | ||||
| VSG, PCR, | |||||
| Marcadores óseos | |||||
| Grover et al, 200642 | n=21 (EA) 9,2 años | ASAS 20 | 60mg mensual | 19% cumplen respuesta ASAS20 | 23,8% |
| Toussirot et al, 200643 | n=35 (Esp) 14 años | BASDAI | 60mg mensual | Disminución de BASDAI | 28,6%: fiebre, astenia, mialgias, artralgias |
| BASFI | |||||
| VSG, PCR | |||||
| Maksymowych et al, 200230 | n=72 (EA) 15,1 años | BASDAI | Grupo 1: 10mg/mes | Mejoría de todas las variables en el grupo de 60mg | 68,3% en grupo de 60mg; 46,5% en grupo 10mg: artralgias, mialgias |
| BASFI | Grupo 2: 60mg/mes | ||||
| BASGI | |||||
| VSG, PCR |
BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; BASFI: Bath Ankylosing Spondylitis Functional Index; BASMI: Bath Ankylosing Spondylitis Metrology Index; BASGI: Bath AS Global Index; EA: espondilitis anquilosante; Esp: espondiloartropatía; PCR: proteína C reactiva; RM: resonancia magnética; VSG: velocidad de sedimentación generalizada.
En el estudio doble ciego de Maksymowych et al llevado a cabo para comparar la dosis de 10mg frente a la de 60mg, se presentan los datos de un total de 84 pacientes con EA (es el estudio con mayor número de pacientes hasta la fecha)30 En los 72 pacientes que cumplieron el seguimiento durante 6 meses, el grupo tratado con la dosis de 60mg presentó una mejoría significativa de todas las variables de desenlace del estudio, esto es, de BASFI, BASDAI, BASMI (Bath Ankylosing Spondylitis Metrology Index) y BASGI (Bath AS Global Index) con respecto al grupo de 10mg. Destacar que esta cohorte de Maksymowych et al presentaba una clínica eminentemente axial. Sólo 16 pacientes del grupo inicial presentaban artritis periférica a su inclusión.
En cuanto a efectos secundarios, no hay casos descritos en el uso de bifosfonatos en EA que hayan presentado necrosis mandibular y los resultados hasta la fecha derivados de los estudios comentados, demuestran que los efectos secundarios son escasos y de muy leve repercusión.
TalidomidaSe han descrito propiedades anti-TNF asociadas a la talidomida, que en otros contextos ha sido usada como sedante, antiemético e incluso en el tratamiento de la lepra. Su efecto modulador y antiinflamatorio se podría explicar mediante la inhibición de la producción de interleuquinas 1 y 12, los factores de necrosis tumoral alfa y gama, además de inducir un incremento de la relación linfocitos T CD8/CD4 por disminución de los linfocitos T adyuvantes circulantes31. Con esto, escasos estudios se han llevado a cabo de su aplicación en Esp y con cohortes muy pequeñas, aunque los resultados han sido prometedores. P Yang et al han presentado en 2009 el estudio más reciente hasta la fecha del uso de talidomida en AS32. Su cohorte de 29 pacientes con AS activa definida como un BASDAI >3, fue dividida en 2 grupos, uno de ellos tratado con diclofenaco asociado a talidomida y otro con diclofenaco solo, con poblaciones muy homogéneas. Añaden un grupo control de 10 pacientes sanos. En este estudio, a la mejoría clínica y analítica añaden las variaciones tras el tratamiento de los niveles de M-CSF (factor estimulante de colonias de macrófagos) y TGF-b1 (factor de crecimiento transformante beta-1), ambos relacionados estrechamente con TNF-alfa y elevados en los pacientes con EA frente a niveles normales de los controles sanos. Los resultados demuestran que la mejoría de BASDAI se alcanza en ambos grupos tratados sin diferencia significativa entre ambos, mientras que VSG y PCR se reducen de manera significativa en el grupo con talidomida. Los valores de TGF-1 y M-CSF también se reducen en el grupo con talidomida. Los autores concluyen que esto último es producto de la disminución de TNF-alfa, también medida antes y después del tratamiento y significativamente reducida en los pacientes con talidomida respecto al grupo de diclofenaco solo.
Estudios previos al de P Yang et al demuestran la eficacia de talidomida aunque son estudios abiertos con cohortes pequeñas. Son resumidos en el artículo de JC Davis et al31. Breban et al presentan los resultados del estudio de una cohorte de de 12 pacientes, 9 AS, 1 artritis psoriasica y 2 Esp indiferenciadas, tratados con talidomida. Siete de ellos presentaron mejoría en VSG y PCR y en 2 de ellos una reducción del 50% en el BASDAI inicial. En un total de 5 pacientes tuvo que ser el tratamiento discontinuado por efectos secundarios tales como mareo, estreñimiento o somnolencia33. Tanto F Huang et al como JC Wei et al mostraron un amplio porcentaje de mejoría en sus respectivas cohortes de pacientes tratados con talidomida a dosis de 200mg al día, con efectos secundarios menos frecuentes que la cohorte de Breban et al probablemente por su estrategia de subida paulatina de dosis34,35.
Por lo tanto, talidomida parece una opción prometedora como tratamiento en las Esp. aunque serían necesarios estudios controlados para probar fehacientemente su eficacia y seguridad.
ConclusiónTomando en conjunto los datos expuestos en esta revisión en cuanto a la evidencia científica del papel de los FAME en la afectación axial de las Esp, podemos llegar a la conclusión de que su eficacia es hoy día muy limitada. Así lo afirman todas las revisiones y consensos previos al respecto1,23,36,37, incluido el trabajo de SP Lasalle y AA Deodhar de 2007 que repasa el tratamiento específico de la espondiloartritis axial44. El limitado papel de SSZ en el tratamiento de Esp con predominio periférico y su aparente utilidad en pacientes de reciente comienzo, así como la escasa evidencia a favor de su papel en la prevención de nuevos episodios de uveítis, son lo más destacado de este fármaco. SSZ, además, es el FAME más estudiado hasta la fecha en el ámbito de las Esp y el que parece más adecuado a la hora de plantearnos un tratamiento «modificador» en las situaciones clínicas comentadas. En cuanto a metotrexato, no hay ningún dato a favor del uso en pacientes con espondiloartritis axial y podría tener cierta utilidad en pacientes con afectación periférica. Mesalazina y leflunomida tienen, si cabe, un papel más restringido y su uso no está justificado hoy día. En cuanto a pamidronato y talidomida, presentan algunos datos positivos, siendo el primero una opción válida en pacientes con predominio axial y que no toleran tratamiento biológico. La talidomida, por su parte, tiene mayor restricción de uso debido a sus potenciales efectos secundarios.
Con esto, el término fármaco modificador de enfermedad, tan justificado en su origen en la AR, es más que controvertido al ser extrapolado a las Esp y, mucho más si cabe, en la espondiloartritis axial. Su uso a medio camino entre los AINE y la terapia biológica es de eficacia escasamente probada y en casos muy seleccionados tal y como se ha querido demostrar en esta revisión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.