Notas preliminares
La transferencia libre del músculo recto interno fue descrita por primera vez en 1976 por Harii et al5,6. Gracias a la escasa morbilidad de la zona donante, a la facilidad de su extracción, a la constancia de su anatomía (fig. 1) y a la diversidad de aplicaciones posibles, este músculo constituye hoy en día uno de los colgajos convencionales de la microcirugía reparadora.
Las numerosas posibilidades de modificación de su forma, de extracción del músculo aislado o en diversas formas de isla cutánea, la posibilidad de una aplicación funcional y el aprovechamiento de su porción tendinosa confieren a este colgajo una gran versatilidad para resolver diversos problemas.
Principios quirúrgicos y objetivos
Obtención y trasplante de un colgajo libre microvascular de piel y tejidos blandos para cubrir defectos en casi cualquier región del cuerpo.
Ventajas
El músculo puede extirparse con o sin una isla cutánea.
La isla cutánea puede tener forma longitudinal, transversal o de T5,13,15.
El músculo puede dividirse longitudinalmente en dos fracciones para trasplantar14.
El músculo puede dividirse transversalmente en dos fracciones para trasplantar11 (fig. 6).
La superficie que va a cubrirse con el músculo puede aumentar hasta el triple de su anchura original seccionando el perimisio7,8 (fig. 7).
Posibilidad de uso funcional10.
Pedículo vascular largo, de unos 6 cm.
Morbilidad mínima de la zona donante2,4.
También puede extraerse por endoscopia12.
Abordaje fácil (decúbito supino, pierna libre).
Situación favorable de la cicatriz.
Desventajas
Gran exigencia técnica y de personal debido a la transferencia microquirúrgica de tejido libre.
Control posquirúrgico del colgajo durante 10 días.
Indicaciones
Defectos de tejidos blandos de hasta 10 x 22 cm.
Sustitución funcional de un músculo, por ejemplo del bíceps o de la musculatura facial.
Contraindicaciones
Contraindicaciones generales que impidan cualquier intervención quirúrgica.
Imposibilidad de anastomosis en la zona receptora.
Defectos de tejidos blandos o reacciones inflamatorias en ambas caras mediales de los muslos.
Carencia de recursos técnicos o humanos.
Información para el paciente
Riesgos quirúrgicos generales.
Incisiones cutáneas.
Formación de hematomas en la zona donante.
Necrosis cutáneas en los bordes del transplante.
Supervisión del injerto trasplantado durante 10 días.
Pérdida del colgajo por problemas en las anastomosis sin revisión posible o por infecciones resistentes al tratamiento.
Ingreso hospitalario durante 7-14 días.
Prohibición de practicar deporte durante 4 semanas.
Debilidad temporal de los aductores de la cadera.
Preparación para la intervención
Anamnesis exacta de posibles enfermedades vasculares.
En caso necesario, valoración ecográfica o angiográfica de la situación vascular de la región receptora; no es necesario hacer una valoración ecográfica de la región donante gracias a su situación anatómica fiable.
Afeitado.
Profilaxis antibiótica en dosis única periquirúrgica con una cefalosporina de segunda generación.
Documentación fotográfica del defecto (antes, durante y tras la intervención).
Instrumental
Instrumental para microcirugía (S&T, Schaffhausen, Suiza).
Material de sutura Ethilon® 10/0 (Ethicon, Johnson & Johnson Medical, Viena, Austria).
Microscopio quirúrgico (Zeiss OPMI Vario, Carl Zeiss Meditec AG, Jena).
Tijera larga y fuerte (unos 35 cm) para cortar el tendón.
Anestesia y posición del paciente
Anestesia epidural o anestesia general.
Decúbito supino sobre una mesa horizontal; pierna opuesta algo más baja.
Opcionalmente también puede ser en decúbito lateral o semilateral.
La pierna donante debe quedar libre.
Desinfección cutánea de la pierna donante, la ingle y la región púbica.
Cubrir la región púbica.
Cubrir la pierna donante a partir de la rodilla con un paño quirúrgico en forma de bolsa (fig. 2).
Técnica quirúrgica
Figuras 1 a 5
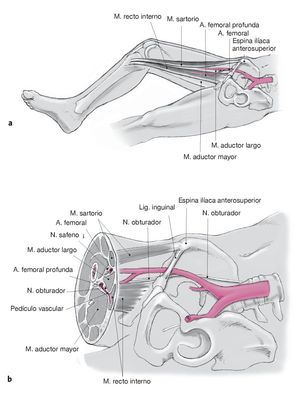
Figuras 1a y 1b. Anatomía. El recto interno es el músculo más superficial del grupo de los aductores; nace en la rama inferior del pubis, junto a la sínfisis, y discurre con su tendón hacia la superficie medial de la tibia, donde se inserta junto con los tendones del sartorio y del semitendinoso. El músculo está rodeado por su cara ventral por el sartorio y el aductor largo, por su cara medial por el aductor mayor y por la dorsal por el semimembranoso (a). Recibe el riego sanguíneo por un pedículo principal situado a unos 8-10 cm de distancia del ligamento inguinal. La arteria tiene un diámetro aproximado de 1,5 mm; casi siempre lleva dos venas acompañantes y tiene una longitud de unos 6 cm. La arteria sale de la arteria femoral profunda y discurre con sus venas acompañantes entre los músculos aductor mayor y aductor corto, hasta llegar a la porción proximal del músculo recto interno. Algo más distal entran también dos o tres ramas vasculares procedentes del sistema de la arteria femoral superficial (b). La perfusión sanguínea de la isla cutánea requiere de una atención especial. Durante mucho tiempo las necrosis cutáneas de las porciones distales de las islas diseñadas longitudinalmente sobre el músculo constituyeron un problema. El motivo de esta aparente falta de fiabilidad de las islas cutáneas era que solamente se encuentran vasos perforantes del músculo que irriguen la piel en el tercio proximal, rara vez en el tercio medio y casi nunca en el tercio distal del músculo recto interno. La zona cutánea irrigada por los perforadores del músculo recto interno tiene una orientación transversal, es decir, más oblicua que paralela al eje del músculo. El músculo está inervado por la rama anterior del nervio obturador, que se encuentra 1-2 cm proximal al pedículo principal, con el que transcurre de forma paralela en el músculo. Este nervio puede movilizarse hasta 7 cm de longitud. Antes de empezar la operación en el muslo, se recomienda preparar la zona receptora para asegurarse de que existe una posibilidad de conexión adecuada.
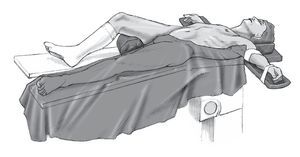
Figura 2 Posición. Decúbito supino sobre una mesa horizontal; pierna opuesta algo más baja. La pierna donante queda libre. Desinfección cutánea de la pierna donante, la ingle y la región púbica. La pierna donante se cubre desde la rodilla hacia abajo con un paño quirúrgico en forma de bolsa; la zona proximal a la ingle se cubre con paños quirúrgicos adhesivos.
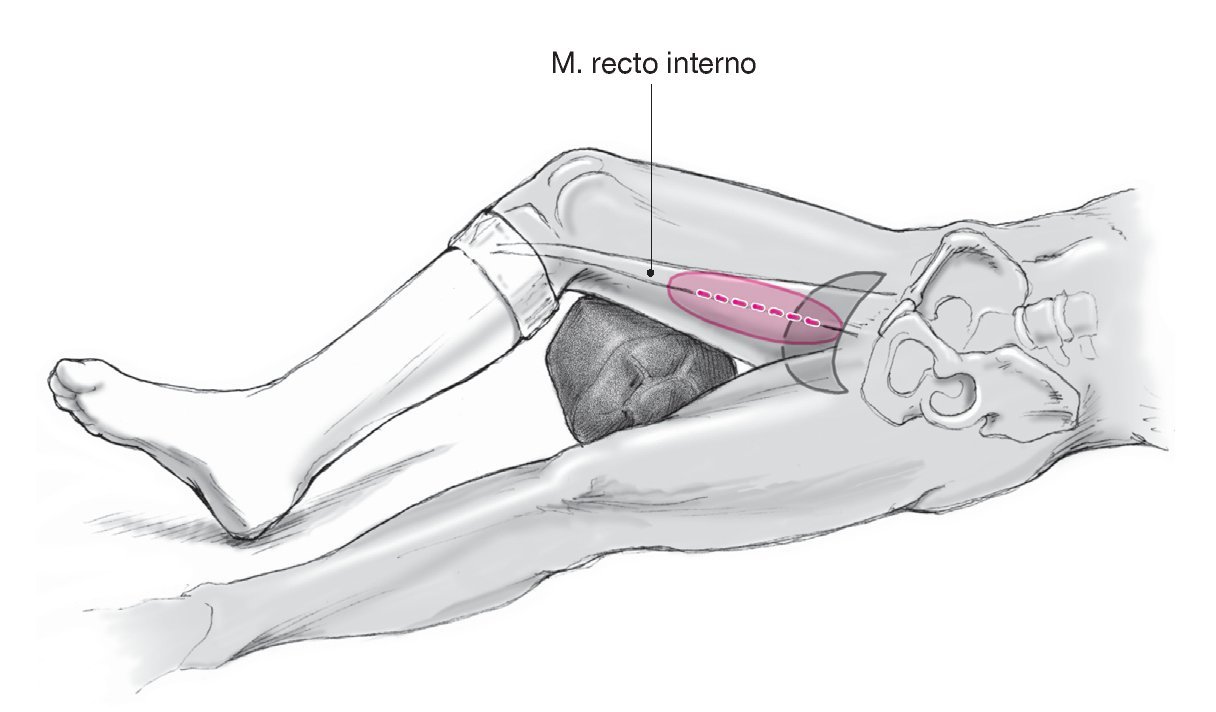
Figura 3 Incisión cutánea. En la pierna se dibuja el recorrido del músculo recto interno identificado mediante palpación. Tras doblar la pierna se dibuja la incisión de la piel y, en su caso, de la isla cutánea prevista. Colgajo muscular: la incisión empieza unos 5 cm distal al pubis y discurre unos 15 cm en dirección distal, por la cara dorsal del recorrido dibujado del músculo. Colgajo musculocutáneo: si se levanta el colgajo con su forma clásica longitudinal, dibujar la isla cutánea a lo largo de los dos tercios proximales y la fracción posterior del músculo dibujado. Puede alcanzar un tamaño máximo de 10 x 22 cm. Alternativamente puede dibujarse una isla cutánea transversal del mismo tamaño. En este caso el borde proximal de la isla cutánea, que también es fusiforme, discurre desde la porción medial de la ingle por el pliegue de los aductores/región púbica hasta el pliegue glúteo. Se debe escoger la posición que permita que un tercio de la superficie esté en posición ventral y dos tercios en posición dorsal al músculo señalado.
Figuras 4a a 4c Preparación. Colgajo muscular: tras la incisión cutánea, al penetrar en el tejido subcutáneo se debe proteger la vena safena mayor. Tras abrir la fascia del muslo, se presenta la cara medial del músculo recto interno entre el aductor largo y el aductor mayor (a). El injerto se prepara desde el extremo distal en dirección proximal. Si no está previsto utilizar el músculo biseccionado, se ligan los vasos que entran en su mitad distal. Para disecar la mitad proximal, se aparta con ganchos el aductor largo en dirección ventral y lateral, lo que permite localizar fácilmente el pedículo principal y disecarlo en una longitud de unos 6 cm desde su nacimiento en la arteria femoral profunda. Las ramas que se dirigen hacia los músculos aductores largo y mayor se coagulan o se pinzan. Si es necesario, también puede disecarse de esta forma la rama anterior del nervio obturador, situado un poco proximal al pedículo principal, en una longitud de 7 cm (b). Una vez asegurado el pedículo principal, puede cortarse el músculo por su extremo distal y proximal, conforme al tamaño deseado. Se ha demostrado la utilidad de sobredimensionar un poco el músculo, como tejido de reserva. La porción proximal se corta mediante diatermia bajo control visual directo. La porción distal, una vez hecha una disección roma, se puede cortar con una tijera larga y fuerte sin control visual, o mediante una incisión distal corta. Colgajo musculocutáneo (c): en primer lugar, practicar una incisión en la piel y preparar la porción distal del colgajo cutáneo. Esto permite identificar el músculo sin correr el riesgo de separar la fraccion cutánea del músculo. Para facilitar su identificación, cabe tirar del músculo para intuir su recorrido proximal. Tras comprobar la posición de la isla cutánea, diseccionar igual que para el colgajo muscular. Es imprescindible evitar que se separe el músculo de la isla cutánea. Cierre de la herida: tras cortar el músculo, cerrar la herida por capas, colocando un drenaje Redon. Disposición de los vendajes de la zona donante: apósitos grasos sobre la incisión, compresa seca, vendaje elástico (clase de compresión II) y colocación de un calzón Europa hasta retirar los puntos.
Figuras 5a y 5b Injerto muscular. Fijar transitoriamente el injerto en la zona receptora con dos o tres puntos de Vicrilo. En primer lugar se hace la anastomosis microquirúrgica de la arteria y después de la vena del músculo. Tras una clara reperfusión, adaptar holgadamente el injerto y, si es necesario, cubrir con un injerto de espesor parcial (a). Tras acabar la operación se coloca una sonda de oxígeno (Licox CMP®, Integra Neurosciences, Gesellschaft für Sondentechnik, Kiel-Mielkendorf) y se fija con puntos de sutura (b). Disposición de los vendajes de la zona receptora: vendaje laxo con apósitos grasos, compresa y ventana de inspección en caso de isla cutánea.
Particularidades (figs. 6 y 7)
Figuras 6a a 6d Si el músculo dispone de un segundo pedículo vascular distal de buen calibre, puede dividirse en dos. Tras disecar ambos pedículos vasculares, biseccionar en la proporción deseada mediante diatermia.
Figuras 7a a 7d Para aumentar la superficie del colgajo muscular, puede cortarse el perimisio por su cara medial, es decir, por la cara opuesta a la de entrada de los vasos. Esto permite aplanar la sección del músculo y por lo tanto aumentar la superficie que se va a cubrir.
Tratamiento postoperatorio
Anticoagulación con heparina de bajo peso molecular, a dosis doble de la habitual en tromboprofilaxis, hasta el alta. Si el postoperatorio no presenta complicaciones, no se necesita ningún tratamiento con heparina no fraccionada.
Medición de la presión parcial relativa de oxígeno (Licox CMP®) y valoración de la isla cutánea cada hora durante los 2 primeros días; cada dos horas los 2 días siguientes; cada 4 h los siguientes 2 días y, por último, cada 6 h hasta el décimo día.
Dependiendo del corte, impedir la sedestación completa durante 7 días (posición semitumbado).
Cambio diario de vendaje durante los 3 primeros días, a continuación, cada 2-3 días.
Movilización a partir del tercer día posquirúrgico con apoyo fisioterapéutico para evitar la abducción descontrolada del muslo.
Retirada de los drenajes a las 24 h o cuando la cantidad extraída a diario sea inferior a 20 ml.
Retirada de puntos de sutura a los 12-14 días.
Práctica de ejercicio con las piernas a partir de la cuarta semana.
Controles tras la cicatrización de las heridas a los 3, 6, 12 y 24 meses.
Documentación fotográfica en el momento de retirar los puntos y a los 3 y 12 meses.
Errores, riesgos, complicaciones
Pocas posibilidades de conexión en la zona receptora: necesidad de interponer un segmento venoso para conseguir una anastomosis con vasos más proximales de mayor calibre.
Si hay problemas con la anastomosis o lesiones vasculares, durante la operación se administran 3.000 UI de heparina i.v. Tras la operación este tratamiento se continúa hasta el día 7 con bomba de infusión de heparina, a razón de 10.000 UI/24 h (tiempo de tromboplastina parcial objetivo: 50-60 s).
Varios vasos sanguíneos de calibre reducido en el músculo: disección de los vasos hasta su salida de la arteria profunda del muslo y aprovechamiento de las ramificaciones.
Fallo de la recapilarización o lividez tras adaptar el colgajo: volver a desprenderlo y volver a colocar el pedículo vascular, para evitar posibles pliegues.
Caída de la presión parcial de oxígeno tras la operación: control de la temperatura, si es necesario aplicación local de calor; ecografía para valorar el flujo sanguíneo en el pedículo del colgajo y para descartar una compresión a causa de un hematoma; si fuera necesario, revisión quirúrgica inmediata.
Si se sospecha la formación de un hematoma, control ecográfico de su tamaño y descartar una posible compresión del pedículo vascular. En caso de compresión vascular o hematoma creciente, revisión.
Si empiezan a aparecer síntomas de necrosis, comprobar el flujo sanguíneo a través del pedículo vascular (ecografía). Si está intacto, puede esperarse a desbridar hasta que se haya delimitado el área de necrosis.
Las complicaciones del riego vascular son las responsables de las revisiones en más de dos tercios de los casos. Cerca de tres cuartas partes de las revisiones afectan al retorno venoso. Más del 90% de los problemas circulatorios aparecen durante las primeras 72 h. La tasa de pérdidas totales descrita en la bibliografía es del orden del 4%1,3,9.
Resultados
Durante los últimos 10 años hemos realizado el seguimiento de 254 injertos libres de músculo recto interno. El músculo recto interno se utilizó en el 61% de los casos (155 pacientes) para restablecer la cobertura de tejidos blandos; en el 6,7% (17 pacientes) para un restablecimiento funcional y en el 32,3% (82 pacientes) para la reconstrucción de tejidos blandos de la mama femenina.
La tasa total de pérdidas de colgajos fue del 4,3%; en el 13,0% de los casos hubo complicaciones debidas a la intervención, como insuficiencia de la conexión vascular (casi siempre del retorno venoso), hematomas o pérdidas parciales del colgajo.
Correspondencia
Dr. Heinrich M. Schubert
Universitätsklinik für Plastische und Wiederherstellungschirurgie (Clínica universitaria de cirugía plástica y reconstructora, Universidad de medicina de Innsbruck)
Medizinische Universität Innsbruck
Anichstrasse 35
6020 Innsbruck (Austria)
Tel.: (+43/512) 504-80893; fax: -6780893
Correo electrónico: Heinrich.Schubert@i-med.ac.at