Objetivo. Puenteo primario estable de defectos óseos acetabulares del tipo IIa y IIb según Paprosky y reconstrucción del centro de rotación anatómico. Reconstrucción de defectos asociada con esponjosa homóloga mediante la técnica del «impaction grafting» para la reconstrucción de un alojamiento protésico con capacidad de soportar carga y «down grading» del defecto óseo en caso de una nueva intervención de revisión.
Indicaciones. Defectos acetabulares del lecho / borde prominente acetabular con borde acetabular caudal intacto y borde prominente acetabular con capacidad de carga remanente (Paprosky tipo IIa, IIb).
Contraindicaciones. Presencia de infección de la articulación de la cadera. Defectos óseos acetabulares o una sustancia ósea sin capacidad de soportar carga que impide el anclaje seguro del anillo de reconstrucción metálico en el nivel de entrada del acetábulo.
Técnica quirúrgica. Abordaje lateral transglúteo a la articulación de la cadera. Extracción de los componentes protésicos acetabulares aflojados. Fresado del alojamiento de la prótesis bajo conservación del hueso remanente con estabilidad mecánica. Preparación de los chips de esponjosa homólogos e impactación en los defectos óseos acetabulares. Inserción de la caja del techo acetabular después del anclaje del gancho caudal en la incisura acetabular. Anclaje primario estable con posición de 1-2 tornillos en el transcurso del vector de fuerza, así como tornillos de esponjosa en la zona del techo acetabular. Cementación del injerto de polietileno.
Tratamiento postoperatorio. Movilización con 2 muletas a partir del 1.er día postoperatorio. Carga parcial con 20 kg durante 6 semanas postoperatorias. Si la radiografía nativa muestra que el asiento del postizo permanece estable, aumento de la carga de 10 kg/semana después de las 6 semanas hasta la carga total manteniendo la profilaxis antitrombótica. Limitación de la flexión de cadera a 90º. Evitar movimientos de abducción bajo rotación externa simultánea, así como actividades de tiempo libre y de deporte con saltos y fuerzas de impacto axial durante 12 meses postoperatorios. Controles radiológicos después de 3, 6, y 12 meses, así como cada 2 años.
Resultados. Entre los años 2008 y 2011 se asistió a 22 pacientes consecutivos con 23 prótesis y fueron sometidos a un seguimiento posterior durante 38 ± 11 meses. En las fases pre y postoperatoria se observó un aumento significativo en la escala de cadera de Harris (82,2 ± 8,7 vs. 44,7 ± 10,7) y en la escala de Merle-d’Aubigné (14,6 ± 1,9 vs. 7,5 ± 1,3). En 21 casos pronóstico radiológico de una osteointegración; 2 líneas radiolucentes parciales (9%) en las zonas I-III según DeLee y Charnley. En 21 cajas (92%) se registró un aumento del diseño trabecular en el sentido de una reconstrucción de la microarquitectura trabecular en el área aumentada y dos prótesis (9%) registraron una migración. Durante el seguimiento se requirió revisión quirúrgica de tres implantes (13%).
Redacción
M. Rudert, Würzburg
Ilustraciones
R. Himmelhan, Heidelberg
Introducción
La cantidad de prótesis de articulaciones de cadera implantadas a nivel mundial se calcula en aproximadamente 1,2 millones de unidades, de las cuales unas 170.000 ya solo en Alemania1. A pesar de que las prótesis primarias de cadera presentan unas tasas de sobrevivencia globales muy buenas por sobre del 90% después de 10 años de su implantación2, se ha registrado un aumento considerable de la cantidad de intervenciones de recambio endoprotésicas en los últimos 10- 15 años2,3. El problema principal de la actual cirugía de revisión endoprotésica de la cadera es el aflojamiento de la prótesis y la pérdida de sustancia ósea periprotésica con frecuencia asociada2,3,5-7. Especialmente las intervenciones de revisión del cótilo de cadera se ven dificultadas por pérdidas de sustancia ósea periprotésicas y una a menudo insuficiente calidad ósea de la sustancia ósea remanente4.
Durante la revisión acetabular, en primer lugar, es necesario asegurar un puenteo estable del defecto con reconstrucción del centro de rotación anatómico mediante la elección de implantes de revisión adecuados; en segundo lugar, hay que realizar la reconstrucción de los defectos acetabulares. Para el área del acetábulo existen diferentes tipos de implantes y pueden aplicarse distintas terapias de reconstrucción en función del tipo de defecto. Con respecto al aumento para la reconstrucción del defecto acetabular, precisamente en el caso de los pacientes jóvenes, hay que intentar realizar una reconstrucción biológica con reconstrucción de un lecho estable del implante con posible reducción «down grading» de los defectos en caso de una nueva revisión7.
La técnica del «impaction grafting» («injerto de impactación») constituye una posibilidad de reconstrucción biológica de defectos en la que se injertan chips de hueso alogénico para el aumento de defectos óseos junto con una caja antiprotusión metálica8,9. Ello incluye la preparación del alojamiento original del implante bajo conservación del hueso remanente con estabilidad mecánica, así como orificios en el alojamiento del implante para favorecer la revascularización. Finalmente, se realiza la impactación de los chips óseos alogénicos para crear una capa de tejido esponjoso estable10,11. Las cajas antiprotusión sirven para puentear el defecto. Se anclan en el hueso pélvico vital y mediante la transmisión de fuerzas sobre el hueso nativo protegen a los injertos óseos impactados de forma estable pero todavía sin capacidad de carga total ante sobrecarga mecánica, y de este modo favorecen la remodelación12.
El «anillo de reconstrucción acetabular» (ARR-Titan, Peter Brehm Chirurgie, Weisendorf, Alemania) se ha concebido como un cótilo de techo acetabular con un gancho caudal que se ajusta a la forma del techo acetabular anatómico. El gancho caudal sirve para la reconstrucción del centro de rotación anatómico tomando como referencia la incisura acetabular. Los injertos óseos impactados se pueden integrar mediante la transmisión de fuerzas sobre el hueso autóctono conservado bajo la protección mecánica de la caja acetabular.
Principio y objetivo de la intervención
Puenteo de defectos óseos acetabulares del tipo IIa y IIb según Paprosky con estabilidad primaria y reconstrucción del centro de rotación anatómico por medio de la reconstrucción de defectos asociada con tejido esponjoso homólogo mediante la técnica del «impaction grafting» para la reconstrucción de un alojamiento del implante con capacidad de soportar carga a través de un abordaje lateral transglúteo modificado, que proteja las partes blandas.
Ventajas
— Anclaje óseo quirúrgico fijo con estabilidad primaria de la prótesis para la protección del aumento mediante el puenteo cráneo-caudal de los defectos acetabulares del tipo IIa y IIb según Paprosky desde la incisura acetabular hasta el borde acetabular.
— Anclaje mediante fijación de la prótesis con tornillos de ángulo variable (el avellanado de la cabeza del tornillo se realizará de modo que al introducir los tornillos el ángulo de inserción se pueda variar 20º independientemente del ángulo de la caja metálica).
— Libre elección de la posición del cótilo de polietileno independientemente de la posición de la caja antiprotusión metálica para determinar la anteversión (10-15º) y la inclinación (aproximadamente 45º) adecuadas.
— Reconstrucción del centro de rotación anatómico mediante la referenciación en el borde acetabular caudal (incisura acetabular) a través del gancho caudal.
— Mejor osteointegración y estabilidad secundaria gracias a la estructura rugosa de la superficie posterior de la caja tratada por chorros de corindón (índice de rugosidad [Rz] 40-60 μm) del anillo de reconstrucción acetabular.
— «Impaction grafting» para el «down grading» de los defectos óseos en caso de una nueva intervención de revisión con chips de esponjosa homólogos para la reconstrucción biológica secundaria de un alojamiento acetabular resistente.
Desventajas
— Riesgo de infección por utilización de aloinjertos óseos.
— En caso dado, ausencia de osteointegración con el consiguiente fracaso de la caja antiprotusión y posible fracaso o rotura del material.
— El anclaje del cótilo cementado en la caja acetabular metálica se deberá valorar críticamente en los pacientes con alergia demostrada a los componentes del cemento óseo.
— No existe ninguna posibilidad de aplicar la combinación metal-metal por falta de un anclaje libre de cemento de un injerto de cerámica en la caja antiprotusión metálica.
Indicaciones
— Defectos del lecho y/o del techo acetabular ante un borde acetabular dorsal intacto (tipo IIa y IIb según Paprosky).
Contraindicaciones
— Destrucción ósea del borde acetabular distal (incisura acetabular), defectos óseos del borde prominente del acetábulo o del borde acetabular distal (Paprosky tipo IIc-IIIb), que impiden el puenteo fijo y sin movimientos del defecto óseo en dirección cráneo-caudal.
— Falta de estabilidad ósea, que, a pesar de un apoyo seguro del anillo metálico en el nivel de entrada del acetábulo, impide un anclaje de los tornillos primario estable (osteoporosis grave, hipofosfatasia, haber recibido radioterapia, etc.).
— Presencia de infección de la articulación de la cadera.
Información para el paciente
— Riesgos quirúrgicos generales, como hemorragia, hemorragia secundaria, trombosis, embolia, alteraciones de la cicatrización, lesiones de vasos sanguíneos y de nervios (n. isquiático, n. femoral, n. glúteo superior con riesgo de insuficiencia glútea).
— Infecciones protésicas agudas o crónicas.
— Infección recidivante o nueva después de un recambio protésico en uno o dos tiempos.
— Información sobre reacciones inmunológicas («graft versus host reaction») y sobre el riesgo de infección potencial por la transmisión de aloinjertos óseos para el aumento de defectos periprotésicos voluminosos y de osteólisis con chips de esponjosa homólogos.
— Aflojamiento del anillo antiprotusión metálico con la consiguiente rotura del implante o de los tornillos en un proceso aséptico o séptico.
— Diferencia de longitud de las piernas.
— Luxaciones postoperatorias con necesidad de reposición cerrada o abierta.
— Pinzamiento de los tendones psoas en el borde acetabular anterior.
— Transfusión peri o postoperatoria de sangre propia o alogénica.
— Carga parcial postoperatoria durante 6-12 semanas.
Preparación de la intervención
— Planificación preoperatoria mediante software de planificación digital o plantillas para la preparación previa de la posición y el tamaño del implante teniendo en cuenta las estructuras óseas existentes (compensación de la diferencia de longitud de las piernas).
— La presencia de defectos óseos pre e intraoperatoria puede variar después de la explantación de la prótesis acetabular primaria (utilización de procedimientos de reconstrucción y prótesis de revisión alternativos).
— Determinar los materiales de las prótesis inseridas (pasaporte de implantes, informe quirúrgico), sobre todo en el caso de intervenciones de recambio protésico aislado (vástago, cono, etc.) y previsión de sistemas de cabezas modulares.
— Ante la sospecha de un aflojamiento protésico séptico o de una infección periprotésica, se requerirán reconocimientos preoperatorios secundarios para establecer un diagnóstico diferencial.
— Para el aumento de defectos óseos masivos, es necesario tener a disposición chips de esponjosa alogénicos (banco de huesos) en cantidad suficiente (discrepancia entre la extensión de los defectos detectada en el preoperatorio mediante examen radiológico y la extensión de los defectos detectados intraoperatoriamente).
— Afeitado directamente preoperatorio de la pierna, inclusive de la zona adyacente de la rodilla.
— Prever la realización de un seguimiento intensivo en caso de ser necesario por motivos de anestesia.
— Administración antibiótica perioperatoria en el caso de prótesis aséptica con una cefalosporina de tercera generación; después de un proceso de dos o más tiempos tras una infección periprotésica, terapia antibiótica en función a la resistencia del patógeno causante o terapia empírica adaptada a la situación patógena prevista (administración antibiótica después de la obtención de pruebas de tejido profundo para microbiología e histología).
— Profilaxis antitrombótica peri y postoperatoria en función del peso y del riesgo (heparina de bajo peso molecular) hasta conseguir la carga total bajo control regular de la cantidad de trombocitos.
Instrumental y prótesis
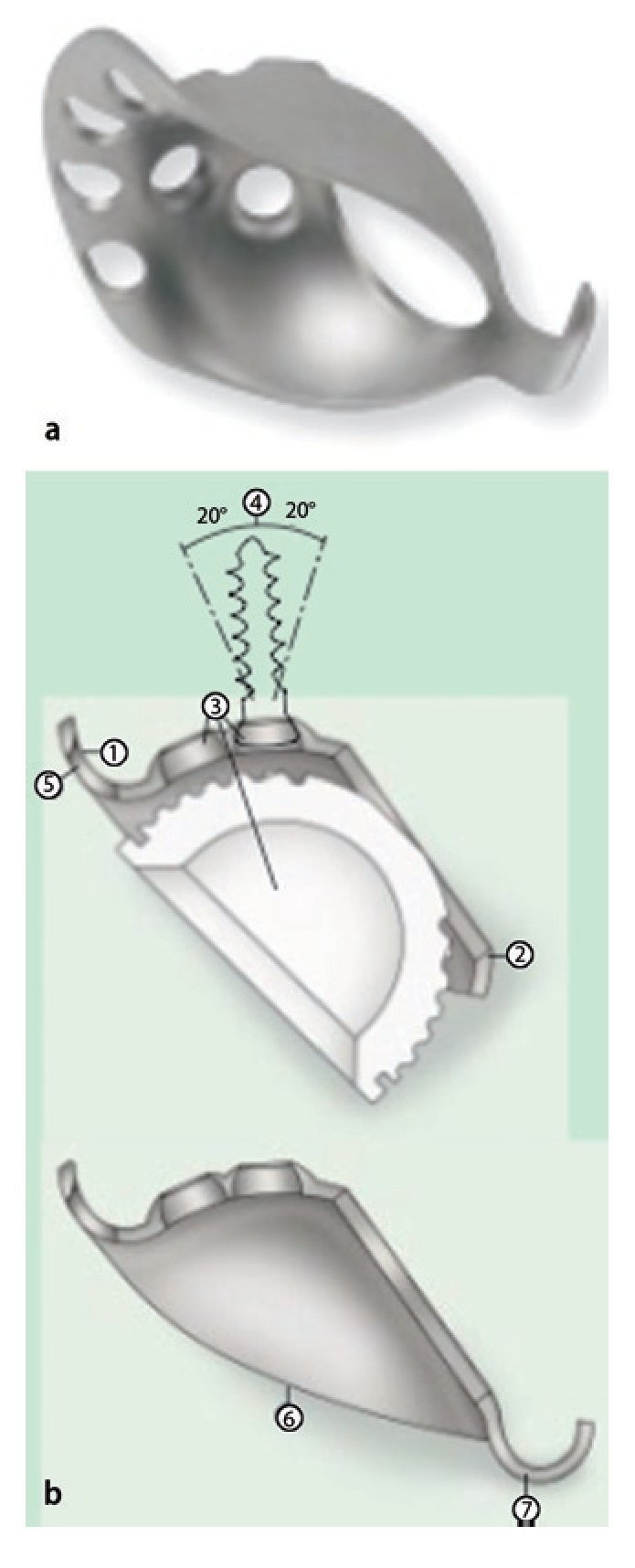
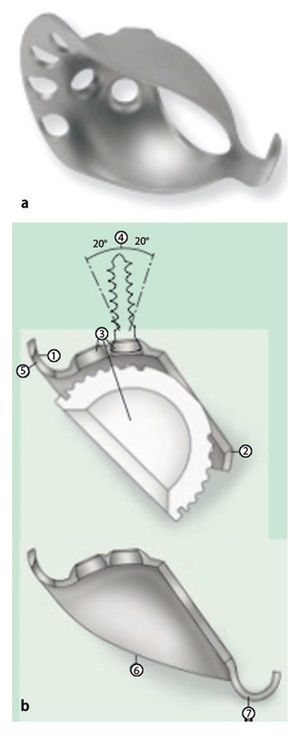
— Instrumental original para el anillo de reconstrucción acetabular ARR-Titanio (ARR-Titanio, Peter Brehm GmbH, Weisendorf, Alemania) formado por un anillo de reconstrucción acetabular con un gancho caudal (diámetro 44-62 mm), así como un cótilo Vektor cementado de polietileno UHMW (diámetro: 44-60 mm; fig. 1).
Fig. 1a) Anillo de reconstrucción acetabular ARR con gancho caudal: tamaños disponibles de diámetro 44-62 mm con cótilo «Vektor» cementado de polietileno UHMW de diámetro 44-60 mm. b) El diseño del ARR-Titanio se adapta a la forma del techo acetabular y gracias a la forma anatómica del borde craneal ofrece una óptima estabilidad primaria en la reconstrucción del acetábulo (1). La forma elíptica del orificio en el lecho del cótilo garantiza la aposición de huesos en el centro del cótilo (caña ancha, 2). Los cinco orificios para los tornillos centrales se distribuyen con un ángulo mínimo posible entre sí, de modo que los tornillos se pueden insertar en el hueso ilíaco en la dirección de los vectores de fuerza (3). El diseño avellanado de las cabezas de los tornillos se ha realizado de modo que durante la inserción de los tornillos el ángulo se puede variar 20º independientemente de la dirección (4). Los orificios para los tornillos en el borde craneal del cótilo se han realizado colisos para garantizar la inserción de los tornillos en el ángulo más plano posible (dirección de los vectores de fuerza) con relación al borde craneal del cótilo (5). Superficie arqueada aplanada de la prótesis (en el ángulo menor posible con relación al nivel de inserción) (6), para obtener una superficie de contacto ósea lo mayor posible (a, favorece la integración ósea) y una superficie de contacto del cemento lo mayor posible (b, garantiza la fijación durable del cótilo insertado). El gancho (7) ofrece temporalmente una mayor estabilidad primaria y posiciona el anillo antiprotusión en el centro de rotación. (Información extraída del folleto de información del producto: anillo de reconstrucción acetabular ARR-Titanio. Por cortesía de Peter Brehm GmbH, Weisendorf, Alemania.)
— Instrumental para prótesis de la articulación de la cadera.
— Set de extracción de cemento con cinceles especiales, pinza para la explantación en el caso de un cótilo cementado aflojado.
— Molino triturador óseo (por ejemplo, Peter Brehm GmbH, Weisendorf, Alemania).
— Injertos óseos alogénicos o chips de esponjosa comerciales disponibles en el mercado, como por ejemplo esponjosa Tutoplast® (Tutogen Medical GmbH, Neunkirchen am Brand, Alemania) o chips de esponjosa DIZG (Instituto Alemán para la Sustitución de Tejidos y Células GmbH, Berlín, Alemania).
— Sistema de cabeza modular flexible, por ejemplo, Merete BioBall® (Merete Medical GmbH, Berlín, Alemania).
— Sierra oscilante con hoja de cortar ancha y estrecha.
— Preparar un aparato de rayos X (arco en C).
Anestesia y posición del paciente
— Intervención bajo anestesia espinal o por intubación.
— Posición del paciente en decúbito supino o lateral.
— Pierna del lado a intervenir colocada en el borde de la mesa de operaciones.
— Mesa para operaciones de cadera con cuña glútea extraíble durante la intervención con el paciente en posición de decúbito supino.
— Cubrir la pierna de modo que se pueda mover con libertad.
— Soporte de fijación a la altura de la cresta ilíaca del lado opuesto (para intervenciones con el paciente en decúbito supino).
— Un apoyo en la sínfisis, el esternón y la unión sacrolumbar respectivamente (para intervenciones con el paciente en posición lateral).
Técnicas quirúrgicas
(Fig. 2-7).
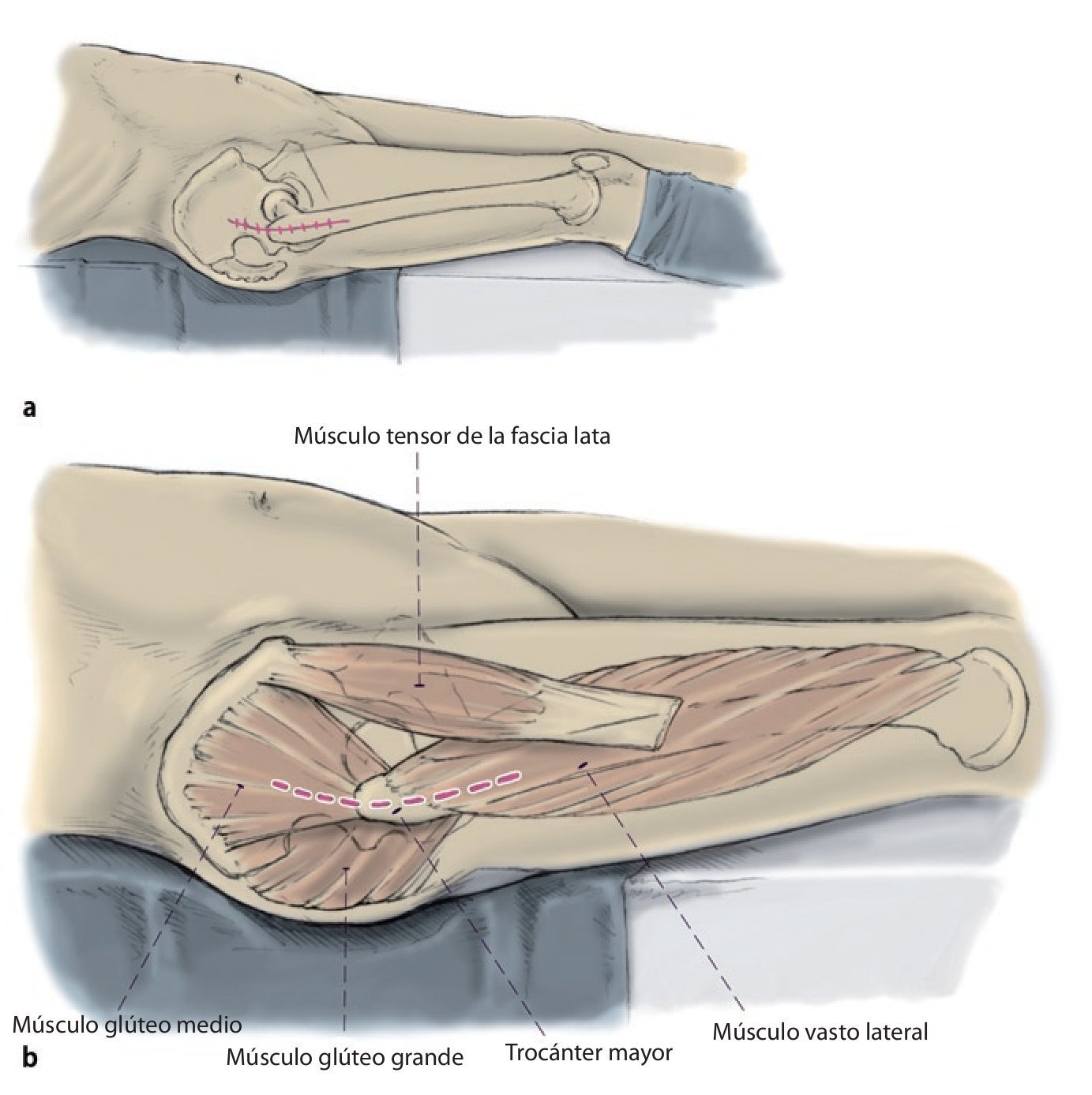
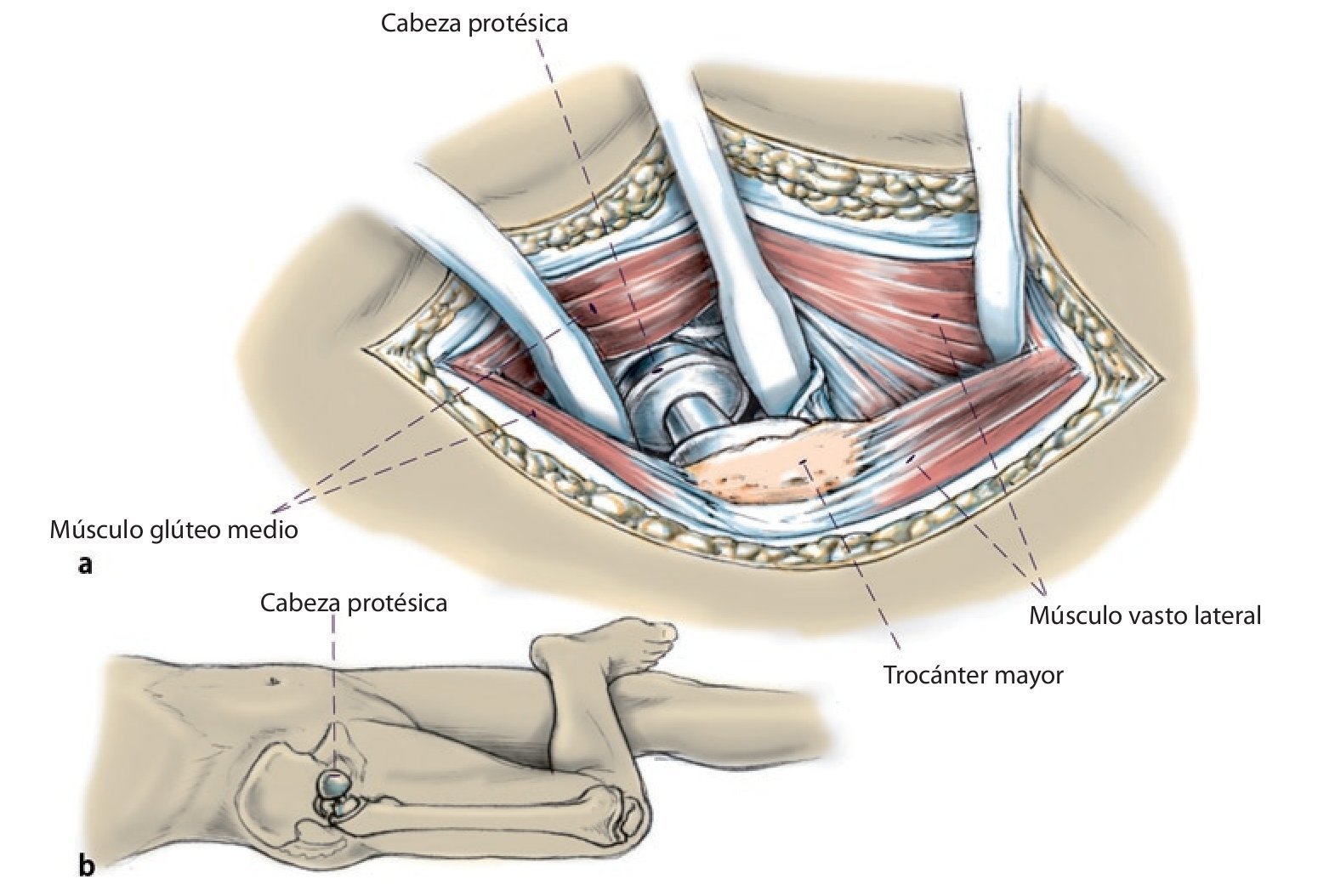
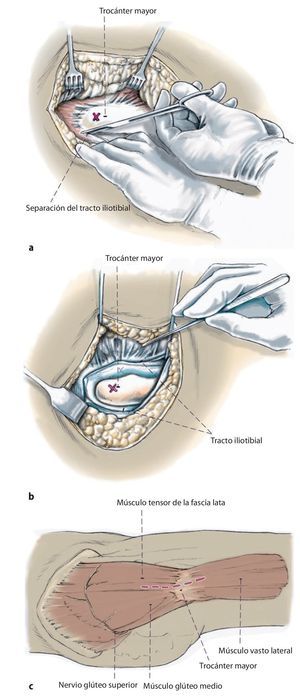
Fig. 2a, b) Cadera «suspendida» durante la intervención con el paciente en posición de decúbito supino.
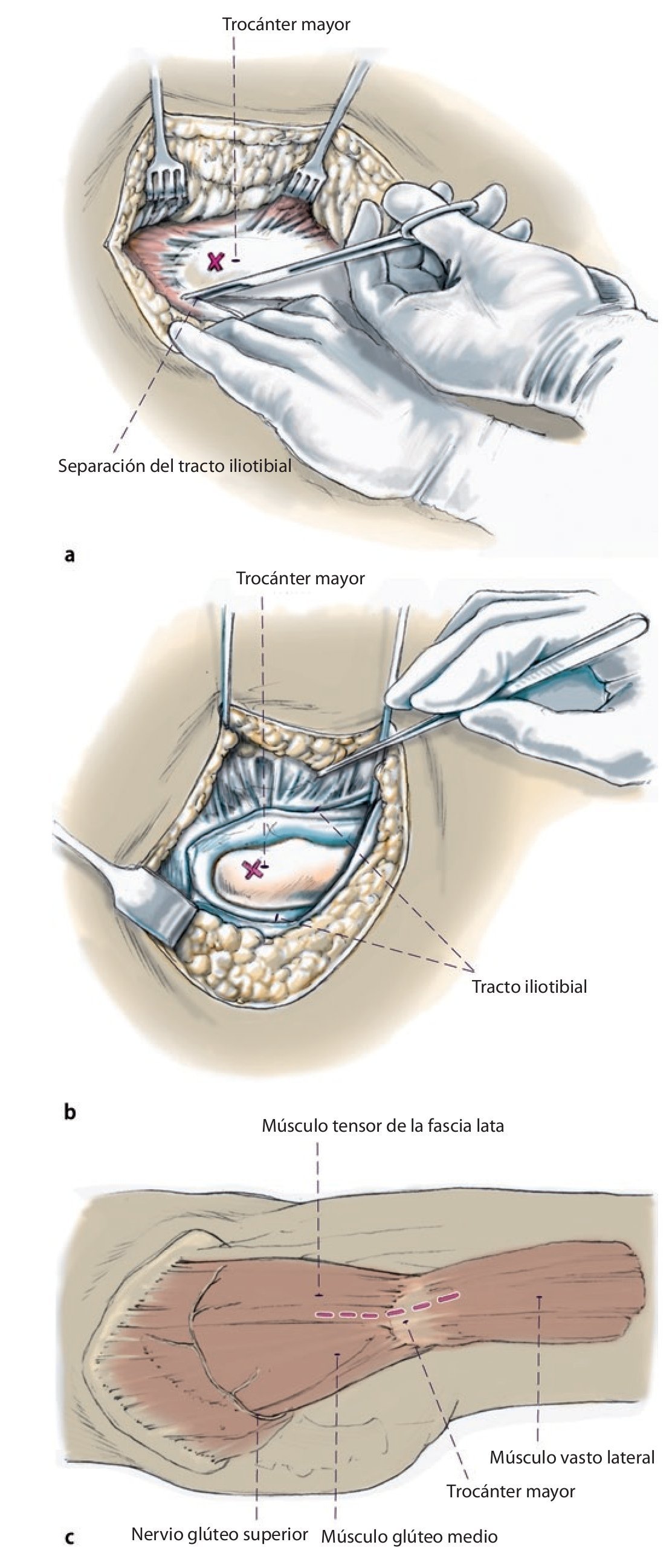
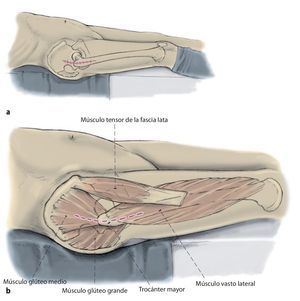
Fig. 3 Preparación del sitio a través de un abordaje lateral transglúteo modificado según Bauer et al.13. El tracto iliotibial se incide muy hacia dorsal en la unión del tercio medio al tercio dorsal; en caso necesario, se amplía hacia craneal para obtener una buena visibilidad sobre el acetábulo (a, b). A continuación, se seccionan los músculos glúteos medial y vasto lateral en el límite entre el tercio medio y el tercio anterior. Se deberá tener en cuenta en realizar una separación craneal del músculo glúteo medio limitada de 2-3 cm (c) para evitar dañar el nervio glúteo superior en la zona del abordaje. El bucle muscular compuesto por músculo glúteo medio y pequeño, el tejido tendoperiosteal en el trocánter mayor y el músculo vasto lateral se aparta hacia ventral.
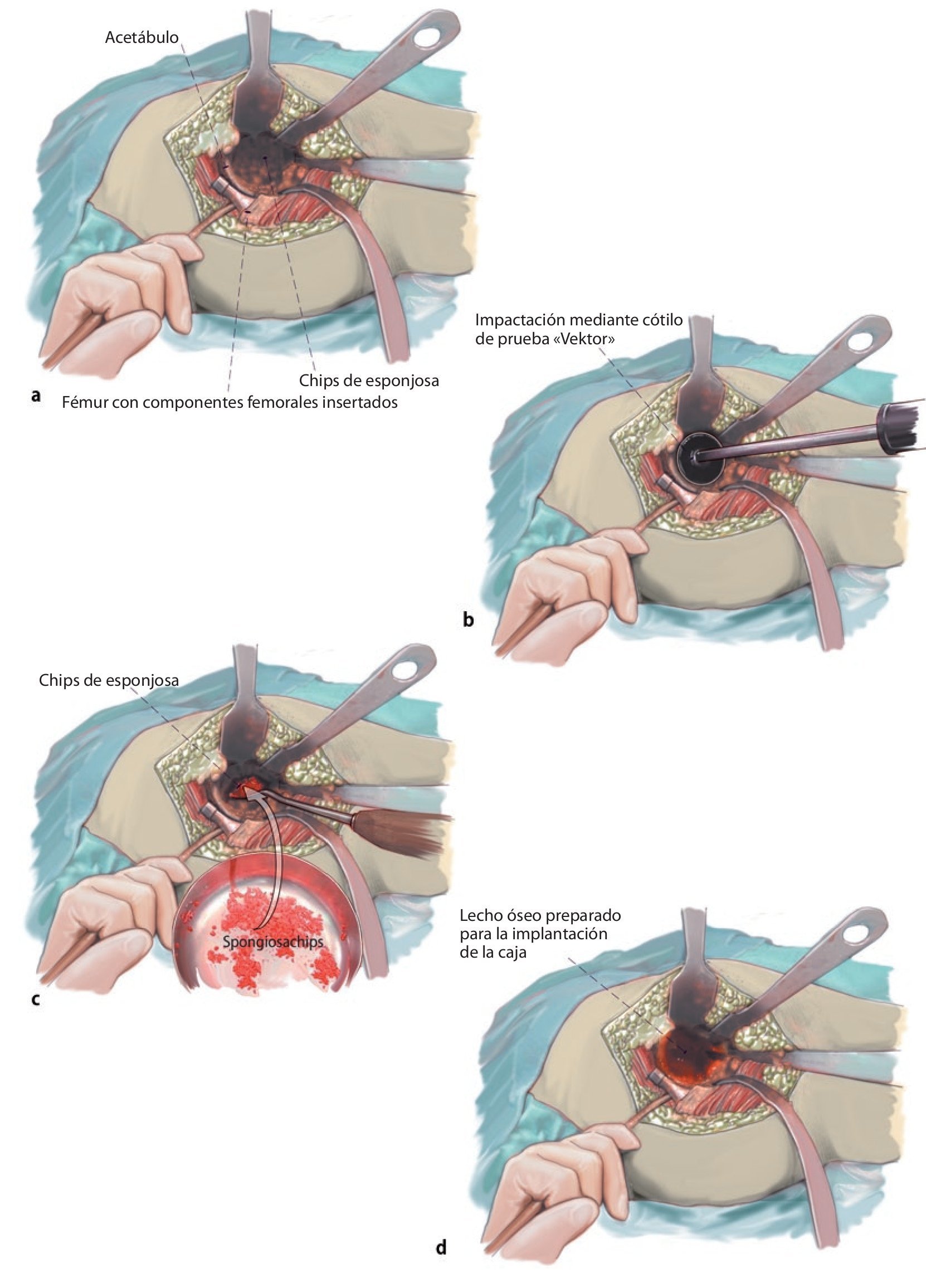
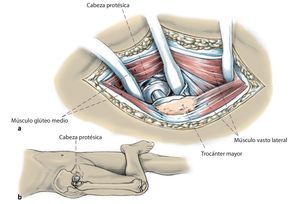
Fig. 4a, b) Después de la escisión de la cápsula articular ventral, craneal y caudal, luxación de la cabeza femoral en flexión, abducción y rotación externa en la articulación de la cadera con cambio de posición de la pierna a la posición de «4» (rodilla en flexión, rotación externa y abducción de cadera). A continuación, se completará la capsulotomía circundante, sobre todo de las partes dorsales y caudales; de ser necesario, movilización de los rotadores externos contraídos. Después de la exposición de los componentes femorales se controlará que su asiento sea fijo y, si es preciso, se extraerá la prótesis. Si se trata de una prótesis modular con un vástago fijo, se cortará la cabeza teniendo cuidado de no dañar el cono. En el caso de una prótesis no modular, se apartarán todos los componentes femorales hacia posterolateral. Extracción de los componentes acetabulares. Cótilos cementados: los cótilos cementados se removerán y explantarán en función de su resistencia con un cincel recto o uno hueco. Los restos del cemento se extraerán a continuación con el cincel y el Luer. Ante la presencia de protrusiones acetabulares, se deberá realizar una preparación bajo especial protección de las partes blandas hacia la profundidad del lecho del cótilo por la cercanía de los vasos sanguíneos del ilíaco. Cótilos no cementados: en el caso de cótilos no cementados con inserto de polietileno, este se suele poder aflojar golpeando con cuidado sobre el borde y extraerlo a continuación del componente acetabular. En el caso de cótilos no cementados con inserto de cerámica, se recomienda realizar todo el procedimiento con mucho cuidado y proteger las partes blandas adyacentes mediante compresas quirúrgicas, a fin de evitar la rotura de la cerámica. Si se han insertado tornillos para un anclaje primario del cótilo sin cemento, se deberán extraer con el destornillador. En el caso de cótilos parcialmente fijos se debería utilizar un cincel curvo para desprender el borde del cótilo del hueso. A continuación es útil atornillar el instrumental de inserción a través del orificio roscado central y poder extraer el cótilo sin dañar el hueso a través de la palanca alargada realizando alternativamente movimientos de palanca y aplicando el cincel. La extracción de cajas antiprotusión con bridas requiere la exposición de las bridas en el hueso ilíaco, así como la extracción de los tornillos. Tras extraer el cótilo aflojado se realizará un desbridamiento extenso y se retirarán todas las partes de tejido granulado, restos de cemento y partes óseas necróticas. A continuación, se realizará un nuevo control del defecto óseo, puesto que entre la extensión del defecto determinada mediante radiología nativa durante el preoperatorio y el diagnóstico real intraoperatorio pueden aparecer grandes discrepancias. Después se extraerán con cuidado los restos escleróticos del lecho acetabular con la fresa y posteriormente se lavará el sitio intraoperatorio varias veces con solución de lavado para anillos. A modo de prueba, se introducirá una caja del tamaño adecuado para controlar su asiento, así como para evaluar el defecto óseo que se pretende reconstruir. Se considera que la caja tiene buen asiento cuando se puede obtener una cierta estabilidad primaria sin fijación con tornillos y con la sola presión de la prótesis. Posteriormente se realizarán pequeños orificios (aproximadamente, de 3-5 mm) en el alojamiento de la prótesis para fomentar la revascularización del hueso autóctono.
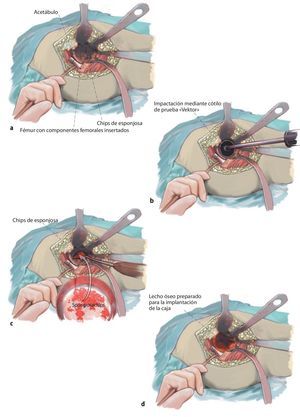
Fig. 5a, b) Entretanto, ante la presencia de defectos voluminosos del acetábulo se prepararán los chips de esponjosa alógena para su posterior impactación. Para la fabricación de chips óseos se deberá rehidratar el injerto dentro de un recipiente con una solución salina fisiológica del 0,9% durante el tiempo necesario hasta que todos los poros estén rellenos de líquido y el injerto se sumerja en la disolución. Para reforzar las propiedades biológicas del implante se mezclarán los chips óseos con 10-20 ml de sangre del propio paciente. Ello es importante para obtener un dentado óptimo de los chips (5-10 mm) y garantizar su incorporación mediante osificación endocondral a lo largo del límite osteoconductor14,15. Ello se puede asegurar mediante la utilización de chips de esponjosa comerciales o la fabricación propia de chips óseos con un molino triturador de huesos o manualmente mediante el sistema Luer.
Fig. 6a-d) La esponjosa preparada se introduce en varias capas dentro del defecto periprotésico y se comprime capa por capa con los cótilos «Vektor» de prueba como «impactador» en un dimensionado descendente (escalonamientos disponibles de 2 mm). Durante este proceso se deberá prestar atención a mantener una relación de mezcla equilibrada de chips de esponjosa homólogos de tamaños diferentes durante la impactación. El objetivo mediante esta técnica del «impaction grafting» es aumentar la estabilidad primaria del hueso y evitar la capacidad de migración de la prótesis (nota: el diámetro nominal indica el diámetro interno del anillo de reconstrucción ARR; espesor de la pared de la prótesis: 2 mm). Se recomienda preparar el lecho de la prótesis con los cótilos de prueba hasta alcanzar el tamaño del anillo de reconstrucción ARR. Mediante la implantación de la caja se obtendrá, por tanto, una compactación adicional de 4 mm en el alojamiento de la prótesis).
Fig. 7 Después de la reconstrucción del defecto con aloinjerto, se encaja la caja antiprotusión mediante presión en el acetábulo y se fija con tornillos de esponjosa de rosca completa. Para ello se introduce el gancho caudal del anillo de reconstrucción ARR en la incisura acetabular y se enclava. En caso necesario, se puede conformar posteriormente el gancho con una pinza con superficies lisas (a). Para obtener el anclaje de tres puntos óptimo para el anillo de reconstrucción (realización de tres superficies de apoyo situadas a una distancia determinada entre sí sobre el hueso nativo), el anillo se impactará en la incisión del acetábulo después del anclaje del gancho caudal. Para ello se recomienda utilizar el cótilo «Vektor» de prueba en función del diámetro nominal del ARR. Después de la impactación se comprobará que el anillo de reconstrucción tenga un asiento estable y sin movimientos (b). A continuación, se fijará la caja antiprotusión con un tornillo de esponjosa de 6,5 mm a través de los orificios para tornillos en el borde acetabular («tornillos para borde acetabular») en la pelvis, teniendo en cuenta de no fijar el tornillo dentro de la caja para evitar el contacto final con el hueso (c). Los orificios para los tornillos de esponjosa de 6,5 mm se taladrarán previamente con una broca de 4,5 mm. Durante este proceso se deberá tener especialmente en cuenta la dirección del recorrido de estos orificios; en caso de orificios bicorticales, existe el peligro de dañar vasos sanguíneos y nervios. En el paso siguiente se ocuparán los orificios centrales con tornillos (d). Los tornillos de fijación de la cúpula se deberían anclar siguiendo la dirección del vector de fuerza en la zona de carga del hueso ilíaco. El avellanado de las cabezas permite variar la dirección de los tornillos dentro de los orificios centrales en un ángulo de 20º independientemente de la dirección. Para ello se pueden utilizar si es preciso brocas flexibles o un destornillador con junta cardán. Los tornillos de fijación de la cúpula tienen la función de modificar el flujo de fuerzas dirigidas hacia craneal asumiendo una parte de la transmisión de las mismas y ejercer presión suficiente sobre el hueso impactado. Durante su inserción se pondrá especialmente atención en que los tornillos de fijación de la cúpula se introduzcan con el momento de giro máximo posible adaptado a la calidad ósea del paciente. Solo después se deberían fijar los «tornillos de borde del acetábulo» hasta hacer contacto con la prótesis y/o ocupar el resto de orificios para tornillos en el borde acetabular (e). En este caso, los «tornillos del borde acetabular» sirven como tornillos de apoyo; un momento de giro primario demasiado alto de los tornillos puede suponer el riesgo de que el injerto se tambalee hacia fuera y comportar la pérdida de la estabilidad óptima si los tornillos se introducen y no existe suficiente superficie de apoyo en la zona del borde acetabular. Introducción de un injerto de polietileno cementado en anteversión (10-15º) e inclinación (aproximadamente 45º) óptimas. La posición del injerto se puede elegir independientemente de la estructura de la caja. En caso de retroversión de la caja, sin embargo, en el momento de posicionar el injerto se pondrá atención para evitar el pinzamiento ventral entre los componentes femoral y acetabular. Si se utiliza un injerto estándar, este deberá ser 2 mm más pequeño que el diámetro nominal de la caja; si se utiliza un injerto de retención, este deberá ser 4 mm más pequeño que el diámetro nominal de la caja. Ante una situación articular inestable con insuficiente función muscular, existe la posibilidad de implantar un injerto antiluxación o para displasia o un injerto de retención como se indica arriba para la creación de articulaciones estables y minimizar los riesgos de una luxación postoperatoria. También es posible la implantación de un sistema de cótilo tripolar que tiene un efecto autocentrante y ofrece consiguientemente una mayor estabilidad. Se aplica cemento óseo mezclado al vacío en la caja y, después de posicionar el injerto bajo aplicación continua de presión en la zona proximal, se provoca la cementación final. El objetivo del cemento es únicamente el de garantizar la estabilidad entre cótilo y metal. Mediante la apertura en el apex del anillo de reconstrucción –que sirve, entre otras cosas, para mejorar la impactación del injerto óseo–, lógicamente no se puede evitar completamente la penetración del cemento en el lecho del injerto. Se extrae el cemento presionado sobrante. En función de los componentes femorales insertados, de la edad del paciente y de la indicación de revisión, se decidirá utilizar unos componentes de deslizamiento determinados, en caso necesario, utilizando un adaptador cónico metálico (por ejemplo, sistema Merete-BioBall®, Merete Medical GmbH, Berlín, Alemania). Tras el lavado a fondo de los componentes femoral y acetabular se realizará la reposición mediante tracción en la pierna y rotación interna. Después de la reposición se verificará la articulación de la cadera en cuanto a arco de movimiento y estabilidad. Nueva verificación de que la longitud de la pierna, la función y la estabilidad sean correctas. Lavado a fondo del área de la herida. Hemostasia cuidadosa. Inserción de dos drenajes Redon profundos. Cierre por capas de la herida. Drenaje Redon subcutáneo, sutura cutánea.
Tratamiento postoperatorio
— Control radiológico intraoperatorio en dos planos con documentación de imágenes en la sala de operaciones antes del cierre de la herida.
— Vendaje estéril de la herida.
— Aplicación de un vendaje Spica.
— Inmovilización de la pierna operada en una férula de espuma.
— Profilaxis antitrombótica adaptada al peso y al tipo de riesgo con un heparina de bajo peso molecular (por ejemplo, enoxaparina) durante cuatro semanas postoperatorias como mínimo hasta alcanzar la carga total con seguridad.
— Primer cambio de vendaje el 2.º día postoperatorio con extracción de los drenajes de Redon.
— Movilización a partir del 1.er día postoperatorio con dos muletas con 20 kg de carga parcial durante 4-6 semanas postoperatorias bajo indicación fisioterapéutica.
— Limitación de la flexión de la cadera a 90º durante las primeras 4-6 semanas postoperatorias, así como prohibición de realizar movimientos de abducción y de rotación exterior forzada para evitar una luxación.
— Extracción del material de sutura a partir del 14.º día postoperatorio.
— Control radiológico de la cadera intervenida en dos niveles entre el 2.º y el 7.º día postoperatorio.
— Control de la evolución del paciente mediante examen clínico y radiografías nativas después de seis semanas; si la prótesis permanece en su posición y existe una osteointegración progresiva, se procederá gradualmente a la carga total. Otros controles de la evolución clínicos y mediante radiografías nativas después de 3, 6, y 12 meses, así como anuales.
Errores, riesgos y complicaciones
— Diferencia de longitud de piernas intraoperatoria: compensación mediante componentes protésicos modulares adecuados en el vástago del fémur en caso de una intervención de recambio de cótilo aislada utilizando, por ejemplo, el sistema Merete-BioBall® (Merete Medical GmbH, Berlín, Alemania).
— Lesión nerviosa (n. isquiático, n. femoral), entre otras, durante la compensación de una diferencia de longitud de piernas preoperatoria como lesión por hiperextensión: compensación moderada de la diferencia de longitud de piernas, determinación de la velocidad de conducción nerviosa para la especificación de la lesión.
— Cranealización del centro de rotación debido a un apoyo insuficiente sobre el borde prominente del acetábulo: según la magnitud, revisión quirúrgica y caudalización del centro rotacional mediante sistemas de revisión alternativos (por ejemplo, sistemas de cótilos ovalados en sentido longitudinal).
— Osificaciones periarticulares a pesar de la profilaxis con un antirreumático no esteroideo: en caso de osificaciones masivas con dolor en función de la carga de la pierna y limitaciones de movilidad, por regla general la única alternativa suele ser la resección quirúrgica. En este caso, se debería asegurar antes de la intervención la inactividad de la osificación mediante una cintigrafía ósea y fosfatasa ósea alcalina de valor normal.
— Ausencia de incorporación o incorporación parcial de los chips óseos con formación de un lecho acetabular no resistente a cargas mecánicas con falta de integración ósea secundaria de la prótesis como punto de partida de un aflojamiento precoz: revisión quirúrgica.
— Lesión de vasos sanguíneos interpélvica: exposición de la hemorragia a través de un abordaje retro o transperitoneal y sutura de vasos microquirúrgica o reconstrucción de vasos con injertos vasculares autólogos o artificiales.
— Infección nueva o de recidiva de la prótesis: desbridamiento extenso, recambio de las partes protésicas móviles y antibiosis tras la determinación de resistencias microbiológicas. En caso de infección tardía, extracción de la prótesis y procedimiento en dos tiempos.
Resultados
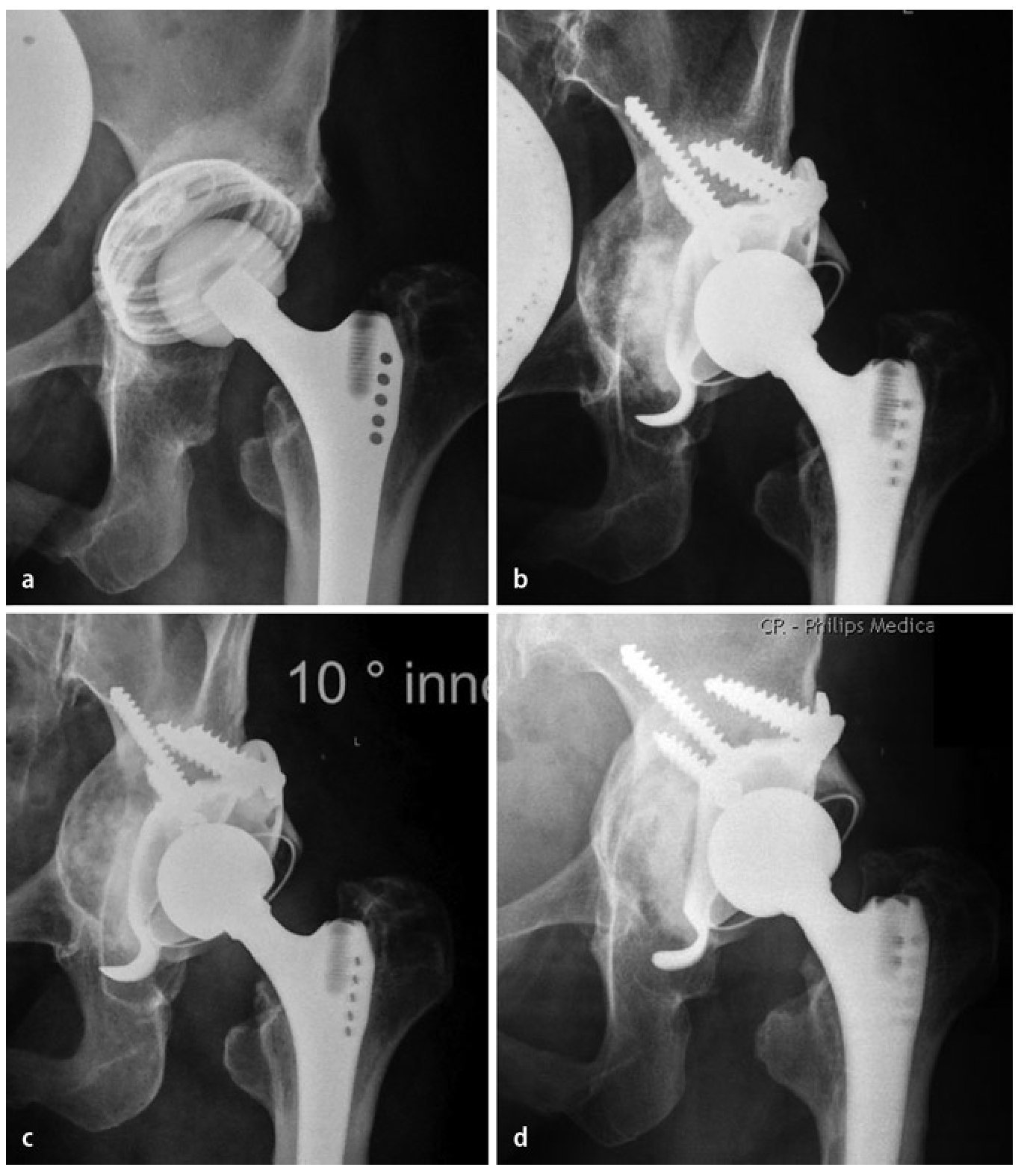
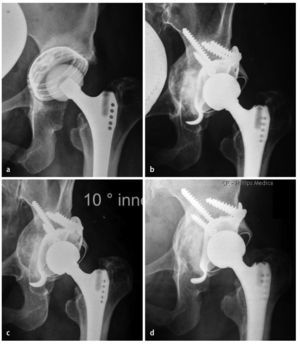
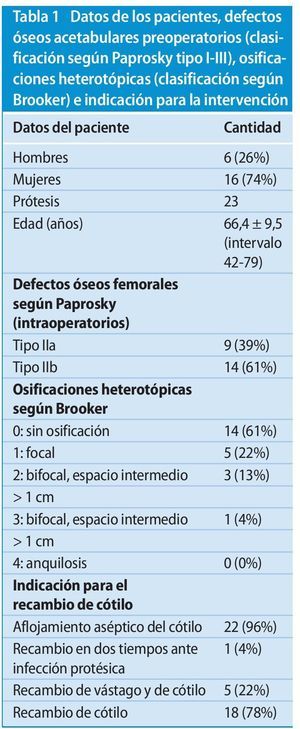
Entre enero de 2008 y mayo de 2011 atendimos en total a 22 pacientes consecutivos con 23 anillos de reconstrucción acetabular del tipo ARR-Titanio en combinación con una reconstrucción de defectos biológica asociada con chips de esponjosa homólogos mediante la técnica del «impaction-grafting», y los sometimos a un seguimiento posterior clínico y mediante radiografías nativas (38 ± 11 meses; intervalo: 24-60 meses) (ejemplo de caso, ver fig. 8). El seguimiento posterior se realizó en base a datos agregados y anónimos, obtenidos en el marco de los controles clínicos rutinarios. Los datos de los pacientes se han resumido en la tabla 1.
Fig. 8 Osteointegración progresiva del injerto compactado.
El abordaje quirúrgico se realizó en todos los casos transglúteo. La evaluación clínica válida de la función pre y postoperatoria se llevó a cabo con ayuda de la escala de cadera de Harris (HHS16) y de la escala de Merle-D’Aubigné17. La determinación de los defectos acetabulares se realizó según Paprosky en base a las radiografías tomadas en la fase preoperatoria18. Durante la fase intraoperatoria se realizó el control del diagnóstico preoperatorio en función de la magnitud del defecto acetabular. En los casos que presentaron diferencias entre el diagnóstico preoperatorio en base a las radiografías nativas y el diagnóstico intraoperatorio nos decantamos por la clasificación de defectos obtenida en la fase intraoperatoria.
La valoración mediante las radiografías nativas se llevó a cabo en base a imágenes generales estándar de la cadera a escala 1:1,15. Para ello, se evaluaron las líneas radiolucentes y las osteólisis según la propuesta de DeLee y Charnley19, tanto entre prótesis e injerto como entre injerto y hueso autóctono. También se midió la inclinación de la caja.
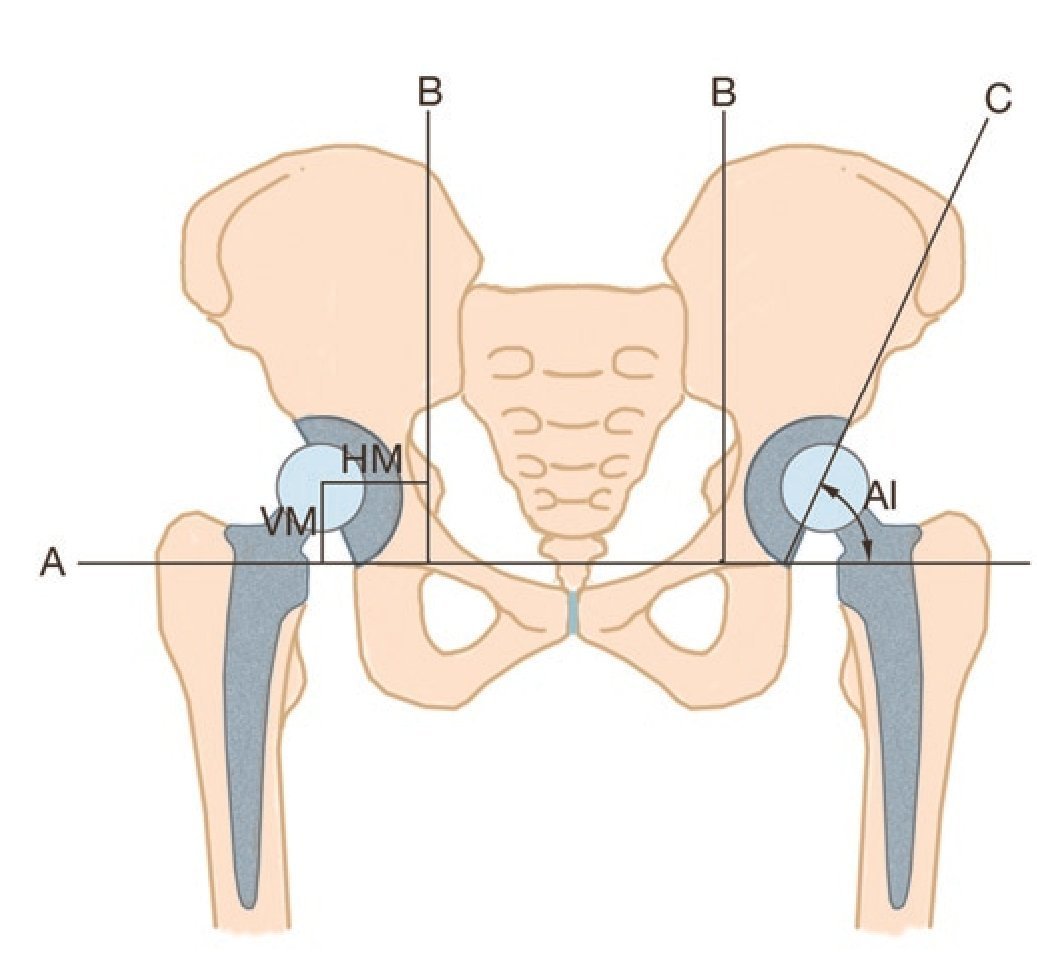
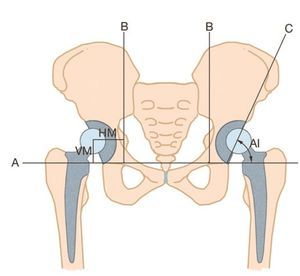
Para valorar la osteointegración de la esponjosa homóloga impactada y una posible migración de la prótesis como indicación de un aflojamiento mecánico, se midió el índice acetabular, así como la migración horizontal y vertical según el método descrito por Peters et al.20(fig. 9), y se comparó su evolución temporal (evolución de las radiografías directamente postoperatorias y en el momento de la última visita de seguimiento).
Fig. 9 Índice acetabular (AI), migración horizontal (HM) y vertical (VM).
La migración se definió según los criterios de Bonnomet et al.21 como modificación de la inclinación de la caja del techo acetabular de más de 5º, como migración de más de 4 mm del centro de rotación o como presencia de una rotura del material o de tornillo. Además, también se evaluó la osteointegración de la esponjosa homóloga en base a los procesos de cambio trabecular en la región del defecto aumentado. Como referencia, usamos la arquitectura trabecular del hueso nativo circundante (espesor y orientación trabecular22,23,24). También realizamos la clasificación de las osificaciones heterotópicas según Brooker et al.25.
Durante el control de la evolución clínica se pudo observar una mejora significativa de los valores HHS medios (82,2 ± 8,7 vs. 44,7 ± 10,7 puntos; p ≤ 0,05) y de la escala de Merle-d’Aubigné (14,6 ± 1,9 vs. 7,5 ± 1,3 puntos; p ≤ 0,05) en comparación con la evaluación preoperatoria.
En el 26% de los casos (n = 6) se pudo observar una diferencia de longitud de piernas de > 5 mm, que permaneció constante durante la evolución postoperatoria.
La valoración mediante radiografías nativas mostró en el 91% de los casos (n = 21) una osteointegración fija de los componentes acetabulares sin señales de aflojamiento o de líneas radiolucentes en las zonas I-III según DeLee y Charnley19. Se observó una línea radiolucentes en la zona I y en la zona III respectivamente entre los componentes del techo acetabular y el tejido esponjoso homólogo impactado, así como entre este y el alojamiento óseo autóctono. En el 87% de los casos (n = 20) las radiografías nativas mostraron una evolución del diseño trabecular en aumento en el sentido de una reconstrucción de la microarquitectura trabecular en el área aumentada como síntoma cualitativo de una reconstrucción ósea biológica.
En 21 cajas antiprotusión (91%) se registró una integración estable con una posición inalterada del centro de rotación anatómico; únicamente dos prótesis (9%) registraron una migración de la prótesis según la definición proporcionada por Bonnomet et al.20. Sin embargo, durante la evolución de la entidad se observó también una consolidación con aumento de la osteointegración, de modo que no hubo necesidad de indicar una intervención quirúrgica.
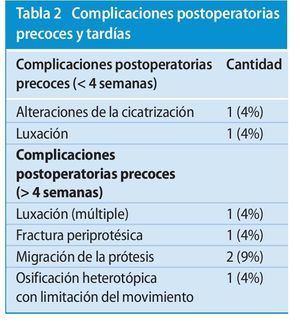
Las complicaciones postoperatorias tempranas (< 4 semanas) y tardías (> 4 semanas) se han resumido en la tabla 2. A causa de la luxación de recidiva se tuvo que cambiar el injerto por uno antiluxación en una paciente. Otra paciente sufrió una fractura periprotésica del tipo II según Johansson debido a una caída, por lo que se tuvo que cambiar la prótesis por una prótesis de revisión modular que puenteara la fractura del tipo MRP-Titanio® (Peter Brehm GmbH, Weisendorf, Alemania).
En un caso (4%) se extrajeron quirúrgicamente osificaciones periarticulares (estadio III según Brooker) a los 24 meses de la implantación debido a masivas limitaciones de movimientos funcionales.
Cumplimiento con las directrices éticas
Conflicto de intereses. M. J. Friedrich, S. Gravius, J. Schmolders, M. D. Wimmer y D. C. Wirtz indican que no existe ningún conflicto de intereses.
Este artículo no contiene pruebas en personas o animales
Correspondencia
Dr. M.J. Friedrich
Klinik und Poliklinik für Orthopädie und Unfallchirurgie, Rheinische Friedrich-Wilhelms-Universität Bonn
Sigmund-Freud-Str. 25, 53105 Bonn (Alemania)
max.friedrich@ukb.uni-bonn.de