Redacción
D.C. Wirtz, Bonn
Ilustraciones
J. Kühn, Heidelberg
Introducción
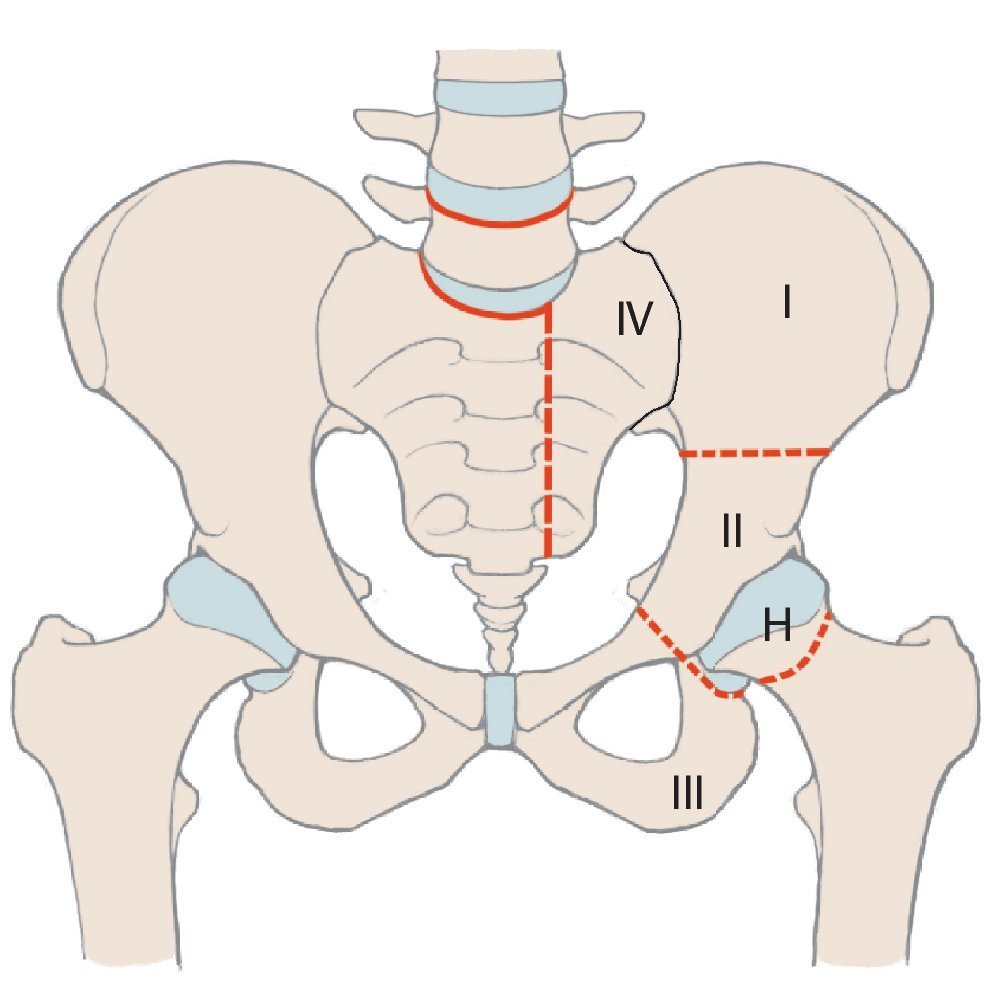
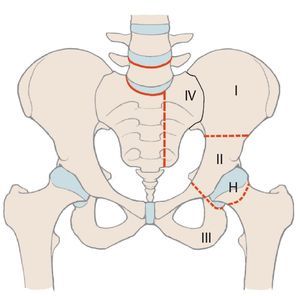
En comparación con los tumores malignos localizados en las extremidades, los situados en la cadera tienen un pronóstico peor a causa de su proximidad a estructuras neurovasculares y viscerales1. Además, en el momento de realizar el diagnóstico a menudo ya se detectan tamaños de tumores considerables. Para obtener un buen resultado oncológico durante la terapia de los tumores malignos de cadera es muy importante mantener unos márgenes de resección adecuados, por lo que, con frecuencia, el único tratamiento curativo es la hemipelvectomía2. Cada vez más se emplean procedimientos de preservación de la extremidad, puesto que sus resultados oncológicos se corresponden en gran parte a los de los procedimientos ablativos debido a la introducción de conceptos terapéuticos multimodales3,4. Tras una resección de cadera se pueden aplicar diferentes procedimientos de reconstrucción en función de la extensión de la resección, que hacen posible preservar la extremidad. Una división esquemática de la cadera simplifica la descripción de las zonas de resección y permite realizar una estimación de la pérdida de funcionalidad. Para ello Enneking y Dunham presentaron en el año 1978 por primera vez un sistema de clasificación de los diferentes defectos de resección5(fig. 1). Según esta clasificación, se diferencia entre defectos de resección supraacetabulares (P I «pelvis»), acetabulares (P II), infraacetabulares (P III) y sacros (P IV). H I («hip») se refiere a la resección del fémur proximal, H Amp («amputation») a la amputación de la extremidad. Si en defectos del tipo I se conserva una parte del hueso ilion, entonces no es necesario realizar una reconstrucción. En aquellos pacientes que presenten únicamente defectos del tipo III en el hueso pubis o en el isquion tampoco hace falta resección alguna. Después de la resección periacetabular (defectos del tipo II) se deberá asegurar, sin embargo, la transmisión de fuerzas desde la extremidad inferior hacia el esqueleto axial6,7.
Fig. 1. Clasificación de los defectos de resección pélvicos y femorales según Enneking.
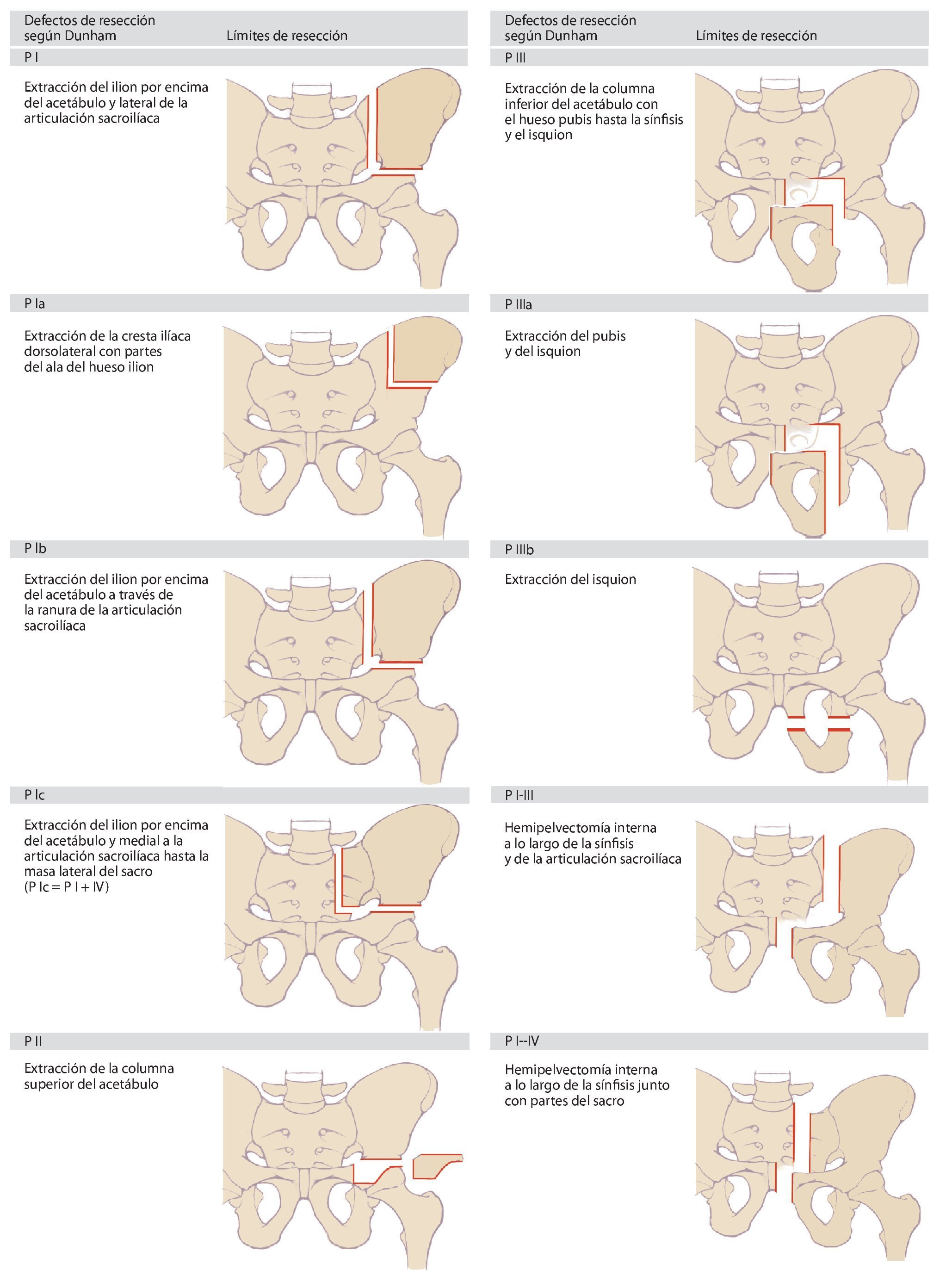
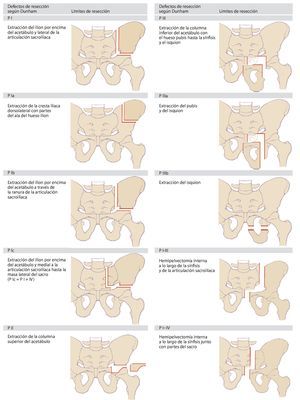
Dunham elaboró posteriormente una clasificación más exacta de los diferentes tipos de defectos8(fig. 2). En la actualidad, estas dos clasificaciones sientan la base sobre la cual se ha elaborado una nomenclatura uniforme en la cirugía tumoral de la pelvis. En la práctica, estos modelos clasificatorios demostraron ser insuficientes para la determinación de la necesidad y del tipo de reconstrucción. Puesto que los tumores de la pelvis ósea en el momento de realizar el diagnóstico suelen presentar invasiones extracompartimentales, a la hora de elegir el tipo de reconstrucción a aplicar en cada caso se deberá tener en cuenta el defecto de partes blandas resultante de la resección9,10. Precisamente durante el tratamiento con megaprótesis metálicas se pondrá atención en asegurar un cubrimiento suficiente con partes blandas de la prótesis con el fin de evitar una infección y alteraciones en la cicatrización. Además, durante la planificación de la intervención también se deberá tener en cuenta una posible afectación de los órganos pélvicos y de las estructuras neurovasculares.
Fig. 2. Clasificación de los defectos de resección pélvicos según Dunham. Según la extensión de la resección se añade a la tipología las letras a, b o c.
La reconstrucción después de la resección de una parte de la pelvis junto con el acetábulo o la articulación de la cadera (P II) supone un reto especial para el cirujano. El objetivo de este tratamiento debería ser, además de obtener el mejor resultado oncológico posible, la preservación de una extremidad funcional. La premisa para ello es conseguir transferir las cargas al ilion o al sacro remanentes mediante un anclaje estable de la superficie de resección distal. Para ello no es absolutamente necesario el cierre del anillo pélvico y algunos autores han dejado de recomendarlo debido a las altas tasas de aflojamiento observadas después de su fijación en el pubis o en el isquion11-13. Si los defectos son de pequeño tamaño, se pueden utilizar cótilos con calce craneal o cótilos con anclaje cónico14-16. En caso de efectuarse únicamente una resección P II y preservación de la cabeza femoral, es posible provocar una pseudoartrosis rígida mediante la adaptación de los extremos óseos. Sin embargo, si los defectos están extendidos, la falta de reconstrucción provoca a menudo una inestabilidad con una funcionalidad limitada de la extremidad13. Mediante procedimientos quirúrgicos como la artrodesis iliofemoral o isquiofemoral o super girdlestone se obtienen, en general, peores resultados funcionales globales debido a un acortamiento significativo de la pierna y a limitaciones en la movilidad de la misma17-19. En el caso de defectos combinados, la cirugía de desplazamiento de la cadera según Winkelmann ha demostrado ser un procedimiento relativamente poco complicado, aunque también en este caso hay que contar con un acortamiento de pierna significativo20,21. Mediante el uso de un aloinjerto o de un autoinjerto auto-clavado con o sin implantación de una endoprótesis, se pueden puentear defectos óseos. En este caso, como complicaciones especiales aparecen reabsorción del trasplante, infección y protrusión acetabular22-24.
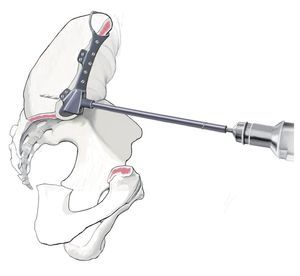
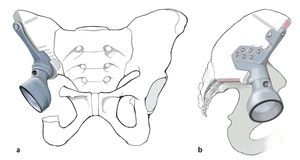
Las ventajas de un tratamiento endoprotésico con megaprótesis hechas a medida (custom made) tras una resección P II única o combinada son la prevención de grandes diferencias de longitud de las piernas, la conservación de una cierta movilidad y la garantía de una estabilidad vertical. Ello supuso que hasta los años noventa aumentara el empleo de estos procedimientos quirúrgicos. A pesar de los buenos resultados funcionales iniciales, con el tiempo se fue detectando un aumento de las tasas de infección y de migración de los implantes24,25. Por este motivo recomendamos analizar siempre, sobre todo en el caso de pacientes más jóvenes, si los objetivos quirúrgicos se pueden alcanzar también con un procedimiento de reconstrucción biológico. No obstante, con la posibilidad de elaborar una planificación exacta de los niveles de resección en el modelo pélvico se pudo reducir drásticamente la tasa de recidiva local inicialmente tan elevada26-28. En base a las primeras experiencias obtenidas con la implantación de megaprótesis hechas a medida se fueron desarrollando progresivamente sistemas endoprotésicos de construcción semi-modular. Únicamente la pieza de anclaje en el hueso ilion y el sacro se siguen fabricando todavía de modo individual para cada paciente. Mediante un procedimiento especial rapid-prototyping con una fresa CNC de cinco ejes se puede fabricar un modelo pélvico de poliuretano en tamaño original. Este modelo sirve de ayuda para la planificación tridimensional de los niveles de resección y para el desarrollo de plantillas hechas a medida para la instrumentación, así como para la fabricación de una prótesis construida a medida para cada paciente29,30. En principio, estos pasos también se pueden realizar mediante procedimientos de CAD/CAM en los que la planificación se realiza virtualmente sobre el modelo. En este caso, el implante se ajusta al modelo virtual según la forma de anclaje elegida. El anclaje del implante puede ser cementado o no cementado. Según el tipo o la situación del defecto será necesaria una fijación en el ilion o en el sacro remanente. Una estructura superficial macroporosa del implante favorece la integración ósea de la prótesis. Las todavía altas tasas de complicaciones postoperatorias requieren que el cirujano efectúe la indicación para un reemplazo endoprotésico parcial de pelvis bajo aspectos muy críticos12,31.
Principio y objetivo de la intervención
Tratamiento de tumores del anillo pélvico mediante la resección parcial o total del hueso innominado con conservación de la extremidad. Resección lo más extensa posible y control tumoral local. Implantación y anclaje estable de una megaprótesis hecha a medida para la preservación de la movilidad del paciente.
Ventajas
— Preservación de la pierna sin acortamiento significativo de la longitud de la misma.
— Evitar un tratamiento protésico externo en comparación con la hemipelvectomía externa.
— Conservar la máxima función posible en la articulación de la cadera y de la capacidad de carga de la pierna.
— Sin trasplante óseo o materiales de relleno adicionales.
— Mantenimiento de los niveles de resección planificados durante el preoperatorio mediante el empleo de plantillas de resección preparadas. No hace falta recurrir a sistemas de navegación, por lo que no hay pérdida de tiempo.
— En principio es posible el tratamiento de todos los defectos de resección.
Desventajas
— Altas tasas de complicaciones.
— Planificación y fabricación preoperatorias complejas y que requieren mucho tiempo.
— Intervención técnicamente muy compleja, que puede durar varias horas.
— Sin reducción de los defectos para intervenciones posteriores mediante aumento del volumen óseo (alógeno o autógeno).
— Requiere de una preparación de partes blandas bastante compleja para el cubrimiento de la endoprótesis.
— Intervención practicable únicamente en hospitales con asistencia sanitaria multidisciplinar con unidad de vigilancia intensiva, cirugía vascular, cirugía visceral y cirugía plástica.
Indicaciones
— Sarcomas óseos y de partes blandas primarios.
— Lesiones benignas o semimalignas cada vez más agresivas.
— Metástasis (en caso de resistencia a la radioterapia y/o de pronóstico bueno).
La indicación para llevar a cabo una hemipelvectomía y una reconstrucción endoprotésica se realizará bajo las premisas siguientes:
— Se pueden alcanzar bordes de resección casi tan amplios como en el caso de una hemipelvectomía externa.
— La resección y la posterior reconstrucción permiten conservar o reconstruir la funcionalidad de la extremidad afectada.
— El estado de salud general y la esperanza de vida del paciente permiten realizar esta intervención extensiva.
— El paciente rechaza una hemipelvectomía externa.
Contraindicaciones
— Esperanza de vida limitada y estado general malo.
— Metástasis extensas.
— Infección persistente u osteomielitis resistente a la terapia.
— Falta de cooperación por parte del paciente.
— Recidiva local después de una resección con conservación de la extremidad.
La resección parcial de pelvis con posterior reconstrucción endoprotésica está contraindicada en los casos con las siguientes condiciones oncológicas especiales:
— Extensión tumoral en la zona proximal de la articulación sacroilíaca con afectación simultánea del plexo lumbosacro o de las raíces nerviosas.
— Afectación extensiva de las partes blandas intra o extrapélvicas, de modo que ya no sea posible el cubrimiento de la prótesis con las partes blandas.
— Extensión al muslo con afectación del nervio ciático o femoral.
— La intervención no supone ningún beneficio oncológico o funcional.
Información para el paciente
— Los riesgos quirúrgicos generales (trombosis, embolia, lesiones vasculares, lesiones nerviosas, hemorragia, infecciones, alteraciones en la cicatrización de la herida) son mayores que los riesgos de una cirugía estándar en ortopedia o en cirugía traumatológica.
— Las lesiones de vasos sanguíneos grandes y las hemorragias masivas pueden tener también consecuencias letales.
— Lesión de partes blandas interpélvicas.
— Disfunciones eréctiles, incontinencia.
— Limitación de la movilidad de la articulación de la cadera a causa de osificaciones heterotópicas.
— Sensación de inestabilidad, tendencia a hinchazón de la pierna.
— Aflojamiento o luxación de la prótesis.
— Necrosis de partes blandas e intervenciones de reconstrucción plástica secundarias.
— Hemipelvectomía externa secundaria.
— Carga parcial de la extremidad operada durante doce semanas como máximo.
— Es posible que la libre movilidad no se consiga hasta pasadas las 24 semanas.
— Puede ser necesario el uso permanente de una ayuda para la marcha.
Preparación de la intervención
— Biopsia y análisis histológico de la lesión en un centro especializado en tumores óseos y de partes blandas. El abordaje para la biopsia debe ser el mismo que el abordaje definitivo posterior. Se prestará atención en elegir el trayecto más directo y corto hasta el tumor, que se tendrá que extirpar durante la resección definitiva. Se mantendrá un margen de seguridad con respecto a la articulación y a los paquetes vasculonerviosos. En el caso de tumores primarios, se realizará, por regla general, una biopsia de incisión abierta para obtener suficiente material para realizar la histología convencional y la inmunohistoquímica32-34.
— Información al paciente sobre un tratamiento terapéutico multimodal con terapia de quimioterapia y/o radioterapia neadyuvante o adyuvante, a ser posible en el marco de una conferencia interdisciplinaria sobre tumores. Control preoperatorio para determinar una posible afectación metastásica de los órganos adyacentes mediante CT toraco-abdominal o sonografía abdominal. Diagnóstico sobre la propagación según el tipo de tumor también mediante una cintigrafía ósea o PET. El pronóstico del paciente determinará básicamente la posibilidad de una terapia quirúrgica.
— Análisis mediante tomografía por resonancia magnética (TRM) de la pelvis y del muslo proximal para excluir una afectación de las grandes estructuras neurovasculares y de los órganos pélvicos. Determinación de la extensión de la afectación de partes blandas.
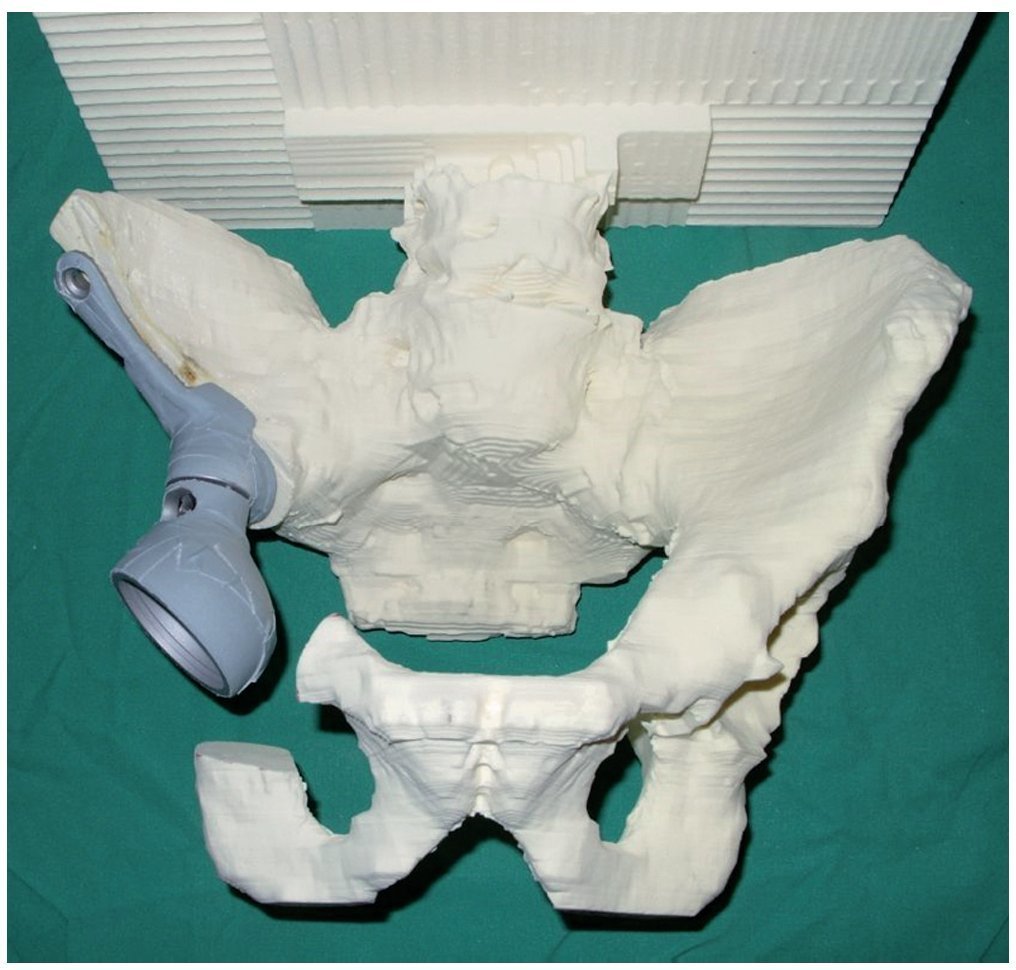
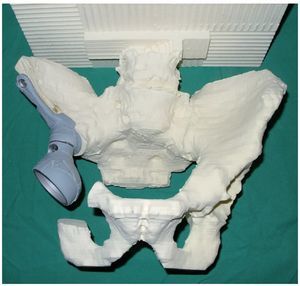
— Determinación de los niveles de osteotomía sobre la base de un modelo de pelvis de poliuretano a escala 1:1, fabricado según un TC de capa delgada. Sobre la base de este modelo y de los datos de la tomografía computada de la pelvis se fabricará una prótesis hecha a medida, así como plantillas especiales para la osteotomía, después de que el cirujano haya dibujado el nivel de osteotomía (fig. 3).
Fig. 3. Modelo de pelvis de poliuretano en tamaño original con simulación de los anclajes protésicos después de dibujar los niveles de resección y de recortar la zona afectada por el tumor.
— Preparación preoperatoria normal del paciente.
— Angiografía facultativa de pelvis. Sobre todo en el caso de afectación tumoral del uréter se realizará ureteropielografía, pielograma intravenoso o TC con medio de contraste para fase tardía. Colocación de un catéter ureteral.
— Si es posible, en el marco de la angiografía se debería realizar una embolización selectiva de los vasos tumorales.
— Rastreo (screening) de la trombosis mediante ecografía doppler proximal y distal.
— Vaciado intestinal preoperatorio. Colocación perioperatoria de un catéter intestinal (por ejemplo, Acti-Flo, de la marca Hollister; puede permanecer durante 29 días colocado) a fin de evitar una posterior contaminación de la herida. En algún caso excepcional, colocación de un estoma externo protector doble y reposición después de la cicatrización de la herida.
— Preparación de una cantidad suficiente de concentrado de eritrocitos, plasma y trombocitos (mínimo, 20-20-10).
— Afeitado de la mitad de la pelvis afectada y del muslo directamente antes de la entrada a quirófano. Afeitado y lavado minuciosos especialmente en la región anogenital.
— Profilaxis antibiótica perioperatoria como dosis única 10-30 min antes de la incisión cutánea (cefalosporina de segunda o tercera generación, per ejemplo, cefuroxima 1,5 g). La mayoría de los antibióticos utilizados durante la profilaxis tienen una semivida del suero de 60 min aproximadamente, de modo que, si el tiempo de la intervención es superior a dos horas, se recomienda aplicar una nueva dosis a causa de las propiedades farmacocinéticas.
Instrumental e implantes
— Set instrumental estándar para cirugía endoprotésica de cadera con ganchos Langenbeck de diferentes anchuras y longitudes, elevadores Hohmann puntiagudos y romos. Se recomienda utilizar elevadores grandes y romos para proteger la escotadura ciática durante la osteotomía del ilion.
— Bandeja para instrumental de cadera, bandeja para instrumental de estómago e instrumental adicional, especialmente espátulas grandes y anchas y separadores para hígado y vejiga.
— Separador para suelo acetabular (por ejemplo, elevador de fémur, 26 mm, marca Mathys).
— Separadores pélvicos romos especiales de tamaño mediano y grande (por ejemplo, de 268 o 323 mm, marca Synthes).
— Cinceles para pelvis anchos y estrechos.
— Sierra oscilante y sierra Gigli.
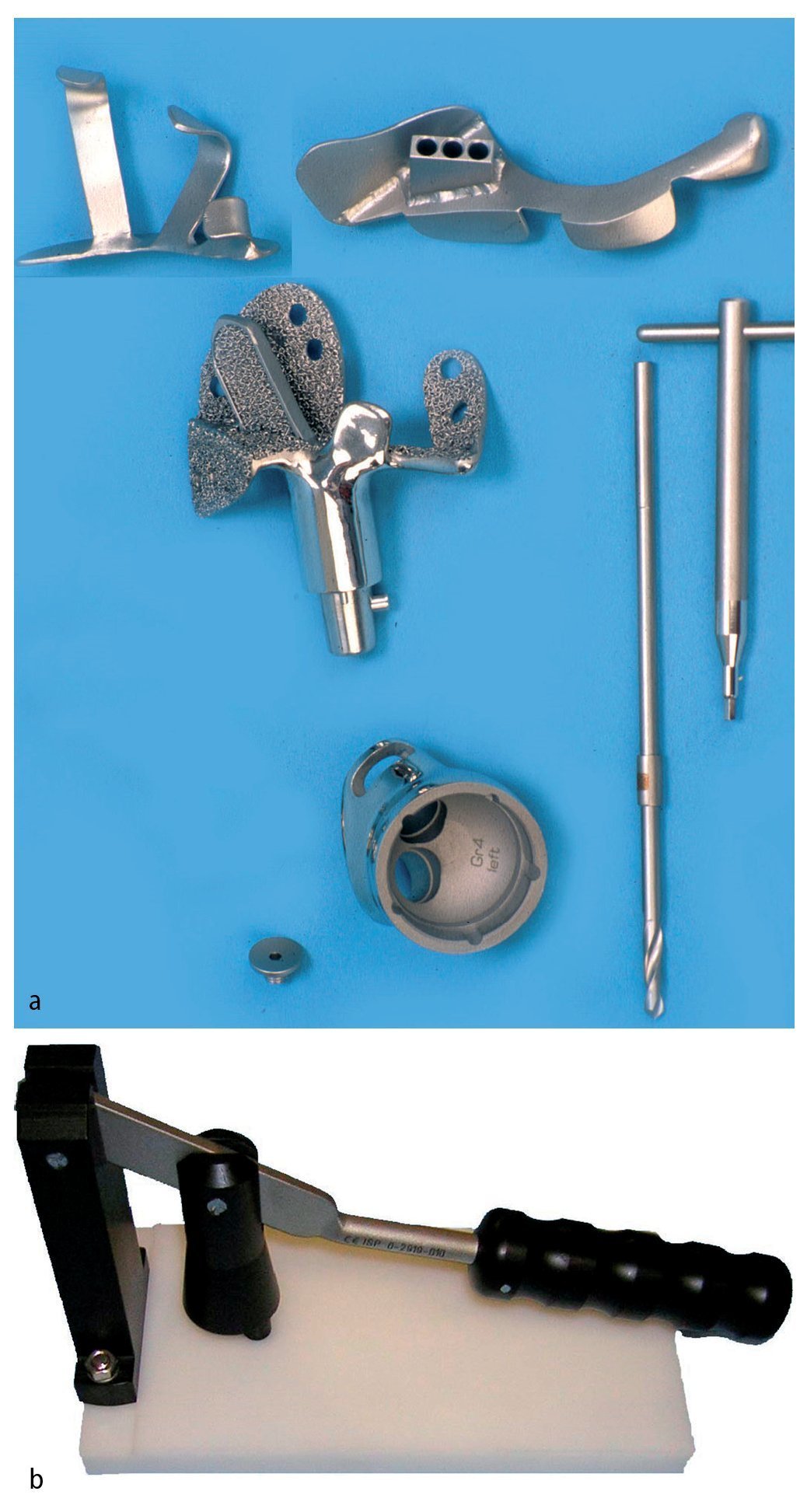
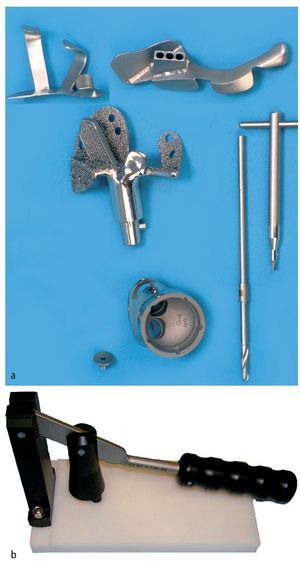
— Plantillas de resección fabricadas individualmente para cada caso para la conservación de los niveles de osteotomía y guías de perforación para el anclaje intramedular, así como fijación atornillada (por ejemplo, guía de perforación y de resección para el ilion de la marca Orthodynamics, Lübeck, por ejemplo; fig. 4a).
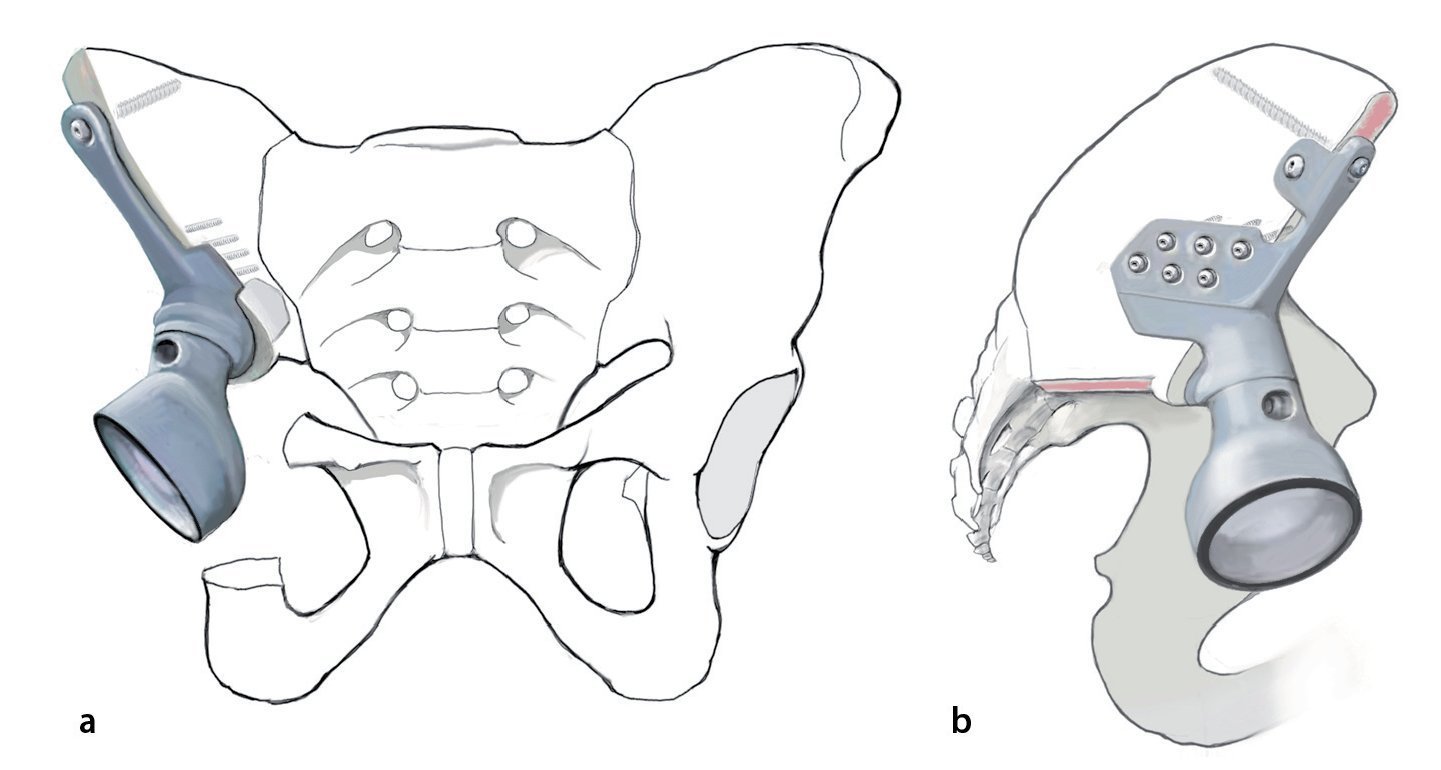
Fig. 4. Plantillas de resección, guías de perforación (arriba) y prótesis para el anclaje en el ilion con vástagos intramedulares y brida anatómica (centro). Cono de inserción para la unión entre la pieza de anclaje individual y el cótilo. Taladro con tope (derecha, a). La cabeza protésica posee un diámetro de 32 mm, mientras que el nivel de inserción del PE tiene solo un diámetro de 30,7 mm. Es importante introducir la cabeza en el inserto de polietileno «super constreñido» antes de inserirlo en el cótilo metálico. Para ello se dispone de un instrumento de impactación especial (marca Orthodynamics, Lübeck, b). Si se recorta el nivel de entrada del inserto, se aumenta la capacidad de retención de la cabeza. De este modo se limita el efecto de constreñimiento, que debe evitar la luxación de la cabeza con respecto al inserto.
— Impactor para la inserción de la cabeza en el inserto de polietileno (inserto «super constreñido»; fig. 4b).
— Vástagos femorales estándar, prótesis tumorales para la resección del fémur proximal (por ejemplo, vástago de cadera GHE o reemplazo de fémur modular sistema MML, marca Orthodynamics).
— Prótesis de pelvis hecha a medida con cótilo constreñido, así como posibilidad de anclaje preparado previamente para cada caso en el ilion o el sacro (por ejemplo, reemplazo parcial de pelvis, marca Orthodynamics).
Anestesia y posición del paciente
— El proceso anestésico se rige fundamentalmente según las recomendaciones de Molnar et al.35. Por regla general, se recomienda realizar una intubación. Esta se suele combinar generalmente con una anestesia epidural y muy raramente también con una anestesia espinal36.
— No se recomienda el empleo de un recuperador celular (cell-safer) por el peligro de una diseminación tumoral sistemática.
— En el postoperatorio es necesario proseguir con la terapia en una unidad de cuidados intensivos. Aquí se llevará a cabo la terapia respiratoria posterior y se compensará el equilibrio ácido-base en la sangre, de líquidos y de electrolitos.
— Paciente en posición lateral móvil (floppy lateral position37). Para la preparación anterior, el paciente se posicionará en primer lugar con la espalda sobre la mesa de operaciones. Se colocará un cojín debajo del lado afectado de la pelvis y se estabilizará por el ala pélvica contraria mediante un apoyo. Para la preparación posterolateral, se girará al paciente y, por consiguiente, la pelvis 45º hacia el lado. Para ello se colocará el brazo sobre un apoyabrazos en el lado contrario a la altura del tórax. Posicionando la cresta ilíaca del lado no afectado a la altura del punto de flexión de la mesa de operaciones es posible inclinar posteriormente la mesa en el punto de flexión para facilitar el abordaje entre la cresta ilíaca y el hueso sacro en el lado afectado.
— Lavado de la piel en posición lateral desde el pie de la pierna afectada hacia proximal hasta el proceso xifoides y ventral y dorsal hasta sobrepasar la línea media.
— La pierna del lado afectado se cubrirá con libre movilidad. Se debe garantizar un abordaje libre de la mitad pélvica afectada desde el hueso pubis del lado contrario hasta la región sacroilíaca del lado contrario.
— Hay que contemplar la posibilidad de realizar radiografías también en proyecciones oblicuas (radiografías de acetábulo y pelvis, inlet y outlet). Se evitará sobreponer piezas metálicas de la mesa de operaciones. Recomendamos el uso de una mesa de carbono. También suele resultar de gran ayuda en este caso una prolongación de la mesa de operaciones a fin de evitar colisionar con la columna o las patas de la mesa de operaciones.
Técnicas quirúrgicas
(Figs. 5-16)
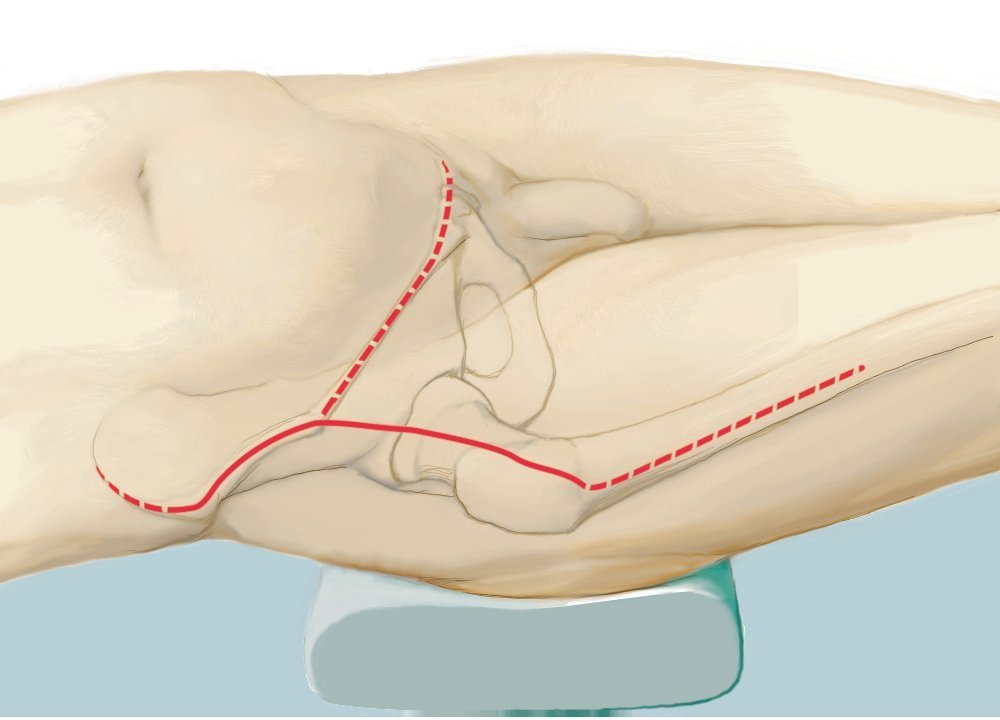
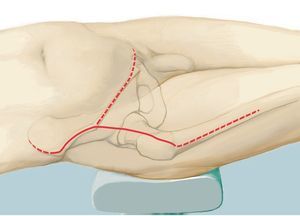
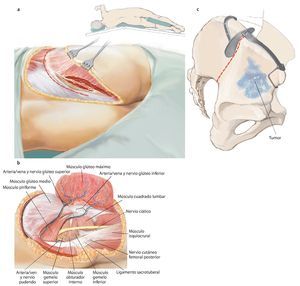
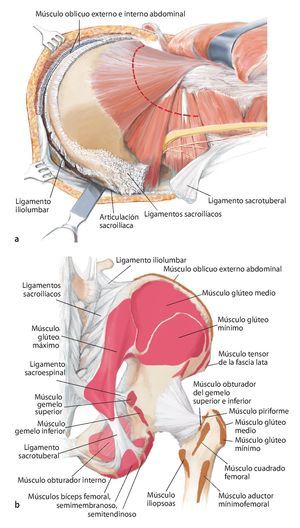
Fig. 5. Inicio de la intervención con el paciente en posición de decúbito supino. Incisión ventral según el utilitarian approach según Enneking5. Incisión cutánea desde el borde superior de la cresta ilíaca pasando por la espina ilíaca anterior superior hacia ventral en dirección del tubérculo púbico. Segunda incisión cutánea desde la espina ilíaca anterior superior hasta el trocánter mayor. Como alternativa, se puede adelantar la primera incisión hasta el centro del ligamento inguinal y ampliar en forma de arco sobre el muslo, a fin de evitar bordes de colgajos agudos y, consecuentemente, alteraciones en la cicatrización de la herida. El corte se puede prolongar a lo largo del fémur. Se trata de una combinación de incisiones como las descritas por Smith-Petersen38 y Judet39. La incisión se determinará fundamentalmente en función de la localización del tumor y por los niveles de resección y se establecerá de manera individual para cada paciente. Las incisiones se realizarán en la zona en la que se han efectuado las biopsias anteriores, de modo que la cicatriz de la biopsia se pueda rodear en forma de huso con suficiente distancia.
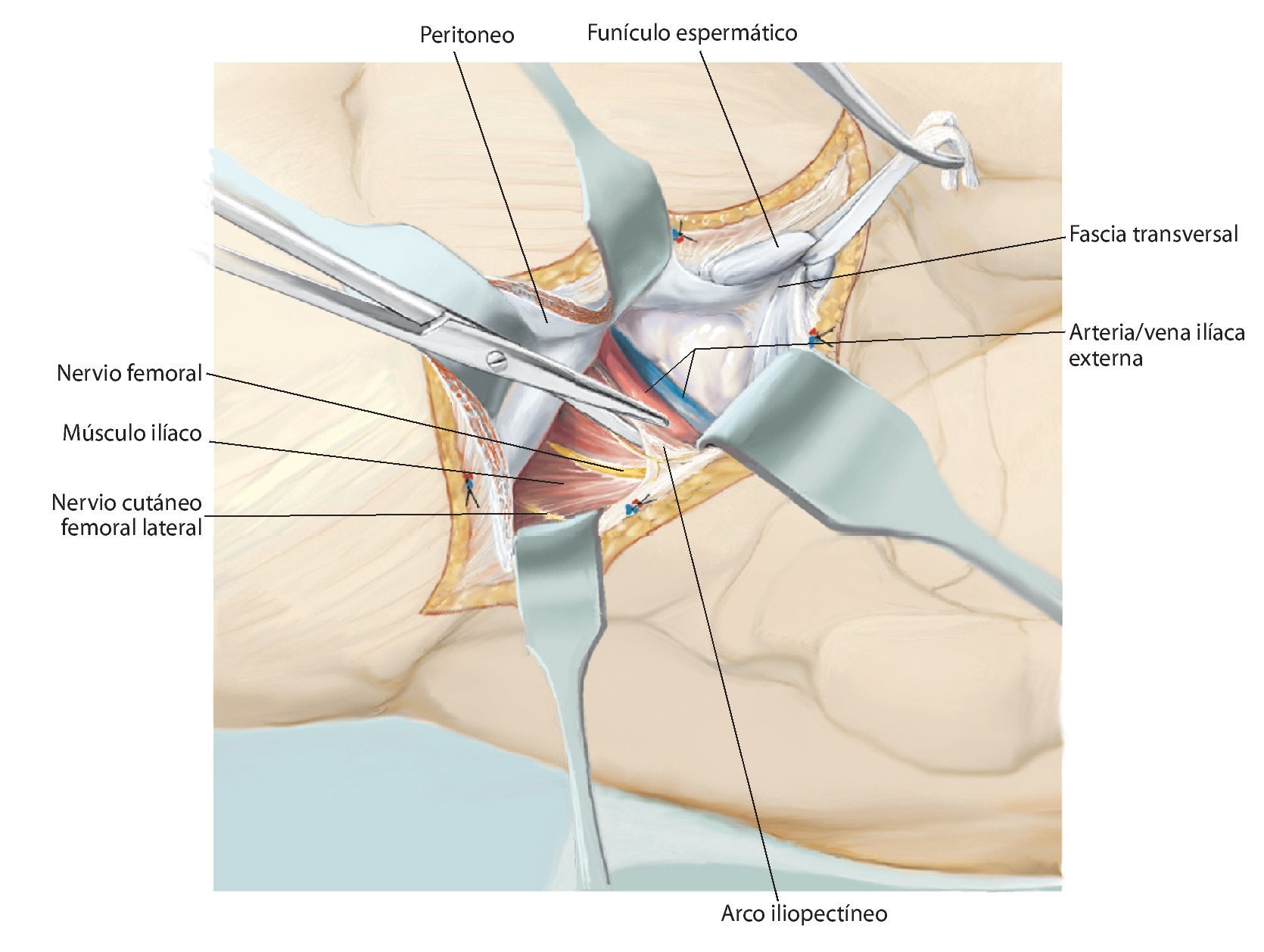
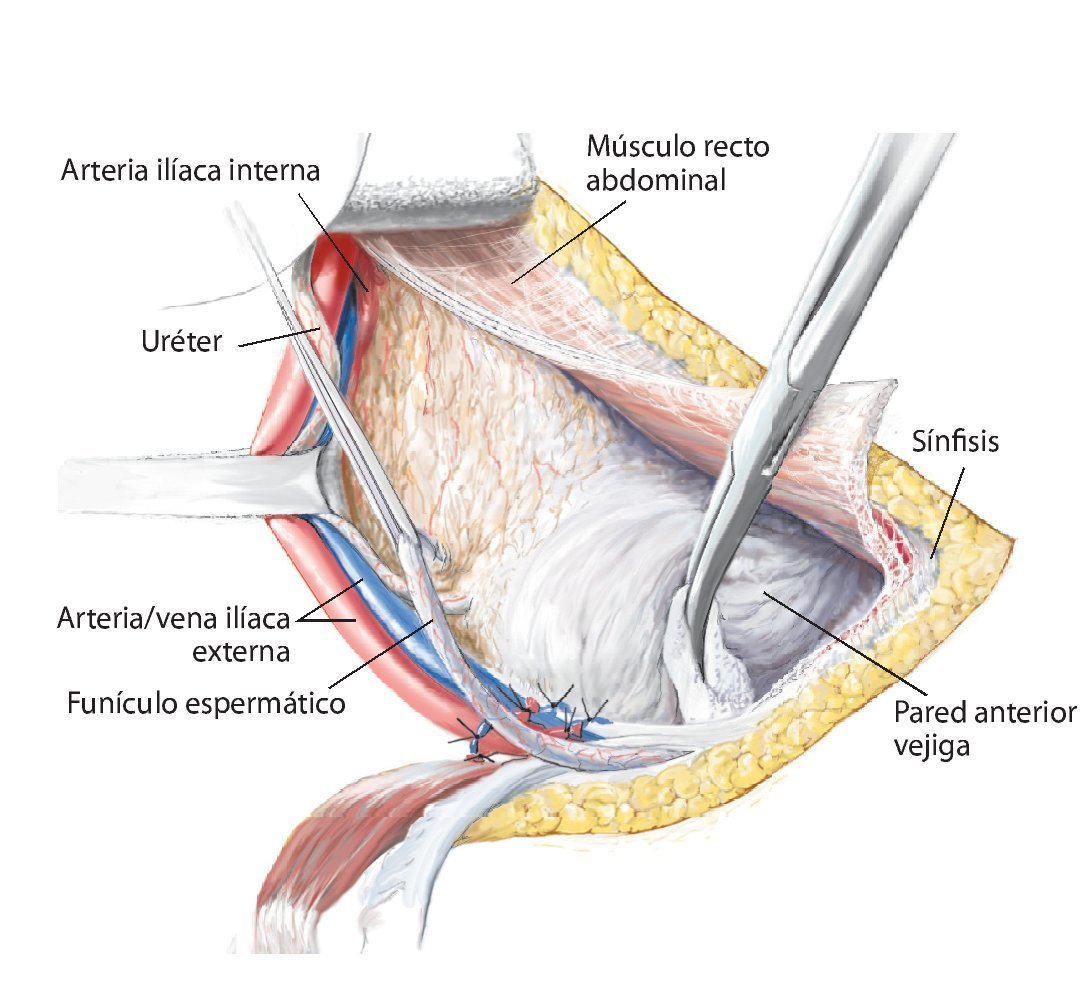
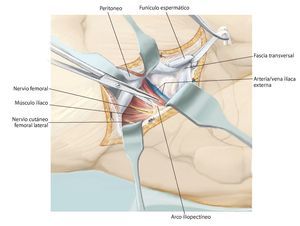
Fig. 6. Preparación del tejido subcutáneo y sección de la aponeurosis del músculo oblicuo externo abdominal desde la espina ilíaca anterior superior hasta la sínfisis. Abertura de la pared anterior del canal inguinal. A lo largo del ligamento inguinal se realizará la separación roma de la inserción de los tres músculos de la pared abdominal desde lateral. En el hombre, liberación del funículo espermático cortando la pared posterior del canal inguinal, la fascia transversal. En la mujer, se ligará el ligamento redondo del útero con un vessel-loop y se retraerá hacia medial. Preparación roma de los vasos ilíacos externos desde medial del arco iliopectineo y separación del mismo. El nervio femoral y el músculo iliopsoas se sujetarán hacia lateral. Junto al origen del ligamento inguinal transcurre el nervio cutáneo femoral lateral, que en la mayoría de los casos se deberá ligar. El ligamento se puede separar en la espina ilíaca con la inserción del músculo abdominal del hueso ilion y sujetar hacia craneal y medial. Hacia distal se separan los músculos sartorio, recto femoral y tensor de la fascia lata de la espina ilíaca anterior superior y de la cresta ilíaca anterior.
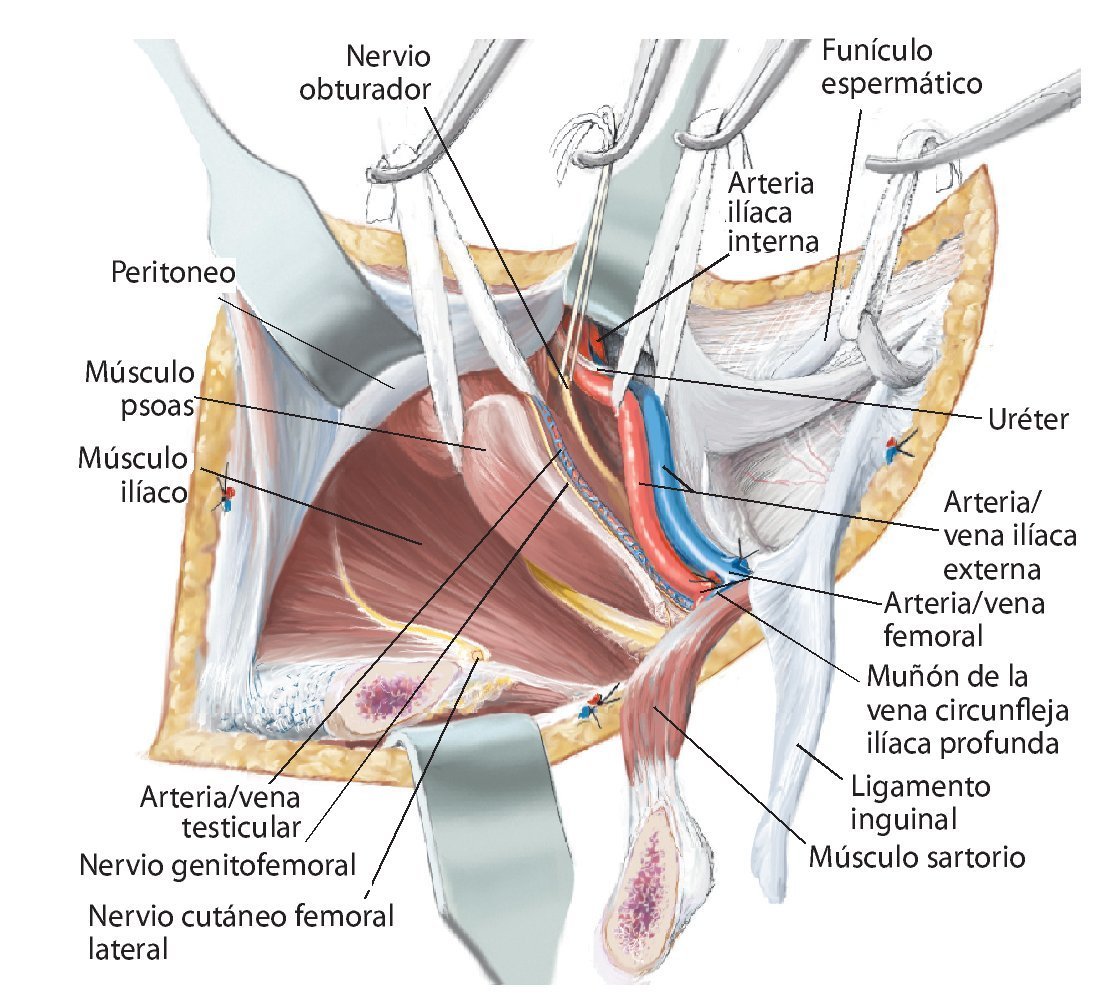
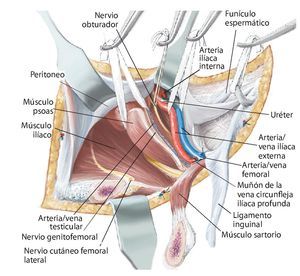
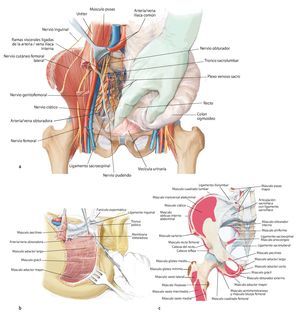
Fig. 7. En la zona caudal del ligamento inguinal se realizará la ligadura próxima a la salida de la arteria y vena circunfleja ilíaca superficial, la arteria epigástrica superficial y la arteria y vena pudenda externa lateral y medial de la arteria femoral común. Preparación de los vasos sanguíneos femorales hasta su desembocadura en la vena safena magna. Se realizará la preparación estrictamente roma de los vasos sanguíneos femorales en la zona de la estrella venosa para evitar una disección de los vasos linfáticos. Hay que intentar conservar la mayor cantidad de tejido perivascular posible para reducir el peligro de formación de un linfodema crónico. En la zona proximal del ligamento inguinal se realizará la ligadura de la arteria y vena circunfleja ilíaca profunda que transcurre hacia lateral y de la arteria y vena epigástrica inferior que transcurre medial del anillo inguinal profundo. El 10-30% de los pacientes presentan una anastomosis especialmente fuerte (corona mortis) entre la arteria epigástrica inferior y la arteria ilíaca externa y la arteria obturatriz (fig. 11). Esta anastomosis se deberá buscar y ligar por vía retropúbica para evitar hemorragias mayores. Preparación hasta la arteria y la vena ilíaca interna. Exploración del nervio femoral en la fosa entre el músculo psoas y el músculo ilíaco y ligarlos mediante un vessel loop. Si el psoas no está afectado por ningún tumor, se hará pasar por debajo del mismo el nervio femoral y los vasos femorales para protegerlos.
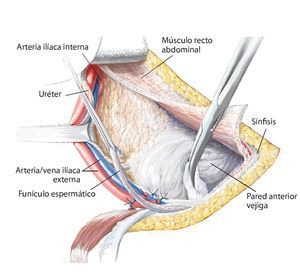
Fig. 8. Elevación roma del peritoneo y desplazamiento de la pared anterior de la vejiga urinaria de la sínfisis, según la extensión de la resección en la rama superior e inferior del hueso pubis. En caso de que la resección se haya realizado en la proximidad de la sínfisis, se deberá separar el músculo recto abdominal en la rama superior del hueso pubis.
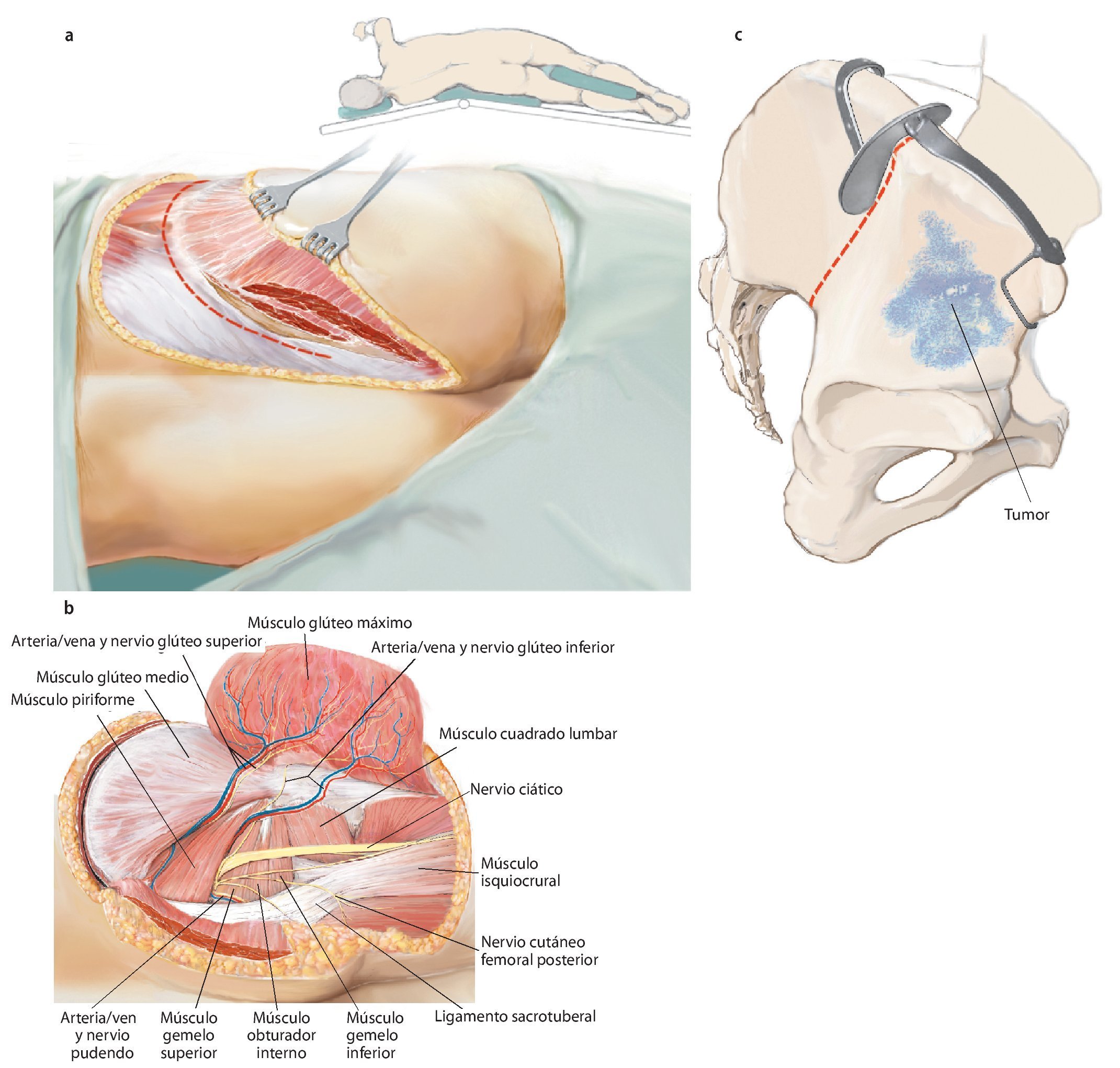
Fig. 9. A continuación, se gira al paciente y se inclina la pelvis unos 45º hacia lateral. El brazo se apoya en el lado contrario sobre un apoya-brazos. La incisión dorsolateral también sigue el abordaje utilitarian según Enneking. La cresta ilíaca se expone en toda su longitud (a). En el interior se separará el músculo oblicuo interno abdominal y el músculo transverso abdominal; en el exterior, el músculo oblicuo externo abdominal. Ahora la mesa de operaciones se puede inclinar ligeramente en el punto de flexión por debajo de la cresta ilíaca, para poder separar las inserciones del músculo latísimo del dorso, cuadrado lumbar, iliocostal lumbar y sacroespinal con más facilidad del ilion cercano al sacro y del hueso sacro. A continuación se formará un colgajo musculocutáneo grande formado por tejido subcutáneo y músculo glúteo máximo, que se preparará hacia distal hasta su inserción tendinosa en el trocánter mayor femoral. La incisión dorsal debería prolongarse hasta la altura de la espina ilíaca posterior inferior, a fin de permitir una preparación exacta del colgajo musculocutáneo dorsal. De este modo se facilita la exposición de las estructuras neurovasculares, que nacen del agujero suprapiriforme (nervio glúteo superior y arteria/vena glútea superior) e infrapiriforme (nervio ciático, nervio glúteo inferior, arteria/vena glútea inferior, nervio pudendo, arteria/vena pudenda interna). La arteria glútea superior y, cuando sea posible, la arteria glútea inferior se deberían conservar para garantizar el abastecimiento suficiente del colgajo musculocutáneo. El músculo glúteo medio y el mínimo suelen permanecer por regla general en el espécimen quirúrgico futuro. En el paso siguiente, tenotomía de los rotadores externos cortos y de los músculos glúteos pequeños en el trocánter mayor. Identificación y conservación del nervio ciático (b). Hacia medial se expone la superficie dorsal del hueso isquion y la inserción de los músculos bíceps femoral, semitendinoso y semimembranoso, y se corta el ligamento sacrotuberal. Transposición del ligamento sacroespinal en el hueso isquion. Extracción de la cápsula para la exposición de la articulación de la cadera, en caso de que no esté afectada. Osteotomía del cuello femoral para una posterior implantación de un injerto estándar. En caso de que la articulación de la cadera esté afectada por el tumor, se debe extraer in toto con el músculo glúteo pequeño y la osteotomía femoral debe efectuarse distal de la línea intertrocántea, a fin de permitir la implantación de un reemplazo de fémur proximal. (c) Si se conserva una parte del ilion, entonces con la plantilla fabricada previamente se establecerá el nivel de la osteotomía en el hueso ilion. Esta se puede realizar oblicua, recta o incluso escalonada en función de la extensión tumoral. Es importante inserir un separador romo en el agujero ciático mayor para proteger las estructuras neurovasculares.
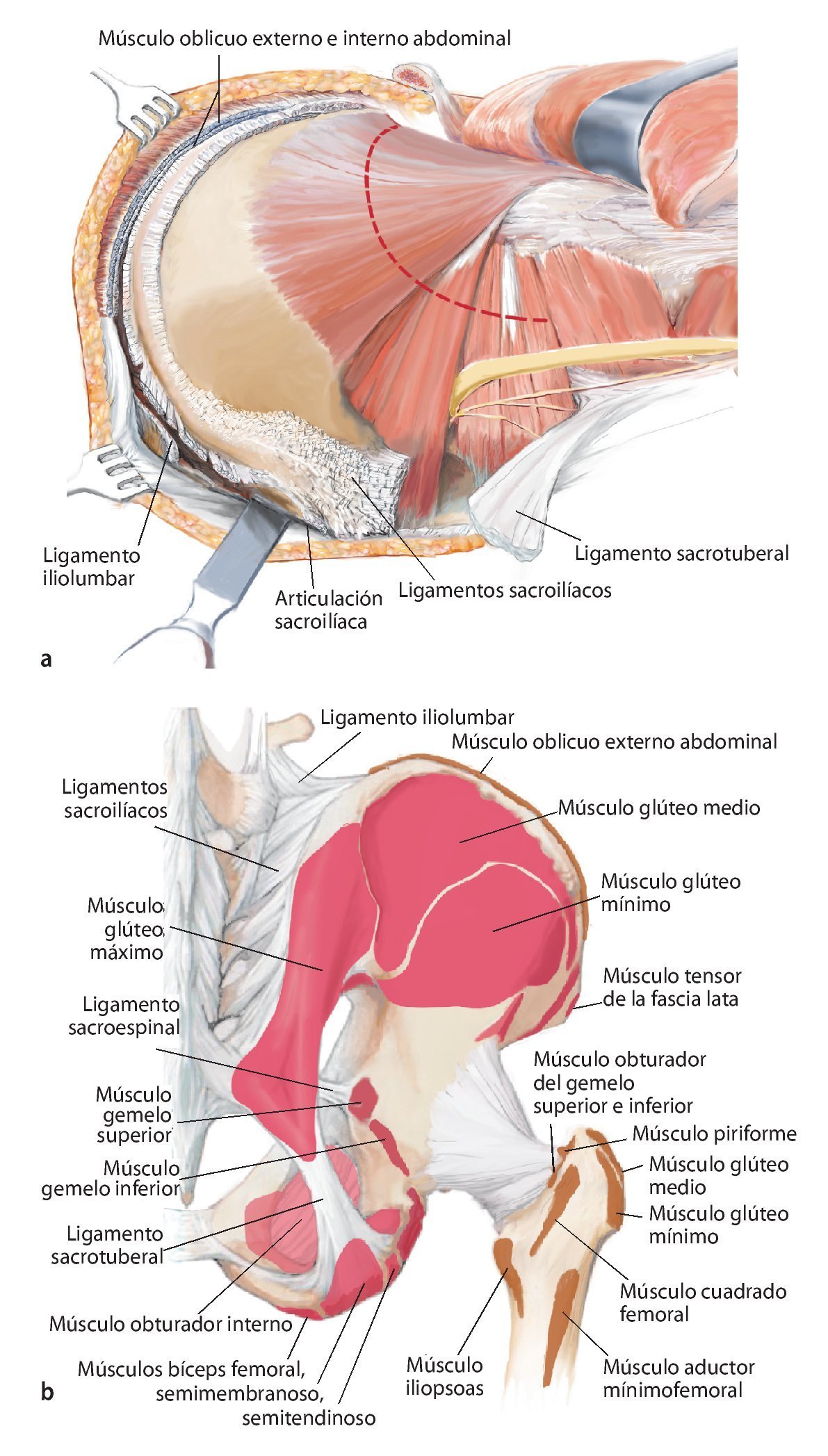
Fig. 10. En caso de una resección del tipo P-Ib según Dunham se separarán en la zona próxima del sacro las partes dorsales del ligamento sacroilíaco interóseo y posterior, así como el ligamento iliolumbar. Se reseccionará la cápsula articular de la articulación iliosacra y se elevará la articulación con un cincel (a). A continuación quedan al descubierto las partes ventrales de los ligamentos de refuerzo. También en este punto es útil inclinar la mesa en el punto de flexión. El conocimiento exacto del origen y de la inserción de los ligamentos y de los músculos es decisivo para el éxito de la intervención. La musculatura en la pelvis y en el fémur proximal debería separarse lo más próxima posible al origen y a la inserción en la zona de transición tendinosa (b), a fin de evitar una hemorragia innecesaria. Este procedimiento facilita, además, la refijación posterior.
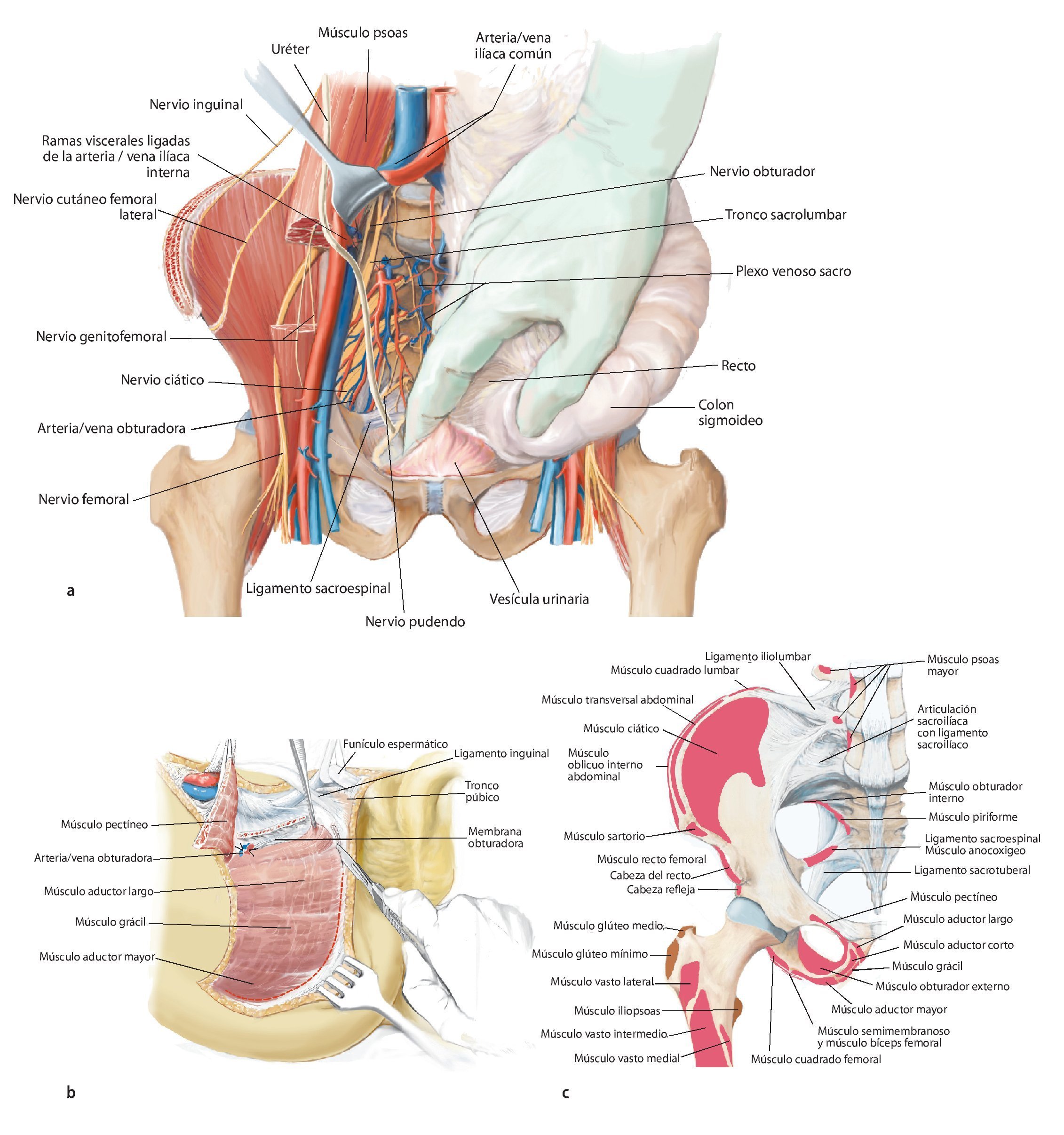
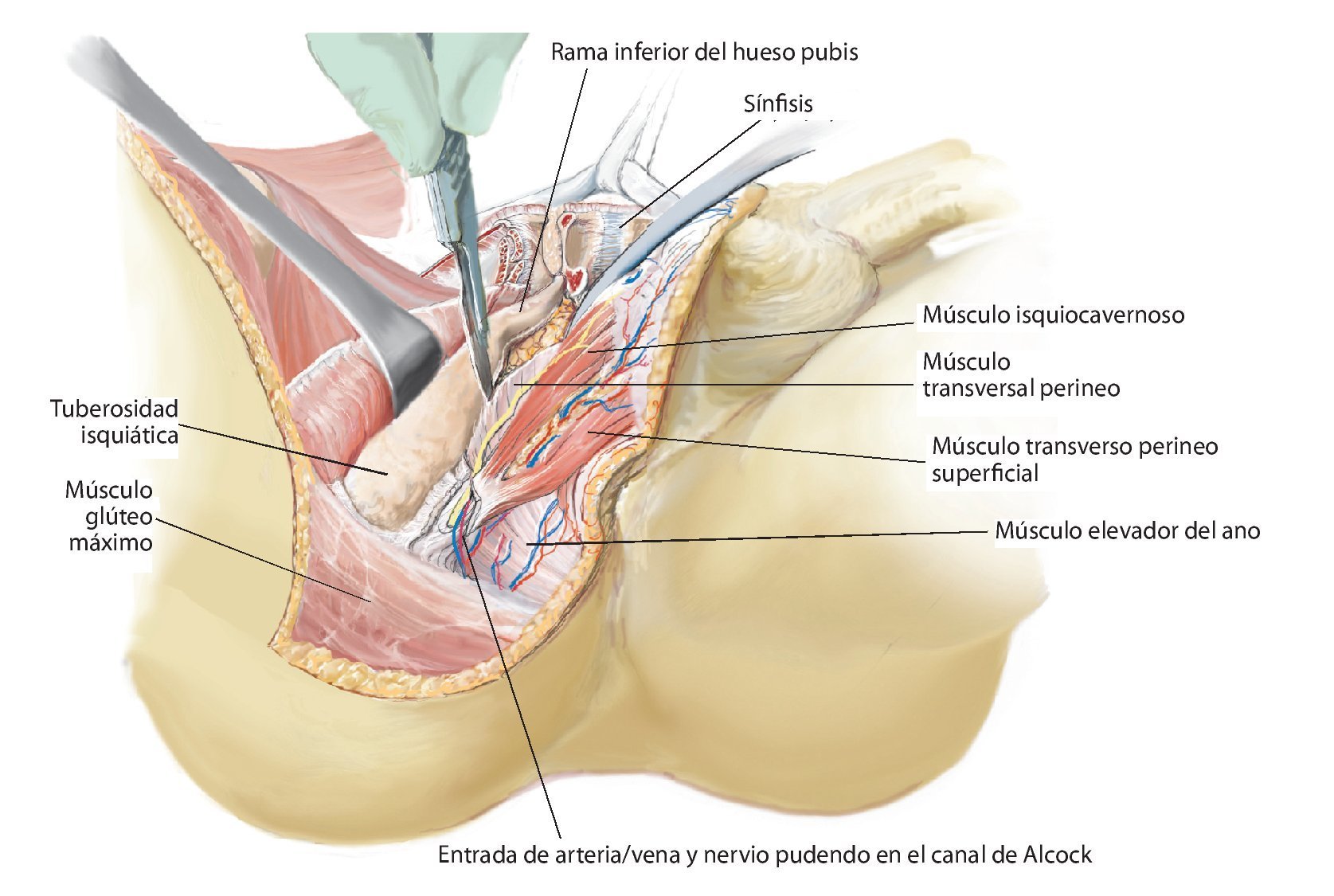
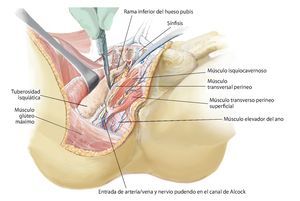
Fig. 11. Se vuelve a girar al paciente en posición supina. Ahora se exponen las estructuras intrapélvicas posteriores (a). Para una mejor exposición de la articulación iliosacra, se puede cortar el músculo psoas, para luego poder movilizarlo conjuntamente con los vasos ilíacos externos y el nervio femoral hacia lateral. El músculo ilíaco permanece en lo que posteriormente será el espécimen quirúrgico, a fin de evitar la diseminación del tumor. Mediante la inserción postoperatoria de un catéter ureteral se puede identificar con facilidad el uréter durante el próximo paso quirúrgico y sujetar hacia lateral. Después de movilizar el músculo psoas se puede buscar y ligar el nervio obturador y la fosa obturadora en la línea arcuata en caso de ser necesario para una resección P III. A continuación se realiza la preparación de las ramas de la arteria y vena ilíaca interna. Las ramas, que transcurren en dirección del agujero ilíaco mayor y menor (arteria glútea superior e inferior), se exponen por separado y deberían conservarse para asegurar un suficiente flujo sanguíneo del colgajo musculocutáneo glúteo. Las ramas viscerales, así como la arteria iliolumbar y la arteria obturadora, pueden ligarse en la proximidad de la salida. Ahora se tienen que exponer las raíces nerviosas del plexo lumbosacro. Para ello, las pequeñas ramas venosas del plexo lumbosacro se deberán ligar o sellar, a fin de evitar una hemorragia. A continuación, se cortarán los ligamentos de refuerzo ventrales de la articulación sacroilíaca. En caso de efectuarse una resección P IV, se debería introducir antes de la osteotomía unos alambres Kirschner desde ventral hacia dorsal inmediatamente lateral del agujero sacro para asegurar que el nivel de resección sea el correcto y no poner en peligro las raíces nerviosas sacras. Para una resección de tipo P III se aducirá y rotará hacia fuera la pierna en el siguiente paso quirúrgico (b). Los orígenes de los músculos grácil, aductor largo, pectíneo, aductor corto y mayor se cortarán en función de la extensión de la resección. El músculo obturador externo permanece en lo que será posteriormente el espécimen quirúrgico posterior. Ahora se lleva a cabo la separación de las fibras remanentes del grupo muscular isquiocrural en la tuberosidad isquiática. En caso de que un resto de la rama superior o inferior del hueso pubis permanezca, se deberán conservar los grupos musculares que allí se originan. También desde ventral es importante que la sección de los ligamentos y músculos se efectúe próxima al hueso (c).
Fig. 12. En caso de conservación de partes del hueso pubis y del isquion se suprimen los pasos quirúrgicos descritos a continuación. Los niveles de osteotomía se establecerán entonces en función de la expansión tumoral. Sin embargo, en caso de realizarse una resección P III se procederá del modo siguiente: la sección de la sínfisis con un cincel requiere la protección de la vejiga y la uretra con un gancho romo o insiriendo un dedo en el agujero ciático mayor. Durante la sección del ligamento transverso perineal se protegerán la arteria/vena dorsal del pene, el nervio dorsal del pene y la uretra mediante el empleo de un gancho romo en el extremo distal de la sínfisis. En el paso siguiente se desprenderá el diafragma pélvico y urogenital con un método romo. Para ello, se separarán el músculo transverso perineo, el músculo isquiocavernoso, el músculo coxígeo y partes del músculo elevador del ano de la rama inferior del hueso pubis y del isquion. Durante este procedimiento se deberá prestar especial atención al nervio pudendo, que, después de su entrada en el canal de Alcock entre los músculos transverso perineo profundo, elevador del ano y obturador interno, transcurre junto al hueso isquion. A continuación se puede extraer el espécimen quirúrgico por debajo del paquete vasculonervioso y del músculo psoas (en caso de haberse conservado) hacia lateral. El tumor se deberá extraer según la técnica «no touch» in toto con las estructuras de partes blandas adyacentes. De ser posible, se intentará realizar una resección R0, en la que los músculos glúteo mínimo y medio, e ilíaco, así como los orígenes de los aductores profundos y los rotadores externos pequeños, deberán permanecer en el espécimen quirúrgico. Según el grado de afectación de las partes blandas por el tumor, se deberá extender la resección muscular. El músculo isquiocrural se suturará con el suelo pélvico.
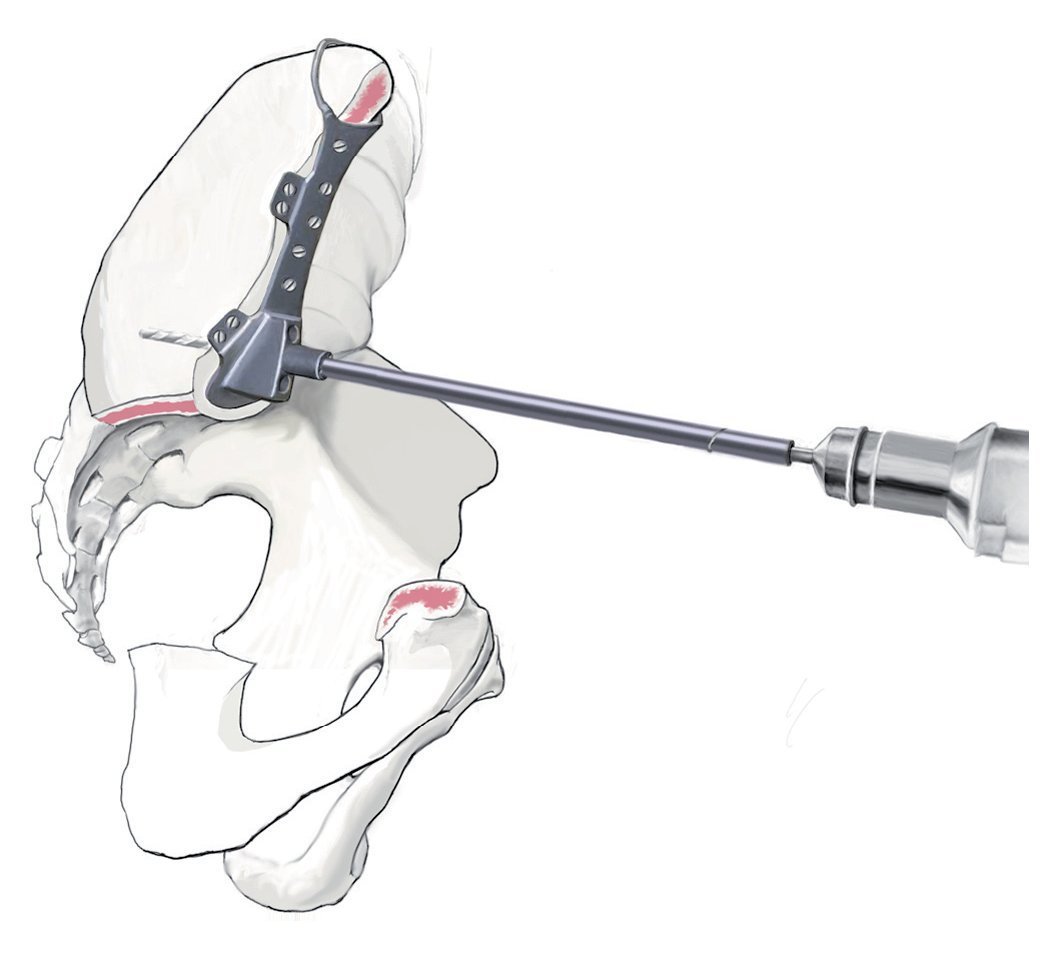
Fig. 13. Después de realizar con cuidado la hemostasia se fijará a continuación la guía de perforación en el hueso remanente. Esta se ajustará al borde de corte. Es por ello por lo que resulta importante realizar la resección con la plantilla preparada. La fijación de la prótesis se suele llevar a cabo con una brida para su apoyo exterior y con un vástago intramedular alineado en el hueso ilion en función de la dirección principal de la transmisión de fuerzas. Para poder introducir el vástago en el hueso ilion se realizará un orificio en el ilion con un taladro de 8 hasta 10 mm. La guía de perforación indica la dirección de la perforación. La profundidad está limitada por el tope del taladro.
Fig. 14.a, b) A continuación, se introduce la prótesis con el vástago intramedular. Los agujeros en la brida y en el cuerpo protésico se ocuparán con tornillos. En caso de que después de realizada la hemipelvectomía se requiera un anclaje en el hueso sacro, este se asegurará también con ayuda de un vástago intramedular. A pesar del empleo de la guía de perforación preparada previamente, el orificio se debería realizar bajo control por imágenes (a.-p., radiografías inlet y outlet, hueso sacro lateral) fin de evitar a toda costa la perforación del primer neuroforamen o del canal sacro. El punto de entrada del orificio se observa en una toma lateral exacta en la radiografía del hueso sacro a la altura del centro de S1 y en proyección a.-p. a pocos milímetros dorsal del canto posterior de S1. De este modo, el punto de entrada se proyecta en proyección lateral exactamente lateral del canal sacro. La profundidad la limita el tope del taladro. Para asegurar que la perforación y la inserción del tornillo se realizan dentro de la masa lateral del hueso sacro, también se puede realizar una palpación digital de los forámenes sacros. El cono de inserción entre acetábulo y cuerpo protésico se asegura con un tornillo. Tras la implantación de la prótesis y ocupación de los agujeros con tornillos se introducirá un inserto «super constreñido». A continuación, se procede a la implantación del vástago femoral y a la conexión del cuerpo con el vástago protésico. Los músculos remanentes del cinturón pélvico y del muslo se suturan entre sí. En caso de existir remanentes musculares y fasciales en el fémur, estos se podrán utilizar para la refijación. Si se originan grandes huecos musculares, entonces es posible puentear los defectos con cinta Trevira® (marca Telos, Marburg, Alemania) o con malla de reconstrucción de teleftalato de polietileno (PET) (marca Implantcast, Buxtehude, Alemania). Sin embargo, se deberá tener en cuenta que, en cualquier caso, se trata de un cuerpo extraño adicional de gran superficie, que puede favorecer una colonización bacteriana. En caso de afectación del músculo glúteo máximo y cubrimiento insuficiente de partes blandas del implante, pueden ser necesarios colgajos musculares regionales o también, por ejemplo, una cirugía con colgajo libre de músculo latísimo del dorso. Sin embargo, este tipo de intervenciones se deberían planificar durante la fase preoperatoria y las debería llevar a cabo un cirujano con experiencia en microcirugía40.
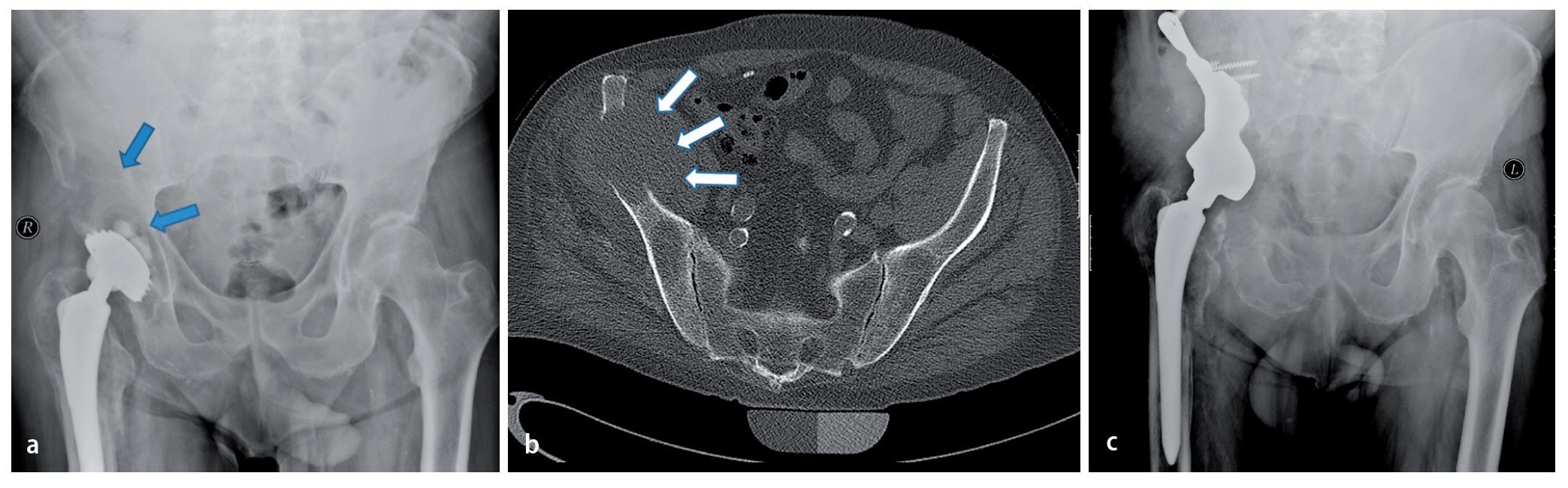
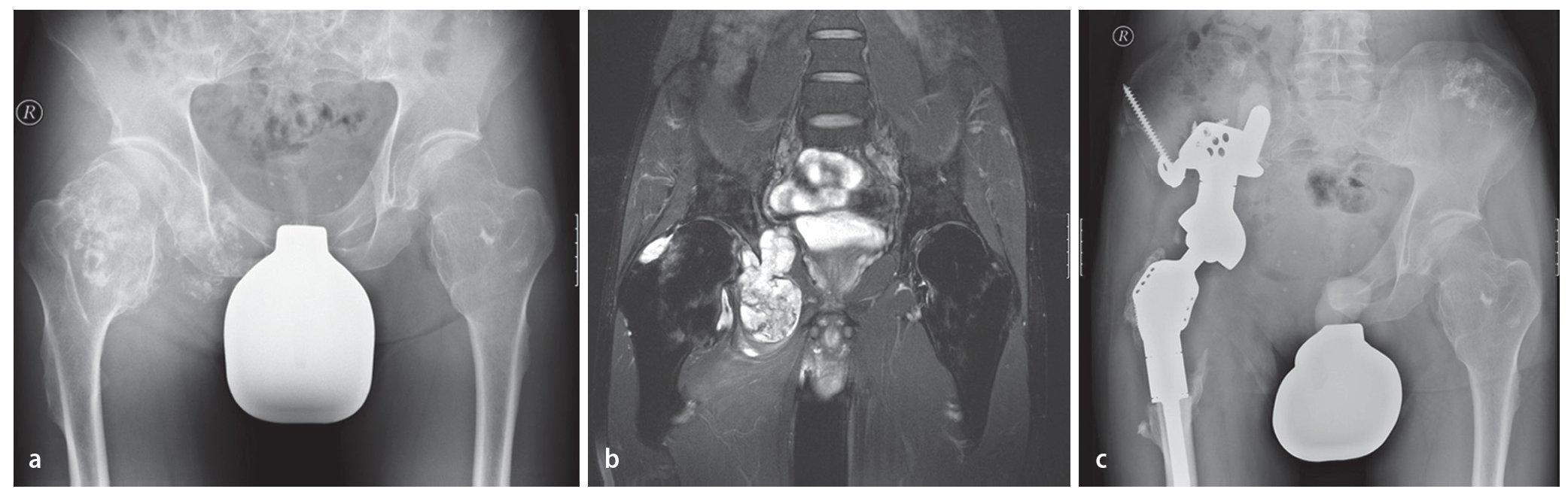
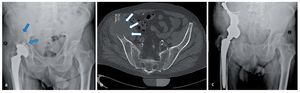
Fig. 15. Un paciente de 61 años con dolores dependientes de la carga dos años después de la implantación de una prótesis total de articulación de cadera (vástago bicontacto, acetábulo SC con anillo atornillado). La radiografía de pelvis muestra una osteólisis extensa (flechas) con afectación del ala del hueso ilion derecho hasta la zona periacetabular. Además del diagnóstico, se observó un estado según el tipo de fractura Vancouver B1 (a). Confirmación del diagnóstico mediante biopsia con agujas con ayuda de una tomografía computarizada (b). En caso de metástasis histológicamente probada de un carcinoma de esófago anteriormente reseccionado, por motivos curativos se indicará la resección e implantación de una prótesis parcial de pelvis. Seis meses después de la implantación se iniciará la integración ósea de la estructura superficial macroporosa sin señales de aflojamiento con un resultado funcional bueno (escala MSTS 18, porcentaje MSTS 60%, c).
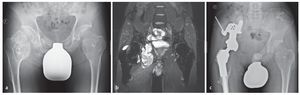
Fig. 16. Un paciente de 44 años con condrosarcoma secundario a exostosis cartilaginosa. El paciente está sometido a grandes cargas por motivos laborales (a). La RM preoperatoria muestra la afectación tumoral de la articulación de la cadera y la expansión intrapélvica del tumor (b). El análisis clínico y radiológico mostró un buen asiento del material del implante sin señales de aflojamiento con un buen resultado funcional (escala MSTS 21, porcentaje MSTS 70%, c).
Ejemplos de casos clínicos
Tratamiento postoperatorio
— Aplicación de un vendaje estéril y vendaje de ambas piernas y de la pelvis. La pierna operada se inmovilizará en una férula de gomaespuma con la articulación flexionada. Se posicionará al paciente sin presionar el nervio ciático, puesto que en función de la extensión de la resección este podría dañarse.
— Seguimiento médico intensivo hasta la estabilización de los parámetros vitales y reducción del tiempo de uso del respirador. Substitución de componentes sanguíneos y optimización de los parámetros de coagulación.
— Una vez finalizada la sedación y tras la extubación del paciente, se verificará la función del nervio ciático y del femoral.
— En primer lugar, profilaxis trombótica con heparina no fraccionada bajo control regular de los parámetros de coagulación (objetivo PPT entre 40 y 50 s, en caso de intervención adicional de vasos sanguíneos, entre 60 s y 70 s). Tras la fase de estabilización, cambio a heparina fraccionada en dosis adaptada al peso del paciente hasta alcanzar la carga total. En pacientes de alto riesgo, en primer lugar se realizará, además de una profilaxis trombótica medicamentosa, una terapia de compresión neumática intermitente de las pantorrillas (por ejemplo, Kendall SCD 700, marca Covidien41). Realización de ecografía doppler rutinaria del sistema venoso proximal y distal para excluir la posibilidad de una trombosis de venas profunda postoperatoria.
— Los drenajes situados superficialmente se suelen extraer por regla general después de 2-3 días con un caudal de 50 ml/24 h. Los drenajes colocados a más profundidad se deberían dejar durante 2-3 días más.
— Higiene cuidadosa postoperatoria de la zona anogenital para evitar la contaminación de la herida. Utilización de un catéter intestinal en pacientes de cuidados intensivos y alimentación mediante sonda, puesto que cabe esperar excrementos líquidos.
— Determinación individual de la capacidad de carga y del grado de movimiento en función de la extensión de la resección ósea y de los grupos musculares separados. En principio, no se requiere inmovilización en cama durante los primeros días postoperatorios. Los ejercicios de movilización se realizarán en primer lugar bajo analgesia controlada por el paciente. Se evitará realizar ejercicios abdominales forzados. Durante las primeras doce semanas el paciente debe usar una ortesis para la estabilización de la articulación de la cadera (por ejemplo, SofTec Coxa®, marca Bauerfeind, Alemania). Mediante una articulación especial monocéntrica se limita el rango de movilidad y, por tanto, se actúa contra una tendencia a la luxación. Durante las primeras seis semanas, el rango de movilidad para la extensión/ flexión tiene que limitarse a 0º-20º-60º, sin movimientos rotacionales, y más adelante, liberación a 0º-0º-90º. El paciente se levantará lo más pronto posible de la cama bajo indicaciones fisioterapéuticas con carga inicial sobre puntillas de la extremidad operada (10 kg de carga parcial aproximadamente) durante 6-12 semanas. A continuación, se aumentará parcialmente la carga en 10 kg por semana aproximadamente. Se introducirá un tratamiento terapéutico posterior según el aumento de la carga. Se llevará a cabo un tratamiento ergo-terapéutico y se informará sobre el uso de ayudas para la marcha (muletas, asiento elevador para inodoro, cojín cuña). Los primeros controles radiográficos mediante visualización de la pelvis en posición profunda se deberían realizar en el postoperatorio inmediato. Asimismo, se deben llevar a cabo controles adicionales después de la primera movilización y durante el aumento de la carga.
— Tratamiento posterior oncológico adaptado a las recomendaciones del Centro de Tumores de Múnich para sarcomas óseos y de partes blandas42. Al paciente se le debe entregar una planificación en el momento del alta con las fechas de control posteriores.
— Introducción de medidas de rehabilitación psicosocial.
Errores, riesgos y complicaciones
— Pérdida de sangre intra y postoperatoria: la pérdida de sangre intraoperatoria se reducirá al máximo. Con tal fin, los músculos se separarán del hueso en la zona próxima a la inserción de la zona de unión tendinosa. El empleo de cera ósea favorece la hemostasia en las superficies de resección óseas. Desde hace un tiempo en nuestra clínica efectuamos la aplicación tópica de ácido tranexámico (1,5 g en 100 ml NaCl) después de una prótesis ya implantada. Esta solución se lavará y succionará tras un breve tiempo de acción. De este modo se puede reducir la pérdida de sangre postoperatoria43.
— Hemorragia de las ramas de la arteria ilíaca interna: en el caso de grandes masas tumorales en la pelvis menor después de realizar una preparación presacra, pueden producirse hemorragias ocultas procedentes sobre todo de las ramas de la arteria ilíaca interna (arteria iliolumbar, sacra lateral, glútea superior e inferior); en el caso de producirse una hemorragia postoperatoria, se realizará una angiografía digital de sustracción con embolización mediante espirales.
— Lesión del uréter: el uréter cruza por la derecha la arteria ilíaca externa, y por la izquierda, la arteria ilíaca común. En su recorrido posterior pasa por la pelvis menor por debajo de los vasos testiculares en el hombre y de la arteria uterina y ovaria en la mujer. En caso de que el uréter esté rodeado por masas tumorales o que el tumor se encuentre situado en la inmediata vecindad del mismo, resulta imprescindible la colocación preoperatoria de un catéter ureteral a fin de evitar una lesión mediante reconocimiento digital de las estructuras: en caso de que las lesiones del uréter sean pequeñas, es posible realizar una primera sutura. Los defectos mayores se deberán puentear mediante una uretero-cisto-neostomía o una cirugía con técnica Psoas-Hitch. Es importante la conservación completa del tejido adiposo y conectivo periuretal vascularizado.
— Lesiones del nervio femoral o ciático: este tipo de lesiones pueden producirse por la presión intraoperatoria del gancho, durante la preparación presacra del tumor o durante la extracción mediante giro de la mitad pélvica. La extremidad se posiciona con la articulación flexionada (cama articulada) para relajar las estructuras de partes blandas. Por regla general, estas paresias son solo transitorias: en estos casos no se requiere ninguna terapia específica. En caso de que persista más allá de los primeros días, rogamos al paciente que consulte a un neurólogo para descartar y documentar una lesión intraoperatoria del nervio. Si existe sospecha de que el nervio está lesionado, se realizará una revisión y una exploración temprana con el fin de suturar el nervio44.
— Inestabilidad postoperatoria de la prótesis: el paso más importante para una implantación exacta es la determinación exacta de los niveles de resección establecidos en la fase preoperatoria. Para ello, resulta útil realizar una orientación intraoperatoria mediante puntos de referencia anatómicos como la espina ilíaca anterior superior. Cualquier error que se cometa durante este paso de la intervención provocará incongruencia entre la prótesis y la superficie de resección. Ello se puede evitar mediante el empleo de las plantillas de resección preparadas y de guías de perforación: si a pesar de todo aparece una inestabilidad postoperatoria con luxación del reemplazo parcial de cadera, será necesario retirar la prótesis. En el caso de que ya no sea posible una reimplantación de la prótesis, siempre pueden usarse procedimientos que no cubren el defecto pélvico: pseudoartrosis rígida «super girdlestone» o artrodesis de las superficies de resección.
— Luxación de cadera postoperatoria: según el mecanismo de producción de la luxación se girará el inserto o el acetábulo para soltar la unión, de modo que el promontorio se detenga en dirección de la luxación. Se llevará a cabo la implantación primaria de un inserto constreñido y se utilizará una ortesis de cadera hasta que la musculatura sea lo suficientemente fuerte. Hay que indicar muy claramente al paciente los movimientos que no debe realizar (por ejemplo, sentarse en una posición muy baja para atarse los zapatos). Mediante el empleo de una malla de reconstrucción (por ejemplo, tubo Trevira®) de polietileno se puede reducir adicionalmente la tendencia a la luxación. Este tubo se fija en el hueso en las superficies óseas a nivel de los límites proximal y distal mediante hilos no reabsorbibles. Con el cubrimiento de toda la prótesis se puede refijar el tejido de partes blandas en la malla de reconstrucción a fin de obtener una estabilización adicional.
— Infección: en caso de infección profunda resulta inevitable retirar el reemplazo parcial de cadera y administrar una terapia antibiótica sistemática adaptada al análisis. En caso de que quede un surco de cicatriz grande, entonces se puede aplicar la cirugía de músculos con injertos locales. En casos muy raros es necesaria una segunda hemipelvectomía externa.
Resultados
Los datos del presente estudio retrospectivo proceden de un banco de datos internos de una clínica sobre sarcomas óseos y de partes blandas. Los pacientes todavía vivos se han sometido a un seguimiento regular que se lleva a cabo in domo o en un centro de ortopedia tumoral.
Entre abril de 1994 y noviembre de 2008 38 pacientes consecutivos fueron sometidos a una hemipelvectomía parcial o completa y a un reemplazo endoprotésico con una megaprótesis hecha a medida. Los 38 pacientes estaban afectados por un tumor en el acetábulo y/o en la articulación de la cadera. La edad media de las 16 mujeres y los 22 hombres en el momento de la intervención era de 54,3 años (26- 77 años). Quince pacientes habían enfermado por un sarcoma óseo maligno primario (estadios de la UICC: un estadio IB, dos estadios IIA, nueve estadios IIB, tres estadios III). Con nueve casos, el condrosarcoma fue el tumor óseo maligno primario más frecuente, seguido del sarcoma de Ewing, con cuatro casos. Los otros tumores óseos fueron un hemangiopericitoma y un osteosarcoma telangiectásico. Cinco pacientes sufrieron un sarcoma de partes blandas maligno primario (estadios de la UICC: un estadio IIA, un estadio IIB, tres estadios III). Hubo dos casos de sarcomas no especificados «non otherwise specified sarcomas» (NOS, antes denominados HFM pleomórficos), dos tumores de vaina nerviosa (MPNST) y un liposarcoma. Dieciocho pacientes sufrieron metástasis óseas de tumores primarios extraóseos. Con mayor frecuencia aparecieron carcinomas de células renales (n = 10), de tiroides (n = 2) y de mama (n = 2). Otras entidades fueron un carcinoma del tracto aerodigestivo superior, un carcinoma de recto, uno de próstata y un carcinoma de esófago. En ocho pacientes con metástasis óseas se trató en el momento del diagnóstico de metástasis sólidas. Todos los pacientes fueron acogidos en un programa de tratamiento interdisciplinario. Desde el momento de la biopsia del tumor hasta los controles posteriores se realizó semanalmente una reunión con cada paciente en el marco de una conferencia sobre tumores de periodicidad semanal. En los casos en que se decidió realizar una resección parcial de pelvis transcurrieron de promedio tres semanas hasta la intervención. Este período de tiempo es debido a la mayor complejidad logística que supone fabricar la prótesis y las plantillas de resección individuales. Desde hace más de treinta años compramos estas prótesis especiales a la empresa Orthodynamics (antes ESKA-implants). En este tipo de prótesis la fijación se suele realizar, por regla general, a través de un transmisor de fuerza intramedular y una brida sujeta en la parte externa del hueso. El vástago del ilion se introduce en el sentido principal de la transmisión de fuerzas fisiológicas14,15,26,27,45. El instrumento estándar, objetivo para eliminar la limitación funcional del paciente, sirvió a la escala MSTS («Musculosceletal tumor Society») según Enneking46. La evaluación de los datos estadísticos se realizó en base al programa SigmaStat 3,5® (systat).
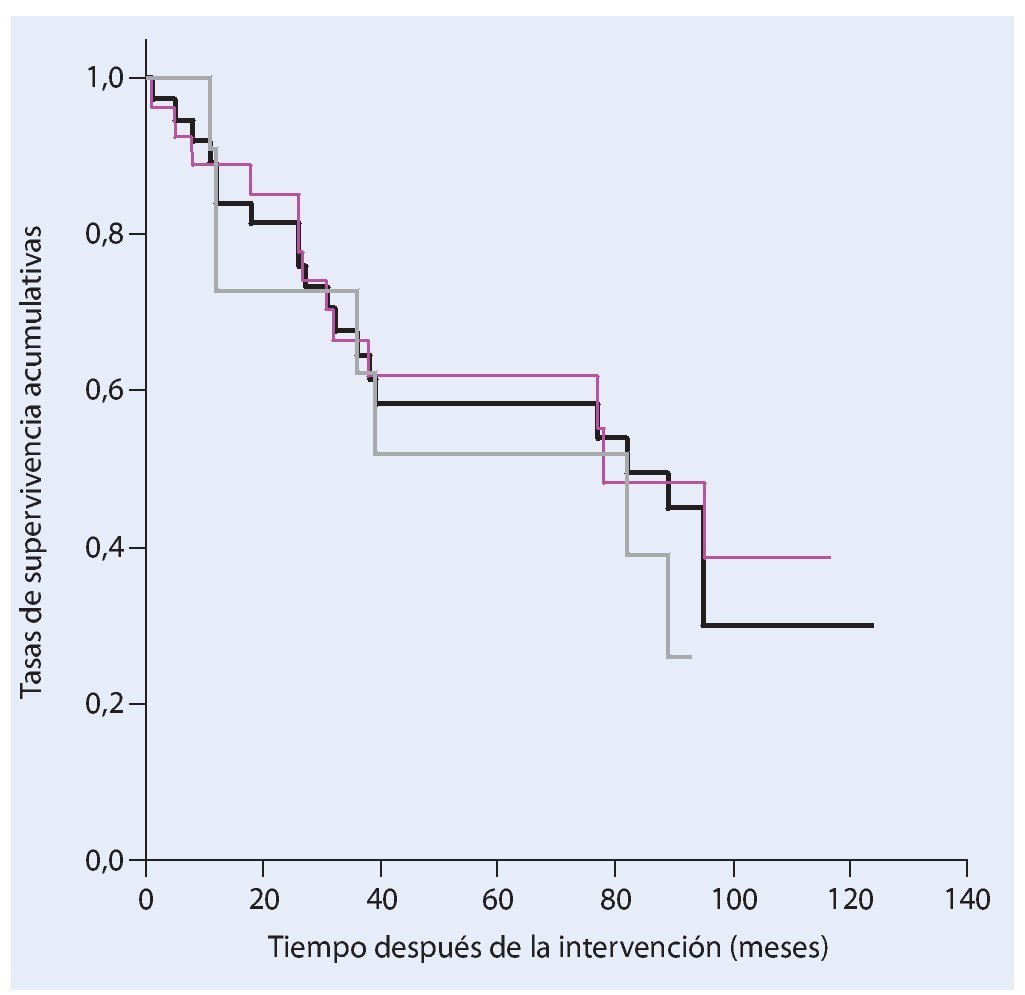
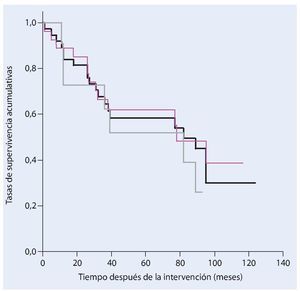
De los 38 pacientes tratados con una resección de la pelvis y un reemplazo endoprotésico a causa de un tumor maligno en la actualidad todavía dieciocho siguen vivos. La tasa de supervivencia después de cinco años entre nuestro colectivo de pacientes es del 58%, y del 30% después de diez años (fig. 17). Veintisiete pacientes fueron sometidos a una resección marginal o amplia (estadio R0) y a once pacientes se les realizó únicamente una resección intralesional. Durante la evolución de la enfermedad y después de un estadio de resección R0 se desarrolló una recidiva local y después de una resección intralesional se detectaron cinco recidivas locales. La incidencia de recidivas locales fue en total del 15,8%.
Fig. 17. Análisis del tiempo de supervivencia según Kaplan-Meier. Supervivencia total de todos los pacientes (negro), supervivencia después de una resección amplia o marginal (rosa) y supervivencia después de una resección intralesional (gris).
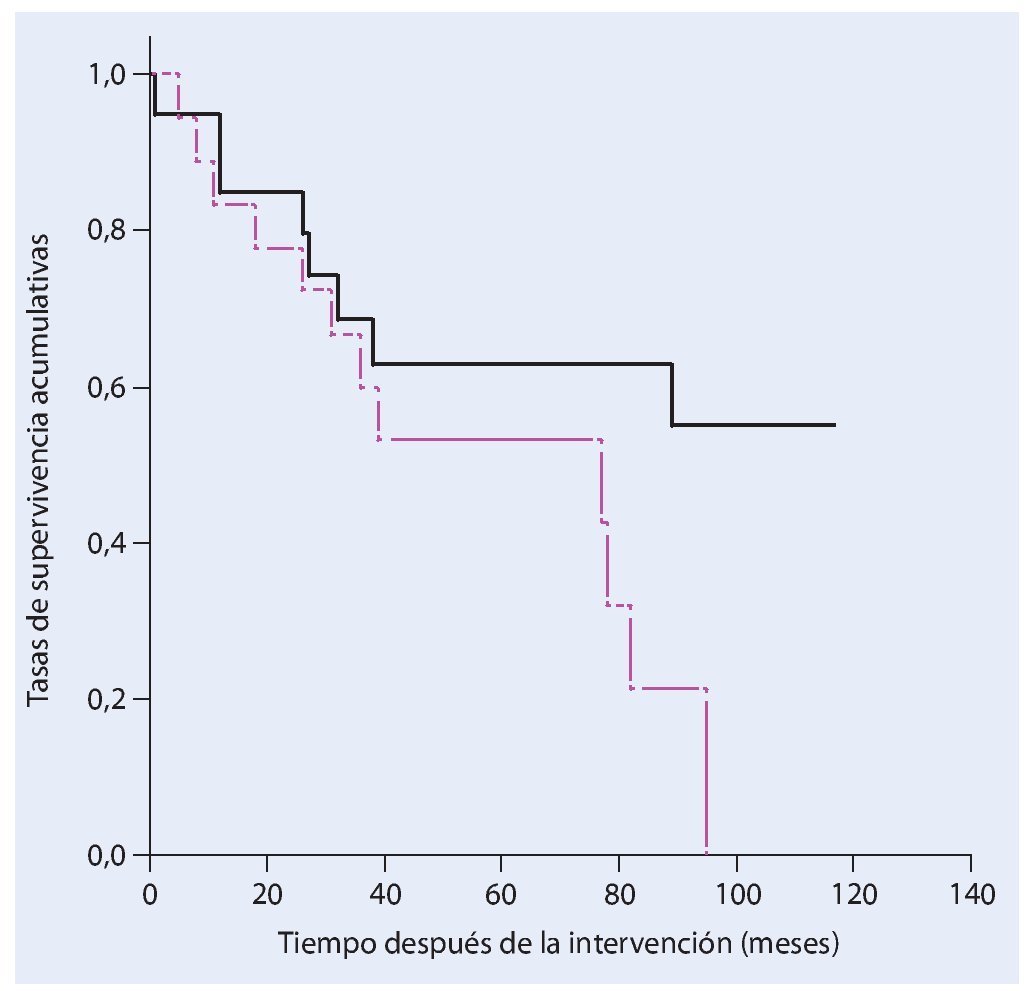
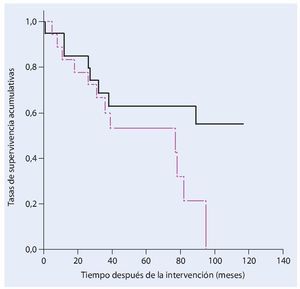
La tasa de supervivencia de los pacientes cinco años después de haber sufrido un tumor maligno primario es del 63%. En pacientes con metástasis esta tasa es del 54% (fig. 18).
Fig. 18. Análisis del tiempo de supervivencia según Kaplan-Meier. Supervivencia de los pacientes con un tumor primario (negro) y secundario (rosa) maligno.
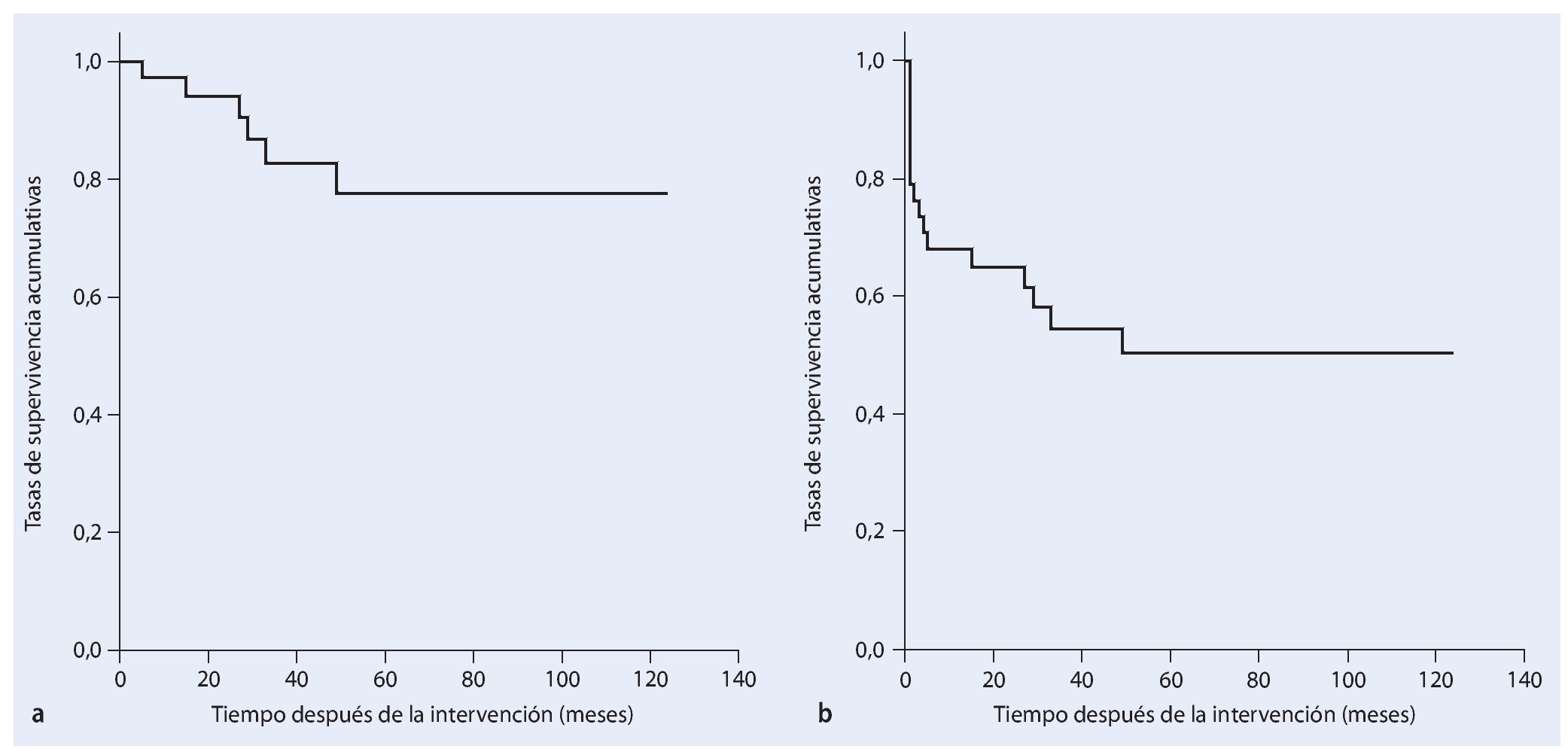
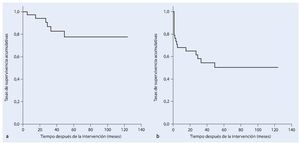
En la fase postoperatoria ocho pacientes (21%) sufrieron una infección profunda. En seis de los pacientes esta infección se pudo tratar con éxito mediante el desbridamiento, lavado y terapia antibiótica sistemática adaptada al control. En todos los casos se trató de una infección temprana. Hubo otras dos infecciones que se manifestaron clínicamente con posterioridad (a los 29 a 49 meses postoperatorios), en las que resultó necesaria una hemipelvectomía externa secundaria en el transcurso de la enfermedad. En cuatro casos (10,5%) apareció un aflojamiento aséptico de la pieza de anclaje proximal de la prótesis, por lo que se reemplazó el implante. En el transcurso postoperatorio seis pacientes (15,8%) sufrieron luxaciones recidivantes de cadera: cuatro de los casos se solucionaron mediante un cambio de inserto y la utilización de malla de reconstrucción Trevira® y en dos fue necesaria la utilización permanente de una ortesis Newport. Cuatro pacientes desarrollaron en el postoperatorio una trombosis venosa profunda. Un paciente falleció de una embolia pulmonar fulminante. En cinco casos se presentó una alteración de la cicatrización superficial y en seis casos una debilidad del elevador del pie. En el transcurso de la enfermedad dos pacientes sufrieron paresia regresiva y cuatro paresia persistente, que fueron tratados con una férula para el pie. Otras complicaciones que aparecieron fue una hemorragia postoperatoria de la rama de la arteria ilíaca interna. En este caso se pudo realizar una embolización con espirales controlada por angiografía del vaso sanguíneo afectado. En la fase postoperatoria se tuvo que vaciar un hematoma profundo y dos hematomas superficiales. En un total de veinte pacientes (52,6%) resultó necesaria una intervención de revisión quirúrgica. Según Kaplan-Meier, la supervivencia del implante con el punto final clínico de cambio de prótesis o de una hemipelvectomía externa después de cinco años fue del 78%. Si se tienen en cuenta las luxaciones, infecciones y los hematomas como motivo de revisión, la supervivencia del implante después de cinco años fue del 51% (fig. 19).
Fig. 19. Análisis del tiempo de supervivencia según Kaplan-Meier. a) Supervivencia del implante cuyo punto final clínico es el cambio de prótesis o una hemipelvectomía externa. b) Supervivencia del implante sin revisión teniendo en cuenta luxaciones, infecciones y hematomas como motivo de revisión.
Doce de los dieciocho pacientes todavía vivos pudieron ser sometidos a un seguimiento posterior clínico. En un caso ya se había realizado un cambio de la prótesis parcial de pelvis. La puntuación media según la escala MSTS (30 puntos corresponden al 100%) en el momento de la última revisión clínica fue de 13,1 ± 5,2 puntos (5-22 puntos), que corresponde a un resultado medio del 43,7%. Cinco pacientes mostraron un resultado funcional bueno (51-75%), tres pacientes un resultado satisfactorio (26-50%) y cuatro un resultado malo (0-25%). El resultado final satisfactorio se debe al hecho de que diez pacientes requieren del uso de ayudas para la marcha. El modelo de ambulación fue clasificado como malo por nueve pacientes. Sin embargo, con respecto a la aceptación emocional, el procedimiento quirúrgico obtiene buenos resultados: once de los doce pacientes que pudieron someterse a un seguimiento posterior volverían a someterse a la intervención y se muestran satisfechos con el resultado.
Cualquier medida reconstructiva después de la resección parcial de pelvis requiere una indicación, técnica quirúrgica y rehabilitación individual. El resultado funcional a menudo se puede clasificar únicamente como satisfactorio después de una resección parcial de pelvis o de una hemipelvectomía completa. El objetivo primario debería seguir siendo el control tumoral local y sistemático. Los resultados aquí representados ponen de manifiesto que, debido a las tasas de complicaciones postoperatorias todavía altas, la indicación se tiene que realizar bajo criterios muy exigentes. La decisión individual sobre el tipo de terapia a aplicar en cada caso se deberá decidir por consenso interdisciplinario. Además, en el momento de realizar la indicación se deberán tener en cuenta las expectativas personales del paciente y los requisitos a la funcionalidad posterior de la extremidad.
Conflicto de intereses. El autor del presente trabajo declara que ni él ni sus coautores tienen conflicto de intereses en relación con la publicación de este trabajo.
Correspondencia
Prof. Dr. M. Rudert
Orthopädische Klinik König-Ludwig-Haus,
Julius-Maximilians-Universität Würzburg Brettreichstr. 11, 97074 Würzburg (Alemania)
I-orthopaedie.klh@uni-wuerzburg.de