Notas preliminares
La capacidad de regeneración del cartílago articular es muy escasa11,13. Las lesiones en el cartílago no tratadas pueden ocasionar daños secundarios en la superficie articular y la aparición precoz de artrosis. Actualmente existen diversos métodos de tratamiento quirúrgico para corregir los defectos locales de gran tamaño del cartílago en la articulación de la rodilla1:
- Las técnicas que estimulan la médula ósea (perforación del espacio medular) a menudo generan un tejido fibrocartilaginoso de sustitución que conlleva un riesgo alto de padecer una degeneración subsiguiente. Estas técnicas suelen realizarse cuando los defectos son pequeños o de tamaño mediano16,18.
- En los autotrasplantes de cilindros osteocondrales, los defectos pueden rellenarse de forma individual o mediante una mosaicoplastia5,7,8. A menudo los radios de curvatura preformados de los cilindros no permiten restablecer de forma óptima la congruencia específica de la superficie articular. Como consecuencia, las propiedades biomecánicas del injerto no son las idóneas y las fuerzas de cizalla resultantes lo ponen en peligro. Además, no deja de suponer un problema la morbilidad en la zona de extracción del cilindro.
- El trasplante autólogo de condrocitos (TAC) en la articulación de la rodilla ha permitido obtener buenos resultados en el tratamiento de los defectos limitados de gran tamaño de espesor parcial o total14, así como en los defectos osteocondrales del cartílago4,6,15 de hasta 2 cm2. Las células autógenas del cartílago obtenidas por artroscopia se llevan en el laboratorio a una fase de división celular con un fenotipo indiferenciado similar al del fibroblasto, de manera que puedan multiplicarse. En las técnicas convencionales, estas células autógenas y cultivadas del cartílago se inyectan como suspensión en el defecto cubierto por un parche perióstico autógeno. Una vez adheridas, se vuelven a diferenciar hasta desarrollar el fenotipo condrocítico y comienzan a producir matriz cartilaginosa extracelular.
- En los últimos años se ha incrementado el uso del implante autólogo asistido por matriz12. Éste se basa en polímeros biodegradables (láminas de fibra y geles) que actúan como sustancia portadora (matriz) de las células autógenas cartilaginosas cultivadas. En esta técnica ya no es necesario extraer un colgajo de periostio de la cabeza tibial.
En el implante autólogo de condrocitos guiado por matriz (MACI®, Genzyme, Neu-Isenburg, Alemania) que se describe en este artículo se utiliza una matriz reabsorbible de colágeno I/III, de origen porcino, como sustancia portadora2,3,17.
La matriz utilizada en este caso tiene una cara rugosa, con células, mientras que la otra cara no lleva células y es "oclusiva", es decir, su función es la de aislar frente al espacio articular ("cámara bioactiva"). Las células trasplantadas deben tener el mayor contacto físico posible con la base del defecto (adherencia) y, desde allí, recibir los estímulos reguladores. Si la orientación fuera inversa, probablemente también se rellenaría el defecto, aunque no existen datos concluyentes al respecto.
En principio, esta técnica quirúrgica también puede emplearse con otros productos para IACM en los que se utilice una matriz laminar.
Principios quirúrgicos y objetivos Autotrasplante de células cartilaginosas autógenas cultivadas en los defectos localizados del cartílago de la rodilla con el fin de reparar la superficie articular y evitar una artrosis secundaria.
Ventajas
Es una técnica sencilla, ya que se emplea una matriz que contiene células, en vez de una suspensión con células cartilaginosas (como en el TAC convencional).
No es necesario preparar el colgajo de periostio, por lo que se ahorra tiempo y el abordaje quirúrgico es más pequeño.
Es posible realizar otros tratamientos simultáneos, por ejemplo, espongioplastia, contención rotuliana, alineación del eje o sustitución del ligamento cruzado.
Desventajas
Matriz y medios de cultivo xenógenos.
Tiempo y costes del cultivo celular en el laboratorio.
Es necesario realizar dos intervenciones.
Implantación de un material que inicialmente no puede soportar carga.
Aún no existen datos a largo plazo.
No puede lograrse una reparación completa del defecto con cartílago articular hialino.
Indicaciones
Defectos locales de espesor parcial o total del cartílago en la articulación de la rodilla14 de hasta 2 cm2.
Defectos locales osteocondrales de la superficie articular en la rodilla (osteocondritis disecante [OD]).
Contraindicaciones
Artrosis.
Desviaciones axiales que no pueden corregirse.
Inestabilidad en los ligamentos que no puede corregirse.
Inestabilidad en la rótula que no puede corregirse.
Pacientes mayores de 50 años (aproximadamente).
Artritis bacteriana manifiesta o previa.
Artritis reumatoide.
Intolerancia a las proteínas alógenas.
Contraindicaciones generales de una intervención quirúrgica.
Información para el paciente
Riesgos quirúrgicos generales.
Es un procedimiento en dos tiempos.
Obligación de someterse a las pruebas serológicas de detección de la hepatitis, el VIH y la sífilis, para el cultivo en el laboratorio.
Biopsia artroscópica del cartílago para el cultivo celular.
La segunda intervención abierta tendrá lugar 3 o 5 semanas después.
Empleo de una matriz de proteínas animales (en este caso, colágeno porcino); no se puede descartar un riesgo residual de infecciones víricas y contaminación bacteriana.
Posibles intervenciones adicionales para estabilizar los ligamentos y/o alinear el eje.
Procesos irritativos en el postoperatorio con inflamación y derrame, lo que puede requerir una punción.
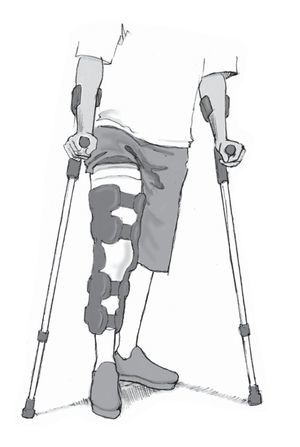
El tratamiento postoperatorio incluye el empleo de muletas y una órtesis de rodilla para descargar el peso durante 6 a 8 semanas.
Es necesario administrar un tratamiento tromboprofiláctico hasta que pueda volverse a cargar todo el peso sobre la pierna.
El tratamiento postoperatorio es intensivo y requiere entre dos y tres sesiones de fisioterapia a la semana.
También es necesario que el paciente realice ejercicios fisioterapéuticos por su cuenta.
El paciente no podrá trabajar durante unos 2 o 4 meses, según el caso. Si su actividad laboral requiere cargar la rodilla, debería plantearse cambiar de actividad o de puesto de trabajo.
El paciente no podrá practicar ningún deporte durante unos 6 meses, especialmente los de pelota o en equipo.
Puede que la lesión en la articulación de la rodilla avance.
El paciente deberá someterse a un seguimiento clínico.
Se recomienda que el seguimiento incluya resonancia magnética, aunque no es estrictamente necesario.
Preparación para la intervención
Evaluación clínica de ambas extremidades inferiores: se documentará el eje de cada pierna y la estabilidad de los ligamentos y la rótula.
Radiografías convencionales de la articulación de la rodilla en dos planos; en caso necesario, ampliadas mediante proyecciones del desfiladero y radiografías de toda la pierna en bipedestación.
Se recomienda realizar una resonancia magnética de la articulación de la rodilla en el preoperatorio.
Información sobre las actividades condicionantes para un buen resultado y que dependen del propio paciente (por ejemplo, dejar de practicar deportes, utilizar muletas y fortalecer la musculatura).
Instrumental
Instrumental habitual para artroscopia, además de una cureta anular o sacabocados para biopsia.
Equipo para biopsia del laboratorio correspondiente.
Instrumental para artrotomía en la articulación de la rodilla, cureta, papel de aluminio y papel resistente (por ejemplo, del envoltorio de la sutura); para la espongioplastia, se requiere además un conjunto de escoplos y un martillo.
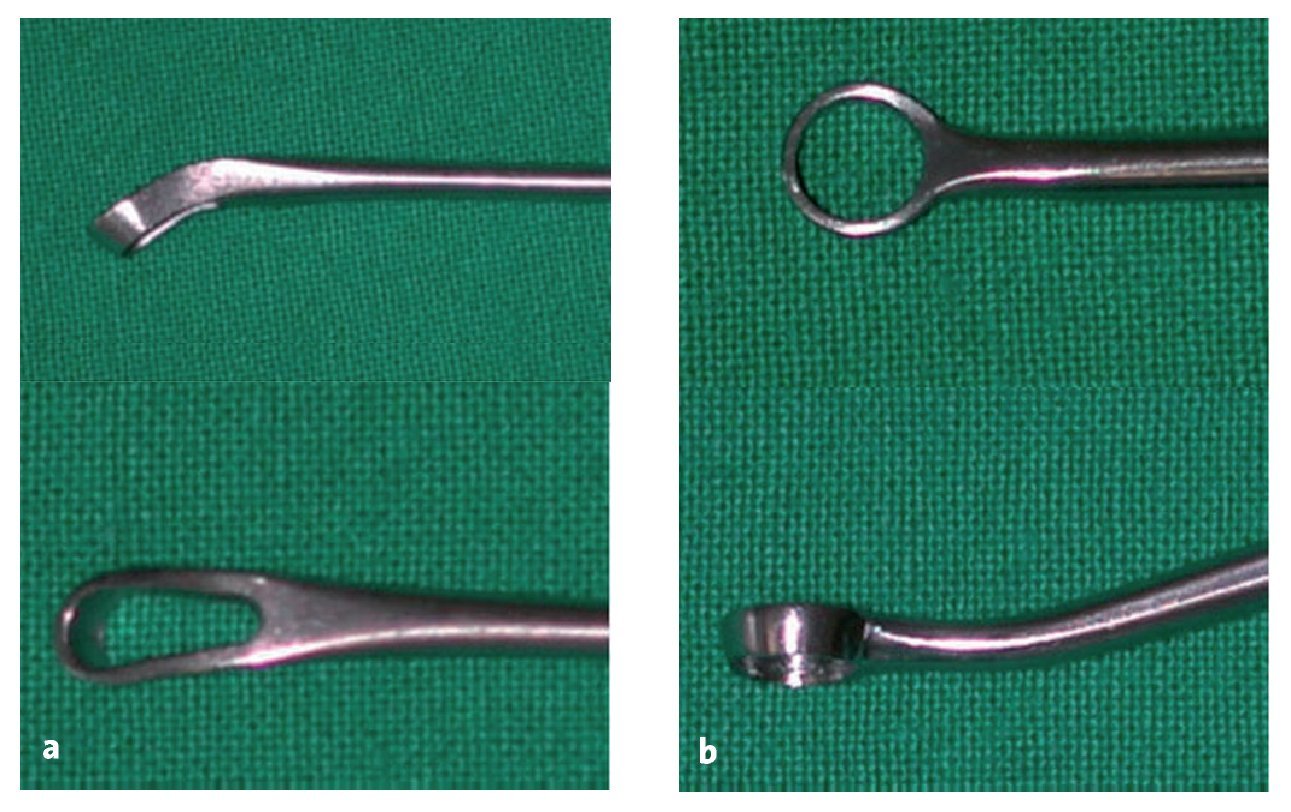
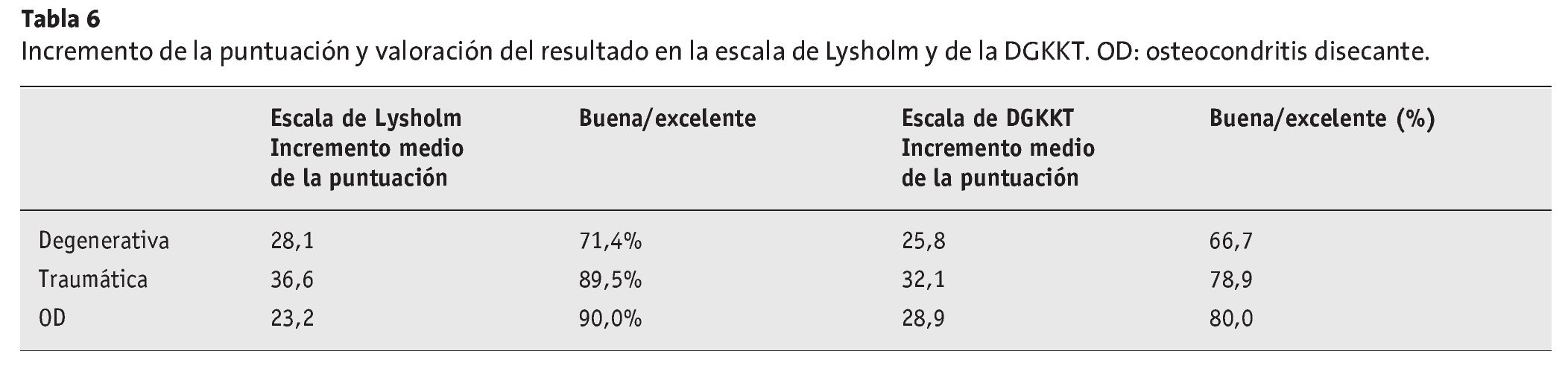
Cureta anular acodada (por ejemplo, Aesculap, Tuttlingen, Alemania; fig. 1a).
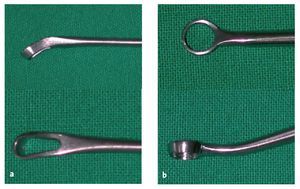
Cureta anular redonda (por ejemplo, R. Wolf, Knittlingen, Alemania; fig. 1b).
Figuras 1a y 1b. a) Cureta anular ovalada y acodada para obtener una biopsia del cartílago mediante artroscopia (por ejemplo, Aesculap, Tuttlingen, Alemania). b) Cureta anular redonda para corregir el defecto en cirugía abierta (por ejemplo, R. Wolf, Knittlingen, Alemania).
Anestesia y posición del paciente
Anestesia regional o general por intubación; eventualmente, catéter para aliviar el dolor.
Se recomienda administrar un tratamiento antibiótico preventivo en monodosis (por ejemplo, cefalosporinas).
Colocar al paciente en decúbito supino.
Isquemia en el muslo proximal.
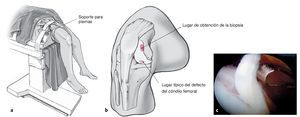
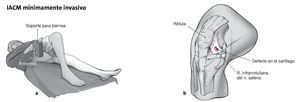
Para la artroscopia: soporte para la pierna, el reposapiernas debe estar abatido y la pierna suspendida.
Para el autotrasplante: pierna tumbada sobre la mesa quirúrgica y reposapiernas lateral a la altura del muslo proximal.
Técnica quirúrgica
Figuras 2 a 8
Ejemplo de un implante autólogo de condrocitos guiado por matriz para corregir un defecto en el cartílago del cóndilo femoral interno
Biopsia del cartílago mediante artroscopia
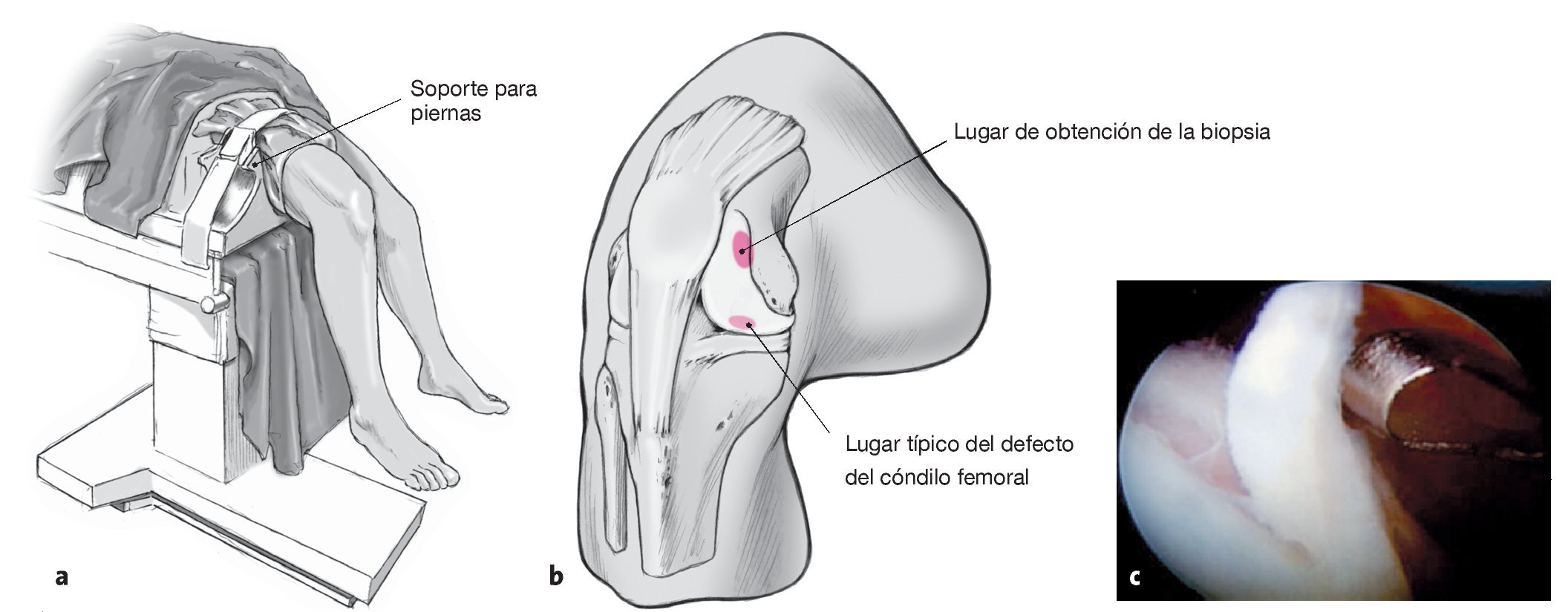
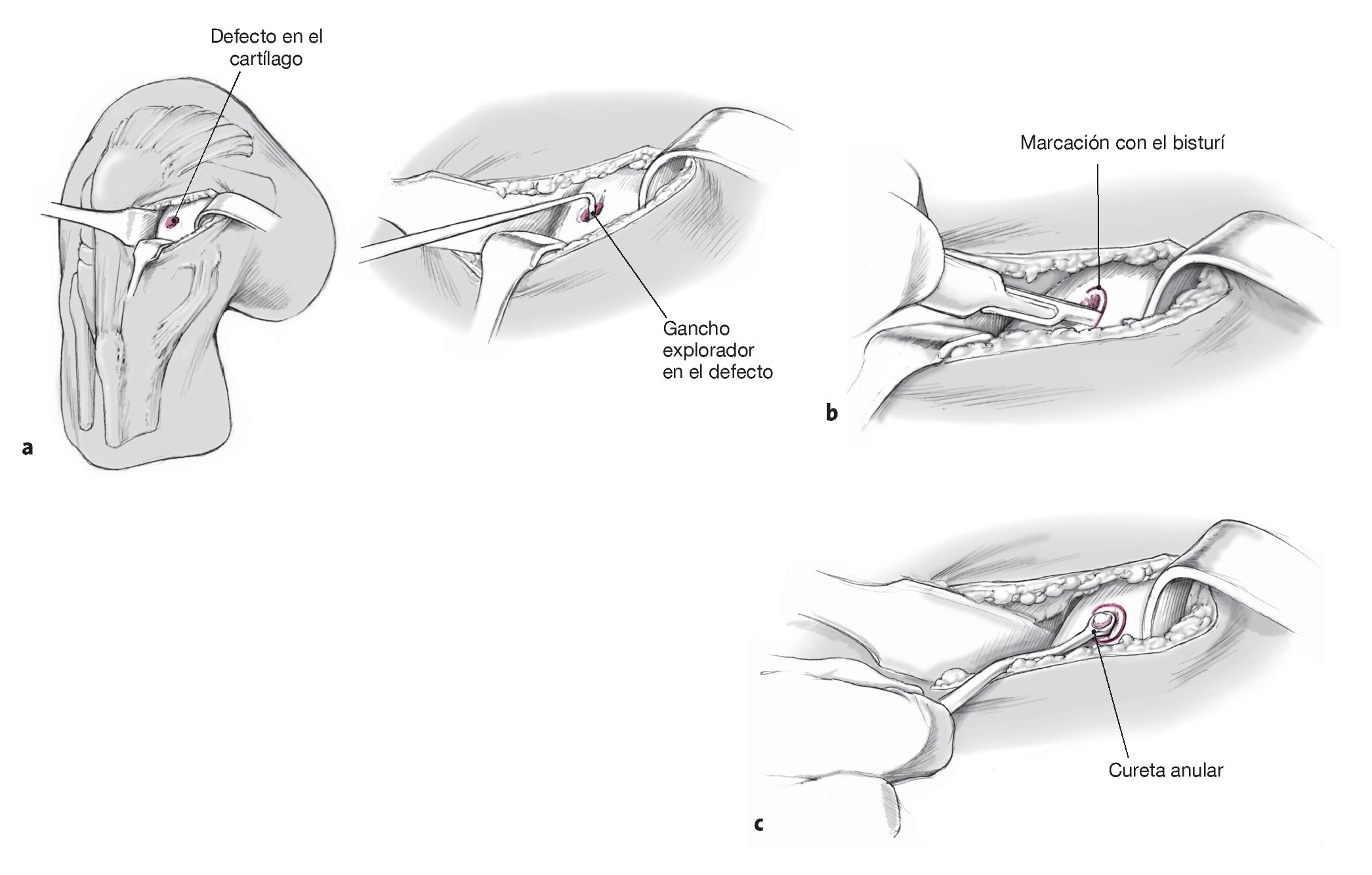
Figuras 2a a 2c. La articulación de la rodilla se colocará en un soporte (por ejemplo, Arthrex, Karlsfeld, Alemania) con una flexión de 90º y la pierna suspendida sobre el borde de la mesa quirúrgica (a). La biopsia de espesor total se obtiene preferentemente del tejido cartilaginoso sano que se encuentra en el borde interno de la tróclea (b, c) o de la fosa intercondílea, mediante un acceso anterior estándar. Para ello, se utiliza una cureta anular acodada (véase la figura 1a) o un sacabocados o pinzas de biopsia, según las indicaciones de los fabricantes del implante autólogo. La biopsia (de unos 200 a 400 mg; el equivalente a dos o tres granos de arroz) se transferirá en condiciones estériles a la solución tampón de transporte y se enviará al laboratorio de cultivo conforme a las indicaciones del fabricante.
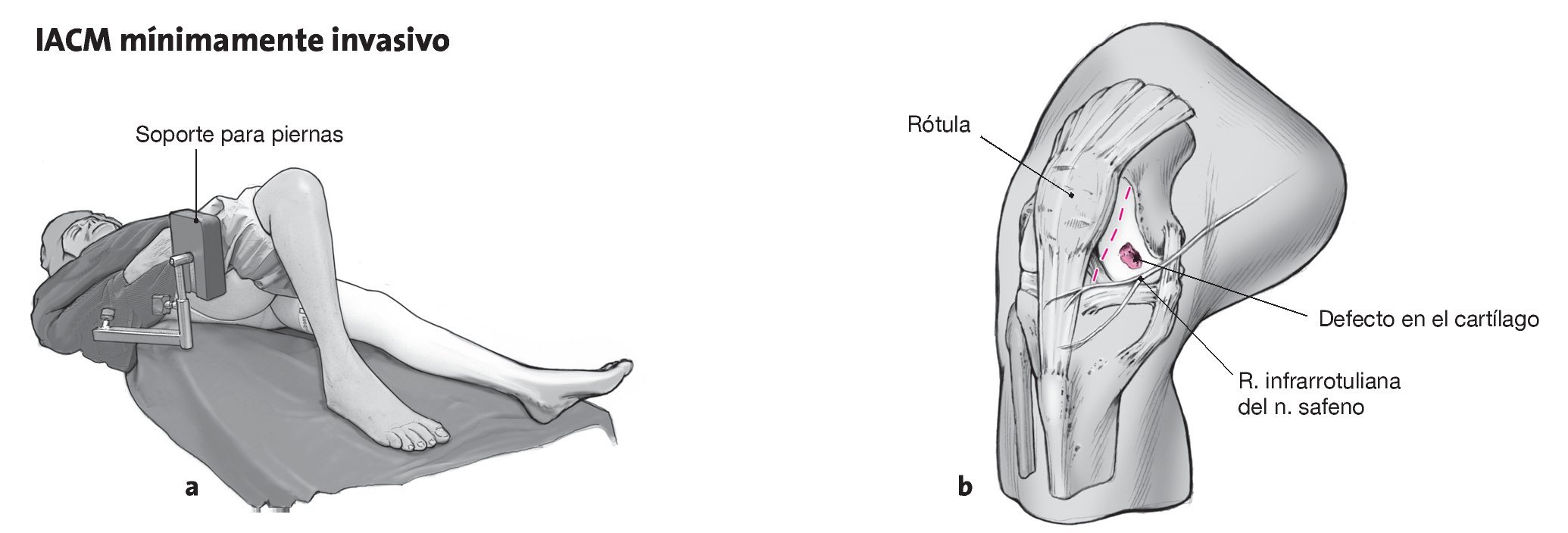
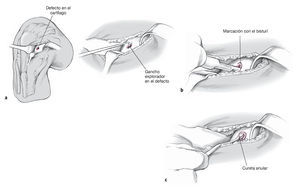
Figuras 3a y 3b. La pierna yacerá sobre la mesa quirúrgica. La rodilla debería poder flexionarse al máximo, dependiendo del lugar en que se encuentre el defecto; resulta útil colocar un reposapiernas lateral en el muslo proximal (a). Se efectuará una incisión de entre 4 y 6 cm de longitud en dirección anteromedial hasta la altura del acceso utilizado con anterioridad para la artroscopia. De esta forma, se mantendrá casi siempre intacta la rama infrarrotuliana del nervio safeno. Al abrir la cápsula, se debe tener cuidado con la base del cuerno anterior del menisco interno. Para mejorar la visualización, se puede preparar también el cuerpo adiposo infrarrotuliano manteniendo intacto el ligamento transverso anterior (b).
Figuras 4a a 4c. El separador de Hohmann o de Langenbeck se coloca en la fosa intercondílea o en la fosa interna (a). Para exponer el defecto en el cóndilo, la articulación de la rodilla debe flexionarse si es necesario más de 90º. Se empleará un gancho explorador para valorar las dimensiones del defecto. Se realizará una incisión vertical con un bisturí para marcar la zona del defecto hasta llegar al tejido sano (b). Después, se realizará la ablación tangencial completa del cartílago inestable o dañado con una cureta anular redonda (véase la figura 1) o una cureta cortante (c). No se debe dañar la laminilla subcondral. El objetivo es lograr un borde vertical y estable de cartílago intacto, lo que se puede comprobar con un gancho explorador.
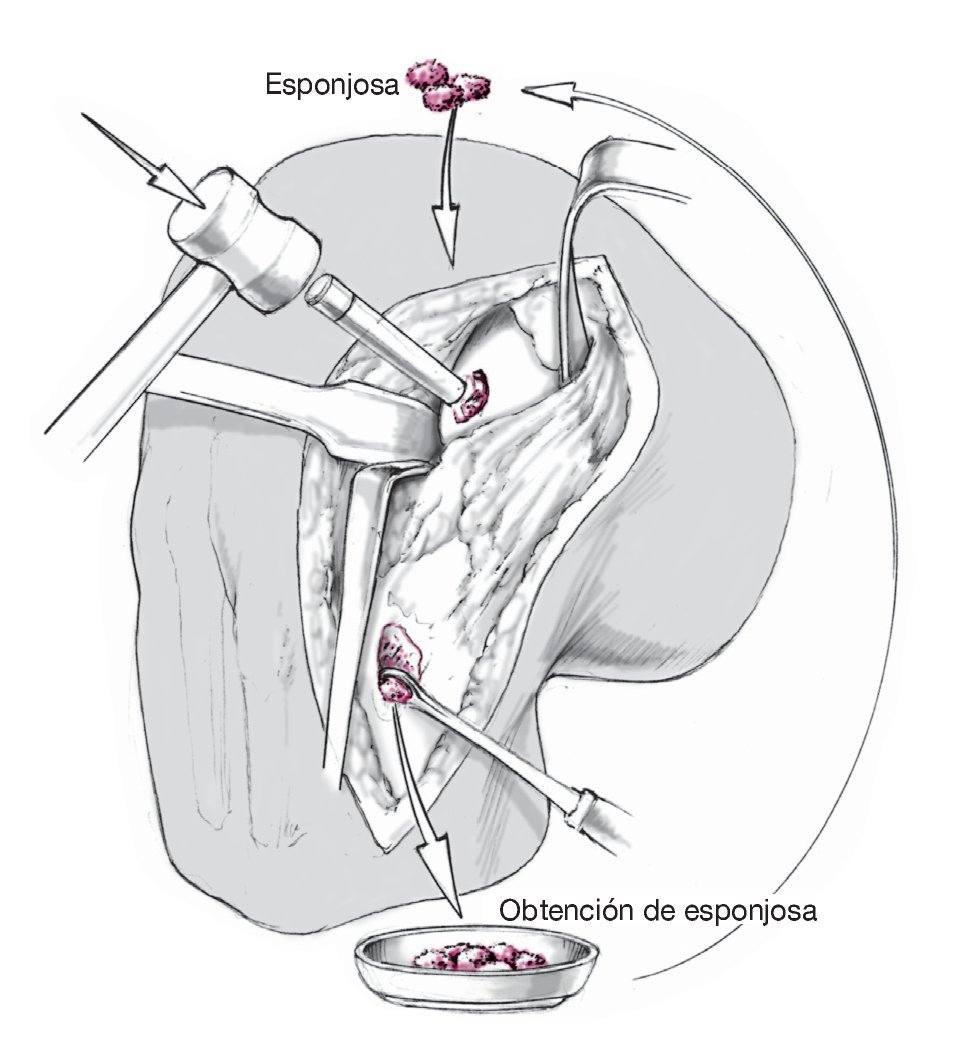
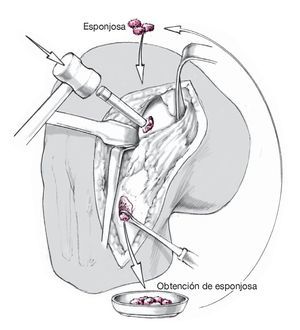
Figura 5. Si el paciente presenta una osteocondritis disecante, se extraerá la zona esclerosada en el lecho del tejido disecado con un escoplo y una cureta cortante, hasta visualizar la esponjosa sana. La incisión se prolongará en dirección distal, y la cabeza interna de la tibia se expondrá entre la tuberosidad y la pata de ganso. A continuación, se obtendrá esponjosa de la cabeza tibial. La esponjosa se introducirá hasta el nivel subcondral mediante la técnica de fijación a presión.
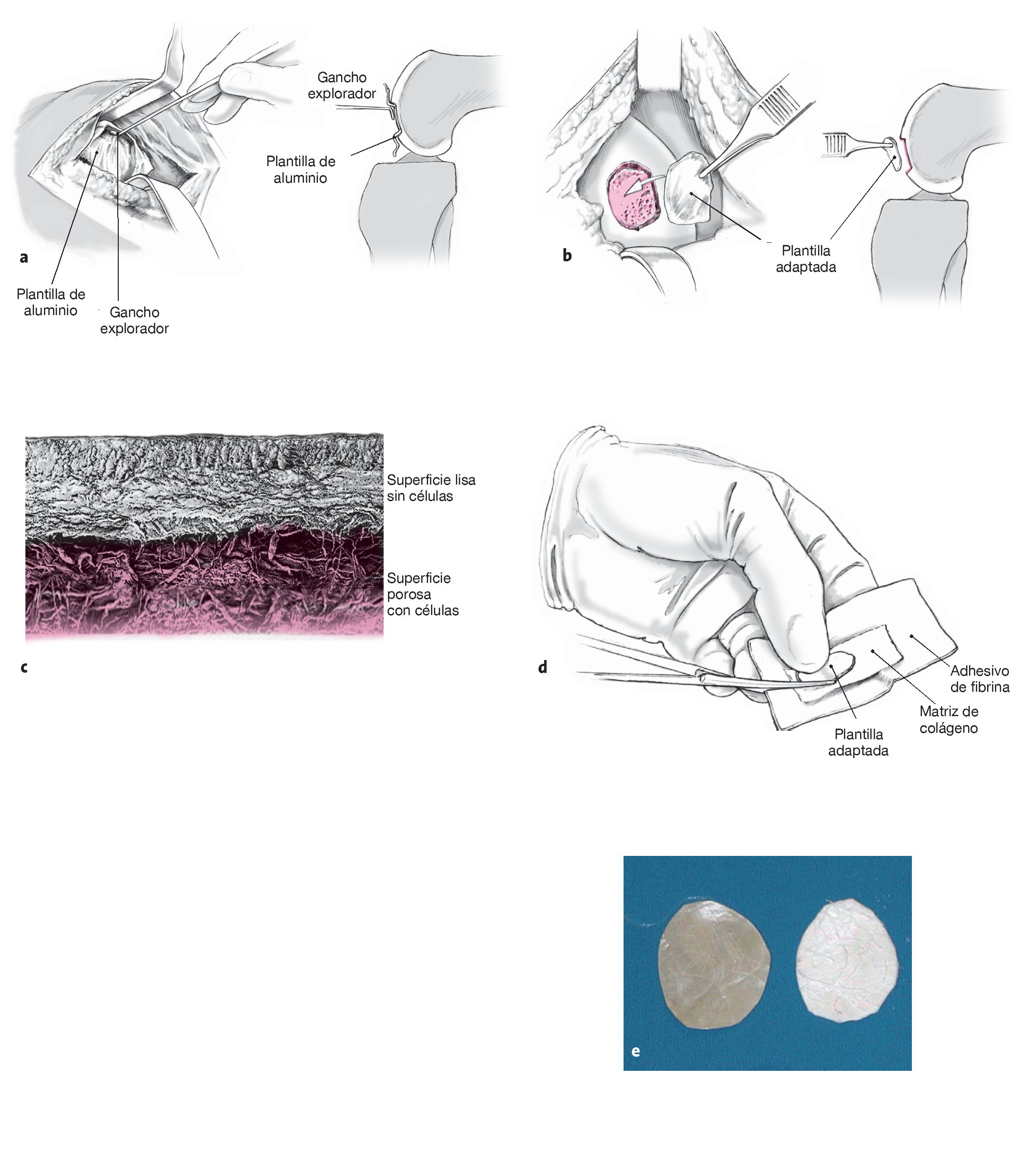
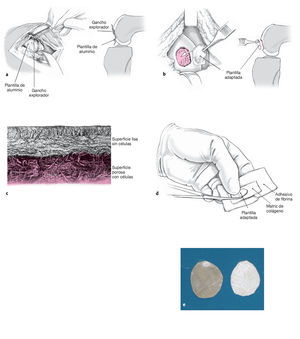
Figuras 6a a 6e. Con papel de aluminio (por ejemplo, el envoltorio de suturas) y un gancho explorador se hará una plantilla a escala 1:1 que tenga exactamente las mismas dimensiones que el defecto. Después, la plantilla se cortará con unas tijeras (a). Se volverá a comprobar que las dimensiones de la plantilla son exactas colocándola en el defecto y, si fuera necesario, realizando los ajustes correspondientes (b). La matriz MACI® está compuesta de colágeno I/III; bajo el microscopio óptico puede observarse que uno de los lados es rugoso y el otro liso (c). Se identificará el lado rugoso de la matriz, que lleva las células, y se colocará sobre el papel resistente con la cara rugosa dirigida hacia el cirujano. A su vez, la plantilla de aluminio se situará de tal forma sobre la matriz que el lado rugoso con células esté orientado hacia la base del defecto durante la colocación (d). Se cortará la matriz con las mismas dimensiones de la plantilla (e).
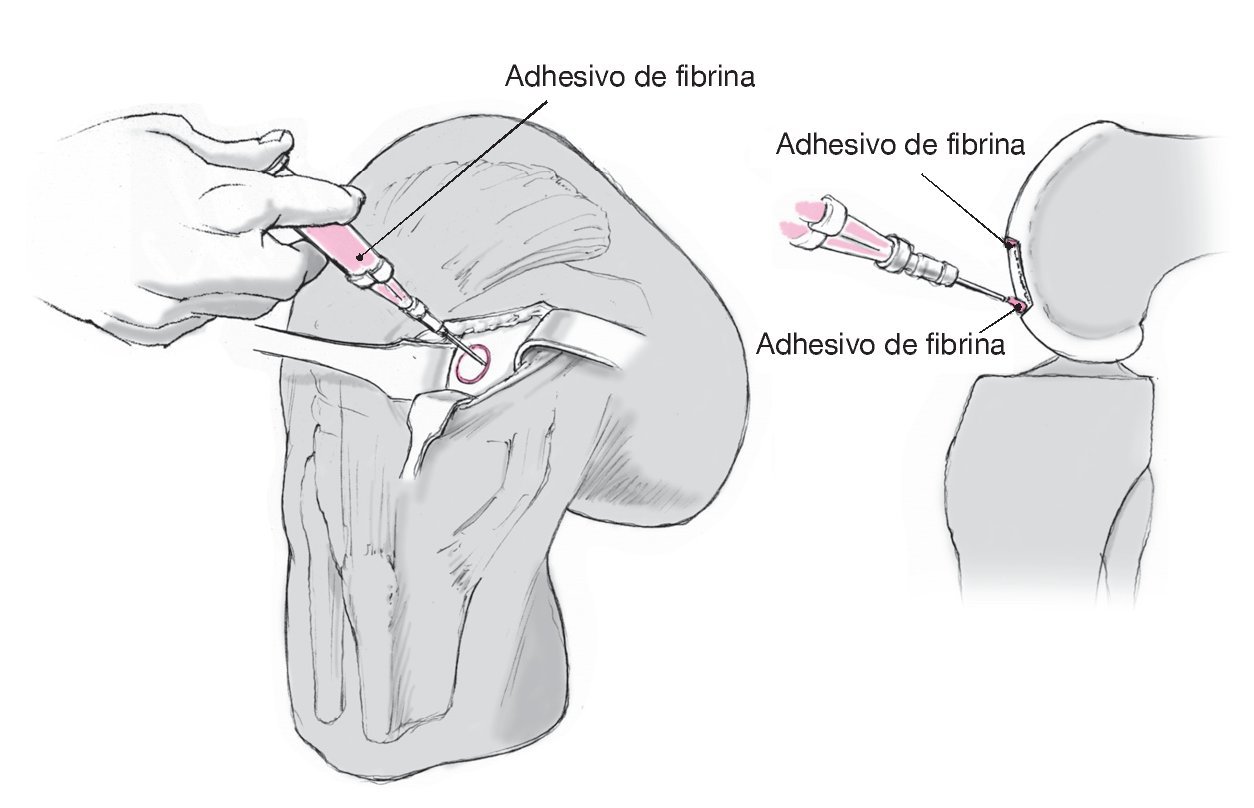
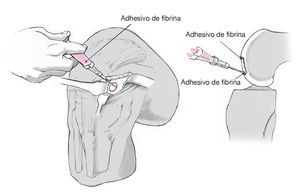
Figura 7. El lado rugoso con células de la matriz se orientará hacia la base del defecto y se sellará con adhesivo de fibrina (por ejemplo, Tissucol® Duo S Immuno, de Baxter Deutschland GmbH, Unterschleissheim, Alemania) en el defecto preparado. Los bordes se sellarán con el adhesivo de fibrina, evitando aplicar un exceso de adhesivo (goteos). A continuación, se moverá la articulación de la rodilla, con la rótula nuevamente centrada y de forma dinámica en todo el rango de movimientos. Acto seguido, se supervisará la ubicación del injerto. Si se ha obtenido esponjosa, se debe colocar la cubierta cortical y sellar con el adhesivo de fibrina restante. Después, se lavará con cuidado la herida quirúrgica, se colocará un drenaje de Redon en la bolsa suprarrotuliana, se tapará la membrana sinovial y se cerrará la cápsula con una sutura de vicrilo. Proseguir con una sutura subcutánea invertida y cerrar la dermis preferentemente con la técnica intracutánea. Por último, vendar la herida y rodear toda la pierna con un vendaje de compresión elástica.
Figura 8. Colocar en el quirófano una férula de reposo u órtesis en la rodilla con la pierna en posición de 0º, a fin de prevenir una dislocación del injerto y permitir que se produzca una mejor adherencia celular durante las primeras 48 h.
Particularidades
El IACM debería realizarse al mismo tiempo que una sustitución del ligamento cruzado u osteotomía de transposición (en caso contrario, existe el riesgo de pérdida de líquido debido a una miniartrotomía en la artroscopia posterior o cizallamiento del injerto por manipulación indirecta).
Tratamiento postoperatorio
Vendar la herida, colocar un vendaje de compresión elástica en toda la pierna, inmovilizarla en posición de 0º durante 48 h y administrar suficientes analgésicos; se recomienda la administración de antiinflamatorios no esteroideos. Colocar la extremidad afectada en una férula de reposo y tratar con crioterapia. Eliminar el drenaje de Redon al cabo de 24 h y, después, iniciar un tratamiento funcional. Se realizará movimiento pasivo continuo mediante férula motorizada en el hospital con limitación de movimientos. Se permite una carga parcial (20 kg en contacto con el suelo) y deambulación progresiva durante 6 semanas mediante marcha de tres puntos. Después, los ejercicios se orientarán en función del dolor y la inflamación hasta que pueda volverse a cargar todo el peso sobre la pierna. Se utilizará una órtesis de rodilla articulada (por ejemplo, Hypex® Lite, Albrecht, Neubeuern, Alemania) con limitación gradual de la flexión: en el caso de defectos en el cóndilo, 0/60º (extensión/flexión) durante 2 semanas; después, 0/90º durante 2 semanas y, por último, 0/120º durante 2 semanas. En el caso de defectos en la rótula o la tróclea, la limitación de movimientos en la flexión debe ser mayor: 0/30º (extensión/flexión) durante 2 semanas; después, 0/60º durante 2 semanas y, por último, 0/90º durante 2 semanas.
Comenzar la fisioterapia durante la estancia en el hospital, ejercitar el cuádriceps, aplicar estimulación eléctrica y realizar entrenamiento cinestésico y ejercicios para recuperar la fuerza muscular exclusivamente en cadena cinética cerrada.
Hospitalización de unos 6 u 8 días. Retirar el material de sutura de forma ambulatoria 12 o 14 días después de la intervención.
Seguir con la fisioterapia en condiciones ambulatorias. Realizar revisiones clínicas por parte del cirujano a las 6 y 12 semanas. Se recomienda controlar la evolución del paciente mediante resonancias magnéticas en secuencias sensibles al cartílago (secuencias eco del espín ponderadas en T1 y T2) a los 6 y 12 meses, aunque no es obligatorio.
El tratamiento termina cuando se logra que la rodilla recupere todas sus funciones sin causar dolor.
Asesorar sobre las posibilidades de prevención secundaria (actividades cotidianas y deportivas que no lesionen las rodillas).
Errores, riesgos, complicaciones
Se debe tener mucho cuidado al colocar la matriz durante la implantación, ya que es fundamental que el lado rugoso con células esté orientado hacia la base del defecto.
Si existe osteocondritis disecante, se deberán realizar los pasos necesarios para vitalizar la base del defecto.
La espongioplastia sólo puede llevarse a cabo como máximo hasta el nivel subcondral; no se debe sobrellenar el defecto.
Llenar el defecto por encima del nivel adecuado provoca inestabilidad mecánica.
Si se observa cizallamiento o pérdida del injerto debido a que la matriz es demasiado grande y sobresale por el borde del defecto, se procederá a eliminar las gotas derramadas de fibrina, se reducirá el tamaño de la matriz, eventualmente se realizará una sutura local (por ejemplo, con PDS 5.0, Ethicon Norderstedt, Alemania) y se volverá a realizar un control dinámico.
Si persisten las molestias en el postoperatorio o se observa la aparición de síntomas de bloqueo, se efectuará una nueva resonancia magnética. Si se observan indicios de inestabilidad, pérdida o hiperplasia del injerto, se llevará a cabo una revisión artroscópica.
Resultados
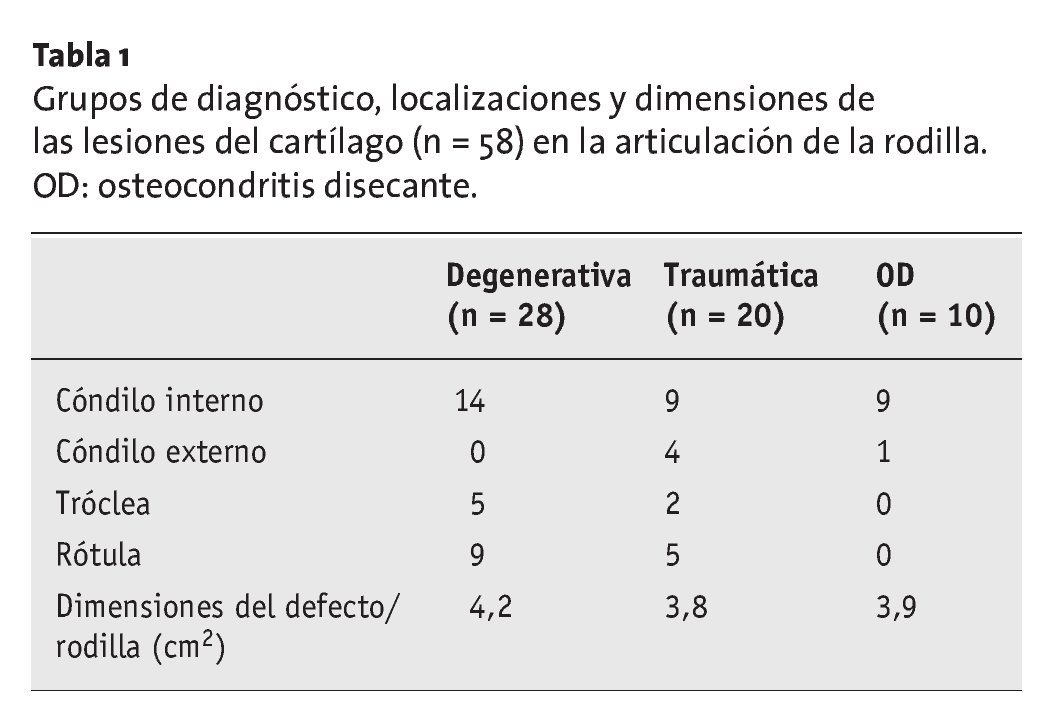
Se sometió a un implante autólogo de condrocitos guiado por matriz (MACI®, Genzyme, Neu-Isenburg, Alemania) a 50 pacientes (24 mujeres y 26 varones con edades comprendidas entre 14 y 44 años, siendo la media de edad de 30,3 años) que presentaban 58 defectos focales del cartílago (III-IV) en la articulación de la rodilla: en el cóndilo interno (n = 32) o externo (n = 5), en la rótula (n = 14) y en la tróclea (n = 7). El promedio del período de seguimiento fue de 24 meses (entre 21 y 29 meses). El promedio de las dimensiones del defecto era de 4,1 cm2 (entre 1,6 y 6,1 cm2).
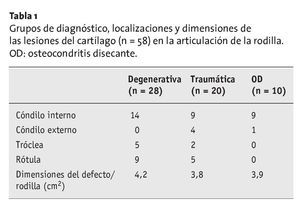
En la tabla 1 se muestran las dimensiones, la localización y la etiología de los defectos en el cartílago (n = 58).
Tabla 1 Grupos de diagnóstico, localizaciones y dimensiones de las lesiones del cartílago (n = 58) en la articulación de la rodilla. OD: osteocondritis disecante.
Del total de 50 pacientes, 37 (74%) se habían sometido previamente como mínimo a una intervención quirúrgica (entre una y cuatro) para tratar el defecto en el cartílago. Veintiún pacientes presentaban una lesión cartilaginosa idiopática y degenerativa, mientras que en otros 19 la lesión respondía a un traumatismo. Los 10 pacientes que sufrían OD se sometieron a un autotrasplante de esponjosa en la cabeza tibial medial. Se efectuó una resección parcial del menisco y cuatro divisiones del retináculo como tratamiento artroscópico concurrente. En 10 pacientes se llevó a cabo una sustitución del ligamento cruzado anterior y trasplante simultáneo doble de los músculos semitendinoso y recto interno, además de un anclaje bioabsorbible mediante la técnica de un solo canal; y en otras dos ocasiones, una refijación del menisco con anclajes bioabsorbibles.
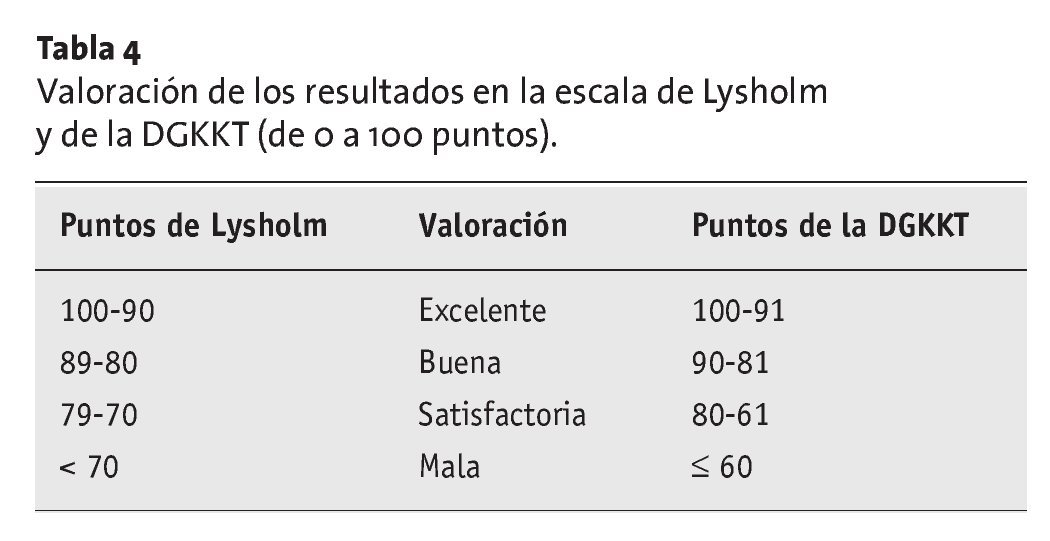
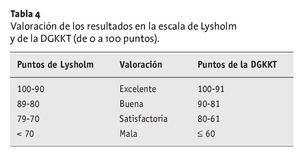
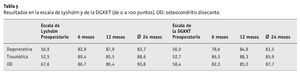
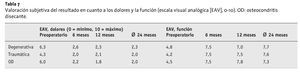
Se evaluó clínica y prospectivamente a todos los pacientes con la escala de Lysholm10 (tablas 2 y 4) y la escala de la DGKKT9 (Deutsche Gesellschaft für autologe Knorpel- und Knochenzelltransplantation) (tablas 3 y 4), además de mediante resonancias magnéticas (secuencias eco del espín sensibles al cartílago y ponderadas en T1 y T2). Se pidió a los pacientes que evaluaran el dolor y la función mediante una escala analógica visual (EAV, de 0 a un máximo de 10), y se les preguntó sobre su valoración subjetiva del resultado quirúrgico.
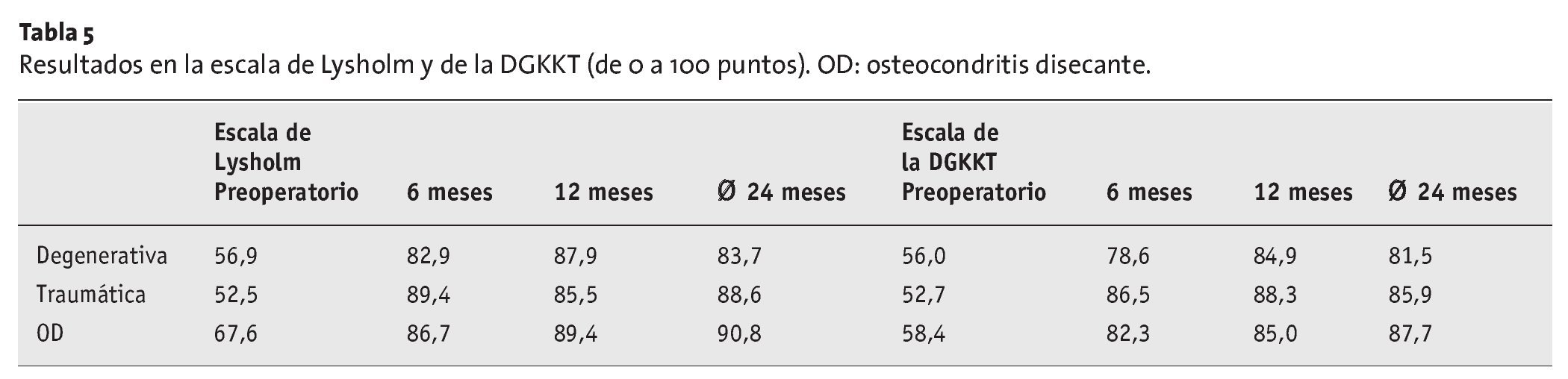
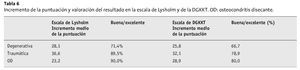
En las tablas 5 y 6 se muestran las puntuaciones obtenidas cronológicamente, la puntuación total y la valoración final de cada subgrupo. En la tabla 7 se desglosan por subgrupos las valoraciones subjetivas de los pacientes en cuanto al dolor y la función.
En total, la valoración del conjunto de la población de pacientes mostró una mejoría de 30,1 puntos en la escala de Lysholm, y de 30,2 puntos en la escala de la DGKKT, siendo cada escala de 100 puntos. Estas mejorías fueron significativas (p < 0,01; prueba de la t). El incremento mayor se produjo durante los 6 primeros meses y se mantuvo estable en evaluaciones posteriores. Las diferencias dentro de los subgrupos a los 12 y 24 meses no fueron significativas. En la valoración final de la puntuación, los pacientes que presentaban lesiones degenerativas en el cartílago alcanzaron comparativamente la menor proporción de resultados buenos o excelentes. El mayor incremento en la puntuación se observó en los pacientes que presentaban lesiones traumáticas en el cartílago. Los pacientes con osteocondritis disecante, aunque tenían las puntuaciones iniciales más altas, sólo obtuvieron un incremento regular, aunque con la mayor proporción de resultados buenos y excelentes. En la artroscopia de revisión, realizada al cabo de 12 meses, a una paciente que presentaba escamas de origen traumático en el cóndilo interno y sustitución simultánea del ligamento cruzado anterior (n.º 10, tabla 8), se observó una crondromalacia III-IV progresiva de la correspondiente zona articular femoral y tibial del compartimento interno. Puesto que el dolor seguía siendo intenso, se implantó una pieza aloplástica interpuesta en la superficie articular (Confor-MIS, Schönebeck, Alemania). La puntuación de esta paciente (37 en la escala de la DGKKT y 35 en la de Lysholm) se incluyó en las estadísticas, pero no estaba satisfecha con el resultado de la intervención y contestó negativamente a la pregunta sobre una eventual repetición de la operación.
En cuanto al resto de los pacientes, según la valoración subjetiva del dolor y la función mediante la EAV y la evaluación de la satisfacción con el resultado, todos los subgrupos salieron ganando con la intervención en la misma medida. Del total de 50 pacientes, 43 (86%) volverían a someterse a una intervención de este tipo, 6 (12%) no sabían, y 1 (2%) la rechazaría.
No se registró ninguna complicación general grave, como infección articular o trombosis.
Según las resonancias magnéticas realizadas tras un promedio de 19,8 meses (entre 16 y 28 meses), los porcentajes de pacientes con un relleno del defecto como mínimo del 75% fueron del 66,7% (14 de 21) en los defectos degenerativos, del 68,4% (13 de 19) en los defectos traumáticos y del 80% (8 de 10) en presencia de osteocondritis disecante. Se pudo observar en ese momento un derrame leve en el 18% (9 de 50) de los pacientes, y moderado en el 4% (2 de 50).
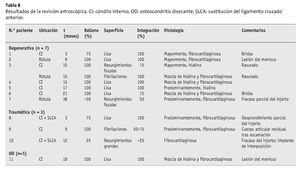
Se llevaron a cabo revisiones artroscópicas debido al dolor tras 3-38 meses en 11 de 50 pacientes (22%), en los que se habían corregido 12 defectos (véase la tabla 8). En 3 casos, la intervención no permitió establecer ninguna relación con el implante autólogo MACI® (en 2 ocasiones se trataba de lesiones en el menisco, y en otra ocasión, de restos articulares por escamas del cartílago). En un paciente se observó un desprendimiento parcial del injerto, y en otros dos pacientes, un fracaso parcial o total del injerto, respectivamente. En los estudios histológicos de las biopsias por punción de espesor total se observó que el tipo de tejido regenerado más frecuente era el "mayormente fibrocartilaginoso" (5 de 12), seguido de la "mezcla de hialino y fibrocartilaginoso" (4 de 12) y el "mayormente hialino" (2 de 12) o "fibrocartilaginoso" (1 de 12).
Durante el seguimiento, se constató que el procedimiento MACI® produjo en la población observada una mejoría funcional considerable, un destacado alivio del dolor y una gran satisfacción. A partir de nuestra experiencia, consideramos que una aplicación estricta de los criterios de inclusión y exclusión es la base fundamental para el éxito terapéutico. Aún deberán realizarse estudios a largo plazo y comparativos con el fin de evaluar los resultados del IACM. Sería deseable que se llevara a cabo un estudio aleatorizado para comparar distintas estrategias terapéuticas.
Correspondencia
Dr. Sven Anders
Clínica de Ortopedia de la Universidad de Regensburgo y Clínica Asklepios de Bad Abbach
Kaiser-Karl-V.-Allee 3
93077 Bad Abbach (Alemania)
Tel.: (+49/9405) 18-0; fax: -2925
Correo electrónico: s.anders@asklepios.com