Objetivo. Preservación de la articulación de la cadera mediante tratamiento de la necrosis de cabeza femoral aséptico en el paciente adulto o, al menos, evitar la progresión de la enfermedad.
Indicaciones. Necrosis de cabeza femoral aséptica del paciente adulto en los estadios I-III de Steinberg. En el estadio IVa de Steinberg (menos del 15% de la superficie articular, aplanamiento < 2 mm), con el objetivo de preservar la articulación de la cadera en el estadio precoz del colapso de cabeza femoral.
Contraindicaciones.Coxartrosis manifiesta, infección articular. Contraindicaciones relativas: Colapso de la cabeza femoral > 2 mm o > 15% de la superficie articular (a partir del estadio IVb según Steinberg), factores de riesgo persistentes (abuso de alcohol, quimioterapia, radiación local, aplicación de altas dosis de cortisona), así como obesidad mórbida (BMI > 40).
Técnica quirúrgica. Artroscopia de la articulación de la cadera en caso de lesiones del cartílago intraarticulares y/o posible colapso de cabeza femoral. Sin colapso de la cabeza femoral, múltiples perforaciones con una vaina de perforación paralela a través de un abordaje lateral (Steinberg II, III). A continuación, curetaje de la necrosis a través de un orificio central e inserción de injerto autógeno de esponjosa con instrumental OATS (Steinberg IIb/c, IIIb/c). Como intento de reconstrucción en el estadio IVa según Steinberg con relleno del segmento aplanado de la cabeza para la restauración del contorno de la cabeza (controlada mediante radiografías).
Tratamiento posterior. Carga parcial (10 kg) de la pierna intervenida durante 6 semanas. En caso de grandes focos subcondrales (Steinberg IIIc) o de fractura subcondral con colapso de cabeza (Steinberg IVa), carga parcial durante 12 semanas.
Resultados. Resultados precoces en 53 pacientes (56 articulaciones de cadera, tratamiento consecutivo durante el periodo de tiempo comprendido entre junio de 2004 y diciembre de 2009) después de un promedio de 33 ± 20 meses: tasa de éxito del 86% en los estadios previos al colapso I-III (sin implantación de prótesis total, sin nueva intervención, sin progreso radiológico asociado a nuevos síntomas clínicos). El fracaso de la terapia para la preservación de la articulación según estos criterios fue para el estadio I según Steinberg de 0 casos (0%); en el estadio II, de 2 (10%); en el estadio III, de 3 (25%), y en el estadio IVa, de 4 (31%).
Redacción
M. Rudert, Würzburg
Ilustraciones
J. Kühn, Heidelberg
Introducción
La necrosis aséptica de la cabeza femoral en el paciente adulto es una afección causada por múltiples factores, que puede destruir la arquitectura ósea y provocar el colapso de la cabeza femoral con la consiguiente aparición de artrosis22. Las imágenes radiográficas convencionales y la resonancia magnética (sin contraste) o el TAC son considerados los métodos decisivos para cuantificar la extensión de la necrosis, así como los cambios articulares en la fase preoperatoria10,18,32,33. La radiografía y la resonancia magnética de las articulaciones de la cadera permiten determinar si la cadera contralateral también está afectada24, como sucede en el 30-70% de los casos. En el estadio precolapso y en la fase inicial del colapso de la cabeza femoral no siempre es posible diferenciar con claridad los estadios precoces del colapso de la cabeza femoral, ni la severidad del daño sufrido en el cartílago1,2,11,29. Ruch et al.25 y Sekiya et al.26 examinaron pacientes que presentaban una osteonecrosis de cabeza femoral visible mediante radiografía convencional (según la clasificación de Marcus) por vía artroscópica para determinar si el cartílago estaba dañado. Los estadios II y III de Marcus previos al colapso ya mostraban lesiones del cartílago entre el 44 y el 100% de los casos.
Ante la sospecha de existencia de una lesión del cartílago, consideramos procedente indicar la realización de una artroscopia de la articulación de la cadera también en los estadios previos al colapso de la necrosis de cabeza femoral. A todos los pacientes que presentan un colapso de la cabeza femoral claro y que, sin embargo, deban ser sometidos a una terapia de preservación articular, se les realiza una artroscopia de cadera.
En base a los datos que se encuentran en la literatura, únicamente debería intentarse aplicar una terapia conservadora primaria en los estadios precoces asintomáticos (estadios 0 y I según Steinberg28) por el riesgo de que la enfermedad se extienda. Las opciones terapéuticas consisten en la descompresión de la pierna afectada y en una terapia farmacológica (por ejemplo, con derivados de prostaciclina, bifosfonatos y estatinas6,9). Para los estadios de grado superior, existen diferentes cirugías quirúrgicas, como perforación10,16, inyección de médula ósea autóloga concentrada8,31, diferentes tipos de trasplantes óseos14,27 e incluso osteotomía de fémur o de cadera12,23. Para los estadios más avanzados a menudo no queda otra opción que la implantación de una prótesis total de cadera. En su metaanálisis sobre la perforación de la necrosis de cabeza femoral, Marker et al. incluyeron 26 trabajos (1992-2007) con un total de 1.268 articulaciones de cadera tratadas. El resultado de la valoración mostró en los estadios previos al colapso que en el 21% de los casos (estadio I según Ficat) y en el 48%/50% (estadios II/III según Ficat) respectivamente el fracaso era visible en el control radiográfico. De los pacientes tratados mediante perforación en el estadio postcolapso precoz (estadio III según Ficat), el 66% tuvo que ser sometido a una nueva operación en el transcurso del tratamiento. En los grupos de pacientes integrantes del presente estudio las tasas de fracaso fueron de hasta el 78% (estadios I-III según Ficat10,16). La presencia de un «crescent sign» (fractura subcondral sin aplastamiento de la cabeza, Steinberg III y Ficat IIb) comporta el empeoramiento del pronóstico con relación al curso radiológico y clínico de la enfermedad16.
En conclusión, después de una perforación única, sobre todo en los estadios tardíos previos al colapso, un porcentaje relativamente alto de pacientes sufren un aumento de la necrosis de cadera con la consiguiente destrucción de la articulación. Los procedimientos de tratamiento adicionales tienen el objetivo de mejorar las tasas de éxito. Para la osteoinducción adyuvante se puede aplicar el efecto de campos electromagnéticos para la estimulación osteoblástica tanto mediante un procedimiento no invasivo13,17 como invasivo15,19,20. Actualmente, el procedimiento se aplica en forma de un tornillo canulado Asnis III s-seriesTM (Stryker GmbH, Duisburgo, Alemania). El instrumental correspondiente facilita además la perforación y el curetaje.
Principio y objetivo de la intervención
El objetivo del tratamiento es la preservación de la función de la articulación de la cadera en caso de osteonecrosis de cabeza femoral en el paciente adulto.
En los estadios precoces, el objetivo del tratamiento es la regeneración de la cabeza femoral. En los estadios más avanzados o en caso de colapso de la cabeza femoral, se puede intentar preservar la articulación si el cartílago articular está intacto para evitar o retrasar la progresión de la enfermedad.
Ventajas
- Terapia en función del estadio.
- Diagnóstico seguro de una lesión condral, especialmente en estadios tardíos previos al colapso y en la fase de inicio del aplanamiento de la cabeza femoral. Es posible aplicar una terapia para el tratamiento de patologías concomitantes intraarticulares.
- Reducción y/o seguimiento de la extensión de la enfermedad y sus complicaciones mediante la medición continua de la fuerza durante la artroscopia de la cadera.
- Reducción de la exposición a la radiación y terapia mínimamente invasiva mediante la utilización de instrumentos especiales («vaina de perforación»).
Desventajas
- La artroscopia de la cadera requiere un tiempo de preparación adicional y prolonga el tiempo quirúrgico.
Indicaciones
Diagnóstico artroscópico
- En los estadios I-III según Steinberg, ante una sospecha clínica o en base a una tomografía por resonancia magnética de la presencia de patologías intraarticulares, por ejemplo, lesiones del cartílago.
- En el estadio IV según Steinberg para la valoración del cartílago y de la consiguiente terapia.
Terapia para la preservación de la cabeza utilizando la clasificación según Steinberg
- Estadio I: perforación.
- Estadio II: perforación, curetaje a través del orificio central, plombaje con esponjosa autóloga del fémur (estadio IIa, IIb). En el estadio IIc y en función del tamaño, se aplicará adicionalmente esponjosa de la cresta ilíaca.
- Estadio III: de forma análoga al estadio II. A nivel subcondral se realizará con cuidado la impactación de la esponjosa para estabilizar la zona con peligro inmediato de colapso.
- Estadio IVa con recubrimiento de cartílago intacto o lesión de cartílago global hasta un grado II («Outer-bridge») y/o lesión de cartílago local hasta un grado III: terapia de preservación de la cabeza (en pacientes con una buena colaboración, sin perfil de riesgo alto) con un intento de reparar el colapso subcondral.
- Estadio IVa con la afectación de la superficie completa del cartílago y todos los estadios > IVa: por regla general, se aplicará una terapia sintomática solo en el caso de realizarse una artroscopia. Las lesiones de cartílago pequeñas de IIIº/IVº grado se pueden alisar y/o microfracturar según su magnitud.
Contraindicaciones
- Contraindicaciones generales de la artroscopia (por ejemplo, falta de capacidad de distracción articular).
- Colapso avanzado de la cabeza femoral y artrosis.
- Relativas: noxas persistentes y/o perfil de alto riesgo; lesión de cartílago extensa/afectación de la superficie completa del cartílago ≥ IIIº de «Outerbridge».
Información para el paciente
- Lesiones del labrum y del cartílago (a causa de la artroscopia, perforación).
- Lesiones de los nervios en función del tipo de abordaje o debido a la tracción.
- Rotura de instrumentos / olvido de material quirúrgico.
- Extracción de sustancia esponjosa del fémur o de la cresta ilíaca (morbilidad por extracción de tejido, sobre todo de la cresta ilíaca).
- Utilización de material sintético de repuesto óseo para el relleno de defectos de depresión mayores («donor site») en el fémur proximal (estadio IIc, IIIc).
- Carga parcial durante 6-12 semanas (10 kg) con ayuda de muletas durante el tratamiento posterior.
- Progresión de la necrosis a pesar del tratamiento quirúrgico, colapso de cabeza femoral, artrosis.
- Riesgos quirúrgicos generales.
Preparación de la intervención
- Examen clínico: rango del movimiento de la articulación de la cadera. Test del labrum (impactación, aprehensión, signos de irritación del trocánter).
- Radiografía convencional: radiografía de la cadera y radiografía axial de la articulación de la cadera afectada para valorar el contorno de la cabeza (interrupción del hueso subcondral, aplanamiento de la cabeza femoral). Estimación de la extensión de cambios escleróticos y císticos (magnitud del curetaje, volumen de la sustancia esponjosa necesaria, duración prevista de la fase de descompresión). Exclusión de cambios óseos concomitantes (displasia, coxa vara epifisaria, atrapamiento por efecto-cam/ pinza) y posibles obstáculos a causa de la artroscopia (estrechamiento del espacio articular, osteofitos).
- RM (sin contraste) de las dos articulaciones de la cadera. En caso de que el contralateral esté afectado, realizamos primero la terapia en el lado más afectado, siempre y cuando sea posible realizar una intervención con preservación de la articulación. Además, también evaluamos el labrum y el cartílago femoral. Exclusión de otras patologías intraarticulares (por ejemplo, cuerpos articulares libres, sinovialitis/ derrame). Representamos mediante imágenes la zona del edema y/o del área necrótica de la cabeza femoral para planificar la intervención.
- Repetición de la toma de imágenes (radiografía/RM), cuando estas tienen más de seis semanas.
- Tratamiento antibiótico perioperatorio (por ejemplo, administración de una sola dosis de una cefalosporina de 2.ª generación).
- Medidas generales de preparación quirúrgica, inclusive afeitado del área a intervenir.
Instrumental
- Mesa extensible (por ejemplo, Orthostar II 1425, de la empresa Maquet GmbH & Co. KG, Rastatt, Alemania). Acolchamiento reforzado de la barra de contra-extensión.
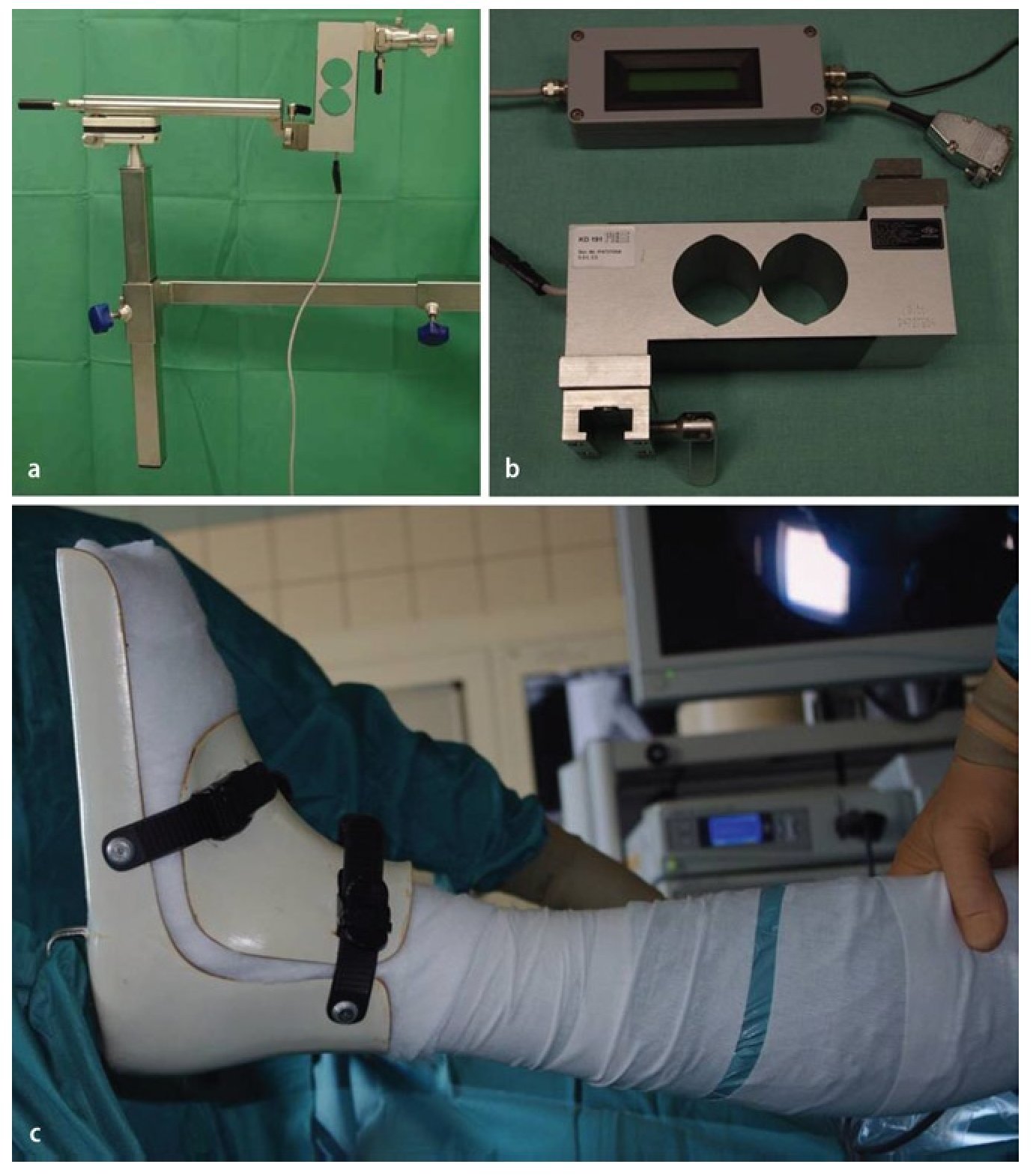
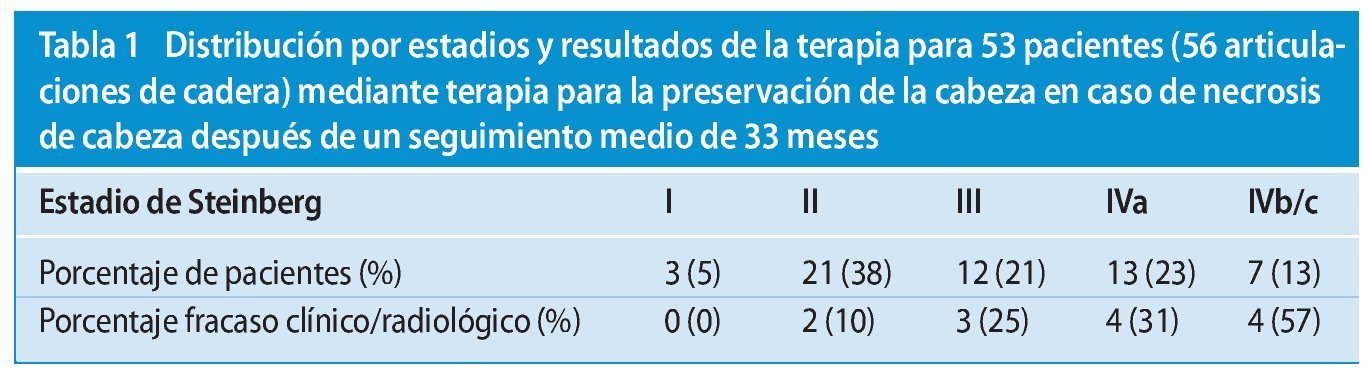
- Soporte para piernas especial con medición de la fuerza de extensión (fabricación especial de la empresa Liebau Orthopädietechnik, Rostock, Alemania; fig. 1).
Fig. 1 Utilizamos un soporte estéril para el pie (a), que permite modificar durante la fase intraoperatoria la posición de la pierna en extensión bajo conservación de la esterilización. Un sensor de fuerza (b) realiza el seguimiento continuo de la posición en extensión de la pierna sujeta en un estribo de extensión y tapada con un vendaje estéril (c).
- Unidad fluoroscópica con funda esterilizada (por ejemplo, de Ziehm Vision, Ziehm Imaging GmbH, Nürnberg, Alemania).
- Set de instrumental para artroscopia de cadera estándar: torre de artroscopia con un ángulo visual de 70º, incluyendo cámara, fuente de luz, sistema de documentación por vídeo, unidad de bomba, shaver y aparatos electrotérmicos.
- Líquido de lavado diluido con norepinefrina (1 ml de artenerol® [1:1.000]; Aventis Pharma, Frankfurt am Main, Alemania) para 1 l de solución de Ringer (Fresenius Kabi Austria, Graz, Austria).
- Instrumental artroscópico, inclusive ganchos palpadores, varillas de cambio, portales Half Pipe® (marca Karl Storz, Tuttlingen, Alemania).
- Perforación: instrumental ASNIS-III s-seriesTM con vainas de perforación, alambres roscados (longitud: 330 mm; diámetro: 3,2 mm), fresas, curetas e impactador para esponjosa (fig. 2). Los alambres roscados permiten la inserción y una extracción cómoda y constante en la misma dirección incluso en casos de esclerosis extendida.
- Extracción de esponjosa y aplicación: instrumentos OATS® (marca Arthrex, Inc., Naples, EE. UU.; fig. 2) para la extracción de cilindros de esponjosa de la cresta ilíaca o de la metáfisis femoral.
Fig. 2 Para el tratamiento del área necrótica utilizamos, entre otros, los instrumentos de la imagen. Instrumental ASNIS III s-seriesTM: los alambres de Kirschner roscados (1) tienen un diámetro de 3,2 mm. La vaina de penetración (2) sirve para la protección del tejido para el alambre central y el taladro central. Mediante vainas de inserción se asegura tanto el guiado de los alambras como de la fresa canulada. La vaina de penetración paralela (3) permite la inserción guiada de otros alambres paralelos al alambre ya insertado. El impactor permite comprimir, por ejemplo, la esponjosa en la cabeza femoral o material de sustitución ósea en la zona de extracción del injerto. Los punzones cilíndricos OATS® (Arthrex, Inc., Naples, USA; 4) permiten la extracción mínimamente invasiva de cilindros de esponjosa y su aplicación en el área ósea cureteada. Cureta (5) para el desbridamiento de la necrosis y/o esclerosis. El medidor de profundidad (6) sirve para determinar la longitud en el caso opcional de usar un tornillo de inducción.
Anestesia y posición del paciente
- Anestesia por intubación.
- Posición de decúbito supino, colocación de la protección radiológica para el paciente, mesa extensible, acolchamiento de la zona de los pies y de la barra de contra-extensión. Alineación de la unidad de extensión, de modo que la pierna a intervenir se pueda colocar posteriormente en posición de ligera abducción y flexión (aproximadamente 10º), así como en rotación neutra. Fijación de la pierna que no se interviene (aproximadamente 30º en abducción, rotación neutra, 0º en extensión) con un soporte para pies en la mesa para la estabilización de la cadera.
- Medición de la fuerza de extensión (KD 191, marca ME Messsysteme, Henningsdorf, Alemania).
- Soporte para el pie (fabricación especial, marca Liebau Orthopädientechnik, Rostock, Alemania). Esta fabricación especial permite el movimiento estéril de la articulación de la cadera con nueva ortesis de extensión, así como la medición de la extensión durante la intervención quirúrgica.
Técnicas quirúrgicas (Figs. 3-12)
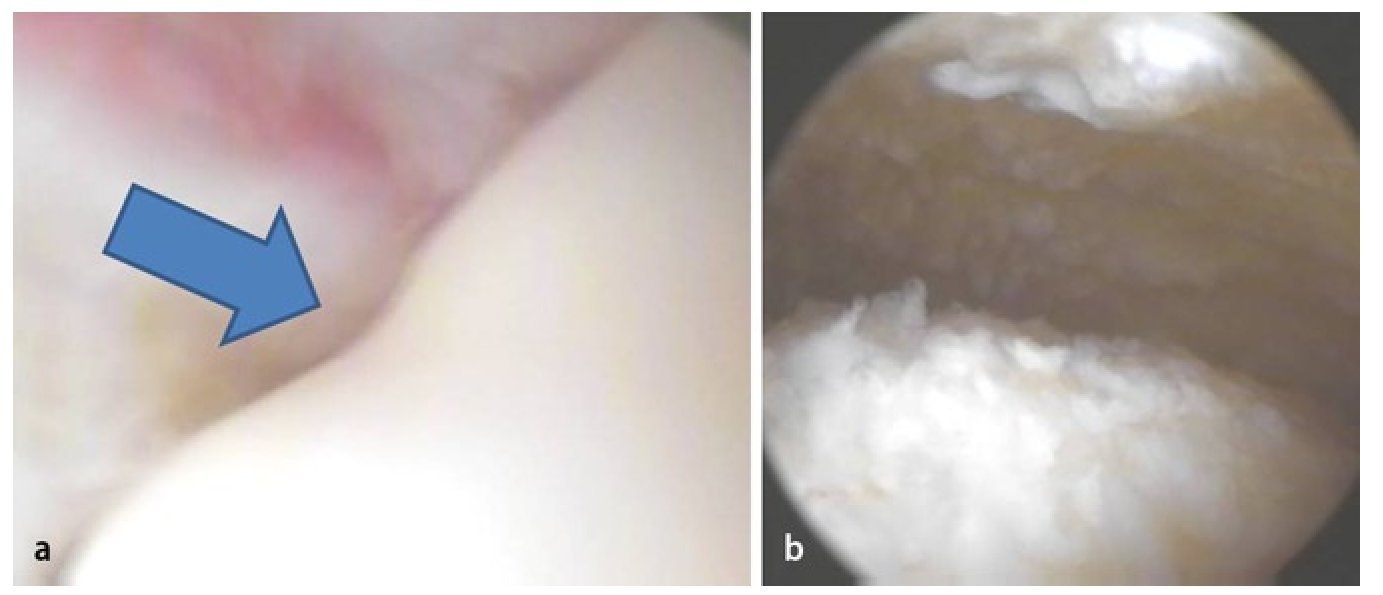
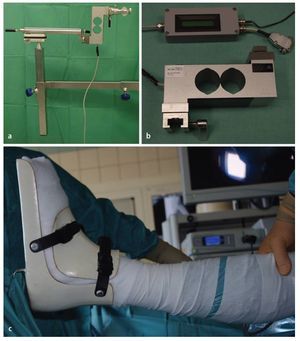
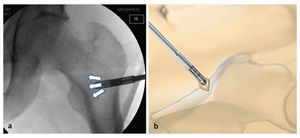
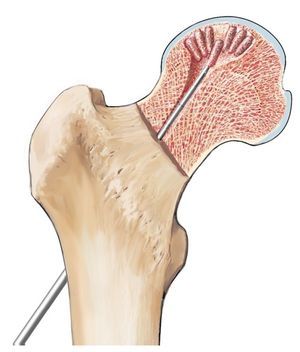
Fig. 3 Vista sobre el portal anterior. Examen mediante gancho palpador de la articulación y verificación de la estabilidad del cartílago -(a) «abolladura» visible y palpable de la cabeza femoral, estadio IVa de Steinberg- así como medición del área del cartílago dañada. En caso de colapso avanzado (b) puede producirse el desprendimiento de la capa cartilaginosa. En este caso, se pueden tratar simultáneamente otras patologías intraarticulares mediante artroscopia.
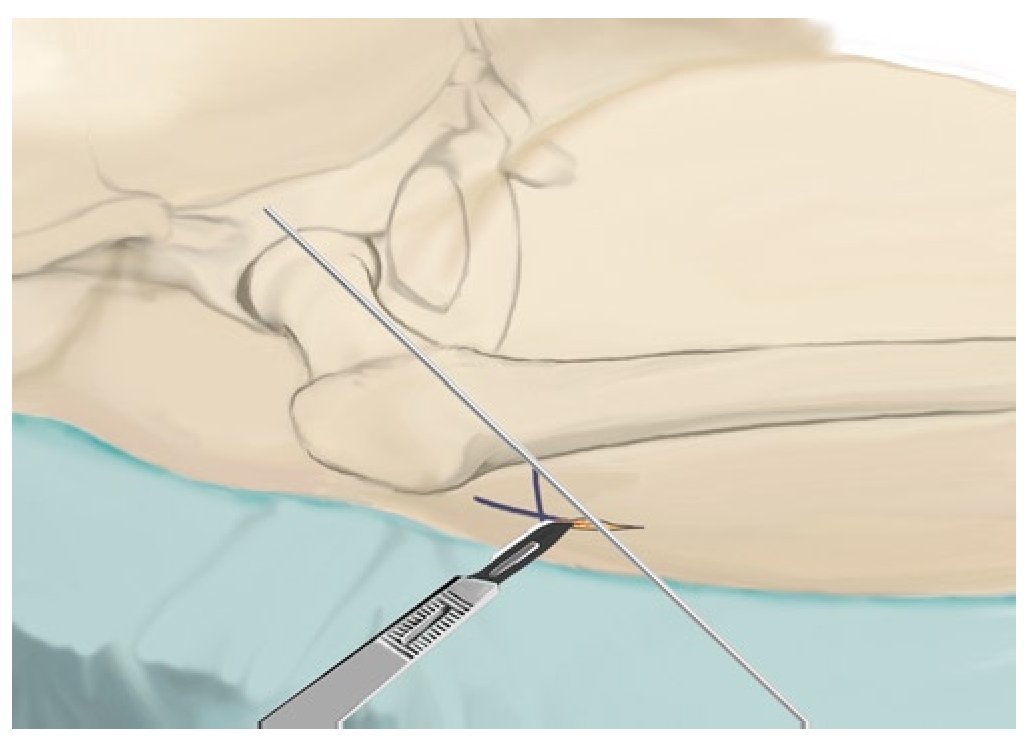
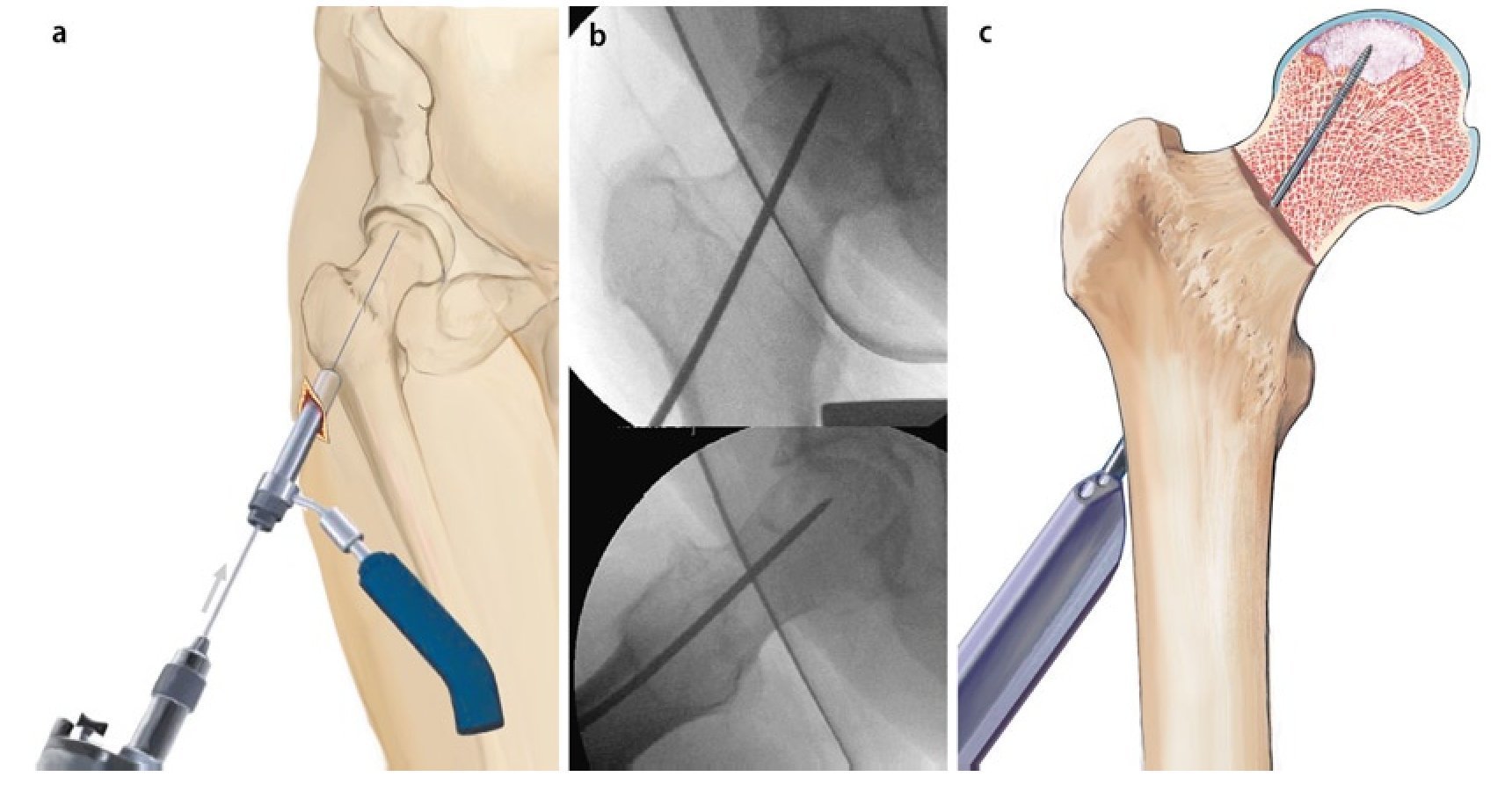
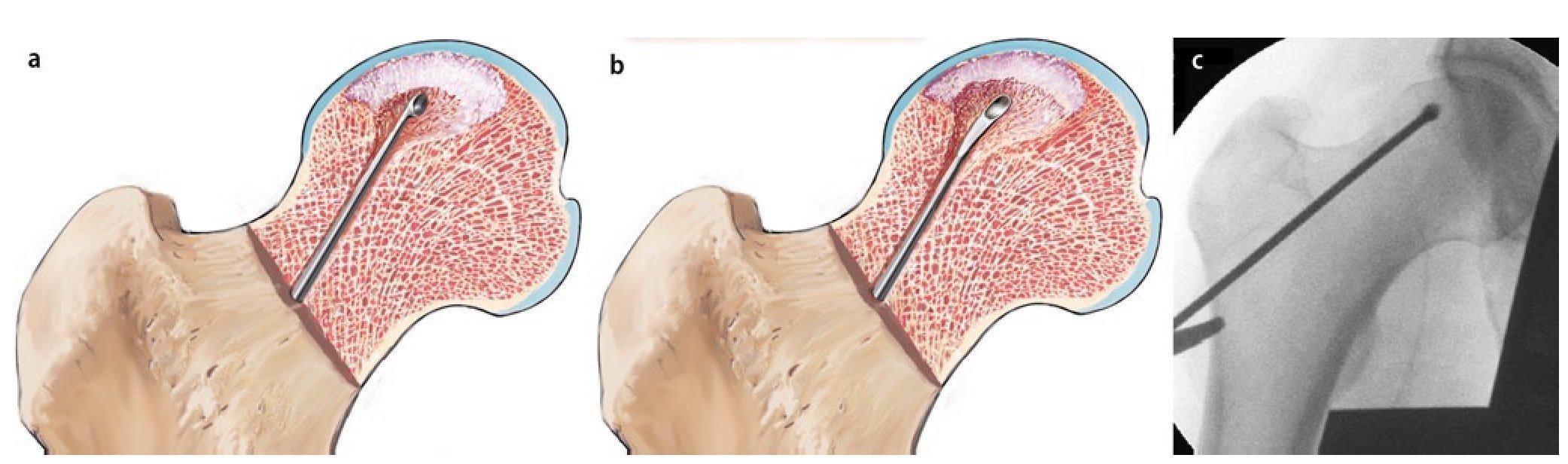
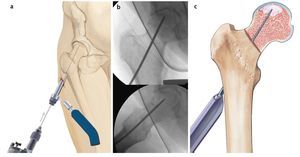
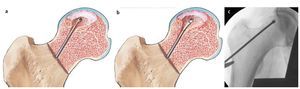
Fig. 4 Se coloca un alambre sobre la cadera de modo que este coincida en la proyección anteroposterior con la posición que se prevé que tomará posteriormente el alambre central. La punta del alambre debería proyectarse hacia el centro de la zona necrótica, el punto de inserción en la cortical lateral tendría que hallarse por debajo del trocánter mayor en la zona de unión con la diáfisis. La incisión cutánea de aproximadamente 4 cm de longitud se iniciará alrededor de la zona de proyección del alambre en el muslo lateral. En caso de presencia de una capa extensa de partes blandas, la incisión cutánea se puede realizar claramente inferior al trocánter palpable. En caso de que la incisión se realice en posición anteroposterior, se deberá tener en cuenta la antetorsión femoral. Posicionamos la pierna en rotación interna, de modo que el cuello femoral se encuentre en posición horizontal y posicionamos la incisión cutánea en la vista lateral en proyección sobre la cortical posterior.
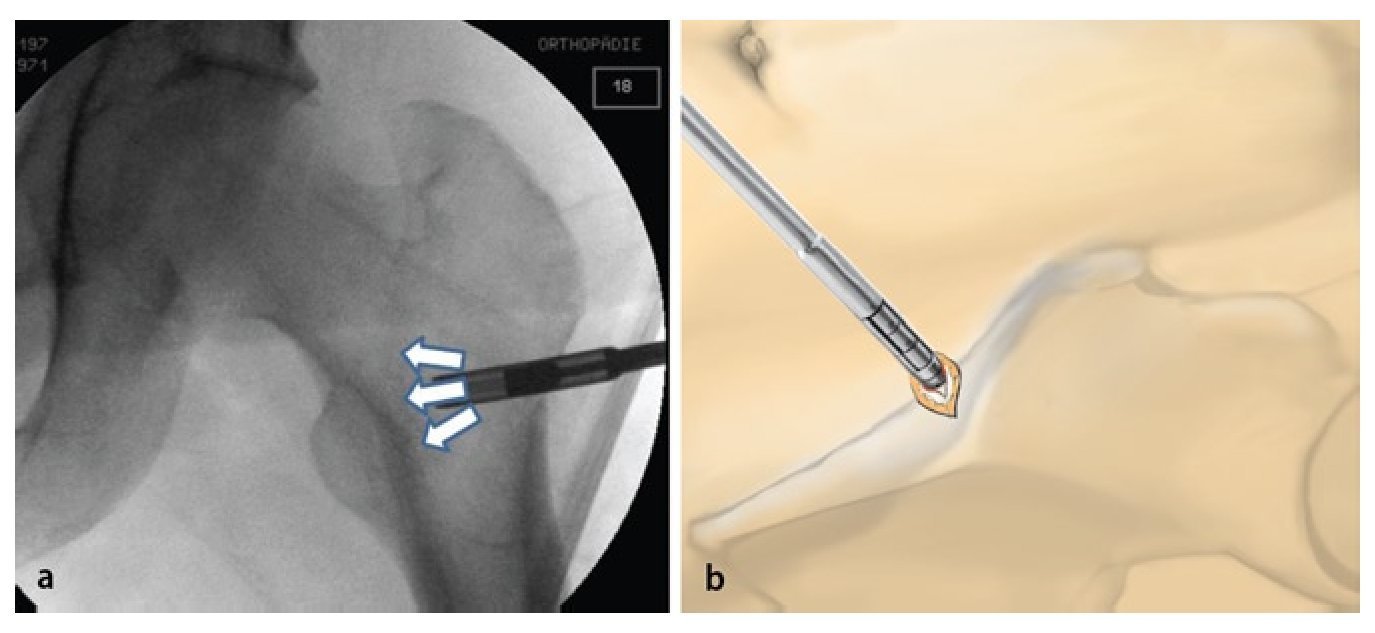
Fig. 5 Se realiza una incisión sobre el tracto iliotibial y el músculo vasto lateral y se divide en dirección de las fibras. El instrumento guía, inclusive la vaina de inserción para el alambre roscado, se coloca sobre la cortical lateral (a). El primer alambre se introduce bajo control fluoroscópico a 2 niveles (a.-p. y axial) en la zona necrótica (b). El objetivo es penetrar hasta lo más profundo posible dentro del foco sin romper el hueso subcondral (evitar posibles lesiones del cartílago). Para asegurar la correcta dirección de perforación, se deberá tener en cuenta la antetorsión del cuello femoral y la posición exacta del foco necrótico en la cabeza femoral (en la mayoría de los casos, el cuadrante anterior-superior). A continuación se puede insertar la vaina de perforación paralela (c).
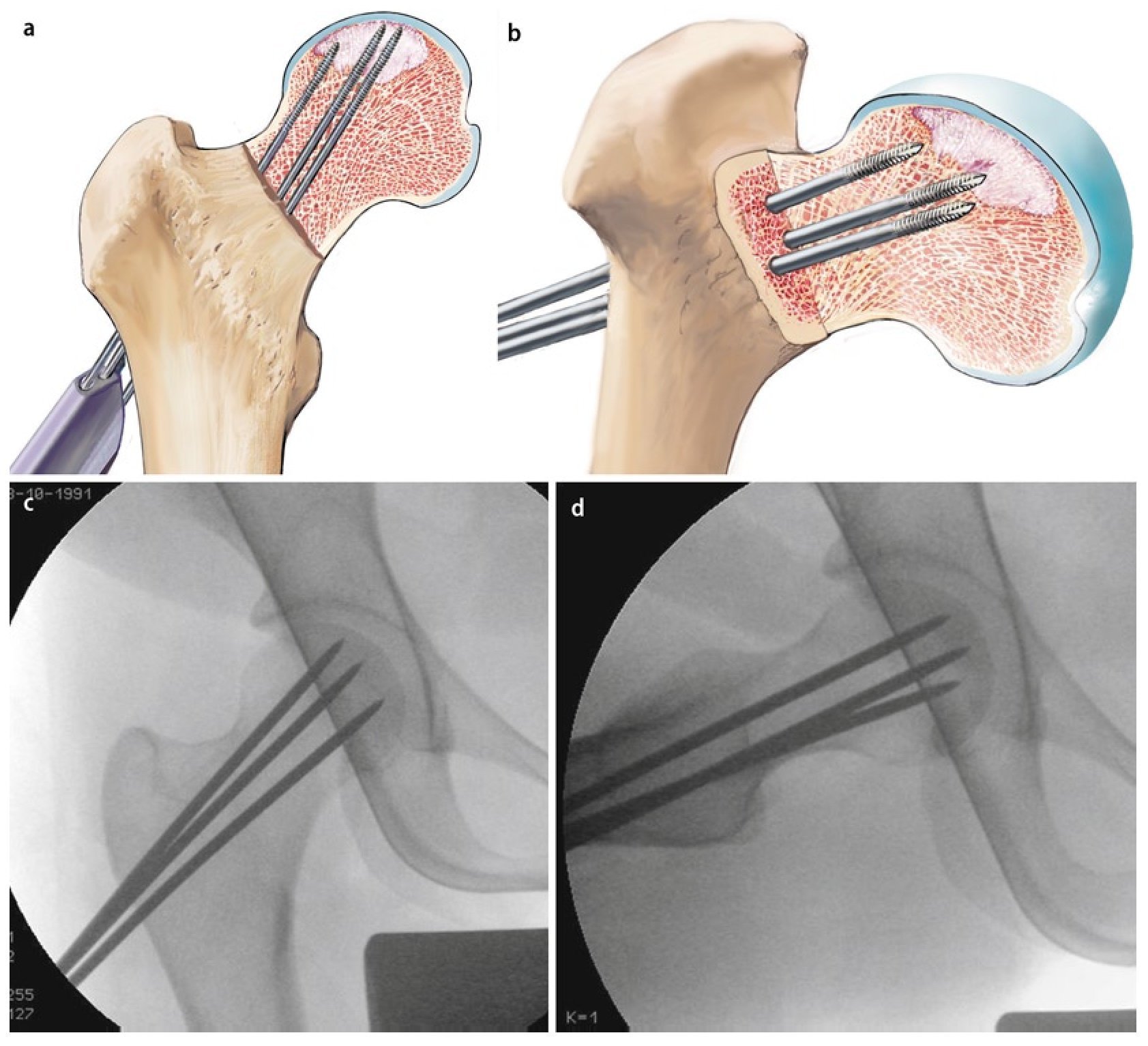
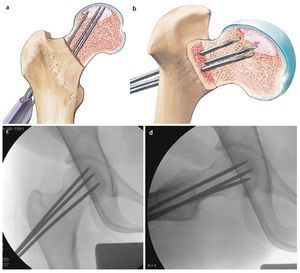
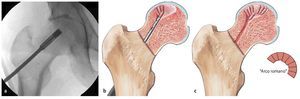
Fig. 6 Después de insertar el primer alambre en posición central, se lleva a cabo la perforación múltiple (a, b) ocupando la vaina de perforación paralela en las posiciones deseadas. De este modo, el instrumental permite reducir el tiempo de control mediante fluoroscopio. El guiado o la penetración suficiente del alambre en la zona afectada tiene como objetivo evitar una posible desviación accidental de la dirección de perforación deseada y, con ello, una rotura de la cortical del cuello femoral. Si no se utiliza la vaina de perforación, se pueden realizar alternativamente múltiples perforaciones divergentes a través de una zona de penetración (c, d) en la cortical lateral.
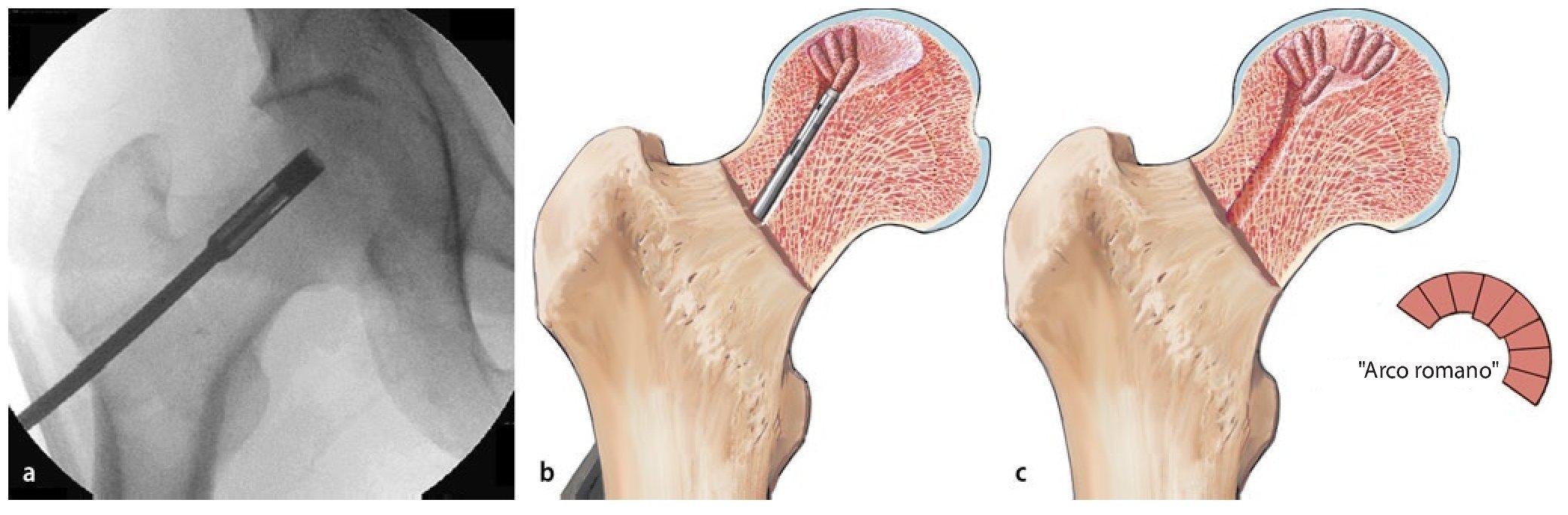
Fig. 7 El alambre central es sobreperforado después de extraer la vaina de perforación (a). Para ello se pueden utilizar varias brocas canuladas (4,9 mm, 6,5 mm, 8,0 mm), que se pueden usar con el instrumento guía. Para el curetaje y plombaje de focos de mayor tamaño suele ser necesaria una broca de 8 mm (b). Durante la sobreperforación se pondrá atención de que la broca y el alambre no se descentren. En caso de que ello suceda, el alambre roscado podría girar durante la sobreperforación y perforar el fémur. Tras la sobreperforación se extrae el alambre de perforación central.
Fig. 8 Para la extracción de esponjosa utilizamos el sistema OATS®. Si es preciso, se rellenarán varios punzones cónicos de 6 y 7 mm. De la metáfisis femoral se pueden extraer entre dos y tres cilindros en forma de abanico (a), siempre y cuando en la resonancia magnética no se observe ningún indicio de necrosis o ninguna zona con edema. Mediante un abordaje «mini-open», por ejemplo, se pueden extraer más cilindros de esponjosa de la cresta ilíaca anterior (b).
Fig. 9 Para el curetaje son apropiadas cucharas afiladas (a) y curetas especiales (b). Mediante una fresa de bola (c) se puede extraer una cantidad de esclerosis severa de manera que sea posible la revascularización de la esponjosa introducida. Se deberá evitar debilitar más el hueso subcondral con el curetaje.
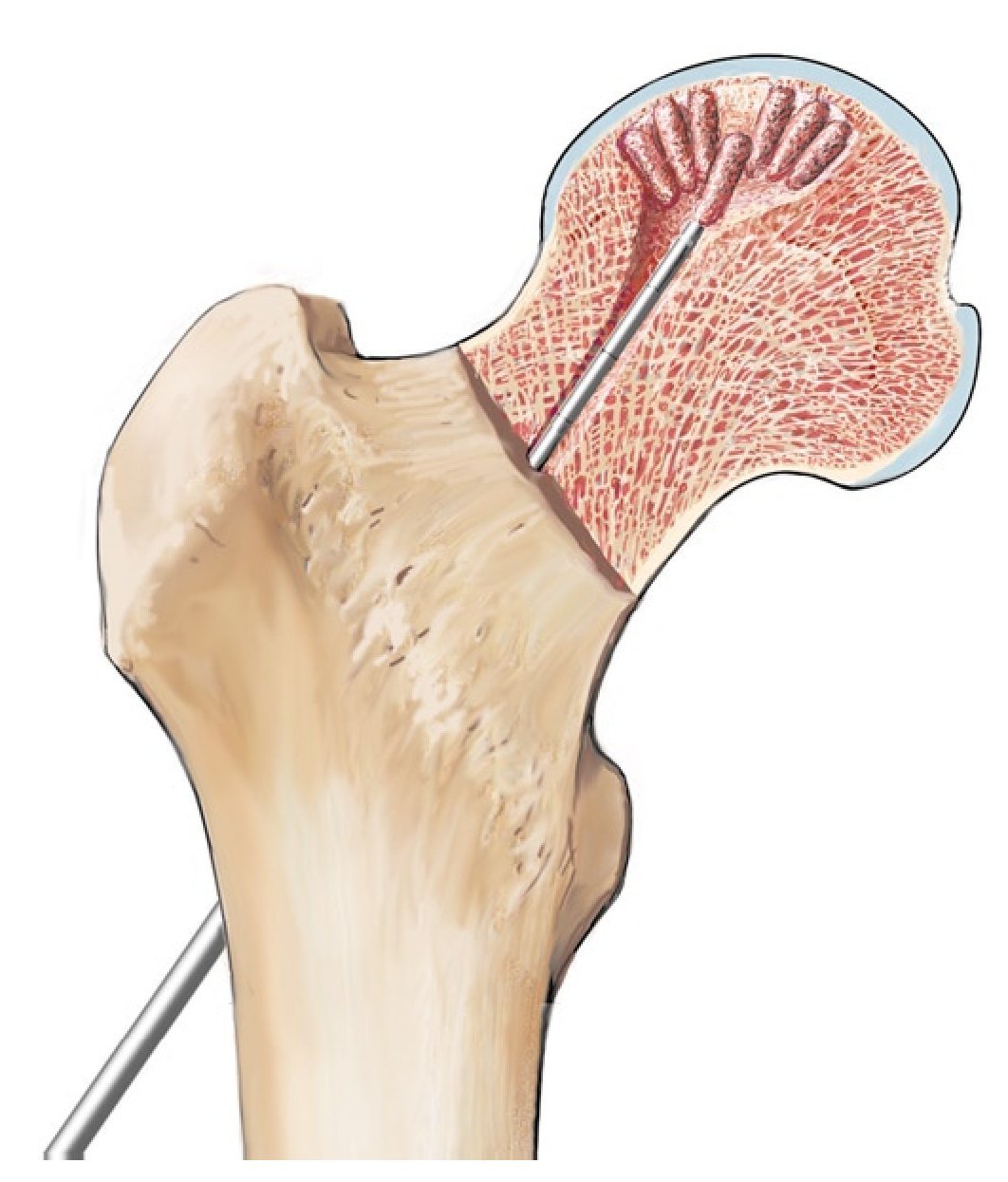
Fig. 10 Los punzones cilíndricos OATS® más pequeños pueden introducirse en el canal de perforación de 8 mm en direcciones diferentes, de modo que los cilindros de esponjosa rellenen finalmente el defecto (a, b). La disposición de la esponjosa en forma de arcos romanos (c), aumenta la capacidad de carga de la trasplantación de esponjosa. Para no obstaculizar la revascularización, los cilindros de esponjosa no se deberían comprimir en exceso tras su inserción.
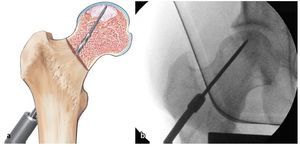
Fig. 11 En el estadio IVa de Steinberg se comprime la esponjosa con un impactador bajo control fluoroscópico directamente por debajo de la zona de colapso y se estabiliza el hueso subcondral. Para ello, la pierna se posiciona de modo que el segmento a restaurar del hueso subcondral esté en contacto con la superficie articular acetabular. Mediante esta estructura es posible reducir el riesgo de una sobrecorrección con las consiguientes lesiones del cartílago. El informe final debería incluir las imágenes del fluoroscopio en dos planos para documentar que el defecto en la cabeza femoral ha sido suficientemente rellenado. En algún caso especial, por ejemplo, después de la restauración de la esfericidad (Steinberg IVa), se puede realizar de modo complementario un examen artroscópico final. Con la posición presentada, solo se deberá fijar de nuevo el soporte para pies y montar la extensión. No es necesario cubrir la zona con un vendaje estéril. Particularidad: procedimiento para electroterapia invasiva (opcional).
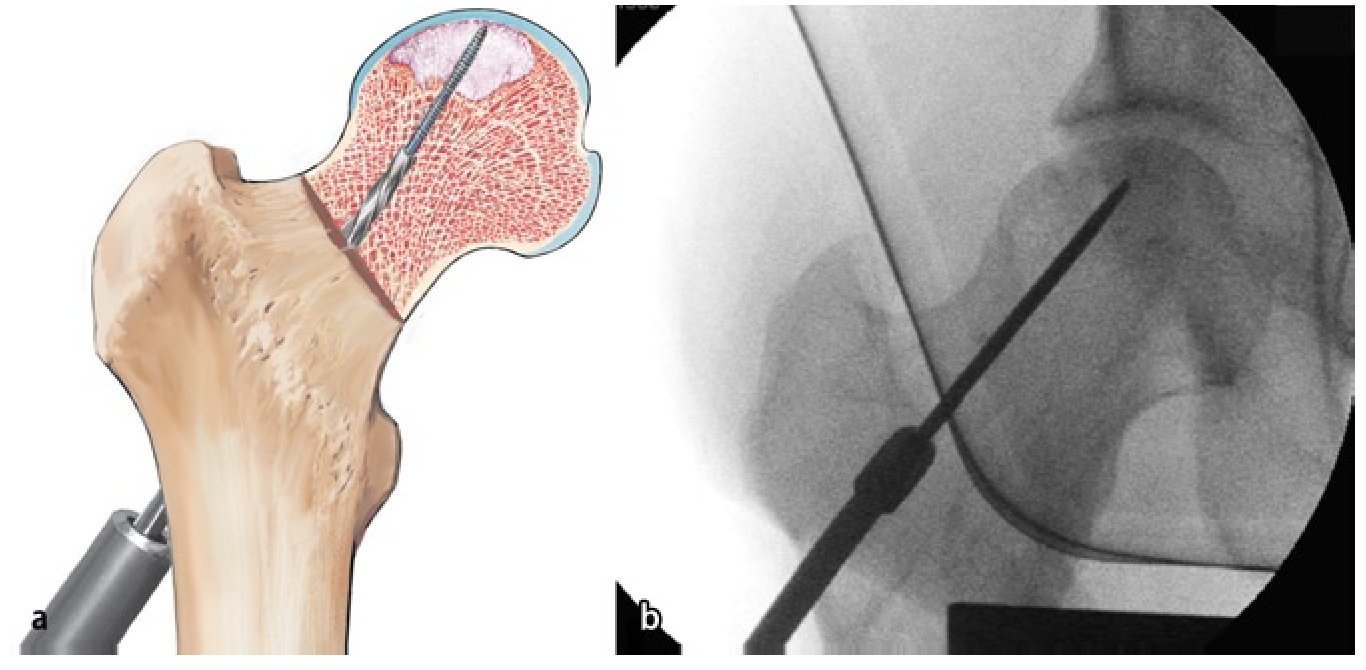
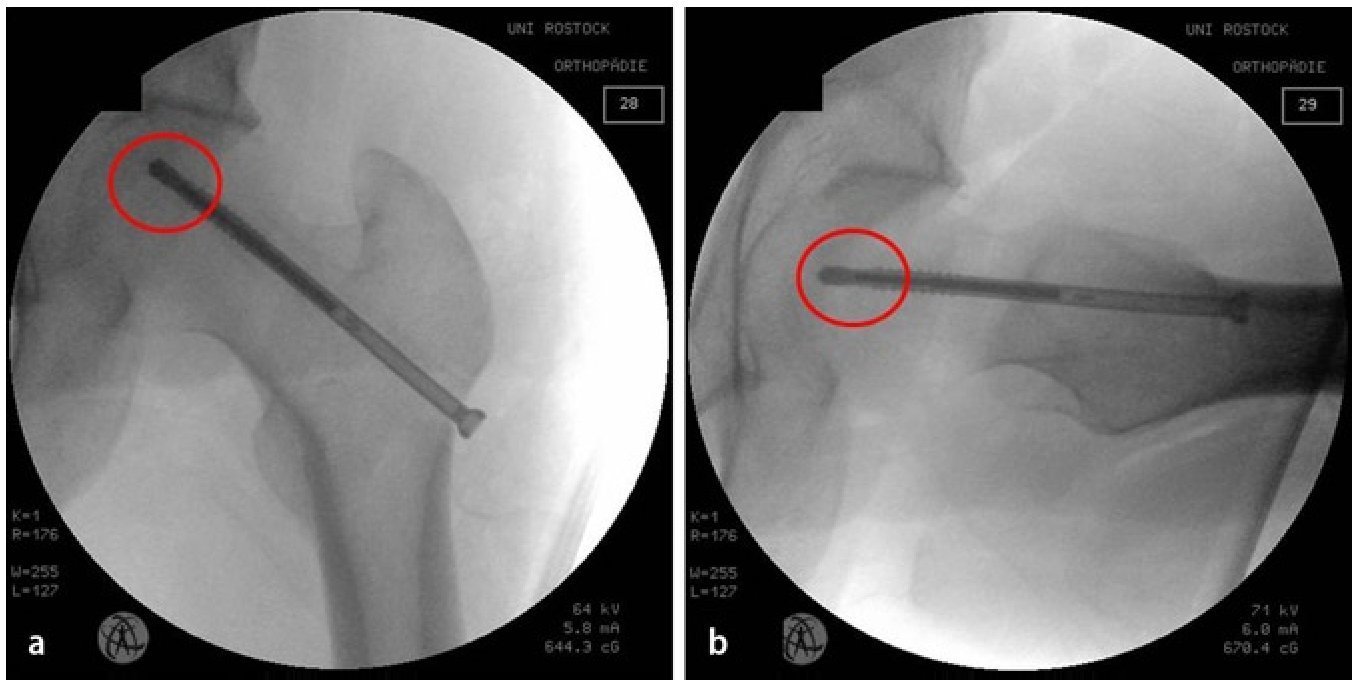
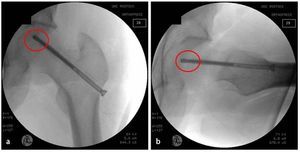
Fig. 12 Opcionalmente (estadios II y III de Steinberg): estimulación eléctrica para la regeneración ósea interna (ASNIS III s-seriesTM; tornillo canulado de 6,5 mm, marca Stryker Trauma GmbH, Schönkirchen, Alemania) con bobina externa (Neue Magnetodyn GmbH, Munich, Alemania). El medidor de longitud (fig. 2) sirve para determinar la longitud cuando se utiliza el tornillo de inducción. El objetivo es posicionar posteriormente la punta activa del tornillo en la zona central de la anterior área necrótica. La dirección del orificio central (fig. 7) corresponde a la futura posición del tornillo de inducción en ambos planos (a, b).
Tratamiento postoperatorio
- Tratamiento farmacológico: heparina de bajo peso molecular durante la fase de carga parcial.
- Estadios I, IIa/b de Steinberg (focos pequeños y medianos): carga parcial de 10 kg durante seis semanas con ayuda de muletas y, a continuación, aumento de la carga durante dos semanas. Se permite la realización de ejercicios libres activos y pasivos.
- Estadios IIc, IIIc, IVa de Steinberg (foco grande por debajo de la zona de carga principal e inicio de colapso): carga parcial prolongada a doce semanas. Se permite la realización de ejercicios libres activos y pasivos.
- Particularidad: en caso de presencia de patologías intraarticulares concomitantes, se modificará el tratamiento posterior según la terapia realizada.
- Cortar los extremos de los hilos del material de sutura reabsorbible a partir del día 12 postoperatorio.
- Control radiológico postoperatorio antes de autorizar la carga total al paciente.
Errores, riesgos y complicaciones
- Lesión temporal del nervio pudendo provocada por la posición de la pierna y/o presión sobre el nervio: proceso de observación.
- Morbilidad de extracción en caso de extracción ósea (fractura de cresta ilíaca, posible fractura femoral en lesiones de la cortical media o debida a un punto de inserción demasiado distal en la cortical lateral): tratamiento conservador u osteosíntesis en función del diagnóstico según el tipo de fractura.
- Rotura de material durante la artroscopia o el curetaje/plombaje, sobre todo en casos de esclerosis extensa: se deberán extraer los cuerpos extraños intraarticulares. En caso de presencia de cuerpos extraños en el cuello o en la cabeza femoral se evaluarán las ventajas y los inconvenientes potenciales de su extracción.
Resultados
Desde junio de 2004 hasta junio de 2009 se intervino quirúrgicamente a 56 pacientes (59 articulaciones de la cadera) con necrosis de cabeza femoral mediante una técnica de preservación de la articulación. Tres pacientes fueron intervenidos en ambas caderas en un intervalo de ocho semanas. El seguimiento posterior se basó en el control clínico y radiológico e incluyó a 53 pacientes (56 articulaciones de cadera). A dos pacientes no se les pudo localizar y otro paciente había fallecido de infarto de miocardio. Las causas del fracaso de la terapia para la preservación de la articulación se atribuyeron a la implantación de una prótesis total de cadera, a la implantación inminente de una prótesis total de cadera y a cualquier tipo de intervención quirúrgica en la articulación de la cadera, así como a la aparición de nuevas molestias en la cadera con progreso radiológico de la necrosis.
Los pacientes de nuestro grupo fueron sometidos a seguimiento durante un tiempo medio de 33 ± 20 meses (12- 74 meses) durante el postoperatorio (distribución por sexos: v:m = 39:14; edad: 44 ± 8,2 años [18-57 años]; BMI: 27 ± 5,89).
La distribución por estadios de los pacientes según Steinberg, así como el tiempo de tratamiento posterior medio (parte porcentual / meses), resultó ser:
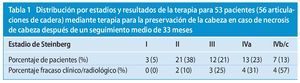
- Estadio I: 3 pacientes (5%/17 meses) - Estadio II: 21 pacientes (38%/ 35 meses)
- Estadio III: 12 pacientes (21%/ 40 meses)
- Estadio IV: 20 pacientes (36%/ 30 meses) tratados mediante terapia de preservación de la cabeza, de los que 13 (23%) estaban en el estadio IVa y 7 (13%) en el estadio IVb/c
Durante el tiempo que duró nuestro estudio, todos los pacientes en el estadio II, III y IVa fueron tratados también con tornillos ANISTM, además del esquema de tratamiento descrito. Los casos de grandes defectos de esponjosa en el fémur proximal fueron rellenados con material de sustitución ósea (todos los estadios IIc, II-Ic, IVc). En total, 28 pacientes (50%) sufrieron una afectación en la cadera contraria, de los que solo 3 obtuvieron la indicación para ser sometidos a una terapia para la preservación de la articulación.
Se indicó una artroscopia de la articulación de cadera a 33 pacientes en total. A causa de los diagnósticos resultantes, a 7 pacientes (21%) no se les pudo aplicar ninguna terapia para la preservación de la articulación mediante curetaje/plombaje. Los pacientes fueron excluidos del estudio con la condición de que, en caso de que así se indicara, se sometieran a un tratamiento endoprotésico.
El fracaso de la terapia para la preservación de la articulación según los criterios arriba indicados se distribuye entre los estadios I-IV de Steinberg de la siguiente manera:
- Estadio I: 0 pacientes (0%)
- Estadio II: 2 pacientes (10%)
- Estadio III: 3 pacientes (25%)
- Estadio IVa: 4 pacientes (31%)
- Estadio IVb/c: 4 pacientes (57%)
La terapia para la preservación de la cabeza fracasó totalmente en el 14% de las articulaciones de cadera intervenidas. La tasa de éxito fue del 86% para todos los pacientes con necrosis de cabeza femoral previa al colapso después de un promedio de 33 ± 20 meses (12-74 meses). Los resultados se muestran en la tabla 1.
Entre las complicaciones que aparecieron se dio una lesión temporal por presión del nervio pudendo (2,6%; sin medición de la extensión) con disminución completa y una osificación heterotópica (2,6%; Brooker II) como consecuencia de la artroscopia de cadera. (Complicación como consecuencia de la extensión descrita en 4,5,7).
Tanto en los estadios previos al colapso (hasta Steinberg III incluido) como en el estadio post-colapso precoz (Steinberg IVa) se consiguieron buenos resultados con la técnica presentada en este estudio, también en cuanto a los datos que se encuentran en la literatura16,21 y teniendo en cuenta el tiempo de seguimiento, relativamente corto. En el estadio precoz del colapso de la cabeza femoral es justificable todavía intentar aplicar un tratamiento para la preservación de la articulación. En los casos de colapso extendido (estadios IVb/c de Steinberg), entre nuestro grupo de pacientes se observó una tasa de fracaso claramente mayor en comparación con los estadios más precoces. Por tanto, en estos casos no está indicado aplicar una terapia para la preservación de la articulación mediante el procedimiento descrito.
Conflicto de intereses. El autor del presente trabajo declara que no existe ningún conflicto de intereses para él ni para los co-autores.
Correspondencia
Dr. M. Ellenrieder
Orthopädische Klinik und Poliklinik, Universität Rostock
Doberaner Str. 142, 18057 Rostock (Alemania)
martin.ellenrieder@uni-rostock.de