Introducción
La causa de la osteomielitis de columna puede ser de origen bacteriano y no bacteriano. Dados los síntomas inespecíficos, el diagnóstico precoz es un desafío para el tratamiento médico3. Los déficit neurológicos son previsibles en más del 50% de los pacientes. Dada la naturaleza destructiva de la espondilitis, la estabilidad de la columna vertebral está comprometida y conduce a la lesión de las estructuras neurales5.
Un abordaje anterior permite un desbridamiento radical y una eliminación de todo el foco inflamatorio, así como del tejido necrótico. El defecto resultante ha de rellenarse para restaurar la alineación espinal y asegurar la estabilidad2,6,9.
No existe consenso en la bibliografía sobre el material óptimo para la sustitución vertebral. Para rellenar el defecto, es preferible hueso autólogo2,6,8. Con frecuencia, postoperatoriamente aparece un desplazamiento, una fractura o la reabsorción del injerto insertado7,9.
Por esta razón, nosotros hemos adoptado el recambio del cuerpo vertebral con un cilindro de titanio MOSS® descrito por Stolze y Harms8.
Principios quirúrgicos y objetivos
Abordaje transtorácico derecho (T2-T10), dos costillas por encima de la vértebra afectada o un abordaje retroperitoneal transpleural izquierdo (T11-T12) a la vértebra afectada. Resección radical de todo el tejido inflamatorio, secuestro óseo y absceso. Relleno del defecto con un cilindro MOSS® de titanio rellenado con hueso autólogo procedente de la cresta ilíaca o de la costilla extirpada utilizándolo como un espaciador y estabilizador. Dependiendo de la extensión y del grado de destrucción, se añade una instrumentación anterior o posterior (fig. 1). Restauración de la forma y función indolora de la columna, así como prevención y eliminación de los déficit neurológicos.
Figuras 1 a-c. Representación esquemática del principio quirúrgico.
a) Preoperatoriamente. b) Tras la completa resección de los tejidos inflamatorios y el secuestro. c) Inserción del cilindro de titanio MOSS® rellenado con hueso esponjoso autógeno.
Ventajas
* Cura rápida de la espondilitis y consolidación ósea.
* Prevención o corrección de la desalineación de la columna.
* Estabilidad inicial elevada.
* Movilización precoz sin necesidad de sostén.
* Estancia hospitalaria corta.
Desventajas
* Riesgo quirúrgico elevado debido al abordaje anterior.
* Necesidad de ingreso en unidad de cuidados intensivos.
* Coste elevado del implante.
Indicaciones
* Espondilitis específica e inespecífica con importante destrucción de un cuerpo vertebral y/o déficit neurológico.
* Formación de un absceso importante.
* Curso progresivo a pesar de un adecuado tratamiento conservador.
* Dolor persistente o creciente.
Contraindicaciones
* Mal estado general secundario a otras enfermedades.
Información al paciente
* Explicación del abordaje.
* Riesgos quirúrgicos habituales, como infección, hematoma, tromboflebitis y embolismo.
* Riesgo de lesión de grandes vasos o pulmón.
* Riesgo de lesión de estructuras neurales que pueden provocar déficit neurológicos, incluyendo la posibilidad de paraplejía.
* Fallo del implante con rotura del metal y desplazamiento.
* Ausencia de fusión.
* Riesgos asociados a transfusiones de sangre (hepatitis, infección por el VIH).
* Dolor y formación de hematoma.
* Lesión del nervio femorocutáneo y hernia de la pared abdominal en el lugar de extirpación del hueso.
* En general, reposo en cama postoperatorio durante 4 días.
* En ausencia de complicaciones, se puede dar el alta del hospital a los 14 días.
Evaluación preoperatoria
* Radiografía de la columna dorsal en 2 planos.
* RM para determinar la extensión del proceso inflamatorio, incluyendo cambios en los tejidos blandos.
* Estudios neurológicos y de velocidad de conducción nerviosa.
* Disponibilidad de 4 a 6 unidades de sangre.
* Ingreso en unidad de cuidados intensivos.
* Administración de enema la noche anterior a la cirugía.
* Rasurado de la zona quirúrgica inmediatamente antes de la cirugía.
* Colocación de catéter y tubo de Levine.
* Colocación de vía venosa central.
* Disponibilidad de escopia.
Instrumental quirúrgico e implantes
* Bisturí eléctrico bipolar.
* Separador de costilla autoajustable y separador pulmonar.
* Gubias, curetas, punzones, pinzas, escoplos para desbridamiento.
* Distractor intersomático.
* Caja de titanio MOSS® (De Puy-Motech, De Puy Orthopädie, Mellinweg 16, 66820 Sulzbach, Alemania), forma oval, diámetro 17 x 22 mm, 22 x 28 mm, 26 x 33 mm, variando la longitud entre 10 y 90 mm.
* Cizalla y pinza para manipular el implante de titanio (DePuy- Motech).
* Caja opcional para estabilización anterior.
* Opcional: tornillos pediculares y sistema de barras para estabilización posterior.
Anestesia y colocación
* Anestesia endotraqueal utilizando un tubo de doble luz.
* Decúbito lateral izquierdo con almohada bajo el flanco izquierdo.
* Ligero descenso de la parte de los pies de la mesa de operaciones para la extensión lateral de la columna.
Técnica quirúrgica
Figuras 2 a 17
Abordaje transtorácico para la espondilitis T8/91 (figs. 2-13)
Figura 2. Incisión cutánea curvilínea caudal a la escápula siguiendo la sexta costilla; se inicia un palmo lateral a la apófisis espinosa y se finaliza en la articulación costovertebral. Palpación y enumeración de costillas.
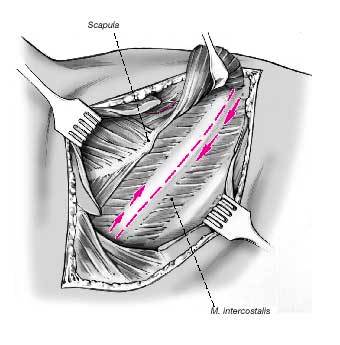
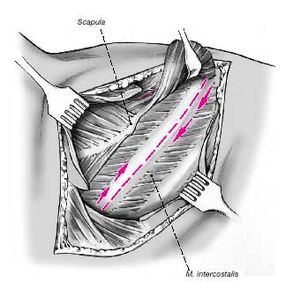
Figuras 3a y b. El músculo dorsal ancho es dividido completamente y tan caudal como sea posible transverso a la dirección de sus fibras para proteger el nervio toracodorsal.
Figura 4. División del músculo serrato anterior, también tan caudal como sea posible, y determinación de la sexta costilla.
Figura 5. El periostio de la costilla se separa longitudinalmente con un bisturí eléctrico. Se libera de los músculos intercostales desde el borde craneal de la costilla de posterior a anterior y desde el borde caudal de anterior a posterior.
Figura 6. Separación cuidadosa de los tejidos blandos restantes de la costilla con un periostótomo de costilla.
Figura 7. Extirpación de un segmento de costilla de 10 a 12 cm en su parte anterior utilizando un costótomo.
Figura 8. Incisión de la pleura y apertura del tórax.
Figura 9. Inserción del separador de costilla y apertura cuidadosa de la caja torácica. Retracción medial del pulmón con la espátula pulmonar. Marcado de la altura craneal y caudal de la resección vertebral con agujas utilizadas para aspiración con ayuda de escopia. La envoltura vertebral de la pleura es incidida entonces sobre la línea media del cuerpo vertebral, ligadura y división de los vasos segmentarios.
Figura 10. Exposición de la zona de inflamación, extirpación radical del hueso necrótico y tejidos blandos inflamados, incluyendo el absceso con gubia, diversas curetas y escoplos, punzones y pinzas hasta llegar a visualizar el hueso esponjoso vital y bien vascularizado. Las superficies de resección del cuerpo vertebral se nivelan con un cincel. Los tejidos resecados y el líquido del absceso se remiten para su análisis microbiológico. En presencia de una compresión de la médula espinal, se realiza un amplia exposición anterior del canal espinal y, si es necesario, una extirpación del tejido cicatrizal que comprime el saco dural.
Figura 11. Después de la medición del tamaño del defecto, se coloca convenientemente un cilindro de titanio MOSS®, rellenado con hueso auntólogo extraído de la cresta ilíaca o resecado de la costilla, e insertado después de la distracción intervertebral. Tras la liberación del distractor, las láminas serradas del espaciador impactan en la superficie esponjosa de la vértebra. Inserción de una esponja de colágeno cargada de gentamicina (como Sulmycin®, Essex Pharma GMBH, Thomas-Dehler-Strasse 27, 81731 München, Alemania). Inserción de un drenaje torácico.
Figura 12. Suturas con puntos simples que aproximan las costillas vecinas, el periostio y los músculos intercostales, cerrando entretanto la pleura al mismo tiempo.
Figura 13. Sutura continua del serrato anterior y el dorsal ancho, incluyendo la fascia muscular. Cierre del tejido celular subcutáneo y la piel. Conexión del drenaje torácico a aspiración sellada con agua.
Consideraciones especiales
Si la sustitución de la parte anterior del cuerpo vertebral no es lo suficientemente estable, está indicada una instrumentación posterior. Éste es el caso en la espondilitis de la columna dorsal media y más caudal (T7-T12). La estabilización posterior puede ser realizada en el mismo tiempo, lo que es preferible, o más tarde. La decisión depende de las condiciones del paciente y debe tomarse después de consultarlo con el anestesista. Si la estabilización se realiza inmediatamente después de la implantación del espaciador, es necesario realizar un cambio completo de ropa del personal involucrado, el cual debe volverse a lavar y utilizar un nuevo juego de tallas.
Instrumentación posterior para la espondilitis T8/9
(figs. 14-17)
Figura 14. Posición en decúbito prono. Paciente con soportes de bastidor o almohadas.
Figura 15. Campo operatorio tras la incisión de la piel, tejido subcutáneo y fascia muscular. Los músculos han sido rechazados con un periostiótomo de Cobb.
Figura 16. Localización de los pedículos y determinación del punto de entrada de los tornillos pediculares en el cuerpo vertebral.
Figura 17. La instrumentación se extiende desde la vértebra craneal intacta a la vértebra caudal intacta. Después de completar la artrodesis, se realiza un control radiológico con escopia en dos planos. Colocación de dos drenajes. Cierre de la herida por planos, vendaje estéril.
Tratamiento postoperatorio
* El día 1 el paciente empieza con ejercicios activos y pasivos en cama. Retirada del catéter el día 2 y de los drenajes torácicos el día 4. Al paciente se le permite ahora levantarse de la cama, en general sin ortesis.
* Alta del hospital al inicio de la semana 3, con la condición de que el estado neurológico no dé lugar a preocupaciones. En presencia de paraplejía el alta depende del grado de cuidados que necesite el paciente. Se recomienda el traslado a una unidad de rehabilitación especialmente equipada.
* Para las infecciones inespecíficas, los antibióticos son administrados dependiendo de los estudios de sensibilidad hasta que los parámetros de inflamación retornen a los valores normales (velocidad de sedimentación, proteína C reactiva), generalmente durante 6 semanas. Para infecciones específicas, los tuberculostáticos son administrados al menos durante 6 meses. Nosotros preferimos un tratamiento combinado de isoniacida, rifampicina, pirazinamida y etambutol durante 2 meses, seguido de isoniacida y rifampicina durante otros 4 meses.
* Control radiológico en dos planos inmediatamente después de la cirugía; radiografía de tórax tras la retirada del drenaje torácico para descartar un neumotórax. Otra radiografía de tórax mientras el paciente esté todavía en el hospital. Control radiológico de la columna dorsal a las 6 semanas, y a los 3, 6 y 12 meses.
Errores, riesgos, complicaciones
* Lesión pulmonar: sutura inmediata.
* Lesión vascular: taponamiento o sutura vascular. Consultar con el cirujano vascular si es necesario.
* Lesión de la duramadre: sutura de la dura y aposición de tejido graso que se unirá a la sutura con una cola de fibrina (Tissucol®, Baxter Hyland Immuno Division, Im Breitspiel 13,69126 Heidelberg, Alemania).
* Resección incompleta del tejido inflamatorio y progresión de la infección: revisión tras la RM; repetir el desbridamiento e inserción de una esponja de colágeno cargada de gentamicina.
* Hemotórax: revisión y evacuación del hematoma. Búsqueda y eliminación de la fuente de sangrado.
* Neumotórax: repetir el drenaje torácico.
* Emplazamiento incorrecto o desplazamiento del cilindro de titanio MOSS®: revisión y emplazamiento correcto bajo escopia.
Resultados
Entre octubre de 1995 y noviembre de 2000 operamos a 19 pacientes (3 mujeres y 16 varones, con una media de edad de 63 (43-79) años; tabla 1) afectados de espondilitis de la columna dorsal (figs. 18-21). Además, en 12 pacientes se realizó una instrumentación posterior y en uno una laminectomía. En otros 2 pacientes se logró una estabilización mediante un tornillo-barra insertado anteriormente. La elección del procedimiento dependió de la extensión y el grado de la infección.
Figura 18. Paciente de 63 años. La radiografía anteroposterior pone de manifiesto una espondilitis de T12.
Figura 19. El mismo paciente de la figura 18. RM ponderada en T2, plano sagital. Cambios en la intensidad de la señal en T11-L1.
Figura 20. Radiografía anteroposterior postoperatoria tras sustitución del cuerpo vertebral por vía anterior y artrodesis posterior.
Figura 21. Radiografía lateral postoperatoria tras sustitución del cuerpo vertebral por vía anterior y artrodesis posterior.
El intervalo entre el inicio de la aparición de síntomas y la cirugía alcanzó una media de 8 (1-20) semanas. El lavado intraoperatorio demostró la presencia de Staphylococcus aureus (infección inespecífica) en 8 pacientes, y en tres pacientes la cirugía fue hecha por tuberculosis (infección específica). Candida albicans, Pseudomonas aeruginosa, Staphylococcus epidermidis y Enterococcus se encontraron cada uno en un paciente. El cultivo de 4 pacientes fue negativo.
La única complicación intraoperatoria registrada fue una lesión del saco dural en un paciente parapléjico (Frankel grado B4; tabla 2). El paciente falleció a causa de un accidente cerebrovascular. Fue necesario la revisión en un paciente a causa de un hemotórax; sufrió un embolismo pulmonar postoperatorio debido a una trombocitopenia tipo II inducida por la heparina.
Se observó un neumotórax, que remitió después de renovar la instalación del tubo torácico.
Un paciente con insuficiencia renal sometido a diálisis falleció en el postoperatorio, un segundo paciente murió debido a una hemorragia cerebral (v. anteriormente), y un tercero debido a un infarto de miocardio 5 semanas después de la intervención.
Evaluación de 16 pacientes después de una media de 23 (7-66) meses. Dado que no encontramos un sistema de puntuación en la bibliografía para los pacientes con espondilitis, desarrollamos nuestros propios criterios5, que incluyen parámetros subjetivos, como dolor, medicación, distancia andada, capacidad para trabajar y disminución en las actividades de la vida diaria, así como hallazgos objetivos, como alteraciones sensoriales, fuerza muscular y movilidad. Finalmente, se consideraron los hallazgos radiológicos. Un resultado perfecto tiene una puntuación de 50. En nuestra población de pacientes, la puntuación aumentó de 13 antes de la intervención a 37 postoperatoriamente (tabla 3).
Para la valoración del estado neurológico se utilizó la clasificación de Frankel (tabla 2)4. Se encontró un déficit neurológico preoperatorio en 11 de 19 pacientes (tabla 3). En el momento de la evaluación había mejorado como mínimo un grado en 9 pacientes. Un paciente con un Frankel grado A no presentó mejoría en su estado neurológico. Un paciente con un Frankel grado B falleció después de la cirugía. En el momento de la evaluación no se registró ningún déficit neurológico en 13 de 16 pacientes (tabla 3).
La curación de la espondilitis debería documentarse clínica y radiológicamente en todos los pacientes.
Se comprobó radiológicamente en todos los pacientes una buena consolidación ósea con la incorporación del cilindro de titanio MOSS®. A pesar del desplazamiento del espaciador en un paciente, se observó una buena consolidación.
Correspondencia
Konrad Mahlfeld, MD. Orthopedic University Hospital. Leipzinger Straße 44. 39120 Magdeburg, Alemania. Tel: (+49/391) 671-4022; Fax: 4006. Correo electrónico: Konrad.Mahlfeld@Medizin.uni-magdeburg.de