Introdução
A tuberculose (TB) é a doença infecciosa que mais mata no mundo.1 Apenas em 2014, 9,6 milhões de casos de TB foram diagnosticados no mundo e, desses, 12% ocorreram em pacientes infectados pelo HIV.1 No Brasil, também em 2014, a incidência de TB foi estimada em 44/100.000 habitantes, e 17% dos casos ocorreram em indivíduos infectados pelo HIV.1 Na população infectada pelo HIV, a TB representa a doença oportunista mais incidente2 e a principal causa de hospitalização3 e morte.1,4
A infecção pelo HIV é responsável por uma redução aguda dos linfócitos T CD4 específicos para o M. tuberculosis,5 e os indivíduos infectados pelo HIV apresentam um risco 26 vezes maior de desenvolver TB do que aqueles não infectados.6 Apesar de mais incidente em indivíduos com imunodeficiência avançada,7 diferentemente das demais infecções oportunistas, a TB pode ocorrer em pacientes infectados pelo HIV em diferentes estratos de CD4.8
Por outro lado, a ocorrência de TB nesses indivíduos também tem impacto negativo na progressão da imunodeficiência, aumentando o risco de ocorrência de uma nova doença definidora de AIDS e o risco de morte por causas direta e indiretamente relacionadas à TB.9-11
O manejo da TB em pacientes infectados pelo HIV persiste como um desafio aos profissionais e gestores de saúde. A elevada morbimortalidade aponta para a necessidade de atuar de maneira eficiente na prevenção e cura da TB. No entanto, o diagnóstico e o tratamento da doença nessa população permanecem complexos.
Este artigo tem o propósito de fazer uma revisão atualizada da literatura científica acerca do manejo clínico da coin-fecção HIV-TB, abordando os seguintes tópicos: 1) diagnóstico de TB em pacientes infectados pelo HIV; 2) tratamento da TB em pacientes infectados pelo HIV; 3) terapia antirretroviral (TARV) em pacientes com TB; 4) uso de sulfametoxazol-trimetoprim (SMX-TMP) em pacientes com coinfecção HIV-TB; 4) síndrome inflamatória da reconstituição imunológica relacionada à TB (IRIS-TB, do inglês Immune Reconstitution Inflammatory Syndrome); 5) toxicidade da TARV e dos tuberculostáticos; e 6) prevenção da TB em pacientes infectados pelo HIV. O manejo terapêutico de TB multidroga resistente não faz parte do escopo desta revisão.
Diagnóstico de TB em pacientes infectados pelo HIV
Uma das principais dificuldades no manejo da TB em pacientes infectados pelo HIV é o diagnóstico precoce dessa infecção. Casos atípicos, apresentações extrapulmonares e casos com escarro negativo são frequentes nessa população,12 e podem resultar em erros e/ou atrasos diagnósticos.13 Dessa forma, a Organização Mundial de Saúde (OMS) e o Ministério da Saúde brasileiro (MS) recomendam que os pacientes infectados pelo HIV sejam rastreados para TB em todas as consultas por meio de questionamento sobre a presença de um ou mais dos seguintes sinais e sintomas: tosse com qualquer duração, febre, perda ponderal e sudorese noturna.14,15
O uso desse algoritmo de sinais e sintomas tem sensibilidade elevada, próxima a 80%, e elevado valor preditivo negativo (97%), o que torna possível afastar com relativa segurança a suspeição de TB nos indivíduos que não apresentem nenhum dos sinais/sintomas avaliados.16 A presença de qualquer um desses sinais/sintomas deve desencadear o início de investigação para TB, incluindo realização de exames de imagem e coleta de amostras para exames bacteriológicos (pesquisa de bacilos álcool-ácidos resistentes, cultura para M. tuberculosis e testes moleculares, quando disponíveis) e o tratamento empírico para TB deve ser iniciado em caso de alta suspeição clínica.15,17
As rifamicinas (rifampicina ou rifabutina) apresentam elevada atividade esterilizan tecontra o M. tuberculosis, são seguras e estão associadas a menores riscos de falha terapêutica e TB recorrente.
Nos últimos anos foram desenvolvidos novos testes que aumentam a capacidade de diagnóstico da TB. Entre eles, destacam--se o Xpert® MTB/RIF e a detecção de lipoarabinomanana (LAM) na urina por ELISA ou fluxo lateral. O Xpert® MTB/RIF é um teste molecular automatizado baseado em PCR (do inglês polymerase chain reaction) capaz de detectar o M. tuberculosis e, simultaneamente, detectar resistência à rifampicina em menos de duas horas. Sua sensibilidade é alta (79% para indivíduos infectados pelo HIV e 86% em indivíduos não infectados pelo HIV),18 e é capaz de detectar o M. tuberculosis em todos os casos da doença com escarro positivo e em 70% dos casos da doença com escarro negativo.19 Desde 2013, o Xpert® MTB/RIF está disponível na rede pública de saúde do Brasil como teste inicial para o diagnóstico de TB.20
A LAM é um lipopolissacarídio componente da parede celular do M. tuberculosis. O teste de detecção urinária de LAM (Clearview TB ELISA) apresenta alta especificidade (acima de 98%), porém sua sensibilidade está diretamente relacionada com a contagem de CD4, alcançando melhor sensibilidade (67-85%) em indivíduos com CD4 abaixo de 50 células/mm3.21,22 Assim, sua aplicação clínica parece ser mais adequada para a investigação de TB em pacientes hospitalizados e/ou com imunodeficiência avançada.22,23
Tratamento da TB em pacientes infectados pelo HIV
As rifamicinas (rifampicina ou rifabutina) apresentam elevada atividade esterilizante contra o M. tuberculosis, são seguras e estão associadas a menores riscos de falha terapêutica e TB recorrente,24-26 e devem, portanto, compor o esquema terapêutico inicial de todos os pacientes com TB (exceto em casos de contraindicação por resistência ou toxicidade).
O esquema terapêutico de primeira linha preconizado pela OMS e pelo MS consiste na administração de rifampicina/ isoniazida/pirazinamida/etambutol (RHZE) por dois meses, seguido por rifampicina/ isoniazida (RH) por mais quatro meses (exceto em casos de TB meníngea, quando a fase de manutenção de RH deve ser prolongada por um total de sete meses).13,15 A efetividade desse esquema terapêutico em pacientes infectados pelo HIV com TB multissensível é alta (taxa de cura próxima a 90%) e similar àquela observada em pacientes não infectados pelo HIV.27,28
Novas estratégias terapêuticas com o objetivo de aumentar a efetividade e reduzir a toxicidade do tratamento de TB em pacientes infectados pelo HIV continuam sendo investigadas. Uma metanálise que inclui 57 ensaios clínicos29 avaliou duas estratégias alternativas ao tratamento convencional: o uso de rifampicina restrito à fase intensiva do tratamento (primeiros 1-2 meses de tratamento) e o uso de rifampicina três vezes por semana (em vez do uso diário). A primeira estratégia (uso de rifampicina restrito à fase intensiva vs. rifampicina durante todo o tratamento) foi associada a maior risco de falha terapêutica, recorrência de TB e emergência de resistência aos tuberculostáticos.29 A segunda estratégia (rifampicina três vezes por semana vs. rifampicina diária) se associou a um maior risco emergência de resistência aos tuberculostáticos.29
O ensaio multicêntrico randomizado REMEMBER comparou o tratamento empírico para TB (4RHZE/2RH) vs. uso de isoniazida profilática (por seis meses) em pacientes iniciando TARV com CD4 abaixo de 50 células/mm3. A hipótese do estudo de que o tratamento empírico de TB pudesse reduzir a mortalidade em pacientes com imunodeficiência avançada não foi confirmada.30 Outro ensaio clínico randomizado, RAFA trial, testou a administração de altas doses de rifampicina (15 mg/kg) com o objetivo de reduzir a mortalidade de pacientes infectados pelo HIV com TB. Os autores demonstraram que essa estratégia reduziu a mortalidade em 12 meses em pacientes com contagens de CD4 abaixo de 100 células/mm3, sem aumentar a incidência de hepatotoxicidade, sugerindo que doses maiores de rifampicina são seguras e podem melhorar os desfechos de pacientes com imunodeficiência avançada.31
Encontra-se em andamento o TBTC Study 31 (ClinicalTrials.gov: NCT02410772), que tem como objetivo comparar esquemas curtos de tratamento de TB em pacientes infectados pelo HIV. Esse estudo compara três estratégias terapêuticas: 1) dois meses de RHZE + quatro meses de RH (grupo controle); 2) oito semanas de rifapentina + isoniazida + pirazinamida + etambutol seguidos por nove semanas de rifapentina + isoniazida; 3) oito semanas de rifapentina + isoniazida + pirazinamida + moxifloxacino seguidos por nove semanas de rifapentina + isoniazida + moxifloxacino.
A TARV reduz em 44 a 72% a mortalidade dos pacientes infectados pelo HIV durante o tratamento da TB.
Terapia antirretroviral em pacientes com TB
A TARV reduz em 44 a 72% a mortalidade dos pacientes infectados pelo HIV durante o tratamento da TB.32 No entanto, o uso simultâneo de antirretrovirais e tuberculostáticos apresenta alguns desafios, entre eles: 1) adesão às múltiplas drogas (tuber-culostáticos, antirretrovirais e profilaxias); 2) sobreposição de toxicidade dos tuber-culostáticos e dos antirretrovirais que pode levar à interrupção do tratamento e/ou à necessidade de esquemas alternativos; 3) ocorrência de IRIS-TB; e 4) interações entre os tuberculostáticos e os antirretrovirais.33
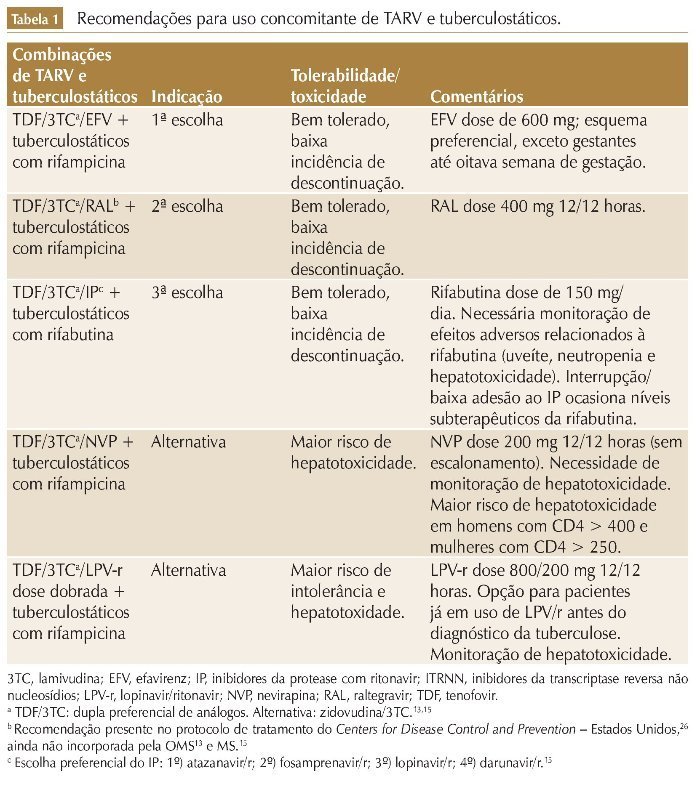
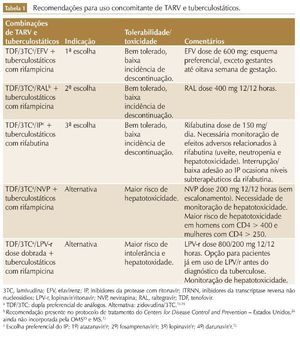
Entretanto, apesar dos potenciais complicadores citados, os benefícios decorrentes do uso de TARV superam seus riscos. A TARV deve ser iniciada em todos os pacientes infectados pelo HIV com TB15,17,26 (tabela 1).
Com qual esquema de TARV iniciar?
Primeira escolha: TARV baseada em efavirenz e tratamento da TB com rifampicina
Embora a rifampicina induza a expressão do citocromo P450 (CIP) 2B6, principal via metabólica do efavirenz (EFV), os dados de farmacocinética do estudo STRIDE demonstraram que as concentrações plasmáticas mínimas (Cmín) do EFV em pacientes em uso de rifampicina não foram inferiores àquelas dos pacientes sem uso de rifampicina, e que apesar de as Cmín do EFV em pacientes com peso ≥ 60 kg terem sido menores que as Cmín daqueles com peso < 60 kg, não houve associação entre maior peso e menor supressão virológica.34 Da mesma maneira, o estudo CAMELIA também demonstrou que as Cmín do EFV (administrado na dose de 600 mg/ dia) em pacientes em uso de rifampicina não foram reduzidas, e que não houve associação entre peso corporal e Cmín do EFV.35 Em conjunto, esses dados apontam para a eficácia e segurança do uso de EFV 600 mg/dia, independentemente do peso, para todos os pacientes em uso de rifampicina, diferindo da indicação do FDA, que sugere aumento da dose em pacientes com peso > 50 kg.36
Os inibidores de integrase (INI) repre sentam uma alternativa terapêutica em pacientes com contraindicação ao uso de EFV.
Segunda escolha: TARV baseada em inibidores da integrase e tratamento da TB com rifampicina
Os inibidores de integrase (INI) representam uma alternativa terapêutica em pacientes com contraindicação ao uso de EFV. No entanto, a experiência com essa estratégia ainda é limitada26 e estudos de fase III estão em andamento, e poderão fornecer evidências que corroborem essa estratégia terapêutica.
A rifampicina é um potente indutor da UDP-glicurosiltransferase1A1, principal via de metabolização do raltegravir (RAL) e do dolutegravir (DTG).37,38 O ensaio clínico de fase II REFLATE TB comparou o uso de RAL em dose padrão (400 mg 12/12 horas), dose dobrada (800 mg 12/12 horas) e EFV (600 mg/dia) em pacientes em uso de rifampicina, e o percentual de pacientes com supressão virológica nas semanas 24 e 48 foi semelhante nas três estratégias, sugerindo que: 1) não haveria necessidade de aumentar a dose de RAL com uso concomitante de rifampicina; e 2) a eficácia da dose padrão de RAL (400 mg 12/12 horas) parece ser semelhante à do EFV em pacientes em uso de rifampicina. Esses achados motivaram a realização do REFLATE TB 2 (ClinicalTrials.gov: NCT02273765, ainda em andamento), um estudo de fase III de não inferioridade que compara a eficácia do RAL (400 mg 12/12 horas) ao EFV (600 mg/dia) em pacientes em uso de rifampicina.
O DTG também é um INI que está sendo testado como opção para uso concomitante com rifampicina em pacientes com coinfecção HIV-TB. Dados de farmacocinética sugerem que o uso concomitante de DTG (50 mg 12/12 horas) e rifampicina e de DTG (50 mg/dia) e rifabutina resultam em concentrações séricas adequadas do DTG.39 O ING117175 (ClinicalTrials. gov: NCT02178592, ainda em andamento) é um estudo de fase IIIb de não inferioridade que compara a eficácia do DTG (50 mg 12/12 horas) ao EFV (600 mg/dia) em pacientes infectados pelo HIV com TB em uso de rifampicina.
A indução do CIP3A4 pela rifampicina tem efeito importante na farmacocinética da Nevirapina (NVP).
Terceira escolha: TARV baseada em inibidores de protease e tratamento da TB com rifabutina
A rifabutina é uma rifamicina com eficácia semelhante à rifampicina. Por atuar de maneira menos intensa no CIP3A4, a rifabutina não interfere de modo significativo nas concentrações séricas dos inibidores de protease (IP).40 Por outro lado, quando administrada concomitantemente com esses antirretrovirais, os níveis de rifabutina ficam significativamente mais altos, aumentando os riscos de toxicidade por essa droga (uveíte, neutropenia, hepatotoxicidade).41-45
A posologia ideal da rifabutina em pacientes em uso de IP foi avaliada em ensaios clínicos, que demonstraram que a sua administração na dose de 150 mg três vezes por semana em pacientes em uso de lopinavir/ritonavir (LPV/r) 400/100 mg 12/12 horas está associada a níveis séricos subterapêuticos de rifabutina (resultando em risco de falha terapêutica e emergência de resistência às rifamicinas).40,41,46 A dose de 150 mg/dia de rifabutina em pacientes em uso do LPV/r (400/100 mg 12/12 horas) demonstrou ser segura e atingir Cmín adequada para o tratamento da TB.40 Essa posologia é a recomendada pelos protocolos de tratamento para pacientes infectados pelo HIV em uso de IP.15,26
Outras opções terapêuticas
A indução do CIP3A4 pela rifampicina tem efeito importante na farmacocinética da Nevirapina (NVP), e o uso de rifampicina reduz a Cmín da NVP em até 55%.47-51 A eficácia e a segurança da NVP em pacientes em tratamento de TB com rifampicina foram avaliadas no estudo CARINEMO. Nesse estudo, apesar de a NVP ter sido inferior ao EFV (69,8% dos pacientes no braço do EFV atingiram supressão virológica na semana 48 vs. 64,6% dos pacientes no braço da NVP),51 o percentual de pacientes em uso de NVP que alcançou supressão virológica (64,6%) foi semelhante ao observado em ensaios clínicos com pacientes sem TB,52 demonstrando que a eficácia dessa droga não foi afetada pelo uso concomitante de rifampicina. O CARINEMO ainda forneceu evidências da segurança do uso concomitante da NVP (200 mg 12/12 horas, sem escalonamento) com rifampicina.51 Dessa forma, a NVP é uma alternativa terapêutica para pacientes com coinfecção HIV-TB em caso de contraindicação às opções terapêuticas anteriores.
O uso concomitante de IP e rifampicina deve ser reservado somente para os casos em que não há outra opção de TARV e nos locais onde a rifabutina não está disponível.
A indução do CIP 3A4 e da glicoproteína P pela rifampicina também resulta em redução dos níveis séricos dos IP em até 90%.26,53,54 Altas doses de ritonavir são capazes de compensar os efeitos da rifampicina, e esquemas contendo super-boosted LPV (LPV/r 400/400 mg 12/12 horas) conseguem alcançar níveis séricos satisfatórios do IP.54 Outra estratégia possível é o uso de dose dobrada de LPV/r (800/200 mg 12/12 horas) em pacientes com TB em uso de rifampicina.55 No entanto, a utilização dessas duas estratégias é limitada pela baixa tolerabilidade, alta incidência de descontinuação do tratamento e risco de hepatotoxicidade, com necessidade de monitoração clínica e laboratorial frequente dos marcadores de lesão hepática.54,55 Portanto, o uso concomitante de IP e rifampicina deve ser reservado somente para os casos em que não há outra opção de TARV e nos locais onde a rifabutina não está disponível.13,26
Quando iniciar TARV em pacientes infectados pelo HIV com TB
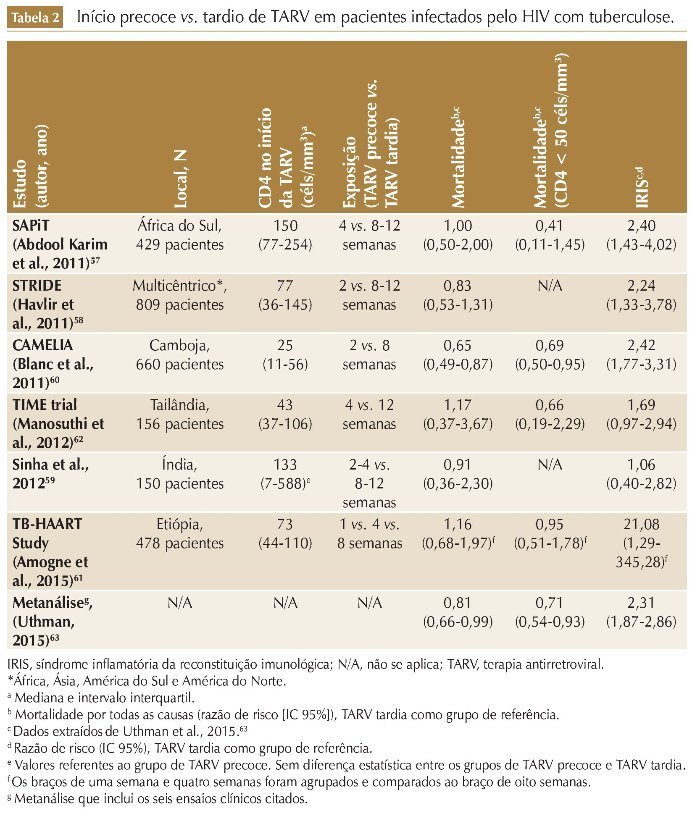
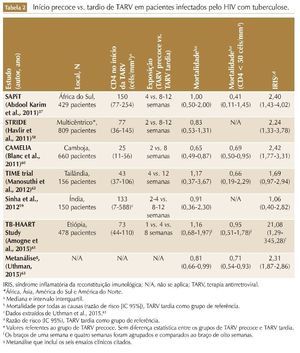
Outro tópico importante relacionado à TARV em pacientes infectados pelo HIV com TB é o momento ideal para o início da terapia. Importantes ensaios clínicos randomizados56-61 (tabela 2) compararam três estratégias possíveis: 1) TARV precoce (início de TARV em até duas a quatro semanas após o início do tratamento da TB); 2) TARV tardia (início de TARV entre oito e doze semanas após o início do tratamento da TB) e 3) TARV sequencial (início de TARV após o término do tratamento da TB). Os resultados desses estudos foram analisados em conjunto em uma metaná-lise que demostrou que a TARV precoce está associada à redução de 19% da mortalidade em relação à TARV tardia (razão de risco [RR] 0,81; intervalo de confiança de 95% [IC 95%]: 0,66-0,99), e que esse efeito é mais pronunciado em pacientes com CD4 abaixo de 50 células/mm3 (RR 0,71; IC 95%: 0,54-0,93).62 Entretanto, nos pacientes com CD4 acima de 50 células/mm3, as estratégias de TARV precoce vs. TARV tardia não diferiram em relação ao impacto na mortalidade (RR 1,05; IC 95%: 0,68-1,61).62
Essas evidências foram incorporadas pelos protocolos de tratamento; a OMS indica início de TARV em até duas semanas após o início de tratamento para TB em pacientes com contagens de CD4 < 50 células/mm3 e em até oito semanas para os pacientes com CD4 > 50 células/ mm3.17 No Brasil, o MS recomenda início da TARV em até duas semanas após o início de tuberculostáticos para pacientes com CD4 < 200 células/mm3 e para os pacientes com CD4 > 200 células/mm3 na oitava semana após o início dos tuberculostáticos (término da fase intensiva).15 A exceção a essa regra se aplica nos casos de TB meníngea,15,17 já que um ensaio clínico randomizado que incluiu pacientes infectados pelo HIV com tuberculose meníngea não demonstrou redução da mortalidade no grupo de pacientes que iniciou TARV precoce (hazard ratio [HR] 1,12; IC 95%: 0,81-1,55), e estratégia de TARV precoce foi associada a maior incidência de even-tos adversos graves.63 Dessa forma, o início de TARV em pacientes infectados pelo HIV com TB meníngea deve ser adiado (após oito semanas de uso de tuberculostáticos), independentemente do valor do CD4, a fim de reduzir a incidência de eventos adversos graves.
O uso de SMX-TMP em pacientes com coinfecção HIV-TB
O SMX-TMP é um antibiótico de baixo custo, bem tolerado, e seu uso está associado com a redução da morbimortalidade de indivíduos infectados pelo HIV. Ensaios clínicos randomizados e estudos observacionais demonstraram que o uso de SMX-TMP está associado à redução da mortalidade de pacientes com coinfecção HIV-TB.64,65 Essas evidências suportam a indicação do uso de SMX-TMP profilático para todos os indivíduos com coinfecção HIV-TB, independentemente da contagem de CD4.17 No entanto, apesar de serem robustas as evidências que indiquem seu uso, o momento de suspensão do SMX-TMP em pacientes infectados pelo HIV com TB ainda não está claro, pois dados demonstraram que a interrupção de seu uso (em pacientes com CD4 > 200 células/mm3 ou mesmo após o término do tratamento da TB) esteve associada ao aumento do risco de morte.66
Duas apresentações clínicas distintas estão descritas para a IRIS-TB. São elas: a TB pa radoxal e a unmasking TB.
IRIS-TB
Duas apresentações clínicas distintas estão descritas para a IRIS-TB. São elas: a TB paradoxal e a unmasking TB.67 A TB paradoxal é caracterizada por piora dos sinais e sintomas da TB após o início da TARV.67 A unmasking TB refere-se ao aparecimento de sinais e sintomas de TB (até então não presentes) semanas após o início da TARV.67 Na maioria dos casos, os sintomas de TB paradoxal se iniciam nos primeiros dois meses após o início de TARV (media-na de 52 dias no estudo STRIDE).68
Apesar de os mecanismos imunológicos da IRIS não estarem completamente elucidados, essa síndrome decorre de uma resposta inflamatória exacerbada como resultado do restabelecimento parcial da imunidade ocasionada pela TARV.69 Desse modo, pacientes com IRIS-TB podem apresentar sinais e sintomas que refletem o acometimento de múltiplos órgãos e sistemas, incluindo febre, piora dos sintomas respiratórios ou do infiltrado pulmonar em exames de imagem, aumento de linfonodos (ocasionalmente com supuração), formação de abscessos e derrames cavitários.67,68
Em uma metanálise que incluiu seis ensaios clínicos randomizados comparando TARV precoce vs. TARV tardia em pacientes infectados pelo HIV com TB (tabela 2), a incidência de IRIS-TB foi estimada em 17,5% nos pacientes que receberam TARV precoce e em 8,3% nos pacientes que receberam TARV tardia. O uso de TARV precoce foi associado a um aumento de 2,3 vezes no risco de IRIS-TB (RR 2,31, IC 95%: 1,87-2,86).62 É necessário ressaltar que a diferença nas incidências de IRIS entre os estudos pode estar relacionada ao grau de imunodeficiência das populações incluídas nesses estudos. Isso fica evidente quando comparamos os estudos STRIDE (incidência de IRIS-TB = 7,6% e mediana de CD4 no início da TARV = 76 células/ mm3)67 e CAMELIA (incidência de IRIS = 26% e mediana de CD4 de 26 células/ mm3).70 De fato, no estudo STRIDE, os pacientes que iniciaram TARV com CD4 < 50 células/mm3 tiveram uma incidência de IRIS-TB duas vezes e meia maior do que aqueles que iniciaram TARV com CD4 ≥ 50 células/mm3 (ambos no braço de TARV precoce).68 No entanto, a redução da mortalidade relacionada ao uso de TARV precoce (especialmente em pacientes com CD4 < 50 células/mm3)56,59 supera os riscos associados à ocorrência de IRIS-TB, e o início de TARV não deve ser poster-gado em pacientes com imunodeficiência avançada.
A ocorrência de IRIS-TB no sistema nervoso central representa a apresentação clínica mais preocupante no contexto dos pacientes com TB.
A ocorrência de IRIS-TB no sistema nervoso central representa a apresentação clínica mais preocupante no contexto dos pacientes com TB. Primeiro porque a incidência de IRIS-TB em pacientes com TB meníngea é mais frequente (47% dos casos TB meníngea) e a mortalidade atribuída a ela também é elevada (podendo alcançar 38% dos casos de IRIS-TB).71 Um ensaio clínico randomizado demonstrou que o uso de TARV precoce (em até sete dias após início de tuberculostáticos vs. início de TARV após oito semanas de tuberculostáticos) foi associado à maior incidência de IRIS e de eventos adversos graves.63 Essas evidências foram incorporadas pelos consensos terapêuticos, e em caso de TB meníngea o início de TARV deve ser postergado para oito semanas após início dos tuberculostáticos.15
O tratamento da IRIS-TB dependerá dos órgãos e sistemas acometidos e da severidade da manifestação clínica. Na maior parte dos casos, a apresentação da IRIS-TB é branda e não requer tratamento específico nem interrupção da TARV.72 Em casos moderados, anti-inflamatórios não esteroidais (AINES) podem ser usados para promover melhora dos sintomas (apesar da não haver ensaios clínicos que comprovem o efeito benéfico dessa intervenção).72 Acometimento do sistema nervoso central, desenvolvimento de insuficiência renal aguda e de insuficiência respiratória podem caracterizar IRIS-TB grave. Nesses casos, a interrupção de TARV e o uso de corticosteroides estão indicados.72 As estratégias terapêuticas envolvem o uso de metilprednisolona intravenosa 40 mg 12/12 horas ou prednisona via oral 20-70 mg/dia por 5-12 semanas.73
Um ensaio clínico randomizado, placebo controlado avaliou o uso de prednisona (1,5 mg/kg/dia por duas semanas, escalonado para 0,75 mg/kg/dia por mais duas semanas) em pacientes com IRIS-TB (foram excluídos os pacientes com IRIS grave). Neste estudo, o uso de prednisona foi associado à redução do tempo de hospitalização e da necessidade de procedimentos invasivos.74 Além disso, os pacientes que usaram prednisona apresentaram melhora mais rápida dos sintomas e dos escores de performance e de qualidade de vida.74
Em relação ao uso de corticosteroides ou AINES como estratégia para a prevenção de ocorrência de IRIS, à exceção dos casos de TB meníngea e TB pericárdica (nos quais o uso de corticoide adjuvante está indicado),13 não há evidências, até o momento, que corroborem essas estratégias. No entanto, dois ensaios clínicos randomizados estão em andamento, avaliando a eficácia da prednisona (ClinicalTrials.gov: NCT01924286) e do meloxicam (AINE inibidor da Cox-2) (ClinicalTrials.gov: NCT02060006) na prevenção de IRIS-TB em pacientes infectados pelo HIV.
Toxicidade da TARV e dos tuberculostáticos
Hepatotoxicidade ou lesão hepática induzida por drogas (DILI, do inglês drug induced liver injury), reações cutâneas, toxicidade renal e neurotoxicidade são efeitos adversos comuns aos antirretrovirais e tuberculostáticos e podem complicar o manejo dos pacientes com coinfecção HIV-TB.
A DILI associada ao uso concomitante de TARV e tuberculostáticos é um evento adverso comum e desafiador, que pode acarretar interrupção do tratamento, hospitalização e morte.75 Cerca de 15% dos pacientes infectados pelo HIV em uso de tuberculostáticos podem apresentar DILI.76 Suas manifestações clínicas podem variar desde elevação assintomática das enzimas hepáticas até insuficiência hepática fulminante;77 o tempo mediano entre o início dos tuberculostáticos e o aparecimento dos sintomas é de 16 semanas (variando entre seis semanas e seis meses).78
Estudos estimaram a incidência e os fatores de risco para DILI em pacientes infectados pelo HIV no Brasil. Em uma amostra de 149 pacientes infectados pelo HIV hospitalizados em São Paulo, DILI foi diagnosticada em 22% deles, e o uso de tuberculostáticos foi associado a um aumento de 2,3 vezes na chance de apresentar DILI (odds ratio 2,31; IC 95%: 1,27-4,19).79 Outro estudo, conduzido no Rio de Janeiro, acompanhou prospectivamente 2.631 pacientes monoinfectados pelo HIV com transaminases normais no início do seguimento por um período mediano de cinco anos (intervalo interquartil: 2,7-7,1 anos). Durante o estudo, a taxa de incidência de lesão hepática (definida como aumento de ALT maior ou igual a três vezes o limite superior da normalidade) foi estimada em 5,4/1.000 pessoas--ano (IC 95%: 4,3-6,9/1.000 pessoas-ano) e o tratamento para TB foi associado a um aumento de três vezes no risco de apresentar lesão hepática (HR 3,13; IC 95%: 1,71-5,76). Além disso, dos casos incidentes de lesão hepática, 28% foram classificados como DILI associada ao uso de tuberculostáticos.80
Prevenção de tuberculose em pacientes infectados pelo HIV
TARV como prevenção
O uso de TARV reduz em 65 a incidência de TB em pacientes infectados pelo HIV.
O uso de TARV reduz em 65 a incidência de TB em pacientes infectados pelo HIV.81 Estudos randomizados demonstraram que o início imediato de TARV (vs. início de TARV guiado pelo CD4) está associado à redução da incidência de TB.82-84 O estudo TEMPRANO, conduzido na Costa do Marfim, randomizou pacientes infectados pelo HIV, virgens de TARV, com mediana de CD4 465 células/mm3, para iniciarem TARV imediatamente ou postergarem seu uso até que atingissem níveis de CD4 que indicasse TARV (de acordo com os consensos da OMS vigentes). Nesse estudo, o início imediato de TARV reduziu em 44% o risco de TB, morte ou outras doenças graves (HR 0,56; IC 95%: 0,41-0,76).84 O HPTN 052, que incluiu pacientes virgens de TARV, com mediana de CD4 436 células/mm3, demonstrou uma redução de 51% no risco de TB no grupo de pacientes com início imediato da TARV comparados àqueles que postergaram seu início até CD4 < 250 células/mm3 (HR 0,49; IC 95%: 0,28-0,89).82
No Brasil, motivado pelas evidências de que o início imediato de TARV não só reduz a transmissão do HIV85 como também reduz a morbimortalidade dos pacientes infectados pelo HIV,82-84,86 o MS recomenda, desde 2013, o início de TARV para todos os indivíduos infectados pelo HIV, a despeito das contagens de CD4.15 Essa mudança no protocolo de tratamento no Brasil provavelmente irá resultar em redução da incidência de TB nos pacientes infectados pelo HIV nos próximos anos.
Profilaxia com isoniazida
O uso de quimioprofilaxias como tratamento da TB latente previne a progressão da in fecção do M. tuberculosis para TB ativa.
O uso de quimioprofilaxias como tratamento da TB latente previne a progressão da infecção do M. tuberculosis para TB ativa. A efetividade dessa estratégia foi avaliada em uma metanálise que incluiu 12 estudos randomizados e concluiu que o uso de quimioprofilaxias está associado a uma redução de 32% no risco de TB ativa em pacientes infectados pelo HIV (RR 0,68; IC 95%: 0,54-0,85).87 No entanto, nessa metanálise, o efeito protetor foi mais evidente no subgrupo de pacientes com intradermo reação positiva (PPD ≥ 5 mm, do inglês Purified Protein Derivative) (RR 0,38; IC 95%: 0,25-0,57) do que naqueles com PPD não reator (RR 0,89; IC 95%: 0,64-1,24).87
Dentre as opções de quimioprofilaxia disponíveis, a isoniazida profilática (IPT) representa a estratégia mais utilizada, com eficácia e segurança demonstradas em pacientes infectados pelo HIV.87 Ensaios clínicos randomizados demonstraram o efeito protetor da IPT em pacientes infectados pelo HIV que vivem em locais de alta e média prevalência de TB. No THRio, estudo brasileiro que incluiu pacientes infectados pelo HIV com PPD reator, o uso de IPT (por seis meses) foi associado a uma redução de 83% no risco de TB (HR 0,17; IC 95%: 0,11-0,25).88 Rangaka e cols., em estudo conduzido na África do Sul, observaram que o uso de IPT (por 12 meses) reduziu o risco de TB em 37% (HR 0,63; IC 95%: 0,41-0,94), e que esse efeito protetor foi mais pronunciado em pacientes com PPD não reator (HR 0,43; IC 95%: 0,21-0,86) e em pacientes com IGRA (do inglês interferon gamma release assay) negativo (HR 0,43; IC 95%: 0,20-0,96).89 O TEMPRANO, conduzido na Costa do Marfim, demonstrou que o uso de IPT (por seis meses) associado o uso de TARV teve um efeito aditivo na proteção contra morte e/ou ocorrência de eventos graves (HR 0,65; IC 95%: 0,48-0,88).84
A OMS recomenda o uso de IPT por pelo menos seis meses em indivíduos infectados pelo HIV que não tenham evidência clínica de TB ativa, incluindo gestantes, crianças e indivíduos com histó-rico de TB tratada (profilaxia secundária).90 No entanto, a cobertura de IPT na população infectada pelo HIV ainda permanece aquém do esperado,91 inclusive no Brasil. O estudo THRio, em uma avaliação da adesão dos médicos aos protocolos de prevenção da TB em pacientes infectados pelo HIV, identificou que a realização do PPD representa um gargalo na provisão de IPT no Brasil, já que mais da metade dos pacientes elegíveis (51%) não realizou PPD e, dentre os que apresentavam PPD reator, apenas 53% deles iniciaram IPT.92
O uso de IPT em pacientes infectados pelo HIV é eficaz84,87,88 (inclusive em pacientes com PPD não reator que vivem em locais de alta carga de TB),89 é custo efetivo93 e não está associado ao aumento da resistência à isoniazida94 ou à maior incidência de eventos adversos graves.87,95,96 Treinamento das equipes de saúde com o objetivo de intensificar o rastreio de TB, a realização de PPD e a prescrição da IPT mostrou-se capaz de reduzir a incidência de TB no Brasil.97 A identificação de barreiras ao uso de IPT e políticas nacionais de saúde que aumentem a cobertura de IPT são imprescindíveis para reduzir a morbimortalidade da coinfecção HIV-TB.
Financiamento
BG agradeceu o financiamento do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e a Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ).