Introdução
A eficácia da terapia antirretroviral (TARV) é uma função direta de dois fatores: da potência do esquema antirretroviral instituído e do potencial de durabilidade desse esquema; a durabilidade se traduz realmente na assim chamada barreira genética à resistência do esquema utilizado. Neste artigo de revisão serão explorados alguns aspectos relacionados à potência dos medicamentos distintos e de suas associações, bem como da barreira genética a esses medicamentos – conceitos antigos, mas ainda aplicáveis, com nuanças relacionadas ao tratamento inicial e ao tratamento de resgate para pacientes portadores de vírus resistentes. Discutiremos especificamente sobre o tratamento inicial nos dias atuais (no Brasil e nos países desenvolvidos – onde a indicação do tratamento se faz no momento do diagnóstico da infecção), principalmente sobre a durabilidade do tratamento, que, como mencionado, se traduz por sua barreira genética.
A potência na terapia antirretroviral
No momento que se iniciam os testes de medicamentos em humanos, alguns pontos precisam ser definidos. Um dos mais relevantes é a potência in vivo do medicamento, que, em última análise, define a dose a ser utilizada. Normalmente, a potência in vivo de um medicamento é definida pela determinação da queda da carga viral em voluntários humanos infectados pelo HIV expostos a períodos curtos de monoterapia com esse medicamento. Esses períodos variam entre 10 a 14 dias, e normalmente os voluntários são expostos a doses diferentes de antirretrovirais para que se defina a menor dose que proporcione a maior queda de carga viral. Em geral, a capacidade de inibir a replicação viral em monoterapia esgota-se a partir de determinada dose de medicamento, ou seja, mesmo com o aumento das doses, a queda média de carga viral não aumenta mais. Deve-se enfatizar que a potência in vivo dos inibidores da protease (IP) tem sido consistentemente semelhante quando se trata de pacientes infectados por HIV plenamente sensíveis aos antirretrovirais, culminado com queda de carga viral de cerca de 1,8 log10. Entretanto, é preciso saber que os IP não peptídicos de segunda geração, como o tipranavir (TPV) e o darunavir (DRV), apresentam potência in vivo superior na presença de vírus resistentes, já que seu perfil de resistência e sua cinética intracelular fazem com que a inibição de vírus resistentes ocorra de modo privilegiado.
A potência in vivo também deve ser considerada não apenas para medicamentos de maneira isolada, mas também para a associação de medicamentos. Algumas associações de medicamentos com os esquemas contendo três análogos aos nucleosídios padeceriam não só de fragilidade em sua barreira genética, mas também da limitada potência para inibição da replicação do HIV, o que ficaria mais óbvio na dificuldade da supressão viral quando a carga viral é elevada, ou seja, superior a 100.000 cópias/mL.1 Nesse contexto, um dado interessante emergiu há vários anos, a partir do estudo 720, conduzido pela empresa farmacêutica Abbott em pesquisas com lopinavir (LPV). O estudo 720 avaliou desempenho e segurança da associação entre estavudina (d4T), lamivudina (3TC) e lopinavir/ritonavir (LPV/r) entre pacientes virgens de tratamento. Para a investigação da potência in vivo do LPV/r, um dos braços do estudo avaliou por duas semanas o LPV em monoterapia,1 e a queda de carga viral no braço do LPV/r em monoterapia foi semelhante à obtida com a associação com d4T e 3TC.2 Algumas especulações interessantes surgiram a partir de então: se para o sucesso do tratamento precisamos de medicamentos com boa potência e alta barreira genética, eventualmente, um IP com ritonavir em monoterapia (IP-r) poderá ser suficiente para cumprir esse objetivo, já que as evidências sugerem que a potência e a barreira genética sejam altas nesses casos, posto que são necessárias cerca de oito mutações para que se comprometa severamente um IP-r. Além disso, mutações na protease aparentemente não são selecionadas em um paciente infectado por HIV do subtipo B sem mutações preexistentes na protease. A partir de então, um grande número de estudos usando IP-r emergiu.3-5 Os estudos com monoterapia com IP-r têm sido bastante ilustrativos para o entendimento da TARC e, especialmente, para o entendimento dos IP. A história é sempre a mesma: os esquemas com IP-r em monoterapia são menos eficazes que os esquemas contendo IP-r associados a dois inibidores de transcriptase reversa análogos aos nucleosídios (ITRN). Os esquemas com IP-r em monoterapia trazem um risco maior de viremia baixa, mas que pode ser amplamente revertido com intensificação pela associação de dois ITRN. A intolerância a esquemas com IP-r em monoterapia é menor do que a proporcionada por IP-r associado a dois ITRN ou dois ITRN e efavirenz (EFV).4,5
Um avanço subsequente na estratégia utilizando os IP-r em monoterapia surgiu a partir dos estudos que associam IP-r à 3TC. O primeiro a ser conduzido explorando essa estratégia foi o estudo Gardel.6 O racional parece meio óbvio: IP-r em monoterapia, apesar de seguro por não selecionar vírus resistentes (como será melhor discutido posteriormente), e apesar de propiciar menores índices de toxicidade e intolerância, pode não ter a potência suficiente para suprimir a viremia em uma porcentagem pequena de pacientes, necessitando de intensificação posterior, como também já foi discutido. Essa intensificação mínima necessária poderia ser fornecida pela 3TC, que é o ITRN com melhor perfil de tolerabilidade. Em resumo, os dados do estudo Gardel após 96 semanas, que comparou 3TC ou dois ITRN com LPV/r, demonstraram que 90,3% dos pacientes usando 3TC mantiveram carga viral indetectável em comparação a 84,4% dos pacientes usando dois ITRN.7
Um avanço subsequente na estratégia utilizando os IP-r em monoterapia surgiu a partir dos estudos que associam IP-r à 3TC
Um dos avanços no uso dos antirretrovirais foi o entendimento de que a biodisponibilidade do IP no meio intracelular é fundamental para a eficácia desses agentes. Níveis elevados de IP no meio intracelular sempre foi um problema, porque a toxicidade desses agentes também é alta. Dessa maneira, para que se obtivesse um nível intracelular alto, era preciso uma administração de quantidades tóxicas de medicamentos. O uso do ritonavir mudou parcialmente esse contexto. Com ele, altos níveis de medicamentos são mantidos no meio intracelular sem a necessidade de ingestão de altas doses de IP, já que a eliminação do IP fica retardada pela inibição de sua metabolização, proporcionada pelo ritonavir (inibição do citocromo hepático CYp3A4). Como mencionado anteriormente, o uso de IP-r passa a ser suficiente para a inibição da replicação viral, quando o paciente é portador de vírus plenamente sensíveis ao IP que esteja sendo utilizado. Entretanto, quando o vírus apresenta mutações de resistência, a potência do IP-r fica reduzida e novas mutações de resistência podem ser selecionadas, fazendo com que ocorra um aumento na resistência cruzada e uma restituição da capacidade replicativa do vírus (fitness).8 Um avanço nesse sentido ocorreu com o desenvolvimento dos IP não peptídicos, como o DRV e o TPV.
Uma das barreiras para a manutenção de níveis adequados de IP no meio intracelular é a hidrólise desses medicamentos por enzimas responsáveis por degradação dessas substâncias. Os IP não peptídicos, em verdade, são menos suscetíveis à hidrólise intracelular, e isso funcionaria como um booster adicional para esses medicamentos.9 Além disso, a potência de ligação do IP com o sítio ativo da protease contribuiria muito com a eficácia específica de um IP na presença de vírus mutantes. A potência da ligação do IP com o sítio ativo da protease é uma função da assim chamada capacidade de reconhecimento do sítio ativo na qual o IP deve se ligar e da estabilidade dessa ligação, variáveis estas que podem ser investigadas in vitro.10 A diminuição da hidrólise intracelular, a potência da ligação do IP com a protease e o perfil de resistência diferenciado dos IP não peptídicos contribuem para sua eficácia no tratamento de resgate para pacientes portadores de HIV com mutações de resistência na protease.
O dolutegravir (DTG) apresenta uma potência sem precedentes, mostrando uma queda da carga viral média em monoterapia de 2,5 log10.11 Claramente, essa potência está subestimada. Isso porque em sete dias de monoterapia com DTG, a carga viral baixou para níveis indetectáveis em nove dos dez pacientes testados.11
Logo, para sabermos a real potência do DTG, deveriam ser escolhidos pacientes com carga viral realmente elevada, a fim de que se definisse o real impacto desse medicamento na diminuição da viremia. Além disso, após a interrupção do medicamento no sétimo dia de tratamento, a carga viral continuou a diminuir, mostrando que, eventualmente, sete dias seriam insuficientes para a determinação da real potência desse medicamento.11
Ao modelo do que foi feito com os IP, a associação de DTG com 3TC foi testada em um grupo pequeno de pacientes. Um estudo denominado PADDLE demonstrou em 20 pacientes que todos evoluíram para níveis de carga viral indetectável após a oitava semana de tratamento com DTG e 3TC.12
O potencial de durabilidade do esquema antirretroviral é fundamental para sua eficácia
Barreira genética para resistência aos antirretrovirais
Como mencionado anteriormente, o potencial de durabilidade do esquema antirretroviral é fundamental para sua eficácia. Quando mencionamos a durabilidade, temos que fazer referência direta à barreira genética do esquema antirretroviral a ser utilizado. Podemos definir a barreira genética como a facilidade com que o vírus desenvolve resistência frente aos medicamentos em uso pelo paciente. Nesse caso, quando a resistência emerge rapidamente com o uso de um determinado medicamento ou associação de medicamentos, consideramos a barreira genética baixa. Mutações preexistentes de resistência podem, a priori, diminuir a barreira genética a um medicamento a ser utilizado, o que ocorre na resistência cruzada ou quando há transmissão de vírus resistentes (resistência transmitida ou primária).
A barreira genética de um antirretroviral pode ser aferida in vitro ou in vivo. Os testes in vitro normalmente comparam medicamentos de uma mesma classe para definição em cultura sobre o tempo necessário para que haja desenvolvimento de mutações de resistência. Dessa maneira, ficou definido in vitro que o tempo para seleção de mutações de resistência é menor para a nevirapina (NVP) do que para o EFV, e que mutações para etravirina (ETV) não emergiram quando um micromolar de medicamento foi utilizado nas culturas para todos os medicamentos.14 Isso sugere que a barreira genética in vitro da NVP é inferior à do EFV, que é, por sua vez, inferior à da ETV. Mesmo na presença de vírus mutantes com mutações Y181C, K103N ou ambas, a barreira genética in vitro é elevada para ETV.13
De maneira semelhante, a barreira genética in vitro para os IP não peptídicos TPV e DRV é maior do que a de todos os outros IP.14 Importante ressaltar que, virologicamente falando, essa barreira genética superior do TPV e DRV não faria nenhuma diferença in vivo quando se tratasse de pacientes portadores de vírus plenamente sensíveis aos IP, posto que, como será discutido a seguir, a inibição da protease é máxima nesses casos quando qualquer IP-r é utilizado, não havendo também seleção de vírus mutante.
Quando se investiga a barreira genética dos inibidores de integrase in vitro, conclui-se que a barreira genética do DTG é maior do que a do raltegravir (RAL) e elvitegravir (EVG), em que a seleção de mutações de resistência nas culturas aconteceu com um grande retardo.15
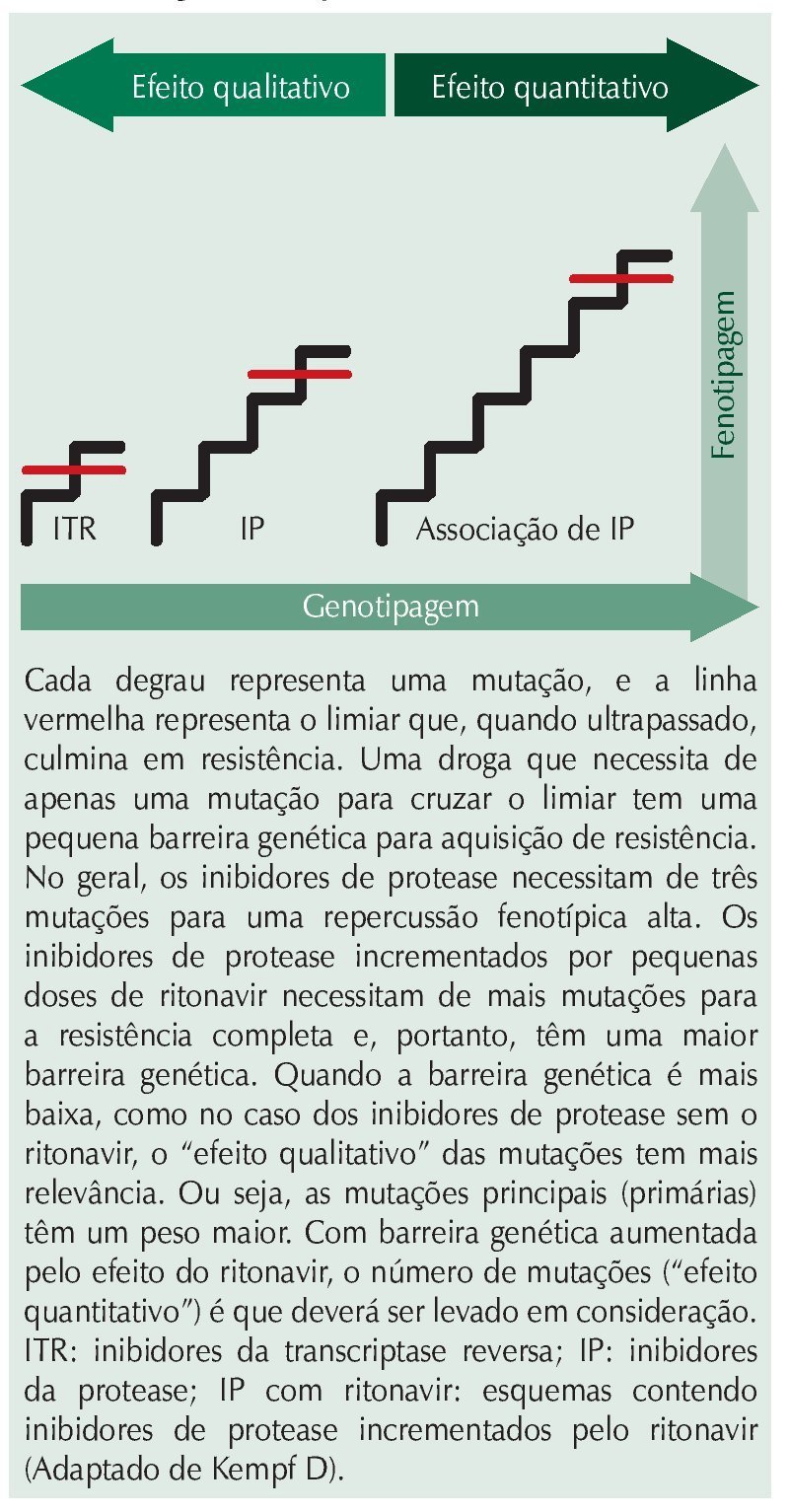
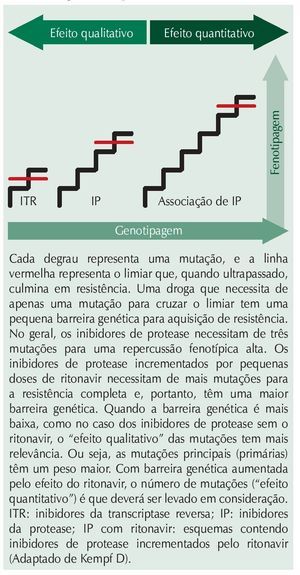
Com relação ao que ocorre in vivo, didaticamente dividimos a barreira genética em três grupos: um que leva em consideração o número de mutações necessárias para o decréscimo do efeito antirretroviral, e que tem relação fundamental com os IP; um segundo grupo que leva em conta a rapidez com que uma mutação é selecionada e tem mais relação com os ITR; e um terceiro grupo que leva em consideração o perfil de mutações necessárias para resistência a um esquema antirretroviral. Deve-se levar em consideração que, enquanto a capacidade de supressão em níveis indetectáveis tem relação com a potência do medicamento ou esquema antirretroviral, a durabilidade do esquema ou do medicamento tem relação com a barreira genética. Como exemplo de medicamento potente e de baixa barreira genética, temos a enfuvirtida (T20), na qual uma mutação na gp41 leva à perda da ação do medicamento e, consequente, à baixa durabilidade do tratamento em caso de replicação viral na presença deste medicamento.
Quando se investiga a barreira genética dos inibidores de integrase in vitro, conclui-se que a barreira genética do DTG é maior do que a do raltegravir e elvitegravir
Barreira genética e número de mutações
Normalmente, os ITR apresentam uma barreira genética menor em relação ao número de mutações para que haja resistência; em alguns casos, uma única mutação pode causar um impacto considerável na suscetibilidade do medicamento em questão (fig. 1). Por sua vez, os IP precisam de um número maior de mutações para que a resistência seja completa. Quando IP são usados sem o incremento do ritonavir ou cobicistat (COBI), são necessárias pelo menos três mutações, e pelo menos uma delas deve ser mutação principal, ou mais de quatro mutações na ausência de mutações principais (fig. 1). Quando usados com baixas doses de ritonavir ou COBI, os IP precisam de um número maior de mutações, que devem variar entre seis a dez, para que haja resistência ampla em decorrência dos altos níveis séricos basais alcançados por esses IP. Interessante notar que o aspecto qualitativo das mutações (mutações principais ou acessórias) se perde com o incremento propiciado pelo ritonavir ou COBI, e, nesses casos, o aspecto quantitativo (número de mutações) passa a ser o preponderante. Mesmo que ainda tenha ação, um determinado IP pode ter a durabilidade limitada em um paciente que já apresente vírus com algumas mutações na protease. Em outras palavras, se são necessárias oito mutações para que haja resistência completa a um determinado IP, e o vírus do paciente já apresenta, por exemplo, cinco mutações, a barreira genética, nesse caso, encontra-se diminuída.
Figura 1 Desenho sobre a teoria da barreira genética para resistência do HIV-1.
É interessante observar que pacientes virgens de tratamento tratados com IP com o incremento desses potencializadores não desenvolvem resistência na protease, mesmo na vigência de falha virológica
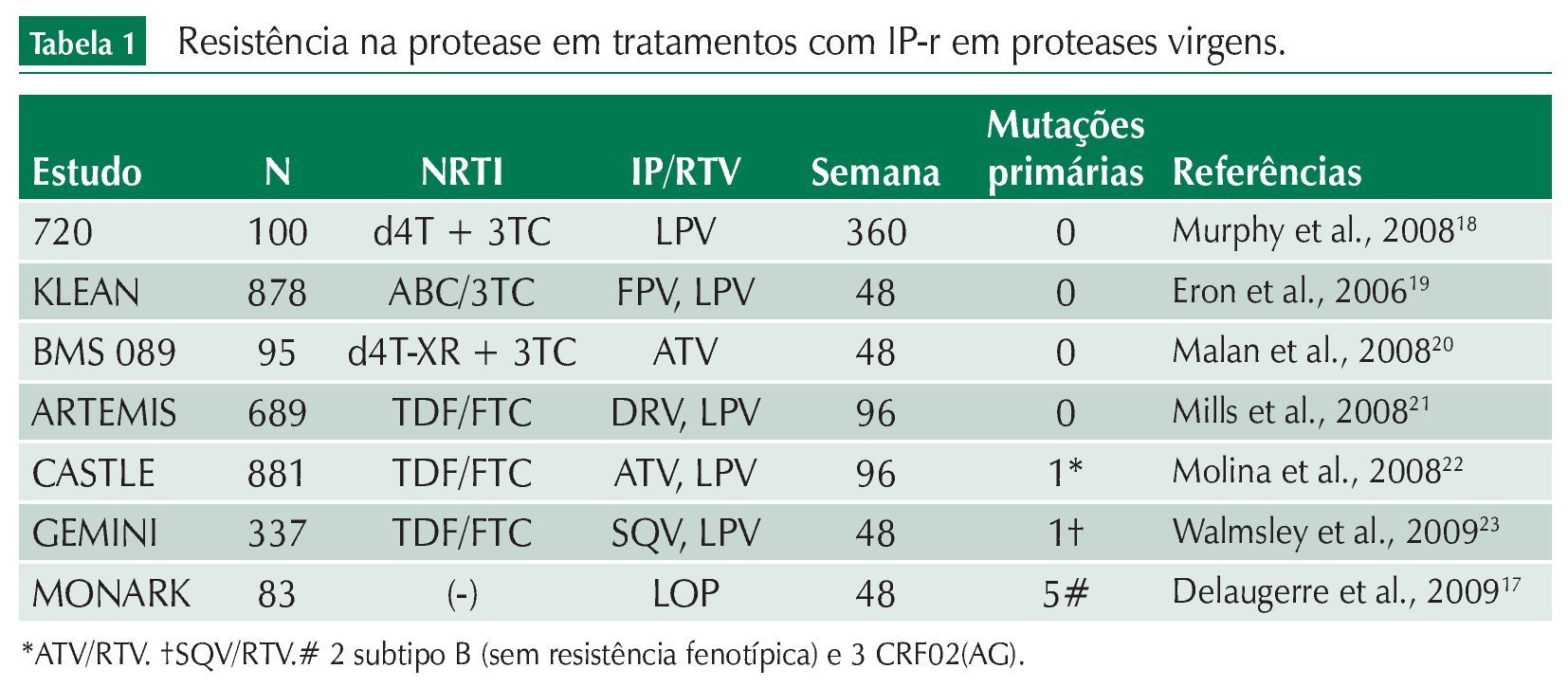
Alguns IP, como o atazanavir (ATV), propiciam um nível basal de medicamento superior ao da maioria dos IP na ausência do incremento propiciado pelo ritonavir ou COBI. Nesse caso, há uma necessidade mínima de cinco mutações para que se atinja um IC50 superior a 3,0 na fenotipagem, com correspondente resistência. Obviamente, a barreira genética ao ATV aumenta na presença de baixas doses de ritonavir ou COBI. O uso desses “potencializadores” deve ser, na medida do possível, a prática recomendada para o uso de qualquer IP (tabela 1).
É interessante observar que pacientes virgens de tratamento tratados com IP com o incremento desses potencializadores não desenvolvem resistência na protease, mesmo na vigência de falha virológica. Em outras palavras, parece não ser possível que um vírus selvagem adquira mutações passo a passo selecionadas por um IP incrementado pelo ritonavir ou COBI, ou que apareça simultaneamente uma quantidade grande de mutações na protease que pudessem levar à perda de ação desse IP. Isso ficou claro em alguns estudos utilizando o LPV/r, nos quais, após escape virológico, a sensibilidade dos vírus aos diversos IP continuava a mesma de antes do tratamento.16 Do mesmo modo, existem estudos com saquinavir/ritonavir (SQN/r) e estudos com amprenavir/ritonavir (APV/r) com os mesmos resultados (tabela 1). Esse tipo de achado jogou luz à possibilidade do uso de IP incrementados pelo ritonavir em monoterapia. De fato, os estudos utilizando IP-r em monoterapia não propiciam a emergência de mutações de resistência, e o resumo desses estudos pode ser visto na tabela 1. Interessante notar que a resistência aos IP nos estudos clínicos usando terapia combinada com IP/r emergiu em um caso de paciente usando ATV e um caso de paciente usando SQN (tabela 1). Nesses casos, emergiram mutações específicas para esses IP, e pode-se especular que, pelo fato de esses IP não serem coformulados com o ritonavir, a falta de adesão especificamente ao ritonavir leva à exposição ao IP sem o incremento propiciado pelo ritonavir (booster), o que definitivamente levaria à seleção de mutações de resistência. Não se deve negligenciar que a necessidade de um número maior de comprimidos (e, no passado, a necessidade de refrigeração) do ritonavir pode, em alguns casos, representar um aumento de complexidade para a adesão ao tratamento. O estudo MONARK, que tratou pacientes com LPV/r em monoterapia, apresentou o caso de cinco pacientes que desenvolveram mutações de resistência com baixa viremia ao longo do tratamento.17 Nesse estudo, três pacientes estavam infectados por vírus CRF_02 (recombinantes entre os subtipos A e G), e dois pelo subtipo B. Em um dos pacientes infectados pelo vírus do subtipo B, o fold change para o LPV antes do início do tratamento era de 1,49, e após a viremia passou a ser de 1,13, o que não caracteriza resistência; as mutações L10L/F e V82A/V detectadas no pico de viremia poderiam estar presentes no pré-tratamento. O mesmo ocorreu com o outro paciente infectado pelo vírus do subtipo B com emergência da mutação M46I, no qual o fold change foi de 1,16 no basal para 1,40 na viremia. Com relação aos três pacientes infectados pelo CRF_02, a resistência pode legitimamente ter emergido, já que em todos consistentemente a mutação L76V emergiu e o fold change aumentou entre duas a cinco vezes, comparando o pré-tratamento com o pico da viremia.
Algumas mutações são selecionadas com muita facilidade e rapidez por alguns medicamentos, como a mutação M184V pelo 3TC
Barreira genética e facilidade na seleção de mutações
O medicamento que mais se aproxima em termos de barreira genética aos IP incrementados pelo ritonavir ou COBI é o inibidor de integrase (INI) DTG, como será discutido no final deste artigo.
Esse tipo de conceito se aplica bem aos ITR. Normalmente, são necessárias poucas mutações para que haja resistência aos ITR, na maior parte das vezes uma mutação já pode ser suficiente. Algumas mutações são selecionadas com muita facilidade e rapidez por alguns medicamentos, como a mutação M184V pelo 3TC. Da mesma forma, mutações selecionadas pela NVP e EFV podem acontecer com facilidade. Sabe-se, por exemplo, que cerca de metade dos pacientes falhando ao tratamento inicial contendo dois inibidores de transcriptase reversa não análogos aos nucleosídios (ITRNN) e EFV apresentará mutações de resistência ao EFV. Desses pacientes com resistência ao EFV, metade apresentará a mutação M184V em decorrência do uso de 3TC ou emtricitabina (FTC), e não haverá emergência de resistência ao outro ITRNN (tenofovir [TDF], abacavir [ABC] ou zidovudina [AZT]).24,25 Já medicamentos como a didanosina (ddI) precisam também de uma única mutação específica, mas essa é selecionada a partir de um período de tempo de exposição a esse medicamento bem superior (mutações específicas como as dos códon 65, 69 e 74). A tabela 2 resume esse tipo de barreira genética e os diversos ITR.
A barreira genética não é muito alta, comparada à dos IP-r, como demonstrado pelos estudos de switch.
A falha virológica ao RAL nem sempre está acompanhada de resistência, o que ocorre em cerca de até 50% dos casos, indicando que os testes de resistência são fundamentais nesses casos.26 A barreira genética não é muito alta, comparada à dos IP-r, como demonstrado pelos estudos de switch.27 Nos estudos SWITCHMRK, 702 pacientes com tratamento estável e carga viral indetectável por pelo menos três meses usando LPV/r foram randomizados para continuar com o tratamento (n = 32) ou substituírem o LPV/r por RAL (n = 350). Os estudos programados para durarem 48 semanas foram prematuramente interrompidos na semana 24, visto que o braço do RAL apresentava 6,2% a mais de falha virológica. A partir desses casos, é possível concluir que os pacientes em uso estável de LPV/r, e que foram selecionados, estavam bem e tolerando o tratamento, sendo que um preditor de lapso ao RAL foi falha virológica prévia ou mutações previamente detectadas relacionadas aos ITRN. Sabe-se que a principal causa de falha em esquemas contendo IP-r é a intolerância à combinação de medicamentos, e não a emergência de resistência. Conclui-se, portanto, que nesse grupo específico de pacientes, a falha e a resistência ocorreram mais frequentemente ao RAL, devido à menor barreira deste medicamento, comparada à dos IP-r.
De modo semelhante, o estudo TMC125-C227 selecionou 116 pacientes virgens de tratamento a IP e com falha a ITRNN com pelo menos uma mutação à ITRNN, mas com sensibilidade (inferida) à ETV, para serem resgatados com os dois melhores ITRN e ETV (n = 59) ou dois ITRN, e IP-r selecionado pelo investigador (n = 57).28 Nota-se que a ETV foi desenhada justamente para esses casos: resgate da falha de ITRNN. Novamente, nesse exemplo o estudo foi interrompido com 24 semanas em decorrência do maior número de falhas virológicas e emergência de resistência, e uma das causas, aqui, poderia ser a barreira genética inferior da ETV entre pacientes falhando a ITRNN em comparação aos IP-r.
É possível afirmar que o maraviroque (MVQ) tem uma barreira genética elevada, posto que apenas a minoria, cerca de 1/3 dos pacientes em falha virológica, apresenta vírus com a mudança do tropismo para o uso do receptor CXCR4. Nesses casos, especula-se que o medicamento ainda apresente atividade e que o MVQ não seja o responsável pela falha virológica em questão. Em alguns casos mais raros, um vírus com pequena diminuição de suscetibilidade ao MVQ pode emergir sem a respectiva mudança de tropismo. Essas variantes virais podem apresentar mutações na alça V3 da GP120, como A316T ou I323V.29
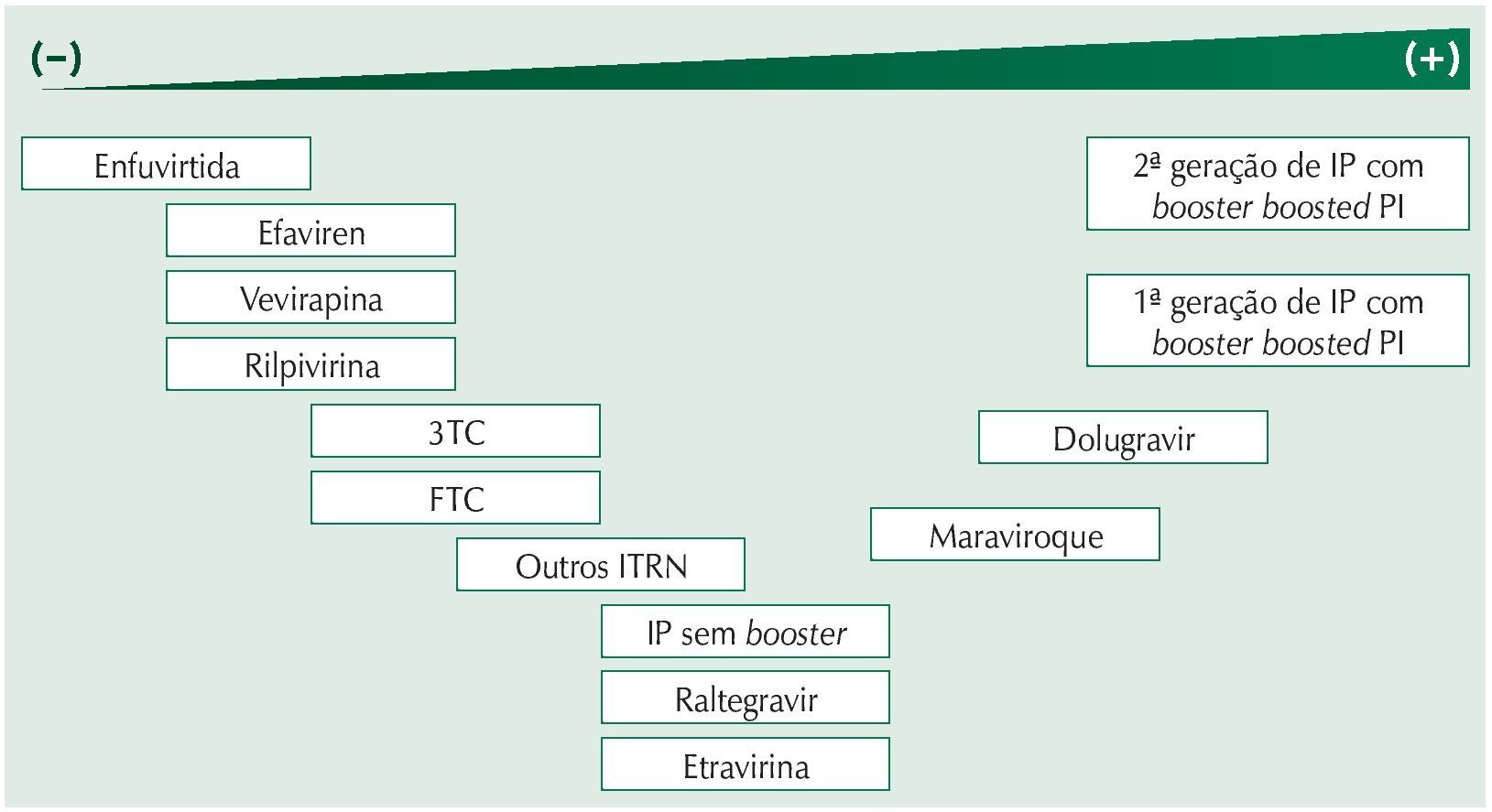
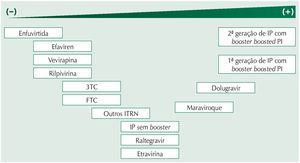
A barreira genética para o desenvolvimento de resistência à T20 é extremamente baixa; duas semanas de viremia são suficientes para proporcionar resistência a esse medicamento em praticamente todos os casos.30 Assim, os tratamentos contendo T20 não devem perdoar a replicação viral, e a indetectabilidade da carga viral é condição fundamental. Para isso, deve--se insistir na adesão ao tratamento. Um estudo comparando resgate com e sem T20 demonstrou que o desempenho era melhor no braço usando a T20 apenas quando a adesão ao tratamento era superior a 85%.31 Quando a adesão era inferior, não havia nenhuma vantagem no uso adicional da T20, e esse resultado pode ser entendido levando-se em consideração a baixa barreira genética do medicamento. Em outras palavras, na baixa adesão existe uma chance maior de viremia, e na viremia há uma chance rápida de resistência à T20, com consequente perda do benefício desse medicamento (fig. 2).
Figura 2 Barreira genética para desenvolvimento de resistência aos antirretrovirais em vírus sem mutações prévias de resistência. Barreira genética crescente da esquerda para a direita.
A mutação M184V leva à resistência ao 3TC, a mutação K65R leva à resistência ao TDF e a associação de ambas leva à resistência ao ABC
Barreira genética e associação de antirretrovirais
O exemplo de que associação de antirretrovirais pode ter durabilidade pequena, uma vez que eles apresentam baixa barreira genética, ficou mais evidente recentemente, com alguns estudos de associação de ITRN. Como já mencionado, é importante que se tenha o conceito de que enquanto a potência de um antirretroviral tem relação com o nível de queda da carga viral proporcionado por esse medicamento em monoterapia, a durabilidade de um esquema combinado tem relação com a barreira genética que essa associação proporciona. Como exemplo, temos um estudo que randomizou pacientes virgens de tratamento para serem tratados com ABC/3TC e EFV (n = 92), em comparação a ABC/3TC e TDF (n = 102).32 Após 48 semanas, 49% dos pacientes do braço do TDF apresentaram falha virológica, comparados a 5,4% do braço do EFV. Quase a totalidade dos pacientes em falha no braço do TDF apresentou a emergência das mutações M184V e K65R. A primeira suspeita recaiu em uma possível interação farmacológica desfavorável entre esses medicamentos, mas os níveis séricos extracelulares medidos estavam normais. Note que a mutação M184V leva à resistência ao 3TC, a mutação K65R leva à resistência ao TDF e a associação de ambas leva à resistência ao ABC. Portanto, são necessárias apenas duas mutações para que se obtenha resistência completa a um esquema como este, caracterizando uma barreira genética extremante baixa.
O mesmo possivelmente ocorre em esquemas que utilizam a combinação de AZT, 3TC e ABC, nos quais apenas duas mutações são suficientes para comprometer seriamente a eficácia do esquema (códons 215 e 184 da transcriptase reversa). O estudo ACTG 5095 randomizou pacientes que receberam AZT/3TC/ABC (n = 382), comparados a pacientes que receberam AZT/3TC/EFV (n = 765). Houve falha de 21% dos pacientes no braço do ABC, comparada a 11% no braço de EFV.15
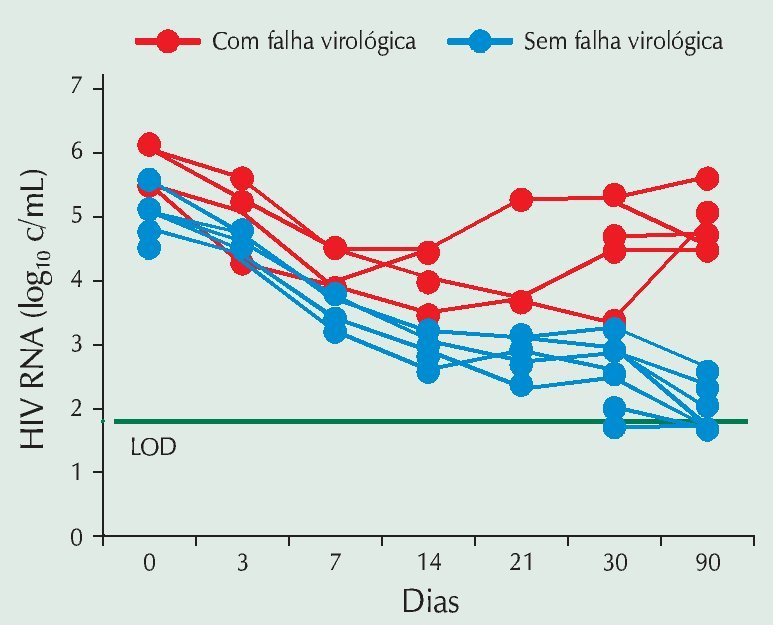
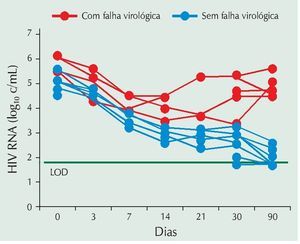
Teoricamente, poderiam ser utilizados até quatro ITRN, desde que cada um deles fosse competidor de um nucleotídeo distinto (adenosina, timidina, citosina e guanosina). Dois inibidores de um mesmo tipo de nucleotídio teoricamente não ofereceriam um benefício extra na atividade antirretroviral (AZT e d4T, ou 3TC e zalcitabina [ddC] ou TDF e ddI). Como exemplo, temos o estudo piloto que acompanhou 22 pacientes previamente virgens de tratamento por 24 semanas em uso de TDF, ddI e 3TC. As falhas aqui também foram dramaticamente altas: 20 entre os 22 pacientes (91%). Nesse caso, 20 pacientes apresentaram a mutação M184V e 10 apresentaram a mutação K65R, que são as mutações de resistência tanto do ddI quanto do TDF.33 Novamente, houve especulação sobre a baixa barreira genética do esquema, que precisaria de apenas duas mutações para proporcionar resistência completa. Dois detalhes aqui chamam a atenção: o primeiro é que existem mais falhas do que mutação de resistência, posto que somente a metade dos pacientes que falharam apresentou as mutações para TDF e ddI. A segunda relaciona-se ao fato de que a porcentagem de pacientes falhando é muito mais elevada. Uma das explicações para isso pode residir no fato de que tanto o TDF quanto o ddI estariam inibindo a mesma subetapa do ciclo replicativo do HIV, a competição pela adenosina. Desse modo, é concebível que a associação ddI/TDF, em termos de eficácia, corresponda ao uso de não dois, mas apenas um medicamento.34 Assim, a associação TDF, ddI e 3TC corresponderia, hipoteticamente, a um esquema duplo. Essa possibilidade ficou mais clara ainda em outro estudo, que comparou TDF, ddI e EFV a TDF, ddI, EFV e LPV/r por 12 semanas em pacientes previamente virgens de tratamento.35 Sabe-se que esquemas usando dois ITRN e EFV são os que normalmente apresentam melhor desempenho (primeiro braço). Nota-se também que a literatura confirma que, para tratamento inicial, quatro medicamentos não apresentam superioridade a três medicamentos (segundo braço). Entretanto, foram detectadas seis falhas em 14 pacientes no braço sem o LPV/r, enquanto nenhuma falha ocorreu no braço com LPV. Múltiplas mutações foram detectadas no braço com mau desempenho dos antirretrovirais, como quatro pacientes com L74V/I (ddI), dois com K65R (ddI e TDF), cinco com G190S/E e um com K103N (ambos EFV). Foi interessante notar que todas as falhas ocorreram nos pacientes com carga viral superior a 100.000 cópias/mL, e a queda dos níveis de carga viral nos pacientes com falha demonstrou que nenhum deles chegou a níveis indetectáveis antes da falha virológica, o que é mais típico de falta de potência do que falha por resistência secundária (fig. 3). Especulamos aqui, também, que essa associação (ddI, TDF e EFV) poderia se tratar de esquema duplo e não triplo, e, obviamente, o esquema duplo usando um ITRN e um ITRNN falharia antes em pacientes com carga viral basal mais elevada.
Figura 3 Falha virológica precoce entre pacientes previamente virgens de tratamento tratados com tenofovir, didanosina e efavirenz. Carga viral em log10 cujo limite inferior de detecção é de 1,69 log10 (50 cópias/mL).35
Dois inibidores de um mesmo tipo de nucleotídio teoricamente não ofereceriam um benefício extra na atividade antirretroviral
De acordo com os observações adicionadas às interações farmacológicas imprevisíveis entre esses dois medicamentos36 e à toxicidade celular decorrente dessa associação, na qual mesmo havendo uma resposta virológica pode haver uma pronunciada queda de CD4,34 a combinação entre ddI e TDF não deveria ser utilizada.
A conclusão do estudo ACTG 5201, comparando desempenho de doses fixas de TDF/FTC com doses fixas de ABC/3TC, demonstrou de maneira inequívoca que para níveis elevados de carga viral (superiores a 100.000 cópias/mL), o desempenho da primeira dupla de medicamentos foi superior ao da segunda.25 A explicação mais provável que encontramos para justificar esse ocorrido está na diferença entre as barreiras genéticas das duas duplas de ITRN. Em ambos os casos, a mutação que ocorreria mais precocemente seria a M184V, mutação selecionada tanto pelo FTC quanto pelo 3TC. Ocorre que a mutação M184V piora a suscetibilidade do ABC, mas melhora a ação do TDF. Obviamente, é concebível que essa mutação seja selecionada mais frequentemente quando os níveis de carga viral basal são altos, explicando assim a diferença de resultados ocorrida nesse estudo. Assim, apesar das características semelhantes dos ITRN, a combinação TDF/3TC ou FTC apresentaria uma barreira genética maior que a combinação ABC/3TC ou FTC.
Os estudos que comparam dois ITRN com ITRNN ou IP-r confirmam que o desempenho dos braços usando ITRNN (EFV ou NVP) é superior ou igual ao braço contendo IP-r.24,25,37 A diferença encontra-se normalmente na emergência de resistência por ocasião da falha. Como mencionado anteriormente, a frequência de resistência aos ITRNN é elevada na falha, e muitas vezes acompanhada de resistência aos ITRN que fazem parte do esquema. A falha aos esquemas contendo IP-r não demonstra desenvolvimento de resistência aos IP e menor incidência de mutações para os ITRN. Pode-se dizer, portanto, que esquemas contendo IP-r não apresentam maior barreira genética, como também protegem a emergência de resistência para os ITRN quando comparados aos esquemas contendo ITRNN.
O INI DTG demonstrou, por sua vez, que apresenta uma barreira genética excelente, mudando o paradigma da classe anteriormente representada pelo RAL e EVG. Em nenhum dos estudos pivotais utilizando DTG para início de tratamento houve seleção de mutações de resistência a esse medicamento ou aos ITRN associados a ele. O estudo SINGLE comparou a associação de DTG com ABC/3TC com a associação de dose fixa combinada contendo TDF/FTC/EFV para o tratamento inicial. Foram recrutados 414 pacientes no braço do DTG, em comparação a 419 no braço do EFV. Após 144 semanas, nenhum dos 414 pacientes falhando ao DTG apresentou qualquer mutação de resistência, enquanto entre os 419 pacientes falhando ao EFV, um apresentou mutação aos ITRN (K65R) e seis apresentaram mutações ao EFV.38
De maneira semelhante, o estudo FLAMINGO comparou o DTG ao DRV-r, ambos associados a dois ITRN, para pacientes virgens de tratamento. Ao final de 96 semanas, 1% dos 242 pacientes alocados no braço do DTG (dois pacientes) e 2% dos 242 pacientes do braço do DRV-r (quatro pacientes) apresentaram falha virológica. Nenhum apresentou vírus com mutações de resistência na transcriptase reversa, na protease (DRV) ou na integrase (DTG), confirmando a barreira genética semelhante entre DTG e IP incrementados pelo ritonavir.38,39
Em nenhum dos estudos pivotais utilizando DTG para início de tratamento houve seleção de mutações de resistência a esse medicamento ou aos ITRN associados a ele Mais um exemplo vem do estudo SPRING-2, que comparou DTG e RAL no tratamento inicial, ambos associados a dois ITRN, estudo esse que começou com 411 pacientes em cada braço. Ao final de 24 semanas, foi detectada falha virológica em 5% (20 pacientes) no braço do DTG, comparados a 7% (28 pacientes) no braço do RAL. Nenhuma mutação de resistência foi detectada em 12 pacientes nos quais a genotipagem foi possível no braço do DTG, comparado a um paciente apresentando resistência ao RAL e quatro pacientes com mutações de resistência aos ITRN entre 19 pacientes do braço do RAL em que a genotipagem foi possível, confirmando mais uma vez que medicamentos de maior barreira genética protegem os medicamentos de menor barreira genética (ITRN).40