Las interacciones de la membrana celular con proteínas o con receptores celulares se modifican por la acción de etanol en la membrana. El etanol y otros alcoholes pequeños, al ser surfactantes naturales de interfases acuosas/orgánicas, actúan también sobre la membrana celular estresándola mecánicamente e inhibiendo la adsorción natural de grupos terminales en dichas interfases. En este trabajo se muestra como el metanol bloquea la adsorción de los grupos terminales aun a concentraciones muy bajas. Conforme aumenta la concentración de metanol en la fase acuosa, la tensión interfacial decrece, lo que muestra estrés adicional sobre la membrana celular.
The interaction of ethanol on the cellular membrane inhibits the interaction with membrane proteins or cellular receptors. Ethanol and other small alcohols are natural surfactants of aqueous/organic interfaces, and also affect the cellular membrane stressing it mechanically, and inhibit the natural adsorption of terminal groups at the aqueous/organic interface. In this work we show how methanol inhibits the adsorption of terminal groups even at very small concentrations. As methanol concentration increases in the aqueous phase, the interfacial tension decreases, showing additional stress over the cellular membrane.
Se han propuesto varios mecanismos para explicar los efectos de alcoholes pequeños en la membrana celular. Entre estos mecanismos se encuentran respuestas ampliadas de receptores GABAA (ácido ã-aminobutírico tipo A) debido a la presencia de etanol1-2, e inhibición de receptores glutamato tipo NMDA3-4. Un mecanismo adicional es la acción de alcoholes pequeños en la interfase entre la membrana celular y la fase acuosa que rodea a la célula5-7. El efecto de alcoholes pequeños sobre la interfase ha sido estudiado en membranas celulares de ratones, donde se ha encontrado un incremento de la fluidez de la membrana al ser expuesta al etanol8. Se encontró que un nivel óptimo de fluidez es necesario para algunas funciones fisiológicas.
Se sabe que, sin la adición de etanol, las membranas sinaptosomales son más fluidas que las membranas de mielina, y éstas a su vez son más fluidas que las membranas mitocondriales. Todas las membranas estudiadas incrementan su fluidez en la presencia de etanol a concentraciones bajas y altas, excepto por las membranas de mielina, que aun a concentraciones altas de etanol no incrementan su fluidez. El efecto de la adición de etanol tiende a desaparecer cuando la exposición a esta sustancia es por largos periodos6.
En este trabajo tratamos de demostrar que la molécula de alcohol más pequeña, es decir el metanol, bloquea la adsorción de las cadenas en la interfase acuosa/orgánica. En un artículo previo9 se mostró que los grupos hidrofóbicos pertenecientes a cadenas de hidrocarburos se adsorben preferencialmente en la interfase donde muestran un moderado aglutinamiento. Este efecto se puede considerar como equivalente al que ocurre cuando se condensa agua sobre superficies hidrofóbicas, donde también cerca de una interfase líquido/vapor las moléculas de agua muestran una preferencia a adsorberse en la interfase y eventualmente a condensarse. En este caso tenemos la adsorción de grupos hidrofóbicos en la interfase orgánica (rica en n-alcanos)/acuosa (rica en agua en fase vapor). Este mismo comportamiento se ha observado en cadenas con grupos terminales hidrofílicos autoensambladas en contacto interfacial con agua líquida10, lo cual es más parecido a sistemas biológicos reales.
En este trabajo se muestra que al introducir metanol, el más pequeño de los alcoholes, desaparece la adsorción de grupos terminales en la interfase, debido a que el metanol actúa como surfactante, bloqueando la interacción de los grupos terminales con la fase acuosa.
MetodologíaSe llevaron a cabo simulaciones de Dinámica Molecular manteniendo constantes el número de moléculas, volumen y temperatura del sistema (DM-NVT). El sistema consiste de fases líquidas en bulto con sus correspondientes interfases para obtener las densidades del bulto y las propiedades interfaciales (perfil de densidades a lo largo de la interfase y tensión interfacial) de la mezcla binaria agua con n-pentano y la ternaria agua con metanol y n-pentano. Todas las simulaciones se llevaron a cabo usando el algoritmo de Verlet a temperatura ambiente y constante; el tiempo de paso usado fue de 1 fs. Las diferentes concentraciones fueron modeladas usando entre 100 a 540 moléculas de agua, 150 a 350 moléculas de n-pentano, y de 50 a 220 moléculas de metanol.
Los parámetros de los potenciales de interacción usados para describir las moléculas de agua, metanol y n-pentano fueron tomados de la literatura11-13. Las fuerzas intermoleculares debido a interacciones tipo Lennard–Jones fueron calculadas usando un potencial truncado esféricamente14. Sitios en la misma molécula separados por 3 ó más enlaces también se modelaron con el potencial truncado esféricamente. El radio de corte para las interacciones tipo Lennard–Jones fue de 15.72 Å. Las interacciones electrostáticas se calcularon usando la técnica de sumatorias de Ewald. Las reglas de mezclado de Lorentz–Berthelot fueron usadas para calcular las interacciones cruzadas de sitios disimilares. Después de un periodo de equilibrio de 150 ps, las propiedades estudiadas se obtuvieron por un periodo adicional de simulación de 600 ps.
Las simulaciones DM-NVT de la interfase líquido-líquido de la mezcla binaria agua–n-alcano se llevaron a cabo a 298.15 K, sin considerar la formación de una fase gaseosa. Simulaciones previas a esta temperatura muestran que la cantidad de moléculas en la fase vapor es despreciable15, por lo que la formación de una interfase líquido-líquido-vapor no se espera. Debido a que se forzó la desaparición de la fase vapor y su correspondiente interfase líquido-vapor, el sistema no está completamente relajado, por lo tanto la presión del sistema se encuentra lejos de la presión de vapor de equilibrio del sistema. Para ajustar la presión del sistema a un valor experimental representativo, el tamaño de la celda de simulación se ajustó para producir una presión atmosférica.
La densidad de las fases se calculó usando los valores promedio de los perfiles de densidad, ajustadas a una función hiperbólica tangente16. Los perfiles se obtuvieron a lo largo del eje perpendicular a la superficie de la interfase. La tensión interfacial y la presión del sistema se calcularon a partir de la definición molecular del tensor de presiones17.
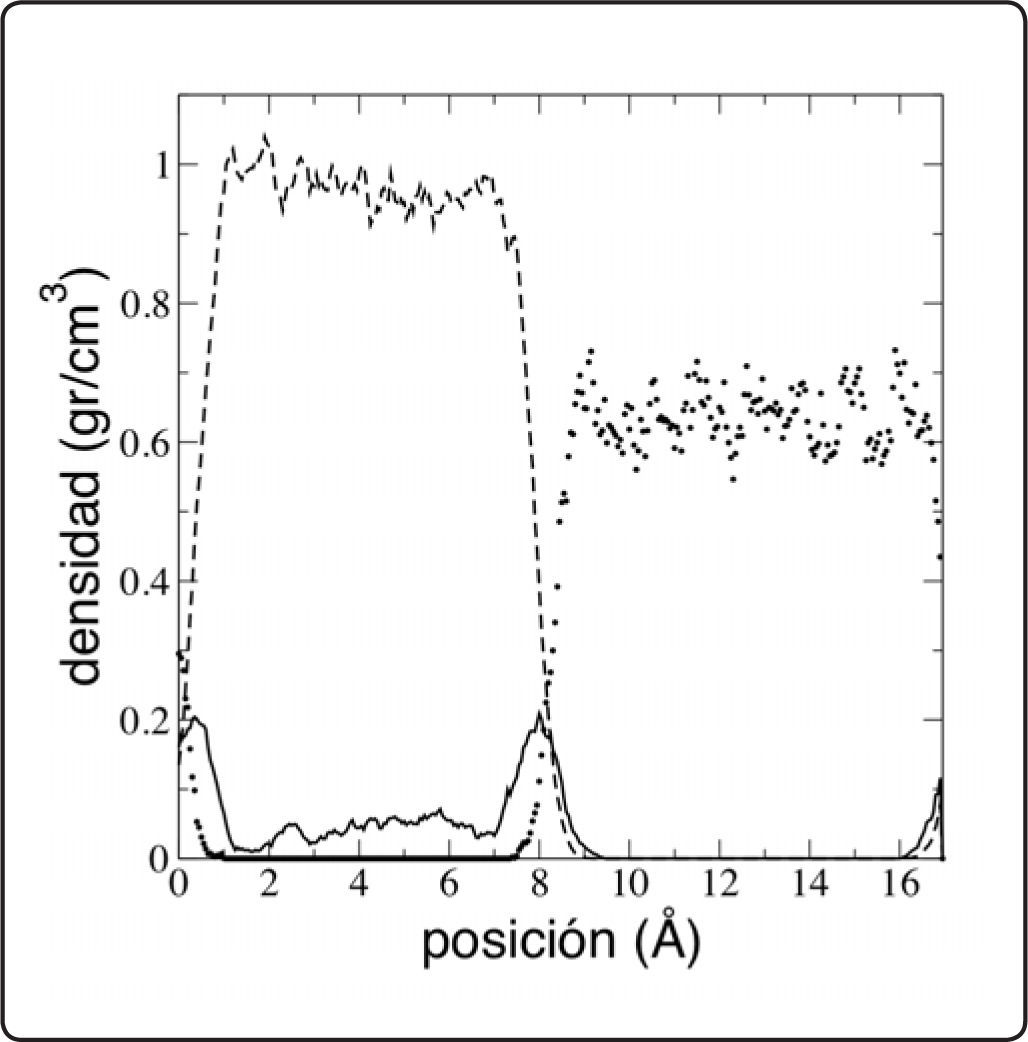
ResultadosLos perfiles de densidad promediados para el sistema binario agua–n-pentano en el equilibrio líquido-líquido a 298.15 K y a 1 atm aparecen en la Figura 1. El sistema se extiende en una celda de largo de alrededor de 28 Å, con un espesor interfacial de alrededor de 5 Å. El perfil de densidad del agua está bien definido en la interfase, en otras palabras podemos observar como empieza a decrecer en la fase acuosa y como termina de cambiar en la fase orgánica. Para la especie n-pentano, se puede observar como termina el perfil monótonamente en la fase acuosa, pero en la fase orgánica, cerca de la interfase, el perfil no decrece de esta forma. Cerca de las interfases, el perfil de densidad del n-pentano muestra dos picos con diferencias con respecto al valor de densidad promedio del bulto de alrededor de 0.08 g/cm3. Estos picos muestran que las moléculas de densidad se abultan en la interfase, es decir, se adsorben preferiblemente en la interfase. La tensión interfacial obtenida de este sistema es de 50.84 ± 3.16 mN/m, este valor se compara bien con el resultado experimental obtenido por Matsubara y asociados18.
El sistema ternario agua–n-pentano–metanol también se simuló en la coexistencia líquido-líquido a 298.15 K y a 1 atm. Se tomó de base una configuración equilibrada del sistema agua–n-pentano, donde algunas moléculas de agua fueron intercambiadas por metanol, para simular diferentes concentraciones. En la Figura 2 aparece un esquema de cómo luce el sistema en una conformación equilibrada a una fracción mol de 0.095 (sólo las moléculas de metanol se dibujaron en su tamaño normal para facilitar la comprensión de la conformación del sistema). La mayoría de las moléculas, a esta concentración baja de metanol, prefieren ubicarse en la interfase, o bien dentro de la fase acuosa, pero no dentro de la fase orgánica, lo que ubica al metanol como un aditivo interfacial del sistema agua–n-pentano. Bajo este esquema de simulación, se obtuvieron los perfiles de densidad para fracciones mol de metanol desde 0.024 hasta 0.681. Los perfiles de densidad para las fracciones mol de metanol de 0.024 y 0.179 se muestran en las Figuras 3 y 4, respectivamente. Como se observa en los perfiles de densidad, una vez que se agrega metanol al sistema agua–n-pentano, los picos de adsorción de n-pentano en la interfase casi desaparecen, y el bulto de la fase orgánica aparece un poco más estructurado, lo cual se muestra como variaciones constantes de la densidad a lo largo de la región del bulto en dicha fase.
Esquema del sistema ternario agua–n-pentano–metanol a 298.15 K y a 1 atm, con una fracción mol de metanol en la fase acuosa (izquierda) de 0.095 en equilibrio líquido-líquido. Sólo las moléculas de metanol fueron dibujadas en su tamaño real para facilitar una visión clara del sistema. Los átomos de oxígeno, hidrógeno y los grupos funcionales CH3 y CH2 son dibujados en gris oscuro, gris claro y negro, respectivamente.
La concentración de moléculas de metanol no sólo se incrementa en el bulto conforme aumenta la fracción mol de metanol; la concentración de moléculas de metanol en la interfase aumenta también considerablemente, como se puede observar en los perfiles de densidad a fracciones mol de metanol de 0.024 y 0.179. Además de interponerse entre las fases acuosa y orgánica, las moléculas de metanol también modifican las interacciones en la interfase, y conforme aumenta la concentración de moléculas de metanol en el bulto, la tensión interfacial del sistema decrece como se muestra en la Figura 5. Estos resultados muestran que las moléculas de metanol, debido a su naturaleza química (polares), cuando se adicionan a la mezcla agua–n-pentano funcionan como pequeños surfactantes, bloqueando las repulsiones entre las fases acuosa y orgánica. No se simularon concentraciones más altas de metanol debido a que a estas concentraciones desaparece la interfase líquido-líquido y aparece un sistema líquido-vapor.
Tensión interfacial del sistema ternario agua– n-pentano–metanol a 298.15 K, 1 atm en equilibrio líquido-líquido, como una función de la fracción mol de metanol. Los cuadrados representan los resultados experimentales de Hampton y colaboradores19 Los círculos representan los resultados de este trabajo.
Sistemas modelo que intentan recrear las fuerzas interfaciales entre la membrana celular y las fases acuosas líquidas, muestran que el metanol tiene el efecto de bloquear la adsorción de grupos funcionales hidrofóbicos, preferiblemente en la interfase. El metanol tiene la misma organización de grupos funcionales que el etanol, del cual ya se ha mostrado sus efectos sobre las membranas y en general sobre ciertas funciones fisiológicas, por lo que se espera que este estudio con metanol muestre la tendencia en los fenómenos moleculares que ocurren con el etanol. Las cadenas de lípidos se adsorben preferiblemente en la interfase cuando no hay ningún surfactante (metanol) presente en el sistema. Tomando en cuenta que a la membrana celular se le describe como una doble capa de lípidos, se puede esperar que en ausencia de metanol los grupos funcionales terminales también se anclen selectivamente en la interfase, y el efecto del metanol provoque un bloqueo de esa adsorción preferente, induciendo una separación adicional entre las cadenas de lípidos, incrementando la razón área superficial/número de cadenas. Esta separación adicional es probablemente la causa del incremento de la fluidez de las membranas celulares.
La adsorción preferente en la interfase se puede considerar como el efecto equivalente a la condensación de moléculas de agua en superficies hidrofóbicas.
Al aumentar la concentración de metanol en el sistema se observa un incremento del efecto surfactante del metanol en la mezcla agua–n-pentano, el cual se manifiesta en una mayor reducción de la tensión interfacial del sistema.
En sistemas biológicos reales, la membrana celular está compuesta de cadenas donde los grupos terminales en contacto con la molécula de agua son hidrofílicos, aun en esos sistemas esperamos el mismo comportamiento que en los sistemas estudiados en este trabajo, donde las moléculas alcohólicas actuarán como surfactantes, incrementando la relación entre el área superficial y el número de cadenas, lo que también provocará un efecto desorbedor y, finalmente, un aumento de la fluidez de la membrana celular.
José Luis Rivera agradece el apoyo del CONACYT en su programa de Ciencia Básica, bajo el proyecto No. 134508.