En los bosques templados están sucediendo modificaciones importantes debido al cambio climático; en latitudes polares va en aumento su área de distribución, mientras que en las tropicales se reduce por incremento en la temperatura y las sequías. Uno de los agentes bióticos reguladores de los bosques templados son los insectos descortezadores que ocasionan la mortalidad de ciertos árboles. Estos insectos han aumentado en número, favorecidos por el cambio climático y las consecuencias sobre los bosques no se han dejado esperar. En épocas recientes en el hemisferio norte la mortalidad masiva de coníferas debida a la sinergia negativa entre cambio climático e insectos descortezadores ha sido evidente. En México, también se han experimentado infestaciones por descortezadores nunca antes vistas; por lo que se está tratando de entender las interacciones involucradas entre el cambio climático, la salud forestal y los insectos descortezadores, para detectar las áreas con mayor susceptibilidad al ataque por estos insectos y proponer medidas de manejo que disminuyan las afectaciones.
Temperate forests are experiencing important modifications due to climate change, in polar latitudes they are increasing their distributional range while in tropical latitudes they are decreasing, due to higher temperature and droughts. Bark beetles are considered one of the biotic agents that regulate temperate forests because they kill some trees. These insects have increased in abundance, favored by climate change, and the consequences for temperate forests are evident. In recent times, the northern hemisphere has suffered a massive coniferous mortality due to the negative synergy between climate change and bark beetle abundance. Mexico has also experienced bark beetle infestations never seen before; this is why it is important to understand the interactions between climate change, forest health and bark beetle abundance to visualize the most important bark beetle susceptible areas in Mexico. Also with this information we could propose management strategies to diminish bark beetle impacts.
Los bosques templados en el mundo, constituyen un ecosistema que abarca el 15% de la superficie terrestre, siendo importante por la provisión de servicios ambientales para los humanos. En México, los bosques templados están dominados por coníferas del género Pinus con la mayor diversidad de especies de este género a nivel mundial, convirtiéndose el país en el centro de origen y diversificación de este grupo (Challenger & Soberón, 2008). El género Pinus se originó en el Cretácico inferior (hace ∼145 millones de años) y en la actualidad cuenta con 111 especies, de las cuales 46 especies con 3 subespecies y 22 variedades están presentes en México y de éstas 55% son endémicas (Sánchez-González, 2008). Los bosques de pino en México, se encuentran distribuidos principalmente en las sierras con altitudes entre los 1,500 a los 4,000 msnm. Dependiendo de la altitud, la exposición y la latitud en la que se encuentren, se congregan en diferentes comunidades, formando bosques de coníferas, bosques de pino-encino o bosques de encino-pino, según la dominancia de cada género (Rzedowski, 1978).
Además de su importancia filogenética y biogeográfica, el género Pinus tiene una gran relevancia social, ya que por su utilidad se ha convertido en una parte significativa del desarrollo de México y hoy en día muchas comunidades rurales dependen de los bosques como forma de vida.
El manejo de los bosques de pino en México, se relaciona principalmente con la explotación maderera. Según los datos de la Comisión Nacional Forestal (CONAFOR) en 2014 se cosecharon 4.3 millones de m3 de pino y representaron un ingreso de 6,039 millones de pesos (SEMARNAT, 2015); además, los bosques de pinos proveen otro tipo de recursos no maderables como la resina, animales para alimento, plantas medicinales y ornamentales y de manera muy importante de combustible para un número importante de hogares. Se ha calculado que 27 millones de personas dependen de la leña para cocinar tanto en el sector urbano como el rural (Berrueta Soriano, 2007). Los bosques de pino en México, son fundamentales también para la provisión de servicios ambientales como son: la captura de agua, captura y almacén de carbono, regulación de la temperatura, además de ser un resguardo de la biodiversidad y belleza escénica (CONABIO, 2009). Sin embargo, a pesar de que los bosques templados mexicanos están sujetos a un uso importante y una porción creciente de ellos se encuentra bajo algún programa de manejo, existe una gran disparidad en cuanto a su éxito. Si bien hay comunidades con una organización y manejo ejemplar, como Nuevo San Juan Parangaricutiro en Michoacán e Ixtlán de Juárez en Oaxaca, en numerosas comunidades forestales existe la tala ilegal e incendios no controlados, aún con planes de manejo vigentes, lo cual pone en riesgo el desarrollo sustentable de las regiones de bosque templado en el país (Bray et al., 2007).
Actualmente, los bosques de pino en México, cubren aproximadamente 10 millones de Ha, no obstante, de acuerdo con Challenger & Soberón (2008), solamente el 50% se encuentra en buen estado de conservación y el resto presenta algún tipo de deterioro. Debido a la sobrexplotación y cambio de uso de suelo, algunas especies están dañadas y requieren de protección legal específica para su conservación. De hecho, se ha registrado que al menos 20 taxa de pinos están en alguna categoría de riesgo y dos de ellos: Pinus maximartinezii y P. muricata se encuentran en peligro de extinción (Sánchez-González, 2008).
DISTURBIO EN LOS BOSQUES TEMPLADOSLos bosques templados presentan regímenes de disturbios variables. En algunas regiones el fuego es el principal agente que permite la regeneración de especies no dominantes y elimina a los árboles débiles e incluso algunas especies de pino dependen de las altas temperaturas generadas por el fuego para que se abran los conos donde se alojan sus semillas (Pausas & Keeley, 2009). Debido a que la gran mayoría de los bosques de pino son manejados por el hombre, la frecuencia e intensidad de los fuegos naturales se han modificado. En algunos lugares se suprimen los fuegos, para impedir la pérdida del arbolado, mientras que en otros, se han promovido en exceso los incendios, para realizar cambio de uso de suelo con fines agrícolas o ganaderos (Rodríguez-Trejo, 2008; Pérez-Salicrup et al., 2016).
DESCORTEZADORESLos escarabajos descortezadores son coleópteros herbívoros que pertenecen a la familia Curculionidae de tamaño muy pequeño, su cuerpo oscila entre los 0.1 y 0.6cm y presentan el hábito de ser endófitos, cavan galerías por debajo de la corteza de los árboles para alimentarse. Hay dos grandes grupos: los pertenecientes a la subfamilia Scolytinae que se alimentan directamente del floema de los árboles y los escarabajos conocidos como Ambrosiales, dentro de la subfamilia Paltipodinae, que además de perforar la corteza, cultivan hongos ambrosiales y no se alimentan directamente del árbol hospedero, sino de los hongos que cultivan en su interior (Farrel et al., 2001). Entonces, es importante diferenciar que aunque los dos grupos de Curculionidae viven dentro de los árboles, solamente unos se alimentan directamente del floema (Scolytinae), mientras que los otros de los hongos que cultivan (Platipodinae). En ambos casos, los escarabajos adultos cavan un túnel en la corteza de los árboles para ovipositar por debajo de ella. En algunas especies de ambos grupos solamente la hembra cava y en otras la ayuda el macho. Una vez dentro del árbol y después de aparearse, las hembras hacen un túnel vertical en donde van ovipositando, separando los huevos con cierta distancia entre sí, para que no haya interferencia entre las larvas al momento de alimentarse. Cuando emergen las larvas conforme van alimentándose, cavan túneles longitudinales alejándose del túnel parental y comen hasta que adquieren la talla adecuada para llevar a cabo la metamorfosis, salir del árbol como adultos y completar su ciclo de vida. Cada especie de descortezador deja un patrón de galerías diferente en la madera del árbol (Wood, 1982). En el caso de los escarabajos ambrosiales, cada especie tiene una asociación mutualista con un hongo en particular, por lo que cuando los jóvenes adultos emergen de los árboles para buscar una pareja y aparearse, llevan consigo esporas de su hongo simbionte con el fin de compartir con la nueva generación el hongo que les proporcionará alimento, asegurando así el bienestar de la nueva generación (Wood, 1982). Por lo general, la mayoría de las especies de escarabajos descortezadores atacan árboles debilitados por la edad, la sequía, el fuego, enfermedades o daño mecánico, sin embargo, hay especies agresivas como Dendroctonus frontalis (Fig. 1) y Dendroctonus ponderosae que, cuando sus poblaciones son muy grandes, pueden infestar árboles sanos al realizar ataques masivos sobre ellos en superficies extensas (Billings et al., 2004; Bentz et al., 2010).
En el mundo hay descritas alrededor de 3,000 especies de escarabajos descortezadores y en México se encuentran 870 de éstas distribuidas en 87 géneros, aunque es probable que esta cifra aumente, porque aún se siguen describiendo nuevas especies (Atkinson, 2013).
Los descortezadores tienen una función primordial en la dinámica de los bosques templados, al promover el recambio de especies vegetales permitiendo el establecimiento de otras que son menos competitivas cuando eliminan a algunos individuos dominantes. Sin embargo, son pocas las especies de insectos que pueden causar la mortalidad de los árboles por si mismas, la mayoría no matan al árbol hospedero y se mantienen en poblaciones pequeñas como agentes de saneamiento natural del bosque (Christiansen & Bakke, 1988). En México, el número de especies de escarabajos descortezadores que causan mortalidad de las coníferas, se reduce a menos de 20, la mayoría pertenecen al género Dendroctonus y algunas especies al género Ips (Cibrián-Tovar et al., 1995; Salinas-Moreno et al., 2004; Fonseca et al., 2008).
CAMBIO CLIMÁTICOLos cambios ambientales que el planeta Tierra está experi-mentando debido a las actividades antropogénicas, han tenido diferentes repercusiones sobre los ecosistemas. En promedio la temperatura global del planeta se ha incrementado entre 0.5-1°C y con ello los fenómenos meteorológicos extremos como tormentas o huracanes (World Metereological Organization, 2013). En México, también se ha observado un aumento generalizado en la temperatura en épocas recientes (Sáenz-Romero et al., 2010) independientemente de las oscilaciones relacionadas con el fenómeno meteorológico de El Niño (Pavia et al., 2009). Las predicciones para el año 2030, indican que el país experimentará un creciente nivel de temperatura de 1.4°C en promedio y una disminución en la precipitación promedio de 5.6% (Sáenz-Romero et al., 2010). En algunas regiones la temperatura ha sido incluso mayor y se ha combinado con una reducción en la precipitación, propiciando condiciones de sequía inusuales. En particular los efectos directos del cambio climático sobre la vegetación son evidentes en todo el mundo (Walther et al., 2002; Parmesan & Yohe, 2003). Por ejemplo, las zonas áridas y semiáridas están expandiéndose (Archer et al., 1995), el límite latitudinal de los bosques templados se ha recorrido hacia los polos (Grace et al., 2002) y varios tipos de vegetación, así como varias especies en particular, han migrado altitudinalmente en tiempos recientes (Lenoir et al., 2008). Las poblaciones de animales también han experimentado cambios importantes; por ejemplo, en Gran Bretaña se ha reportado que 22 especies de mariposas han expandido su ámbito hogareño hacia latitudes más frías (Parmesan et al., 1999), mientras que en España, 16 especies de mariposas cambiaron su distribución altitudinal (subieron casi 200 m) lo que representa un aumento considerable de su hábitat óptimo (Wilson et al., 2005).
CAMBIO CLIMÁTICO Y DESCORTEZADORESEn particular, el cambio climático global en los bosques templados ha propiciado una disminución en la intensidad de los inviernos y se ha reducido el número de días con temperaturas bajo cero, por lo que se consideran como uno de los ecosistemas más vulnerables ante el fenómeno (González et al., 2010). Varios estudios han documentado que existe un desacoplamiento entre las condiciones climáticas actuales y los requerimientos ambientales de los bosques templados (Smith et al., 1992; Brolsma, 2010; Reich et al., 2016), y que este desacoplamiento se acentuará hacia el futuro con las predicciones climáticas para las regiones templadas (Rehfeldt et al., 2012). En términos biológicos, esta situación de alteración climática, ha dado lugar a que el crecimiento de los árboles, pueda extenderse por un mayor periodo de tiempo en las regiones más frías (Bentz et al., 2010), mientras que los árboles en el límite de distribución altitudinal inferior y latitudinal hacia el Ecuador, se encuentran más estresados por sequía ocasionando mortalidades masivas por falta de agua (Allen et al., 2010; Mátyás, 2010; Worral et al., 2013; Allen et al., 2015). En estos mismos bosques, la regulación de las especies de herbívoros relacionada con la presencia de las bajas temperaturas, ha disminuido considerablemente dando como resultado que las poblaciones de algunos insectos herbívoros aumenten y se conviertan en plaga al expandir sus poblaciones, en particular Dendroctonus ponderosae y Dendroctonus frontalis (Bentz et al., 1991; Safranyik & Linton, 1998; Raffa et al., 2008). Este es el caso de los escarabajos descortezadores que ha sido bien documentado en Estados Unidos, Canadá y Europa (Ungerer et al., 1999). Solamente en Canadá, en el año 2008 se reportó una infestación epidémica en los bosques de la Provincia de Columbia Británica, con un brote de Dendroctonus ponderosae que en menos de 10 años acumuló 14 millones de hectáreas afectadas donde hubo una mortalidad desproporcionada en cinco especies de pinos (Safranyik et al., 2010) En Colorado y Arizona, el grupo de investigación de Negrón et al., 2009, modelaron en el paisaje los factores determinantes que dieron lugar a una creciente mortalidad de Pinus ponderosa asociada a descortezadores (Dendroctonus ponderosae, Ips lecontei, I. pini, I. calligraphus, I. latidens, I. knausi e I. integer) y encontraron que los sitios con mayor sequía ubicados en altitudes menores presentaban mayores mortalidades arbóreas (Negrón & Popp, 2004; Negrón et al., 2009). En Europa se han experimentado situaciones similares, particularmente entre 1980 y 1985 hubo sequías recurrentes en el centro del Continente que desencadenaron en una infestación importante de varios géneros como (Ips, Dendroctonus, Scolytus y Tomicus), sobre diversas coníferas (Picea spp., Pinus spp., Abies spp.), con una mortalidad inusual de árboles localizados en rangos altitudinales menores (Schutt & Cowling, 1985).
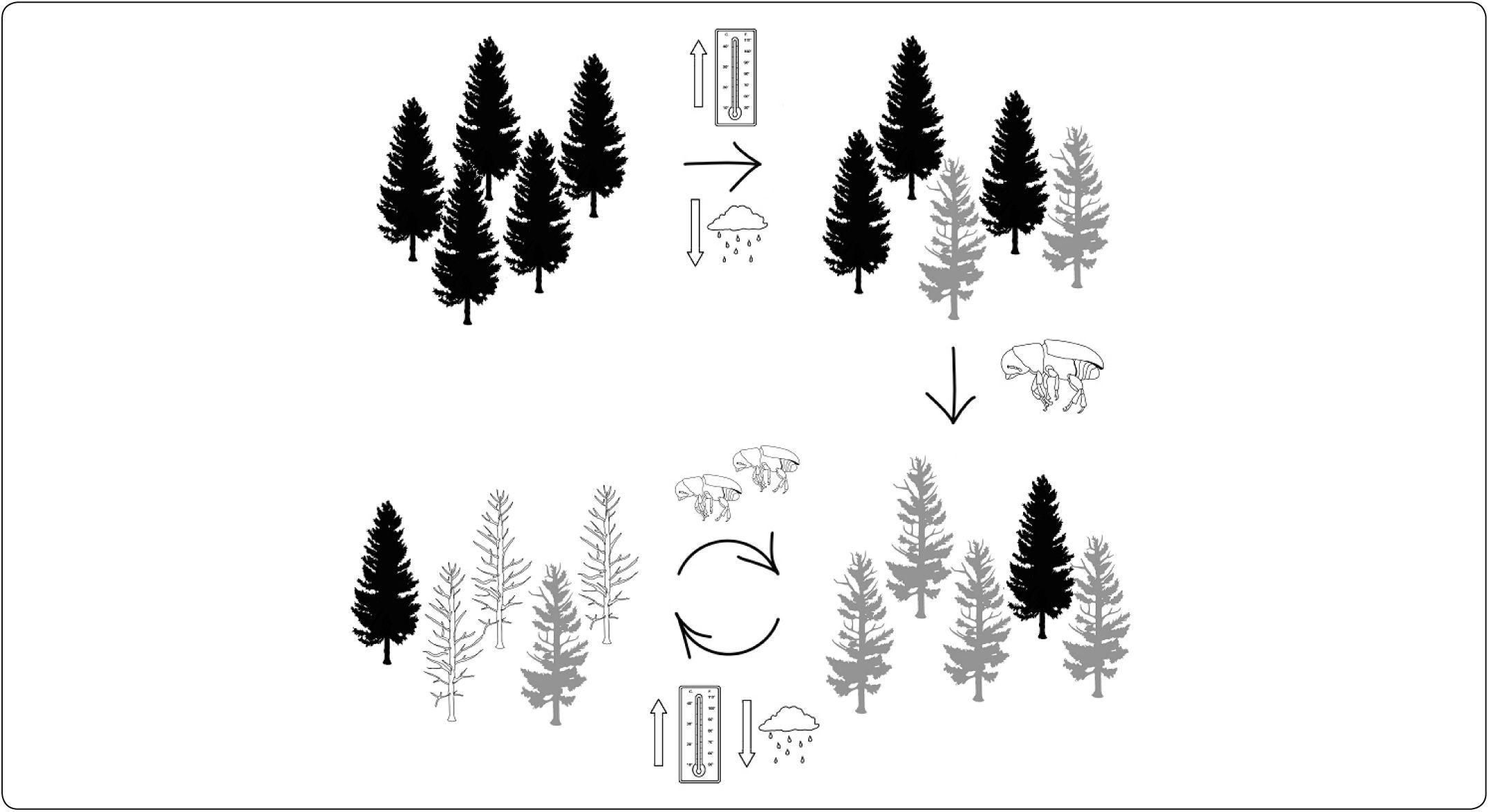
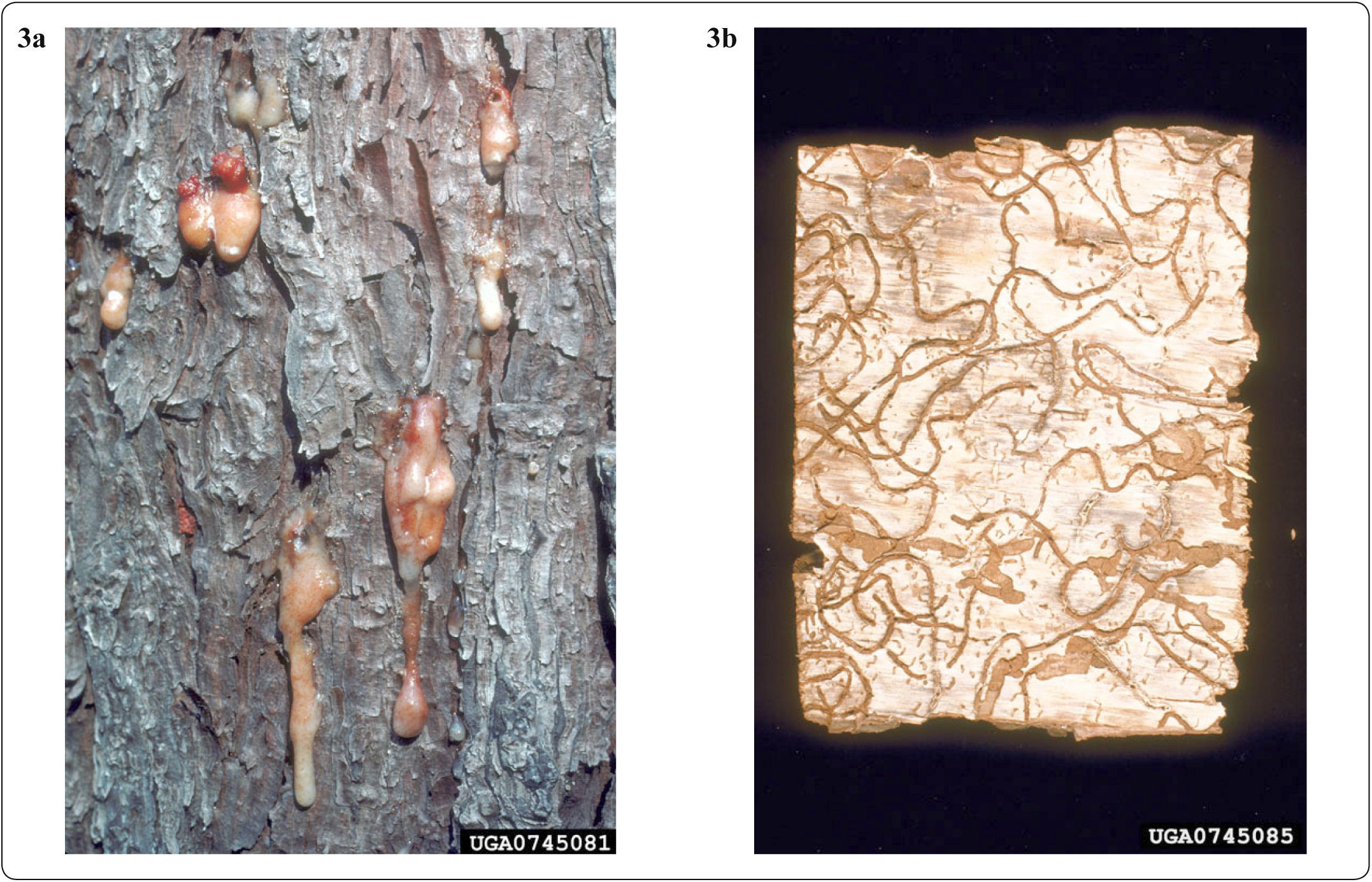
La problemática, que los escarabajos descortezadores repre-sentan para los bosques templados, en las condiciones actuales de cambio climático, son un ciclo de retroalimentación negativa con impacto muy fuerte sobre los ecosistemas templados y que continúa en aumento conforme las temperaturas y la sequía se acentúan (Logan et al., 2003; Anderegg et al., 2015). Es decir que, al aumentar la temperatura, las poblaciones naturales de descortezadores incrementan el número de individuos y su capacidad de infestación, mientras que los árboles se ven estresados por la sequía y disminuyen su capacidad de defenderse del ataque de estos insectos (Fig. 2). Como se explicó anteriormente, los árboles en los límites xéricos de distribución de estos ecosistemas regularmente se encuentran sometidos a un estrés anormal y por lo tanto están fisiológicamente disminuidos, lo que implica que tienen una menor capacidad de defenderse del ataque de los insectos herbívoros y en condiciones extremas se mueren. Los pinos se defienden de ellos mediante la producción de resinas, de manera que un árbol sano al ser perforado por un insecto, libera un torrente de resina que impide a éstos penetrar a sus tejidos (Fig. 3); sin embargo, cuando el árbol está débil presenta menos resina al reducirse ésta en los ductos por donde pasa en el xilema o incluso deja de producirla y los insectos penetran y acceden fácilmente al floema, terminando por matar al árbol (Gaylord et al., 2015). Por otro lado, el aumento en la temperatura ambiental además de disminuir la mortalidad de los insectos en el invierno (Safranyik & Linton, 1998; Faccoli, 2002), acelera su ritmo metabólico, inhibe la diapausa y ha permitido que aumenten el número de generaciones que tienen por año (Bentz et al., 1991; Bentz et al., 2010). Algunos estudios, han reportado por ejemplo que en el sur de Italia, donde el clima es menos extremo que en el norte, Ips typographus presenta dos generaciones al año en lugar de una que era lo usual (Faccoli, 2002). Otros estudios han encontrado que las poblaciones de Pinus contorta del norte de la Columbia Británica que no habían estado expuestas a incrementos poblacionales de Dendroctonus ponderosae, son más susceptibles a los nuevos ataques que las poblaciones donde coincidían ambas especies, por lo que prevén que las explosiones poblacionales sigan teniendo efectos muy importantes en las poblaciones norteñas (Cudmore et al., 2010). En épocas recientes, estudios relacionados con los grandes brotes de Dendroctonus ponderosae en Canadá, estimaron la modificación en el sumidero de carbono que normalmente representan los bosques templados al producirse una mortalidad masiva de árboles. Kurz et al. (2003), calcularon que los bosques de Columbia Británica, en los años de fuerte infestación, no solamente dejaron de absorber el bióxido de carbono atmosférico, sino que se convirtieron en una importante fuente de producción de bióxido de carbono equivalente al ∼75% de los gases emitidos anualmente en todo Canadá, debido a los incendios forestales. Por otro lado, en California, Etaough Jones et al. (2004), encontraron que los pinos en sitios con alta contaminación por nitrógeno son más susceptibles al ataque por descortezadores. De manera que la retroalimentación negativa, con el aumento en las emisiones de gases de efecto invernadero, debido a la mortalidad masiva de árboles y calentamiento global, también tenderá a acrecentarse junto con la deposición de nitrógeno.
a) Tronco de pino atacado por descortezadores. Se muestran los grumos de resina producidos por el árbol ante la perforación de los escarabajos, fotografía cortesía de Erich G. Vallery, USDA Forest Service - SRS-4552, Bugwood.org. b) Galerías formadas por D. frontalis debajo de la corteza de los pinos, fotografía cortesía de W.H. Bennett, USDA Forest Service, Bugwood.org
Por lo hasta aquí expuesto, los bosques templados de México, no son la excepción ante las consecuencias del cambio climático y su relación con las plagas forestales (Návar, 2015). En épocas recientes, se han documentado brotes de escarabajos descortezadores que afectan grandes extensiones de bosques. Por ejemplo, en el año 2013 el 12% de los bosques de pinos presentaron brotes (Sistema Nacional de Información Ambiental), en particular en ese mismo año el 25% de los bosques de Durango y 18% de los bosques de Chihuahua tuvieron una afectación importante.
Históricamente, los mayores brotes de descortezadores en México, han ocurrido en el Eje Neovolcánico transversal, zona que coincide con la mayor diversidad de pinos, pero no con la mayor diversidad de especies de descortezadores del género Dendroctonus (Salinas-Moreno et al., 2010). En Michoacán, se ha reportado un aumento en la incidencia de brotes de estos insectos: en la Reserva de la Biosfera de la Mariposa Monarca en los años 2007-2008, cuando se presentó una sequía importante, se registraron infestaciones de Scolytus mundus causando una alta mortalidad sobre árboles de oyamel (Manzo-Delgado et al., 2013). En la comunidad forestal de Nuevo San Juan Parangaricutiro, también se identificó un incremento en el número de brotes de descortezadores, por lo que se realizó un estudio para evaluar tanto la incidencia de éstos en el bosque como el daño. En dicho trabajo se encontró la existencia de una relación significativa entre la abundancia de este tipo de insectos y las máximas temperaturas (Rubín-Aguirre et al., 2015); en la comunidad donde se realizó el estudio existe una mayor riqueza y abundancia de descortezadores secundarios en altitudes bajas (mediada por las máximas temperaturas) y también un mayor daño sobre el arbolado. Este patrón, aporta información para interpretar el aumento de descortezadores en altitudes menores de los bosques de pino, así como corroborar que los pinos están debilitados en los sitios con mayor temperatura y también que la abundancia de insectos es mayor a bajas altitudes, siendo el resultado un aumento en la probabilidad de focos de infestación, sobre todo si este patrón se corrobora con descortezadores más agresivos. Adicionalmente, es importante resaltar que la abundancia y distribución de los descortezadores también está muy relacionada con factores bióticos como la comunidad de depredadores en cada lugar (Reeve, 1997; Ryall & Fahrig, 2005), así como con la composición de la vegetación de cada bosque en particular (Winter et al., 2015; Dhar et al., 2016). En México, hay muy pocos estudios que hayan realizado evaluaciones sobre estos factores, por lo que sin duda representan un área de oportunidad significativa.
CONCLUSIONESLas predicciones de cambio climático en México son drásticas para los bosques templados y son pocos los estudios que documenten la distribución espacio-temporal de la infestación, magnitud de los brotes de descortezadores en ellos y su posible asociación con el incremento de la temperatura y cambio en el patrón de lluvias. Debido a las evidentes consecuencias negativas que se han registrado en otros países como: la mortalidad masiva de árboles, el aumento en la emisión de gases de efecto invernadero, así como las repercusiones para las comunidades que viven de los bosques con la consecuente pérdida de su sustento de vida, es fundamental encaminar esfuerzos para entender mejor la dinámica de los descortezadores en el país y poder proponer no sólo estrategias de manejo que permitan prevenir y controlar su incidencia, sino también, para disminuir los costos por daños en la actualidad y en el futuro próximo.
Agradecemos las opiniones de dos revisores anónimos que fortalecieron el manuscrito. Este artículo forma parte del proyecto de investigación CONACYT-CONAFOR 2014-CO1-234547.