El factor de bloqueo inducido por progesterona (PIBF) es una proteína inmunomoduladora por medio de la cual la progesterona ejerce varios de sus efectos inmunológicos en diferentes células de alta proliferación, que incluyen desde células embrionarias hasta células tumorales. El PIBF ocasiona un incremento en la síntesis de anticuerpos asimétricos y de citocinas tipo Th2 como las interleucinas (IL) 4, 6 y 10, así como una disminución en la actividad citotóxica de las células NK y en la producción de citocinas tipo Th1, como el factor de necrosis tumoral alfa (TNFα) e IL-12. Lo anterior provoca una reducción en la relación Th1/Th2 que es característica del embarazo sano, lo que tiene como consecuencia un aumento en la inmunidad humoral y una disminución en la inmunidad celular. Estos mecanismos inmunomoduladores tienen como resultado una evasión del sistema inmune de la madre por parte del feto para que el embarazo llegue a término. De manera interesante, diversos estudios sugieren que estos mismos mecanismos son utilizados por las células cancerosas para facilitar la progresión de tumores que presentan sobre-expresión del PIBF.
The progesterone-induced blocking factor (PIBF) is a protein that mediates the immunomodulatory effects of progesterone in cells with high proliferation rate, including embryonic and tumor cells. PIBF increases the synthesis of asymmetric antibodies and Th2 cytokines such as interleukins (IL) 4, 6 and 10, but decreases NK cells cytotoxic activity and Th1 cytokines such as tumor necrosis factor alpha (TNFα) and IL-12. The former causes a reduction in the rate Th1/Th2 that is distinctive of a healthy pregnancy, which it provokes an increment in humoral immunity as well as a decrease in cellular immunity. These immunomodulatory mechanisms enable the fetus to evade the mother immune system allowing pregnancy proceeds to term. Interestingly, several studies suggest that these same mechanisms are used by cancer cells to facilitate progression of tumors that exhibit overexpression of PIBF.
La progesterona (P4) es una hormona esteroide derivada del colesterol, es sintetizada principalmente por los ovarios, placenta y glándulas suprarrenales [1,2]. La P4 es responsable de regular diversas funciones como la conducta sexual, el embarazo y la neuroprotección [3–5], además de estar involucrada en procesos patológicos como el cáncer [6,7].
Las concentraciones séricas de la P4 en mujeres con un embarazo sano varían de 100 a 500nM [8] y se ha documentado que bajas concentraciones de P4 están relacionadas con embarazos con riesgo de aborto o bien, partos prematuros [8,9]. Se ha observado que los linfocitos T γ/δ de mujeres con embarazo normal muestran menor citotoxicidad y una mayor capacidad de unión a la P4 que aquellos linfocitos de mujeres con embarazo de alto riesgo. Una correlación inversamente proporcional entre la capacidad de unión a la P4 y la actividad citotóxica de los linfocitos indica que esta hormona genera un efecto de bloqueo de la citotoxicidad de los linfocitos in vivo[9]. Este efecto se debe a que la P4 induce la producción de una proteína denominada factor de bloqueo inducido por progesterona (PIBF), descubierta por primera vez en linfocitos T maternos γ/δ en 1989 por Szekeres-Bartho et al., [10] y que participa en la regulación de la respuesta inmunológica y el crecimiento tumoral.
MECANISMOS DE ACCIÓN DE LA PROGESTERONAMuchas de las acciones de la P4 se llevan a cabo a partir de la unión con su receptor intracelular a progesterona (RP), que actúa como factor de transcripción regulado por ligando [11,12]. Existen dos principales isoformas de este receptor, RP-A (94 kDa) y RP-B (116 kDa), codificadas por el mismo gen pero con funciones, patrón de expresión y regulación diferentes. La isoforma completa es RP-B mientras que RP-A tiene el extremo N-terminal truncado [11]. La activación de la transcripción de genes blanco involucra la dimerización de estas isoformas, que se unen a los elementos de respuesta a progesterona (PRE) presentes en la región promotora de dichos genes [11–13]. La mifepristona o RU486 es un antagonista del RP que promueve la unión de los dímeros del RP A:A, que al unirse a los PRE resultan ser transcripcionalmente silenciosos; el RU486 también provoca la unión de dímeros del RP A:B lo que resulta en la inhibición de la transcripción de los genes blanco [14].
LA PROGESTERONA EN EL EMBARAZOLa P4 es esencial para el establecimiento y el mantenimiento del embarazo y participa en la ovulación, desarrollo uterino [8,13], implantación e inmunomodulación [8]. Niveles bajos de la P4 en el suero de mujeres embarazadas están relacionados con riesgo de aborto o parto prematuro [9,15], caracterizados por un aumento en la inmunidad relacionada con los linfocitos Th1 y la producción de citocinas por parte de éstos, como son IL-2, IL-12, TNFα e Interferón gamma (IFNγ) [16], mientras que un embarazo sano está caracterizado por un aumento en la inmunidad asociada a linfocitos Th2 y por lo tanto a la producción de citocinas como IL-10, IL-4 e IL-6 [16,17]. La P4 tiene un papel muy importante al reducir la tasa Th1/Th2 lo que ocasiona un descenso en la actividad citotóxica de los linfocitos maternos [17,18].
Se ha informado que la P4 disminuye la citotoxicidad de los linfocitos T maternos γ/δ al igual que la actividad de las células NK [18]. La interacción de la P4 con el RP presente en los linfocitos T γ/δ tiene como resultado la secreción del PIBF [19], el cual es responsable de la disminución de la actividad citotóxica de estas células [17,19], este efecto causado por la P4 es bloqueado con la adición del RU486, lo que indica que la inducción del PIBF se lleva a cabo a través de la activación del RP [19].
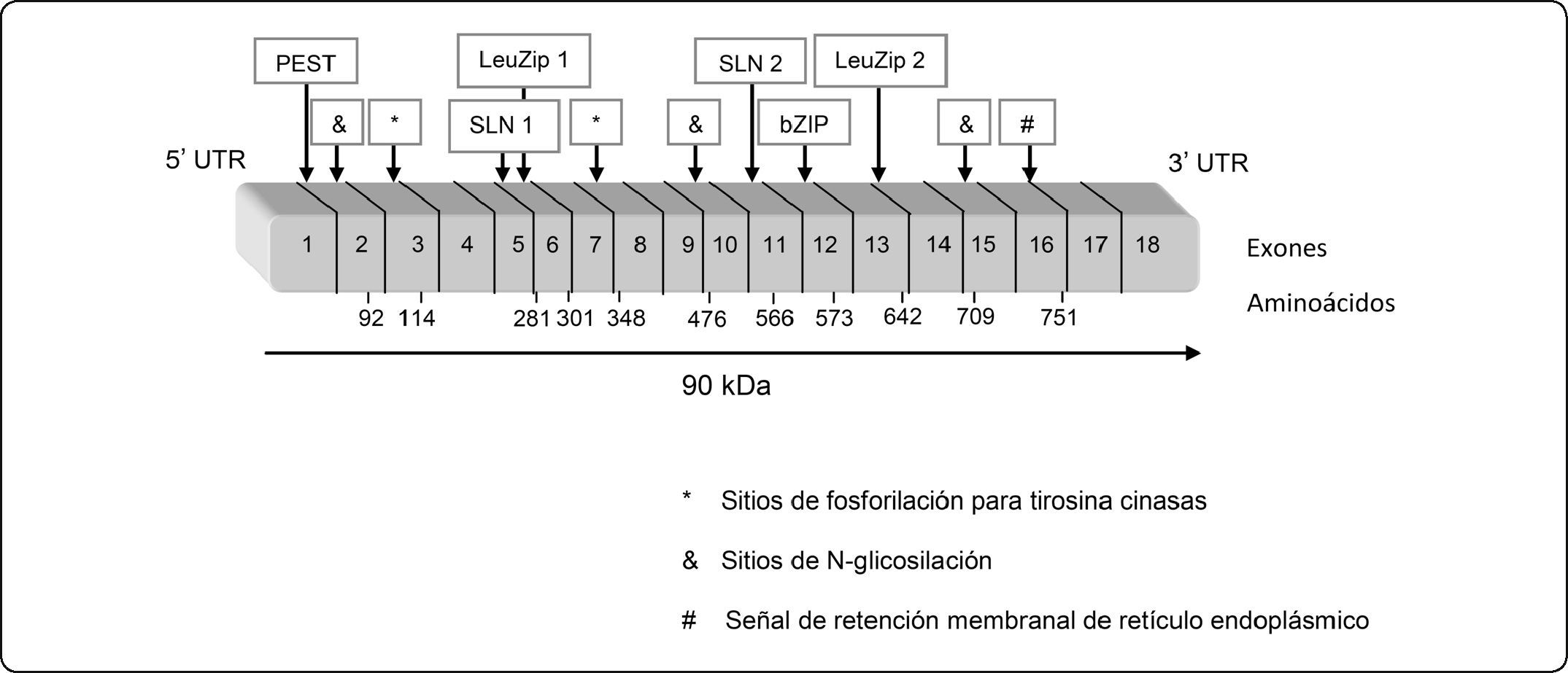
ESTRUCTURA DEL PIBFEl gen del PIBF se localiza en el cromosoma 13 (13q21-q22), cerca de los genes de susceptibilidad para el cáncer de mama [20]. El mapeo de la secuencia del ADN complementario (cADN) codificante del PIBF y la caracterización de la proteína resultante mediante el uso de una biblioteca de cADN obtenida de células de hígado humano, dio como resultado una clona con un marco de lectura abierto de 2271 pb entre una región de 347 pb y 146 pb de 5’ a 3’ sin traducir (5’ a 3’ UTR). En la posición de 348 pb se encuentra el codón de inicio de traducción (ATG) [20].
El análisis del cADN indica que el PIBF contiene 757 aminoácidos con una masa molecular promedio calculada de 89,724Da y con un punto isoeléctrico teórico de 5.73. El análisis de hidrofobicidad indica que el PIBF es una proteína hidrofílica, con una estructura general de α hélice [20]. La composición de aminoácidos muestra un alto porcentaje de ácido glutámico (14.4%), leucina (13.6%) y lisina (10.2%), y un menor porcentaje de triptofano (0.1%) y cisteína (0.8%). La molécula contiene un zipper de leucina (LeuZip), una señal de localización nuclear (SLN) y características básicas de zipper de proteínas de unión al ADN (bZIP). Estudios de posibles sitios de modificación posttraduccional revelaron varios sitios de fosforilación para tirosina cinasas y sitios de N-glicosilación [20]. Contiene además de una secuencia putativa PEST, secuencia peptídica con residuos de prolina (P), ácido glutámico (E), serina (S), y treonina (T), que sugiere una vida media corta de la proteína, además de una secuencia de señal corta N-terminal y una señal de retención membranal de retículo endoplásmico (RE) [20] (Figura 1).
Organización de los dominios del PIBF. El gen del PIBF contiene 18 exones, los cuales codifican para una proteína de 90 kDa, organizada en diversos dominios funcionales. PEST: secuencia peptídica que contiene residuos de prolina (P), ácido glutámico (E), serina (S), y treonina (T); SLN: Señal de localización nuclear; LeuZip: zipper de leucina; bZIP: zipper básico de leucina; *: sitios de fosforilación para tirosina cinasas; &: sitios de N-glicosilación y #: una señal de retención membranal de retículo endoplásmico (RE).
A través de la clonación y secuenciación de fragmentos de PCR, en el 2004, Lachmann et al., [21] determinaron la composición de exones de las isoformas resultantes del proceso de corte y empalme alternativo del ARN mensajero (mARN) del PIBF en diferentes tipos celulares, utilizando células mononucleares de sangre periférica de humano (PBMCs), células de la placenta de humano y de ratón, así como también una biblioteca de cADN de testículo de ratón, que se usó para clonar las isoformas resultantes de corte y empalme alternativo. La isoforma de tamaño completo codificada por 18 exones [20,21], fue la predominante en ratón y en humano, con un peso molecular de 90 kDa y con la amplificación y secuenciación de los fragmentos de PCR se obtuvieron diferentes formas de la proteína de pesos moleculares de 10, 14, 18, 35, 67 y 76 kDa. La mayoría de las estructuras previstas como las SNL, los LeuZip y dominio bZIP no están presentes en estas isoformas de menor tamaño [21].
LOCALIZACIÓN CELULARUn análisis de la secuencia de la proteína de 90 kDa del PIBF, predijo un motivo estructural de hélice superenrollada. Se ha sugerido que las proteínas con esta característica son comunes en el material pericentriolar [22]. Además ciertos miembros de la familia de estas proteínas están implicados en procesos cancerígenos y se encuentran localizados en el centrosoma, donde regulan la estabilidad de los microtúbulos, afectan la morfología celular, el movimiento, así como el transporte de material intracelular [22].
Estudios de inmunofluorescencia en las líneas celulares HeLa, K562 y OVCAR-3 derivadas de adenocarcinoma de cérvix, leucemia mieloide crónica y adenocarcinoma de ovario respectivamente, sugieren una interacción del PIBF con el aparato de Golgi, el centrosoma y el huso mitótico [21]. Una purificación de los centrosomas de células embrionarias humanas de riñón (HEK293) transfectadas con el plásmido pVpRXR y una construcción de un vector para lograr la expresión constitutiva del PIBF, sugieren que la proteína de 90 kDa se encuentra presente en forma predominante en el área perinuclear, mientras que una de las isoformas con peso de 35 kDa, se encuentra dispersa en el citoplasma [21]. Kim et al., [22] mostraron por inmunofluorescencia, que al silenciar la expresión del PIBF con ARN de interferencia (siARN) en células HeLa, los centrosomas en las células se observaban íntegros hasta la profase del ciclo celular, sin embargo, ocurría una fragmentación del huso mitótico durante la prometafase y metafase, sugiriendo que el PIBF tiene un papel importante en la integridad del huso mitótico durante la mitosis [22].
VÍAS DE SEÑALIZACIÓN DEL PIBFEl PIBF se une a un heterodímero compuesto por el receptor del PIBF (PIBF-R) y la cadena α del receptor de IL-4 (IL-4R) en la membrana celular [18,23]. Al unirse el PIBF al IL-4R, induce su heterodimerización con el PIBF-R, promoviendo la fosforilación de tirosina en su cadena α y la activación de la cinasa janus 1 (JAK1), la cual fosforila los residuos de tirosina del receptor para crear sitios de acoplamiento para el transductor de señal y activador de la transcripción 6 (STAT6). Después de unirse a la cadena α del IL-4R, STAT 6 se convierte en el sustrato de JAK1 [23,24]. La fosforilación de los residuos de tirosina localizados entre el dominio de homología Src 2 (SH2) del IL-4R y el dominio de transactivación C-terminal provoca la dimerización de STAT6 [25]. Finalmente estos dímeros se translocan al núcleo donde se unen a secuencias palindrómicas (secuencia consenso TTCN2-4GAA) en las regiones promotoras de genes blanco para iniciar la transcripción [23] (Figura 2).
Mecanismo de acción del PIBF. A través de la unión con el complejo IL-4Rα/PIBF-R, el PIBF activa la vía JAK1 /STAT6, que está relacionada con la proliferación celular y la producción de citocinas Th2. Además el PIBF es capaz de funcionar como factor de transcripción, mediante su unión a la región promotora de genes como IL-6 y EGF, relacionados con la invasión celular.
Se ha documentado que el PIBF-R se encuentra anclado a glicosilfosfatidilinositol en microdominios localizados en la membrana plasmática, llamados balsas lipídicas, que están enriquecidas con colesterol y glicoesfingolípidos [18], Mediante microscopía de dos fotones, se ha observado que cuando el PIBF se une con su receptor, disminuye la fluidez de la membrana al formarse agrupaciones de glicoesfingolípidos, colesterol y proteínas de membrana, que ocasionan la integración de una amplia plataforma de balsas lipídicas, que podría desencadenar diferentes respuestas biológicas [18].
La remoción del colesterol de las balsas lipídicas con metil-β-ciclodextrina (Mβ-CD) anula el efecto del PIBF en la activación de la vía JAK1/STAT6 [18]; este efecto también se logra al bloquear el IL-4Rα [26]--lo que revela la importancia de ambos receptores para la señalización celular mediada por el PIBF.
EL PIBF COMO MOLÉCULA INMUNOMODULADORADurante un embarazo normal, el PIBF es secretado principalmente por los linfocitos T, la placenta y el útero; su concentración sérica se incrementa continuamente hasta la semana 37 de gestación y hay un marcado descenso al término del embarazo [27]. La concentración del PIBF en el suero de mujeres con 24 y 33 semanas de gestación de un embarazo de alto riesgo (59 ng/mL) es significativamente menor que la concentración en el suero de mujeres con embarazo normal (272 ng/mL) [28,29] lo que sugiere que el PIBF es una molécula de crucial importancia para el mantenimiento del embarazo.
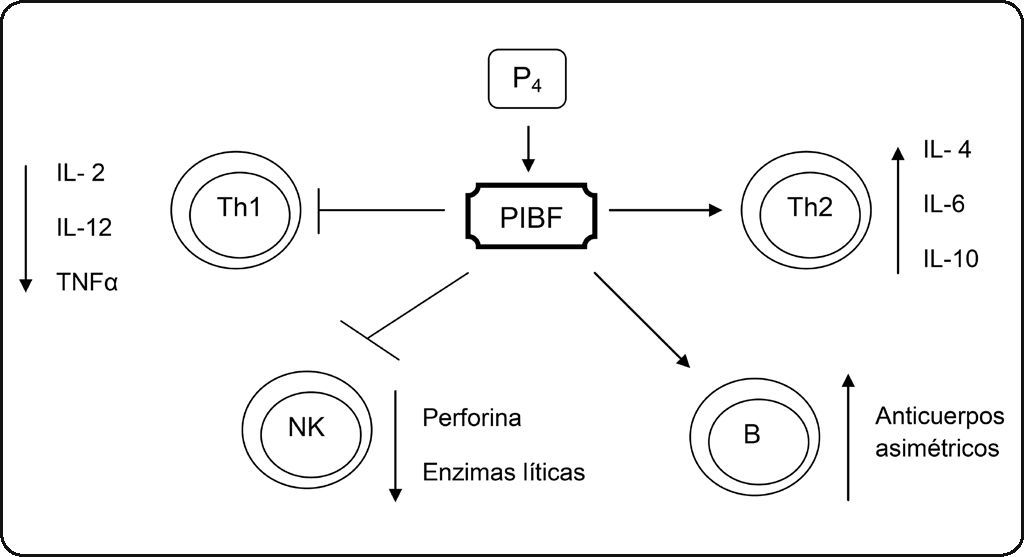
La capacidad inmunomoduladora del PIBF permite mantener el embarazo en un estado de inmunosupresión [29,30], con el fin de que el feto evada el sistema inmunológico de la madre y el embarazo llegue a término. El PIBF reduce la tasa Th1/Th2 [30], lo que contribuye a disminuir la respuesta inmune celular. Se ha demostrado que el PIBF incrementa la producción de citocinas Th2 como IL-10, IL-3 e IL-4 in vitro[30] e IL-6 in vivo[31] (Figura 3). La expresión del PIBF en linfocitos T obtenidos del suero de mujeres embarazadas tiene una relación inversa a la concentración de TNFα, y en estudios in vitro se observa una inhibición de la expresión de IL-12 por el PIBF [32], obteniendo así una disminución de producción de citocinas tipo Th1 [28,30] (Figura 3).
Efectos inmunomoduladores del PIBF. La progesterona (P4) induce la expresión del PIBF, el cual, mediante el aumento de citocinas Th2, la disminución de las citocinas Th1, el bloqueo de la actividad de las células NK, así como la regulación de la producción de anticuerpos asimétricos no efectores por parte de las células B, disminuye la citotoxicidad celular y mantiene un estado de inmunosupresión controlado.
El PIBF impide la síntesis de la prostaglandina F2 alfa (PGF2 α), al inhibir a la fosfolipasa A2 (PLA2), que es la enzima que cataliza la liberación del ácido araquidónico (AA) de los fosfolípidos de membrana y que es posteriormente convertido a prostaglandinas por la enzima ciclooxigenasa 2 (COX-2) [31]. Al inhibirse la PGF2 α se reduce la producción de IL-12 y la actividad citotóxica de las células NK [31].
Con el incremento de citocinas tipo Th2, el PIBF provoca la síntesis de anticuerpos asimétricos por los linfocitos B, debido a su estructura asimétrica, estos anticuerpos no tienen funciones efectoras, sino que funcionan como anticuerpos de bloqueo [33] (Figura 3). El PIBF bloquea la lisis mediada por células NK en fibroblastos embrionarios humanos in vitro[34] y en células del bazo de ratonas Balb/c embarazadas que fueron tratadas con progesterona [35]. Este efecto del PIBF se asoció a la inhibición de la liberación de perforina de las células NK, así como también por la disminución de la degranulación y secreción de las enzimas líticas por parte de estas células [36] (Figura 3).
PIBF Y CÁNCERSe ha relacionado al PIBF con la progresión tumoral debido a su proximidad a los genes de susceptibilidad para el cáncer de mama en el cromosoma 13 [20] y a su localización celular en el centrosoma [21]-−. El PIBF puede ser secretado por células cancerígenas para evadir el sistema inmune y así contribuir al desarrollo tumoral [16,27]. Se ha reportado que el PIBF se encuentra sobre-expresado en tejido tumoral de útero, mama y estómago en comparación con el tejido sano respectivo [28]. La concentración sérica del PIBF en pacientes que presentan tumores malignos llega a ser hasta de 1000 ng/mL, significativamente más alta que la concentración de 272 ng/mL que se observa durante el inicio del tercer trimestre de un embarazo normal [27,29].
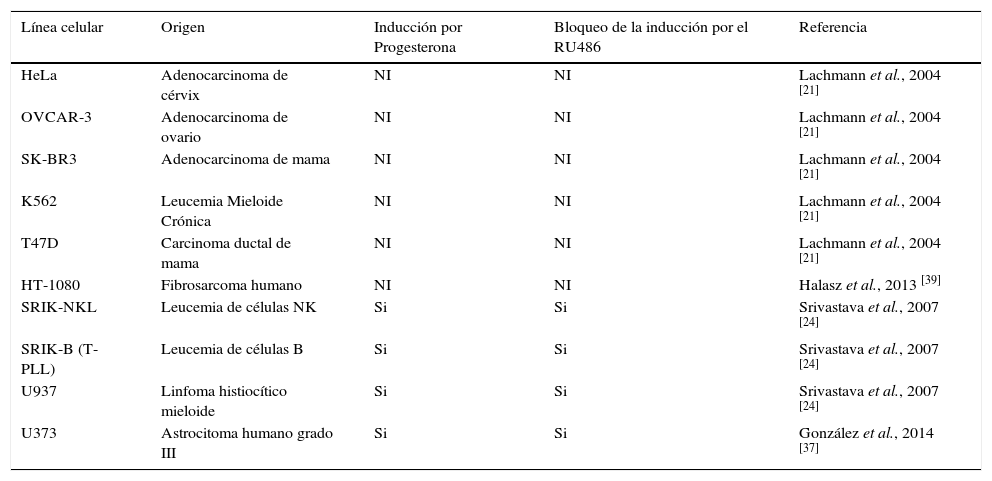
Lachmann et al., [21] demostraron por estudios in vitro que el PIBF se encuentra altamente expresado en diversas líneas celulares tumorales de humano, como HeLa, K562, OVCAR-3, T47D, SK-BR3 y MCF-7, derivadas de un adenocarcinoma de cérvix, una leucemia mieloide crónica, un adenocarcinoma de ovario, un carcinoma ductal de mama y las dos últimas de adenocarcinomas de mama, respectivamente [21]. Srivastava et al., [24] encontraron que el PIBF se expresa en diversas líneas celulares de forma constitutiva, como U937, SRIK-B (T-PLL) y SRIK-NKL, derivadas de un linfoma histiocítico mieloide, una leucemia de células B y una leucemia de células NK respectivamente y que además, el PIBF se inducía por efecto de la P4 y la adición del RU486 bloqueaba la inducción (Tabla I).
Expresión del PIBF en diferentes líneas celulares tumorales y su regulación por la P4. NI = No ha sido investigado
| Línea celular | Origen | Inducción por Progesterona | Bloqueo de la inducción por el RU486 | Referencia |
|---|---|---|---|---|
| HeLa | Adenocarcinoma de cérvix | NI | NI | Lachmann et al., 2004 [21] |
| OVCAR-3 | Adenocarcinoma de ovario | NI | NI | Lachmann et al., 2004 [21] |
| SK-BR3 | Adenocarcinoma de mama | NI | NI | Lachmann et al., 2004 [21] |
| K562 | Leucemia Mieloide Crónica | NI | NI | Lachmann et al., 2004 [21] |
| T47D | Carcinoma ductal de mama | NI | NI | Lachmann et al., 2004 [21] |
| HT-1080 | Fibrosarcoma humano | NI | NI | Halasz et al., 2013 [39] |
| SRIK-NKL | Leucemia de células NK | Si | Si | Srivastava et al., 2007 [24] |
| SRIK-B (T-PLL) | Leucemia de células B | Si | Si | Srivastava et al., 2007 [24] |
| U937 | Linfoma histiocítico mieloide | Si | Si | Srivastava et al., 2007 [24] |
| U373 | Astrocitoma humano grado III | Si | Si | González et al., 2014 [37] |
En la línea celular U373, derivada de un astrocitoma humano grado III, la P4 induce la expresión del PIBF a nivel del mARN y de la proteína [37]. En este mismo estudio se encontró que la isoforma completa de 90 kDa se encuentra principalmente en el núcleo, mientras que la isoforma detectada de 57 kDa se localiza primordialmente en el citoplasma [37], lo que concuerda con los resultados de Lachmann, en el 2004 [21]. Mediante una co-inmunoprecipitación se pudo demostrar la asociación del PIBF con el IL-4R, y se corroboró el aumento de la fosforilación de JAK1 y de STAT6 que indica la activación de esta vía [37]. Las líneas derivadas de astrocitomas humanos grado III y IV sobre-expresan STAT6 en comparación con astrocitos normales, por lo que se ha relacionado a esta vía con el crecimiento e invasión celulares [38]. De manera interesante, se observó que el PIBF aumenta la proliferación de las células U373.
Con el uso de un ensayo de inmunoprecipitación de la cromatina (ChIP) en células HT-1080 derivadas de un fibrosarcoma humano, se descubrió que el PIBF tiene la capacidad de unirse a la región promotora de genes como IL-6 y el factor de crecimiento epidérmico (EGF) (Figura 2) [39]. En ensayos in vivo mediante un xenotrasplante de células HT-1080 con siARN contra el PIBF inyectadas en el saco vitelino del embrión del pez cebra, se observó que las células mostraban un menor potencial invasivo en comparación con el grupo control, lo cual sugiere que el PIBF facilita la invasión tumoral. El silenciamiento del PIBF resulta en la disminución de las metaloproteinasas de la matriz extracelular 2 y 9 (MMP-2 y MMP-9) en las células HT-1080. Además el tratamiento con el PIBF aumenta la expresión de IL-6 y ésta a su vez induce la fosforilación en los residuos de serina 727 y tirosina 705 de STAT3, activando la vía JAK1/STAT3, la cual se ha relacionado con la invasión celular [39].
Posteriores investigaciones sobre las vías de señalización del PIBF y sus mecanismos de acción permitirán dilucidar el papel que tiene este factor en el embarazo, así como en la iniciación y progresión tumoral, y de esta manera evaluar si puede ser considerado como un posible blanco terapéutico.
CONCLUSIONESEl PIBF es una proteína que se encuentra altamente expresada en diversas células que poseen una elevada capacidad de proliferación, y están involucradas tanto en procesos fisiológicos como el desarrollo embrionario, y en patológicos como el cáncer. El PIBF mediante el proceso de corte y empalme alternativos exhibe varias isoformas, la más abundante en diversos tipos celulares es la de 90 kDa, asociada al centrosoma que actúa como factor transcripcional de diversos genes involucrados en procesos de proliferación y migración celulares, como IL-6 y EGF; las demás isoformas son más pequeñas y se sugiere que actúan de forma autocrina funcionando como ligando al unirse al heterocomplejo PIBF-R/IL-4Rα, activando diversas vías de señalización, siendo la más estudiada la vía JAK1/STAT6, que está involucrada tanto en procesos de proliferación celular como en un aumento de producción de citocinas Th2. En diversos tumores se ha encontrado una alteración en la tasa Th1/Th2, con predominio de las citocinas de linfocitos Th2, fenómeno que pudiera ser atribuido en parte a la capacidad inmunomoduladora del PIBF ampliamente documentada durante el embarazo.
Araceli Gutiérrez Rodríguez es becaria CONACyT del Programa de Maestría y Doctorado en Ciencias Bioquímicas, UNAM.