Alcoholismo
Epidemiología
El efecto del alcohol en la salud se caracteriza por ser complejo y multidimensional, estando su consumo ampliamente extendido y culturalmente aceptado en la mayoría de los países occidentales. Las encuestas domiciliarias realizadas por la Delegación del Gobierno para el Plan Nacional sobre Drogas del Ministerio de Sanidad y Consumo entre 2007 y 2008, dirigidas a la población de 15 a 64 años 1, ponen de manifiesto que a pesar de una reducción del consumo diario (10,2 % frente a 14,9 % registrado en 2005), el alcohol sigue siendo la sustancia psicoactiva con un consumo más extendido entre la población española.
El impacto sanitario asociado al consumo de alcohol es muy importante. Según un informe de la Secretaría de la Organización Mundial de la Salud (OMS) (Ginebra, enero de 2005) 2, en el año 2000 el consumo de alcohol fue responsable del 4 % de la morbilidad mundial, lo que supone un nivel apenas inferior al causado por el tabaquismo (4,1 %) y la hipertensión arterial (4,4 %). A escala mundial se estima que en el mismo año el alcohol causó 1,8 millones de muertes, equivalente al 3,2 % de los fallecimientos. A nivel europeo se estima que el 6,8 % de la carga de enfermedad de los países de Europa occidental está relacionada con esta droga 3. Así, el consumo de etanol contribuye a la aparición de numerosas enfermedades, entre ellas la cirrosis hepática, determinados tipos de cáncer, la dependencia al alcohol y el síndrome alcohólico fetal.
Más allá de los problemas sanitarios, el consumo de alcohol origina un importante coste económico por la pérdida de capacidad productiva a causa del absentismo, enfermedad o accidente laboral. A todo ello hay que añadir el coste de las consultas médicas e ingresos hospitalarios, y también los costes sanitarios debidos a accidentes de tráfico. Son interesantes las cifras que publicó el Eurocare en 1995 referentes a Europa, continente con mayor consumo, producción y exportación de alcohol, en las que se estima el valor medio de la producción de alcohol en el 2 % del producto interior bruto (PIB), mientras que el coste económico de los problemas relacionados con su consumo representa el 5-6 %.
En la actualidad, la investigación biomédica sigue realizando un gran esfuerzo para clarificar los mecanismos de acción del etanol, que aún son en gran parte desconocidos.
Neurobiología del alcoholismo. Sistemas implicados
La ingesta de alcohol produce una gran variedad de efectos fisiológicos y conductuales, de manera dosis-dependiente, pudiéndose establecer la siguiente graduación, de menor a mayor dosis: ansiolisis, miorrelajación, analgesia, sedación, amnesia, hipotermia y anestesia. El alcohol etílico o etanol es tóxico para la mayoría de los tejidos del organismo; produce alteraciones sobre el sistema cardiovascular, el sistema digestivo, el sistema nervioso central (SNC), los nervios periféricos, el sistema músculo-esquelético y sobre el feto 4. En este trabajo nos centraremos en los efectos psicoactivos del etanol.
De manera general el etanol genera una profunda depresión de las funciones neuronales, pero todavía es desconocido el mecanismo concreto por el cual el etanol ejerce sus efectos en el cerebro. Inicialmente se propuso la hipótesis de la alteración de la fluidez de la membrana neuronal, basada en la liposolubilidad del etanol, la cual proponía que los efectos agudos del etanol se deberían a un aumento de la fluidez de la membrana neuronal, mientras que el consumo crónico, de manera compensatoria, aumentaría la rigidez de la membrana, con la consiguiente alteración de las funciones 5,6. Sin embargo, hoy en día sabemos que el etanol interactúa con determinadas proteínas de la membrana neuronal implicadas en la transmisión de señales, dando lugar a cambios en la actividad neuronal.
El etanol interactúa principalmente con dos receptores de membrana: el receptor GABAA, que forma en su interior un canal para el ión Cl- y es activado entre otras sustancias por el neurotransmisor GABA (ácido-γ-amino-butírico), y el receptor NMDA (N-metil-D-aspartato), que forma un canal catiónico básicamente para el Ca 2+ y es activado por el glutamato. El GABA está considerado como el neurotransmisor inhibidor por excelencia del SNC, y por contra, el glutamato, junto con el aspartato, como el principal neurotransmisor excitador. El efecto del etanol sobre estos dos sistemas se basa en la potenciación de la acción del GABA y en el antagonismo sobre la acción del glutamato, actuando en consecuencia como depresor del SNC 7,8.
Sin embargo, el etanol afecta también a casi todos los demás sistemas neuroquímicos. Así, las propiedades reforzadoras o adictivas del etanol se reflejan en el aumento que ejerce sobre las descargas de las neuronas dopaminérgicas en el área tegmental ventral y sobre la liberación de dopamina en el núcleo acumbens 9,10. El sistema opioide también se encuentra implicado en la neurobiología del consumo de alcohol, de modo que el etanol aumenta la liberación de péptidos opioides en el núcleo acumbens, produciendo una sensación de bienestar, y la administración de antagonistas opioides reduce la ingesta de alcohol 11. Otro de los sistemas implicados es el serotonérgico. Se ha observado un déficit en la transmisión serotonérgica en pacientes alcohólicos, y fármacos que inhiben este sistema incrementan el consumo de etanol, mientras que fármacos que lo potencian disminuyen el consumo de este compuesto 12,13. Del mismo modo, también se encuentran modulados por el etanol la neurotransmisión noradrenérgica 14, los canales de Ca 2+ principalmente de tipo L 15, y el sistema endocannabinoide, en el que nos centraremos en este artículo.
Finalmente, aparte de interactuar directamente sobre componentes de la membrana celular, su carácter lipofílico podría permitir al etanol modular también componentes citoplasmáticos, entre los que se encuentran los segundos mensajeros. Así, el etanol potencia la producción de AMPc mediada por ciertos receptores 16. También se ha descrito que la proteína quinasa C (PKC) está implicada en la sensiblidad de algunos receptores al etanol 17. Para terminar, en la vía de señalización de las MAP quinasas, y concretamente en la subfamilia ERK, también se han descrito cambios 18.
Sistema cannabinoide endógeno
Los cannabinoides constituyen un conjunto de compuestos psicoactivos presentes en las hojas y brotes florecidos de la planta de la marihuana, cannabis sativa. Esta planta herbácea ha sido utilizada durante más de 4.000 años por sus propiedades terapéuticas, así como por sus efectos farmacológicos como sustancia de abuso. La planta contiene más de 400 compuestos químicos diferentes, de los cuales aproximadamente 60 se consideran cannabinoides 19.
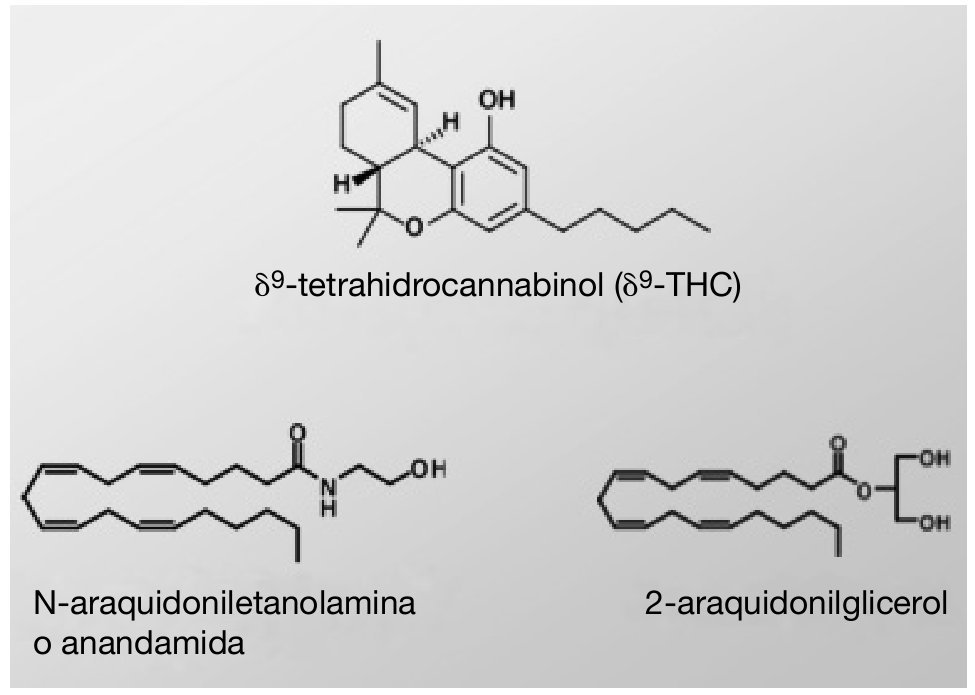
El comienzo de la investigación en el campo de los cannabinoides se podría situar en 1964, cuando se aisló el δ9-tetrahidrocannabinol (δ9-THC) 20, ingrediente psicoactivo y principal responsable de la actividad farmacológica de la marihuana (fig. 1). El clonaje en los años noventa de dos receptores de membrana a los cuales se unen los compuestos cannabinomiméticos 21,22 abrió el camino hacia la comprensión de la farmacología de los cannabinoides. Actualmente, los receptores cannabinoides, junto con sus ligandos endógenos, las enzimas involucradas en la biosíntesis y degradación de estos ligandos y las proteínas transportadoras de membrana, comprenden un nuevo e importante sistema de neuromodulación: el sistema cannabinoide endógeno.
Figura 1. Estructura química del δ9-THC, la anandamida y el 2-araquidonilglicerol.
Receptores para cannabinoides
Debido al carácter altamente lipofílico de los compuestos cannabinoides naturales, la primera hipótesis que se consideró para la acción de dichos compuestos fue que estaba mediada por una interacción de manera inespecífica con los componentes de la membrana celular 23. Actual mente se sabe que la mayor parte de las acciones farmacológicas producidas por los compuestos cannabinoides se debe a su interacción con al menos dos proteínas receptoras, denominadas receptores cannabinoides CB1 y CB2, pertenecientes a la superfamilia de receptores acoplados a proteínas G. Diversas evidencias farmacológicas sugieren también la existencia de un tercer tipo de receptor cannabinoide, llamado CB3 o no CB1/CB224-26, que sin embargo hasta la fecha no ha sido clonado. Del mismo modo, también sabemos que los cannabinoides interaccionan de manera específica con otros receptores, como por ejemplo el receptor vaniloide tipo 1, o el recientemente descrito receptor huérfano GPR55 26.
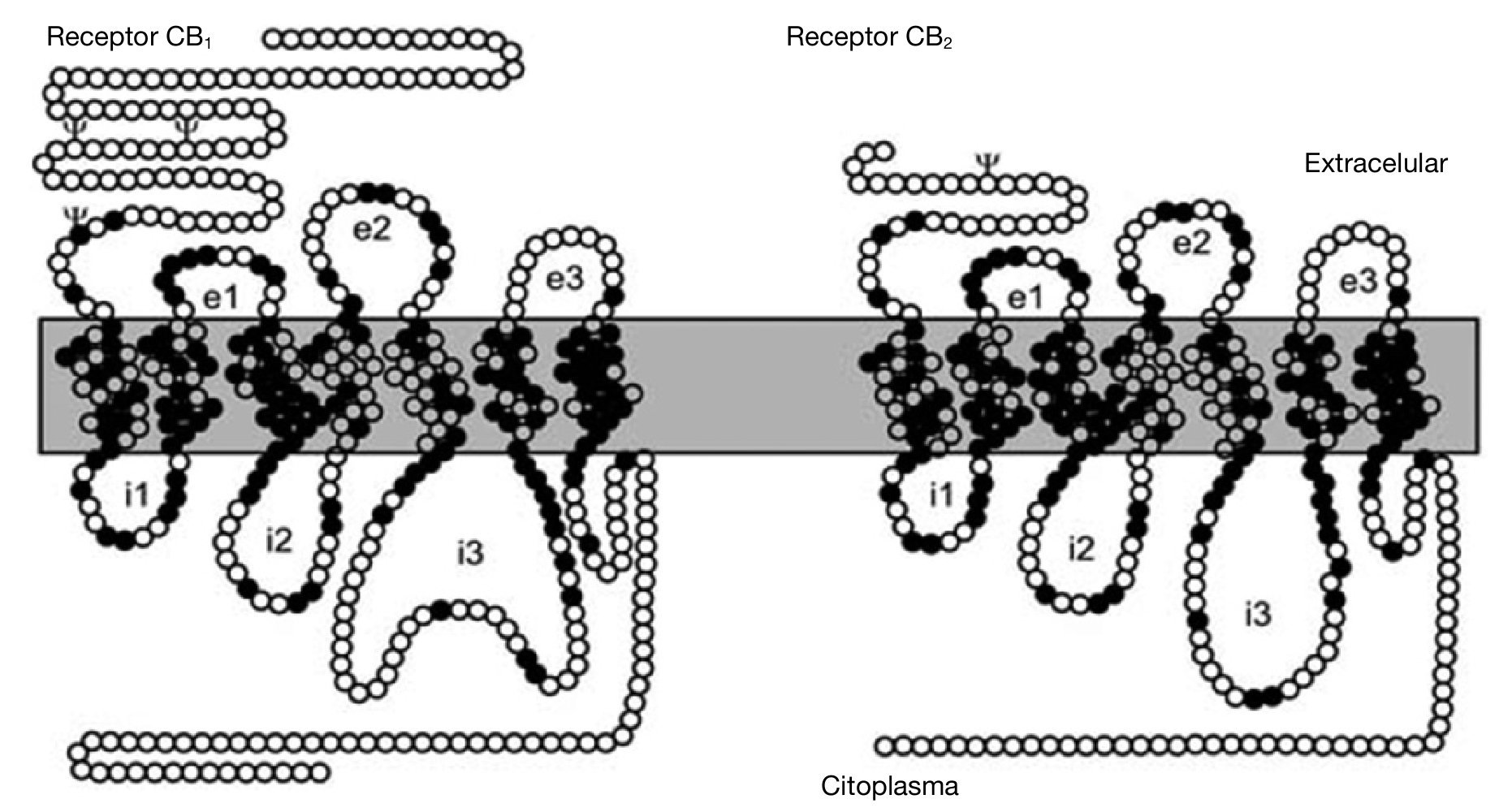
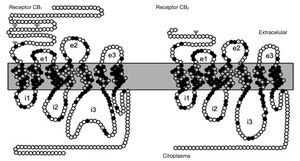
Ambos receptores para cannabinoides clonados, CB1 y CB2, constan de un dominio amino-terminal extracelular, un dominio carboxi-terminal intracelular y 7 dominios transmembrana, y en su estructura se encuentran residuos específicos típicos como sustratos de fosforilación, lugares de fijación de ligandos, de proteínas G, etc. El receptor CB121,27,28 contiene 472-473 aminoácidos organizados en una secuencia altamente conservada entre las especies que se han estudiado. El receptor CB222, polipéptido de 360 aminoácidos, presenta un 44 % de homología en su secuencia de aminoácidos con el CB1 (68 % en las regiones transmembrana) (fig. 2).
Figura 2. Representación esquemática de los receptores CB1 y CB2. Aminoácidos comunes a los dos receptores (círculos negros); aminoácidos diferentes (círculos blancos). Sitios consenso de glucosilación (c); asas extracelulares (e1, e2, e3); asas intracelulares (i1, i2, i3).
Receptor CB1
Los principales mecanismos intracelulares en los que están implicados los receptores cannabinoides CB1 incluyen: la inhibición de la adenilato ciclasa 29, la regulación de distintos canales iónicos 30 y la activación de las MAP quinasas 31. Los efectos identificados hasta el momento tienen como punto de partida el acoplamiento del receptor CB1 a las proteínas G.
En la mayor parte de los tejidos analizados, el receptor cannabinoide se une a proteínas de tipo Gi/o inhibitorias, aunque también se ha observado el acoplamiento al tipo Gs29. Así, la activación de los receptores CB1 produce una inhibición de la vía de la adenilato ciclasa, lo que da lugar al descenso en los niveles de AMPc intracelular, afectando por tanto la capacidad de fosforilación de las proteínas quinasas. Además, también induce una inhibición de los canales de Ca 2+ y un aumento en la conductancia de K+.
El receptor CB1 se expresa fundamentalmente en el SNC de mamíferos 32,33, principalmente como receptor presináptico, y donde se le atribuye un papel importante como neuromodulador de la liberación de neurotransmisores. Es el receptor más abundante de los acoplados a proteínas G en el cerebro de mamíferos. En cerebro de rata se encuentran niveles elevados de CB1 en los ganglios basales, capa molecular del cerebelo e hipocampo; niveles moderados en la corteza cerebral, y niveles bajos en hipotálamo, tallo cerebral y médula espinal 34. Sin embargo, en cerebro humano se ha observado una mayor expresión de este receptor en la corteza prefrontal y el núcleo caudado, comparado con el cerebelo y el hipocampo 35.
Receptor CB2
La activación del receptor CB2 también produce una inhibición de la adenilato ciclasa y una activación de la vía de las MAP quinasas 36,37. Sin embargo, no produce modificaciones en la regulación de los canales iónicos 38.
La distribución del receptor CB2 difiere de la del subtipo CB1, localizándose principalmente en bazo, amígdala y células del sistema inmune (linfocitos B y T, monocitos, etc.) 39. Al contrario que el receptor CB1, su activación no modifica la liberación de neuro transmisores.
En cuanto a la distribución del receptor CB2 en cerebro de mamíferos, existe bastante controversia. Numerosos estudios no han sido capaces de detectar su presencia en cerebro sano 39,40. Otros trabajos, sin embargo, han demostrado la presencia de CB2 en diferentes componentes del cerebro humano, tales como astrocitos 41, microglia perivascular 42 y microcapilares 43. Por otro lado, algunos trabajos describen la existencia de CB2 en cerebro solamente en situaciones patológicas, concretamente en cerebro postmortem de pacientes con enfermedad de Alzheimer 44, en macacos infectados con el virus de la inmunodeficiencia de simios 45 y en ratas que han sufrido hipoxia isquémica 46.
Endocannabinoides
Los ligandos endógenos de los receptores para cannabinoides son compuestos derivados de ácidos grasos poliinsaturados, siendo los más conocidos y estudiados hasta el momento la N-araquidoniletanolamina o anandamida (AEA) y el 2-araquidonilglicerol (fig. 1). En los últimos años se han identificado en el SNC otros cannabinoides endógenos, como son el noladin éter, la virodhamina (O-araquidoniletanolamina), la N-araquidonildopamina (NADA) y la docosatetraeniletanolamida 29.
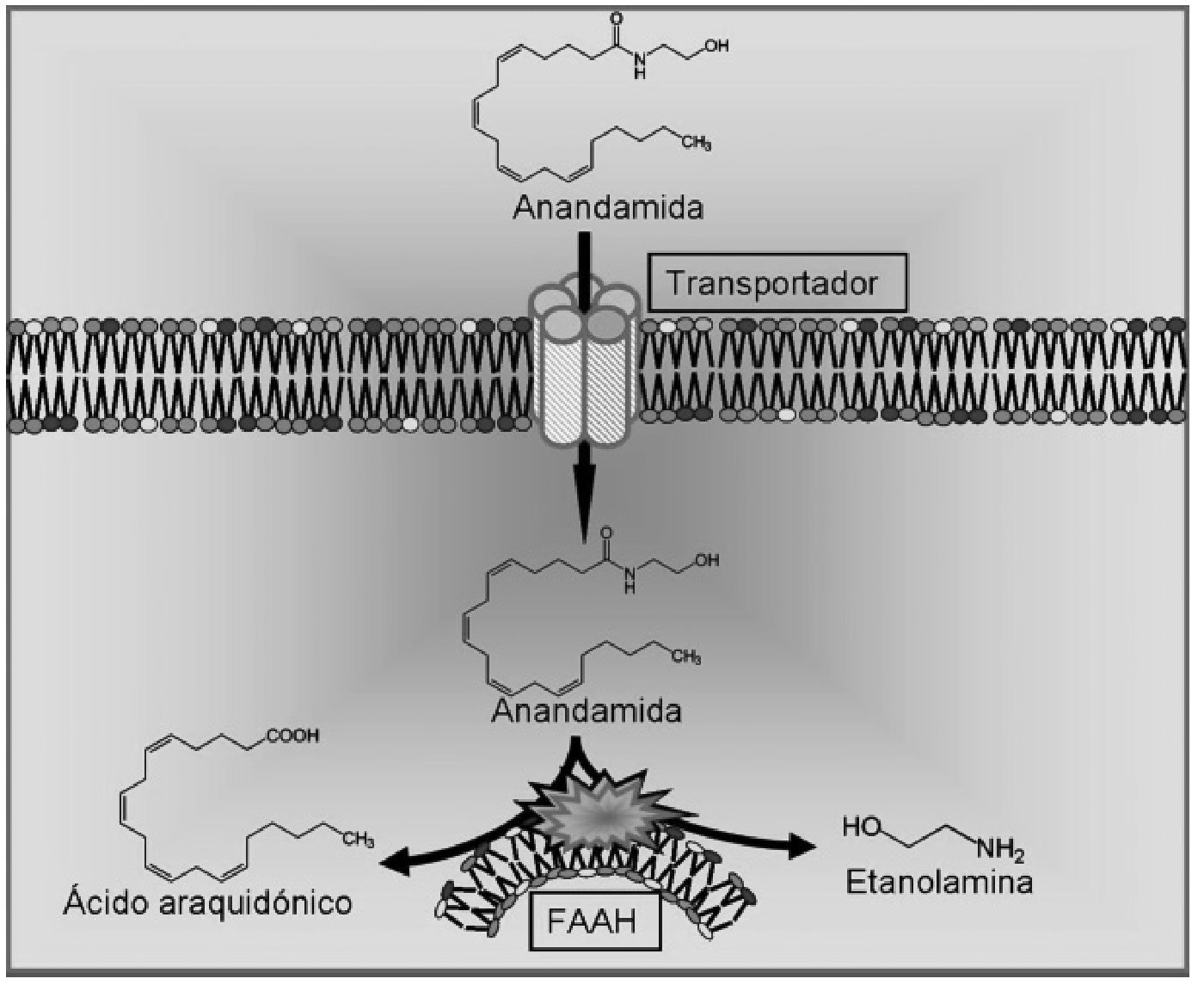
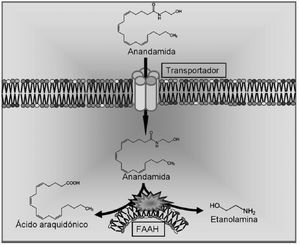
La anandamida fue aislada por primera vez en 1992 28 en cerebro de cerdo y posteriormente encontrada en órganos periféricos incluyendo la piel y los tejidos cardiovascular, renal y reproductor. Su estructura no está relacionada con los cannabinoides naturales derivados de la planta cannabis sativa, pero produce los efectos clásicos de la actividad cannabinoide como son la inmovilidad, la catalepsia, la analgesia y la hipotermia 28,47. La síntesis de la anandamida se produce en dos pasos sucesivos. En primer lugar, la enzima N-acetiltransferasa cataliza la formación del precursor N-araquidonil-fosfatidil-etanolamina, y en una segunda fase este precursor es hidrolizado por la fosfolipasa D 48. La liberación de anandamida es dependiente de Ca 2+ y se produce tras la despolarización neuronal 49. La inactivación de este endocannabinoide también requiere dos etapas. Se postula que la primera es la recaptación de la anandamida extracelular por un transportador de alta afinidad que aún no ha sido clonado, y la segunda es la hidrólisis intracelular catalizada por una enzima hidrolasa de ácidos grasos (FAAH) 50, dando lugar a sus dos componentes fundamentales: el ácido araquidónico y la etanolamina 51 (fig. 3).
Figura 3. Procesos de recaptación y degradación de la anandamida. FAAH: enzima hidrolasa de ácidos grasos.
El 2-araquidonilglicerol fue aislado inicialmente en intestino de perro 52, y posteriormente hallado en bazo, páncreas y cerebro, ejerciendo efectos celulares similares a los descritos para los cannabinoides naturales. La síntesis de este endocannabinoide parece deberse a la acción de la enzima diacilglicerol lipasa, que convierte el diacilglicerol en 2-araquidonilglicerol. En cerebro su liberación está mediada por el aumento de Ca 2+ intracelular elicitado durante la despolarización neuronal. Tras su liberación, el 2-araquidonilglicerol es recaptado rápidamente, y consecutivamente degradado por acción de la monoacilglicerol lipasa, que lo convierte en ácido araquidónico 53,54.
Los endocannabinoides, por lo tanto, cumplen con las condiciones necesarias de todo neurotransmisor, ya que son sintetizados y liberados desde las neuronas, son capaces de unirse y activar receptores de membrana, y finalmente son inactivados por recaptación y degradación enzimática en el interior de la célula. No obstante, los endocannabinoides presentan una clara diferencia respecto a los neurotransmisores clásicos, y es que no se almacenan en vesículas sinápticas, sino que son sintetizados a demanda 48, actúan en las proximidades del lugar donde se han liberado, y son rápidamente inactivados 55. También poseen otra característica muy particular, y es que pueden actuar como mensajeros retrógrados, es decir, que como consecuencia de estímulos concretos se liberan desde las neuronas postsinápticas, siendo capaces de estimular receptores cannabinoides situados a nivel presináptico 56.
Implicación del sistema cannabinoide endógeno en el alcoholismo
La transmisión cannabinoide parece ser relevante en los circuitos cerebrales que regulan el consumo, la dependencia y la tolerancia a etanol. En primer lugar, el etanol y el δ9-THC producen efectos farmacológicos similares: euforia y estimulación a dosis bajas, efectos sedantes a dosis altas. Por otra parte, es bien conocido que el etanol es responsable de alteraciones en el movimiento y en la memoria, así como hipotermia y sedación, y concretamente en regiones cerebrales implicadas en estos procesos -hipocampo, corteza, estriado, sustancia negra y cerebelo- se observa la presencia de elementos del sistema cannabinoide endógeno. Además, se ha descrito tolerancia cruzada entre el δ9-THC y el etanol 57.
Los resultados de estudios farmacológicos recientes han contribuido a una mayor comprensión de la implicación del sistema cannabinoide endógeno en la neurobiología del alcoholismo. Así, existen evidencias de tipo bioquímico, comportamental y genético que corroboran esta implicación.
Estudios bioquímicos
La administración crónica de etanol en mamíferos modula elementos del sistema cannabinoide endógeno a diferentes niveles. En primer lugar, en experimentos in vitro realizados en células de neuroblastomas del tipo SK-N-SH, se observó que la exposición crónica de estas células a etanol conllevaba un aumento de los niveles de anandamida y su precursor biosintético de manera concentración -y tiempo-dependiente 58. Este cambio en el contenido de los endocannabinoides también se demostró in vivo, al detectarse un aumento de anandamida en la región límbica anterior y un descenso de anandamida y 2-AG en el mesencéfalo de ratas expuestas de manera crónica a etanol 59.
Por otro lado, la densidad del receptor cannabinoide CB1 se encuentra disminuida, sin cambios en su afinidad, tras una administración crónica de etanol en cerebro de ratón 60. Además, la funcionalidad de estos receptores está también reducida en ratones que han sido expuestos crónicamente a este compuesto, como se ha descrito mediante estudios de fijación de [ 35S]GTPgS 61. Asimismo, esta exposición crónica a etanol da lugar a una modificación del ARNm del receptor CB1 en diferentes regiones cerebrales de rata 62. Sin embargo, en otro trabajo no se hallaron diferencias en la expresión de ARNm ni en la fijación de radioligandos selectivos del CB1 en ratas expuestas de manera crónica a etanol 63. Por otro lado, se ha descrito que la actividad de la enzima encargada de la degradación de la anandamida, la FAAH, se encuentra modificada en las mismas condiciones. Así, la administración crónica de etanol en ratones disminuye su actividad 64. En cuanto a la neuromodulación que ejerce el receptor CB1 sobre la síntesis de neurotransmisores, se ha observado una desensibilización por la administración crónica de etanol en la capacidad de este receptor para modular la síntesis de monoaminas en cerebro de rata in vivo65.
Dentro de este contexto, muchos autores sugieren que esta desensibilización del receptor CB1 en mamíferos que consumen alcohol de manera crónica se puede deber, como explican los conceptos clásicos de la farmacología, a una sobre-estimulación por sus ligandos endógenos, que se encuentran aumentados. Ahora bien, este aumento de los niveles de endocannabinoides podría tener como origen una mayor síntesis, una menor recaptación a través del transportador de anandamida, o una menor degradación por parte de la enzima FAAH.
En el caso de la abstinencia generada tras una interrupción de la administración crónica de alcohol, se ha descrito una recuperación de la densidad del CB1 (que se encontraba disminuida por el consumo crónico) tras 24 horas de abstinencia 64. En otro trabajo, sin embargo, se observa una primera reducción de la expresión del ARNm del CB1 tras dos días de abstinencia, seguida de un incremento a los 40 días 66. Por otro lado, en cuanto a los endocannabinoides, se ha descrito un gran descenso de los niveles de anandamida y 2-AG en regiones límbicas tras 48 horas de abstinencia, sin que la densidad del receptor CB1 se viera modificada 67.
En los últimos años se han realizado algunos estudios en cerebro humano de individuos con diagnóstico previo de alcoholismo. Se ha observado una hiperactividad del sistema endocannabinoide en la corteza prefrontal de sujetos alcohólicos suicidas, detectándose un aumento de los endocannabinoides AEA y 2-AG, junto con unos niveles de expresión y de funcionalidad del receptor CB1 elevados 68. Se postula que esta hiperactividad podría desempeñar un papel importante en la asociación entre alcoholismo y conducta suicida.
En cuanto a la exposición aguda a etanol, trabajos recientes han demostrado que esta también produce cambios en el sistema cannabinoide endógeno. De manera aguda el etanol reduce los niveles tanto de anandamida 69, como de 2-AG y otras N-aciletanolaminas 70 en cerebro de ratas, y se observa también una disminución en la expresión del ARNm de CB1 en diferentes regiones cerebrales 71, mediante mecanismos todavía desconocidos.
Estudios comportamentales
Las evidencias de tipo comportamental se basan en la modulación del sistema cannabinoide exógenamente, resultando en una preferencia o consumo de etanol alterada, que sugiere la implicación de este sistema modulador en el mecanismo reforzador del etanol. Así, el antagonista selectivo de los receptores CB1 rimonabant (SR141716) disminuye la ingesta de etanol tanto en ratones 72 como en ratas con preferencia por el etanol 73. Efectos similares se han observado tras la administración de surinabant (SR147778) 74,75, otro antagonista del receptor CB1 recientemente sintetizado. Por el contrario, la administración de agonistas cannabinoides, como CP 55,940 o WIN 55,212-2, aumentan el consumo y la preferencia por el etanol en ratas 76 y en ratones 77.
En el mismo sentido, ratones knockout para el receptor CB1 presentan un consumo y preferencia por el etanol reducido, y una sensibilidad y síntomas de abstinencia elevados, al compararlos con ratones no modificados genéticamente (wildtype) 78. Además, ratones knockout para la enzima FAAH, que no poseen mecanismos para degradar la anandamida y por tanto poseen niveles muy elevados de este endocannabinoide, muestran un consumo y preferencia por el etanol incrementados, y una sensibilidad a la sedación producida por el etanol disminuida, comparándolos con ratones wildtype79,80. Estos efectos se reprodujeron en ratones no mutados, cuando se les administró el inhibidor de la FAAH, URB597 79,80.
Por otra parte, se ha demostrado en animales de experimentación la importancia del sistema cannabinoide endógeno en el fenómeno de las recaídas al consumo de etanol 81 y en el efecto que el estrés produce en este consumo 82. En último lugar, los receptores cannabinoides del tracto gastrointestinal también se han relacionado con los mecanismos de absorción y distribución del etanol, al haberse observado un mayor nivel de etanol en sangre tras una inyección aguda de etanol (a altas dosis) en ratones que no expresaban el receptor CB183.
Estudios genéticos
La predisposición hacia un consumo excesivo de alcohol y hacia el desarrollo de alcoholismo se ha asociado con factores genéticos. Según numerosos estudios, la heredabilidad del alcoholismo se sitúa en torno al 40-50 % 84,85. Una evidencia de la implicación del sistema cannabinoide endógeno en el consumo de alcohol es que existen diferencias en el receptor cannabinoide CB1 entre cepas de roedores que presentan preferencia o aversión por el etanol. Se ha observado una disminución en la densidad de receptores CB1 en ratones con alta preferencia por el etanol, frente a los ratones que muestran aversión por este compuesto 86. En estudios de fijación de [ 35S]GTPγS ha podido observarse que los ratones que presentan aversión por el alcohol tienen receptores CB1 menos eficaces que la cepa preferente 87. Sin embargo, en estudios de fijación de [ 35S]GTPγS en cerebro de ratas, se ha descrito una reducida funcionalidad de los receptores CB1 en la cepa de ratas con preferencia al etanol frente a la cepa que presenta aversión 88.
En otro estudio más reciente se ha observado la existencia de una alteración genética para la degradación de endocannabinoides en la corteza prefrontal de ratas preferentes de alcohol. Así, una disminución de la densidad y funcionalidad del receptor CB1 se ve acompañada de una reducción en la expresión del ARNm de la enzima FAAH y de su actividad, y de un aumento simultáneo de los niveles del endocannabinoide 2-AG 89.
Por otro lado, estudios genéticos realizados en el ser humano también han descrito asociaciones entre variaciones del sistema cannabinoide endógeno y el alcoholismo. Existe una variación en el gen que codifica el receptor CB1 (CNR1), cuya aparición está asociada a una mayor gravedad de los síntomas asociados al síndrome de abstinencia 90. Recientemente se ha descrito que un alelo para este mismo polimorfismo está asociado con una mayor densidad del CB1 en la corteza prefrontal, una mayor activación cerebral ante estímulos relacionados con el alcohol, una mayor percepción subjetiva de la recompensa provocada por el alcohol, y mejores resultados tras el tratamiento con fármacos que modulan el sistema mesolimbicocortical 91. Además, se ha observado que otros polimorfismos de nucleótido único (SNP) en el CNR1 también parecen modular el riesgo de desarrollar una adicción al alcohol y a otras drogas de abuso 92. Del mismo modo, estudios similares han descrito que en el gen que codifica para la enzima FAAH existe un SNP altamente asociado con el uso problemático de drogas y alcohol 93. Por otra parte, el receptor CB2 también ha sido analizado en una población japonesa, y se ha descrito un polimorfismo de este receptor asociado a la dependencia alcohólica 94.
Sin embargo, otros estudios han descartado esta posible asociación de SNP del CNR1 en el alcoholismo. Está descrito que un polimorfismo de este gen se encuentra asociado al uso intravenoso de drogas de abuso, pero no se observó ninguna asociación significativa con el abuso o dependencia al alcohol 95. Asimismo, tampoco se halló una asociación de este polimorfismo del CNR1 en la patogénesis del delirium tremens96.
El sistema cannabinoide endógeno como posible diana terapéutica en el tratamiento del alcoholismo
Los datos farmacológicos sugieren que el sistema cannabinoide endógeno incrementa la sensibilidad a diferentes sustancias con propiedades reforzadoras. Este efecto se debería principalmente a su capacidad de modular la actividad del sistema de recompensa mesolimbicocortical 97. Con respecto al etanol, como se ha comentado anteriormente, parece claro que los receptores cannabinoides CB1 están directamente implicados en mediar parte de sus acciones reforzadoras en los circuitos de recompensa. De este modo, mientras los fármacos agonistas de los receptores CB1 estimulan la ingesta de etanol en ratas 98, los fármacos antagonistas de estos receptores bloquean la capacidad del etanol de estimular la liberación de dopamina en el núcleo acumbens, disminuyen la ingesta en ratas y previenen la recaída en el consumo 73,74.
A la vista de estos estudios donde se han observado numerosas evidencias de la implicación del sistema cannabinoide endógeno en la dependencia al etanol, y en los cuales el bloqueo de los receptores cannabinoides parece reducir el consumo, la recaída y la motivación hacia el consumo en animales, se ha postulado la hipótesis de que los fármacos antagonistas selectivos de los receptores cannabinoides CB1 pudieran ser de utilidad en el tratamiento del alcoholismo. A partir de esta hipótesis se han llevado a cabo hasta el momento dos ensayos clínicos de fase II. Ambos ensayos clínicos, diseñados a doble ciego, se han centrado en estudiar el efecto del antagonista selectivo de los receptores cannabinoides CB1 rimonabant frente a placebo. El rimonabant ha demostrado previamente en diferentes estudios clínicos su capacidad para bloquear los efectos reforzadores de diferentes sustancias de abuso, reduciendo por ejemplo el consumo de tabaco y la ingesta de comida. Esto ha hecho que este fármaco haya sido comercializado para el tratamiento de la obesidad 99. Sin embargo, la comercialización de rimonabant ha sido recientemente suspendida por la posibilidad de aparición de efectos adversos psiquiátricos graves durante su utilización.
En el primero de los ensayos clínicos se valoró la posible eficacia del tratamiento con rimonabant (20 mg) durante 12 semanas en la prevención de recaídas en pacientes alcohólicos en periodo de desintoxicación 100. Aunque el rimonabant mostró un ligero efecto en reducir la tasa de recaídas, las diferencias no fueron estadísticamente significativas frente a placebo. La falta de eficacia de rimonabant podría explicarse por una tasa elevada de respuesta en el grupo placebo y por una duración del tratamiento relativamente corta 100.
El segundo de los ensayos ha valorado la eficacia de rimonabant en reducir el consumo de etanol en pacientes adictos a esta sustancia. Sin embargo, sus resultados no han sido todavía publicados (http://clinicaltrials.gov/ ct2/show/NCT00075205).
Como conclusión podemos afirmar que son numerosas las evidencias científicas que avalan una implicación del sistema cannabinoide endógeno en la instauración de los procesos de abuso y dependencia alcohólicas. A partir de estos hechos son necesarios nuevos estudios que valoren en profundidad la posible utilidad terapéutica de la manipulación farmacológica del sistema cannabinoide endógeno para el tratamiento del alcoholismo.
*Financiado en parte por el Plan Nacional Sobre Drogas (PI2006I045) y por el Instituto de Salud Carlos III, Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM. A.M. Erdozain disfruta de una beca predoctoral para la formación de investigadores del Gobierno vasco.
Los autores declaran que no existe conflicto de interés.
Correspondencia:
L.F. CALLADO.
Departamento de Farmacología. Facultad de Medicina y Odontología. Universidad del País Vasco/Euskal Herriko Unibertsitatea. C/ Barrio Sarriena, s/n. 48940 Leioa. Bizkaia. España.
Correo electrónico: lf.callado@ehu.es
Recibido: 26-02-2009
Aceptado para su publicación: 14-04-2009