La predisposición genética al alcoholismo y la vulnerabilidad al abuso de cocaína u otras sustancias psicoactivas
The genetic predisposition toward alcoholism and the vulnerability to cocaine and other psychoactive drug abuse
MARTINEZ-RAGA, J.
South London and Maudsley NHS Trust. Maudsley Hospital. Londres.
Correspondencia:
Dr. J. MARTINEZ-RAGA.
Departament of Psychiatry.
South London and Maudsley NHS Trust.
Maudsley Hospital.
Denmark Hill London SE5 8AZ (Reino Unido).
RESUMEN: Objetivo: evaluar si la predisposición genética a una mayor sensibilidad al alcohol es generalizable a la cocaína.
Material y métodos: evaluación de las respuestas subjetivas y farmacocinéticas tras la administración aguda de cocaína. Pacientes, participantes: 1 grupo de sujetos con antecedentes familiares de alcoholismo y otro grupo de sujetos sin tales antecedentes.
Resultados: no se observaron diferencias entre grupos en los efectos subjetivos. Los sujetos con antecedentes familiares mostraron un patrón farmacocinético diferente.
Conclusiones: los mecanismos de susceptibilidad al alcohol y al abuso de cocaína parecen ser diferentes entre sí.
PALABRAS CLAVE: Adicción a drogas. Vulnerabilidad a drogas. Abuso de cocaína.
ABSTRACT: Objective: to assess whether the genetic predisposition toward alcoholism is associated with cocaine abuse.
Material and methods: subjective responses and pharmacokinetic analysis following acute cocaine administration. Patients: one group of subjects with family history of alcoholism and another group of subjects without family history of alcoholism.
Results: no differences between groups were observed in the subjective effects. Differences between groups were observed in pharmacokinetics of cocaine.
Conclusions: the mechanisms of vulnerability to alcohol abuse seem to be different from those involved in cocaine abuse.
KEY WORDS: Drug addiction. Drug vulnerability. Cocaine abuse.
Introducción
El presente trabajo se divide en 2 partes. En primer lugar se presenta una revisión de los datos provenientes de estudios epidemiológicos, así como de estudios neurobiológicos y neurofarmacológicos, que sugieren la asociación entre los antecedentes familiares de alcoholismo y la predisposición al abuso o dependencia a otras sustancias psicoactivas y en particular a la cocaína. En la segunda parte se presentan datos de un estudio llevado a cabo específicamente para evaluar las diferencias en los efectos subjetivos, farmacocinéticos, fisiológicos y electrofisiológicos a una dosis intranasal de cocaína en función de los antecedentes familiares de alcoholismo. En concreto se presentan datos provenientes de la respuestas subjetivas y farmacocinéticas.
La relación entre la existencia de antecedentes familiares de alcoholismo y una mayor susceptibilidad para desarrollar abuso o dependencia al alcohol ha sido ampliamente documentada a lo largo de las últimas décadas en numerosos estudios. Los resultados de estudios de gemelos, estudios de adopción y estudios de familias han indicado que los individuos con antecedentes familiares de alcoholismo presentan un riesgo entre 3 y 5 veces superior de desarrollar alcoholismo que los sujetos sin tales antecedentes familiares1-4. El modo de transmisión parece ser complejo y multifactorial, tal como ocurre con la mayoría de trastornos psiquiátricos, y es probablemente la interacción de factores biológicos y ambientales lo que da el nivel final de riesgo5-7.
El patrón de transmisión más probable de la vulnerabilidad a desarrollar un trastorno por abuso de alcohol parece producirse bien mediante un modelo poligénico y/o bien mediante un modelo de transmisión autosómica dominante con expresión incompleta5,8,9. El gen del receptor dopaminérgico D2, el denominado DRD2, y especialmente el alelo TaqI-A1 ha sido asociado con la dependencia al alcohol10,11. Se ha sugerido también una asociación del alelo TaqI-B (B1) del gen DRD2 con el abuso de alcohol y drogas psicoestimulantes como la cocaína o las anfetaminas11. Sin embargo, estudios recientes han aportado resultados contradictorios a este respecto12. Por otro lado, el sistema opioide endógeno a través del gen del receptor (OPRM1) también ha sido asociado con el síndrome de dependencia al alcohol y otras drogas como la nicotina, el cannabis, las anfetaminas o la cocaína13. También se ha sugerido una posible vinculación del gen promotor del transporte de la serotonina en la desarrollo de abuso crónico de alcohol14.
La mayor vulnerabilidad al abuso o dependencia al alcohol en sujetos con antecedentes familares de alcoholismo se ha explicado en función de una menor intensidad de su respuesta fisiológica y subjetiva, y por tanto del menor refuerzo positivo que experimentan a dosis moderadas de alcohol15-17. Al presentar una respuesta atenuada a los efectos del alcohol y por tanto sentirse menos intoxicados, los sujetos con antecedentes familiares de alcoholismo tenderían a consumir mayores cantidades para obtener efectos similares a los experimentados por individuos sin dichos antecedentes. Así, carecerían de uno de los numerosos posibles signos internos de alarma que les indicaría cuando parar de beber antes de estar demasiado embriagados. Mientras que estos sujetos podrían sentir relativamente pocos efectos después de haber consumido entre 3 y 5 bebidas, también podrían embriagarse más rápidamente tras superar un cierto nivel de consumo de alcohol. Esto a su vez podría contribuir al desarrollo de tolerancia conductual y farmacológica, lo que a su vez conllevaría la necesidad de dosis cada vez más elevadas de alcohol para alcanzar la intoxicación.
Schuckit et al han llevado a cabo una serie de estudios de seguimiento en el que evaluaron la relación entre la respuesta a una dosis específica de alcohol en 450 individuos con y sin antecedentes familiares de alcoholismo y el posterior desarrollo de abuso o dependencia al alcohol tras un período de 8 años de seguimiento3,16,17. En dichos estudios la existencia de antecedentes familiares de alcoholismo se asociaba con un riesgo 3 veces superior de desarrollar un trastorno por uso de alcohol. El mayor riesgo de desarrollar abuso o dependencia al alcohol también se asociaba con una menor respuesta al alcohol. Asimismo, entre los sujetos que desarrollaron abuso o dependencia al alcohol, un significativo mayor número de sujetos con antedentes familiares también cumplían criterios de abuso o dependencia a sustancias psicoestimulantes.
Si bien múltiples estudios sugieren una relación entre los antecedentes familiares de alcoholismo y la mayor vulnerabilidad a desarrollar abuso o dependencia al alcohol, existen pocos datos sobre la relación entre dichos antecedentes familiares y la vulneralidad a otras drogas de abuso. Sin embargo, hay evidencias de un mecanismo fisiológico común heredable, responsable de una mayor susceptibilidad para el abuso o dependencia a sustancias psicoactivas, en individuos expuestos18. Miller et al19 y Wallace20 hallaron que el 51 y el 61%, respectivamente, de pacientes dependientes de cocaína tenían antecedentes familiares de alcoholismo. Los resultados de una encuesta de 744 universitarios varones indicaron que el abuso de sustancias psicoactivas era más prevalente entre los estudiantes en los que algún familiar de primer o segundo grado presentase un diagnóstico de dependencia al alcohol según los criterios del DSM-III-R21. Una conclusión similar se obtuvo en un estudio con adolescentes22. Rounsaville et al23 en un amplio estudio de familias observaron tasas más altas de alcoholismo, abuso de drogas, trastorno antisocial de la personalidad y depresión mayor entre los parientes de primer grado de los pacientes dependientes a opiáceos que en los parientes de los controles normales. Asimismo se ha descrito que los individuos cuyo padre tenía antecedentes de abuso de alcohol o drogas presentaban una mayor tendencia a haber consumido cocaína, heroína u otras drogas de abuso, y de haber consumido alcohol a diario durante el año anterior que los individuos sin dichos antecedentes familiares; asimismo, un mayor número de sujetos cuyos padres presentaban antecedentes de abuso de sustancias psicoactivas habían sido tratados por problemas de abuso de alcohol o drogas24.
Hasta la fecha muy pocos estudios han evaluado la influencia genética en la predisposición al consumo, abuso y dependencia a otras sustancias psicoactivas distintas al alcohol7,25. Estos estudios sugieren que la influencia relativa de factores ambientales y genéticos varía enormemente dependiendo de la clase de droga, de si se considera el consumo, abuso o dependencia, así como del sexo del individuo. Mientras que los factores ambientales parecen tener una mayor importancia de cara a predisponer al consumo de sustancias psicoactivas, los resultados de estos estudios indican que los factores genéticos son de mayor importancia que la influencia ambiental en la vulnerabilidad al abuso o dependencia de sustancias psicoactivas, particularmente en el caso de la cocaína y otras sustancias psicoestimulantes, así como en el caso de tratarse de individuos varones. Las diferencias en la importancia de los factores genéticos y ambientales entre distintas sustancias psicoactivas posiblemente refleja las diferencias de las distintas clases de drogas en sus mecanismos de acción, sus efectos neurobiológicos y en sus efectos subjetivos y conductuales26.
En resumen, junto a la clara evidencia de la existencia de una vulnerabilidad genética al alcoholismo existen numerosos datos que sugieren el papel de los factores genéticos en la vulnerabilidad al abuso o dependencia a otras sustancias psicoactivas. Más concretamente, datos procedentes de diferentes estudios parecen indicar una mayor susceptibilidad común al abuso o dependencia al alcohol y a la cocaína. Por ello se decidió llevar a cabo un estudio en el que se evaluó la hipótesis que la predisposición genética a una mayor sensibilidad al alcohol pueda no ser exclusiva a dicha sustancia, sino que se generaliza también a la cocaína. Por tanto, evaluamos si un grupo de sujetos con antecedentes familiares de alcoholismo (cAFA) y otro grupo de sujetos sin antecedentes familiares de alcoholismo (sAFA) presentaban diferentes respuestas subjetivas y farmacocinéticas tras la administración aguda de cocaína.
Material y métodos
Catorce varones, voluntarios sanos, cAFA con una edad media de 26,4 años (intervalo: 22-34) y 14 sujetos sAFA cuya edad media era de 26,1 años (intervalo: 21-35) participaron en el estudio llevado a cabo en el laboratorio de Neuropsicofarmacología Clínica del Alcohol and Drug Abuse Research Center, en McLean Hospital y la Universidad de Harvard. Los sujetos con patología neurológica, infecciosa, neoplásica o psiquiátrica, o con abuso o dependencia, presente o pasado de alcohol u otras sustancias psicoactivas fueron excluidos del estudio. Todos los sujetos eran consumidores ocasionales de cocaína por vía intranasal. Los sujetos actuaron como sus propios controles y fueron estudiados en condiciones doble-ciego en 2 sesiones experimentales separadas. El orden de administración de la cocaína y el placebo fue randomizado entre sujetos. La cocaína fue administrada por vía endonasal a una dosis de 0,05 (placebo) y 0,9 mg/kg mediante un dispositivo de autoadministración expresamente diseñado. Los sujetos debían esnifar la mitad de la dosis por cada una de las fosas nasales.
Los antecedentes familiares de alcoholismo se determinaron mediante un método cuantitativo basado en parte en el método de densidad de los antecedentes familiares27.El proceso se llevó a cabo a través de una serie de pasos. En primer lugar se utilizaron los criterios establecidos por Schuckit28 y ampliados mediante la utilización del módulo de evaluación individual de la sección de alcoholismo del Family History Assessment Module (FHAM), que es una entrevista estructurada diseñado para el diagnóstico los principales29.Este instrumento describe criterios operacionales específicos para determinar los diagnósticos en función de la información obtenida mediante el método de historia familiar. Según el FHAM, para ser catalogado como «alcohólico» el pariente en cuestión debería haber experimentado, de forma repetida, al menos 3 problemas asociados con el consumo de alcohol a lo largo de su vida. Por último se calculó un sistema de puntuación del siguiente modo: 1 punto por el padre, 0,5 puntos por cada hermano/a o por cada abuelo/a y 0,25 puntos por cada tío/a. Para ser considerado como sujetos cAFA, la suma de la puntuación de sus parientes debía ser igual o superior a 0,75 puntos, y debería ser inferior a 0,25 puntos para ser calificado como sujeto sAFA. En el caso de que la suma de la puntuación de sus parientes fuese de 0,50 puntos los sujetos eran excluidos del estudio, con el fin de asegurar una clara diferenciación entre sujetos cAFA y sAFA.
Los efectos subjetivos de la cocaína y las respuestas a los cuestionarios se recogieron a través de un joystick de ordenador adaptado para su uso con estos fines y que proporciona una medida continuada e ininterrumpida del inicio y duración total de los efectos de la cocaína experimentados por los sujetos, así como de la aparición de efectos considerados como intensamente positivos o reforzantes («euforia») y de efectos considerados como intensamente negativos o desagradables («disforia»)30
Los sujetos debían responder mediante el joystick a 7 escalas analógicas visuales (EAV) computerizadas, según como se sintiesen en el momento preciso en que estas apareciesen en la pantalla. Para ello debían mover un cursor sobre una línea horizontal de 100 mm de longitud en cuyos extremos figuraban las palabras none («nada») y extremely («extremadamente») para responder a cada una de las siguientes preguntas: «How good do you feel?» («¿Cuán bien se siente?»), «How happy do you feel?» («¿Cuán contento se siente?»), «How high do you feel?» («¿Cuán colocado se siente?»), «How stimulated do you feel?» («¿Cuán estimulado se siente?»), «How anxious do you feel?» («¿Cuán ansioso se siente?»), «How bad do you feel? («¿Cuán mal se siente?»), «How strong is your desire to use cocaine?» («¿Cuán fuerte es su deseo de consumir cocaína?»). También se administró una versión de 49 ítems del Addiction Research Center Inventory (ARCI) (31), un cuestionario de verdadero-falso que consta de las siguientes 5 escalas: MBG, que fundamentalmente mide euforia; PCAG, una medida de sedación y letargia; LSD, que mide cambios disfóricos y simpaticomiméticos; BG, sensible a los estimulantes; a una escala sensible a los efectos de la d-anfetamina. Los sujetos debían responder a las EAV y al ARCI en 8 ocasiones durante cada sesión experimental: 10 minutos antes y 10, 30, 60, 90, 120, 180 y 240 minutos tras haber esnifado la cocaína o el placebo.
El estudio incluía la extracción de muestras de sangre para el análisis de los niveles de plasmáticos cocaína y 2 de sus metabolitos, benzoilecgonina (BE) y metiléster de ecgonina (EME). Junto con las muestras basales durante la primera hora tras la administración de la droga se obtuvieron muestras cada 5 minutos, obteniéndose el resto de muestras de sangre a los 75, 90, 105, 120, 150, 180, 210 y 240 minutos. Las muestras de plasma fueron analizadas mediante técnicas cromatografía de gases y espectrometría de masas (GC/MS)32.
El análisis de las puntuaciones de los cuestionarios, y de las muestras de sangre se llevó a cabo mediante un análisis de varianza (ANOVA) bifactorial de mediciones repetidas, siendo los AFA y la dosis de cocaína las variables independientes, recurriendo a la prueba de «t» de Student para la comparación de los valores medios en cada uno de los puntos temporales para el análisis post-hoc. El análisis estadístico de las características sociodemográficas y de los efectos subjetivos obtenidos mediante el joystick se realizó mediante la prueba de *2 para las variables cualitativas, mientras que el análisis de las variables cuantitativas se utilizó la prueba de «t» de Student. El nivel de significatividad estadística se estableció a valores de p < 0,05.
Resultados
Respuestas subjetivas obtenidas mediante el joystick
Doce (85,7%) sujetos cAFA y 9 (64,3%) sAFA manifestaron detectar los efectos de la cocaína tras la administración de la dosis activa. Asimismo, 9 (64,3%) sujetos cAFA y 7 (50,0%) sAFA experimentaron sensaciones de euforia tras la administración de cocaína. Seis (42,9%) individuos cAFA y 2 (14,3%) sAFA experimentaron sensaciones de disforia. No se apreciaron diferencias significativas entre ambos grupos en ninguno de estos parámetros, ni tampoco en la latencia a detectar los efectos a la cocaína, la duración total de los efectos de la cocaína, la latencia a experimentar las sensaciones de euforia, el número de episodios de euforia, la duración total de la euforia, la latencia a experimentar los efectos disfóricos, el número de episodios de disforia y la duración total de las sensaciones de disforia.
Respuestas en las escalas analógicas visuales (EAV)
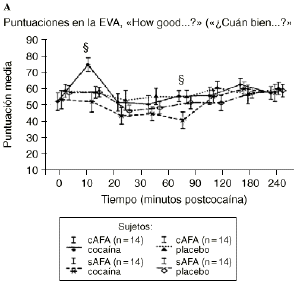
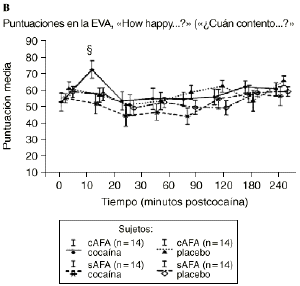
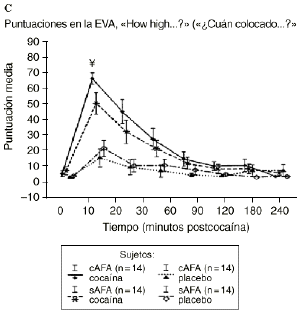
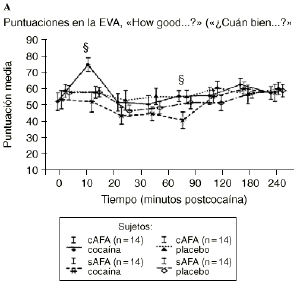
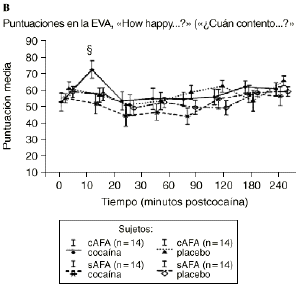
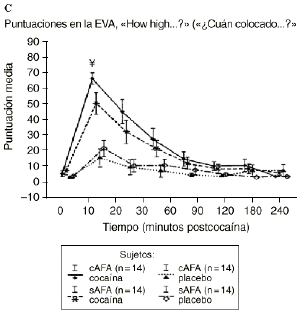
Mientras que la administración de placebo no provocó variaciones pronunciadas en las puntuaciones de las EAV, la dosis activa causó cambios apreciables en mayor o menor medida en todas las EAV. El análisis mediante ANOVA bifactorial de medidas múltiples no mostró diferencias estadísticamente significativas entre ambos grupos con respecto a ninguna de las 9 EAV utilizadas en el estudio. Sin embargo, tal como se observa en la figura 1, los análisis posthoc revelaron que tras la administración de la dosis activa (0,9 mg/kg) los sujetos cAFA presentaban puntuaciones significativamente más altas en la EAV how good do you feel? a los 10 minutos (72,1 ± 13,8 vs 51,5 ± 21,3; p < ,007) y a los 90 minutos (54,6 ± 11,6 vs 41,4 ± 16,6; p < 0,03) tras haber esnifado la cocaína. Asimismo, a los 10 minutos tras la administración de la cocaína también presentaban puntuaciones significativamente superiores en la EAV how happy do you feel? (69,4 ± 17,8 vs 51,1 ± 20,5; p < 0,02), y marginalmente superiores en la EAV how high do you feel? (67,0 ± 14,6 vs 50,3 ± 27,1; p = 0,05).
Figura 1. A) Puntuaciones medias (± 1 SEM) de las EAV: «How good do you feel?» («¿Cuán bien se siente?»). B) «How happy do you feel?» («¿Cuán contento se siente?»). C) «How high do you feel?» («¿Cuán colocado se siente?») tras la administración de cocaína (0,9 mg/kg) y placebo en sujetos con y sin antecedentes de alcoholismo (cAFA y sAFA). Los signos § y ¥ indican diferencias estadísticamente y marginalmente significativas, respectivamente.
Respuestas en el ARCI
La administración del placebo no provocó cambios marcados en las puntuaciones del ARCI. La administración de la cocaína, sin embargo, cambios en las 5 escalas que fueron máximos a los 10 minutos tras a la administracón de la droga. Ni el análisis de los datos mediante un ANOVA bifactorial ni el subsiguiente análisis posthoc reveló diferencias estadísticamente significativas entre los 2 grupos.
Niveles plasmáticos de cocaína y sus metabolitos
Las concentraciones plasmáticas de cocaína y de su metabolito benzoilecgonina (BE) estuvieron disponibles de 11 sujetos cAFA y 13 sAFA, mientras que las concentraciones plasmáticas de metiléster de ecgonina (EME) fueron obtenidas de 6 individuos cAFA y 8 sAFA. Tras el placebo no se detectó la cocaína o sus metabolitos en ninguna de las muestras de plasma.
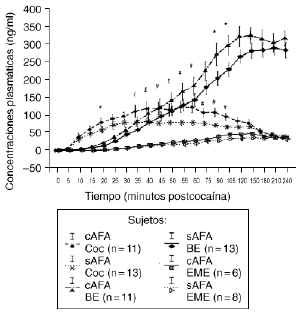
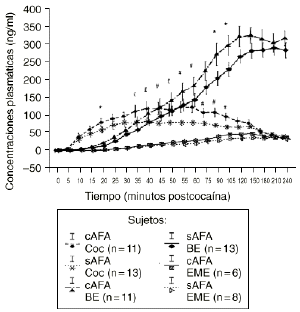
En el análisis de las muestras obtenidas tras la administración de las dosis activa mediante el ANOVA monofactorial (con los AFA como variable independiente) no se observaron diferencias significativas entre los 2 grupos en los niveles de cocaína, BE y EME. Pero tal como se aprecia en la figura 2 el subsiguiente análisis mostró que los sujetos cAFA presentaban niveles plasmáticos de cocaína significativamente superiores que los sujetos sAFA a los 45 (121,2 ± 17,7 vs 78,5 ± 8,0; p < 0,05), 55 (126,3 ± 16,1 vs 80,5 ± 7,8; p < 0,02), 60 (125,6 ± 16,2 vs 80,6 ± 7,8; p < 0,03), 75 (109,3 ± 13,0 vs 77,7 ± 6,3; p < 0,05), 90 (110,4 ± 13,3 vs 72,9 ± 5,9; p < 0,02) y 105 minutos (97,5 ± 11,1 vs 67,7 ± 5,6; p < 0,03), y niveles marginalmente superiores a los 35 (113,5 ± 18,5 vs 78,9 ± 9,5; p = 0,095), 40 (120,8 ± 18,9 vs 83,5 ± 9,6; p = 0,078) y 50 minutos (117,7 ± 18,0 vs 80,7 ± 7,3; p = 0,055) tras la administración de la droga. Asimismo, los individuos cAFA alcanzaron concentraciones marginalmente superiores de BE a los 20 minutos (21,3 ± 4,3 vs 12,4 ± 2,6; p = 0,077), 90 minutos (279,4 ± 33,5 vs 210,0 ± 20,6; p = 0,096) y 105 minutos (304,7 ± 29,2 vs 235,7 ± 20,1; p = 0,058) tras haber esnifado la droga.
Figura 2. Niveles plasmáticos de cocaína (Coc), benzoilecgonina (BE) y metiléster de ecgonina (EME) tras la administración de cocaína (0,9 mg/kg) en sujetos con y sin antecedentes de alcoholismo (cAFA) y (sAFA). # y £ : diferencias estadísticamente y marginalmente significativas, respectivamente, en los niveles plasmáticos de cocaína entre ambos grupos. * Diferencias marginalmente significativas en los niveles plasmáticos de BE entre ambos grupos.
Conclusiones
Basándonos en los datos de los estudios que han sugerido que la mayor vulnerabilidad al abuso o dependencia al alcohol en sujetos cAFA se explica en base a la menor intensidad de su respuesta al de alcohol, y asumiendo que los individuos cAFA podrían también presentarían una menor sensibilidad a otras drogas de abuso, también esperábamos que en el presente estudio el grupo de sujetos cAFA presentasen una menor respuesta fisiológica y subjetiva tras la administración aguda de cocaína. Sin embargo, y si bien no aparecen diferencias en los efectos subjetivos medidos mediante el joystick o en el ARCI, los sujetos cAFA presentan puntuaciones significativamente más altas a los 10 minutos tras la administración en tres de las EAV que miden los efectos reforzantes de la cocaína. Asimismo, los sujetos cAFA alcanzaron concentraciones significativamente más altas de cocaína entre los 45 y 105 minutos tras su consumo. A pesar de que el curso temporal es diferente, las diferencias en concentraciones plasmáticas podrían asociarse a las diferencias en los efectos subjetivos. Es poco probable que las diferencias en las concentraciones plasmáticas de cocaína puedan deberse a diferencias en su metabolismo debido a que no habían diferencias en las concentraciones de los 2 metabolitos.
Si consideramos que las diferencias en los efectos subjetivos son modestos y de breve duración, y si la mayor vulnerabilidad al abuso de sustancias psicoactivas en individuos cAFA es a través de una menor respuesta subjetiva, en ese caso parece improbable que dichos individuos presenten un mayor riesgo para el consumo o el abuso de cocaína. Sin embargo, estudios clínicos y epidemiológicos sugieren que los hijos de individuos dependientes del alcohol presentan una mayor predisposición no sólo a desarrollar alcoholismo, sino también un trastorno por uso de cocaína y otras sustancias psicoactivas18,19,21. Por tanto, si las diferencias subjetivas y farmacocinéticas en el presente estudio se asocian con una mayor susceptabilidad al uso de cocaína en los sujetos cAFA, los mecanismos fisiológicos y neuroquímicos subyacentes serían distintos a los que explican la mayor vulnerabilidad al abuso de alcohol. Esto podría explicarse al menos en parte por el diferente modo de acción de la cocaína como psicoestimulante, comparado con el alcohol y sus efectos breves e inmediatos caracterizados por un aumento de las sensaciones placenteras y una intensa euforia33. De hecho, el uso repetido de la cocaína se ha explicado como un intento de la búsqueda repetida de la euforia34. En tal caso, los sujetos cAFA al experiementar efectos subjetivos reforzantes más intensos tras la administración intranasal de cocaína podrían ser más vulnerables al uso continuado. Son necesarios más estudios experimentales y epidemiológicos que ayuden a desvelar la compleja relación entre los antecedentes familiares de alcoholismo y la mayor vulnerabilidad al abuso o dependencia de sustancias psicoactivas.
Bibliografía
1. Cloninger CR, Bohman M, Sigvardsson S. Inheritance of alcohol abuse: cross-fostering analysis of adopted men. Arch Gen Psychiatry 1981;38:861-7.
2. Merikangas KR. The genetic epidemiology of alcoholism. Psychol Med 1990;20:11-22.
3. Schuckit MA, Smith TL. An 8-year follow-up of 450 sons of alcoholic and control subjects. Arch Gen Psychiatry 1996;53:202-10.
4. Prescott CA, Kendler KS. Genetic and environmental contributions to alcohol abuse and dependence in a population-based sample of male twins. Am J Psychiatry 1999;156:34-40.
5. Schuckit MA. A clinical model of genetic influences in alcohol dependence. J Stud Alcohol 1994b;55:5-17.
6. Kendler KS, Walters EE, Neale MC, et al. The structure of the genetic and enviromental risk factors for six major psychiatric disorders in women. Phobia, generalyzed anxiety disorder, panic disorder, bulimia, major depression, and alcoholism. Arch Gen Psychiatry 1995;52:374-83.
7. Van den Bree MB, Svikis DS, Pickens RW. Genetic influences in antisocial personality and drug use disorders. Drug Alcohol Depend 1998;49:177-87.
8. Devor EJ, Cloninger CR. Genetics of alcoholism. Annu Rev Genet 1989;23:19-36.
9. Agarwal DP. Molecular genetic aspects of alcohol metabolism and alcoholism. Pharmacopsychiatr 1997;79-84.
10. Blum K, Noble EP, Sheridan PJ, et al. Allelic association of human dopamine D2 receptor gene in alcoholism. JAMA 1990;263:2050.
11. Noble EP. The D2 dopamine receptor gene: a review of association studies in alcoholism and phenotypes. Alcohol 1998;16:33-45.
12. Edenberg HJ, Foroud T, Koller DL, et al. A family-based analysis of the association of the dopamine D2 receptor (DRD2) with alcoholism. Alcohol Clin Exp Res 1998;22:505-12.
13. Kranzler HR, Gelernter J, O''Malley S, Hernandez-Avila CA, Kaufman D. Association of alcohol or other drug dependence with alleles of the ñ opioid receptor gene (OPRM1). Alcohol Clin Exp Res 1998;22:1359-62.
14. Little KY, McLaughlin DP, Zhang L, et al. Cocaine, ethanol, and genotype effects on human midbrain serotonin transporter binding sites and mRNA levels. Am J Psychiatry 1998;155:207-13.
15. Pollock VE. Meta-analysis of subjective sensitivity to alcohol in sons of alcoholics. Am J Psychiatry 1992;149:1534-8.
16. Schuckit MA. Low level of response to alcohol as a predictor of future alcoholism. Am J Psychiatry 1994a; 151:184-189.
17. Schuckit MA, Smith TL. Assessing the risk of alcoholism among sons of alcoholics. J Stud Alcohol 1997;58:141-5.
18. Cadoret RJ, Yates WR, Troughton E, Woodworth G, Stewart MA. Adoption study demonstrating two genetic pathways to drug abuse. Arch Gen Psychiatry 1995;52:42-52.
19. Miller NS, Gold MS, Belkin BM, Klahr AL. Family history and diagnosis of alcohol dependence in cocaine dependence. Psychiatry Res 1989;29:113-21.
20. Wallace BC. Crack cocaine smokers as adult children of alcoholics: the dysfunctional family link. J Subst Abuse Treat 1990;7:89-100.
21. McCaul ME, Turkkan JS, Svikis DS, et al. Alcohol and drug use by college males as a function of family alcoholism history. Alcohol Clin Exp Res 1990;14:467-71.
22. Zarek D, Hawkins JD, Rogers PD. Risk factors for adolescent substance abuse: implications for pediatric practice. Pediatr Clin North Am 1987;34:481-93.
23. Rounsaville BJ, Kosten TR, Weissman MM, et al. Psychiatric disorders in relatives of probands with opiate addiction. Arch Gen Psychiatry 1991;48:33-42.
24. Caudill BD, Hoffman JA, Hubbard RL, Flynn PM, Luckey JW. Parental history of substance abuse as a risk factor in predicting crack smokers'' substance use, illegal activities, and psychiatric status. Am J Drug Alcohol Abuse 1994;20:341-54.
25. Tsuang MT, Lyons MJ, Eisen SA, et al. Genetic influences on DSM-III-R drug abuse and dependence: a study of 3,372 twin pairs. Am J Med Genet 1996;67:473-7.
26. Nestler EJ, Aghajanian GK. Molecular an cellular basis of addiction. Science 1997;278:58-63.
27. Turner WM, Cutter HSG, Worobec TG, et al. Family history models of alcoholism: age of onset, consequences and dependence. J Stud Alcohol 1993;54:164-71.
28. Schuckit MA. Ethanol-induced changes in body sway in men at high alcoholism risk. Arch Gen Psychiatry 1985;42:375-9.
29. Rice JP, Reich T, Bucholz KK, et al. Comparison of direct interview and family history diagnoses of alcohol dependence. Alcohol Clin Exp Res 1995;19:1018-23.
30. Lukas SE, Mendelson JH, Woods BT, et al. Topographic distribution of EEG alpha activity during ethanol-induced intoxication in women. J Stud Alcohol 1989;50:176-85.
31. Martín WR, Sloan JW, Sapira JD, Jasinski DR. Physiologic, subjective, and behavioral effects of amphetamine, metamphetamine, ephedrine, phenmetrazine, and methylphenidate in man. Clin Pharmacol Ther 1971;12:245-58.
32. Cone EJ, Hillsgrove M, Darwin WD. Simultaneous measurements of cocaine, cocaethylene, their metabolites and crack pyrolysis products by gas chromatography-mass spectrometry. Clinical Chemistry 1994;40:1299-305.
33. Gawin FH. Cocaine addiction: psychology and neurophysiology. Science 1991;251:1580-6.
34. Johanson CE, Fischman MW. The pharmacology of cocaine related to its abuse. Pharmacol Rev 1989;41:3-52.