A la hora de elaborar un plan terapéutico integrado para la deshabituación de la mayoría de sustancias psicoactivas que conducen a una dependencia física, una de las primeras fases suele consistir en el control del síndrome de abstinencia (o desintoxicación).
En el tratamiento de la adicción a opiáceos el proceso de desintoxicación puede considerarse como el estadio preliminar, necesario pero no suficiente, para la consecución del mantenimiento a largo plazo de la abstinencia.
El hecho de que este paso sea indispensable para el inicio de un programa de mantenimiento con antagonistas o para cualquier otro tipo de programa libre de drogas ambulatorio o en régimen de ingreso, no lo debe convertir en una cuestión exclusivamente farmacológica ni debe considerarse únicamente relevante desde el punto de vista médico.
No obstante, el que sólo signifique un componente pequeño dentro del amplio margen de intervenciones necesarias para el tratamiento y la rehabilitación, no impide que sea vivido como un grave obstáculo por el adicto, por ello su manejo tiene una gran importancia dentro del proceso terapéutico.
Con objeto de ayudar al adicto a opiáceos a superar este obstáculo inicial que representa el síndrome de abstinencia a opiáceos (SAO) cuando se interrumpe el consumo, se han desarrollado diversos protocolos de tratamiento farmacológico1 que suponen un paso importante en la práctica clínica de las adicciones y que, en general, pueden realizarse tanto en el ámbito ambulatorio como hospitalario.
En este sentido, a lo largo de los últimos años han cobrado especial relevancia aquellos protocolos farmacológicos que persiguen una transición más rápida hacia el proceso de deshabituación, acortando el período de desintoxicación mediante el empleo precoz de antagonistas.
Dentro de estos protocolos, una de las técnicas que más interés ha suscitado en la investigación sobre adictos a opiáceos son las denominadas «desintoxicaciones ultracortas», que se caracterizan, de manera general, por lo siguiente:
1. La precipitación de un cuadro de abstinencia en sujetos dependientes de opiáceos mediante la administración de un antagonista.
2. Los síntomas suelen aparecer a los pocos minutos y los más relevantes duran entre 4 y 6 horas, completándose el proceso de desintoxicación en unas 12 horas.
3. La severidad de estos síntomas varía dependiendo del opiáceo utilizado, la dosis habitual, la duración del hábito tóxico, el tiempo de abstinencia previo a la inducción y las características psicológicas del sujeto.
4. Este cuadro se atenúa con agonistas alfa-2 adrenérgicos como la clonidina y la guanfacina o con medidas sintomáticas, como puede ser la atropina o el octeotrido para los trastornos gastrointestinales, o la metoclopramida o el ondansetrón para los vómitos, o las benzodiacepinas y neurolépticos para los cuadros de ansiedad y/o agitación.
En nuestro país diversos grupos han desarrollado protocolos y técnicas tanto en régimen hospitalario como en el ambulatorio, sin embargo su difusión ha sido un tanto controvertida porque:
* Se ha «promocionado» como una técnica curativa, incluso patentada, cuando lo que consigue es lo evidente: se trata de un proceso neurofarmacológico independiente de la voluntad del paciente, que se desencadena tras la toma de un antagonista de opiáceos.
* Los riesgos y costes de la anestesia frente a los riesgos de la realización fuera del entorno hospitalario y/o UCI han suscitado un debate no resuelto.
* La mayor parte de los estudios son observacionales, con importantes limitaciones metodológicas, por lo que es necesario realizar estudios más rigurosos que permitan hacer de estos tratamientos una práctica clínica generalizada.
* No hay consenso en la forma de denominar dicha técnica: desintoxicaciones ultracortas, o ultrarrápidas, pautas de antagonización rápida ambulatorias, desintoxicaciones activas... por lo que a lo largo de este capítulo se denominarán de manera general «inducción ultrarrápida» (IUR), y ambulatorias u hospitalarias según el ámbito en el que se realicen.
El contexto de las IUR
Las referencias científicas
El primero en observar que la inyección e.v. de naloxona precipitaba un SAO de mayor intensidad, pero más corto, fue Blachly en 19732.
En 1978, Gold3 describe la utilidad de la clonidina para suprimir los síntomas vegetativos del SAO.
Riordan y Kleber4, en 1980, fueron los primeros en utilizar clonidina y naloxona, y Charney5, en 1982, quien propone una asociación de clonidina y naltrexona, como un método seguro, eficaz y rápido, de uso hospitalario, para la desintoxicación de pacientes incluidos en PMM (tabla I). Estos trabajos sugieren que el tratamiento de la dependencia física de los opiáceos podría acelerarse con la administración precoz de un antagonista de opiáceos.
A partir de 1987 se comunican los primeros tratamientos ambulatorios en los que se combinan agonistas alfa-2 y antagonistas6-8. En estos trabajos el tiempo necesario se acorta a 3-5 días, y el porcentaje de éxitos es del 80-100%.
Una década después de que Gold publicara su experiencia con la clonidina, los trabajos de Loimer9 comunican un procedimiento para conseguir la desintoxicación de adictos a opiáceos de una forma rápida (tabla II).
Los primeros estudios sobre las IUR publicados en nuestro país son de 199410, con pautas en régimen hospitalario, en hospital de día11. Posteriormente aparecen otras publicaciones que describen protocolos en el ámbito ambulatorio12-14.
Las referencias de las IUR ambulatorias desde la clínica
Es sabido que no todos los tratamientos paliativos del SAO, tanto ambulatorios como hospitalarios, llegan a buen término.
También que durante el tratamiento con naltrexona hay recaídas precoces o de corta evolución que, debido a la pronta neuroadaptación15, requieren de unos días de abstinencia para la continuación del tratamiento y que, a veces, son difíciles de conseguir.
Por otro lado las Unidades de Hospitalización presentan dificultades para el acceso, suelen tener largas listas de espera, tienen criterios y normativas restrictivas para el ingreso inmediato o el reingreso, etc.
Por tanto, desarrollar métodos de tratamiento farmacológico que acorten y faciliten esta transición, de manera cómoda y confortable para el paciente (y para su familia), y que contribuya a un mejor manejo social y global del sujeto dependiente de opiáceos, son algunos de los motivos de desarrollo de estas técnicas.
Un contexto clínico, a modo de ejemplo, puede ser el que se describe a continuación. Situado en el marco de los programas de tratamiento con naltrexona no era difícil encontrarse con «accidentes o transgresiones» del tratamiento (tabla III).
El primero hace referencia a aquel paciente que por accidente hacía una transición brusca del consumo de heroína a la toma de naltrexona y que permitió observar el fenómeno en toda su magnitud16.
El segundo alude al paciente que se saltaba la toma de naltrexona del viernes para consumir el fin de semana y que, de una forma mágica, pretendía volver a la normalidad los lunes pidiendo ayuda farmacológica para aliviar el malestar. Esto permite hacer las primeras asociaciones farmacológicas o «cockteles», que concluyeron en que si se administraba entre 30 y 60 minutos antes de la toma de naltrexona la vivencia del paciente era mucho más confortable.
El tercero se refiere a aquel paciente que, alcanzando importantes períodos de estabilización, hacía recaídas breves, pero su situación laboral le limitaba a la hora de solicitar una ILT, por lo que su utilización de los fines de semana era, al contrario que el paciente anterior, para conseguir la «desintoxicación». Fue el inicio de las estabilizaciones previas de 24 o 48 horas que, por la repetición del proceso, parecía informar de una mayor confortabilidad.
Parecía como si de esta manera, eliminando precozmente el agonista opiáceo de los receptores opiáceos, se restableciera rápidamente la normofuncionalidad en la fisiología neuronal puesto que los síntomas, que aparecían súbitamente, no se prolongaban más allá de unas cuantas horas.
Sin embargo se podía observar que había una gran variabilidad en la expresión y vivencia del cuadro. Aunque las circunstancias en cuanto a dosis, vía, fármacos utilizados, etc., fuesen muy similares, la intensidad de los síntomas y el que el paciente tuviera o no conciencia del proceso, no eran previsibles. En este sentido diversos autores han publicado que la sintomatología de abstinencia a opiáceos pueda estar influenciada por factores psicosociales e individuales con base genética17-19.
Con todo esto, algunos grupos decidieron intentar observar e investigar el proceso en un ambiente hospitalario, mientras otros hacían de ello una técnica de desintoxicación que era practicada a demanda, con consentimiento del paciente, y que se desarrollaba en el domicilio del mismo bajo la supervisión de un familiar.
Las IUR ambulatorias en España
Protocolos farmacológicos
Son aquellos protocolos destinados a atenuar o minimizar los síntomas ocasionados por la precipitación de un síndrome de abstinencia mediante la administración de antagonistas opiáceos, realizados en régimen ambulatorio, bien sea en un dispositivo sanitario o en el domicilio del paciente, y que consiguen la «desintoxicación» del adicto en un plazo inferior a las 24 horas.
Los fármacos utilizados, de manera genérica, para el control de los síntomas se resumen en la tabla IV, aunque las preferencias varían según uno u otro protocolo.
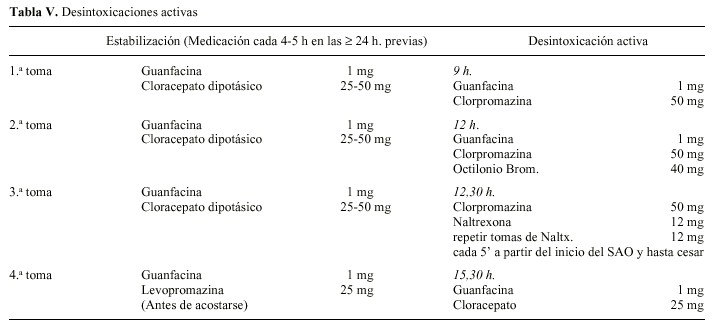
En 1995 Dorta, et al12 presentan un trabajo de 69 IUR ambulatorias con un 97% de éxitos. Describen como principales complicaciones la inquietud (75%), en algunos casos extrema, náuseas y vómitos (20-30%), epigastralgias (6%) y cuadro delirante agudo (5%). Posteriormente, basándose en algunas observaciones, suponen que la intensidad de los síntomas en las IUR es inversamente proporcional al tiempo transcurrido desde el último consumo y realizan un nuevo trabajo20 con 40 adictos a opiáceos a los que estabilizan 24 horas previas a la inducción. Las denominan «desintoxicaciones activas» porque el desplazamiento de los opiáceos de sus receptores no se hace de manera espontánea, y el protocolo que utilizan es el de la tabla V.
Todos los pacientes finalizaron la desintoxicación. Los efectos adversos aparecieron con la primera toma de naltrexona y remitieron con sucesivas tomas de 12 mg de naltrexona. Las complicaciones más relevantes que describen, con este protocolo, son: inquietud (47,5%), náuseas (12,5%), vómitos (5%), diarreas (22,5%). Consideran insignificantes los síntomas que permanecen más allá de las 24 horas. Recomiendan ampliar la abstinencia y/o estabilización previa en caso de opiáceos de vida media larga (metadona)
Carreño, et al describen la desintoxicación realizada, por un grupo de clínicos en Asturias, en dos muestras de 171 y 208 pacientes. En el primer trabajo13 se presentan 3 protocolos bastante similares, que consensuan en uno solo (tabla VI) para la realización del segundo trabajo21.
Todos los pacientes finalizaron la desintoxicación y las complicaciones observadas fueron: hipotensión (5,26%), bradicardia (0,58%), deshidratación (9,35%), epigastralgias (14,03%), alucinaciones (0,58%).
Los dos protocolos descritos anteriormente se desarrollan en el domicilio del paciente, bajo la supervisión de un familiar que, previamente instruido, se encarga de supervisar y manejar el proceso, y únicamente utilizan la vía oral.
Vázquez y Fos14, en 1996, realizan un estudio con 51 pacientes adictos a opiáceos a los que practican una IUR ambulatoria, pero la realizan en el dispositivo sanitario. Estabilizan al paciente 48 horas antes con guanfacina o dextropropoxifeno y se pide la presencia de un familiar el día en que se realiza la IUR. A diferencia de los anteriores se utiliza la vía parenteral además de la vía oral . El procedimiento seguido es el que se describe en la tabla VII.
A las 6 horas del inicio se administran 0,5 mg de guanfacina, y se realiza una toma de constantes y una valoración médica. Los 6 días siguientes se pauta tratamiento, en dosis decrecientes, de guanfacina.
De los 51 pacientes, el 92,15% finalizaron el proceso, el 23,52% no presentó SAO y en el 76,48% se presentaron síntomas con posibilidades de control ambulatorio. El SAO era más discreto para los que consumían menos de 250 mg/día y para los que habían realizado la estabilización previa.
Los efectos adversos más frecuentes fueron: frío (76,92%), inquietud (35,89%), vómito (30,77%), confusión (23,07%), epigastralgia (23,07%), somnolencia (20,51%) y diarrea (17,95%).
Indicaciones, contraindicaciones y ventajas de las IUR ambulatorias
Parece existir consenso entre los autores de los estudios reseñados acerca de las ventajas de este tipo de procedimientos. La mayor parte de ellas se detallan en la tabla VIII.
Sin embargo para poder obtener estas ventajas es necesario evitar en lo posible las graves complicaciones que podrían derivarse de estos procedimientos, como la depresión respiratoria, la broncoaspiración, los episodios confusionales, incluso se ha descrito un caso de muerte22,23, y que han llevado a otros clínicos a no realizarlas nada más que en un entorno hospitalario aunque para ello tengan que utilizar anestesia e intubar.
Quizás una adecuada selección de los pacientes, teniendo muy presentes las indicaciones (tabla IX), las contraindicaciones (tabla X), y un buen conocimiento de la técnica elegida, unido al que la supervisión del proceso sea realizada por un profesional sanitario, a ser posible un clínico, permita minimizar los riesgos y atajar las complicaciones (tabla XI) que pudieran surgir.
Algunos comentarios a modo de conclusiones
* El hecho de que los protocolos presentados tengan como objetivo atenuar el SAO precipitado por la administración precoz de antagonistas de opiáceos, no hace que sean homogéneos. Así nos encontramos:
-- El antagonista utilizado puede ser naloxona14 o naltrexona12,13,21.
-- La administración puede ser secuencial12,14 o mediante una dosis única de bloqueo (50 mg de naltrexona).
-- El intervalo de tiempo que transcurre desde la toma de fármacos «paliativos» a la administración del antagonista es variable, siendo el mínimo de 30 minutos.
-- La abstinencia previa recomendada varía de 12 a 48 h o más (según la vida media del agonista opiáceo).
-- La estabilización del paciente, en el caso de que se considere necesario la abstinencia previa más de 12 horas, puede hacerse con agonistas alfa-2 o con agonistas opiáceos.
-- La supervisión del proceso se lleva a cabo en unos casos por familiares12,13 y en otros por ambos14. De ello se deduce que la recogida de datos y la monitorización del proceso nos puede dar una información poco homogénea.
-- Los criterios sobre si se debe o no administrar tratamiento a las 12 horas de la antagonización, para control de síntomas residuales, así como el tipo de fármacos y la duración, también son variables.
* Sin entrar a valorar si este tipo de procedimientos se debe realizar en un ambiente u otro, lo cierto es que se trata de una técnica que algunos grupos practican de una forma habitual y que otros han pasado a realizarla en un entorno hospitalario24.
* El que se realicen en el ámbito ambulatorio y que tengamos fármacos eficaces para el control de los síntomas no significa que sean seguras. No se debe olvidar que se han descrito complicaciones muy graves, que la sedación no es profunda y uno de los síntomas más frecuentes es la inquietud y/o heteroagresividad verbal, lo que puede suponer un difícil control del paciente en el caso de que quiera irse.
* Existe una disparidad en la presentación de las complicaciones.
* Si bien la presentación de los síntomas, así como su intensidad se ha relacionado con el intervalo transcurrido entre el último consumo de heroína y la inducción con el antagonista, con la dosis, con la vida media de los opiáceos y con la velocidad a la que son desplazados de los receptores, no se debe olvidar que diversos autores han señalado que la sintomatología de abstinencia a opiáceos pueda estar influenciada por factores psicosociales e individuales con base genética16,18,19, y que además esto se comprueba en la práctica con la imposibilidad de prever la intensidad de las complicaciones, lo que exige precaución a la hora de elegir este tipo de procedimientos.
* La elección entre guanfacina o clonidina hoy no es posible al haberse retirado del mercado la primera, sin embargo, y dada la gran utilidad de los agonistas alfa-2 en el control de la sintomatología, hay otras sustancias como la lofexidina, o los antagonistas de los receptores imidazolínicos de tipo I, como la rilmenidina, que parecen haber demostrado la misma eficacia que la clonidina, pero con un perfil cardiovascular más favorable.
* La capacidad que tiene la naltrexona como otros antagonistas para desensibilizar los receptores opioides y normalizar sus poblaciones, nos debe hacer pensar en la utilidad de sustancias como la buprenorfina que, por sus características de agonista/antagonista y su comportamiento frente a la heroína y a la naltrexona25-28, atenuarían la sintomatología en las IUR.
* Con todos los procedimientos se consigue el 100% de las desintoxicaciones a heroína (no se encuentran datos sobre otros opiáceos), si consideramos que la toma de naltrexona es el criterio a utilizar, no obstante hay un porcentaje de pacientes que no toleran bien la sintomatología residual, lo que supone riesgo de recaídas.
* La retención en los tratamientos no guarda relación con la realización de este procedimiento.
* Habría que diseñar estudios metodológicamente correctos en relación con el perfil de pacientes, con la recogida de datos, con las dosis, con nuevos fármacos y en un medio que permita abordar las complicaciones.