Evaluar el estado del arte del manejo, curso y diagnóstico del carcinoma de células renales.
Materiales y métodosSe realizó una búsqueda sistemática de la literatura de artículos originales y de revisión a través de PubMed y, se incluyeron guías internacionales con el fin de determinar los aspectos más importantes referentes a la epidemiología, diagnóstico, manejo y seguimiento del carcinoma de células renales.
ResultadosSe incluyeron 45 artículos originales, todos relacionados con el carcinoma de células renales.
ConclusiónLos diferentes avances imagenelógicos han permitido una mayor resolución espacial permitiendo mejor caracterización de las lesiones renales para un mejor abordaje y planeamiento quirúrgico. Además existen nuevas terapias para el tratamiento de pacientes con carcinoma de células renales que obligan a desarrollar nuevas estrategias de seguimiento y evaluación de respuesta a la terapia.
© 2014 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
To evaluate the state of the art in the management, follow-up, and diagnosis of renal cell carcinoma.
Materials and methodsA systematic search of the literature was performed looking for original and review articles in PubMed. International guidelines were included with the aim of determining the most important references as regards the epidemiology, diagnosis, management, and follow-up of renal cell carcinoma.
ResultsA total of 45 original articles, all of them related to renal cell carcinoma, were included.
ConclusionThe different advances in imaging have helped to provide better spatial resolution, enabling the renal lesions to be better characterised for an improved surgical approach and planning. There are also new treatments for patients with renal cell carcinoma that have led to the development of new strategies for the follow-up and evaluation of the response to treatment.
© 2014 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
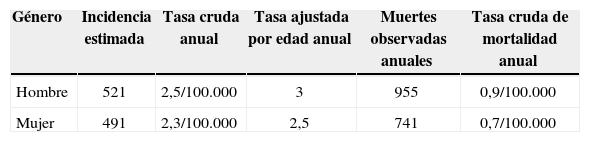
El carcinoma de células renales, el cáncer urológico más letal, es el cáncer epitelial renal más común en los adultos, representando más del 90% de todas las neoplasias malignas renales1. Según el Instituto Nacional de Cancerología en Colombia (INS), en el periodo de 2002–2005 se presentaron 521 casos en hombres y 491 en mujeres de cáncer renal con una tasa anual cruda de 2,5/100.000 habitantes en hombres y 2,3/100.000 habitantes en mujeres2 (tabla 1). En los Estados Unidos ha existido un aumento en la incidencia de cáncer renal, especialmente en la población afroamericana comparando 51.190 nuevos casos y 12.890 muertes en 2007 3 con un estimado de 63.920 casos nuevos y 13.860 muertes por cáncer de riñón en el año 2014 4. Debido a la creciente incidencia del cáncer renal se han desarrollado avances en el manejo del mismo, con mejoras en la técnica quirúrgica, el uso de técnicas de ablación, el mayor uso de la cirugía conservadora y nuevas terapias sistémicas; estos cambios en la diferentes formas de tratamiento nos obligan a mantenernos a la vanguardia en cuanto a la diferenciación de los subtipos tumorales, la estadificación, detección de enfermedad metastásica, detección de recurrencia local, la evaluación de la respuesta al tratamiento y la detección de recaídas tempranas.
Cáncer de riñón, Colombia 2002–2005 según grupo de vigilancia epidemiológica del INC
| Género | Incidencia estimada | Tasa cruda anual | Tasa ajustada por edad anual | Muertes observadas anuales | Tasa cruda de mortalidad anual |
|---|---|---|---|---|---|
| Hombre | 521 | 2,5/100.000 | 3 | 955 | 0,9/100.000 |
| Mujer | 491 | 2,3/100.000 | 2,5 | 741 | 0,7/100.000 |
Los avances en los medicamentos utilizados para el tratamiento de esta patología como por ejemplo los inhibidores de tirosin quinasa han obligado a desarrollar otras escalas aplicadas a las imágenes para el seguimiento de estos pacientes5.
En este artículo revisaremos escalas de evaluación pre-quirúrgica que permite un mejor abordaje pre quirúrgico, estrategia para adecuada estadificación y seguimiento luego de terapia que permita la detección temprana de las recaídas y de enfermedad metastásica
Enfoque pre-quirúrgico del cáncer renalAbordaje imagenológicoActualmente se utilizan tres sistemas de clasificación anatómica y puntuación en la evaluación del cáncer renal, la nefrometría renal, puntuación de Padua y el índice C, los cuales permiten la correcta planeación del abordaje quirúrgico y la predicción de las potenciales complicaciones. Estos sistemas constituyen en la actualidad la mejor herramienta para la categorización de los pacientes6.
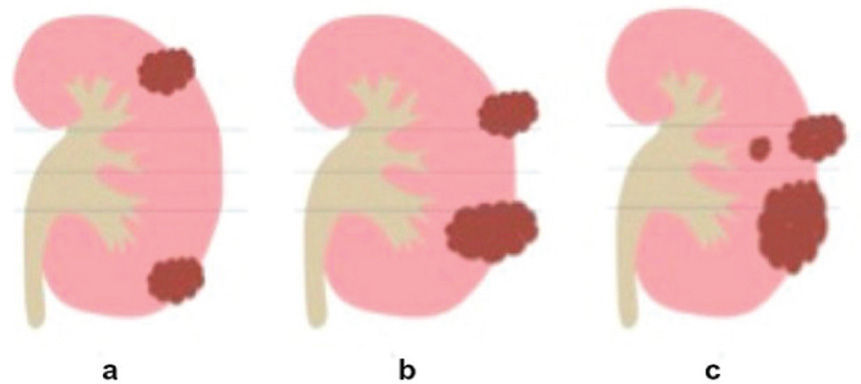
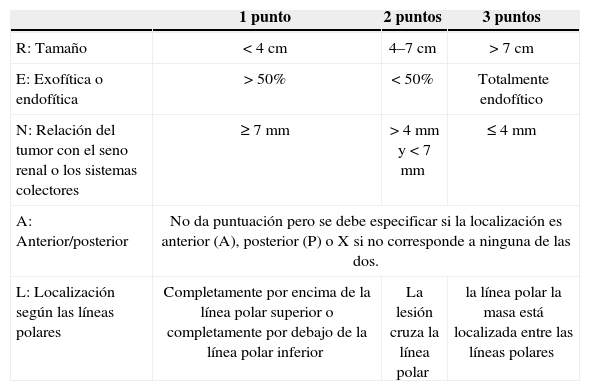
La nefrometría es un novedoso sistema de puntuación por imágenes que da una puntuación de acuerdo a la anatomía de las masas renales7, permitiendo al clínico hacer una aproximación bastante acertada de la complejidad de la lesión tumoral a la cual se enfrenta. Este sistema pretende ayudar a tomar decisiones de manejo conservador o radical, intentando usar un lenguaje común entre radiólogos y clínicos teniendo en cuenta 4 variables diferentes, para asignar una puntación final; La evaluación se hace basado en el tamaño de la lesión, si esta es exofítica o endofítica, la cercanía al seno renal, la localización de la lesión según las líneas polares y la localización de las mismas dependiendo si es anterior o posterior (las diferentes variables se resumen en la tabla 2). Una de las variables evaluadas son las líneas polares, las cuales pueden ser evaluadas en imágenes axiales o coronales y son trazadas de acuerdo al seno renal (fig. 1).
Nefrometría
| 1 punto | 2 puntos | 3 puntos | |
|---|---|---|---|
| R: Tamaño | <4 cm | 4–7 cm | > 7 cm |
| E: Exofítica o endofítica | >50% | < 50% | Totalmente endofítico |
| N: Relación del tumor con el seno renal o los sistemas colectores | ≥7 mm | > 4 mm y < 7 mm | ≤ 4 mm |
| A: Anterior/posterior | No da puntuación pero se debe especificar si la localización es anterior (A), posterior (P) o X si no corresponde a ninguna de las dos. | ||
| L: Localización según las líneas polares | Completamente por encima de la línea polar superior o completamente por debajo de la línea polar inferior | La lesión cruza la línea polar | la línea polar la masa está localizada entre las líneas polares |
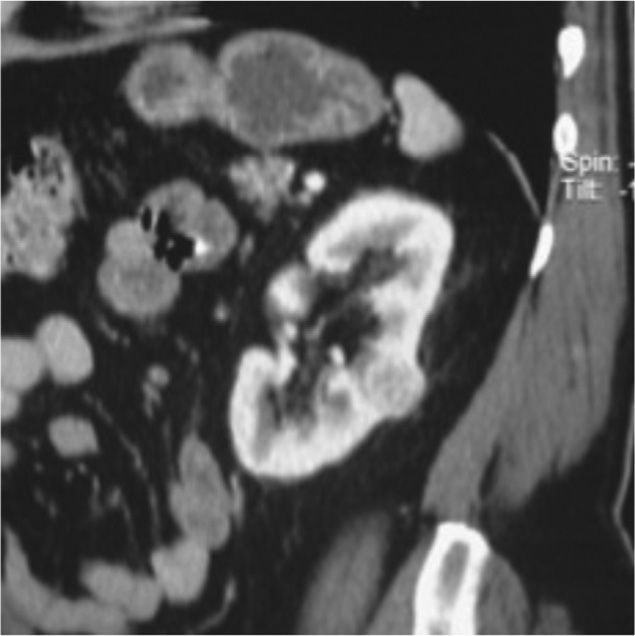
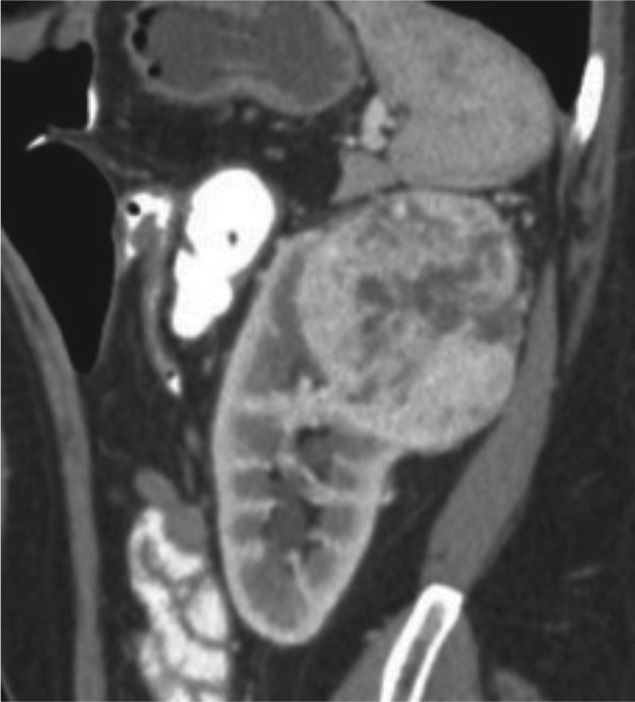
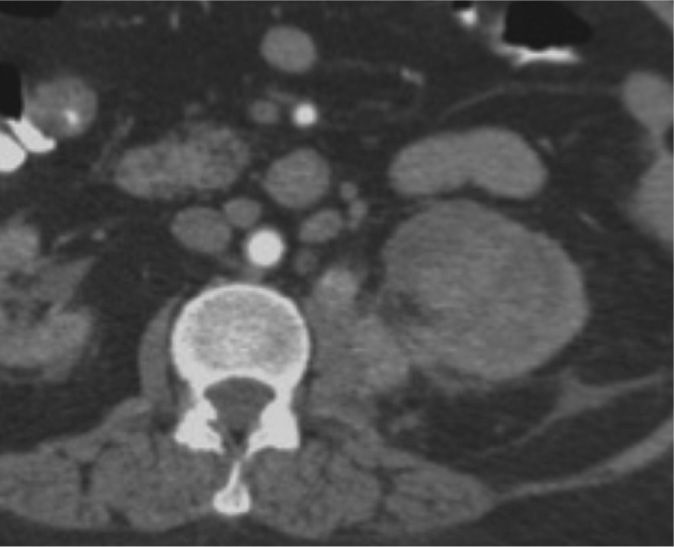
Teniendo en cuenta la puntuación se clasifica en tres categorías: De 4 a 6 = Baja complejidad, de 7 a 9 = Complejidad moderada (fig. 2, tomografía de abdomen y pelvis contrastada donde se evidencia carcinoma de células renales con una puntuación de aproximadamente 7 por nefrometría), y de 10 a 12 = Alta complejidad (fig. 3, tomografía donde se observa carcinoma de células renales con una puntuación de 10 por nefrometría).
Tomografía de abdomen y pelvis contrastada, corte coronal. Masa hipervascular en el tercio medio del riñón izquierdo de 3,2 cm con < 50% de componente exofítico. Esta lesión se localiza a aproximadamente 8 mm del seno renal y en la mitad de las líneas polares. Puntuación aproximada de 7, clasificándola como lesión de complejidad moderada.
Tomografía de abdomen y pelvis contrastada, corte coronal. Masa hipervascular en el polo superior del riñón izquierdo de aproximadamente 5,8 cm, con un componente < 50% de componente exofítico, localizada a 3 mm del seno renal, esta lesión cruza la línea polar superior. Sus características le otorgan un puntaje en nefrometría de 10 puntos, clasificándola como una lesión de alta complejidad.
Se ha encontrado que las tasas de complicaciones posteriores a nefrectomía parcial varían de acuerdo al grado de complejidad de la nefrometría; por ejemplo, pacientes de baja complejidad tienen menor tendencia a desarrollar hemorragia postoperatoria y fístulas urinarias en comparación con pacientes de moderada complejidad. Así mismo pacientes con lesiones clasificadas como alta complejidad son cinco veces más propensos a tener una complicación urológica postoperatoria y mayor tiempo de isquemia intraquirúrgica8.
Los otros métodos como el puntaje PADUA y el Índice C que intentan evaluar la viabilidad, seguridad y el riesgo postoperatorio de la nefrectomía parcial. Estos métodos tienen variables similares a las de la nefrometría. Las variables evaluadas en estas escalas no son los únicos aspectos que debemos nombrar en nuestros reportes radiológicos, ya existen consideraciones anatómicas adicionales en la planificación de la nefrectomía parcial como la proximidad con el uréter o los uréteres, número de arterias y venas renales presente y la existencia de circulación colateral que son determinantes a la hora de tomar una decisión quirúrgica.
EstadificaciónEs fundamental definir qué tipo de estudios se deben solicitar en un paciente con cáncer renal durante su evaluación inicial, es así como se recomienda la realización de una Tomografía o Resonancia Magnética (RM) de abdomen con medio de contraste, en todo paciente con cáncer renal para lograr una adecuada caracterización de la lesión primaria. Por otro lado, las imágenes cerebrales y la gammagrafía ósea solo deben solicitarse en caso de que la historia clínica o el examen físico sugieran compromiso.
En cuanto a la evaluación del tórax existe controversia, sin embargo hoy en día se acepta la toma de una radiografía convencional en la evaluación inicial de pacientes con bajo riesgo y la tomografía de tórax contrastada en pacientes con mayor riesgo, basados en el tamaño de la lesión primaria, tipo histológico entre otras consideraciones clínicas9–11. Es importante recordar la baja sensibilidad de la radiografía simple para detección de nódulos menores a 2 cm.
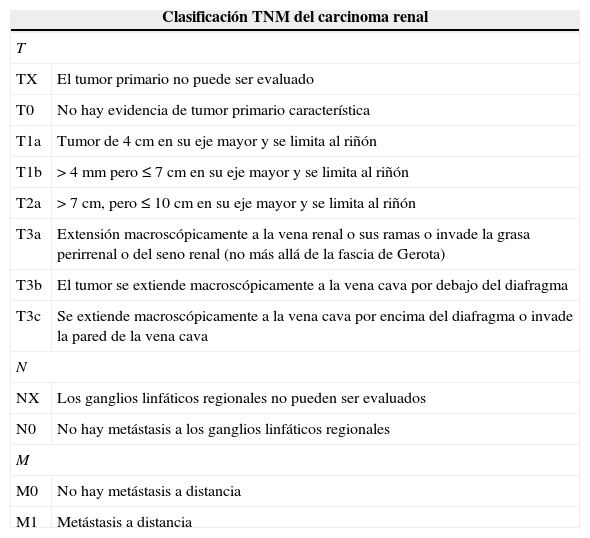
Estadificación clínicaEn el año 2010 el American Joint Committee on Cancer presentó variaciones en el sistema de estadificación para el cáncer renal dando especial valor al tamaño del tumor primario, el compromiso venoso (T3b o T3c), la invasión de órganos adyacentes (T4), las metástasis ganglionares (N1), y la enfermedad metastásica a distancia (tabla 3).
Clasificación TNM
| Clasificación TNM del carcinoma renal | |
|---|---|
| T | |
| TX | El tumor primario no puede ser evaluado |
| T0 | No hay evidencia de tumor primario característica |
| T1a | Tumor de 4 cm en su eje mayor y se limita al riñón |
| T1b | > 4 mm pero ≤ 7 cm en su eje mayor y se limita al riñón |
| T2a | > 7 cm, pero ≤ 10 cm en su eje mayor y se limita al riñón |
| T3a | Extensión macroscópicamente a la vena renal o sus ramas o invade la grasa perirrenal o del seno renal (no más allá de la fascia de Gerota) |
| T3b | El tumor se extiende macroscópicamente a la vena cava por debajo del diafragma |
| T3c | Se extiende macroscópicamente a la vena cava por encima del diafragma o invade la pared de la vena cava |
| N | |
| NX | Los ganglios linfáticos regionales no pueden ser evaluados |
| N0 | No hay metástasis a los ganglios linfáticos regionales |
| M | |
| M0 | No hay metástasis a distancia |
| M1 | Metástasis a distancia |
El papel que juegan las imágenes diagnósticas en las decisiones terapéuticas es cada vez más importante, la razón para esto es el detalle anatómico que la tecnología nos permite dar información útil pre quirúrgica. A continuación revisaremos la aproximación recomendada según la estadificación clínica inicial que depende, de los hallazgos encontrados en las imágenes diagnósticas.
Se han creado 3 grupos de pacientes según la estadificación inicial con 3 estrategias de estudio diferentes, consideraremos entonces aquellos pacientes con enfermedad localizada (T1-2), enfermedad localmente avanzada (T3-4N1) y enfermedad metastásica (TX-3aNX-1M1):
Enfermedad localizada (T1-2)Hace algunos años la nefrectomía parcial se utilizaba exclusivamente en pacientes con tumores menores de 4 cm, sin embargo en la actualidad esta técnica se ha utilizado ampliamente, en comparación con la nefrectomía total, ampliando su rango de tratamiento a tumores de hasta 7 cm12,13. Este cambio en el paradigma se ha basado en la evidencia del aumento de la mortalidad y comorbilidades como por ejemplo aumento en el número de hospitalizaciones, eventos cardiovasculares y disminución de la tasa de filtración glomerular en pacientes con nefrectomía total al compararlos con pacientes en quienes se realizó nefrectomía parcial14.
Las recomendaciones actuales de la Asociación Americana de Urología consideran realizar nefrectomía parcial en todas aquellos pacientes con masas renales estadificadas como T1 (>4 mm pero ≤ 7) siempre que sea técnicamente posible15. Por su parte la nefrectomía parcial para tumores mayores de 7 cm (T2) se reserva solamente para pacientes monorrenos, con insuficiencia renal pre-existente u ocasionalmente cuando la localización del tumor lo permite16.
Es importante anotar que algunos grupos de trabajo han identificado más complicaciones posquirúrgicas tras la nefrectomía parcial que tras la nefrectomía radical encontrando un mayor riesgo de hemorragia severa, fístula urinaria y re intervención por complicaciones17. Estos hallazgos hacen aún más relevante la adecuada estadificación inicial con una evaluación lo más valida posible de la lesión primaria. En estos casos utilizar escalas como la nefrometría es de particular utilidad, ya que esta permite clasificar al paciente de acuerdo a su complejidad quirúrgica y su potencial morbilidad.
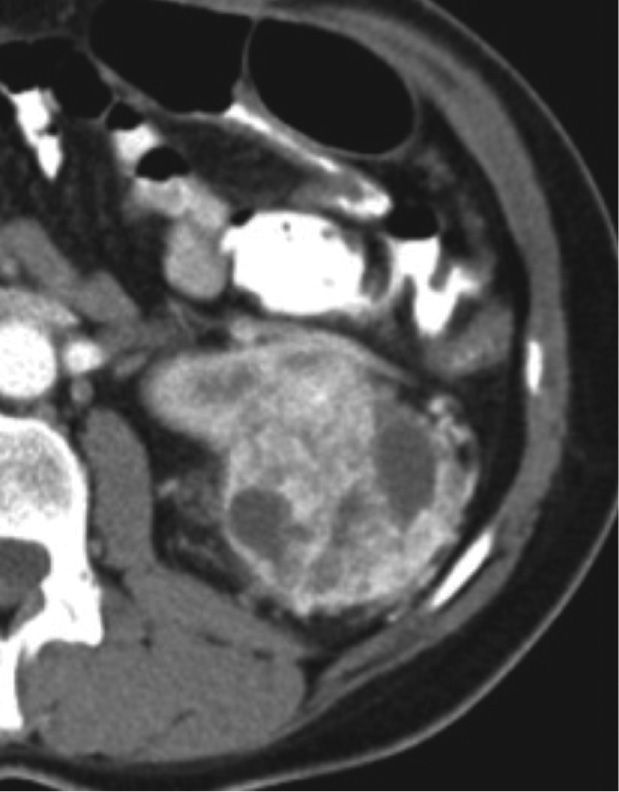
La enfermedad localmente avanzada (T3-4N1)Invasión de grasa (T3a)La evaluación de la invasión de la grasa renal es un aspecto fundamental, que cambia la estadificación del cáncer renal y es un importante predictor de recurrencia y supervivencia en tumores mayores de 7 cm 18, sin embargo esta evaluación no es siempre fácil y ocasionalmente existe una incapacidad de identificar correctamente la enfermedad T3a 19,20. Las imágenes juegan un papel importante para establecer este tipo de compromiso (fig. 4, tomografía de abdomen contrastada que muestra el compromiso de la grasa perirrenal por infiltración neoplásica). La RM tiene mayor sensibilidad en comparación con otras modalidades de imagen.
Tomografía de abdomen y pelvis contrastada, corte axial. Masa de densidad heterogénea, hipervascular con áreas centrales hipodensas, de aproximadamente 5,2 cm localizada en el polo superior del riñón derecho, de aspecto neoplásico, asociado a alteración en la densidad de la grasa perirrenal por infiltración neoplásica.
El carcinoma de células renales en si tiene una tendencia importante a la invasión vascular, especialmente en el lumen de la vena renal y la vena cava inferior (VCI) en 4 al 23% de los casos21,22.
Actualmente, se acepta que la resonancia magnética es el estudio de elección para determinar la presencia y extensión de un trombo venoso tumoral23. Sin embargo, Hall-scheidt et al.24 compararon la tomografía contrastada y la RM para estimar la extensión del trombo, encontrando una tasa de diagnóstico sin diferencias estadísticamente significativas, logrando una precisión diagnostica del 96% para la evaluación del nivel del trombo tumoral25.
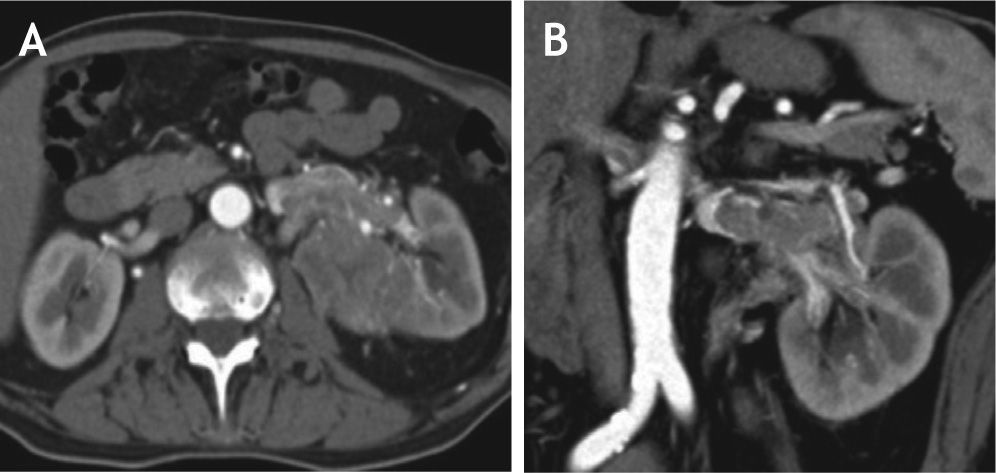
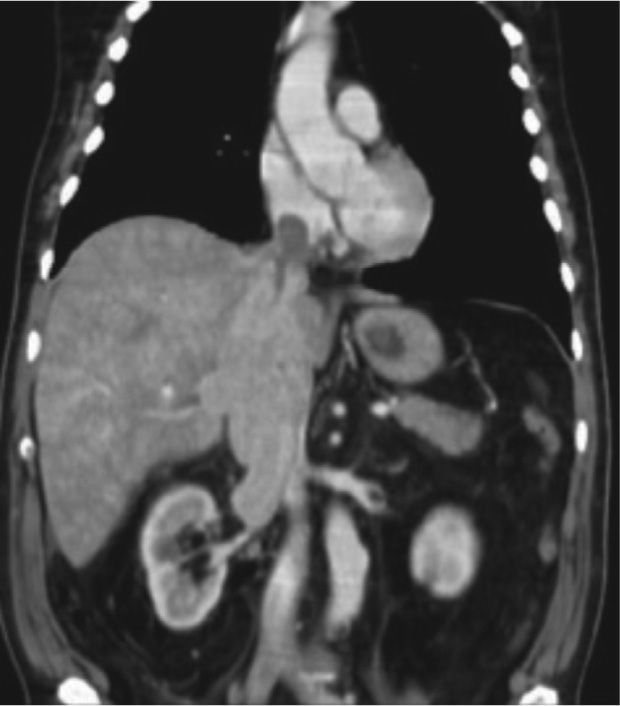
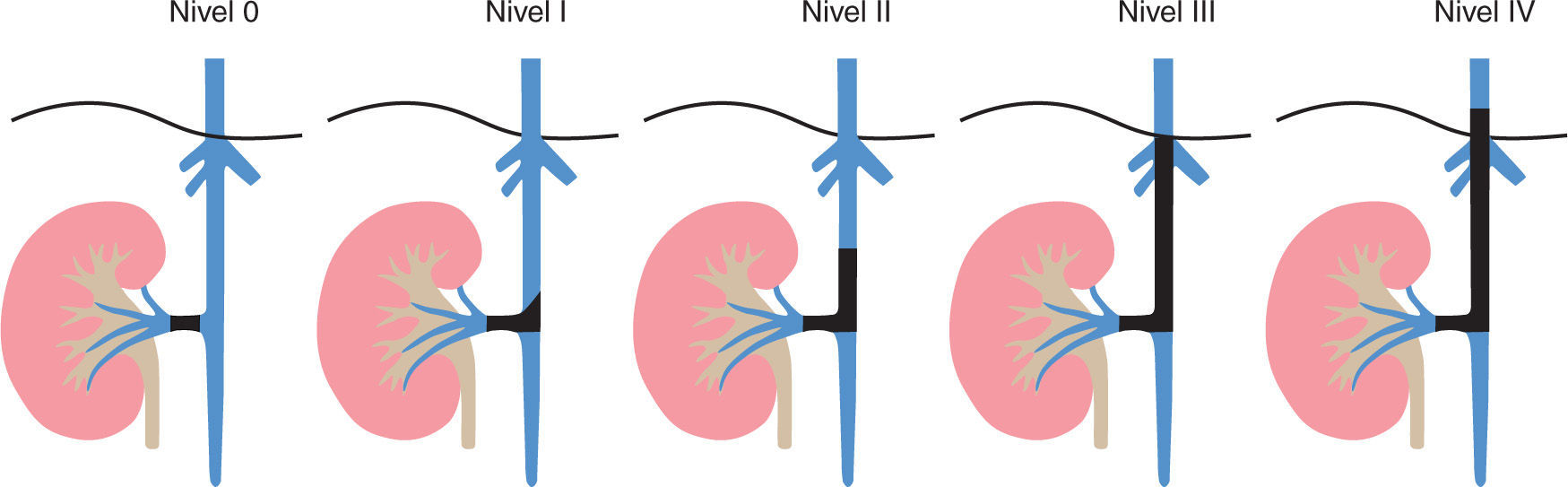
En la evaluación del nivel del trombo tumoral se considera nivel 0 cuando existe compromiso de la vena renal; nivel I, afectación < 2 cm por encima de la vena renal (figs. 5A y B, donde se evidencia compromiso trombótico tumoral de la vena renal izquierda); nivel II, compromiso > 2 cm por encima de la vena renal, pero por debajo de las venas hepáticas nivel III, en la vena cava inferior pero por debajo del diafragma; nivel IV, compromiso de la vena cava inferior por encima del diafragma (fig. 6, tomografía de abdomen donde se reconoce extensa trombosis de la vena renal y cava inferior) (fig. 7, tabla 4).
Evaluación del trombo tumoral. Referencia
| Nivel del trombo | Tasas de complicaciones perioperatorias | |
|---|---|---|
| Nivel 0 | Vena renal | 12% |
| Nivel I | < 2 cm por encima de la vena renal, | 18% |
| Nivel II | > 2 cm por encima de la vena renal, pero por debajo de las venas hepáticas | 20% |
| Nivel III | En las venas hepáticas, pero por debajo del diafragma | 26% |
| Nivel IV | Por encima del diafragma | 47% |
La importancia de la adecuada estadificación y valoración del nivel del trombo tumoral radica en el pronóstico del paciente, las opciones de tratamiento quirúrgico y el riesgo de complicaciones. Es así como existe una relación directa entre la tasa de complicaciones operatorias y el nivel del trombo tumoral que varía de 12% cuando el trombo tumoral se encuentra en nivel 0 a 47% con trombos en el nivel IV26.
Otro hallazgo relevante que ha demostrado ser un factor pronóstico importante es la invasión de la pared de la vena cava inferior, encontrando un riesgo de muerte seis veces mayor en los pacientes con invasión del ostium de salida de la vena renal en comparación con pacientes sin invasión. La resonancia magnética preoperatoria tiene una sensibilidad del 100%, especificidad del 95% y precisión del 92% para estimar la invasión de la pared vascular27.
Compromiso ganglionar (TX-3aN1)El papel de la linfadenectomía en el tratamiento quirúrgico del carcinoma de células renales ha sido muy controvertido, sin embargo se acepta que para pacientes en estadio N0M0 con tumores primarios de bajo riesgo, la linfadenectomía no es necesaria28. Adicionalmente existen otras corrientes que consideran que la realización de linfadenectomía en pacientes con mayor riesgo sin evidencia de enfermedad metastásica podría mejorar el pronóstico y representa un beneficio terapéutico29.
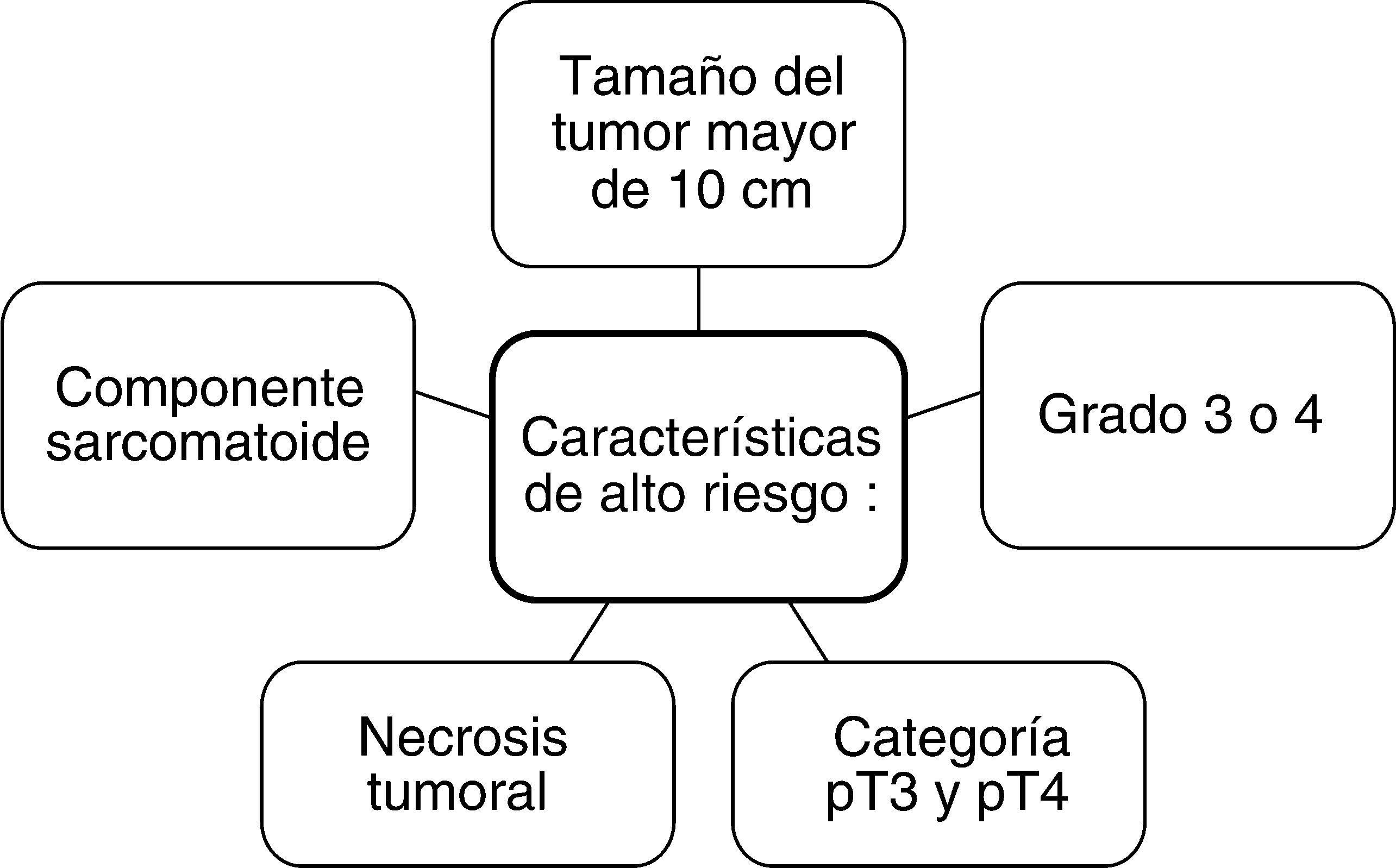
En la Clínica Mayo se determinaron 5 características que confieren alto riesgo a los pacientes con cáncer renal que son: el tamaño del tumor mayor de 10 cm, grados 3 o 4, categoría pT3 o pT4, necrosis tumoral y la presencia de un componente sarcomatoide (fig. 8). Los pacientes con dos o más de estas características tienen un riesgo aumentado de tener ganglios linfáticos positivos29. Los ganglios son positivos cuando tienen > 1 cm en su eje corto (fig. 9, donde se observa compromiso neoplásico ganglionar en un paciente con carcinoma de células renales) con un VPP en las imágenes preoperatorias del 42%30.
Las glándulas suprarrenales y las estructuras vecinas (T4)La necesidad de adrenalectomía ha sido cuestionada debido a la baja incidencia de invasión suprarrenal, la cual se encuentra entre un 5,5 al 5,7%, de los casos31,32, además de la alta morbilidad causada por la insuficiencia suprarrenal secundaria a la adrenalectomía. En el 89% de los casos en los que se evidenció compromiso suprarrenal, se encontró que el tumor renal se hallaba en el polo superior o era multifocal y que la afección de la vena renal aumentaba fuertemente la probabilidad de propagación a la glándula adrenal ipsilateral33. O’Malley et al.34 propusieron realizar adrenalectomía ipsilateral en aquellos pacientes con hallazgos prequirúrgicos en tomografía o resonancia que indicaran extensión adrenal, trombosis venosa tumoral, tumor localizado en el polo superior del riñón o tumores mayores de 7 cm.
El compromiso de órganos vecinos por carcinoma de células renales es raro, representando entre el 1–1,5% de los casos, sin embargo su identificación es fundamental para la adecuada estadificación y confiere un mal pronóstico a los pacientes35,36 con sobrevidas tan bajas de hasta 2,3 meses19. Las estructuras vecinas más comúnmente implicadas son el colon, el páncreas, el diafragma, el hígado, el bazo y el mesenterio35.
El tratamiento de la enfermedad metastásica (TX-3aNX-1M1)La enfermedad metastásica es un punto crucial en el manejo del carcinoma de células renales. En este tema hay 2 aspectos que no podemos dejar de revisar; por un lado, está la adecuada identificación de la enfermedad metastásica para guiar el uso de la terapia sistémica, y por otro lado se encuentran las imágenes de seguimiento para cuantificar la respuesta al tratamiento.
La resección quirúrgica en el tratamiento de metástasis a distancia, denominada nefrectomía citorreductora, es el manejo habitual en aquellos pacientes candidatos para cirugía37,38, ya que este procedimiento mejora la supervivencia cuando los paciente se someten además a terapia con interferón α posquirúrgica.
Seguimiento en carcinoma de células renalesComo hemos visto anteriormente, en la actualidad existen numerosos tratamientos disponibles para los pacientes con carcinoma de células renales; sin embargo, estos tumores pueden presentar recurrencia local o a distancia posterior a estos tratamientos. Ya se conoce que por ejemplo la recurrencia local se asocia con márgenes quirúrgicos positivos, multifocalidad y mayor grado histológico, variables que deben ser correctamente identificadas en la valoración inicial39.
Por todo lo anterior es importante considerar un seguimiento estricto y estandarizado de los pacientes, para detectar en forma temprana los signos de recurrencia local o metástasis y de esta forma ofrecer nuevas alternativas terapéuticas. Este seguimiento debe ser más riguroso en los primeros 3 años postenfermedad, dado que la mayor parte de las recaídas se producen en este periodo de tiempo40.
Las imágenes diagnosticas son el principal método de seguimiento de estos pacientes, donde la tomografía contrastada de tórax y la resonancia magnética con medio de contraste pueden considerarse de elección. A pesar de que no existe un consenso sobre la forma de seguimiento de los pacientes con carcinoma de células renales, diversas entidades han desarrollado algunas recomendaciones a tener en cuenta dependiendo del grado de clasificación (específicamente el tamaño del tumor (T), tipo de tratamiento y factores de riesgo de cada paciente. Todas coincidiendo en que el énfasis en el seguimiento debe ser durante el primer 3-5 años después de la nefrectomía41. Entre ellas se encuentra el Colegio Americano de Radiología, El Colegio Real de Radiólogos y la Asociación Europea de Urología (las recomendaciones de seguimiento se resumen en la tabla 5).
Tabla modificada de Imaging in the Follow-Up of Renal Cell Carcinoma42
| Tipo de tratamiento | Colegio Americano de Radiología | Colegio Real de Radiólogos | Asociación Europea de Urólogos |
|---|---|---|---|
| Posnefrectomía | T1: Radiografía de tórax cada 6-12 meses durante 3 años, y al año 5 | T1: Sin seguimiento | Bajo riesgo: radiografía de tórax o ecografía a los 6, 12, 24, 36, y 48 meses y TAC toracoabdominal contrastado en el año 5 |
| T2: Radiografía de tórax cada 6-12 meses durante 3 años, y luego anualmente hasta el año 5; TAC Contrastado de abdomen al 2.º y 5.º años o a cada año hasta el año 5.T3/T4: radiografía de tórax cada 6-12 meses durante 3 años, y luego anualmente hasta el año 5; TAC contrastado del abdomen cada 3-6 meses durante 3 años, luego anualmente hasta el año 5 | T2/T3: TAC toracoabdominal contrastado a los 24 y 60 meses (si no reciben terapia adyuvante) | Riesgo intermedio: TAC toracoabdominal contrastado a los 6, 24 y 60 meses; radiografía de tórax o ecografía a los 12 y 48 meses | |
| > T3a: TAC toracoabdominal contrastado a los 3-6 meses durante 5 años | Alto riesgo: TAC toracoabdominal contrastado a los 6, 12, 24, 36, 48 y 60 meses | ||
| Postablación | TAC de abdomen simple y contrastado a los 1, 3, 6, y 12 meses | No especifi cado | Riesgo bajo o intermedio: TAC toracoabdominal contrastado a los 6, 24 y 60 meses; radiografía de tórax o ecografía a los 12 y 48 mesesAlto riesgo: TAC toracoabdominal contrastado a los 6, 12, 24, 36, 48 y 60 meses |
| Posquimioterapia | No especifi cado | No especifi cado | No especifi cado |
| Cáncer renal hereditario | No especifi cado | No especifi cado | Fenotipo leve: Imágenes cada 2-3 añosFenotipo agresivo: imágenes cada 3-6 meses |
Posterior a la realización de nefrectomía El Colegio Americano de Radiología por su parte recomienda un seguimiento estricto que varía de acuerdo al tamaño tumoral, de esta forma para tumores estadificados como T1 (menores de 7 cm y confinados al riñón) se debe realizar radiografía de tórax cada 6–12 meses durante 3 años y posteriormente al 5 año pos-tratamiento; en paciente con estadificación T2 se debe realizar radiografía de tórax cada 6–12 meses por 3 años y posteriormente cada año hasta el quinto año; además realizar tomografía de abdomen contrastada cada año hasta el quinto año o en el segundo y en el quinto año. Pacientes clasificados como T3 o T4 deben tener radiografía de tórax cada 6–12 meses por 3 años, posteriormente cada año hasta el quinto año, además de tomografía contrastada de abdomen cada 3 a 6 meses por 3 años y posteriormente cada año hasta el quinto año42.
Adicionalmente, se encuentran las recomendaciones del Colegio Real de Radiología también posterior a nefrectomía donde la primera diferencia con las recomendaciones del Colegio Americano radica en que para pacientes clasificados como T1 no recomiendan ningún tipo de seguimiento. Adicionalmente el Colegio Real de radiólogos recomienda la realización de tomografía de tórax y abdomen contrastada para el seguimiento de los demás estadios, sin tener en cuenta la radiografía de tórax. Es así que pacientes clasificados como T2 y T3 deben tener tomografía de tórax y abdomen contrastada cada 24 y 60 meses siempre y cuando no reciba tratamiento adyuvante. Paciente con estadios mayores de T3a deben realizarse tomografía de tórax y abdomen cada 3 a 6 meses durante 5 años42,43.
Por último, se encuentran las recomendaciones de la Asociación Europea de Urólogos los cuales dividen a los pacientes en tres categorías, de acuerdo con el tipo histológico y estadificación de cada paciente, en bajo, mediano y alto riesgo. Los primeros deben tener radiografía de tórax o ecografía a cada 6 meses hasta el año y luego cada año hasta el tercer año; además deben realizarse tomografía de tórax y abdomen contrastada al quinto año. Los paciente clasificados en la segunda categoría de riesgo, debe realizarse posterior a nefrectomía tomografía de tórax y abdomen contrastada a los 6, 24 y 60 meses y radiografía de tórax o ultrasonido a los 12 y 48 meses. Los pacientes de alto riesgo, por el contrario, deben realizarse tomografía contrastada de tórax y abdomen a los 6, 12, 24 36, 48 y 60 meses.
Por otro lado, es importante tener en cuenta que existen unas recomendaciones especiales de seguimiento para pacientes posterior al tratamiento con terapia ablativa, donde la tomografía y la resonancia juegan un papel fundamental. Es importante recordar que la apariencia de la zona de ablación puede variar dependiendo de la técnica utilizada, el tamaño del tumor primario, la localización y composición de este donde la regla general es que la mayoría de los tumores demuestren disminución gradual en el tamaño, una vez desaparezcan los cambios agudos44. El Colegio Americano de Radiología recomienda la realización de tomografía de abdomen simple y contrastada al primer, tercer, sexto y doceavo mes postratamiento.
Con el paso de los años han surgido otros grupos especiales de seguimiento como los pacientes que reciben quimioterapia y aquellos con cáncer renal hereditario. Este último tipo de presentación se encuentra en aproximadamente el 3-5% de todos los cánceres renales42,45 donde se incluyen síndromes como la enfermedad de Von Hippel Lindau (VHL), el síndrome hereditario leiomioma-cáncer de células renales y el carcinoma de células renales papilar familiar; características comunes en estos tipos de cáncer incluyen la presentación en pacientes más jóvenes (tercera y cuarta décadas de la vida), lesiones múltiples y bilaterales46.
Para cada uno de estos síndromes, mencionados anteriormente, es necesario una estadificación de acuerdo con el subtipo histológico y a la estadificación; de esta forma por ejemplo pacientes con VHL pueden seguirse con imágenes cada 2 a 3 años siempre y cuando no tenga antecedente de carcinoma de células renales ya tratado, ya que este último caso en particular debe ser seguido con imágenes cada 3 a 6 meses. Estas recomendaciones de seguimiento son proporcionadas por la Asociación Europea de Urólogos, y no especifican el método de imagen con el cual se deben seguir los pacientes.
Con todo lo anterior se puede concluir que existen diferentes recomendaciones para el seguimiento de los pacientes con carcinoma de células renales por lo cual es importante una correcta estadificación tumoral e histológica de cada paciente para encontrar la mejor estrategia de seguimiento, siempre buscando el diagnóstico temprano de las recaídas o metástasis a distancia.
Medición en las imágenesClásicamente se han utilizado los criterios RECIST como un método estandarizado y objetivo de evaluar la respuesta a las terapias sistémicas. Estos criterios definen el tamaño mínimo de las lesiones medibles, el número de lesiones que se debe seguir, y el uso de una sola dimensión para medir las lesiones tumorales y según estos parámetros determinar la carga de morbilidad.
La respuesta se clasifica en completa (desaparición de todas las lesiones diana), respuesta parcial (disminución ≥ 30% en el tamaño de las lesiones), enfermedad estable (disminución < 30% en el tamaño de las lesiones o crecimiento < 20%), y progresión de la enfermedad (aumento ≥ 20% de las lesiones índice)40.
Sin embargo, en el carcinoma de células renales, gracias a las nuevas terapias dirigidas, ha habido un importante cambio en el paradigma y gran discusión sobre la necesidad de nuevas escalas de evaluación para el seguimiento del tratamiento. Además diversos estudios han encontrado que la escala del RECIST subestima significativamente la evaluación de la respuesta del tumor después de la terapia antiangiogénica47.
Hoy en día un nuevo concepto integrado en el desarrollo tumoral es la angiogénesis; este es un proceso fisiológico normal, donde se vasculariza un tejido, lo cual involucra el desarrollo de nuevos vasos sanguíneos, todo esto influenciado por diferentes factores de crecimiento proangiogénicos intratumorales48; en el caso especial del carcinoma de células renales el cual se caracteriza de por ser particularmente vascularizado secundario a altos niveles de factores de crecimiento tales como VEGF, TGF [beta] 1 y TGF [alfa]49,50.
En la actualidad este proceso de neoangiogénesis tumoral se ha convertido en un punto importante de terapias y la regresión en la vascularización del tumor tiene una adecuada correlación con la disminución en la atenuación de estas lesiones en respuesta a la terapia. Entre estas escalas encontramos la llamada MASS, donde cada una de sus letras traduce una variable distinta para medir así: M de morfología, A de atenuación y las dos últimas S son tamaño y estructura por sus siglas en ingles. Esta escala se utiliza para evaluar la respuesta y predecir el desenlace clínico de los pacientes con carcinoma de células renales metastásico que reciben terapia antiangiogénica. Para su correcta interpretación es necesario realizar una tomografía o resonancia contrastada y evaluar las lesiones en fase arterial y portal.
La escala MASS puede determinar progresión de la enfermedad cuando se encuentra una lesión metastásica con centro que realza previamente con centro necrótico y/o un nnuevo realce en una masa homogénea que no realzaba. La otra categoría de respuesta al tratamiento se basa en la disminución en más de > 40 HU del realce de una lesión y/o nnecrosis central marcada, la cual significa un cambio mayor del 50% en la atenuación de la porción central de la masa sólida (figs. 10 y 11, resonancias de control de un paciente con carcinoma de células renales izquierdo posterior a nefrectomía total y en tratamiento con terapia antiangiogénica). Se ha encontrado que la escala MASS tiene mayor sensibilidad y valor predictivo negativo que los criterios RECIST llegando hasta un 86 y 60% respectivamente5.
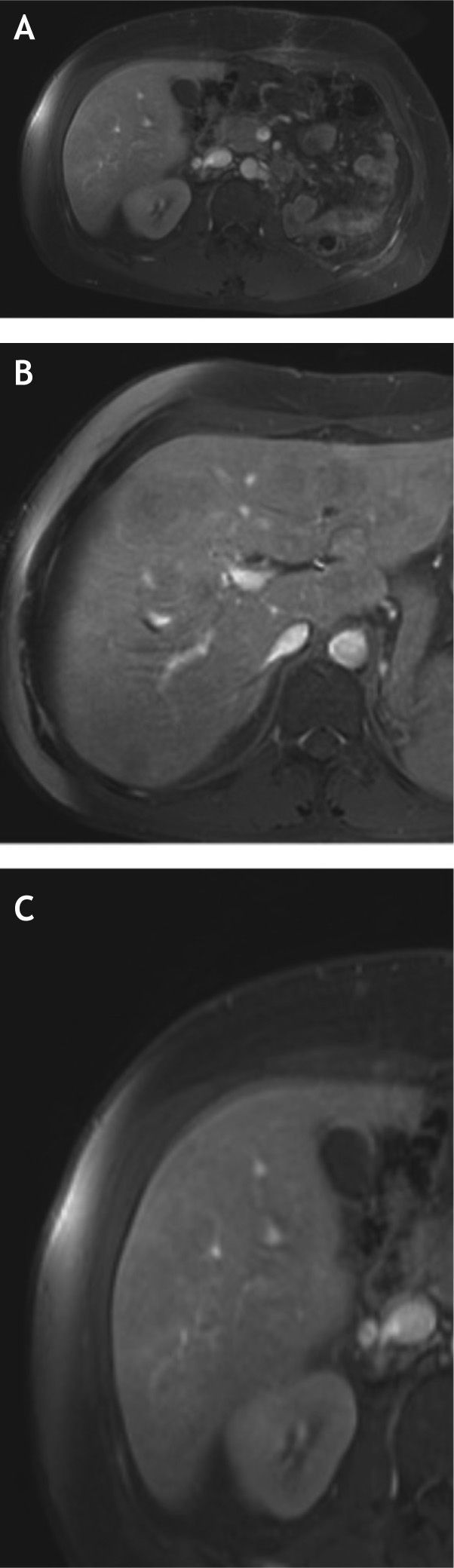
Resonancia magnética de abdomen del 28 de julio de 2014. A) Corte axial post contraste donde se observan cambios postquirúrgicos por nefrectomía radical izquierda. B y C) Cortes post contraste evidenciando múltiples lesiones focales de baja intensidad de señal en ambos lóbulos hepáticos compatibles con depósitos metastásicos.
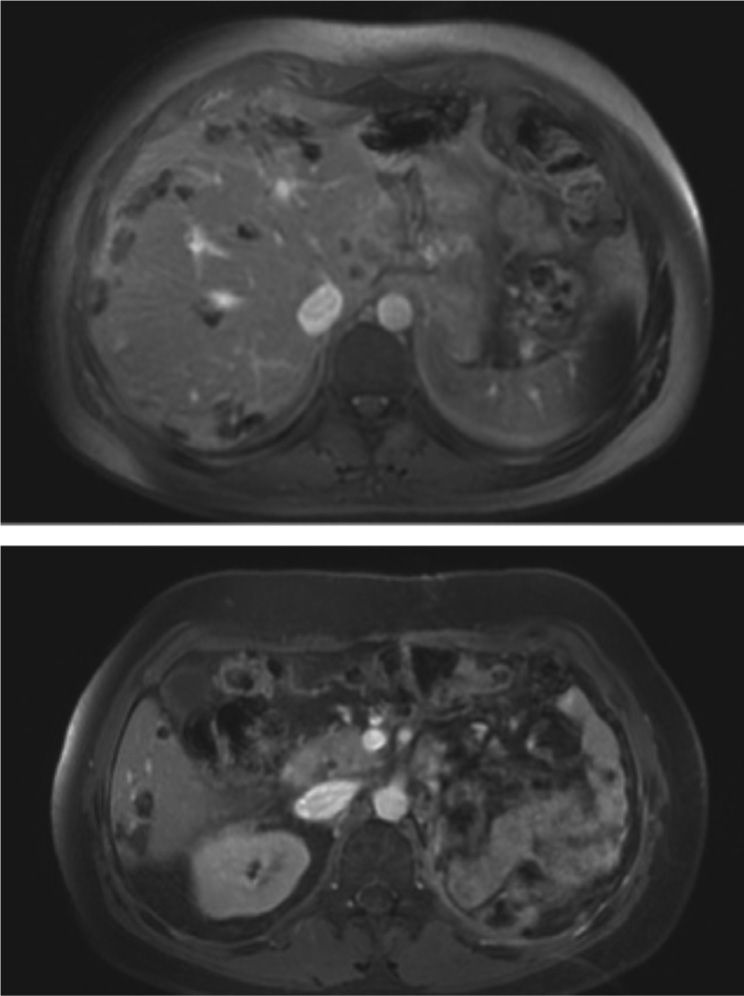
Resonancia magnética de abdomen, cortes axiales poscontraste del 2 de diciembre de 2014: cambios posquirúrgicos por nefrectomía radical izquierda. Múltiples lesiones de baja intensidad de señal en ambos lóbulos hepáticos compatibles con depósitos metastásicos, las cuales en comparación con estudio previo han disminuido de tamaño y de menor intensidad de señal de señal hallazgos compatibles con repuesta al tratamiento según criterios MASS.
La alta resolución de la escanografía y la resonancia magnética, asociado a medio de contraste de forma dinámica, permite una aproximación prequirúrgica de las lesiones renales, ayudando al clínico a establecer la posibilidad de manejo conservador. La información obtenida de las mismas permite un mayor abordaje terapéutico en lesiones localizadas, localmente avanzadas y metastásicas. Estrategias de seguimiento por imagines son fundamentales para la detección temprana de recaída y enfermedad metastásica, las cuales se basan en criterios clínicos de acuerdo al estadio tumoral y al tipo histológico de la enfermedad. La utilización de nuevas terapias antiangiogénicas debe ser evaluada con nuevas escalas (MASS) que permitan establecer la adecuada o no respuesta a la terapia.
Nivel de evidenciaIII.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Diseño del estudio: artículo de revisión.