La infertilidad masculina representa al menos la mitad de los casos de parejas infértiles. Para su diagnóstico generalmente no se tienen en cuenta los parámetros funcionales de los espermatozoides, ni alteraciones fisiológicas como el estrés oxidativo.
ObjetivoComparar los parámetros seminales convencionales y funcionales de hombres con fertilidad comprobada respecto a los de hombres con fertilidad desconocida, además de cuantificar el efecto de la selección espermática sobre diferentes marcadores de estrés oxidativo en los espermatozoides.
Materiales y métodosSe evaluaron los parámetros seminales convencionales (volumen, concentración, movilidad, viabilidad y morfología espermática) y funcionales (potencial de membrana mitocondrial, integridad de la membrana plasmática, lipoperoxidación de membranas, producción de especies reactivas del oxígeno y del nitrógeno intracelulares e integridad de la cromatina espermática) en semen y espermatozoides sin seleccionar y seleccionados, así como en hombres con fertilidad probada y en hombres con fertilidad desconocida.
ResultadosLos espermatozoides seleccionados y los de hombres fértiles tuvieron menores índices de fragmentación de la cromatina espermática. Los hombres fértiles tuvieron mayor porcentaje de espermatozoides que producían especies reactivas del oxígeno. Los espermatozoides de hombres fértiles tuvieron menor porcentaje de lipoperoxidación. Adicionalmente, el procesamiento para seleccionar los espermatozoides no afectó la integridad de la cromatina espermática, a pesar de observarse un incremento en la producción de especies reactivas del oxígeno.
ConclusiónLos parámetros funcionales, y no solo los convencionales de los espermatozoides seleccionados y los de hombres fértiles, son superiores a los de las muestras sin seleccionar y a los de hombres con fertilidad no probada.
Male infertility is responsible for at least half of the cases of infertile couples, but its diagnosis does not always include functional sperm parameters or the evaluation of physiological alterations, such as oxidative stress.
ObjectiveTo compare conventional and functional sperm parameters of fertile men and men with unknown fertility status. In addition, to quantify the effect of the sperm selection process on different oxidative stress markers in sperm cells.
Materials and methodsConventional (volume, concentration, motility, viability, and sperm morphology), and functional (mitochondrial membrane potential, integrity of sperm chromatin, production of intracellular reactive oxygen and nitrogen species, plasma membrane integrity, and lipid peroxidation of cell membranes) sperm and semen parameters were evaluated in men with proven fertility and men with unknown fertility, as well as in non-selected and selected sperm.
ResultsThe selected sperm and those from fertile men showed lower rates of sperm chromatin fragmentation and a higher percentage of sperm producing reactive oxygen and nitrogen species. The spermatozoa of fertile men had a lower percentage of lipid peroxidation. Additionally, the selection procedures did not affect sperm chromatin integrity, despite the increase in production of reactive oxygen species.
ConclusionThe functional, and not only the conventional sperm parameters from fertile men and of selected sperm, are superior compared to unselected semen samples, and those from men with unknown fertility.
La infertilidad es una condición que afecta aproximadamente a un 15% de las parejas en edad reproductiva del mundo1,2 y todavía en sociedades como la nuestra es considerada un problema atribuido a la mujer, aun cuando el hombre es responsable del 50% de los casos1,3.
El diagnóstico de la infertilidad masculina se basa principalmente en la evaluación de los parámetros seminales convencionales, los cuales involucran el análisis macroscópico y microscópico del eyaculado4. Sin embargo, usualmente no se tiene en cuenta la evaluación de las propiedades funcionales del espermatozoide, ni de las anormalidades fisiológicas como el estrés oxidativo, las cuales contribuyen al origen de la infertilidad masculina5,6.
El estrés oxidativo en las células espermáticas es un conjunto de eventos desencadenados por un desbalance entre la producción, exógena y endógena, de especies reactivas del oxígeno (ERO) y del nitrógeno (ERN) y la disponibilidad de moléculas y enzimas antioxidantes en el semen y en el espermatozoide7,8. Las ERO, formadas principalmente durante el metabolismo aerobio en la mitocondria, son moléculas y radicales libres derivados del oxígeno muy inestables químicamente, con la capacidad de generar otras especies igualmente reactivas como las ERN9.
Un exceso de ERO/ERN que sobrepase la capacidad antioxidante seminal y celular tiene consecuencias deletéreas sobre los espermatozoides, y causa fragmentación del ADN espermático y peroxidación de los lípidos en las membranas, lo que afecta la movilidad y la habilidad de fusión con el oocito1,8,10, sin embargo, en una cantidad moderada desencadenan procesos fundamentales para el espermatozoide como la hiperactivación, la capacitación espermática y la reacción acrosomal7,11.
Por otro lado, cuando los espermatozoides son depositados en la vagina, en su ascenso por el útero hacia el oocito sufren varios procesos de selección de los más aptos para la fecundación, bien sea por el pH ácido de la vagina, el ataque de las células del sistema inmune de la mujer o al pasar por el cuello uterino y el moco cervical12,13.
En los procesos de fertilización asistida se utilizan técnicas para seleccionar artificialmente los espermatozoides, como el swim-up y los gradientes de diferente densidad14, metodologías que, debido a la utilización de procesos de centrifugación, pueden causar estrés oxidativo en las células espermáticas13.
El objetivo de este trabajo fue comparar los parámetros seminales convencionales y funcionales de hombres con fertilidad comprobada respecto a hombres con fertilidad desconocida, además de cuantificar el efecto de la selección espermática sobre diferentes marcadores de estrés oxidativo en las células espermáticas.
Materiales y métodosObtención y procesamiento de las muestras seminalesSe analizaron los eyaculados de 36 hombres voluntarios aparentemente sanos: 26 (32±7,2 años) que consultaron al Grupo Reproducción de la Universidad de Antioquia por curiosidad en conocer su calidad seminal o por requerimiento médico (grupo de estudio [GE]) y 10 individuos fértiles (31,1±3,1 años) que tenían al menos un hijo menor de un año o su pareja en estado de embarazo (grupo fértil [GF]). Las muestras seminales se recolectaron por masturbación en recipientes estériles después de un periodo de abstinencia sexual recomendado de 2 a 5 días.
Análisis seminal convencionalDespués de completado el proceso de licuefacción de las muestras de semen (30-60min, a 37°C), se realizó el análisis seminal convencional (volumen, pH, apariencia, viscosidad del semen, concentración, concentración total, movilidad, viabilidad y morfología espermática) de acuerdo con las directrices de la Organización Mundial de la Salud (OMS)4,15,16. La concentración de espermatozoides se determinó usando una cámara de Makler (Sefi Medical Instruments, Haifa, Israel)17 y la morfología de los espermatozoides se analizó siguiendo los criterios estrictos de Tygerberg18. No se incluyeron en los análisis muestras de semen con leucocitospermia (>1×106 leucocitos/mL).
Análisis de parámetros funcionalesLos análisis de citometría de flujo se llevaron a cabo en el citómetro de flujo Epics XL (Becton Dickinson, CA, EUA), con una longitud de onda de excitación de 488nm suministrada por un láser de argón. Las mediciones de dispersión frontal (forward scatter) y de dispersión lateral (side scatter) se utilizaron para seleccionar la población de espermatozoides y para excluir los detritos y agregados que producen efectos indeseados en la fluorescencia general. Un total de 10.000 eventos fueron obtenidos por prueba y todos los datos fueron analizados posteriormente usando el programa FlowJo 7.6.2 (FlowJo LLC, OR, EUA).
Potencial de membrana mitocondrial (ΔΨm)El ΔΨm se evaluó usando la tinción con yoduro de 3,3’-di-hexiloxacarbocianina (DiOC63, Molecular Probes Inc., Países Bajos), un colorante lipófilo, catiónico y selectivo para las mitocondrias de células vivas, el cual indica el estado del potencial de la membrana mitocondrial. El yoduro de propidio (IP, Molecular Probes Inc., Países Bajos) se utilizó como contratinción con el fin de discriminar los espermatozoides necróticos/muertos19. Brevemente, 2×106 de espermatozoides se incubaron en 300μL de buffer fosfato salino (PBS, pH 7,4, Gibco®, NY, EUA) con DiOC6 (concentración final de 10nM) y con IP (concentración final de 12μM) protegidos de la luz (30min, a 25°C). A continuación, los espermatozoides en PBS se lavaron (centrifugación a 180g, 5min), se descartó el sobrenadante y el botón fue resuspendido en PBS para la evaluación mediante citometría de flujo. Los datos fueron analizados como el porcentaje de espermatozoides vivos con alto y bajo ΔΨm (emiten alta y baja fluorescencia en verde, respectivamente) y de espermatozoides necróticos/muertos (emiten fluorescencia roja).
Producción intracelular de especies reactivas del oxígeno y del nitrógenoLos niveles intracelulares de ERO y de ERN fueron evaluados utilizando 2’,7’-di-acetato de dicloro-di-hidrofluoresceína (DCFH-DA; Sigma-Aldrich, St. Louis, MO, EUA, concentración final de 1μM). Al ingresar el DCFH-DA en la célula espermática, sufre la escisión de los grupos acetato por las esterasas intracelulares; el DCFH resultante, no fluorescente, es oxidado por las ERO y ERN (específicamente por H2O2, HO-, ROO- y ONOO-) hasta 2’,7’-diclorofluoresceína (DCF) el cual fluoresce en verde al ser excitado por el láser azul usado en el citómetro de flujo19. La suspensión de células se incubó protegida de la luz (30min, a 25°C) con DCFH-DA (concentración final de 1μM) y con IP (concentración final de 12μM) para excluir los espermatozoides necróticos/muertos, se lavó 3 veces con PBS (180g, 5min) y el botón se resuspendió en PBS antes de analizarlo en el citómetro de flujo. Los resultados se expresan como el porcentaje de espermatozoides negativos para IP y positivos para DCF que exhiben fluorescencia en verde: espermatozoides vivos que producen ERO y ERN.
Evaluación de la integridad de la membrana plasmáticaSe utilizó el estuche comercial Live/Dead® Sperm (Molecular Probes Inc., Países Bajos) para evaluar la integridad de la membrana plasmática, el cual permite discriminar 3 poblaciones de espermatozoides. Brevemente, 2×106 de espermatozoides se incubaron protegidos de la luz (30min, a 25°C) en 300μL de PBS con Sybr-14 (concentración final de 1μM) y con IP (concentración final de 12μM) para excluir los espermatozoides necróticos/muertos, se lavaron con PBS (180g, 5min) y se resuspendieron en PBS antes del análisis por citometría de flujo. Los datos se expresan como el porcentaje de espermatozoides viables (con la membrana plasmática intacta: positivos para Sybr-14 que emiten fluorescencia verde, pero negativos para IP), espermatozoides necróticos/muertos (positivos para IP con fluorescencia roja, pero negativos para Sybr 14) o espermatozoides moribundos (dobles positivos).
Peroxidación de las membranas lipídicasLa degradación oxidativa de los lípidos de membrana se evaluó usando el colorante BODIPY (581/591) C11 (Molecular Probes Inc., Países Bajos) de acuerdo con el método propuesto por Aitken et al.20. BODIPY (581/591) C11, una vez incorporado a las membranas espermáticas, emite fluorescencia naranja que cambia a verde cuando es peroxidado por las ERO. Dos millones de espermatozoides en 300μL de PBS se incubaron protegidos de la luz (30min a 25° C) con BODIPY (581/591) C11 (concentración final 6,6M), se lavaron en PBS (180g, 5min) y se resuspendieron en PBS antes del análisis por citometría de flujo. Los resultados se expresan como el porcentaje de espermatozoides que exhiben la respuesta de fluorescencia verde.
Integridad de la cromatinaLa evaluación de la estructura de la cromatina espermática (SCSA®) se utilizó para determinar el índice de fragmentación del ADN espermático (IFA), según lo descrito previamente por Evenson et al.21 y adaptado en nuestro laboratorio19,22–24. Brevemente, 400μL de una solución de detergente ácido (HCl, NaCl, Triton X-100, agua, pH: 1,2) se añadieron a 5×106 de espermatozoides suspendidos en 200μL de buffer TNE (Tris-HCl, NaCl y EDTA, pH: 7,4). Después de 30 s, los espermatozoides se tiñeron con 600μL de naranja de acridina (6mg/mL, Sigma-Aldrich, St. Louis, MO, EUA) y se analizaron inmediatamente en el citómetro de flujo. El IFA se calculó con la intensidad media de fluorescencia (IMF) roja en proporción a la fluorescencia total (IMF roja+IMF verde), multiplicada por 100.
Selección espermáticaA 9 de las 26 muestras de los voluntarios se les realizó selección espermática y se compararon los parámetros funcionales de los espermatozoides antes de ser seleccionados (no seleccionados [NS]) y después de ser seleccionados (S).
Para la selección de los espermatozoides móviles progresivos se utilizó un gradiente de densidad discontinua (PureSperm 40/80, Nidacon, Suiza) siguiendo las instrucciones del fabricante con algunas modificaciones. Brevemente, se adicionaron a un tubo cónico, sin mezclarse, 400μL del gradiente de mayor densidad, 400μL del gradiente de menor densidad y entre 800 y 1.000μL de la muestra total de semen. Posteriormente, se centrifugó a 300g por 20 min, se retiró el sobrenadante, se resuspendió el botón en 1mL de PBS. Inmediatamente, de la suspensión de espermatozoides seleccionados se tomaron el número de alícuotas necesarias para cuantificar los parámetros funcionales espermáticos. Adicionalmente se evaluó la viabilidad y la movilidad de los espermatozoides recuperados.
Análisis estadísticoLa distribución de los datos se evaluó con la prueba de normalidad de los residuos. Las comparaciones se realizaron usando la prueba de t de Student cuando los grupos de datos seguían una distribución normal y la prueba de Mann-Whitney y la prueba de los rangos Wilcoxon para comparar las variables que no presentaron distribución gaussiana. Los datos fueron analizados utilizando el programa estadístico Prism 5.0 (GraphPad, San Diego, CA, EUA) y un valor de p < 0,05 fue considerado significativo. Los datos que siguieron una distribución normal se expresan como la media±error estándar de la media (SEM) y los que no, como mediana y rango.
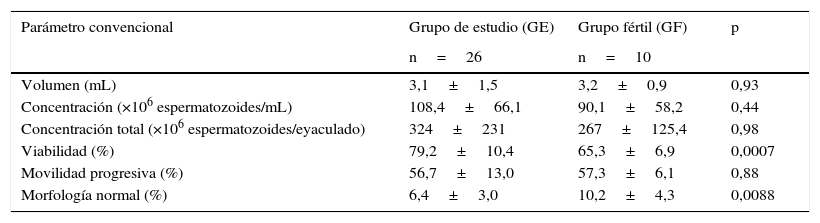
ResultadosLos parámetros convencionales del GE comparados con el de los hombres fértiles GF se compilaron en la tabla 1. Aunque ambos grupos tuvieron parámetros convencionales muy similares, el porcentaje de espermatozoides con morfología normal es mayor en el GF (p=0,0008), mientras que el porcentaje de espermatozoides viables es mayor en GE (p=0,0007).
Distribución de los parámetros seminales convencionales
| Parámetro convencional | Grupo de estudio (GE) | Grupo fértil (GF) | p |
|---|---|---|---|
| n=26 | n=10 | ||
| Volumen (mL) | 3,1±1,5 | 3,2±0,9 | 0,93 |
| Concentración (×106 espermatozoides/mL) | 108,4±66,1 | 90,1±58,2 | 0,44 |
| Concentración total (×106 espermatozoides/eyaculado) | 324±231 | 267±125,4 | 0,98 |
| Viabilidad (%) | 79,2±10,4 | 65,3±6,9 | 0,0007 |
| Movilidad progresiva (%) | 56,7±13,0 | 57,3±6,1 | 0,88 |
| Morfología normal (%) | 6,4±3,0 | 10,2±4,3 | 0,0088 |
Los valores se representan como media±DE.
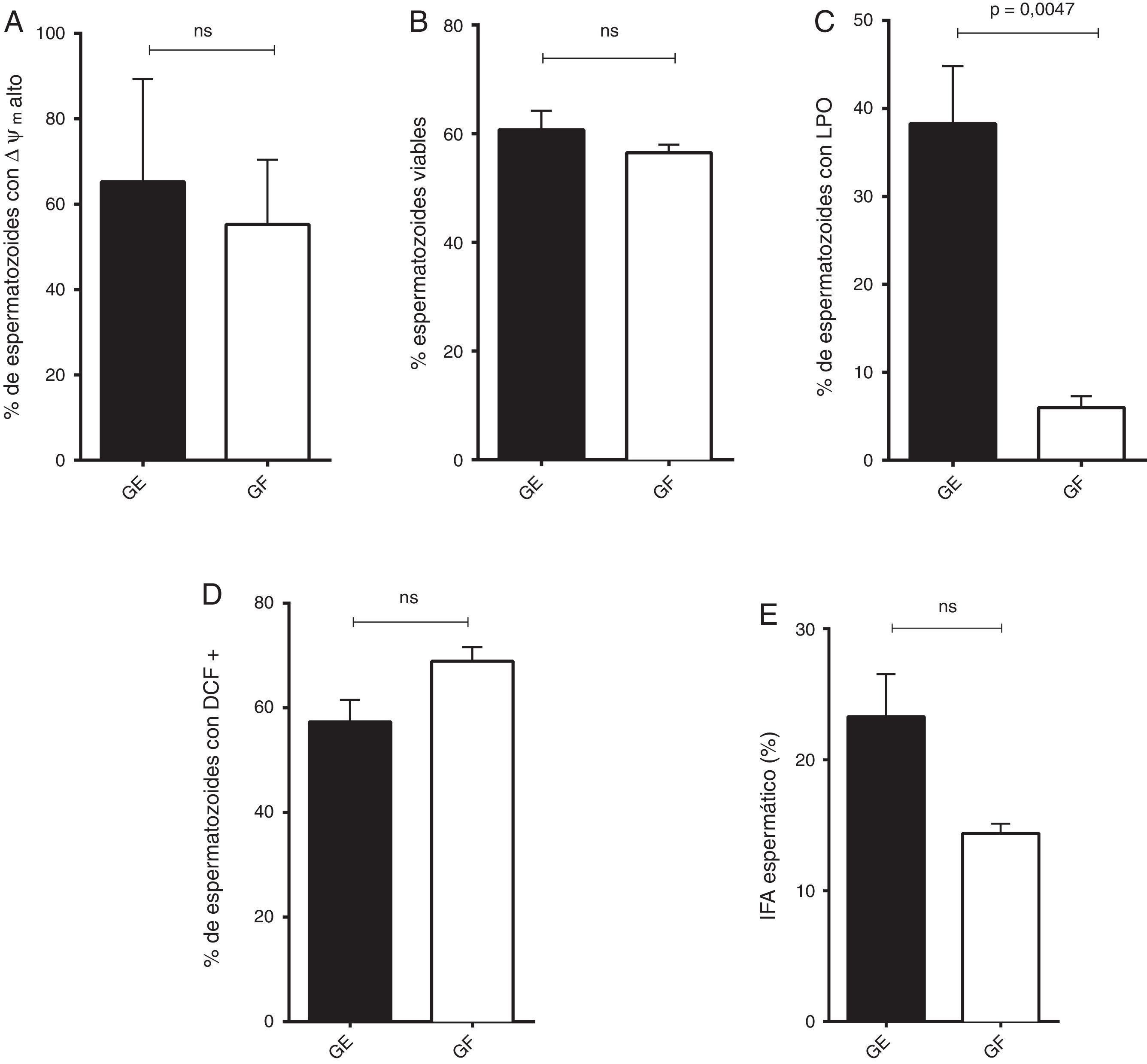
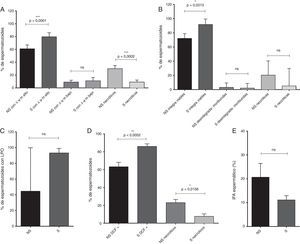
La lipoperoxidación espermática fue significativamente menor en el GF respecto a GE (p=0,0047), de manera similar en este grupo se observa una tendencia a la disminución en el ΔΨm alto, en el porcentaje de células viables y en el IFA (fig. 1).
Distribución de los parámetros funcionales de GE y GF.
A) Espermatozoides con potencial de membrana mitocondrial (ΔΨm) alto (mediana y rango). B) Integridad de membrana plasmática (media y SEM). C) Espermatozoides con lipoperoxidación de las membranas (LPO, media y SEM). D) Espermatozoides positivos para DCF (media y SEM). E) Índice de fragmentación de la cromatina (IFA, media y SEM).
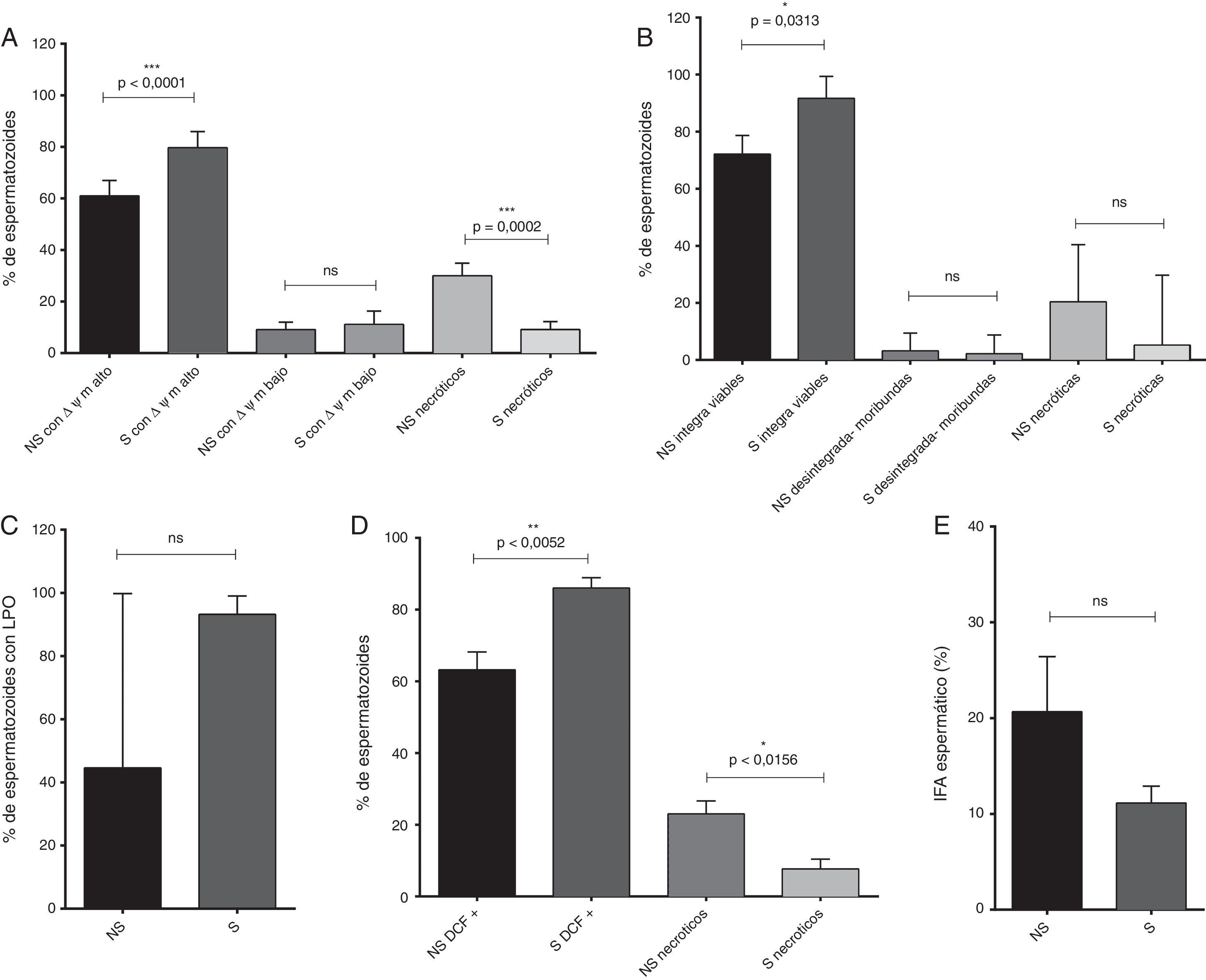
Por otro lado, en los espermatozoides seleccionados se evidenció un aumento significativo del número de espermatozoides con ΔΨm alto (p<0,0001), del número de espermatozoides viables (p=0,0313) y del porcentaje de espermatozoides positivos para DCF, respecto a los espermatozoides no seleccionados (p=0,0052). Adicionalmente, en 3 de los marcadores de estrés oxidativo se evaluó el porcentaje de células necróticas (potencial de membrana mitocondrial, integridad de la membrana plasmática y producción de ERO/ERN): en todas resultó una cantidad inferior de células necróticas en los espermatozoides seleccionados (fig. 2).
Marcadores de estrés oxidativo evaluados en los espermatozoides no seleccionados (NS) y postseleccionados (S).
A) Potencial de membrana mitocondrial (ΔΨm) alto y bajo (media y SEM). B) Integridad de la membrana plasmática–viabilidad (mediana y rango). C) Lipoperoxidación de las membranas celulares (LPO, mediana y rango). D) Porcentaje de espermatozoides positivos para DCF (media y SEM). E) Índice de fragmentación de la cromatina (IFA, media y SEM).
En este trabajo, los parámetros convencionales y funcionales de un grupo de hombres sanos con fertilidad desconocida se compararon con los de un grupo de hombres con fertilidad probada, y se obtuvieron como resultado valores similares para los parámetros seminales convencionales. Sin embargo, conforme a lo que han demostrado estudios previos25,26, el porcentaje de espermatozoides con morfología normal fue significativamente mayor en el GF, aun cuando todos los valores estaban por encima de los límites inferiores de referencia propuestos por la OMS en 20104,15.
Los valores de referencia para los parámetros seminales convencionales han permitido caracterizar la calidad seminal de hombres fértiles y, con cada edición del manual para análisis seminal humano de la OMS se intenta disminuir las diferencias intra- e interlaboratorios16. Aunque la morfología, la movilidad y la viabilidad espermática se han considerado los principales parámetros espermáticos involucrados en la fecundación natural exitosa del oocito26-28, la determinación final de cuáles parámetros espermáticos son los más importantes a la hora de que los espermatozoides fecunden al oocito continúa siendo motivo de estudio. Diferentes investigaciones han asociado el exceso de ERO con la baja calidad seminal28–30 o con infertilidad idiopática, la cual no es explicada por alteraciones en los parámetros seminales convencionales19.
Es interesante que el GF presentó un mayor porcentaje de células espermáticas vivas que producían ERO/ERN, aunque la lipoperoxidación de las membranas, un parámetro relacionado con la producción de ERO, fue significativamente menor en el GF; resultados similares fueron observados en los espermatozoides seleccionados.
El papel de las ERO/ERN en los procesos fisiológicos del espermatozoide es debatido, puesto que es opacado por el efecto negativo que ejercen al desencadenar eventos de estrés oxidativo. Los espermatozoides de los hombres del GF y los espermatozoides seleccionados son un referente de las células espermáticas idóneas para fecundar un oocito y se espera que tengan condiciones fisiológicas superiores. Esto indica que las ERO/ERN detectadas hacen parte del metabolismo y la señalización celular de los espermatozoides de mejor calidad, a su vez, da cuenta del papel fundamental de la regulación celular ejercida por las moléculas antioxidantes en el plasma seminal y por las enzimas antioxidantes intracelulares para prevenir el daño estructural de origen oxidativo en el espermatozoide.
Debido al efecto directo de la fragmentación del ADN en el desarrollo anómalo del embrión22,23, el daño en la integridad de la cromatina espermática como consecuencia del daño oxidativo causado por las ERO y las ERN se ha estudiado ampliamente13,23,31,32, con el fin de establecer algún parámetro predictivo de fertilidad en los hombres. Aunque no fueron significativamente diferentes, el IFA del GF fue menor, lo que señala que en el GE están incluidos hombres que probablemente tendrán alteraciones reproductivas cuando deseen concebir un hijo.
Trabajos realizados por Zini et al.33,34 demostraron que la preparación espermática usando gradientes de diferente densidad incrementa el porcentaje de daño en el ADN y esto lo atribuyeron a la mayor producción de ERO debido a los procesos de centrifugación y al uso de los gradientes de diferente densidad. Sin embargo, en el presente estudio la calidad espermática evaluada con diferentes marcadores de estrés oxidativo fue superior en los espermatozoides seleccionados, incluyendo la integridad de la cromatina espermática, a pesar de presentar un aumento de las ERO/ERN.
Finalmente, la selección espermática es un paso fundamental en el camino de los espermatozoides hacia el oocito en el tracto reproductivo femenino. En los laboratorios de reproducción asistida generalmente se realiza una selección espermática artificial con el fin de obtener los «mejores» espermatozoides con el menor daño en el ADN, además de para eliminar detritos y células que incrementen las especies reactivas del oxígeno exógenas y que afecten el balance oxidante-antioxidante, como lo son los espermatozoides inmaduros y los leucocitos13,35. No obstante, es contradictorio el hecho de que aislar a los espermatozoides del semen, su principal fuente de protección antioxidante, los hace más vulnerables al ataque oxidativo de las ERO y ERN30, cuando se ha demostrado que no separar a los espermatozoides del plasma seminal en los primeros 30 min después de recolectado el semen disminuye la capacidad de fertilización in vitro36,37.
ConclusiónTeniendo en cuenta todo lo anterior, se concluye que se encuentran mejores características, no solo convencionales sino también funcionales, en los espermatozoides seleccionados y en las muestras seminales de hombres fértiles. La información generada en este trabajo contribuye a las investigaciones previas desarrolladas con el fin de determinar si la evaluación de los parámetros espermáticos funcionales puede ser una herramienta para definir los espermatozoides de mejor calidad, así como para buscar tratamientos efectivos más específicos para las alteraciones en la fisiología espermática que afectan la fertilidad masculina.
Responsabilidades éticasProtección a personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y al consentimiento informadoDerecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl presente estudio fue financiado por la Estrategia de Sostenibilidad, Grupo Reproducción, de la Universidad de Antioquia. PCLA es joven investigadora de Colciencias.
Conflicto de interesesLos autores manifestamos no tener conflicto de intereses.