4CMenB es una vacuna que confiere protección frente a la enfermedad meningocócica invasiva por el serogrupo B (EMI por MenB). Autorizada en todo el mundo a partir de los datos de inmunogenicidad y seguridad, disponemos ahora de datos de su efectividad e impacto. Hemos revisado de manera exhaustiva toda la evidencia recopilada en el mundo real desde su autorización.
ResultadosLos datos de 7 países aportan evidencia de efectividad e impacto en diferentes entornos y grupos de edad, incluidos programas de inmunización nacionales/regionales, estudios observacionales y control de brotes. La administración de al menos 2 dosis de 4CMenB redujo la enfermedad meningocócica invasiva (EMI) por MenB en un 50-100% en personas de 2 meses a 20 años. Las estimaciones de la efectividad vacunal en las cohortes completamente vacunadas oscilaron entre el 59 y el 100%. El perfil de seguridad de 4CMenB en el mundo real se correspondió con los datos de los ensayos clínicos previos a su autorización.
ConclusiónLa EMI por MenB es una enfermedad poco frecuente pero potencialmente mortal, con una epidemiología imprevisible. Los datos sobre efectividad e impacto de 4CMenB respaldan su uso para la prevención de la EMI. Los resultados subrayan la importancia de la protección directa de los grupos con mayor riesgo: lactantes/niños pequeños y adolescentes. La protección directa a través de la inmunización sistemática en los lactantes (con rescate de los niños pequeños) y la vacunación sistemática en la adolescencia podrían constituir la modalidad preferida para el control de la enfermedad por MenB.
En Figshare encontrará un resumen en vídeo relacionado con este artículo: https://doi.org/10.6084/m9.figshare.
The 4CMenB vaccine confers protection against serogroup B invasive meningococcal disease (MenB IMD). Licensed worldwide based on immunogenicity and safety data, we now have data on its effectiveness and impact. We have exhaustively reviewed all the evidence gathered in the real world since the vaccine was licensed.
ResultData from 7 countries provide evidence of effectiveness and impact in different settings and age groups, including national/regional immunisation programmes, observational studies, and outbreak control.
The administration of at least 2 doses of 4CMenB reduced IMD by 50-100% in individuals from 2 months to 20 years of age. Estimation of the effectiveness of the vaccine in fully vaccinated cohorts ranged from 59 to 100%. The real-world safety profile of 4CMenB corresponded with the data from the clinical trials undertaken prior to its licensing.
ConclusionMenB IMD is a rare but potentially fatal disease, with unpredictable epidemiology. The data on the effectiveness and impact data of 4CMenB support its use in the prevention of IMD. The results underline the importance of directly protecting the groups most at risk: infants/young children and adolescents. Direct protection through systematic immunisation in infancy (with salvage in young children) and systematic immunisation in adolescents could constitute the preferred model for the control of MenB disease.
La meningitis y la septicemia causadas por Neisseria meningitidis son enfermedades poco frecuentes, pero pueden provocar la muerte o secuelas permanentes. De los 6 serogrupos que causan la mayoría de las enfermedades meningocócicas invasivas (EMI) humanas (A, B, C, W, X e Y), se dispone de prevención para 5 gracias a las vacunas conjugadas actualmente autorizadas dirigidas a los grupos capsulares A, C, W e Y (MenACWY) y a las vacunas proteicas dirigidas al grupo B (MenB)1. La mayoría de las EMI en Europa, Australia, Nueva Zelanda y gran parte del continente americano se deben a MenB, y la incidencia máxima se da en lactantes y niños pequeños1. Los adolescentes y los jóvenes son el segundo grupo de edad más afectado, en el que el aumento de la incidencia de la EMI coincide con el pico de prevalencia de la portación nasofaríngea1,2.
El desarrollo de vacunas MenB con una efectividad amplia se ha visto obstaculizado por los problemas específicos de la cápsula de MenB3–5. La primera vacuna MenB multicomponente (4CMenB, Bexsero®, GSK) se autorizó en 2013, 14 años después de la primera vacuna meningocócica conjugada (serogrupo C)6. 4CMenB se autorizó por primera vez en Europa y se utilizó con una pauta 3+1 a partir de una edad de 2 a 5 meses. Desde 2020, 4CMenB está autorizada a partir de los 2 meses de edad con una pauta 2+1 (tabla 1)7. 4CMenB también se autorizó en Australia y Canadá en 2013 para personas de 2 meses de edad o mayores, y en los Estados Unidos (EE. UU.) en 2015 para adolescentes y jóvenes de 10 a 25 años como pauta de 2 dosis (0, 1 meses) (tabla 1)8–10.
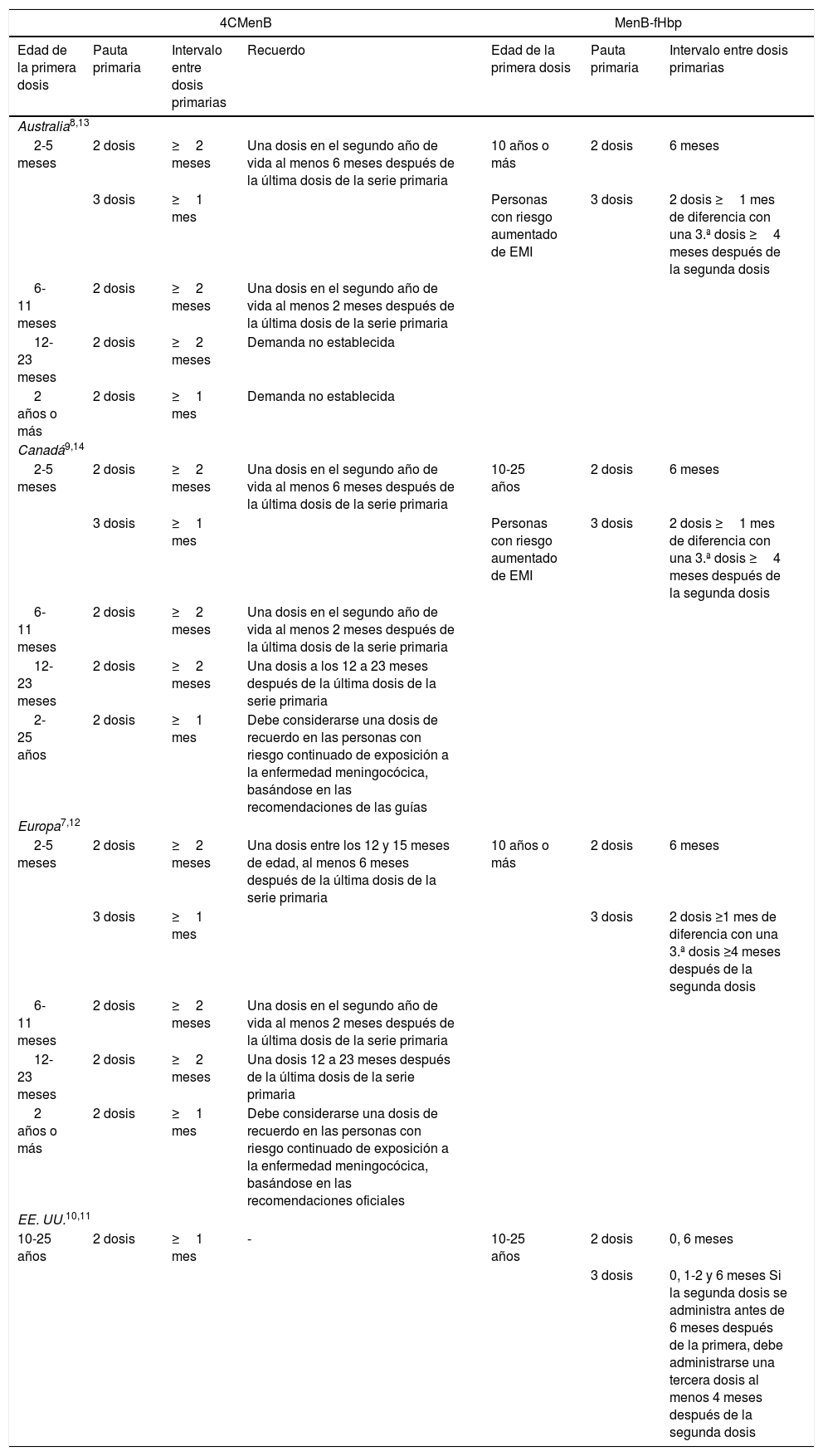
Pautas de vacunación aprobadas con 4CMenB y MenB-fHbp en Australia, Canadá, Europa y Estados Unidos
| 4CMenB | MenB-fHbp | |||||
|---|---|---|---|---|---|---|
| Edad de la primera dosis | Pauta primaria | Intervalo entre dosis primarias | Recuerdo | Edad de la primera dosis | Pauta primaria | Intervalo entre dosis primarias |
| Australia8,13 | ||||||
| 2-5 meses | 2 dosis | ≥2 meses | Una dosis en el segundo año de vida al menos 6 meses después de la última dosis de la serie primaria | 10 años o más | 2 dosis | 6 meses |
| 3 dosis | ≥1 mes | Personas con riesgo aumentado de EMI | 3 dosis | 2 dosis ≥1 mes de diferencia con una 3.ª dosis ≥4 meses después de la segunda dosis | ||
| 6-11 meses | 2 dosis | ≥2 meses | Una dosis en el segundo año de vida al menos 2 meses después de la última dosis de la serie primaria | |||
| 12-23 meses | 2 dosis | ≥2 meses | Demanda no establecida | |||
| 2 años o más | 2 dosis | ≥1 mes | Demanda no establecida | |||
| Canadá9,14 | ||||||
| 2-5 meses | 2 dosis | ≥2 meses | Una dosis en el segundo año de vida al menos 6 meses después de la última dosis de la serie primaria | 10-25 años | 2 dosis | 6 meses |
| 3 dosis | ≥1 mes | Personas con riesgo aumentado de EMI | 3 dosis | 2 dosis ≥1 mes de diferencia con una 3.ª dosis ≥4 meses después de la segunda dosis | ||
| 6-11 meses | 2 dosis | ≥2 meses | Una dosis en el segundo año de vida al menos 2 meses después de la última dosis de la serie primaria | |||
| 12-23 meses | 2 dosis | ≥2 meses | Una dosis a los 12 a 23 meses después de la última dosis de la serie primaria | |||
| 2-25 años | 2 dosis | ≥1 mes | Debe considerarse una dosis de recuerdo en las personas con riesgo continuado de exposición a la enfermedad meningocócica, basándose en las recomendaciones de las guías | |||
| Europa7,12 | ||||||
| 2-5 meses | 2 dosis | ≥2 meses | Una dosis entre los 12 y 15 meses de edad, al menos 6 meses después de la última dosis de la serie primaria | 10 años o más | 2 dosis | 6 meses |
| 3 dosis | ≥1 mes | 3 dosis | 2 dosis ≥1 mes de diferencia con una 3.ª dosis ≥4 meses después de la segunda dosis | |||
| 6-11 meses | 2 dosis | ≥2 meses | Una dosis en el segundo año de vida al menos 2 meses después de la última dosis de la serie primaria | |||
| 12-23 meses | 2 dosis | ≥2 meses | Una dosis 12 a 23 meses después de la última dosis de la serie primaria | |||
| 2 años o más | 2 dosis | ≥1 mes | Debe considerarse una dosis de recuerdo en las personas con riesgo continuado de exposición a la enfermedad meningocócica, basándose en las recomendaciones oficiales | |||
| EE. UU.10,11 | ||||||
| 10-25 años | 2 dosis | ≥1 mes | - | 10-25 años | 2 dosis | 0, 6 meses |
| 3 dosis | 0, 1-2 y 6 meses Si la segunda dosis se administra antes de 6 meses después de la primera, debe administrarse una tercera dosis al menos 4 meses después de la segunda dosis | |||||
EMI: enfermedad meningocócica invasiva.
Otra vacuna MenB, MenB-fHbp (Trumenba®, Pfizer), se autorizó en EE. UU. en 2014, y al principio se aprobó su uso con una pauta de 3 dosis (0, 1-2 y 6 meses) y luego con una de 2 dosis (0 y 6 meses) en personas de 10 a 25 años11. MenB-fHbp se autorizó en Australia, Canadá y Europa en 2017 para su uso con una pauta de 2 (0, 6 meses) o 3 dosis (0, ≥1 y ≥4 meses después de la dosis 2) a partir de los 10 años de edad (tabla 1)12–14.
Ambas vacunas se autorizaron por su seguridad e inmunogenicidad demostrada con análisis de anticuerpos bactericidas en suero en los ensayos clínicos, con la intención de aportar evidencia sobre su efectividad después de la autorización15,16. Cuando se redactó este artículo, MenB-fHbp no se había incluido en los programas nacionales de inmunización (PNI) de ningún país. En consecuencia, las oportunidades para evaluar la efectividad en el mundo real se han centrado en la evidencia publicada, es decir, en las experiencias de control de brotes en EE. UU. y Francia 17–19. 4CMenB se ha implementado en los PNI sistemáticos para lactantes de 8 países: Reino Unido (RU), Irlanda, Italia (incluido San Marino), Lituania, Malta, República Checa, Portugal y Andorra20–27. En 2019 se introdujo un programa regional de inmunización de lactantes en Castilla y León, en 2020 en las Islas Canarias, y en 2018 y 2019 un programa para lactantes y adolescentes, respectivamente, en Australia del Sur28,29. En Australia, el programa 4CMenB se implementó también a partir de julio de 2020 para lactantes aborígenes y de las islas del Estrecho de Torres hasta los 2 años de edad debido a la mayor carga de enfermedad en este grupo30. En EE. UU. se recomienda 4CMenB a partir de los 10 años de edad si la persona corre el riesgo de EMI por MenB, como sucede en casos con deficiencia del complemento, asplenia o durante brotes de MenB. Los adolescentes y jóvenes de 16 a 23 años también se pueden vacunar por decisión clínica compartida31. Además, 4CMenB se utilizó en un programa de control de brotes en Quebec, en la región de Saguenay-Lac-Saint-Jean32, en un estudio aleatorizado por conglomerados en adolescentes de Australia del Sur33 y en el mercado privado de muchos otros países15. La primera estimación de la efectividad de la vacuna en lactantes se publicó en 2016: se describieron la efectividad y el impacto de 2 dosis de 4CMenB administradas en el programa de inmunización de lactantes de RU34. La efectividad global de 2 dosis de 4CMenB frente a la EMI por MenB fue del 82,9% (intervalo de confianza [IC] del 95%: 24,1-95,2)34.
En esta revisión describimos los datos más recientes de efectividad e impacto de 4CMenB. Definimos la efectividad vacunal (EV) como el riesgo de EMI por MenB en personas vacunadas (frente a las no vacunadas), y el impacto vacunal (IV), como la reducción de la enfermedad por MenB en la población a lo largo del tiempo entre personas elegibles para la vacuna, al margen del estado de vacunación.
Control de brotes de enfermedad meningocócica invasiva por MenB en universidades estadounidensesLos universitarios estadounidenses de 18 a 24 años corren más riesgo de EMI por MenB que los jóvenes no universitarios de la misma edad; la incidencia anual entre 2015 y 2017 resultó más de 5 veces mayor que entre los no universitarios35. Entre 2011 y 2019, todos los brotes de EMI en las universidades de EE. UU. se debieron a MenB: hubo 14 brotes, 50 casos y 2 muertes35.
En el periodo de 2013 a 2018, 4CMenB se utilizó para controlar 7 brotes universitarios de EMI por MenB en EE. UU36. Los resultados de 3 de estas campañas vacunales de urgencia se han publicado y revelan que no se produjeron nuevos casos entre los sujetos vacunados tras implementar la campaña37–39. Pese al posible impacto de la vacunación, este resulta difícil de evaluar durante los brotes, ya que estos suelen durar poco, el número de casos es pequeño y la intervención con la vacuna suele comenzar cuando el riesgo global está ya disminuyendo.
La lucha reactiva contra los brotes exige un despliegue rápido de recursos de salud pública con un alto coste y parece difícil conseguir una alta cobertura vacunal36. La adquisición de vacunas y la puesta en marcha de campañas vacunales resultarían más eficientes si existieran ya programas sistemáticos de vacunación. El inicio y la magnitud de la respuesta inmunitaria a una dosis de recuerdo son mayores que tras la primovacunación40, es decir, es probable que la efectividad de una campaña vacunal se acelere y aumente si los destinatarios tienen cierto grado de inmunidad subyacente inducida por la vacuna.
Control del brote de enfermedad meningocócica invasiva por MenB en QuebecQuebec sufrió un brote de EMI por MenB causado por una cepa MenB con una secuencia tipo ST-269; el brote comenzó en 2003 y la mayor incidencia se dio en la región de Saguenay-Lac-Saint-Jean. En mayo de 2014, se implementó una campaña de vacunación masiva con 4CMenB en la región de Saguenay-Lac-Saint-Jean dirigida a todas las personas de 2 meses a 20 años de edad41. La cobertura de 4CMenB para la cepa ST-269 se estimó en el 95%42. Entre mayo y diciembre de 2014, el 82% del grupo etario destinatario había recibido al menos una dosis de la vacuna41. No se notificaron casos de EMI por MenB en personas vacunadas entre 2015 y 2016. El riesgo relativo (RR) de EMI por MenB en la región de Saguenay-Lac-Saint-Jean después de la campaña de vacunación con 4CMenB (de julio de 2014 a diciembre de 2016) frente al riesgo anterior a la campaña (de julio de 2006 a junio de 2014), ajustado por regiones, temporadas, edades y años, fue de 0,22 (IC del 95%: 0,05-0,92; p=0,04)41.
El impacto vacunal se evaluó durante el período de 5 años posterior a la campaña (de julio de 2014 a junio de 2019) y se comparó con el del período anterior a la campaña (de julio de 2006 a junio de 2014) (comunicación personal de Philippe de Wals) (tabla 2). La EMI por MenB disminuyó en el grupo etario destinatario desde 11,4 por 100.000 personas/año en el periodo prevacunal hasta 0,7 por 100.000 personas/año en el período posvacunal (p=0,0001). La incidencia de EMI por MenB disminuyó en un 100% en la población elegible para la vacuna durante los primeros 2 años del programa (p<0,0001), en un 96% al cabo de 4 años (p=0,0013) y en un 94% al cabo de 5 años (p<0,06)32,41 (comunicación personal de Philippe de Wals).
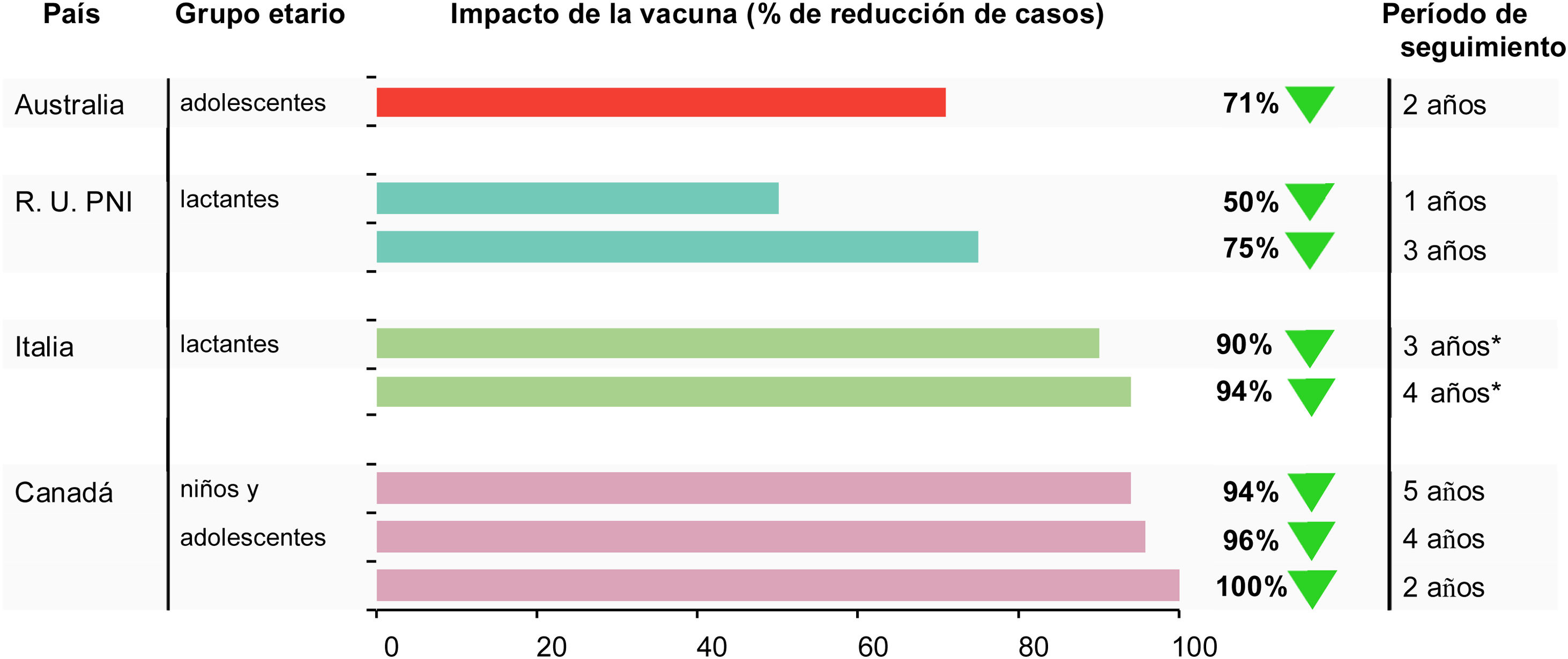
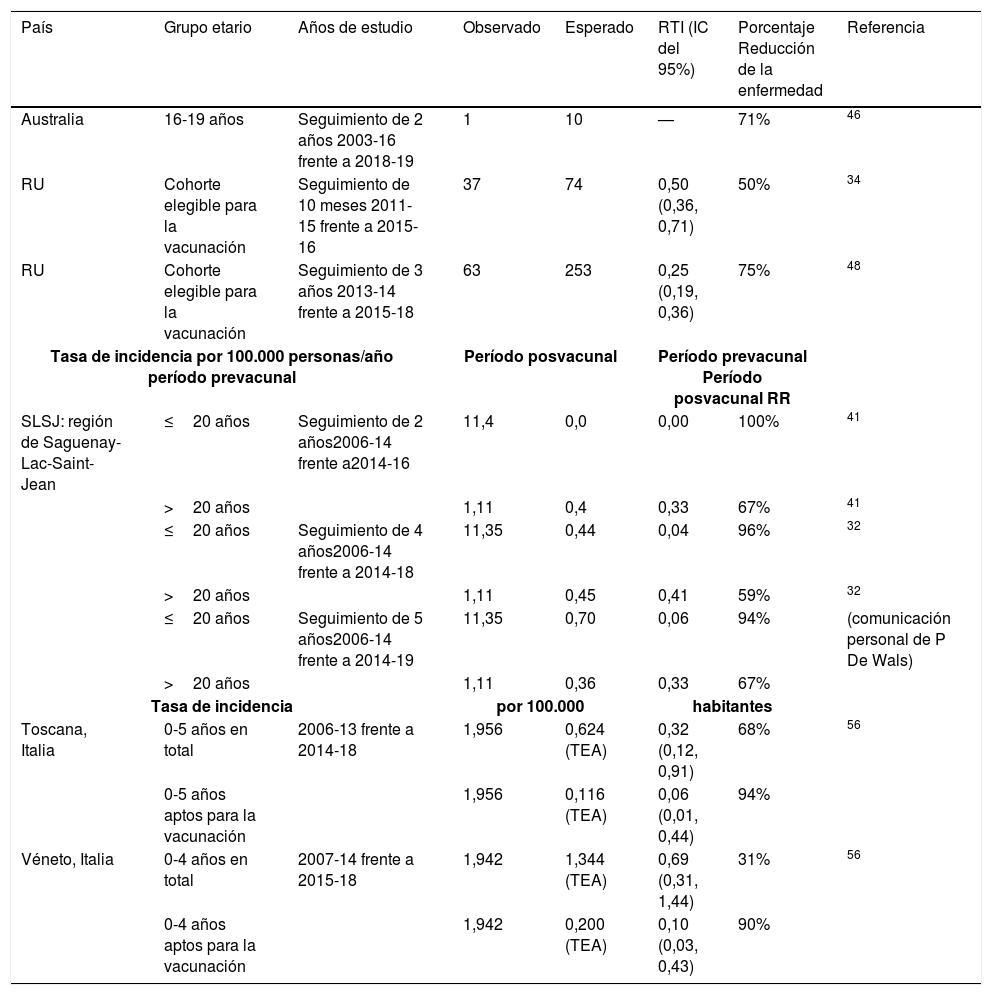
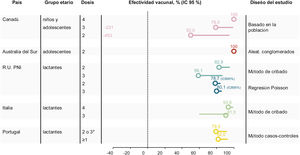
Impacto de la vacuna 4CMenB (porcentaje de reducción de la enfermedad) frente a la enfermedad meningocócica invasiva causada por el serogrupo B
| País | Grupo etario | Años de estudio | Observado | Esperado | RTI (IC del 95%) | Porcentaje Reducción de la enfermedad | Referencia |
|---|---|---|---|---|---|---|---|
| Australia | 16-19 años | Seguimiento de 2 años 2003-16 frente a 2018-19 | 1 | 10 | — | 71% | 46 |
| RU | Cohorte elegible para la vacunación | Seguimiento de 10 meses 2011-15 frente a 2015-16 | 37 | 74 | 0,50 (0,36, 0,71) | 50% | 34 |
| RU | Cohorte elegible para la vacunación | Seguimiento de 3 años 2013-14 frente a 2015-18 | 63 | 253 | 0,25 (0,19, 0,36) | 75% | 48 |
| Tasa de incidencia por 100.000 personas/año período prevacunal | Período posvacunal | Período prevacunal Período posvacunal RR | |||||
| SLSJ: región de Saguenay-Lac-Saint-Jean | ≤20 años | Seguimiento de 2 años2006-14 frente a2014-16 | 11,4 | 0,0 | 0,00 | 100% | 41 |
| >20 años | 1,11 | 0,4 | 0,33 | 67% | 41 | ||
| ≤20 años | Seguimiento de 4 años2006-14 frente a 2014-18 | 11,35 | 0,44 | 0,04 | 96% | 32 | |
| >20 años | 1,11 | 0,45 | 0,41 | 59% | 32 | ||
| ≤20 años | Seguimiento de 5 años2006-14 frente a 2014-19 | 11,35 | 0,70 | 0,06 | 94% | (comunicación personal de P De Wals) | |
| >20 años | 1,11 | 0,36 | 0,33 | 67% | |||
| Tasa de incidencia | por 100.000 | habitantes | |||||
| Toscana, Italia | 0-5 años en total | 2006-13 frente a 2014-18 | 1,956 | 0,624 (TEA) | 0,32 (0,12, 0,91) | 68% | 56 |
| 0-5 años aptos para la vacunación | 1,956 | 0,116 (TEA) | 0,06 (0,01, 0,44) | 94% | |||
| Véneto, Italia | 0-4 años en total | 2007-14 frente a 2015-18 | 1,942 | 1,344 (TEA) | 0,69 (0,31, 1,44) | 31% | 56 |
| 0-4 años aptos para la vacunación | 1,942 | 0,200 (TEA) | 0,10 (0,03, 0,43) | 90% | |||
IC: intervalo de confianza; EMI: enfermedad meningocócica invasiva; RR: razón de riesgos; RTI: razón entre las tasas de incidencia; TEA: tasa de incidencia estandarizada por edades.
Hubo 6 casos de EMI por MenB en la región de Saguenay-Lac-Saint- Jean entre julio de 2014 y junio de 2019. Se notificaron 2 casos en personas vacunadas; un caso de meningitis en un niño de 6 años en 2018, y un caso de meningitis en un niño de 13 años en 2019, ambos habían recibido 2 dosis de 4CMenB en 2014. Los 2 niños se recuperaron. Hubo un caso de meningitis y meningococemia en un adulto joven no vacunado perteneciente al grupo etario destinatario. Los 3 casos restantes se registraron en adultos no vacunados de entre 44 y 65 años, uno de los cuales falleció (comunicación personal de Philippe de Wals).
La EV bruta en el grupo etario destinatario fue del 100% durante los 2 primeros años de la campaña (ningún caso entre personas vacunadas), 79% (IC 95%: −231-99) durante 4 años y 59% (IC 95%: −352-96) durante 5 años (tabla 3, fig. 1) (32-41) (comunicación personal de Philippe de Wals). Considerando las tasas de inmigración y emigración interregionales específicas por edades, la EV ajustada para 5 años fue del 50% (IC 95%: −453-95) (comunicación personal de Philippe de Wals), lo cual indica que en la protección dura unos 4 años después de la vacunación.
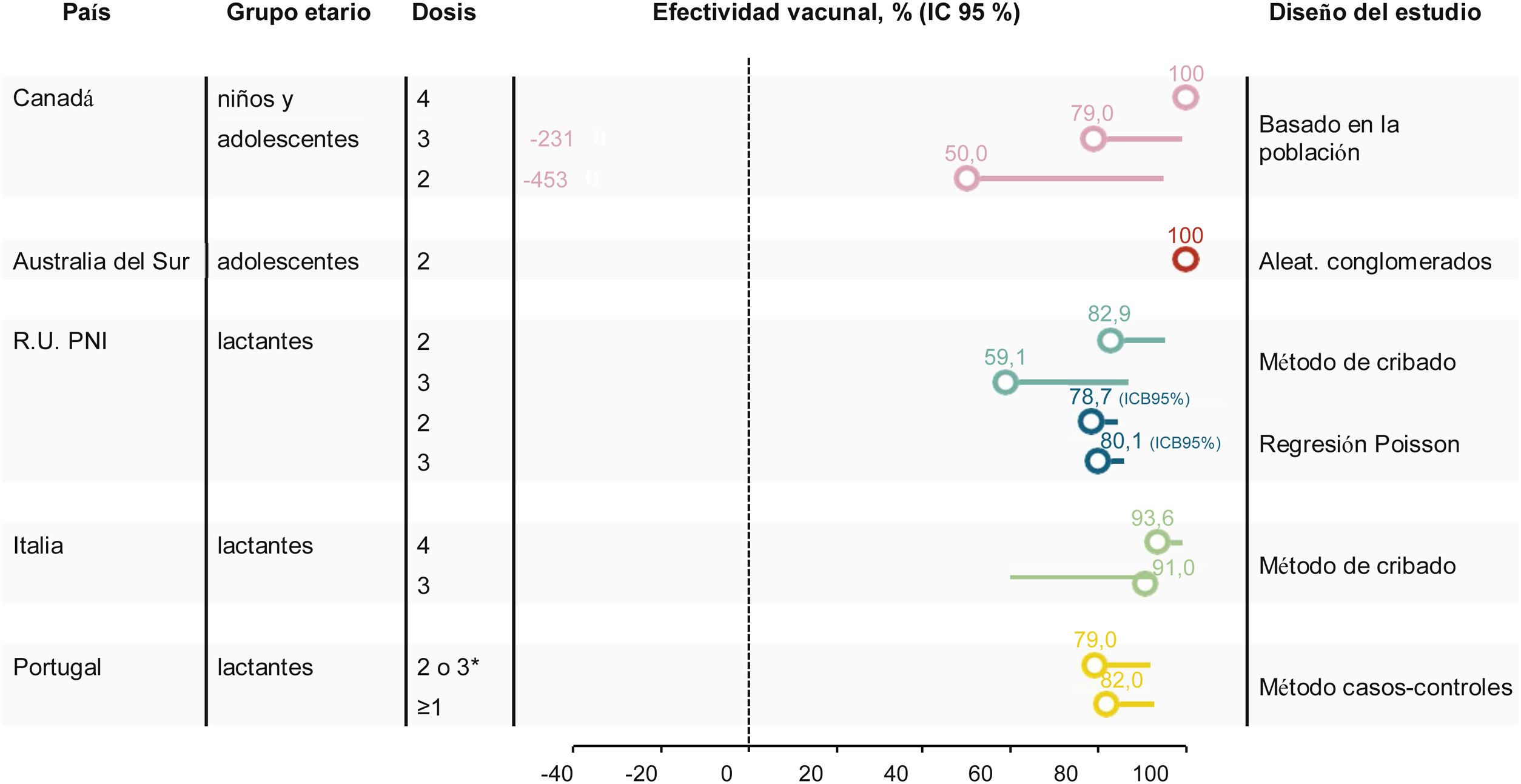
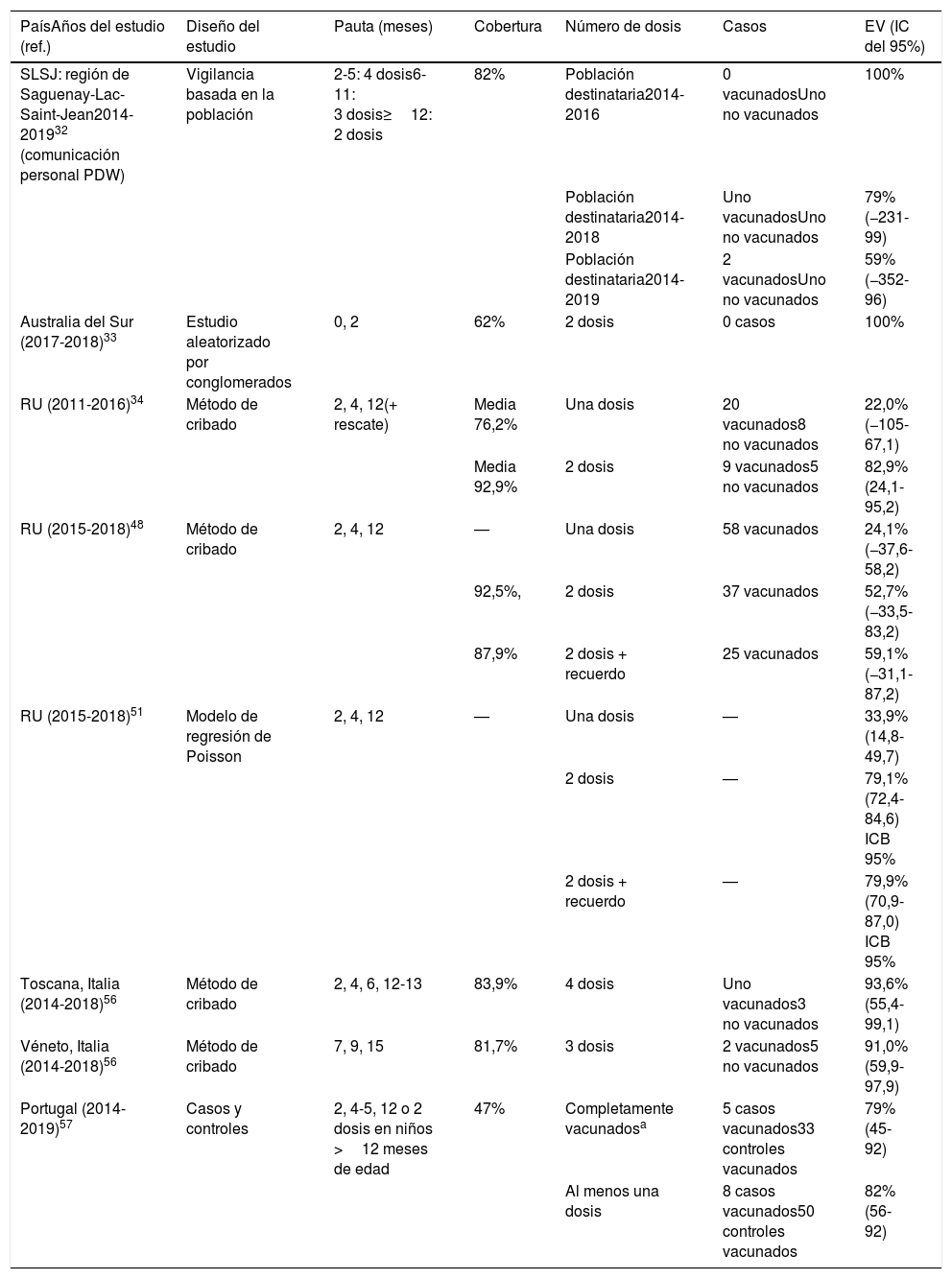
Estimaciones de la efectividad de la vacuna 4CMenB frente a la enfermedad meningocócica invasiva causada por el serogrupo B
| PaísAños del estudio (ref.) | Diseño del estudio | Pauta (meses) | Cobertura | Número de dosis | Casos | EV (IC del 95%) |
|---|---|---|---|---|---|---|
| SLSJ: región de Saguenay-Lac-Saint-Jean2014-201932 (comunicación personal PDW) | Vigilancia basada en la población | 2-5: 4 dosis6-11: 3 dosis≥12: 2 dosis | 82% | Población destinataria2014-2016 | 0 vacunadosUno no vacunados | 100% |
| Población destinataria2014-2018 | Uno vacunadosUno no vacunados | 79% (−231-99) | ||||
| Población destinataria2014-2019 | 2 vacunadosUno no vacunados | 59% (−352-96) | ||||
| Australia del Sur (2017-2018)33 | Estudio aleatorizado por conglomerados | 0, 2 | 62% | 2 dosis | 0 casos | 100% |
| RU (2011-2016)34 | Método de cribado | 2, 4, 12(+ rescate) | Media 76,2% | Una dosis | 20 vacunados8 no vacunados | 22,0% (−105-67,1) |
| Media 92,9% | 2 dosis | 9 vacunados5 no vacunados | 82,9% (24,1-95,2) | |||
| RU (2015-2018)48 | Método de cribado | 2, 4, 12 | — | Una dosis | 58 vacunados | 24,1% (−37,6-58,2) |
| 92,5%, | 2 dosis | 37 vacunados | 52,7% (−33,5-83,2) | |||
| 87,9% | 2 dosis + recuerdo | 25 vacunados | 59,1% (−31,1-87,2) | |||
| RU (2015-2018)51 | Modelo de regresión de Poisson | 2, 4, 12 | — | Una dosis | — | 33,9% (14,8-49,7) |
| 2 dosis | — | 79,1% (72,4-84,6) ICB 95% | ||||
| 2 dosis + recuerdo | — | 79,9% (70,9-87,0) ICB 95% | ||||
| Toscana, Italia (2014-2018)56 | Método de cribado | 2, 4, 6, 12-13 | 83,9% | 4 dosis | Uno vacunados3 no vacunados | 93,6% (55,4-99,1) |
| Véneto, Italia (2014-2018)56 | Método de cribado | 7, 9, 15 | 81,7% | 3 dosis | 2 vacunados5 no vacunados | 91,0% (59,9-97,9) |
| Portugal (2014-2019)57 | Casos y controles | 2, 4-5, 12 o 2 dosis en niños >12 meses de edad | 47% | Completamente vacunadosa | 5 casos vacunados33 controles vacunados | 79% (45-92) |
| Al menos una dosis | 8 casos vacunados50 controles vacunados | 82% (56-92) |
EV: efectividad vacunal; IC: intervalo de confianza, ICB: intervalo creíble bayesiano del 95%.
Resumen de las estimaciones de la efectividad vacunal en lactantes utilizando 4CMenB en diferentes entornos sanitarios
% ICB: intervalo creíble bayesiano del 95%; IC: intervalo de confianza del 95%; PNI: programa nacional de inmunización.
* 2 dosis en lactantes hasta los 16 meses de edad, 3 dosis después de los 16 meses de edad, 2 dosis en niños que iniciaron la vacunación después de los 12 meses.
La RR en personas no vacunadas 4 años después de la campaña fue de 0,48 (IC del 95%: 0,17-1,35; p=0,17), es decir, no respalda un efecto colectivo de la vacunación con 4CMenB y refuerza la necesidad de protección individual32. Aunque la enfermedad invasiva debida a MenB ST-269 no se había erradicado de la región de Saguenay-Lac-Saint-Jean, el programa selectivo de vacunación mostró una efectividad elevada para controlar el brote.
4CMenB confiere protección individual a los adolescentes en AustraliaAustralia del Sur ha experimentado una carga de enfermedad sostenida debida a la EMI por MenB, cuya tasa total de incidencia es de 2,8 por 100.000 habitantes de 0 a 25 años. La vacunación sistemática frente a MenB se introdujo en Australia del Sur en 201843. El programa consiste en un calendario continuado para lactantes y adolescentes con rescates (limitados en el tiempo) para niños y adultos jóvenes. Los lactantes con una edad de hasta 12 meses reciben 3 dosis de 4CMenB a las 6 semanas y a los 4 y 12 meses de edad, y los jóvenes de 15 años reciben 2 dosis de 4CMenB a través de programas de inmunización escolar, dejando un intervalo mínimo de 8 semanas entre las dosis29. Los programas de rescate (2 dosis con un intervalo mínimo de 8 semanas entre ellas) se llevaron a cabo en niños de 1 a 4 años y en jóvenes de 17 a 20 años durante aproximadamente 15 y 13 meses, respectivamente, y ya han finalizado43.
La cobertura de las cepas prevista por el sistema de tipificación de antígenos meningocócicos (MATS) en Australia del Sur alcanzó el 90%44. En un ensayo controlado y aleatorizado por conglomerados («B Part of It») realizado en Australia del Sur se obtuvo una evidencia convincente para responder a la pregunta de si 4CMenB surte impacto en la portación de N. meningitidis33. En un ensayo clínico anterior, realizado en RU con 2.954 personas de 18 a 24 años, se constató un impacto estadísticamente significativo, aunque limitado, de 4CMenB sobre la portación combinada de los grupos capsulares B, C, W e Y, 12 meses después de la vacunación45. El objetivo de «B Part of It» era determinar el efecto de 4CMenB en la prevalencia de la portación de N. meningitidis patógenos en una gran cohorte de adolescentes 12 meses después de recibir 4CMenB33. Se reclutó a un total de 34.489 estudiantes de secundaria y el tratamiento (2 dosis de 4CMenB) o el control (en este caso, los estudiantes recibieron 4CMenB después de la evaluar la portación orofaríngea a los 12 meses) se aleatorizaron por escuelas. En total, el 62% de los estudiantes de secundaria de entre 15 y 17 años de Australia del Sur recibió 4CMenB, lo cual permitió observar el impacto de la enfermedad33,46.
4CMenB careció de impacto en la portación orofaríngea de meningococos asociados a EMI por cualquier grupo capsular, incluido MenB. No se notificó ningún caso de EMI por MenB entre los adolescentes vacunados durante el periodo de prueba (2017-2018) frente a los 12 casos en jóvenes de 15-18 años del año anterior (2015-2016)33. En el periodo posvacunal se observaron unos 15 casos (IC del 95%: 3-19) menos de los esperados de EMI por MenB46.
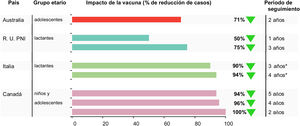
La vacunación redujo la EMI por MenB de manera significativa en un 71% (IC del 95%: 15-90) en la población destinataria (fig. 2). Durante ese mismo periodo, el número de casos de EMI por MenB no se redujo en niños de 0 a 4 años, es decir, no se apreció impacto en la inmunidad de grupo46. Los datos subrayan la necesidad de una protección individual frente a la EMI por MenB.
A partir del 1 de julio de 2020 se ha actualizado el calendario de vacunación australiano para mejorar la protección frente a la enfermedad meningocócica. Se incorporará 4CMenB al PNI de los lactantes aborígenes y de las islas del Estrecho de Torres con un programa de rescate para los niños <2 años hasta 2023. La vacuna 4CMenB también se financia para todas las personas con deficiencia del complemento o asplenia funcional o anatómica30.
Impacto y efectividad de la vacunación sistemática de lactantes con 4CMenB en Reino UnidoReino Unido fue el primer país en incluir 4CMenB en el PNI para todos los lactantes a partir de septiembre de 201534. El programa utiliza una pauta 2+1 administrada a los 2, 4 y 12 meses de edad junto con otras vacunas sistemáticas habituales20,34. Se aconseja a los padres que administren 3 dosis consecutivas de paracetamol profiláctico a los lactantes cuando reciban las dosis 1 y 2 de la vacuna47.
Durante los 3 primeros años del programa, la incidencia de la EMI por MenB se redujo en un 75% en los niños que totalmente elegibles para la vacunación, como lo refleja la razón ajustada entre las tasas de incidencia (RTI) de 0,25 (IC del 95%: 0,19-0,36)48 (tabla 2). El número de casos observados en las cohortes elegibles para la vacunación resultó un 62% inferior al esperado y en los 3 primeros años del programa se previnieron 277 casos de EMI por MenB48 o un caso aproximadamente cada 4 días. Cuatro años después del inicio del programa, esta tendencia se ha mantenido49. La RTI ajustada de la EMI por MenB ha experimentado descensos significativos hasta 2 años después del recuerdo en las cohortes elegibles para la vacunación (0,43; IC del 95%: 0,25-0,74), lo cual se traduce en una reducción continuada del 57% de la incidencia de la enfermedad tras la vacunación de recuerdo48.
La EV se evaluó por el método de cribado indirecto, comparando los casos entre niños vacunados con todos los niños elegibles para recibir 4CMenB. La EV se estimó para los niños nacidos a partir del 1 de julio de 2015 y no incluyó a los que habían sido vacunados durante la campaña inicial de rescate; se efectuó un ajuste por los cambios en la incidencia de la EMI por MenB en los niños de <5 años. La cobertura de una dosis de 4CMenB en 2018 se aproximó al 95%, y el 87,9% había recibido la dosis de recuerdo. La EV de 2 dosis de 4CMenB fue del 52,7% (IC del 95%: −33,5-83,2) y la EV de 3 dosis de 4CMenB alcanzó el 59,1% (IC del 95%: −31,1-87,2)48 (fig. 1).
La EV estimada en este estudio fue menor que la inicial después de los 10 primeros meses del programa (82,9%, IC del 95%: 24,1-95,2)34, posiblemente por el número más bajo de casos en la cohorte no vacunada y la falta de poder estadístico, lo cual sugiere que se pueden utilizar otros métodos de modelación para obtener estimaciones más precisas de la EV en este contexto)48,50,51. La nueva estimación de la EV con un modelo de regresión de Poisson de la incidencia de MenB basada en datos reales reveló una EV de 4CMenB del 79,1% (intervalo creíble bayesiano del 95%: 72,4-84,6) con 2 dosis y del 79,9% (intervalo creíble bayesiano: 70,9-87,0) con 3 dosis51, que se asemeja más a las medidas anteriores de impacto.
Efectos distintos de MenB: Potencial protección de 4CMenB frente a la enfermedad meningocócica invasiva por el serogrupo W (MenW) en Reino UnidoLa cepa hipervirulenta del serogrupo W ST-11 de N. meningitidis ha hecho que aumenten los casos de EMI por MenW en algunos países, incluido RU52. En RU se implementó en 2015 un programa de vacunación de emergencia de adolescentes frente a la enfermedad por MenW con vacunas conjugadas MenACWY casi al mismo tiempo que el programa de vacunación de lactantes con 4CMenB53. En una de las primeras publicaciones sobre el efecto del programa de vacunación MenACWY frente a la enfermedad por MenW en Inglaterra se descubrió que el número de casos de EMI por MenW había aumentado de 2014-2015 a 2015-2016 en todos los grupos de edad, excepto en el grupo etario destinatario de la vacunación MenACWY (jóvenes de 15 a 19 años, en quienes se observó una reducción del 31% de los casos) y en los lactantes menores de un año a quienes se destinó la vacunación 4CMenB (se observó un descenso de los casos del 35%)53. La vigilancia de la EMI por MenW 4 años antes y después de la implementación del programa de vacunación con 4CMenB evidenció un 69% menos de los casos esperados de EMI por MenW en las cohortes de lactantes completamente elegibles para 4CMenB. El programa 4CMenB previno 98 casos de EMI por MenW en lactantes y niños pequeños durante los 4 primeros años54. Estas observaciones se corroboraron en dos estudios in vitro; los niveles elevados de actividad bactericida frente a 6 aislados clínicos de MenW de Inglaterra y Gales en sueros de personas vacunadas con 4CMenB sugieren una reactividad cruzada debida a las proteínas de superficie comunes a ambos serogrupos52. En un estudio con sueros de lactantes vacunados con 4CMenB se apreció una actividad bactericida del 74% de un panel de aislados clínicos de MenC, MenW y MenY que representaban una serie de complejos clonales55.
Efectividad e impacto de la vacuna 4CMenB en Italia4CMenB se autorizó en Italia en 2013, y se implementó en el PNI para lactantes en 2017. Con anterioridad, la política de vacunación se decidía y aplicaba a nivel regional; esto permitía evaluar la EV y el IV de las diferentes pautas utilizadas en entornos sanitarios similares. Toscana introdujo 4CMenB y la financió en la región a partir de 2014 como pauta de 4 dosis para lactantes (se administran a los 2, 4, 6 y 12-13 meses de edad). La cobertura media a los 24 meses fue del 83,9% entre 2016 y 2019. Véneto, en cambio, introdujo la vacunación 4CMenB a partir de 2015 y la financió en la región para lactantes de más edad como pauta de 3 dosis (se administran a los 7, 9 y 15 meses de edad). La cobertura media a los 24 meses fue del 81,7% entre 2017 y 201956.
Entre 2014 y 2019 se produjeron en Toscana 4 casos de EMI por MenB en niños de hasta 5 años; un caso en un niño vacunado que había recibido 2 dosis, y 3 en niños no vacunados, lo cual supone una EV estimada del 93,6% (IC del 95%: 55,4-99,1) (tabla 3). Entre 2014 y 2019 se produjeron 7 casos de EMI por MenB en niños de hasta 5 años en el Véneto; 2 casos en niños vacunados y 5 en niños no vacunados, lo cual supone una EV estimada del 91,0% (IC del 95%: 59,9-97,9)56 (fig. 1).
Aunque las estimaciones de la EV se asemejaron en ambas regiones, la RTI antes y después de 4CMenB reveló un descenso (estadísticamente significativo) en la incidencia de la enfermedad del 68% en Toscana, donde el programa de vacunación comenzó en la fase inicial de la lactancia (RTI: 0,32 [IC del 95%: 0,12-0,91]) frente al 31% (no significativo) en Véneto (RTI 0,69 [IC del 95%: 0,31-1,56]) (tabla 2). En cambio, cuando se tuvo en cuenta el estado de vacunación, la evaluación de la incidencia de la enfermedad en los cohortes vacunados mostró reducciones significativas en ambas regiones que resultaron, como era de esperar, similares a las EV estimadas; 94% (IC del 95%: 56-99) en Toscana y 90% (IC del 95%: 57-97) en Véneto56 (fig. 2).
Efectividad de la vacuna 4CMenB en un estudio de casos y controles en PortugalPortugal autorizó 4CMenB en 2013, pero inicialmente no recibió financiación pública. Pese a no estar incluida en el programa nacional de inmunización, la Sociedad Portuguesa de Pediatría recomendó la vacunación de lactantes con 4CMenB y los padres la aceptaron de manera entusiasta. La cobertura con al menos 2 dosis de 4CMenB aumentó del 32,8% en la cohorte natal de 2015 al 56,7% en la cohorte de 2018. En octubre de 2020 se introdujo 4CMenB en el PNI para lactantes27.
La EV se estimó en un estudio de casos y controles realizado en 31 hospitales pediátricos de todo Portugal entre octubre de 2014 y marzo de 2019. Los casos eran niños con EMI confirmada por el laboratorio de entre al menos 74 días y menos de 18 años. Se asignaron controles (niños sin EMI que habían acudido al mismo hospital, normalmente 2 por caso) a cada caso y se los emparejó por fecha de nacimiento, zona de residencia, sexo y fecha de asistencia al hospital.
Durante el periodo de estudio se notificaron 117 casos de EMI, de los cuales 82 (70%) se debieron a MenB. Hubo 69 casos de MenB con una edad suficiente para haber sido completamente inmunizados. La edad mediana de todos los casos de MenB fue de 17,5 meses (intervalo intercuartílico: 6,2-43,6). La EV frente a la EMI por MenB fue del 79% (IC del 95%: 45-92) en los niños completamente vacunados y del 82% (IC del 95%: 56-92) en los que habían recibido al menos una dosis de 4CMenB (tabla 3, fig. 1)57. Estas estimaciones se complementaron con análisis de sensibilidad que incluían una estratificación por clase socioeconómica, la estimación de la EV por el método de cribado y la estimación de la EV tras la exclusión de la ventana de respuesta inmunitaria de los 14 días. La EV observada en el estudio de casos y controles era mayor que la cobertura de cepas predicha por MATS (67,9% para aislados durante 4 años de 2011 a 201558).
No se registraron muertes ni secuelas a largo plazo entre los casos vacunados, mientras que entre los 87 casos no vacunados hubo 7 muertes (8%) y 16 niños con secuelas (18%).
Estimación del impacto de la vacuna 4CMenB en España4CMenB está comercializada en España desde 2013 y la Asociación Española de Pediatría recomienda la vacunación frente a MenB de los lactantes. Pese a no estar incluida en el PNI ni contar con una financiación pública, se ha logrado una cobertura modesta con 4CMenB. La cobertura de 2 dosis de 4CMenB en los lactantes nacidos en 2015-2016 se estimó en un 34% (con diferencias regionales: hasta un 59% de cobertura en Galicia y un 55% en Castilla y León)15.
El impacto de 4CMenB en España se estimó comparando el número de casos del periodo prevacunal de 2013-2014 con el del período posvacunal de 2017-2018. El número de casos de EMI por MenB disminuyó un 41,7% en los niños de 0 a 5 meses y un 65,4% en los de 6 a 11 meses15. Estas observaciones alentadoras iniciales se están investigando de manera más sistemática en un estudio de casos y controles en España15.
4CMenB está incluida en los programas de vacunación de Castilla y León y Canarias desde 2019 y se ha anunciado su inclusión en el programa de vacunación de Andalucía en 202028.
Experiencia de seguridad con 4CMenB en el mundo realDurante la vigilancia de seguridad en los países, donde 4CMenB se ha utilizado mucho, se comunicó que los acontecimientos adversos tras la vacunación con 4CMenB se correspondían con el perfil conocido de seguridad descrito en los ensayos clínicos59–63. No han surgido problemas de seguridad durante la vigilancia de diversos grupos de edad, países, calendarios y uso en los PNI y en la lucha contra los brotes. Los datos se basan en la administración de más de 3 millones de dosis de 4CMenB a lactantes de RU64,65; la vacunación de unos 30.500 adolescentes de Australia del Sur66; la vigilancia pasiva en Australia tras su comercialización67; la vigilancia tras su implementación en brotes universitarios en EE. UU.68; y la vigilancia posterior a la comercialización en Italia60 y Alemania69. Durante la vigilancia poscomercialización en RU no se halló evidencia alguna de un mayor riesgo de convulsiones, convulsiones febriles o enfermedad de Kawasaki tras la vacunación con 4CMenB64,65. No se detectaron señales de seguridad de mediación inmunitaria o neurológica durante la vigilancia poscomercialización en Alemania69.
Al principio, se identificó una posible señal de seguridad en la región de Saguenay-Lac-Saint-Jean, donde se notificaron 4 casos de síndrome nefrótico en niños de 2 a 5 años en los 13 meses siguientes a la administración de la primera dosis de 4CMenB70. La incidencia del síndrome nefrótico en niños de uno a 9 años fue de 16,3 por 100.000 personas/año durante este periodo y la tasa de ingreso se elevó de manera significativa en comparación con el periodo prevacunal (RR: 7,65; IC del 95%: 1,02-57,09)70. Esta posible señal se investigó más a fondo en una cohorte sustancialmente mayor analizando los ingresos por síndrome nefrótico antes y después de la introducción de 4CMenB en RU. Los resultados no aportaron ninguna evidencia de un mayor riesgo en RU71. Los síntomas del síndrome nefrótico pueden ser inicialmente leves y pasar desapercibidos, lo cual impide una evaluación exacta de la relación temporal con la vacunación. Esto, sumado a la falta de casos de síndrome nefrótico registrados en otros países y a la ausencia de un mecanismo causal biológicamente plausible, hace pensar que los casos observados en la región de Saguenay-Lac-Saint-Jean ocurrieron por casualidad70.
DiscusiónLa eficacia de las vacunas dirigidas a enfermedades poco frecuentes solo puede medirse, en general, después de su autorización y aplicación generalizada. En el caso de 4CMenB, se dispone ahora de estimaciones de la EV en 5 países, obtenidas durante su uso sistemático financiado en RU e Italia, en un entorno sanitario no financiado en Portugal, en un estudio observacional en Australia y en un entorno de control de brotes en la región de Saguenay-Lac-Saint-Jean, Canadá (tabla 3). La EV de al menos 3 dosis de 4CMenB en lactantes osciló entre el 59,1 y el 93,6% y resultó casi siempre superior a las tasas de cobertura de cepas predichas mediante MATS. La vacunación 4CMenB para el control del brote de Quebec conllevó una EV del 100% en niños y adolescentes (de 2 meses a 20 años) en los 2 primeros años después de la vacunación; la EV se mantuvo durante 4 años. Los datos de la vacunación sistemática de lactantes con 4CMenB en RU indican que la EV se mantiene durante 2 años después del recuerdo en niños pequeños vacunados en la lactancia32,48.
El impacto de 4CMenB en las tasas de incidencia de la EMI por MenB se demostró tras la vacunación de lactantes en RU, Italia y España, así como en niños/adolescentes/adultos jóvenes durante los brotes prolongados en la región de Saguenay-Lac-Saint-Jean y Australia del Sur (tabla 2). El impacto de la vacunación en brotes, como los ocurridos en las universidades de EE. UU., es mucho más difícil de medir debido al reducido número de casos. Sin embargo, la ausencia de casos intercurrentes tras implementar la vacunación indica un IV. Se sigue acumulando evidencia sobre el impacto de 4CMenB para el control de brotes. El brote de 5 casos de MenB ocurrido en Francia en 2016-2017, en una escuela de secundaria y un instituto de bachillerato, se abordó mediante una campaña de vacunación con 4CMenB en los 2 centros, así como de los jóvenes convivientes de 11 a 19 años72. No se notificaron nuevos casos tras la campaña de vacunación.
El perfil de seguridad de 4CMenB en el mundo real parece idéntico al de los ensayos clínicos previos a su autorización. No han surgido problemas de seguridad durante la vigilancia posterior a la comercialización.
El volumen uniforme, sustancial y creciente de la evidencia extraída del mundo real respalda la efectividad y el impacto de 4CMenB en la prevención de la EMI por MenB en lactantes y adolescentes. La capacidad de 4CMenB para prevenir la enfermedad gonocócica en los jóvenes justifica que se siga investigando la utilidad de 4CMenB en los adolescentes73.
Desde su autorización en 2013, se dispone de experiencia real con 4CMenB en numerosos países, grupos de edad, pautas y entornos sanitarios. Ahora disponemos de respuesta a algunos de los interrogantes planteados en el momento de la autorización acerca de la implementación de 4CMenB. Los estudios presentados aquí ofrecen respuestas detalladas y uniformes a las cuestiones fundamentales de efectividad, impacto y seguridad; revelan que 4CMenB previene de manera efectiva la EMI por MenB en las personas vacunadas, reduce la incidencia de la enfermedad en las poblaciones y cuenta con un perfil de seguridad coherente con el descrito en los ensayos clínicos. La evidencia del mundo real indica que 4CMenB reduce la EMI por MenB en personas con una edad de 2 meses a 20 años y surte un impacto sustancial en la EMI por MenB observada en RU, Australia, Italia, Portugal, Quebec y en los centros universitarios de EE. UU.32,34,37–39,41,46,48,56. Las EV estimadas en cada uno de estos países resultaron en general más altas que las predicciones tentativas de cobertura de las cepas MenB basadas en métodos como MATS, que oscilaron entre el 66 y el 91%46.
Hasta la fecha, ni 4CMenB ni MenB-fHbp han ofrecido evidencia de un efecto sobre la portación de meningococos32,33,74,75, lo cual lleva a pensar que esta es una característica común a las vacunas MenB basadas en proteínas. La experiencia de Italia indica que la vacunación temprana de los lactantes tiene un mayor impacto en la reducción de los casos de EMI por MenB que la vacunación diferida hasta la edad de 7 meses56. En conjunto, estos hallazgos revisten implicaciones programáticas importantes. Es probable que la efectividad de 4CMenB aumente si se administra directamente a los grupos etarios de alto riesgo. Por tanto, la vacunación 4CMenB debe aplicarse antes del inicio del periodo de máximo riesgo, que en la mayoría de los países corresponde a la franja de lactantes y niños pequeños1. Esto contrasta con las vacunas meningocócicas conjugadas que inducen efectos de rebaño poderosos76 e interrumpen la transmisión gracias a la vacunación de adolescentes, el grupo con las tasas de portación más altas77.
4CMenB también muestra un impacto estadísticamente significativo en la prevención de la EMI por MenW54. El impacto potencialmente más amplio de 4CMenB sobre la enfermedad distinta a MenB o a MenW aún no se ha cuantificado. Especial interés revestiría averiguar si 4CMenB también previene las infecciones por N. gonorrhoeae, que comparte con MenB una homología genética del 80-90%78. En Nueva Zelanda se observó un descenso del número de casos de gonorrea tras una campaña en la que se utilizó una vacuna de vesículas de la membrana externa (idéntica a un componente de 4CMenB), al igual que en la región de Saguenay-Lac-Saint-Jean tras la campaña de vacunación descrita con anterioridad (no alcanzó significación estadística posiblemente por el número reducido de casos)79,80. En un estudio retrospectivo de casos y controles en Nueva York y Filadelfia, la vacunación con 4CMenB se asoció a una probabilidad significativa menor de gonorrea y la efectividad vacunal estimada resultó del 36% (IC del 95%: 23-52)81. Estos estudios aportan información esencial que amplía nuestro conocimiento sobre los posibles beneficios adicionales de la vacuna 4CMenB.
En los próximos años cabe esperar una mayor implementación de 4CMenB en los PNI, la obtención de datos de efectividad a largo plazo para orientar la necesidad de dosis de recuerdo, un conocimiento posiblemente mayor de la contribución de los diferentes componentes de 4CMenB a la protección conferida, la acumulación continua de experiencia en materia de seguridad y un desarrollo perfeccionado de vacunas pentavalentes (MenABCWY) que permitirían prevenir la infección y mejorar la cobertura de todos los principales serogrupos patógenos82.
En conclusión, la EMI causada por MenB es una enfermedad poco frecuente, pero que pone en peligro la vida, con secuelas potencialmente graves y una tasa de letalidad alta. La epidemiología es imprevisible debido a la evolución de las cepas y a la posibilidad de brotes. En el momento del registro se advirtió cierta reticencia a implementar una vacuna frente al MenB en los programas nacionales, dada la ausencia inicial de datos, de evidencia de protección a largo plazo y del impacto presupuestario. Desde entonces, se ha obtenido una evidencia clara sobre la protección inducida por 4CMenB frente a la EMI por MenB en diferentes grupos etarios y entornos sanitarios. Los resultados subrayan la importancia de la protección directa de los grupos con mayor riesgo: lactantes/niños pequeños y adolescentes. La protección directa a través de la inmunización sistemática de los lactantes con rescate de los niños pequeños y la vacunación sistemática de adolescentes podrían constituir la opción preferida para luchar contra la enfermedad por MenB.
Declaración sobre marcas comercialesBexsero es una marca comercial perteneciente al grupo de compañías GSK o licenciada por este grupo. Trumenba es una marca comercial de Pfizer Inc.
FinanciaciónGlaxoSmithKline Biologicals SA financió todos los costes asociados al desarrollo y publicación de este manuscrito.
Participación de la fuente de financiaciónGlaxoSmithKline Biologicals SA participó en la redacción del manuscrito y en la decisión de presentar el artículo para su publicación.
Conflicto de interesesAB, MP, RR y RBB son empleados del grupo de empresas GSK y poseen acciones como parte de su remuneración como empleados. El centro donde trabaja HM recibe financiación de GSK, Pfizer y Sanofi-Pasteur para los estudios dirigidos por investigadores. PDW recibió ayudas de investigación de GSK, Pfizer y Sanofi no relacionadas con este trabajo. RM ha recibido ayudas de GSK para estudios dirigidos por investigadores no relacionados con este trabajo. FM-T ha recibido honorarios de GSK, Pfizer Inc., Sanofi Pasteur, MSD, Seqirus, Novavax y Biofabri y Janssen por su participación en consejos asesores y reuniones de expertos, y por su actuación como ponente en congresos fuera del ámbito del trabajo presentado. FM-T también ha actuado como investigador principal en ensayos controlados y aleatorizados de las empresas mencionadas con anterioridad, excepto Biofabri, así como Ablynx, Regeneron, Novartis y MedImmune, y su institución sanitaria ha recibido honorarios con este motivo; el autor declara subvenciones de AstraZeneca fuera del ámbito del trabajo presentado. FM-T recibe ayuda del Instituto de Salud Carlos III para actividades de investigación (Proyecto de Investigación en Salud, Acción Estratégica en Salud): Fondo de Investigación Sanitaria (FIS; PI070069/PI1000540/PI1601569/PI1901090) del plan nacional de I+D+I y «fondos FEDE». CA no declara ningún conflicto de intereses. Todos los autores declaran no tener ningún conflicto de intereses no financiero.
Este manuscrito se corresponde con la versión traducida del manuscrito original publicado en Journal of Infection (DOI: 10.1016/j.jinf.2021.04.031).
Los autores agradecen a la plataforma Modis la asistencia editorial y la coordinación del manuscrito en nombre de GSK. Joanne Wolter se encargó de la redacción y Divya Kesters del apoyo editorial y de la gestión de la publicación. Los autores también expresan su agradecimiento a Business & Decision Life Sciences por la ayuda con el diseño de las animaciones digitales en nombre de GSK.
La traducción ha sido hecha por Traducciones Medicas Internacionales Dr. Navascues SL a solicitud de Carmen Gonzalez en nombre de GSK. Diego Collin (Business & Decision Life Sciences, en nombre de GSK) ha coordinado la traducción del manuscrito y el apoyo editorial.
Este articulo fue publicado originalmente en inglés por la revista Journal of Infection https://doi.org/10.1016/j.jinf.2021.04.031 y cuenta con el permiso correspondiente para la traducción y publicación en Vacunas.