AVANCES EN EL CONOCIMIENTO GENÉTICO Y MOLECULAR DEL SAHS
F. Barbé, A. Barceló y M. de la Peña*
Unidad de Sueño. Servicio de Neumologia. Hospital Universitario Son Dureta. Palma de Mallorca. España.
*Financiado por FIS expte. CM0300049.
Correspondencia: F. Barbé. Unidad de Sueño. Servicio Neumología. Hospital Universitario Son Dureta. 07014 Palma de Mallorca. España.
El síndrome de apneas-hipopneas del sueño (SAHS) es un trastorno complejo, determinado por múltiples genes, influencias ambientales y factores de desarrollo. Los genes específicos que influyen en el desarrollo de SAHS no se han identificado, aunque hay evidencia de una base genética en la expresión de la enfermedad. Dicha hipótesis se ve reforzada por el hecho de que se ha demostrado que en este síndrome existe una agregación familiar. La mayoría de estudios asimilan el índice de apneas-hipopneas del sueño (IAH) como principal fenotipo del SAHS, ya que es la principal variable que define la enfermedad. Sin embargo, existe gran variabilidad en la definición de los episodios respiratorios que establecen el IAH entre laboratorios; además, el hecho de no mostrar relación con la gravedad de los síntomas adolece de uniformidad en cuanto a su relación con las consecuencias funcionales e impacto fisiopatológico. Las características craneofaciales, el control ventilatorio, la actividad simpática, la laxitud del tejido conectivo o la obesidad central serían fenotipos que se deben tener en cuenta al indagar sobre las bases genéticas del SAHS. Asimismo, otro grupo de genes, los que controlan la actividad metabólica y/o biológica, estarían implicados en la expresión clínica y repercusiones (sobre todo cardiovasculares) de los pacientes con SAHS.
Los mecanismos celulares y moleculares implicados en la etiopatogenia de las complicaciones relacionadas con el SAHS son poco conocidos. Este síndrome se ha asociado a alteraciones en el metabolismo de diferentes proteínas, hormonas, citocinas y neuropéptidos que intervienen en el control del peso corporal, la regulación del sueño, la inflamación y el riesgo cardiovascular. Estos posibles mediadores biológicos se han relacionado con la expresión clínica y/o con las complicaciones del SAHS, y es probable que determinados genes relacionados con los principales factores de riesgo (obesidad, sexo, morfología craneofacial) influyan en la expresión y la síntesis de estos marcadores. Una revisión crítica sobre el tema indica que existen diversas alteraciones bioquímicas que pueden desempeñar un papel patogénico relevante. Entre ellas destacan las siguientes:
1. La obesidad se asocia con frecuencia al SAHS. Se ha sugerido la existencia de un síndrome metabólico que incluye conjuntamente la obesidad y el SAHS, en el que quizá podrían participar factores genéticos que modulasen simultáneamente la biología del adipocito y el control ventilatorio. La coexistencia de SAHS y obesidad favorecería el desarrollo de otros factores de riesgo cardiovascular (síndrome Z: SAHS, obesidad, hipertensión arterial, dislipemia y resistencia insulínica).
2. Los pacientes con SAHS presentan valores elevados de leptina en sangre. La leptina es una hormona sintetizada en el tejido adiposo, que interviene en el control del peso corporal, a la que recientemente se han atribuido también importantes efectos fisiológicos sobre el control de la respiración. No se conoce el papel de la leptina en el SAHS, pero la disminución observada de los valores plasmáticos tras el tratamiento con presión positiva continua en la vía aérea (CPAP), sugiere que el SAHS puede ser un inductor de la síntesis de esta hormona.
3. La leptina interactúa en hipotálamo con 2 neuropéptidos descubiertos recientemente, el neuropeptido Y y las orexinas, a su vez implicados en el control de la conducta nutritiva y la regulación del sueño. Por otra parte, el neuropéptido Y también se libera en las terminaciones del sistema nervioso simpático, y sus valores plasmáticos están relacionados con la actividad de dicho sistema. Actualmente, no se dispone de información acerca del papel que pueden desempeñar estos neuropéptidos en el SAHS, pero los resultados experimentales indican que su actividad puede ser relevante en la patogenia de esta enfermedad.
4. En relación con las citocinas, se ha observado que en pacientes con SAHS hay un aumento en la concentración plasmática de interleucina (IL) 6, y una alteración en el ritmo circadiano de secreción del factor de necrosis tumoral α(TNF-α). Se ha sugerido que estas alteraciones podrían constituir la base biológica de la somnolencia diurna y la fatiga asociadas al SAHS. Sin embargo, hay que tener en cuenta que el tejido adiposo contribuye significativamente en la síntesis de IL-6 y TNF-α, y no se ha explorado la posible relevancia de estas citocinas en pacientes con SAHS no obesos ni en pacientes sin somnolencia. La IL-6 y la TNF-αinducen la síntesis hepática de proteína C reactiva (PCR), un marcador de inflamación y un factor de riesgo independiente de patología cardiovascular. No se dispone de estudios sobre el papel que puede desempeñar la PCR (y, en general, la inflamación sistémica) en el SAHS, ni su relación con las complicaciones cardiovasculares de estos pacientes.
5. El SAHS representa un factor de riesgo cardiovascular. Disponemos de evidencias acerca de un posible papel aterogénico atribuible a las alteraciones respiratorias de estos pacientes, a través de diferentes mecanismos: aumento de actividad del sistema nervioso simpático, disfunción endotelial con alteraciones en la expresión de moléculas de adhesión (ICAM-1, P-selectina), síntesis de factores quimiotácticos y de crecimiento (factor de crecimiento trofoblástico [TGF] α, factor de crecimiento derivado de las plaquetas [PDGF]), pérdida del tono vascular (desequilibrios entre factores vasoconstrictores (endotelina-1, angiotensina-II, tromboxanos) y vasodilatadores (prostaciclina, óxido nítrico), aumento en la oxidación de lipoproteínas, valores de homocisteína elevados y desequilibrios en el sistema de la coagulación (agregación plaquetaria aumentada, disminución de la actividad fibrinolítica). Por otra parte, en la actualidad, también tiende a considerarse la enfermedad cardiovascular como un proceso inflamatorio que, en respuesta a diversos estímulos, favorece el desarrollo de la placa arterioesclerótica. Es posible que el SAHS pueda contribuir a dicha respuesta a través de mediadores proinflamatorios (IL-6, TNF-α) aunque, como se ha comentado antes, en estos momentos la posible relación entre la inflamación, el SAHS y las complicaciones cardiovasculares no se ha explorado y es especulativa.
En resumen, las bases biológicas implicadas en a) la expresión clínica del SAHS, y b) las complicaciones vasculares asociadas a éste son poco conocidas. Los estudios realizados hasta la fecha (pocos) presentan limitaciones metodológicas importantes (número reducido de sujetos incluidos, falta de control de factores de confusión, falta de caracterización fenotípica adecuada) y no permiten establecer conclusiones firmes. El desarrollo de nuevas alternativas terapéuticas requiere ineludiblemente un conocimiento más profundo de las bases celulares y moleculares del SAHS, para lo que se precisan estudios que eviten todas estas limitaciones.
BIBLIOGRAFÍA
Barceló A, Barbé F, Bosch M, Ladaria A, Pons S, Agustí AGN. Influence of obesity upon c-reactive protein and metabolic disturbances in patients with sleep apnea syndrome [en prensa]. Am J Med 2004.
Barceló A, Llompart E, Barbé F, Morla M, Vila M, Agusti AG. Plasminogen activator inhibitor-I (PAI-I) polymorphisms in patients with obstructive sleep apnoea. Respir Med 2002;96:193-6.
Barceló A, Miralles C, Barbé F, Vila M, Pons S, Agustí AGN. Abnormal lipid peroxidation in patients with sleep apnea. Eur Respir J 2000;16:644-7.
Barceló A, Miralles C, Barbé F, Vila M, Pons S, Agustí AGN. Abnormal lipid peroxidation in patients with sleep apnea. Eur Respir J 2000;16:644-7.
Beck B, Richy S, Dimitrov T, Stricker-Krongrad A. Opposite regulation of hypothalamic orexin and neuropeptide Y receptors and peptide expressions in obese Zucker rats. Biochem Biophys Res Commun 2001;286:518-23.
Chin KZ, Shimizu K, Nakamura T, Narai N, Masuzaki H, Ogawa Y. Changes in intra-abdominal visceral fat and serum leptin levels in patients with obstructive sleep apnea syndrome following nasal continuous positive airway pressure therapy. Circulation 1999;100:706-12.
Redline S, Tishler PV. The genetics of sleep apnea. Sleep Med Rev 2000;4:583-602.
Redline S, Tosteson T, Tishler PV, Carskadon MA, Millman RP. Familial agregation of symptoms associated with sleep-related breathing disorders. Am Rev Respir Dis 1992;145:440-4.
Vgontzas AN, Papanicolaou DA, Bixler EO, Hopper K, Lotsikas A, Lin HM. Sleep apnea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance and hypercytokinemia. J Clin Endocrinol Metab 2000;85:1151-8.
Wilcox I, McNamara SG, Collins FL, Grunstein RR, Sullivan CE. "Syndrome Z": the interaction of sleep apnoea, vascular risk factors and heart disease. Thorax 1998;53:S25-8.
TRATAMIENTO DEL SÍNDROME DE APNEAS DURANTE EL SUEÑO. AVANCES
J.M. Montserrat
Unidad Multidiciplinaria de Patologia del Sueño. Hospital Clínic. Barcelona. España.
Durante los últimos años se ha concedido una gran relevancia al síndrome de las apneas hipopneas obstructivas durante el sueño (SAHS) por su elevada prevalencia, sus enfermedades asociadas, su morbilidad e incluso su mortalidad. Además, los pacientes no tratados generan un considerable incremento de gasto sanitario, a pesar de los costes que genera toda la metodología de diagnóstico y tratamiento. El tratamiento es imprescindible porque revierte la mayoría de síntomas. No está clara la actitud que se debe tomar en los pacientes roncadores con un número de apneas/hipopneas durante el sueño elevado, pero sin otra sintomatología. De las diferentes opciones terapéuticas, se considera que la presión positiva continua de la vía aérea (CPAP) es el tratamiento de elección, junto al tratamiento de la obesidad asociada.
El tratamiento del SAHS descansa en los siguientes pilares: la medidas higienodietéticas del sueño, que siempre deben de aplicarse inicialmente de un modo obligatorio, el tratamiento de la obstrucción nasal, si existe, y la CPAP. La cirugía maxilomandibular o la de partes blandas sólo son útiles en casos seleccionados que muestren anomalías precisas. Las prótesis dentales están emergiendo durante los últimos años y son útiles en un porcentaje valorable de casos, también especialmente elegidos. En general, el tratamiento del SAHS se podría decir que es "blanco o negro", es decir, CPAP o no. Aunque esto es real, no deja de ser un poco simplista. El médico debe: a) conocer la enfermedad del sueño en general, aunque sea sólo para el diagnóstico diferencial de la somnolencia o para tratar los casos no graves de otras enfermedades del sueño (piernas inquietas, etc.); b) saber valorar la función nasal, iniciar si procede el tratamiento para mejorarla y conocer cuándo debe remitir al paciente al ORL; c) saber valorar y tratar, al menos inicialmente, la obesidad no mórbida, y d) conocer los aspectos básicos de las prótesis bucales. De este modo, el tratamiento será integral, o sea, mejor
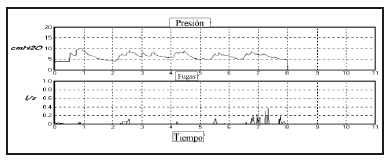
La CPAP consiste en la aplicación de una presión positiva constante en la vía aérea superior (fig. 1). Siempre existe una fuga controlada, que evita la rehinalación. En el SAHS, la CPAP actúa como una válvula neumática, de modo que eleva la presión intraluminal en la vía aérea superior hasta el punto que impide su colapso estático y dinámico. Cada paciente precisa una presión determinada de CPAP, por lo que ésta debe determinarse individualmente, mediante un estudio nocturno. En la actualidad, existen las CPAP automáticas o inteligentes, que adaptan la presión generada a la presencia de episodios respiratorios, de modo que el paciente recibe en cada momento la presión necesaria para normalizar el flujo durante la noche. Obviamente no hace falta realizar estudios nocturnos para su utilización como tratamiento y son probablemente las que se utilizarán en un futuro muy cercano. En la figura 2 se muestran la variaciones de la presión que acontecen automáticamente durante la noche. Las CPAP automáticas pueden utilizarse en dos sentidos: a) como tratamiento, y así se evita la medición de la presión durante la noche, y b) como sistema para medir la presión de CPAP fija que el paciente precisa. Par ello, se procede a analizar la curva de presión que muestra la figura 2. La presión que cubre el 80-90% de la curva de presión es la presión fija recomendada. Se excluyen los períodos de fuga intensa o las subidas muy rápidas en pico de presión. En el caso de la figura 2 el paciente precisará 8-9 cmH2O. Aparte de que la CPAP automática evita una noche de estudio no existen diferencias de eficacia en el tratamiento del SAHS entre la CPAP automática y la fija. La automática es más cara y no la suministra la Seguridad Social.
Figura 1. Utilización de la presión positiva continua en la vía aérea (CPAP). Produce una dilatación de la vía aérea superior y, además, impide su colapso.
Figura 2. Ejemplo de la oscilación de la presión positiva continua en al vía aérea (CPAP) durante la noche como consecuencia de la utilización de una CPAP automática. El espacio entre las rayas verticales representa una hora. Si en este caso se quisiera medir la CPAP fija que el paciente precisa seria de 8-9 cmH2O porque cubre prácticamente toda la noche. La parte superior representa la presión que oscila, atendiendo al carácter automático de la CPAP, y la parte inferior representa las fugas. Una medición del valor de CPAP con fugas notorias no es valorable.
Existen varios sistemas para adecuar el valor de CPAP. El clásico es a través de una polisomnografia convencional, llamado a noche partida (mitad diagnóstico y mitad medición del valor de CPAP [split-night]), mediante sistemas automáticos o a través de formulas predictoras. En la actualidad se considera que, en la mayoría de pacientes, a través de una CPAP automática se puede conocer la presión óptima de CPAP fija. Se puede realizar en casa o en el hospital. Es muy importante tener en cuenta los siguientes puntos: a) adecuada indicación del tratamiento con CPAP; b) adecuada preparación del paciente, y c) adecuado control y seguimiento.
La titulación con polisomnografía convencional es el método clásico, aunque tiene una eficacia similar a las CPAP automáticas, para conocer la presión de CPAP fija que precisa el paciente. Por ello su utilización ha disminuido notablemente. Una vez el paciente se haya entrenado, esté adaptado y ya esté dormido, y presente claros episodios de apneas, hipopneas, ronquidos o períodos de limitación al flujo aéreo se incrementará el valor de CPAP. Habitualmente se aconseja subir 1 cm cada 2-5 min. Una vez hallada, en principio, la presión adecuada para el paciente, se observa su evolución, valorándola y ajustándola, si procede, en supino y en REM. Posteriormente es aconsejable valorar la presión, en ventanas de 20-30 min, para ver los cambios más sutiles y, sobre todo, la confirmación o no de ciertos episodios. Cuando se alcanza la presión óptima, al cabo de 60-90 min se debe de proceder a intentar la reducción del nivel. Para medir el flujo, lo ideal es un neumotacógrafo colocado entre la mascarilla y la válvula de fuga.
Las CPAP automáticas o también llamadas inteligentes son unos aparatos que, a través del análisis de alguno o algunos elementos, como el flujo, o la morfología de la onda inspiratoria y del ronquido, ajustan continuamente el valor de CPAP, de modo que el valor de presión de CPAP varía continuamente durante toda la noche. Hoy día se considera que la medición de la presión fija de CPAP puede hacerse con sistemas automáticos sin problemas. Es el método de elección por su relación coste/eficacia.
En cuanto a las formulas matemáticas, existen diversas ecuaciones basadas tanto en factores anatómicos como fisiológicos que en un porcentaje muy valorable de pacientes miden adecuadamente el valor de CPAP.
BIBLIOGRAFÍA
Lee-Chiong TL, Mohsein V. Clinics in chest medicine. Sleep related breathing disorders. Philadelphia: WB Saunders, 2003.
Sullivan CE, Issa FG, Berthon-Jones M, Eves L. Reversal of obstructive sleep apnoea by continuous positive airway pressure applied through the nares. Lancet 1981;1:862-5.
Collard P, Pieters T, Aubert G, Delguste P, Rodenstein DO. Compliance with nasal CPAP in obstructive sleep apnea. Sleep Medicine Reviews 1997;1:33-44.
Montserrat JM, Ferrer M, Hernandez L, Farré R, Vilagut G, Navajas D, et al. Effectiveness of CPAP treatment in daytime function in sleep apnea syndrome A randomized controlled study with an optimized placebo. Am J Respir Crit Care Med 2001;164:608-13.
Bahammam AS, Delaive K, Ronald J, Manfreda J, Roos L, Kryger M. Health care utilization in males with obstructive sleep apnea syndrome two years after diagnosis and treatment. Sleep 1999;22:740-7.
Barbé F, Mayoralas LR, Duran J, Masa JF, Maimó A, Montserrat JM, et al. Treatment with continuous positive airway pressure is not effective in patients with sleep apnea but no daytime sleepiness. A randomized, controlled trial. Ann Intern Med 2001; 134:1015-23.
Findley L, Smith C, Hooper J, Dineen M, Suratt PM. Treatment with nasal CPAP decreases automobile accidents in patients with sleep apnea. Am J Respir Crit Care Med 2000;161:857-9.
NEUROCOGNITIVE DYSFUNCTION AND SLEEP IN CHILDREN
L.M. O'Brienaand D. Gozalb
aSenior Research Fellow. Kosair Children's Hospital Research Institute. Department of Pediatrics. University of Louisville School of Medicine. Louisville, KY.
bProfessor and Director. Kosair Children's Hospital Research Institute. Departments of Pediatrics. Pharmacology and Toxicology. University of Louisville School of Medicine. Louisville, KY. Estados Unidos.
This work was supported by supported by grants from the National Institutes of Health (HL69932, HL63912, and HL66358), and The Commonwealth of Kentucky Research Challenge Trust Fund.
Correspondence: Louise M. O'Brien, PhD; David Gozal, MD. Kosair Children's Hospital. Research Institute. Department of Pediatrics. University of Louisville School of Medicine. 571 S. Floyd Street, Ste. 439. Louisville, KY 40202. Correo electrónico: lmobri02@gwise.louisville.edu; david.gozal@louisville.edu
ABSTRACT
Sleep disturbance in children, whether due to poor sleep hygiene or to sleep-related breathing disorders, is associated with significant behavioral and neurocognitive deficits. The mechanism(s) by which sleep disturbance contributes to the daytime manifestations are unclear, although it appears that both sleep fragmentation and intermittent hypoxia are important. The long-term outcome for children with untreated diseases leading to sleep disruption is currently unknown. However, increased awareness and early identification and treatment of conditions leading to altered sleep should yield improved neurocognitive outcomes in affected children.
SLEEP DISTURBANCE IN CHILDREN
Sleepiness in children is a major public health concern. However, the impact of daytime sleepiness on the behavior and academic performance of children and adolescents has only recently become a topic of focused investigation. Although the term "sleepiness" can be ambiguous, it may be defined physiologically by means of a Multiple Sleep Latency Test (MSLT), which consists of a series of polysomnographically assessed daytime "nap" opportunities. The shorter the sleep latency during these naps, the higher the degree of sleepiness. While very few studies have objectively measured daytime sleepiness in children, it is quite clear that homeostatic influences (i.e., the time elapsed since the previous sleep period, and circadian clock regulatory systems) impinge on daytime sleepiness. In a series of elegant studies, Carskadon et al showed that pubertal development is associated with increased daytime sleepiness, such that post-pubertal adolescents may require more sleep to maintain pre-pubertal levels of alertness1,2. Despite this physiological evidence, school start times in the US dictate that junior and senior school students have to wake earlier than elementary school students, clearly in conflict with the biological preference for later bedtimes and later wakes time associated with the relative phase delay of puberty3. In addition to the developmental aspects of daytime sleepiness in children and adolescents, circumstances that lead to either inadequate or fragmented sleep have the potential to adversely affect daytime functioning. This is of substantial concern, particularly when considering the high prevalence of objectively-measured sleep fragmentation in school children4.
Much of the current literature on behavioral and neurocognitive sequelae of sleep disruption in children has focused on the daytime effects of sleep restriction, deprivation, and sleep-related breathing disorders, i.e., obstructive sleep apnea (OSA), which elicits sleep fragmentation. Recently developed animal models have also allowed us to further explore the potential mechanisms underlying such sequelae.
BEHAVIORAL CONSEQUENCES OF SLEEP DISTURBANCE
The behavioral effects of sleep loss have been extensively investigated in adults. Sleep fragmentation may be achieved by auditory stimuli inducing arousals throughout the night and will result in performance decrements the following day5-7. Functions requiring concentration and dexterity are more readily affected by the excessive daytime sleepiness (EDS) which results from sleep fragmentation, and, in fact, sleep-fragmented subjects are often confused and disoriented. Aggressive outbursts, irritability, anxiety and depression are all known manifestations of EDS in adults, and appear to be fully reversible once sleep recovery is allowed. In view of these findings in adults and those of Sadeh et al4, who found a high prevalence of sleep fragmentation in children, it is perhaps surprising that the effects of experimental sleep fragmentation on daytime functioning have not been thus far studied in more detail in the pediatric population.
Based on subjective sleep criteria, infants, toddlers, and school-age children who are characterized as poor sleepers show increased incidence and severity of parentally-reported behavioral difficulties compared to children without sleep problems8-13. These observations have been corroborated by objective sleep assessments whereby with more disturbed sleep measures, more altered behavior will emerge14-19. A recent study of sleep and daytime behavior in young children suggested that 36% of children with global reports of sleep problems had significant behavioral problems20. Daytime hyperactivity was associated with restless sleep20, whereas high emotional symptom scores, such as anxiety and depressive symptoms were associated with global sleep problems, prolonged sleep latency, and related to increased difficulty falling asleep13,20. Lavigne et al further demonstrated that pre-school children with shorter total sleep time exhibited more behavioral problems21. In fact, the reciprocal of this paradigm also holds true, whereby improvement in sleep is associated with improvement in daytime behavior15,22. Thus, sleep and behavior exhibit a complex set of interactions that may either interfere with each other or promote each other in children.
Sleep restriction
Few investigations in children have examined the effect of experimental sleep loss on subsequent daytime behavior. Acute sleep restriction for one night has been shown to increase inattentive behavior the following day, although no changes were observed in hyperactive or impulsive behaviors23. Similarly, extended sleep restriction for 7 nights led to an increase in parent-reported oppositional and inattentive behavior, but no increase in teacher-reported behavioral problems24. Notwithstanding such observations, total sleep time does not appear to be the major determinant of daytime behavior problems. Thus, disruption of the sleep process, rather than total amount of sleep, may be the key factor underlying the behavioral alterations that are dependent of sleep. In other words, while some types of sleep disturbance may preserve overall sleep quantity, the presence or absence of sleep fragmentation appears to be the major factor leading to impaired daytime functioning25. Thus, fragmentation by multiple arousals such as is observed in OSA or in periodic limb movement disorder of sleep (PLMD) would be expected to be associated with neurobehavioral disturbances. To corroborate this assumption, a recent study from our group found significant relationships bet-
ween arousals associated with periodic limb movements during sleep and attention-deficit/hyperactivity disorder (ADHD)26. Thus, an associative and possibly causative link appears to be present between fragmented sleep and hyperactive behavior.
Snoring and obstructive sleep apnea
OSA is a more severe form of sleep disordered breathing (SDB), and is a common condition in both adults and children, with estimates that up to 3% of young children are affected9,27-30. OSA is characterized by repeated events of partial or complete upper airway obstruction during sleep, which results in disruption of normal ventilation, blood gas abnormalities, and sleep fragmentation31. Despite the fact that OSA and its associated manifestations were first described as long ago as 188032,33, it was only relatively recently that Guilleminault first recognized OSA as a clinically relevant entity in children34. Indeed, Osler33 reported that children with "loud and snorting" respirations with "prolonged pauses" were often "stupid looking" and slow to respond to questions. He was the first to comment that the "influence upon mental development is striking", yet it took another 100 years or so before his observations on neurocognitive decrements in pediatric OSA were investigated. OSA in children is distinct from OSA that occurs in adults, particularly with respect to gender distribution, clinical manifestations, and treatment35,36. In children, OSA is frequently diagnosed in association with adenotonsillar hypertrophy, and is also common in children with craniofacial abnormalities and neurological disorders affecting upper airway patency. In his early descriptions of pediatric OSA, Guilleminault suggested that removal of the enlarged adenotonsillar tissue will eliminate the clinical symptoms34. However, while enlarged tonsils and adenoids are clearly a major contributor to this disorder, children with OSA also have increased upper airway collapsibility37. Thus, adenotonsillar hypertrophy alone is usually not sufficient to cause OSA, since some children with "kissing tonsils" do not have OSA, while others are not cured after adenotonsillectomy38,39.
The primary symptom of OSA is snoring and affects up to 27% of children with a mean revolving around 10-12%9,19,28,29,40-42. This relatively high frequency in habitual snoring will decrease in 9-14 year-olds to 3-5%43. While snoring is not normal and implies the presence of increased upper airway resistance, many snoring children may have primary snoring, i.e., habitual snoring without obvious alterations in sleep architecture, alveolar ventilation and oxygenation. Notwithstanding the fact that primary snoring is generally considered to be benign, recent evidence from our laboratory suggests that it may in fact be associated with neurobehavioral deficits44. Daytime sleepiness, behavioral hyperactivity, learning problems, and restless sleep are all significantly more common in habitual snorers9,42,44-46.
The implications of OSA and the associated hypoxemia and sleep fragmentation in children are potentially complex. If left untreated, or alternatively, if treated late, pediatric OSA may lead to significant morbidity affecting multiple target organs and systems, and such deleterious consequences may not be completely reversible despite appropriate treatment. The potential consequences of OSA in children include behavioral disturbances and learning deficits9,12,14,46-51, pulmonary hypertension52, systemic hypertension53,54, and compromised somatic growth55. In addition, pediatric OSA is associated with poor quality of life56 and increased healthcare utilization57.
Schooling problems have been repeatedly reported in case-series of children with OSA, and in fact may underlie more extensive behavioral disturbances such as restlessness, aggressive behavior, excessive daytime sleepiness and poor test performances9,12,14,15,18,58-60. Improvements in behavior have been observed following treatment for OSA in children15,48,61 suggesting that at least some of the deficits may be reversible (see below for additional considerations).
Periodic limb movement disorder of sleep (PLMD)
PLMD is now a well-documented disorder of sleep in adults, and is usually accompanied by complaints of insomnia and/or excessive daytime sleepiness in the absence of any other explanatory disorders62. It is only recently that this condition has emerged as a relatively frequent and markedly under diagnosed condition affecting children. Several studies have shown that PLMD and hyperactive behaviors are closely correlated45,63, and in fact, a very high prevalence of ADHD is found among children diagnosed with PLMD64. Furthermore, the reverse also appears to be true, i.e., children with ADHD show a high prevalence of PLMD65,66. Regarding the latter, PLMD appears to be restricted to the more severe cases of ADHD, specifically those requiring referral to specialized medical centers19. We believe that the link between PLMD and ADHD can be explained, at least in part, by the sleep fragmentation resulting from PLM-induced arousals, since children with co-morbid PLMD and ADHD are significantly more likely to have associated arousals than children with PLMD alone26. Thus, and as indicated above in the interactions between sleep and behavior, sleep fragmentation is more likely to induce alterations in behavioral patterns in susceptible children.
Attention-deficit/hyperactivity disorder (ADHD)
ADHD, the most frequently encountered pediatric neurodevelopmental disorder, is characterized by inattention, over-activity, and impulsivity67 and is estimated to affect between 3-5% of school-age children68. Symptoms frequently coincide with other emotional, behavioral, and learning problems, and although the cause of ADHD remains unknown, it is presumed to represent a polygenic disease with implications for and disruption of the dopaminergic, adrenergic, and glutamatergic neurotransmitter systems in selected brain regions68. The problem behaviors identified in ADHD are thought to result from a lack of behavioral inhibition, which interferes with 4 executive functions, namely working memory, self-regulation of affect/arousal, internalization of speech, and reconstitution69.
There is increasing evidence that snoring and SDB are associated with behavioral problems, and in particular with hyperactivity and ADHD (9, 15, 70-72). Hyperactive and inattentive behaviors have been reported in children with OSA (14, 34, 47, 49) and in children with habitual snoring9,12,18,44-46,61. Furthermore, up to one third of all children with frequent, loud snoring or SDB will display significant hyperactivity and inattention9, with improvement in the latter behaviors following surgical treatment of SDB15,73. Conversely, children with ADHD appear to exhibit more sleep disturbances than normal children71,72,74. However, most of the studies on sleep and ADHD have relied on parental reports of sleep disturbance, with very few studies actually performing objective sleep assessments. In a recent study on both subjective (parental questionnaires) and objective (polysomnography) measures from our laboratory, we found that, despite parental reports of sleep disturbances in > 70% of children with ADHD, only 20% of these children had sleep disturbances when assessed by objective polysomnographic criteria19. This is of particular importance given that the majority of studies reporting sleep disturbances in children with ADHD are based on parental perceptions rather than rely on objective assessments. Interestingly, SDB was not more likely to occur among children with significant ADHD symptoms, yet SDB was significantly more prevalent among children with mild hyperactive behaviors, suggesting that SDB can induce significant, albeit mild, behavioral effects but that such effects in behavior will not extend to include overt ADHD. As mentioned earlier, sleep fragmentation associated with periodic limb jerks is more frequent in children with ADHD, thus supporting the notion that restless sleep is indeed more common in ADHD patients.
For the convenience of the reader, table 1 summarizes the evidence for sleep disturbance and behavior.
NEUROCOGNITIVE CONSEQUENCES OF SLEEP DISRUPTION
An extensive body of literature is available on the neurocognitive deficits associated with sleep disruption in adults. These include deficits in attention, concentration, memory, and verbal and non-verbal intelligence75-81. Sleep deprivation has very profound effects on cognitive function in adults, and complex tasks appear more susceptible to sleep deprivation than simple tasks82. Adult patients with sleep apnea have a broad range of neurocognitive deficits, particularly those pertaining to executive functions, i.e. the processes involved in the planning, initiation, and self-regulation of goal-oriented behaviors83. While the literature is less extensive in children, similar deficits in neurocognitive function emerge as a result of sleep disruption.
In the context of SDB, the degree of neurocognitive dysfunction in children with OSA is more severe than that found for children with primary snoring44,46,51, suggesting a dose-dependent response. Furthermore, hypoxemia is closely related to the deficits in executive function whereas sleepiness is more closely associated with attention deficits77,78. Adams et al84 reported a dose-response effect between increasing nocturnal hypoxemia and respiratory disturbance index and decreasing neurocognitive function in a large non-referred sample of adult patients with SDB. The obvious deficits in executive performance found in adults with SDB could reflect hypoxemia-induced frontal lobe dysfunction78. Several investigators have suggested that sleep disturbance is associated with dysfunction of the prefrontal cortex (PFC) in adults82,84,85 and the same principle is applicable to children86. Furthermore, Beebe and Gozal87 have recently proposed a model, whereby sleep apnea induces daytime cognitive deficits via disruption of PFC-dependent processes. These processes will be analyzed separately in the following sections.
Attentional capacity
Attentional capacity is the ability to remain on task and appropriately attend to stimuli in the environment. It plays an important role in learning, and consequently in social and academic development. Using acute sleep restriction and sleep deprivation, Carskadon and co-workers showed that despite increased sleep tendency, as measured by the Multiple Sleep Latency Test (MSLT), no impairment on an auditory attention task was present88,89. In addition, a visual test of sustained attention and inhibition appeared unaffected by acute sleep restriction23, such that these findings in the laboratory are somewhat conflictive with parental reports of impaired attention following acute sleep restriction in these children. For example, children with early school starting times have reported more difficulty than their later starting peers when asked to rate attention and concentration at school90. Nevertheless, Sadeh et al91 found no correlations between sleep schedule or sleep duration and neurobehavioral functioning, and Meijer et al92 found no significant relationships between subjective sleep variables such as time in bed, quality of sleep, feeling rested, and difficulty getting up in the morning, and performance on a task of selective attention. In general, sleep deprivation rather than sleep restriction, appears be associated with more prominent decrements in performance.
Inattentive behavior has also been reported in children with OSA14,47 and in children with habitual snoring9,12,45. Furthermore, Owens-Stively93 suggested the presence of a dose response in the attention-impulsivity scales with moderate to severe OSA children showing a greater deficit than children with mild OSA. In further support of this contention, Blunden et al reported that children with mild SDB demonstrated diminished selective and sustained attention compared with control children46. Work from our laboratory indicates that children with primary snoring44 as well as those with OSA (O'Brien et al, unpublished observations) exhibit deficits in attention compared to control children when measured on parental report scales, and indeed such deficits will be markedly improved after adenotonsillectomy for SDB15,47,49.
Memory
Following acute sleep restriction, investigators have failed to find deficits in a word memory task89, yet such deficits were observed following 38 hours of sleep deprivation in a sample of similar-aged children88. Performance of a verbal memory task appeared unaffected by acute sleep restriction94 and 3 nights of restricted sleep in children aged 10-14 years revealed no deficits on a working memory task95. However, in children with SDB, memory performance on standardized psychometric tests is significantly reduced compared with control children46,60, and a dose-response effect may be present, whereby children with higher respiratory disturbance indices show greater memory deficits60. In contrast, Owens-Stively et al93 and O'Brien et al19,44 failed to identify any differences in memory performance in children with varying degrees of SDB severity and control children. The limited number of studies in this area and the conflicting results clearly require further investigation.
Intelligence
Overall performance on a general test of cognitive ability appears to be unaffected by acute sleep restriction, even if it will be impaired on abstract problem solving tests94,95. Neither acute sleep restriction89, sleep restriction for 3 nights95, nor total sleep deprivation for 38 hours88 elicited significant deficits on computational accuracy although computational speed was observed to decline following total sleep deprivation. Consistent evidence of impaired verbal fluency and creativity was found following acute and extended sleep restriction94,95, although performance on the figural fluency and creativity test (i.e., the ability to communicate unusual and unique ideas through drawing) in the same children was unaffected following acute sleep restriction, and actually improved following extended sleep restriction. Thus, higher cognitive functions that involve verbal creativity and abstract thinking may be more sensitive to sleep restriction in children than their visual/imagery counterparts.
In children with SDB, several studies have documented significantly reduced IQ scores (obtained from the Wechsler Intelligence Scale for Children WISC-III) compared with control children46,60. In these studies, SDB children performed in the lower normal or borderline range. More recently, O'Brien et al have documented significantly impaired General Conceptual Ability scores (a measure of IQ obtained from the Differential Ability Scales; DAS) in children with OSA (O'Brien et al, unpublished observations) when compared with control children. However, Ali et al15 failed to detect any differences in the short form version of the WISC-III. Interestingly, Lewin et al found an inverse relationship between the severity of OSA and verbal ability (obtained from the Differential Ability Scales)51. The authors suggested that only severe OSA is a risk factor for disruption of verbal abilities. However, this issue merits further investigation because the study by O'Brien et al included a majority of children with an apnea/hypopnea index (AHI) between 5 and 10, i.e., not severe OSA, and yet, the verbal abilities and overall language scores were adversely affected (O'Brien et al, unpublished observations).
Learning and school performance
Subjective surveys suggest that children with later, irregular bedtimes, short sleep time, and increased daytime sleepiness, have lower academic achievements than other children96,97. However, a recent study in which 1200 students were surveyed98 failed to find a significant association between total sleep time and school performance. Lower school performance has also been reported in children with SDB14,34,47,61,99,100 and the reciprocal has also been shown to be true, i.e., children with poor academic performance are more likely to have sleep disturbances such as snoring and breathing difficulties48,59. Gozal48 found a 6-9 fold increase in the expected incidence of OSA of first grade children who ranked in the lowest 10th percentile of their class. Moreover, a significant improvement occurred in school grades following adenotonsillectomy and resolution of OSA. However, since the optimal learning potential for these children was unknown, it is possible that long-term residual deficits may be present even after treatment.
To further examine this possibility, Gozal and Pope investigated the history of snoring during early childhood in 2 groups of 13-14 year-old children who were matched for age, gender, race, school being attended, and socioeconomic status, but whose performance was either in the upper or lower quartile of their class101. The investigators found that children who snored frequently and loudly during early childhood were at greater risk for lower academic performance in later years, well after snoring had resolved. These findings suggest that even if a substantial component of the OSA-induced learning deficits is reversible, there may be a long-lasting residual deficit in learning capability. The latter could represent a "learning debt", i.e., the decreased learning capacity during OSA may have led to such a delay in learned skills that recuperation is only possible with additional teaching assistance. Alternatively, the processes underlying the learning deficit during OSA may have irreversibly altered the performance characteristics of the neuronal circuitry responsible for learning particular skills. These studies are now the subject of intense investigation using animal models of SDB (see below).
Table 2 summarizes the evidence for sleep disturbance and neurocognitive performance.
The prefrontal cortex (PFC)
The mechanism(s) by which sleep disruption may contribute to neurobehavioral deficits are unknown. However, it is likely that both the sleep fragmentation and episodic hypoxia that characterize OSA will lead to alterations within the neurochemical substrate of the PFC with resultant executive dysfunction. Indeed, the impaired performance in language and verbal ability, as well as the deficits observed in visuospatial function and academic performance in children with OSA, are all consistent with dysfunction of the PFC. Executive dysfunction appears to be the most susceptible area in untreated SDB in adults76,78,82,84,85, and recent work extends such observations to the pediatric age range49,51. Executive dysfunction can markedly alter the functional recruitment of cognitive abilities, and therefore result in maladaptive daytime behaviors such as hyperactivity, impulsivity, poor planning, and difficulty maintaining attention. The multitude of neuronal connections between the prefrontal regions and other regions of the brain allows the PFC to coordinate cognitive and behavioral output in an "executive" manner102. Therefore it is not surprising that poor performance on executive function tests may relate to dysfunction of other cognitive skills. Thus, children with primary language deficits may perform poorly on tasks of executive function that incidentally require language processing87. In addition, the PFC has been identified as a neurological origin of deficits observed in children with ADHD103 and impairment in the PFC has been observed in these children by fMRI104.
Animal models
Deficits in executive functioning correlate with blood gas abnormalities during sleep and sleep fragmentation. Separation of the individual effect imposed by these factors on behavior and cognition is not possible in human subjects. To overcome such constraints, rodent models have been recently developed and allow for delineation of the role played by intermittent hypoxia and sleep fragmentation in the neurocognitive deficits described above. For example, intermittent hypoxia during sleep will lead to increased neuronal cell loss within the PFC and hippocampus, and to parallel adverse effects on spatial memory tasks in the absence of significant sleep fragmentation or deprivation105. Furthermore, when this model is applied to developing rodents, a unique period of neuronal susceptibility to episodic hypoxia during sleep emerges, and in fact coincides with these ages at which the prevalence of OSA peaks in children106. Since this age also coincides with a critical period of brain development, it is possible that during this period, delayed diagnosis and treatment of OSA will impose a greater deleterious burden on the more SDB-vulnerable brain structures, and ultimately impede the development of the overall neurocognitive potential of children with OSA. Indeed, developing rats exhibit greater decreases in acquisition and retention of spatial tasks irrespective of gender107. Interestingly, male rats exposed to intermittent hypoxia during sleep also exhibit increased locomotor activity, uniquely reminiscent of the hyperactivity of children with SDB, in whom a male predominance is well established. Additionally, perinatal hypoxia in the rat has been shown to lead to long lasting behavioral hyperactivity and a deficit in the PFC dopamingergic transmission108. Thus, intermittent hypoxia during a critical period of development may not only cause early cellular losses in the brain, but may also modify the subsequent development and neural function of critical brain regions even during adulthood. The mechanisms underlying PFC and hippocampal vulnerability to either intermittent hypoxia or sleep disruption are only now being identified. Such mechanisms, which clearly involve oxidant stress and inflammatory pathways109, raise intriguing questions as to the genetic polymorphisms that may account for the differential susceptibility in children.
REFERENCES
1. Carskadon MA, Dememnt WC. Sleepiness in the normal adolescent. In: Guilleminault C, editor. Sleep and Its disorders in children. New York: Raven Press, 1987; p. 53-66.
2. Carskadon MA, Harvey K, Duke P, Anders TF, Litt IF, Dement WC. Pubertal changes in daytime sleepiness. Sleep 1980;2:453-60.
3. Carskadon MA, Viera C, Acebo C. Association between puberty and delayed phase preference. Sleep 1993;16:258-62.
4. Sadeh A, Raviv A, Gruber R. Sleep patterns and sleep disruptions in school age children. Developmental Psychology 2000;36:291-301.
5. Stepansky EJ, Lamphere P, Badia P. Sleep fragmentation and daytime sleepiness. Sleep 1984;7:18-26.
6. Stepansky EJ, Lamphere J, Roehrs T. Experimental sleep fragmentation in normal subjects. Int J Neurosci 1987;33:207-14.
7. Chugh DK, Weaver TE, Dinges DF. Neurobehavioral consequences of arousals. Sleep 1996;19:S198-201.
8. Zuckerman B, Stevenson J, Bailey V. Sleep problems in early childhood: continuities, predictive factors, and behavioral correlates. Pediatrics 1987;80:664-71.
9. Ali NJ, Pitson DJ, Stradling JR. Snoring, sleep disturbance, and behaviour in 4-5 year olds. Arch Dis Child 1993;68:360-6.
10. Minde K, Popiel K, Leos N, Falkner S, Parker K, Handley-Derry M. The evaluation and treatment of sleep disorders in young children. J Child Psychol Psychiatry 1993;34:521-33.
11. Ali NJ, Pitson DJ, Stradling JR. Natural history of snoring and related behaviour problems between the ages of 4 and 7 years. Arch Dis Child 1994;71:74-6.
12. Chervin R, Dillon J, Bassetti C, Ganoczy D, Pituch K. Symptoms of sleep disorders, inattention, and hyperactivity in children. Sleep 1997;20:1185-92.
13. Stein MA, Mendelsohn J, Obermeyer WH, Amomin J, Benca R. Sleep and behavior problems in school-aged children. Pediatrics 2001;107:e60.
14. Guilleminault C, Korobkin R, Winkle R. A review of 50 children with obstructive sleep apnea syndrome. Lung 1981; 159:275-87.
15. Ali NJ, Pitson D, Stradling JR. Sleep disordered breathing: effects of adenotonsillectomy on behaviour and psychological functioning. Eur J Pediatr 1996;155:56-62.
16. Aronen ET, Paavonen EJ, Fjallberg M, Soininen M, Torronen J. Sleep and psychiatric symptoms in school-age children. J Am Acad Child Adolesc Psychiatry 2000;39:502-8.
17. Chervin RD, Hedger K, Dillon JE, PituchKJ. Pediatric sleep questionnaire (PSQ): validity and reliability of scales for sleep-disordered breathing, snoring, sleepiness, and behavioral problems. Sleep Med 2000;1:21-32.
18. Chervin RD, Archbold KH. Hyperactivity and polysomnographic findings in children evaluated for sleep-disordered breathing. Sleep 2001;24:313-20.
19. O'Brien LM, Holbrook CR, Mervis CB, et al. Sleep and neurobehavioral characteristics in 5-7 year old hyperactive children. Pediatrics 2003;11:1.
20. Smedje, H, Broman JE, Hetta J. Associations between disturbed sleep and behavioural difficulties in 635 children aged six to eight years: a study based on parents' perceptions. Eur Child Adolesc Psychiatry 2001;10:1-9.
21. Lavigne JV, Arend R, Rosenbaum D, Smith A. Sleep and behaviour problems among preschoolers. Developmental and Behavioural Pediatrics 1999;20:164-9.
22. Minde K, Faucon A, Falkner S. Sleep problems in toddlers: effects of treatment on their daytime behavior. J Child Adolescent Psychiatry 1994;33:1114-21.
23. Fallone G, Acebo C, Arnedt TA, Seifer R, Carskadon MA. Effects of acute sleep restriction on behavior, sustained attention, and response inhibition in children. Perceptual Motor Skills 2001;93:213-29.
24. Fallone G, Seifer R, Acebo C, Carskadon MA. Prolonged sleep restriction in 11- and 12-year-old children: effects on behavior, sleepiness, and mood. Sleep 2000;23 (Suppl 2):A28.
25. Stores G. Practitioner Review: assessment and treatment of sleep disorders in children and adolescents. J Child Adolesc Psychol Psychiatry 1996;37:907-25.
26. Crabtree VM, Ivanenko A, O'Brien LM, Gozal D. Periodic limb movement disorder of sleep in children. J Sleep Res 2003;12:73-81.
27. Brouillette R, Hanson D, David R, Klemka L, Szatowski A, Fernbach S, et al. A diagnostic approach to suspected obstructive sleep apnea in children. J Pediatr 1984;105:10-4.
28. Gislason T, Benediktsdottir B. Snoring, apneic episodes, and nocturnal hypoxemia among children 6 months to 6-years-old. Chest 1995;107:963-6.
29. Hulcrantz E, Lofstarnd TB, Ahlquist RJ. The epidemiology of sleep related breathing disorders in children. Int J Pediatr Otorhinolaryngol 1995;6(Suppl):S63-6.
30. Young T, Peppard PE, Gottlieb DJ. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med 2002;165:1217-39.
31. American Thoracic Society. Standards and indications for cardiopulmonary sleep studies in children. Am J Respir Crit Care Med 1995;153:866-78.
32. McKenzie M. A manual of diseases of the throat and nose, including the pharynx, larynx, trachea oesophagus, nasal cavities, and neck. London: Churchill, 1880.
33. Osler W. The Principles and Practice of Medicine. New York: Appleton, 1892; p. 335-9.
34. Guilleminault C, Eldridge F, Simmons FB, Dement WC. Sleep apnea in eight children. Pediatrics 1976;58:28-31.
35. Carroll JL, McLoughlin GM. Diagnostic criteria for obstructive sleep apnea in children. Pediatr Pulmonol 1992;14:71-4.
36. Rosen CL, D'Andrea L, Haddad GG. Adult criteria for obstructive sleep apnea do not identify children with serious obstruction. Am Rev Resp Dis 1992;146:1231-4.
37. Isono S, Shimada A, Utsugi M, Konno A, Nishino T. Comparison of static mechanical properties of the passive pharynx between normal children and children with sleep-disordered breathing. Am J Respir Crit Care Med 1998;157: 1201-12.
38. Suen JS, Arnold JE, Brooks LJ. Adenotonsillectomy for treatment of obstructive sleep apnea in children. Arch Otolaryngol Head Neck Surg 1995;121:525-30.
39. Lipton AJ, Gozal D. Treatment of obstructive sleep apnea in children: do we really know how? Sleep Med Rev 2003;7:61-80.
40. Teculescu DB, Caillier I, Perrin P, Rebstock E, Rauch A. Snoring in French preschool children. Pediatric Pulmonology 1992;13:239-44.
41. Owen GO, Canter RJ, Robinson A. Snoring, apnea and ENT symptoms in the paediatric community. Clin Otolaryngol Allied Sciences 1996;21:130-4.
42. Ferreira AM, Clemente V, Gozal D, et al. Snoring in Portuguese primary school children. Pediatrics 2000;106:5:e64.
43. Corbo GM, Forastiere F, Agabiti N, Pistelli R, Dell'Orco V, Perucci CA, et al. Snoring in 9- to 15-year-old children: risk factors and clinical relevance. Pediatrics 2001;180:1149-54.
44. O'Brien LM, Mervis CB, Holbrook CR, Bruner JL, Klau CJ, Rutherford J, et al. Is primary snoring in children really benign? [abstract]. Am J Resp Crit Care Med 2003.
45. Chervin RD, Archbold KH, Dillon JE, et al. Inattention, hyperactivity, and symptoms of sleep disordered breathing. Pediatrics 2002;109:449-56.
46. Blunden S, Lushington K, Kennedy D, Martin J, Dawson D. Behavior and neurocognitive performance in children aged 5-10 years who snore compared to controls. J Clin Exp Neuropsychol 2000;22:554-68.
47. Guilleminault C, Winkle R, Korobkin R, Simmons B. Children and nocturnal snoring - evaluation of the effects of sleep related respiratory resistive load and daytime functioning. Eur J Pediatr 1982;139:165-71.
48. Gozal D. Sleep-disordered breathing and school performance in children. Pediatrics 1998;102:616-20.
49. Owens JA, Spiritio A, Marcotte A, McGuinn M, Berkelhamer L. Neuropsychological and behavioral correlates of obstructive sleep apnea in children: a preliminary study. Sleep Breathing 2000;2:67-78.
50. Blunden S, Lushington K, Kennedy D. Cognitive and behavioral performance in children with sleep-related obstructive breathing disorders. Sleep Medicine Reviews 2001;5:447-61.
51. Lewin DS, Rosen RC, England SJ, Dahl RE. Preliminary evidence of behavioral and cognitive sequelae of obstructive sleep apnea in children. Sleep Medicine 2002;3:5-13.
52. Shiomi T, Guilleminault C, Stoohs R, Schnittger I. Obstructed breathing in children during sleep monitored by echocardiography. Acta Paediatr 1993;82:863-71.
53. Marcus CL, Greene MG, Carroll JL. Blood pressure in children with obstructive sleep apnea. Am J Respir Crit Care Med 1998;157:1098-103.
54. Amin RS, Kimball TR, Bean JA, Jeffries JL, Willging JP, Cotton RT, et al. Left ventricular hypertrophy and abnormal ventricular geometry in children and adolescents with obstructive sleep apnea. Am J Respir Crit Care Med 2002;165:1395-9.
55. Everett AD, Koch WC, Saulsbury FT. Failure to thrive due to obstructive sleep apnea. Clin Pediatr 1987;26:90-2.
56. Rosen CL, Palermo TM, Larkin EK, Redline S. Health-related quality of life and sleep-disordered breathing in children. Sleep 2002;25:648-57.
57. Reuveni H, Simon T, Tal A, Elhayany A, Taraiuk A. Healthcare services utilization in children with obstructive sleep apnea syndrome. Pediatrics 2002;110:68-72.
58. Owens J, Opipari L. Nobile C. Spirito A. Sleep and daytime behavior in children with obstructive sleep apnea and behavioral sleep disorders. Pediatrics 1998;102:1178-84.
59. Weissbluth M, Davis A, Poncher J, Reiff J. Signs of airway obstruction during sleep and behavioral, developmental and academic problems. Dev Behav Pediatr 1983;4:119-21.
60. Rhodes SK, Shimoda KC, Wald LR, O'Neil PM, Oexmann MJ, Collop NA, et al. Neurocognitive deficits in morbidly obese children with obstructive sleep apnea. J Pediatr 1995; 127:741-4.
61. Stradling JR, Thomas G, Warley ARH, Williams P, Freeland A. Effect of adenotonsillectomy on nocturnal hypoxaemia, sleep disturbance, and symptoms in snoring children. Lancet 1990;335:249-53.
62. Chesson AL, Wise M, Davila D, Johnson S, Littner M, Anderson WM, et al. Practice parameters for the treatment of restless legs syndrome and periodic limb movement disorder. Sleep 1999;22:961-8.
63. Chervin RD, Archbold KH. Hyperactivity and polysomnographic findings in children evaluated for sleep-disordered breathing. Sleep 2001;24:313-20.
64. Picchietti DL, Walters AS. Moderate to severe periodic limb movement disorder in childhood and adolescence. Sleep 1999;22:297-300.
65. Picchietti DL, England SJ, Walters AS, Willis K, Verrico T. Periodic limb movement disorder and restless legs syndrome in children with attention-deficit hyperactivity disorder. J Child Neurol 1998;13:588-94.
66. Picchietti DL, Underwood DJ, Farris WA, Walters AS, Shah MM, Dahl RE, et al. Further studies on periodic limb movement disorder and restless legs syndrome in children with attention-deficit hyperactivity disorder. Mov Disord 1999; 14:1000-7.
67. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed. Washington: American Psychiatric Association, 1994.
68. Diagnosis and Treatment of Attention Deficit Hyperactivity Disorder. NIH Consensus Statement 1998;16:1-37.
69. Barkley RA. Behavioral inhibition, sustained attention, and executive functions: Constructing a unifying theory of ADHD. Psychol Bull 1997;121:65-94.
70. Corkum P, Tannock R, Moldofsky H. Sleep disturbance in children with attention-deficit hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 1998;37:637-46.
71. Owens J, Maxim R, Nobile C, McGuinn M, Msall M. Parental and self-report of sleep in children with attention deficit/hyperactivity disorder. Arch Pediatr Adolesc Med 2000;154:549-55.
72. Corkum P, Tannock R, Moldofsky H, Hogg-Johnson S, Humphries T. Actigraphy and parental ratings of sleep in children with attention deficit/hyperactivity disorder (ADHD). Sleep 2001;24:303-12.
73. Dagan-Friedman B, Hendeles-Amitay A, Kozminzki E, Leiberman A, Pilpel D, Taraiuk A, et al. Impaired cognitive performance in children with obstructive sleep apnea syndrome. Am J Resp Crit Care Med 2002;165:A263.
74. Trommer BL, Hoeppner JB, Rosenberg RS, Armstrong KJ, Rothstein JA. Sleep disturbance in children with attention deficit disorder. Ann Neurol 1988;24:322.
75. Berry DTR, Webb WB, Block AJ, Bauer RM, Switzer DA. Nocturnal hypoxia and neuropsychological variables. J Clin Exp Neuropsychol 1986;8:229-38.
76. Greenberg GD, Watson RK, Deptula D. Neuropsychological dysfunction in sleep apnea. Sleep 1987;10:254-62.
77. Bedard MA, Montplasir J, Richer F, Rouleau I, Malo J. Obstructive sleep apnea syndrome: Pathogenesis of neuropsychological deficits. J Clin Exp Neuropsychol 1991;13:950-64.
78. Naegele B, Thouvard V, Pepin JL, et al. Deficits of cognitive executive functions in patients with sleep apnea syndrome. Sleep 1995;18:43-52.
79. Kim HC, Young T, Matthews CG, Weber SM, Woodward AR, Palta M. Sleep disordered breathing and neuropsychological deficits. Am J Repir Crit Care Med 1997;156:1813-9.
80. Engleman H, Joffe D. Neuropsychological function in obstructive sleep apnoea. Sleep Med Rev 1999;3:59-78.
81. Lee MM, Strauss ME, Adams N, Redline S. Executive functions in persons with sleep apnea. Sleep Breathing 1999;3:13-6.
82. Harrison Y, Horne JA. Sleep loss impairs short and novel language tasks having a prefrontal focus. J Sleep Res 1998;7:95-100.
83. Lezak MD. Neuropsychological assessment. 3rd ed. New York: Oxford University Press, 1995.
84. Harrison Y, Horne JA. Sleep deprivation affects speech. Sleep 1997;20:871-7.
85. Harrison Y, Horne JA, Rothwell AL. Prefrontal neuropsychological effects of sleep deprivation in young adults A model for healthy aging? Sleep 2000;23:1067-73.
86. Dahl RE. The impact of inadequate sleep on children's daytime and cognitive function. Semin Pediatr Neurol 1996;3:44-50.
87. Beebe DW, Gozal D. Obstructive sleep apnea and the prefrontal cortex: towards a comprehensive model linking nocturnal upper airway obstruction to daytime cognitive and behavioral deficits. J Sleep Res 2002;11:1-16.
88. Carskadon MA, Harvey K, Dement WC. Sleep loss in young adolescents. Sleep 1981;4:299-312.
89. Carskadon MA, Harvey K, Dement WC. Acute restriction of nocturnal sleep in children. Percept Mot Skills 1981;53:103-12.
90. Epstein R, Chillag N, Lavie P. Starting times of school: effects on daytime functioning of fifth-grade children in Israel. Sleep 1998;21:250-6.
91. Sadeh A, Gruber R, Raviv A. Sleep, neurobehavioral functioning, and behavior problems in school-age children. Child Develop 2002;73:405-17.
92. Meijer AM, Habekothe HT, Van Den Wittenboer GL. Time in bed, quality of sleep and school functioning of children. J Sleep Res 2000;9:145-53.
93. Owens-Stively J, McGuinn M, Berkelhammer L, Marcotte A, Nobile C, Spirito A. Neuropsychological and behavioral correlates of obstructive sleep apnea in children. Sleep Res 1997;26(Suppl):452.
94. Randazzo AC, Muehlbach MJ, Schweitzer PK, Walsh JK. Cognitive function following acute sleep restriction in children ages 10-14. Sleep 1998;21:861-8.
95. Randazzo AC, Schweitzer PK, Walsh JK. Cognitive function following 3 nights of sleep restriction in children ages 10-14. Sleep 1998;21:S249.
96. Kahn A, Van de Merckt C, Rebuffat E, Mozin MJ Sottiaux M, Blum D, et al. Sleep problems in healthy preadolescents. Pediatrics 1989;84:542-6.
97. Wolfson AR, Carskadon MA. Sleep schedules and daytime functioning in adolescents. Child Dev 1998;69:875-87.
98. Eliasson A, Eliasson A, King J, Gould B, Eliasson A. Association of sleep and academic performance. Sleep Breathing 2002;6:45-8.
99. Guilleminault C, Pelayo R, Ledger D, Clerk A, Bocian RCZ. Recognition of Sleep Disordered Breathing in Children. Pediatrics 1996;98:871-82.
100. Richards W, Ferdman RM. Prolonged morbidity due to delays in the diagnosis and treatment of obstructive sleep apnea in children. Clin Pediatr 2000;39:103-8.
101. Gozal D, Pope DW. Snoring during early childhood and academic performance at age thirteen to fourteen years. Pediatrics 2001;107:1394-9.
102. Goldberg E. The executive brain: frontal lobes and the civilized mind. Oxford: Oxford University Press, 2001.
103. Barkley RA. ADHD and the nature of self control. New York: Guilford, 1997.
104. Rubria K, Overmeyer S, Taylor E, Brammer M, Williams SC, Simmons A, et al. Hypofrontality in attention deficit hyperactivity disorder during higher. Order motor control: a study with functional MRI. Am J Psychiatry 1999;156:891-6.
105. Gozal D, Daniel JM, Dohanich GP. Behavioral and anatomical correlates of chronic episodic hypoxia during sleep in the rat. J Neurosci 2001;21:2442-50.
106. Gozal E, Row BW, Schurr A, Gozal D. Developmental differences in cortical and hippocampal vulnerability to intermittent hypoxia in the rat. Neurosci Lett 2001;305:197-201.
107. Row BW, Kheirandish L, Neville JJ, Gozal D. Impaired spatial learning and hyperactivity in developing rats exposed to intermittent hypoxia. Pediatr Res 2002;52:449-53.
108. Brake WG, Sullivan RM, Grafton A. Perinatal distress leads to lateralized medial prefrontal cortical dopamine hypofunction in adult rats. J Neuroscience 2000;20:5538-43.
109. Row BW, Liu R, Xu W, Kheirandish L, Gozal D. Intermittent hypoxia is associated with oxidant stress and spatial learning deficits in the rat [in press]. Am J Resp Crit Care Med 2003.
ASPECTOS LEGALES DE LOS TRASTORNOS RESPIRATORIOS DURANTE EL SUEÑO
P. Martorell Zuluetaay V. Orteg Llorca
aMagistrado. Sección 9.a (civil) de la Audiencia Provincial de Valencia. Valencia. España.
INTRODUCCIÓN
Una de las cuestiones que cobra especial relevancia en nuestros días es la relativa a la responsabilidad profesional, en la medida en que cada vez con más frecuencia se ventilan procedimientos judiciales en determinación de la responsabilidad contractual o extracontractual de médicos, arquitectos, procuradores, abogados, jueces, graduados sociales, etc. De hecho, las reclamaciones por responsabilidad civil medicosanitaria como la de los demás profesionales anteriormente citados han experimentado un notorio crecimiento en la última década, como consecuencia entre otros factores del creciente conocimiento que el ciudadano tiene de sus derechos, lo que genera un incremento considerable de este tipo de reclamaciones ante los tribunales.
Por otra parte, en la actualidad, se considera un problema de salud pública de gran trascendencia el síndrome de apnea obstructiva del sueño, ya que la hipersomnia diurna tiene un gran impacto laboral, social y familiar que se manifiesta especialmente en el ámbito de los accidentes laborales y de tráfico, hasta el extremo de que profesionalmente se recomienda la no aptitud laboral para la conducción de vehículos a todos aquellos conductores que hayan diagnosticados de un síndrome de apnea de grave a moderado, por cuanto que se multiplica por 7 el riesgo de accidentes.
Dentro del marco de esta problemática se centra el objeto de la presente intervención. Del mismo modo que los diferentes grupos de profesionales buscamos una serie de respuestas a las cuestiones que nos suscitan mayores dudas, a fin de conocer de qué forma hemos de actuar en cada caso concreto para evitar incurrir en responsabilidad civil derivada de nuestra actuación profesional, los profesionales médicos conscientes de la importancia que cobra tal responsabilidad en nuestros días buscan respuestas para adecuar su forma de proceder a la hora de diagnosticar y tratar el síndrome de apnea obstructiva del sueño, en la medida en que son conscientes de la trascendencia social de la cuestión examinada. Conocer el origen y las consecuencias de su actividad, así como el modo de proceder ante el enfermo para evitar ulteriores accidentes, y evitar eventuales responsabilidad derivadas de su actuación y frente a su patrimonio, son claves de especial interés, que se someten a examen.
El objeto, pues, de la presente intervención, titulada "Aspectos legales de los trastornos respiratorios durante el sueño" únicamente pretende dar respuesta a algunas de estas cuestiones planteadas por los profesionales sanitarios dedicados a la atención de pacientes con este tipo de trastornos, desde la perspectiva de la responsabilidad civil, lo que necesariamente obliga a enfocar la cuestión desde el tratamiento de la responsabilidad civil, en general, y la responsabilidad del paciente con problemas respiratorios durante el sueño, en relación con la actividad médica, en particular.
RESPONSABILIDAD CIVIL EN GENERAL. PRESUPUESTOS LEGALES Y JURISPRUDENCIALES PARA SU NACIMIENTO. RESPONSABILIDAD CIVIL MÉDICA EN GENERAL
Responsabilidad civil en general
Normalmente, tanto en el ámbito coloquial como en el jurídico, utilizamos la palabra responsabilidad para referirnos a la obligación que tiene el autor de un daño de proceder a su reparación, ya que partimos del principio de que "no causar daño a los demás" constituye una regla esencial de la convivencia humana. Sin embargo, no todos los comportamientos dañosos tienen la misma fisonomía; así, podemos distinguir:
1. Los que derivan del incumplimiento de una obligación, y dan lugar a la llamada responsabilidad contractual, o deber de indemnizar derivado del previo incumplimiento de lo pactado entre los interesados,
2. La categoría de actividades dañosas que derivan precisamente del quebrantamiento del principio de no dañar a los demás, al margen de toda relación jurídica previa entre el causante del daño y la víctima. Nos referimos en este último caso a la llamada responsabilidad extracontractual: obligación nacida de acto ilícito o, en expresión más clásica, y ambigua responsabilidad civil.
A la primera se refiere el artículo 1.101 del Código Civil, al decir que quedan sujetos a la indemnización de los daños y perjuicios los que, en el cumplimiento de sus obligaciones, incurrieren en dolo, negligencia o morosidad, y los que, de cualquier modo, contravinieren el tenor de aquellas. A la segunda se refiere, fundamentalmente, el artículo 1.902 del Código Civil, que examinaremos a continuación.
Buscar el fundamento de la responsabilidad civil es tanto como buscar la circunstancia que determina el nacimiento del deber de indemnizar, ya sea por entender que el autor del daño responde porque éste se haya producido por su culpa, ya sea porque se entienda que responde del daño quien de hecho lo ha causado, independientemente de la culpabilidad.
La doctrina jurídica tradicional, que se encontraba totalmente dominada por el concepto de culpa, ha ido evolucionando paulatinamente como consecuencia del desarrollo cada vez mayor del "maquinismo" y de la aparición de una mentalidad colectiva más avocada a la indemnización a las víctimas de los daños, que a la de la determinación de la culpabilidad de quien los produce; de esta manera, todo ello ha dado lugar, por una parte, a la aparición de leyes dominadas por la voluntad de resarcimiento a quien soporta el daño por el mero hecho de sufrirlo (haya o no mediado culpabilidad del agente) y, por otra, a la interpretación y aplicación de los principios jurídicos tradicionales basados en la doctrina de la culpa, en el sentido de buscar la máxima protección de las víctimas de los sucesos dañosos.
Veamos, seguidamente, los hechos que dan lugar a la responsabilidad civil:
1. Los ocasionados por la actividad directa de la persona (responsabilidad por actos propios).
2. Los producidos por otra, de la que se tiene el deber de responder (responsabilidad indirecta o por hecho ajeno), como por ejemplo, los padres son responsables de los daños causados por los hijos que se encuentren bajo su guarda.
3. Los causados por animales o cosas.
De todos ellos, centraremos esencialmente nuestro examen en la determinación de la responsabilidad civil por actos propios, que se contempla en el artículo 1.902 de nuestro Código Civil, en virtud del cual: "El que por acción u omisión causa un daño a otro, interviniendo culpa o negligencia, está obligado a reparar el daño causado."
La jurisprudencia del Tribunal Supremo, relativa a este precepto, exige la concurrencia de una serie de requisitos para que pueda prosperar la reclamación del perjudicado; los presupuestos exigidos se concretan en los 4 que serán analizados brevemente a continuación, y se debe tener presente que cada uno de estos elementos habrá de concurrir en cada caso concreto en el que se plantee la reclamación por el perjudicado, y habrá de ser analizado por el juzgador en relación con el contexto que da origen a la petición indemnizatoria.
Acción u omisión ilícita
El resultado dañoso puede estar ocasionado tanto por un comportamiento activo (acción) como por una abstención (omisión), pues quien se abstiene de actuar con intención de dañar, o simplemente quien, sin ese propósito, omite un deber impuesto en la Ley, puede ser causante de un resultado dañoso por pasividad, merecedor del correspondiente reproche: pensemos, a título de ejemplo, en el conductor de un turismo que no enciende las luces de su vehículo para conducir de noche o el que, siendo consciente de padecer un trastorno respiratorio durante el sueño, omite voluntariamente su tratamiento pese a desarrollar una actividad laboral que entraña riesgo, o en la empresa de construcción que no suministra a sus empleados los adecuados elementos de protección.
Sin embargo, no cualquier acción u omisión genera la obligación de reparar sino que es necesario, además, que concurra la ilicitud; así las sentencias del Tribunal Supremo de 18 de mayo y de 12 de diciembre de 1984 entienden que, en materia de responsabilidad civil, la simple vulneración del genérico deber jurídico de no causar daño a otro constituye el elemento determinante para la calificación de antijuridicidad de la acción u omisión generadora del daño. No obstante, la plenitud de la regla expresada no impide la existencia de actos que, aun causando daño, se encuentran justificados por el derecho, de manera que su autor no contrae ninguna responsabilidad al realizarlos. Así:
1. El ejercicio del propio derecho (siempre que no sea utilizado sobrepasando los límites normales de su ejercicio con causación de daño para tercero).
2. El consentimiento de la víctima, salvo en los supuestos en que la lesión afecte a un bien o un derecho fuera del poder de disposición de su titular. El ejemplo que habitualmente se utiliza para describir el consentimiento de la víctima es el relativo a la autorización concedida para llevar a cabo una intervención quirúrgica. Cuestión distinta es el eventual nacimiento de responsabilidad del profesional de la medicina como consecuencia de la vulneración de la lex artis ad hoc, o de su deber de información de las consecuencias que de la intervención pudieran derivarse, que no es objeto de examen en esta ocasión, por exceder, en mucho, de lo que es el tema de esta ponencia.
3. La legítima defensa (los daños causados en legítima defensa no son indemnizables).
4. El cumplimiento del deber (p. ej., bomberos que tratan de apagar el fuego).
5. El estado de necesidad.
El daño
La obligación derivada del acto ilícito sólo nace cuando éste se ha producido, y no existe obligación de responder por la sola presencia de una conducta culposa, cuando el resultado dañoso no ha tenido lugar, aun a pesar de la peligrosidad o antisocialidad de la actuación del individuo, que puede constituir, incluso, un ilícito penal.
Por daño se entiende, según Xavier O'Callaghan, "el perjuicio que soporta el sujeto de un derecho subjetivo, por la perturbación, menoscabo o pérdida de éste o de un interés propio", por lo que es conveniente distinguir entre:
1. Daños personales: son los referidos a la vida o integridad física.
2. Daños materiales: consisten en el menoscabo patrimonial sufrido por la víctima y comprenden tanto el desembolso efectivo como la ganancia frustrada o que se haya dejado de obtener, esto es, el daño emergente y el lucro cesante).
3. Daños morales: son aquellos causados directa y exclusivamente, o indirectamente, a consecuencia de un daño personal o material; nuestra jurisprudencia reconoce la obligación de reparación del daño moral en sí mismo considerado. Cada vez es más frecuente, en el ámbito de la responsabilidad profesional, la reclamación por parte del perjudicado de la indemnización por daño moral, con la problemática que conlleva su cuantificación.
El resarcimiento del daño pude producirse a través de 2 mecanismos distintos:
1. La indemnización "por el equivalente", que consiste en el pago de una suma de dinero que funciona a modo de valoración o "precio" del daño ocasionado, y que es lo habitual en los supuestos de responsabilidad profesional médica.
2. La reparación en forma específica, que consiste en hacer desaparecer la causa del daño y en la realización de la actividad necesaria para la reposición al estado primitivo. Sería posible que el perjudicado, en lugar de solicitar el coste económico de una nueva intervención, solicitase ser sometido a ella por el mismo u otro profesional, con el fin, por ejemplo, de hacer desaparecer unas cicatrices antiestéticas.
El daño tiene que ser resarcido íntegramente, pues así lo declara reiterada jurisprudencia, sin que por vía del resarcimiento del daño sea admisible un eventual enriquecimiento injusto.
Culpabilidad
La culpa es la actuación que, por obrar sin la atención y sin la diligencia debidas, causa un resultado dañoso y previsible, entendiendo que la previsibilidad hay que considerarla como la actividad normal del hombre medio con relación a las circunstancias concretas de cada caso. Se ha anticipado anteriormente que, durante los últimos años, se ha producido una importante evolución jurisprudencial en torno al requisito de la culpabilidad, ya sea por la influencia de las leyes que establecen un sistema de responsabilidad objetiva en los supuestos que contemplan (uso de energía nuclear, caza, circulación, etc.), o por influjo de las tendencias europeas favorables a la indemnización de la víctima, que han tenido inmediata repercusión en España. Prescindiendo de las referencias a las sentencias más antiguas, en las que se exigía la absoluta acreditación de la culpa o negligencia del agente con arreglo a lo establecido, en el ahora derogado artículo 1.214 del Código Civil (STS de 4 de diciembre de 1903 y de 29 de diciembre de 1939), ha de señalarse que a medida en que se produjo la evolución de la realidad social con el incremento de la técnica, la jurisprudencia dio una interpretación evolutiva del artículo 1.902, basada en la aparición del riesgo, generador de cada vez mayor número de daños y la presencia cada vez más frecuente de compañías aseguradoras de tales daños. En esta segunda fase se utilizó el mecanismo procesal de la inversión de la carga de la prueba, y así a partir de las primeras sentencias iniciadas por la de 10 de julio de 1943 y consagradas en la de 30 de junio de 1959, el Tribunal Supremo presume que el daño se produce por culpa imputable al autor del mismo, siendo a este último a quien corresponde probar que ha actuado con la diligencia debida, de manera que al demandante le es suficiente acreditar que el demandado ha causado el daño, y corresponde a éste acreditar que en todo momento ha actuado con diligencia. Desde 1981 se ha tendido a la objetivación, pero no de forma absoluta.
Nexo o relación de causalidad entre la acción u omisión y el daño
O lo que es lo mismo, "la relación causa-efecto entre la conducta o comportamiento de la persona que lo produce y el resultado dañoso". Como indica Ricardo de Ángel Yagüez, una de las consecuencias de la doctrina de la relación de causalidad es que el presunto autor de un daño puede verse exento de responsabilidad si acredita que entre su comportamiento y el resultado ha mediado una causa extraña e inimputable, de tal naturaleza y entidad que su comportamiento deba considerarse irrelevante en el desarrollo del resultado lesivo. Puede también ocurrir que la causa extraña concurrente no sea bastante para descartar toda responsabilidad, sino sólo para eximir de la que correspondería al "último resultado" producido, sin eliminar la propia de "resultados intermedios" (el ejemplo clásico que se utiliza es el de que no cabrá imputar al responsable de haber causado heridas leves a otro, los daños que éste haya sufrido a resultas del accidente de circulación en que se ve envuelto el taxi que ha cogido para ir al hospital). Este presupuesto necesario para el nacimiento de la responsabilidad civil cobra especial relevancia en el ámbito de la materia objeto de nuestro estudio, como se verá más adelante, cuando hagamos expresa referencia a las cuestiones concretas que los profesionales sanitarios plantean en relación con su actuación en el ámbito del tratamiento y la información a los pacientes con trastornos del sueño.
La concurrencia de alguna de las causas externas quebrantadora del nexo causal ha de probarse y, en todo caso, se ha de partir de la base de que se trata de causas concretas:
1. El caso fortuito y la fuerza mayor, entendiendo normalmente y al margen de las discusiones doctrinales que concurre el primero cuando el evento productor del daño no ha podido preverse, pero que de haberse previsto se hubiera evitado, y por fuerza mayor aquel suceso que en todo caso resulta inevitable.
2. La acción de un tercero.
3. La acción del propio perjudicado. Si hay exclusivamente culpa del perjudicado, la responsabilidad del agente no existe, obviamente, porque concurre un actuar no culposo o diligente suyo, con un actuar culposo de la víctima. En cambio, el problema se plantea cuando ambas conductas son culposas; en este caso, doctrina y jurisprudencia entienden que la obligación de reparar del agente debe verse disminuida en su intensidad o cuantía, al concurrir la culpa del propio perjudicado con fundamento en el artículo 1.103 del Código Civil, que faculta a los Tribunales para moderar la responsabilidad procedente de la culpa.
El artículo 1903 del Código Civil establece que la obligación que impone el artículo 1902 es exigible no sólo por los actos u omisiones propios, sino por los de aquellas personas de quienes se debe responder. De este modo se produce una disociación aparentemente entre el responsable y el agente del daño. El fundamento de la responsabilidad por hecho ajeno ha de buscarse en el propio tenor precepto, pues después de regular los supuestos en que se da aquella responsabilidad, dice que "la responsabilidad de que trata este artículo cesará cuando las personas en él mencionadas prueben que emplearon toda la diligencia de un buen padre de familia para prevenir el daño".
Por tanto, se han de destacar 2 aspectos: la presunción de que, por parte de los responsables, había existido negligencia en el control de hijos, tutelados o dependientes, o en la elección de estos últimos (personas que cita el precepto), y la conveniencia de asegurar a las víctimas la percepción de la indemnización por los daños que sufriesen, dada la presumible insolvencia de los autores materiales de los hechos (hijos, aprendices, empleados, etc.).
A modo de aplicación del principio de responsabilidad indirecta, el precepto regula los siguientes supuestos:
1. La responsabilidad de los padres de los daños causados por los hijos que se encuentran bajo su guarda.
2. La responsabilidad del tutor de los perjuicios causados por los menores o incapacitados que están bajo su autoridad y habitan en su compañía.
3. La responsabilidad de los empresarios respecto de los perjuicios causados por sus dependientes en el servicio de los ramos en que los tuvieren empleados, o con ocasión de sus funciones.
4. Responsabilidad de las personas o entidades que sean titulares de un centro docente de enseñanza no superior por los daños y perjuicios causados por sus alumnos menores de edad, durante los períodos en que se hallen bajo el control o vigilancia del profesorado del centro, desarrollando actividades escolares o extraescolares y complementarias.
Según Señala Diez Picazo, no es exhaustiva la enumeración de supuestos contemplados en el artículo 1903 del Código Civil, sino que será posible extender el principio de la responsabilidad por hecho ajeno a otras situaciones distintas, siempre que exista una relación jurídica determinante de un nexo de jerarquía o subordinación que permite dar a otros órdenes e instrucciones.
La responsabilidad civil médica en general
Siguiendo a Plaza Penadés, se entiende por "responsabilidad civil medicosanitaria" la derivada de los daños causados en la salud de las personas con ocasión de la prestación de servicios sanitarios, por parte de médicos o facultativos y del personal sanitario en general, así como, en su caso, la responsabilidad del centro sanitario u hospitalario. Indica el citado autor que, hasta ahora era habitual catalogar la prestación sanitaria de la que nace la responsabilidad del médico y del personal sanitario como una actividad o prestación de medios, donde no se puede garantizar el resultado de la sanación, si bien dicha actividad debe de prestarse de conformidad con unas reglas mínimas y comúnmente aceptadas por la lex artis ad hoc, y con una diligencia extrema en el cuidado del paciente en todo momento.
La sentencia del Tribunal Superior de 6 de noviembre de 1990, en relación con lo anterior, decía que:
"La obligación contractual o extracontractual del médico, más en general del profesional sanitario, no es la de obtener en todo caso la recuperación del enfermo o, lo que es igual, no es la suya una obligación de resultado, sino una obligación de medios; es decir, está obligado, no a curar al enfermo, sino a proporcionarle todos los cuidados que requiera según el estado de la ciencia; además, en la conducta de los profesionales sanitarios queda, en general, descartada toda clase de responsabilidad más o menos objetiva, sin que opere la inversión de la carga de la prueba."
No obstante, se admite, en determinados ámbitos de la medicina, que la responsabilidad se deriva de una prestación de resultado, como en la cirugía estética, la oftalmología, la odontología y las operaciones con fines anticonceptivos (implantes de dispositivos intrauterinos, vasectomía o ligadura de trompas).
También se ha aceptado una nueva fuente de responsabilidad sanitaria autónoma e independiente, que opera a pesar de que la prestación sanitaria haya sido correcta o de que se haya obtenido el resultado previsible; es el caso de la falta de información adecuada al paciente, que impide que éste pueda manifestar un consentimiento informado frente a una concreta actuación o servicio sanitario. A este respecto el Tribunal Supremo, en la sentencia de 12 de enero de 2001, indica que el derecho a la información y el consentimiento informado tienden a catalogarse como derechos fundamentales de las personas, como usuarias de la sanidad.
Normalmente, se ha exigido este tipo de responsabilidad medicosanitaria por la vía del artículo 1.902 del Código Civil (responsabilidad extracontractual), y/o por la vía del 1.101 del Código Civil (responsabilidad contractual), y es necesario que el paciente pruebe el carácter culpable o negligente de la actuación del médico o facultativo y del resto del personal sanitario, sin que opere, por regla general, una inversión de la carga de la prueba, salvo en los casos de daños desproporcionados, donde el resultado habla por sí mismo, lo que permite presumir la actuación culpable del personal sanitario, o bien en los supuestos de falta de información antes señalados, en los que se produce un desplazamiento de la carga probatoria. En estos casos corresponde al personal o institución sanitaria la acreditación de que la información se ha facilitado.
La sentencia de la Sección Sexta n.o 467 de 18 de mayo de 2000, dictada en el rollo de apelación 1039/99 (Presidente. Sr. Ortega Llorca), contiene un resumen doctrinal y jurisprudencial sobre la responsabilidad médica profesional, desde su doble perspectiva contractual y extracontractual, en los siguientes términos:
"La responsabilidad médica es expresión de la más amplia de la responsabilidad profesional y tiene especiales caracteres, pero no especiales prerrogativas. Puede ser una responsabilidad contractual, cuando se ha producido un daño por incumplimiento total o parcial de un contrato que contempla el artículo 1101 del Código Civil ('para que surja la responsabilidad contractual es preciso que la realización del hecho daños o acontezca dentro de la rigurosa órbita de lo pactado y como preciso desarrollo del contenido negocial', dice literalmente la sentencia de 11 octubre 1991 [RA 1991\8230], que reitera la de 5 julio 1994 [RA 1994\5602]), o 'extracontractual', cuando el daño no deriva de la ejecución del contrato, sino que se ha producido al margen de la relación contractual o el profesional no ha contratado con la víctima, como sería el caso del médico dependiente del Instituto Nacional de la Salud, cuya responsabilidad extracontractual u obligación derivada de acto ilícito (principio alterum non laedere) se contempla como principio en el artículo 1.902 del Código Civil y se desarrolla en la jurisprudencia.
La obligación del médico, tanto si procede de contrato como si deriva de una relación extracontractual, es una obligación de actividad (o de medios), no de resultado, como reiteradamente ha declarado la jurisprudencia (sentencias de 8 de mayo de 1991, 20 de febrero de 1992, 13 de octubre de 1992, 2 de febrero de 1993, 7 de julio de 1993, 15 de noviembre de 1993, 12 de julio de 1994, 24 de septiembre de 1994, 16 de febrero de 1995, 23 de septiembre de 1996 y 15 de octubre de 1996). La idea que se mantiene es que la obligación no es la de obtener un resultado, sino la de prestar el servicio más adecuado en orden a la consecución de un resultado. Así, una doctrina reiterada del Tribunal Supremo subordina a la previa acreditación de una clara negligencia por parte de quien presta tales servicios, calificados como originadores de una obligación de medios, independiente de los resultados que con ello se obtengan (sentencia del Tribunal Supremo de 29 julio de 1994). Aunque debe señalarse que esta doctrina ha sido matizada al razonar sobre el resultado; en este sentido, dice la sentencia del Tribunal Supremo de 2 de diciembre de 1996 que, no obstante ser la profesión médica una actividad que exige diligencia en cuanto a los medios que se emplean para la curación o sanación, adecuados según la lex artis ad hoc, no se excluye la presunción desfavorable que pueda generar un mal resultado, cuando éste, por su desproporción con lo que es usual comparativamente, según las reglas de la experiencia y el sentido común, revele inductivamente la penuria negligente de los medios empleados, según el estado de la ciencia y las circunstancias de tiempo y lugar, o el descuido en su conveniente y temporánea utilización. Se permite, claro está, que la falta de diligencia en la actividad se deduzca de la producción del daño, en relación de causalidad con la actividad del profesional médico (sentencia de 22 de abril de 1997), pues la responsabilidad en el ámbito sanitario exige la necesaria e incluso concentrada y máxima atención al enfermo, por no resultar de recibo satisfactorio las precipitaciones ni los diagnósticos inadecuados, incompletos, rutinarios o apresurados, ya que la salud es un derecho fundamental de las personas, que les hace acreedores de obtener todas las prestaciones sanitarias precisas e idóneas, sin regateos u omisiones injustificadas, para el logro de su restablecimiento (sentencia de 9 de junio de 1997). Por otro lado, no es preciso que, en casos en que se omite la adopción de un rápido tratamiento, el requisito del nexo causal tenga que concurrir con matemática exactitud (sentencia del Tribunal Supremo de 25 de septiembre de 1999)."
Conviene indicar, finalmente, que se admite la aplicación de los artículos 25 a 28 de la Ley General para la Defensa de los Consumidores y Usuarios, en supuestos de responsabilidad civil médica y hospitalaria. En relación con la expresada normativa, señala Plaza Penadés que en la jurisprudencia del Tribunal Supremo pueden destacarse 3 fases en su aplicación a este tipo de supuestos:
1. Una primera fase de inaplicación de la responsabilidad objetiva contenida en la Ley General para la Defensa de los Consumidores y Usuarios, que resulta de la sentencia de 22 de julio de 1994, en la que se examinaba un supuesto acaecido en 1985 cuando, como consecuencia del tratamiento que recibe un paciente aquejado de un infarto agudo de miocardio, se le causa una tetraplejía que le impide valerse por sí mismo. El Tribunal Supremo declaró que era dudoso que el artículo 28 de la indicada Ley consagrara un sistema de responsabilidad objetiva, que entendía que no podía invocarse en supuestos de responsabilidad civil hospitalaria.
2. Una segunda fase viene representada por la admisión de la normativa de consumo y resolución, conforme a los artículos 1902 y 1903 del Código Civil, que tiene como punto de partida la sentencia de 1 de julio de 1997, que califica como "usuario" al paciente en el servicio sanitario, y configura la responsabilidad del artículo 28 como "objetiva", ya que cubre los daños originados en el correcto uso de los servicios, pero la ratio decidendi recae en la aplicación del artículo 1.902 y 1.903, en su caso.
3. La fase actual que configura la responsabilidad civil médico sanitaria por vía del artículo 28 de la Ley General para la Defensa de los Consumidores y Usuarios, a partir de la sentencia de 9 de junio de 1998, en la que no sólo se acepta la aplicación del precepto, sino que se asienta sobre él la ratio decidendi, con aplicación del mismo de oficio por el tribunal, dado que no se había invocado por la defensa de la víctima paciente sometido voluntariamente a una operación de mejora de audición, que en el transcurso de ésta sufre un shock anafiláctico que determina un estado de coma irreversible, y se mantiene en estado vegetativo hasta su fallecimiento, que la había encauzado a través de los artículos 1902 y 1903 del Código Civil.
LA RESPONSABILIDAD DEL PACIENTE CON PROBLEMAS RESPIRATORIOS DURANTE EL SUEÑO
Dentro del marco anteriormente descrito se sitúa, en principio, la responsabilidad de cualquier individuo, y lógicamente la de los pacientes con síndrome de apneas-hipopneas del sueño grave, sea cual sea su actividad profesional y el ámbito en el que el eventual hecho dañoso pueda producirse, ya sea en el ámbito laboral como consecuencia, por ejemplo, del uso de maquinaria peligrosa, o por el propio riesgo personal que entrañe la actividad (p. ej., el obrero de la construcción que realiza su trabajo sobre un andamio), ya sea como consecuencia de un accidente de circulación.
En relación con lo expuesto, los organizadores de estas Jornadas han planteado una serie de cuestiones, cuya eventual respuesta quieren conocer, pero conviene recordar que, al igual que pasa en la ciencia médica, tampoco la jurídica es una ciencia exacta, en la que la eventual respuesta sea idéntica para todos los casos, pues en cada caso concreto concurre una serie de circunstancias específicas que pueden determinar esenciales diferencias respecto de otro aparentemente semejante. No obstante, y sin perjuicio de partir de la anterior premisa, analizaremos las cuestiones objeto de debate, con el ánimo de intentar despejar algunas de las dudas más comunes.
La cuestión que se plantea es la del paciente con síndrome de apneas-hipopneas del sueño grave conductor habitual que debe tratarse y que se niega a someterse a tratamiento: la actitud que debe adoptar el profesional médico, además de la propia de su actividad médica, es facilitarle la correspondiente información acerca de las graves consecuencias que pueden derivarse de la negativa de seguir el correspondiente tratamiento para superar la enfermedad, así como el riesgo que asume personalmente y frente a los demás. Por otra parte, se habrá de tener presente la actual normativa en materia de prevención de riesgos laborales, a la que se hará la correspondiente referencia. Distinguiremos, pues, algunas y diversas situaciones:
1. Fallecimiento del paciente o daños personales sufridos como consecuencia de un accidente de circulación. En nuestra experiencia profesional, y pese a la constante incidencia que los accidentes de circulación tienen en nuestra actividad como juristas, no hemos tenido la ocasión de examinar ningún supuesto en el que se haya invocado como causa del accidente circulatorio que la víctima padeciera el síndrome que aquí se analiza y que se hubiera negado a someterse a tratamiento. No obstante, como hipótesis, cabría la alegación de la culpa exclusiva de la víctima o la posibilidad de moderación de responsabilidad si se apreciase una concurrencia de causas.
2. Daños producidos por el paciente a terceros.
En principio, y de nuevo, entran en juego las normas que sobre responsabilidad civil se han examinado anteriormente, sin que existan motivos para hacer extensiva la responsabilidad a los profesionales médicos que detectaron la enfermedad, efectuaron el correspondiente diagnóstico e informaron ampliamente al paciente de los riesgos que asumía.
Se plantea la cuestión en orden a la cobertura del accidente por parte de las entidades aseguradoras. No hemos tenido oportunidad de examinar, en relación con las pólizas de responsabilidad civil o las derivadas del seguro obligatorio de vehículos de motor, la invocación de existencia de cláusulas de exoneración de la responsabilidad, por el padecimiento de esta enfermedad en lo que se refiere a la responsabilidad frente a terceros, probablemente porque como hemos tenido ocasión de leer un dato de relieve es el relativo a la actual situación de infradiagnóstico. Esto ha determinado, probablemente, que en términos jurídicos no se haya dado relevancia al tema, entre otras cuestiones, por la dificultad que entraña conocer la existencia de la enfermedad en el sujeto concreto que sufrió o provocó el accidente, si éste estaba o no diagnosticado e informado, y si voluntariamente se negó a seguir el tratamiento indicado para superar la enfermedad. En el ámbito jurídico, la actividad probatoria cobra una especial relevancia, y algunos de estos aspectos, como el relativo a la voluntad, no son siempre fáciles de probar.
Sí se ha planteado la cuestión, sin embargo, desde la perspectiva de los contratos de seguro de enfermedad. Así, la sentencia de la Audiencia Provincial de Navarra (Sección 3.a) de 15 de febrero de 2000 analiza un supuesto en el que se formulaba reclamación de cantidad frente a la aseguradora por razón del período de incapacidad del asegurado por un ataque de insuficiencia cardíaca aguda que le obligó a estar de baja laboral, cuyo origen estaba en el padecimiento de "síndrome de apnea obstructiva del sueño" diagnosticada en 1989, y por tanto con anterioridad a la fecha de inicio de la vigencia de la póliza. La aseguradora había sometido al tomador del seguro el llamado cuestionario de salud, en el que se le preguntaba acerca de si había padecido o padecía alguna enfermedad grave o defecto físico, a lo que el tomador del seguro, sabedor del diagnóstico anteriormente referido y de la calificación de la gravedad de su enfermedad, silenció tal dato de incidencia en la valoración del riesgo, por lo que, con arreglo al contenido del artículo 10.3.o de la Ley de Contrato de Seguro, se apreció que mediaba culpa grave por parte del tomador del seguro y quedó liberada la entidad aseguradora del pago de la prestación contemplada en la póliza, suscrita 10 años después del diagnóstico.
ACTIVIDAD MÉDICA. ALCANCE DE LA RESPONSABILIDAD DEL PROFESIONAL EN RELACIÓN CON LOS PROBLEMAS DERIVADOS DEL DIAGNÓSTICO Y EL TRATAMIENTO DE LOS PACIENTES CON TRASTORNOS DEL SUEÑO
Aun cuando, en los apartados anteriores, se han anticipado algunos aspectos de la actuación profesional de los médicos frente al paciente, y en lo que se refiere a dar cumplida información del alcance y consecuencias de la enfermedad, conviene intentar despejar algunas de las dudas que plantean los médicos. No obstante, como se ha indicado con anterioridad, desde la perspectiva jurídica, como desde la médica, cada caso concreto se ha de valorar desde su individualidad y especificidad.
Los médicos quieren saber qué ocurre cuando un médico de una unidad de sueño ve a un paciente con alta sospecha de síndrome de apneas-hiponeas del sueño, y tiene síntomas y/o una profesión de riesgo (conductor, persona encargada del manejo de maquinaria peligrosa, etc.) y, aunque trate de hacerle el estudio de sueño de forma urgente, la lista de espera hace que el paciente tenga que estar un tiempo en ella, de manera que, entre tanto, se produce un accidente. Ciertamente, se han de seguir los parámetros que, en materia de responsabilidad médica, se han determinado con anterioridad, a fin de establecer en cada supuesto concreto el grado de responsabilidad del médico, el centro hospitalario y, en su caso, las autoridades sanitarias, por cuanto que, como se ha indicado precedentemente, la obligación contractual o extracontractual del médico, no es la de obtener en todo caso la recuperación del enfermo o, lo que es igual, no es la suya una obligación de resultado, sino una obligación de medios. Si han fallado los medios, podrá producirse, lógicamente, el nacimiento de la responsabilidad especialmente del centro hospitalario y de las autoridades sanitarias,desde la perspectiva de los artículos 1.101 y 1.902 y 1.903 del Código Civil o de la de los artículos 25 y 28 de la Ley General para la Defensa de los Consumidores y Usuarios. En todo caso, el deber de información del médico hacia el paciente en orden a la existencia de la sospecha y de los riesgos que entraña el desarrollo de actividades peligrosas, tanto para el paciente como para terceros, es esencial, y debe valorar, incluso, la procedencia de la baja laboral.
Por tanto, cuando un médico de una unidad de sueño ve a un paciente con alta sospecha de síndrome de apneas-hipopneas del sueño y tiene síntomas y/o una profesión de riesgo debe informar ampliamente al paciente de la necesidad de someterse a tratamiento y de las consecuencias que para sí mismo y para los demás se derivan. Además debe proceder a la realización del estudio de sueño a la mayor brevedad posible, de conformidad con los medios de que se dispongan, y en función de cada caso concreto, actuando, en definitiva, conforme a los protocolos para el tratamiento de la enfermedad.
Sin embargo, la preocupación expresada abarca otras cuestiones ajenas a la propia relación entre el médico y el paciente, y afecta a otras dimensiones de naturaleza administrativa en la medida en que incide en aspectos como la obtención y la renovación del permiso de conducir, o a la propia actividad laboral del paciente. Conviene indicar que, en todo caso, la actuación del profesional en lo que a la expedición de certificados se refiere, debe ajustarse a la realidad del caso que examina, sin que quepa en modo alguno encubrir situaciones de riesgo. Por lo demás, conviene tener presentes los siguientes ámbitos de control:
1. Respecto de la obtención y renovación del permiso de conducir. Se ha de tener presente que, con arreglo al contenido del artículo 14 del Real Decreto 772/1997, de 30 de mayo, quien pretenda obtener el permiso de conducir, deberá cumplir, entre otros requisitos, el relativo a "reunir las aptitudes psicofísicas requeridas en relación con la clase del permiso o licencia que se solicite". Del artículo 45 resulta la obligación de someterse a las pruebas y exploraciones necesarias que se han de desarrollar por los centros de reconocimiento de conductores regulados en el Real Decreto 2.272/1985 de 4 de diciembre, y disposiciones complementarias, donde se ha de observar si la persona examinada padece o puede padecer algún trastorno del sueño, puesto que, con arreglo al contenido del Anexo IV de la norma expresada, apartado 7.2 y 10.6, se establecen los criterios de aptitud para obtener o prorrogar permiso o licencia de conducción ordinarios en supuestos de trastornos del sueño de origen respiratorio y no respiratorio. Por tanto, en principio, a estos centros de reconocimiento corresponde detectar la apnea en pacientes no diagnosticados o superar la ocultación de datos por parte de quien está diagnosticado, con arreglo a diversos parámetros, entre los que se pueden encontrar los difundidos por la SEPAR en una campaña en colaboración con la Dirección General de Tráfico, en 1997. En ésta se difundieron criterios para identificar a los enfermos de apnea y de narcolepsia. En todo caso, y a los efectos que prevé la norma, la unidad de sueño que deba certificar, a fin de la obtención o prorroga de la licencia, deberá hacerlo con arreglo a la realidad del caso concreto, e indicar si efectivamente el sujeto está sometido a tratamiento y control, sin que en principio se pueda extender al profesional médico la responsabilidad de un eventual accidente, si con posterioridad a la emisión del informe favorable, el paciente abandonara voluntariamente el tratamiento, por cuanto que se produciría una rotura de la relación de causalidad.
2. Se ha de tener presente, por otra parte, y en lo que a los accidentes laborales se refiere, la normativa vigente en materia de prevención de riesgos laborales. Del contenido de la Ley 31/1995, de 8 de noviembre, artículo 22, se extrae el deber que se impone al empresario de garantizar a los trabajadores a su servicio la vigilancia periódica de su estado de salud en función de los riesgos inherentes al trabajo, vigilancia, que si en principio sólo puede llevarse a cabo cuando éste preste su consentimiento, deviene obligatoria, por excepción al régimen voluntario, en los supuestos en los que la realización de los reconocimientos sea imprescindible para evaluar los efectos de las condiciones de trabajo sobre la salud de los trabajadores o para verificar si el estado de salud del trabajador puede ser un peligro para él mismo, para los demás trabajadores o para otras personas relacionadas con la empresa o cuando así esté establecido en una disposición legal en relación con la protección de riesgos específicos y actividades de especial peligrosidad. La propia norma establece el principio de confidencialidad de la información y se ha de poner en conexión con el artículo 25 relativo a la protección de trabajadores especialmente sensibles a determinados riesgos, por sus propias características personales o estado biológico conocido, entre los que debe incluirse a los pacientes con el tipo de trastornos que se analizan. Las mutuas laborales, conscientes de que los problemas del sueño suponen un grave riesgo de accidentes para los conductores profesionales, proponen protocolos de reconocimiento específico en el ámbito del sector del transporte.
3. Cabe plantear la posibilidad, muy alambicada, difícil de darse en la vida real, de que en casos extremos de riesgo grave e inminente, el médico pueda estar obligado a denunciar conforme a los artículos 259 y 262 la Ley de Enjuiciamiento Criminal, cuando conociera que el sujeto que padezca un síndrome de apneas-hipopneas del sueño realiza una actividad que, por razón de esa enfermedad, pudiera ser constitutiva de un delito doloso, como es el caso del artículo 381 del Código Penal.