TRATAMIENTO DEL DOLOR CRÓNICO ONCOLÓGICO
V. Guillem Porta
Jefe del Servicio de Oncología Médica. Fundación Instituto Valenciano de Oncología. Valencia. España.
INTRODUCCIÓN
El dolor es uno de los síntomas que con más frecuencia se relaciona con el cáncer, ya que ocurre aproximadamente en el 25% de los pacientes en el diagnóstico, y en el 75-80% de aquellos con enfermedad avanzada. Se calcula que el dolor secundario a tumores malignos afecta anualmente a más de 9 millones de personas en el mundo. Además, es uno de los síntomas mas temidos por los pacientes.
El dolor no controlado altera la calidad de vida de los pacientes, ya que afecta a su actividad física, su estado anímico, y las relaciones familiares y sociales. Por ello, el tratamiento del dolor debe ser uno de los pilares fundamentales en el tratamiento de estos pacientes. Todo paciente con cáncer debe ser preguntado en cada visita por la posible presencia de dolor.
En la última década, se ha mejorado de una forma importante en el tratamiento y el control de este síntoma, pero todavía hay un elevado número de pacientes con cáncer que sufren dolor en fases avanzadas de su enfermedad. El consumo de fármacos opiáceos en España todavía se sitúa en cifras sensiblemente inferiores a las deseables, de forma que llama la atención el elevado grado de calidad de la oncología médica española y el bajo consumo de morfina y derivados para el control del dolor de los pacientes oncológicos.
Las causas que justifican una deficiente analgesia en el paciente con cáncer son fundamentalmente: a) no utilizar pautas farmacológicas correctas; b) infradosificar los analgésicos; c) temores sin fundamento, por parte de médicos, personal de enfermería, pacientes y familiares, a los efectos secundarios de los opiáceos; d) no utilizar las frecuencias adecuadas en la administración de los analgésicos, y e) no combinar los diferentes fármacos con acción analgésica de forma correcta.
Mediante un tratamiento oncológico adecuado y/o un correcto tratamiento farmacologicoanalgésico, el dolor de origen maligno puede controlarse adecuadamente en más de un 90% de los casos. Pero, para el correcto enfoque terapéutico del dolor asociado al cáncer, debemos considerar en todo momento que el dolor no es un síntoma aislado, sino una manifestación más de la enfermedad de base, por lo que se debe diseñar un tratamiento multidisciplinario enfocado a tratar específicamente el síntoma y a atajar la enfermedad maligna y sus complicaciones, sin olvidar el entorno familiar y la situación psíquica del enfermo.
Recientemente ha sido introducido el concepto de dolor irruptivo (breakthrough pain), que hace referencia a los incrementos transitorios de dolor que se producen sobre un dolor de base. Este tipo de dolor se presenta entre el 41 y el 67% de los enfermos oncológicos, según diferentes estudios. Posiblemente uno de nuestros principales retos en el control del dolor oncológico consista en aprender a tratar de forma adecuada esta situación.
CAUSAS DEL DOLOR ONCOLÓGICO
La aparición del dolor en el enfermo con cáncer puede estar ocasionada por múltiples factores, que pueden estar relacionados con el tumor, el tratamiento o enfermedades intercurrentes. El crecimiento y la invasión del tumor o de sus metástasis pueden causar dolor por afección del hueso, los nervios, las partes blandas y las vísceras. La localización del tumor es un factor determinante en la frecuencia con que aparece este síntoma; así, por ejemplo, los tumores óseos se acompañan de dolor en el 85% de los casos y en cambio las leucemias y los linfomas sólo lo ocasionan en el 5-15% de los casos.
Los tratamientos oncológicos son los responsables de que uno de cada 5 pacientes sufra dolor como consecuencia de secuelas poscirugía (postoracotomía), posradioterapia (mucositis) o por toxicidad asociada a la administración de citostáticos (neuropatía periférica).
En otros casos, el dolor no está directamente relacionado con la presencia de un tumor ni de sus tratamientos sino que aparece como consecuencia de problemas asociados.
El dolor es un síntoma constante ante la presencia de inflamación o compresión de estructuras nerviosas o vasculares, obstrucción y distensión de vísceras huecas, inflamación, infección y necrosis de tejidos peritumorales, afección del periostio, presencia de lesiones óseas líticas, fracturas patológicas, y por lesiones viscerales o neurológicas ocasionadas por los tratamientos.
En el caso del dolor irruptivo, puede ser de origen incidental, idiopático o espontáneo o aparecer como consecuencia del fallo del final de la dosis del analgésico.
VALORACIÓN DEL DOLOR
Antes de iniciar un tratamiento, es necesario realizar una evaluación exhaustiva y correcta del paciente, que incluya:
Anamnesis. Es necesario documentar el tipo, la localización y la duración del dolor, así como su interferencia en las actividades diarias. Es necesario conocer las crisis de dolor irruptivo que aparecen a lo largo del día, así como las causas que lo desencadenan. Hay que tomarse el tiempo necesario para escuchar al paciente y explicarle las posibilidades y la eficacia de los tratamientos analgésicos, así como la valoración de la respuesta y de los efectos secundarios de los tratamientos analgésicos previos.
Exploración clínica completa, apoyada de todos los estudios analíticos radiológicos e isotópicos necesarios para establecer la causa. Dado que el dolor no puede medirse mediante pruebas diagnósticas, debe tomarse como válido y real lo que refiera el paciente. Debe evitarse el uso de placebos.
Evaluación de la intensidad álgica. Aunque se han estudiado multitud de métodos de valoración, seguimos sin disponer del método de valoración ideal, que sea objetivo, fácilmente reproducible y que refleje de una forma sencilla la intensidad real del dolor que presenta el paciente. Esto es así debido a que el dolor es un síntoma subjetivo, con importantes variaciones en su tolerancia de unos individuos a otros, y que está sometido a grandes influencias en función de factores personales, emocionales, ambientales, sociales, etc.
La forma generalmente más aceptada para la evaluación de la intensidad del dolor, por su sencillez y reproducibilidad, es la utilización de las escalas visuales analógicas (EVA), en las que el enfermo señala sobre una línea de 10 cm su intensidad dolorosa, teniendo en cuenta que en uno de los extremos se representa la total ausencia de dolor y en el extremo opuesto sería la equivalencia al máximo dolor soportable. La utilización de las EVA nos indicará la forma de iniciar una pauta analgésica o la conveniencia o no de modificar la analgésica previamente establecida si nos muestran un control inadecuado.
Evaluación del tipo de dolor. Existen, en general, 2 tipos de dolor:
* Dolor somático y visceral, debido a la estimulación de los nervios aferentes nociceptivos en la piel, las partes blandas, los huesos o las vísceras. Este tipo de dolor es bien controlado con los analgésicos habituales.
* Dolor neuropático, debido a la infiltración o compresión de nervios periféricos. Este tipo de dolor responde mal a los analgésicos habituales, y es necesario el tratamiento con antidepresivos, anticonvulsionantes e, incluso, en ocasiones, anestésicos y maniobras neuroquirúrgicas.
La revaluación del dolor y la respuesta al tratamiento debe realizarse con frecuencia, a efectos de corregir las pautas establecidas, si fuera necesario.
TRATAMIENTO DEL DOLOR ONCOLÓGICO
El mejor tratamiento para el dolor será aquel que vaya encaminado a erradicar la causa que lo produce. Por ello el tratamiento oncológico, bien local (cirugía y/o radioterapia), bien sistémico (quimioterapia, hormonoterapia inmunoterapia o modificadores de la respuesta biológica), será el arma terapéutica que más garantías nos dará para un adecuado control del dolor, tanto cualitativa como cuantitativamente.
Es igualmente cierto que sin unas sencillas normas a seguir en el tratamiento del dolor oncológico, el fracaso en su control está garantizado. Para asegurar el éxito del tratamiento farmacológico es necesario tener en cuenta unas directrices para la correcta utilización del arsenal farmacológico y evitar, además, una serie de factores que dificultan el control analgésico.
Desde hace varios años, el comité de expertos de la Organización Mundial de la Salud (OMS) recomienda la utilización de una pauta farmacológica escalonada (escalera analgésica de la OMS), que utiliza como primer escalón los antiinflamatorios no esteroideos (AINE); el escalón siguiente está representado por los narcóticos menores +/ AINE, y el tercer y último escalón corresponde a los narcóticos mayores +/ AINE. El paso de un nivel (escalón) al siguiente se hace ante la evidencia de la falta de un adecuado control analgésico. Algunos autores proponen la consideración de un "cuarto escalón", que correspondería al tratamiento del dolor mediante técnicas intervencionistas.
La asociación de medicación coadyuvante a los analgésicos es necesaria en muchas ocasiones y debe contemplarse en cualquiera de los tres grados de analgesia.
Recientemente se está planteando la conveniencia de obviar el segundo escalón de la OMS (narcóticos menores), pasando del primer al tercer escalón directamente o incluso iniciar la analgesia con opiáceos mayores, si la intensidad del dolor supera el valor de 6-7 en la EVA.
Debemos hacer una mención especial al dolor neuropático, dado que, por sus características, es el de más difícil control y requiere la asociación de opiáceos mayores, frecuentemente a dosis elevadas, corticoides, antidepresivos y anticonvulsionantes, cuando se presenta en forma de disestesias o de dolor lancinante (véase apartado de fármacos coadyuvantes).
ANTIINFLAMATORIOS NO ESTEROIDEOS
Son el primer paso a la hora de iniciar el tratamiento farmacológico del dolor. Los AINE son capaces de conseguir un adecuado control analgésico para dolores leves y moderados. Una importante limitación de los fármacos de este grupo es que poseen un techo analgésico, lo que significa que al sobrepasar determinada dosis no se mejora la eficacia analgésica y aumenta su iatrogenia. El fármaco más representativo de este grupo es el ácido acetilsalicílico, a dosis de 500-1.000 mg/6 h. Es un potente analgésico para todo tipo de dolores, a excepción de los de origen visceral.
Otros fármacos que se incluyen en este grupo son:
Paracetamol, 500-1.000 mg/4-6 h.
Pirazolonas (dipirona), 1-2 g/6 h.
Otros AINE icluyen el diclofenaco, la indometacina, el naproxeno, el aceclofenaco, etc. Los efectos secundarios más importantes de este grupo de fármacos son, fundamentalmente, la gastrolesividad (a excepción del paracetamol), lo que puede hacer que su uso esté contraindicado en pacientes con antecedentes de enfermedad ulcerosa.
NARCÓTICOS MENORES
Son también conocidos como opiáceos débiles. Su potencia analgésica es mayor que la de los AINE y, asociados a éstos, mejoran su eficacia. Se incluyen en este grupo:
Codeína, 30-60 mg/6 h.
Dihidrocodeína, 60 mg/12 h.
Dextropropoxifeno, 65 mg/4-6 h.
Tramadol, 50-100 mg/6 h. Actualmente están disponibles en el mercado nuevas formulaciones farmacéuticas para la administración retard (cada 12 h), lo que facilita la posología.
Los efectos secundarios son comunes a todos ellos, aunque el estreñimiento es el que presenta mayor incidencia. Otros efectos secundarios que pueden observarse con relativa frecuencia son las náuseas, los vómitos, la somnolencia, el dolor abdominal y la sequedad de mucosas. Debe tenerse en cuenta que el uso de fármacos de este grupo imposibilita su asociación con fármacos del escalón siguiente (narcóticos mayores).
NARCÓTICOS MAYORES
El fármaco más representativo de este grupo es la morfina, y es además el opiáceo mayor de elección por la sencillez en su manejo. Posee gran potencia analgésica, que aumenta a medida que se va escalando la dosis, ya que no posee techo analgésico.
Actualmente, se dispone de varias formas farmacéuticas para la administración de morfina que nos permiten seleccionar la mejor vía de administración en cada caso. La frecuencia con la que se debe administrar dependerá de la vía que se utilice y de la forma farmacéutica:
Vía oral, cada 4 h.
Vía oral o rectal de liberación lenta, cada 8-12 h.
Vía subcutánea, en infusión continua por bomba o cada 4 h.
Vía intravenosa para conseguir adecuado grado de analgesia de forma rápida y posteriormente iniciar la administración del opiáceo por vía oral, transdérmica, etc.
Vía intratecal, en infusión continua por bomba.
La dosis debe individualizarse y debe ir adaptándose en función del grado de analgesia conseguida. Una dosis inicial de morfina de 15 mg cada 4 h por vía oral es la adecuada.
El fentanilo es otro fármaco perteneciente al grupo de narcóticos mayores. Está disponible en forma de parches adhesivos para administración transdérmica (Durogesic®). Supone un gran avance en el tratamiento del dolor crónico ya que no utiliza la vía oral y su administración es bien sencilla (un parche dérmico cada 3 días). Supone una efectiva alternativa para aquellos pacientes con dolor y que precisan la administración de múltiples fármacos o en los que no está indicada la administración de narcóticos por vía oral.
Tras la incorporación del fentanilo transdérmico, la siguiente novedad importante incorporada al arsenal terapéutico contra el dolor oncológico es una nueva forma de presentación del fentanilo: transmucoso (Actiq®), que se presenta en forma de stick, con presentaciones de 200, 400, 600, 800, 1.200 y 1.600 μg. Está indicado para el tratamiento del dolor irruptivo, asociado a un analgésico potente que se utiliza como medicación de base.
La metadona es un narcótico mayor considerado "de recambio" para los casos en que no se puede utilizar la morfina. Su uso no está recomendado de inicio, ya que posee una media vida larga y, por tanto, existe riesgo de acumulación.
Otros fármacos opioides pertenecientes a este tercer nivel, pero no recomendados para el tratamiento del dolor oncológico moderado-intenso, son la meperidina, la buprenorfina y la pentazocina.
Los efectos secundarios de los narcóticos son comunes a todos ellos y los más importantes son:
Estreñimiento: siempre que se administren opioides hay que prevenir o tratar el estreñimiento mediante el aumento de la ingesta de líquidos, y de alimentos ricos en fibra y laxantes.
Náuseas y vómitos: administración de antieméticos como la metoclopramida, 20 mg cada 6 h, po, proclorperacina, 10 mg cada 6 h, po, haloperidol, 0,5-1,0 mg cada 8 h, po.
Sedación: suele ocurrir con frecuencia al inicio del tratamiento y disminuye su intensidad aproximadamente a la semana. En caso de persistir debe valorarse la disminución de la dosis o el cambio de fármaco.
Delirio: disminuir la dosis del opioide si el dolor está controlado o añadir fármacos coadyuvantes. Añadir haloperidol, 0,5-1,0 mg cada 6 h.
La depresión respiratoria, secundaria al uso de estos fármacos, es extremadamente rara a las dosis utilizadas como analgésicos. Su aparición sólo ocurre en casos de administración de dosis altas, en bolo, por vía parenteral.
En caso de aparición de depresión respiratoria o sedación excesiva debe administrarse naloxona para contrarrestar estos efectos. La dosis recomendada es de 0,4 mg i.v. o s.c., y puede repetirse la administración cada 2-3 min.
FÁRMACOS COADYUVANTES
En este apartado se incluyen un grupo de fármacos que, sin poseer efectos analgésicos, favorecen la acción de éstos y tienen un importante papel en el tratamiento combinado, fundamentalmente aumentando el umbral del dolor. Pertenecen a este grupo:
Benzodiazepinas: lorazepam, diacepam, etc.
Antidepresivos tricíclicos: amitriptilina, 25-75 mg por la noche.
Neurolépticos: fenotiacinas, butirofenonas.
Anticonvulsionantes: carbamazepina (100-400 mg/día), fenitoína (3-5 mg/kg/día), gabapentina (900-1.200 mg/día) y topiramato (50-300 mg/día).
Corticoides: prednisona (20-80 mg/día) o dexametasona (4-16 mg/día).
OTROS TRATAMIENTOS
Además del tratamiento farmacológico analgésico, al que nos hemos referido hasta ahora, disponemos de otras alternativas útiles para controlar el dolor por cáncer. Los bifosfonatos (clodronato, pamidronato, etidronato, ibandronato y zoledronato) son un grupo de fármacos que actúan impidiendo la resorción ósea secundaria a metástasis, y consiguen disminuir o retrasar la aparición de complicaciones óseas, como fracturas patológicas, hipecalcemias y dolor óseo.
La radioterapia con fines antiálgicos es una alternativa que debe tenerse en cuenta, ya que aporta un importante beneficio en un número considerable de pacientes con dolor óseo localizado y compresiones o infiltraciones neurológicas, vasculares o linfáticas. La administración de isótopos radiactivos (estroncio-89) también se ha mostrado efectiva para el tratamiento de las metástasis óseas. Las técnicas invasivas y las actuaciones neuroquirúrgicas pueden utilizarse con éxito en el 5-10% de pacientes debido a:
Fracaso de los tratamientos farmacológicos.
En aquellos casos en que el dolor es producido por infiltración de un nervio: plexo celíaco (carcinoma de páncreas), plexo hipogástrico, nervio intercostal o nervio periférico.
Las técnicas más frecuentemente utilizadas son:
Infusiones continuas, con bombas, intratecales o epidurales.
Procedimientos neurodestructivos: neurolisis, cordotomia.
BIBLIOGRAFÍA
Ahmedzai S and Kjær M. 13th International Symposium Supportive Care in Cancer. Copenhagen; 2001, June.
Ahmedzai SJJ. Pain Symptom Management 1997;13:254.
Cleeland CS, Gonin R, Hadfield AK, et al. Pain and its treatment in outpatients with metastatic cancer. N Engl J Med 1994;330:592-596.
Daud RL, Cleeland CS. The prevalence and severity of pain in cancer. Cancer 1982;50:191-8.
Doyle D, Hanks GW, McDonald N. Oxford textbook of palliative medicine. Oxford: Oxford University Press, 1994.
Guillem V, Lavernia J. Rev Cancer 1996;10(Supl 1):18.
Levy MH. Pharmacologic treatment of cancer pain. N Engl J Med 1996;335:1124-32.
Stjernsward J, Colleau SM, Ventafridda V. WHO Organization cancer pain and palliative care program: past, present and future. J Pain Symptom Manage 1996;12:6572.
Twycross RG. Incidence of pain. Clin Oncol 1984;3:515.
Wentein SM. Medical oncology: a comprehensive review. New York: PRR, 1996.
WHO Expert Committee. Cancer pain relief and palliative care. Geneva: WHO, 1990.
DOLOR REUMATOLÓGICO Y SUEÑO
R. Ruiz de la Torre
Hospital Verge dels Lliris. Alcoi. Alicante.
INTRODUCCIÓN
Cuando hablamos de enfermedad reumatológica, nos refirimos a la amplia patología del aparato locomotor, valorada desde el punto de vista del internista, y cuyas enfermedades son tributarias de tratarse médicamente, aunque en algún momento de su evolución precisen de la colaboración de otros procedimientos terapéuticos, como la rehabilitación y la fisioterapia o la cirugía ortopédica. En este grupo de enfermedades nos vamos a encontrar con muy diferentes afecciones, que afectan a articulaciones, huesos y tejidos blandos, como son los músculos, los tendones, los ligamentos, los nervios, etc.
El síntoma cardinal en una consulta de reumatología es el dolor, pero los trastornos del sueño en los enfermos reumáticos son de gran importancia, por su frecuencia y por la repercusión sobre la calidad de vida de los pacientes reumáticos.
No obstante, revisando la bibliografía de los trastornos del sueño, son muy escasos los trabajos publicados en relación con las enfermedades del aparato locomotor, si exceptuamos la fibromialgia y el síndrome de la fatiga crónica, que han sido más estudiados en este sentido, quizá por las alteraciones psicológicas y/o psiquiátricas que les acompañan, pero a los que no me referiré, por ser tema de otra ponencia.
Tampoco hablaré de las alteraciones del sueño ocasionadas por los dolores neuropáticos de procesos reumáticos, como los síndromes canaliculares, la ciática, la cervicobraquialgia, la distrofia simpaticorrefleja y los dolores óseos producidos por metástasis óseas, por ser tratadas también por otros ponentes.
DOLOR CRÓNICO Y ALTERACIÓN DEL SUEÑO
La estimación de sueño eficiente por parte del paciente puede estar alterada por múltiples factores, como ansiedad, estilo de vida, dieta, alcohol, condiciones médicas, edad, etc. Por otra parte, dos tercios de los pacientes con dolor crónico sufren insomnio, aunque la aparición del dolor precede a la queja de dificultad de conciliar el sueño en aproximadamente un 90% de los pacientes.
El dolor y la alteración del sueño llegan a desarrollar un círculo vicioso en el que un día de intenso dolor causa un pobre sueño durante la noche siguiente y la noche de mal sueño conduce a un dolor más intenso durante día siguiente. Existen unos mecanismos de interacción entre el dolor crónico y el insomnio. Mientras estamos despiertos la percepción del dolor se produce por mecanismos regidos por los sistemas sensorial y emocional, que no actúan cuando se duerme. Con técnicas de imagen del cerebro se ha demostrado que áreas límbicas se activan fuertemente con el dolor. Normalmente durante el sueño, el cerebro está filtrando la información sensorial con el fin de proteger su cuerpo. Experimentalmente se han aplicado, durante el sueño, pequeños estímulos dolorosos, y se ha demostrado que la nocicepción permanece activa aunque la reacción es menos intensa que cuando se está despierto, permaneciendo elevada en estadios III y IV no REM, y aumentando en el sueño REM.
El dolor se ha relacionado como la principal causa del insomnio en las enfermedades reumáticas. Especialmente en la artritis reumatoide (AR) y en la fibromialgia se han documentado los hallazgos patológicos durante el sueño con estudios objetivos. El dolor puede influir el proceso del sueño y alterar sus parámetros interactuando con el curso de la enfermedad. Por otra parte, las alteraciones del sueño pueden disminuir el umbral del dolor. El dolor en la AR está originado principalmente por estímulos nociceptivos periféricos en las articulaciones, provocados por la inflamación, pero la correspondencia entre el sueño y el dolor difiere con respecto a los aspectos sensoriales, fisiológicos y conductuales de cada individuo. Muchos estudios se han basado en análisis subjetivos del electroencefalograma (EEG). Sin embargo, las anomalías EEG no son específicas de la fibromialgia, ni de ninguna otra enfermedad, pues se han visto no sólo en enfermedades reumáticas como la AR, la artrosis o el síndrome de Sjögren, sino también en procesos psiquiátricos, cuadros postraumáticos y postinfecciosos pueden aparecer las mismas alteraciones.
TRASTORNOS DEL SUEÑO Y ENFERMEDADES REUMÁTICAS
No son habituales los estudios de los trastornos del sueño en las enfermedades reumáticas, aunque en la práctica clínica el reumatólogo oye constantemente la queja del paciente sobre las diferentes alteraciones del sueño en distintas entidades patológicas. De los más de 400 trabajos recogidos en el Doctor's Guide entre el 2 de enero de 2003 y el 15 de marzo de 2004, relacionados con los trastornos del sueño, solamente hay 4 que hagan referencia a las enfermedades autoinmunes o inflamatorias. Se ha estudiado la posible asociación del insomnio con alteraciones inmunes, comparando el funcionamiento entre dos grupos de pacientes, uno de pacientes con insomnio crónico y otro de buenos dormidores. A ambos grupos se les hizo analítica de sangre: recuento celular (leucocitos, linfocitos, monocitos), complementos C3 y C4, producción de citocinas (interleucina [IL] 1 beta, IL-2, interferón gamma), y antes de la segunda noche, evaluación polisomnográfica. De los resultados obtenidos se desprende que el insomnio crónico se asocia con algunas alteraciones inmunes, pero se necesitan más trabajos de investigación que determinen el significado clínico.
CLASIFICACIÓN DE LAS ENFERMEDADES REUMÁTICAS
Para exponer el tema que nos ocupa, voy a tratar de ir comentando las principales entidades reumatológicas que pueden repercutir en el descanso del paciente, alterando el sueño, siguiendo básicamente la clasificación del American College of Rheumatology (ACR).
Enfermedades inflamatorias del tejido conectivo
Artritis reumatoide
Es una enfermedad inflamatoria sistémica de etiología desconocida que sufren individuos genéticamente predispuestos. Se caracteriza por inflamar fundamentalmente a la membrana sinovial de articulaciones diartrodiales, de vainas tendinosas y de bursas sinoviales de deslizamiento. También puede afectar diversos órganos y sistemas. Tras su inicio, y en ausencia de tratamiento, la inflamación se suele mantener indefinidamente, lo que le da a la enfermedad un carácter crónico. Tiende a afectar a las articulaciones de manera simétrica característica, ya que no es perfecta soliendo haber un lado predominante. El tejido sinovial inflamado tiene características destructivas locales, que invaden y dañan las estructuras de la articulación, lo que da como resultado una alteración de su función. Junto con la inflamación esta destrucción total es responsable de la discapacidad que produce la enfermedad.
En el suero del 80% de los pacientes se detecta la presencia de factor reumatoide y en mucha menor proporción anticuerpos antinucleares y otros autoanticuerpos. Es frecuente la afección extraarticular, sobre todo nódulos reumatoides y más raramente, pueden afectarse diversos órganos. El diagnóstico se basa en el reconocimiento del cuadro clínico, y aunque las manifestaciones clínicas analíticas o radiológicas sean características, se pueden encontrar en otras afecciones. Para el diagnóstico de la AR actualmente se siguen los criterios del American College of Rheumatology modificados.
El comienzo puede ser de diferentes maneras pero es importante reconocer la enfermedad lo antes posible, ya que el diagnóstico precoz permitirá iniciar el tratamiento antes de que se produzca el daño estructural. Hay un comienzo insidioso, que es la forma más común de manifestarse la AR, en el que se notan, durante meses molestias progresivas, incluso nocturnas, que llegan a despertar al paciente. La rigidez matinal mayor de una hora de duración aparece en casi la totalidad de los casos. El comienzo agudo se da en la tercera parte de los enfermos, y comienza súbitamente con poliartritis simétrica muy incapacitante, con dolor continuo que le dificulta el sueño y es más frecuente en pacientes de mayor edad. Hay otro comienzo monoarticular, que nos obliga al diagnóstico diferencial con la artrosis, gota, etc.
El curso clínico está sometido a una importante variabilidad. Hay formas leves que evolucionan lentamente e incluso pueden entrar en remisión, pero lo habitual es que si no se trata correctamente, evolucione hacia la destrucción articular, con grandes deformidades que producen importante disfunción e impotencia funcional.
Las alteraciones del sueño en la AR pueden deberse a las alteraciones inmunes reseñadas anteriormente6, puesto que por otra parte en un estudio realizado en dos grupos de pacientes con AR, uno con y otro sin depresión mayor (DM). En los que tienen DM hay elevación de la escala visual analógica (EVA), del Pittsburg Sleep Quality Index (PSQI) y los valores del HLA DR, con respecto a los que no presentan DM, pero la alteración del sueño es similar en ambos grupos.
Espondiloartropatías inflamatorias
Espondilitis anquilosante (EA)
Es un reumatismo inflamatorio crónico que afecta de forma predominante al esqueleto axial, la pelvis, la columna vertebral y el tórax, y se localiza con más frecuencia y característicamente en las articulaciones sacroilíacas. También pueden afectarse las articulaciones periféricas, y algunos pacientes pueden desarrollar manifestaciones extraarticulares (uveítis, insuficiencia aórtica).
La etiología y la patogenia son desconocidas, pero la fuerte asociación con el HLA-B27 es la base sobre la que se orientan las teorías etiopatogénicas. La forma clásica de presentación de la EA es el síndrome sacroilíaco, bilateral con sacroileítis alternante, que puede irradiarse por la cara posterior de los muslos, simulando una ciática. El dolor se exacerba de madrugada.
El dolor vertebral, de cualquier segmento, pero más frecuente en la región lumbar, aparece tras largos períodos de reposo y sobre todo en la madrugada, despertando al paciente y obligándole a continuos cambios de posición. Es característica la rigidez vertebral matutina, que va desapareciendo a lo largo del día, con la actividad física. La radiografía muestra la alteración bilateral de la sacroilíacas, que evoluciona hacia la anquilosis. La osificación reactiva invade el anillo fibroso intervertebral, tendiendo a formar puentes sindesmofíticos. Las uniones sindesmofíticas darán lugar a la imagen de columna "salomónica" o "de caña de bambú". Posteriormente, al calcificarse el ligamento interespinoso da la imagen de "columna en 3 raíles". Para su diagnóstico se siguen los criterios de Nueva York de 1984.
Artrosis
Los procesos degenerativos del aparato locomotor no cursan con alteraciones del sueño, más bien al contrario, se caracterizan por encontrar mejoría con el reposo, lo que les permite una buena calidad del sueño.
Artropatías relacionadas con la infección
La artritis infecciosa o séptica es una reacción inflamatoria secundaria a la invasión directa de la articulación, por microorganismos patógenos que se manifiesta por dolor, inflamación y limitación de la movilidad articular. De los microorganismos implicados en su patogenia, las bacterias son los más importantes. A pesar de la precisión de los nuevos métodos diagnósticos y de las nuevas generaciones de antibióticos, estas artritis continúan teniendo una elevada morbilidad y mortalidad. La adicción a drogas por vía intravenosa es un importante factor predisponerte al desarrollo de artritis bacterianas.
La artritis séptica puede localizarse en cualquier articulación; las más frecuentes son las de los miembros inferiores (rodillas, tobillos y caderas) y las espondilitis infecciosas sobre todo las tuberculosas. El grado de destrucción articular depende no sólo de la cantidad de microorganismos que llegan a la articulación, sino también de su virulencia y de la resistencia del huésped a la infección.
El proceso inflamatorio puede llegar a ser de gran magnitud, produciendo importante destrucción articular, con dolor continuo, incluso nocturno que le impide al paciente conciliar el sueño.
El tratamiento es el específico de cada infección, previa realización de cultivo de material séptico y su antibiograma. Es necesario el uso de analgésicos, incluso opioides mayores, que permitan el descanso de estos pacientes.
Artropatías microcristalinas
Gota
Es una enfermedad que se manifiesta por presentar episodios inflamatorios generalmente monoarticulares, recurrentes que suelen ser muy intensos y autolimitados. La inflamación está íntimamente relacionada con la presencia de cristales de urato monosódico en el interior de las articulaciones o en zonas próximas, constituyendo los tofos. El diagnóstico se confirma mediante la identificación de cristales de urato monosódico en el líquido sinovial o formando parte de los tofos. La manifestación clínica más habitual de la gota es la aparición de la inflamación en articulaciones o en otras estructuras sinoviales en las que previamente se han depositado cristales de urato monosódico. Esta artritis suele ser monoarticular, de inicio brusco y frecuentemente nocturno.
En aproximadamente la mitad de los casos se inicia en la metatarsofalángica del primer dedo del pie y se conoce con el nombre de podagra. Es quizá el proceso reumatológico más conocido por su implicación nocturna, ya que el paciente lo refiere diciendo que le duele "hasta el roce de la sábana".
Otras artropatías microcristalinas como la de depósito de cristales de pirofosfato cálcico (condrocalcinosis) o por depósito de otros cristales, como fosfato cálcio básico, oxalato, etc., no se caracterizan por el dolor nocturno.
Enfermedades óseas
Osteoporosis
Enfermedad ósea sistémica caracterizada por una masa ósea baja, con alteración de la microarquitectura de los huesos, lo que conlleva un aumento de la fragilidad ósea y, por tanto, un aumento del riesgo de fracturas, según se definió en la Conferencia Consenso sobre Osteoporosis en Hong Kong, en 1993.
En 1994, la OMS definió la osteopoirosis según los resultados de la densitometría ósea, estableciendo 4 categorías:
Normal: cuando la densidad mineral ósea (DMO) es mayor de 1 desviación estándar (DE) del T-Score.
Osteopenia: cuando está entre 1 y 2,5 DE del T-score.
Osteoporosis: si es inferior a 2,5 DE del T-score.
Osteoporosis grave (establecida), si se añaden fracturas vertebrales.
La osteoporosis es conocida como la enfermedad silente, es decir, no es sintomática hasta que se produce la fractura, con dolor agudo provocado por el aplastamiento vertebral tras mínimos esfuerzos. Las fracturas más frecuentes se localizan en D8-D12 y en L1-L5 y darán lugar a una disminución de la talla y a un aumento de la cifosis dorsal. El dolor brusco, muy intenso, de la fractura vertebral aguda da lugar a la alteración del sueño ya que mínimos movimientos le provocan el despertar e incluso les es difícil poder conciliar el sueño. Afortunadamente, con la reparación de la factura cede el dolor intenso en 2-3 semanas, permitiendo que el paciente recupere su descanso nocturno.
Manifestaciones articulares de enfermedades de otros aparatos
En este capítulo haré referencia a un trastorno de índole neurológica, que se acompaña de movimientos periódicos durante el sueño y con frecuencia de insomnio. Se trata del síndrome de las piernas inquietas (SPI), que se caracteriza por una sensación desagradable en las extremidades, desencadenada con el reposo, sobre todo al atardecer o al caer la noche, que provoca la necesidad irreprimible de movilizarlas, lo que conduce al alivio o a la desesperación. En pacientes con insomnio, la prevalencia del SPI es mayor, y alcanza el 6%. Suele aparecer entre los 40 y los 50 años, su incidencia aumenta con la edad, y no hay diferencia entre sexos. Se estima que el SPI puede ser la cuarta causa de insomnio de la población general.
Mediante polisomnografía puede demostrarse disrupción inespecífica del patrón normal del sueño, así como movimientos normales periódicos en fase no REM. Sin embargo, su utilidad en el diagnóstico y tratamiento de los pacientes con SPI parece limitada.
BIBLIOGRAFÍA
Schubert CR, et al. Prevalence of sleep problems and quality of life in an loder population. Sleep 2002;25:889-893.
Lavigne GJ. Pain and insomnia. Insom, Issue 2, Winter 2003-2004.
Drenes AM. Pain and sep disturbances with special reference to fibromyalgia and rheumatoid arthritis. Rheumatology 1999;38:1035-8.
Moldofsky H, et al. Musculoskeletal symptoms and non-REM sleep disturbance in patients with fibrositis syndrome and healthy controls. Psycosom Med 1975;37:341-351.
Bonica JJ. General considerations in chronic pain. En: Bonica JJ, editor. The management of pain. Philadelphia: Lea and Febiger, 1990; p. 180-96.
Savard J, et al. Chronic insomnia and inmune functioning. Psycosom Med 2003;65:211-21.
Pascual Gómez E. Artritis reumatoide. Manifestaciones clínicas. En: Tratado de reumatología. Madrid: Aran Ediciones, 1998; p. 437-60.
Cakirbay H, et al. Sleep quality and inmune functions in rheumatoid arthritis patients with and without major depression. Int J Neurosci 2004;114:254-6.
Sanmartí Sala R. Espondilitis anquilosante. En: Tratado de reumatología. Madrid: Aran Ediciones, 1998; p. 997-1019.
Carreño Pérez L. Artritis de articulaciones periféricas por microorganismos piógenos. En: Tratado de reumatología. Madrid: Aran Ediciones, 1998; p. 1267-80.
Pascual Gómez E. Gota. En: Tratado de reumatología. Madrid: Aran Ediciones, 1998; p. 1460-75.
Tinturé Eguren T. Eritromelalgia. Síndrome de las piernas inquietas. En: Tratado de reumatología. Madrid: Aran Ediciones, 1998; p. 1837-43.
Coccagna G, Lugaresi E. Insomnia in restless legs síndrome. En: Gastaut H, Lugaresi E, Berti-Cerone G, Coccagna G, editors. The abnormalities of sleep in man: procedings of the 15th European Meeting on Electroencephalography, Bologna, 1967. Bologna: Aulo Gaggi Editore, 1968; p. 285-94.
DOLOR Y SUEÑO EN EL RECIÉN NACIDO
V. Roqués Serradilla y M. Roqués Escolar
Servicio Neonatología. Hospital Universitario La Fe. Valencia. España.
INTRODUCCIÓN
El conocimiento de los estados de sueño, en el recién nacido y el adulto, está basado en aspectos electroencefalográficos y la presencia o ausencia de movimientos oculares rápidos. Las características del sueño quieto no REM (SQ) y activo REM (SA), son similares a las encontradas en el niño mayor; no obstante, existe una proporción importante de un estado, sueño indeterminado (SI), que comporta simultáneamente las características del sueño quieto y activo.
Se ha identificado ciclos de estados despierto/dormido, mediante electroencefalograma, en recién nacidos prematuros de 24 semanas de gestación; sin embargo, es a partir de la semana 27 en la que pueden encontrarse períodos estables superiores a 5 min de SA y SQ, con una proporción importante (30% de media) de SI. A partir de la semana 35 el SI disminuye de forma significativa y ocupa un 10% del total del tiempo de sueño, con un SA más presente y durable que el SQ. La alternancia entre SA y SQ se efectúa de forma cíclica, como en el niño mayor, pero estos ciclos son de menor duración (45 min) de media hasta la semana 35, y 60-70 min en semanas posteriores1-3.
La prematuridad y el bajo peso no afectan a la organización del sueño si el niño esta clínica y neurológicamente normal. En el primer mes de vida el recién nacido a termino presenta un 40% del tiempo en SA, un 20% en SQ, un 14% somnoliento y un 13% muy alerta, el resto despierto4,5. En el niño prematuro el SA ocupa un 60-70% del día y se incrementa cuando está enfermo, así como el estado de despierto.
El niño viene de un ambiente intrauterino, en el que ha recibido una amplia variedad de estímulos (latido cardíaco materno, ruidos atenuados del ambiente exterior y cíclico rítmico como el sueño materno). En el nacimiento hay un cambio obligado en un entorno de luces brillantes, ruidos altos y repentinos, y experiencias dolorosas, agresiones que van a influir en la conducta emergente del niño en un momento en que es más vulnerable, sobre todo en los prematuros enfermos. Estos patrones inadecuados de entrada sensorial pueden llevar a distorsión de las funciones del niño pretérmino y alterar la organización de sus estados de sueño.
Los recién nacidos ingresados en cuidados intensivos neonatales sufren cerca de 5 intervenciones por hora, de las cuales al menos una de ellas es dolorosa. Durante estas intervenciones el niño cae frecuentemente en SA, con lo que se reduce la cantidad de SQ y aumenta el tiempo de despierto y llanto, y la consecuente alteración en el ritmo el sueño.
El incremento de la tasa de prematuridad y de su supervivencia ha motivado el estudio del entorno en las salas de hospitalización neonatal y la posible contribución de este entorno, junto con las actitudes en su tratamiento, en la evolución de la enfermedad del niño y su repercusión a largo plazo, implantandose medidas como el "desarrollo de cuidados", la "manipulación mínima", los "ciclos día/noche", con períodos de descanso entre las 19:00 y las 7:00 h, disciplinas indispensables en el cuidado del recién nacido.
Analizaremos algunos de los estímulos más importantes que pueden influir en el sueño en el recién nacido ingresado, ambientales (ruido y luz) y dolorosos, como consecuencia de su tratamiento.
RUIDO
Se han establecido recomendaciones de los niveles acústicos para las unidades neonatales6: 45 dB durante el día y 35 dB por la noche; no obstante, en un ambiente hospitalario es normal que existan niveles entre 50 y 70 dBA, según las zonas, lo que interfiere con el desarrollo normal del sueño en el recién nacido, aumentando el sueño activo e indeterminado en relación con el sueño quieto.
En nuestro servicio7 efectuamos un estudio de los niveles de ruido, y hemos encontrado valores medios, durante la semana, superiores a los 65 dBA, sin diferencia sustancial entre días de trabajo y fines de semana, así como entre día y noche (fig. 1). La identificación de la fuente de este ruido es importante, para establecer medidas de protección; así, las alarmas de los monitores, incubadoras y respiradores producen un aumento importante en los niveles de ruido, entre 56-60 dBA, y es el propio personal que trabaja en las unidades el que puede producirlos superiores.
Figura 1. Niveles de ruido durante los días de la semana.
Por este motivo, se han desarrollado estrategias para su atenuación (tabla 1), arquitectónicas, programas de participación del personal y de aislamiento individual. Las medidas arquitectónicas son mas eficaces en el diseño de nuevas unidades; no obstante, el uso de sistemas absorbentes de ruidos pueden aplicarse en las ya construidas.
Las personas que intervienen en el cuidado del recién nacido deben conocer los efectos perjudiciales del ruido y establecer medidas específicas para disminuir sus niveles, como hablar en tono bajo, limitar el uso de radios y otras fuentes de ruidos, como timbres de teléfono, entre otros. En nuestro servicio ha sido de utilidad el uso de un "sistema semáforo" conectado a micrófonos ambientales que presenta una luz verde con ruidos por debajo de 50 dBA y roja con ruidos por encima de 65 dBA.
El tercer grupo de estrategias para disminuir la exposición al ruido ambiental son las individuales: poner al niño dentro de una incubadora disminuye el nivel de ruido entre 10 y 15 dBA. La aplicación de cobertores, sabanas o mantas sobre la incubadora, como se utiliza en algunas unidades de neonatología, tiene muy poco efecto.
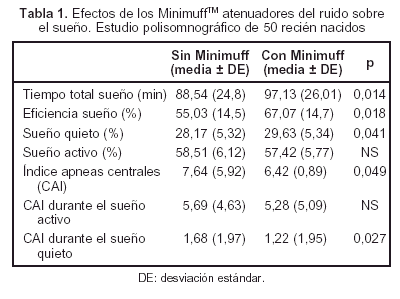
En la actualidad, el uso de "orejeras" se ha considerado un método eficaz para el aislamiento acústico individual. Nosotros realizamos un estudio polisomnográfico en 50 niños prematuros con un sistema de uso comercial (Minimuff Neonatal Noise Attenuators), con una capacidad de absorción de 7 dB. El total del tiempo de sueño (tabla 1) y su eficacia fueron significativamente más largos cuando los pacientes fueron aislados del ruido ambiental, así como el porcentaje del sueño quieto. También encontramos un índice menor de apneas centrales por hora de sueño total y por hora de sueño quieto.
LUZ
Los niveles apropiados de luz en las unidades neonatales no se han establecido, ya que los efectos perjudiciales son menos conocidos que los producidos por el ruido excesivo8. La frecuencia de "ojos abiertos" y estado despierto se han relacionado con los niveles de iluminación, así como con mayor cantidad de SA, aumentando los períodos de SQ cuando se disminuye la intensidad lumínica ambiental.
Últimamente se recomiendan luces diurnas ente 100 y 200 luxes y nocturnas de menos de 50 luxes, para permitir los ciclos de sueño del recién nacido, con fuentes de luz de mayor intensidad para la evaluación del recién nacido, cuando sea necesario.
En nuestra unidad (tabla 2), los niveles de luz durante el día varia de 450-800 luxes, aunque pueden alcanzar más de 100 luxes en las zonas cercanas a las ventanas. Por la noche, sólo se han conseguido menos de los 50 luxes recomendados en áreas de cuidados mínimos.
Al igual que para el control del ruido, se han desarrollado estrategias para su atenuación, arquitectónicas, programas de participación del personas y de aislamiento individual.
Las estrategias arquitectónicas, según las características geográficas del hospital, son las mayores variables para determinar los niveles de luz de la unidad. El diseño de las ventanas y su localización, el tipo de luz usada, etc. deben contemplar los estándares recomendados.
La posición del niño dentro de la unidad y su distancia a las ventanas tienen gran influencia en su exposición a la luz. La rotación de los puestos de hospitalización puede ser un buen método pueden regular esta exposición, así como el uso de persianas, para establecer períodos de oscurecimiento durante el día.
El uso de cobertores sobre las incubadoras o cunas, como medias de protección individual, pueden producir una reducción hasta del 65% (tabla 2) la exposición a la luz diurna en zonas muy iluminadas y por debajo de 50 luxes por la noche. Otras medidas, como tapar los ojos al niño, son de utilidad.
Estos factores ambientales en el sueño del recién nacido son de gran importancia, de tal forma que al reducir la intensidad del ruido y luz ambiental de las 19:00 a las 7:00 h, en las zonas de hospitalización, se ha observado un aumento del SA y un aumento de la organización de los estados de sueño9.
DOLOR
El dolor se ha cuestionado hasta hace pocos años en el recién nacido, un sustrato anatómico y neurofisiológico inmaduro en estos niños era el argumento en que se basaba esta creencia. En la actualidad no existe ninguna duda sobre su sensación dolorosa y los efectos a corto (alteraciones fisiológicas y de los estados se sueño), medio y largo plazo (hiperalgesia, hipersensibilización, disminución del umbral doloroso y cambios en el ritmo del sueño). Un niño ingresado en cuidados intensivos neonatales puede padecer entre 20-30 experiencias dolorosas al día (extracciones sangre, intubación, colocación de vías vasculares, movilizaciones, etc.), la mayoría de ellas sin adecuada analgesia. Este estimulo doloroso va a producir cambios en los estados del sueño, disminución de sus períodos, cambios rápidos en sus ciclos de estados y disminución del sueño REM (SA).
Se han desarrollado instrumentos de medida del dolor que permitan cuantificar su respuesta y establecer medidas de control y tratamiento. En la actualidad se usan más de 32 escores; en la mayoría de ellos, se utiliza la valoración del tipo de sueño, el más conocido es el Premature Infant Pain Profile (PIPP), en el que uno de los principales indicadores es el estado de sueño del niño prematuro.
La utilización de medidas preventivas (disminución del impacto ambiental, manejo con suavidad, pericia en el uso de procedimientos invasivos, reposo antes y entre los procedimientos dolorosos, uso de pacificadores, como chupetes, utilización de sacarosa al 25% inmediatamente antes de los procedimientos, como extracciones sanguíneas, analgesia local, etc.), o de tratamiento con el uso de analgesia opiode (morfina, fentanilo) o no opiode (paracetamol), han demostrado su eficacia en la atenuación y la intensidad del estímulo doloroso y mejora del sueño del niño.
CONCLUSIÓN
El recién nacido, y sobre todo el niño prematuro, son influenciables por múltiples estímulos externos en la organización de sus estados de sueño. Los períodos despierto y con llanto aumentan en detrimento de los de SQ y SA. Esta privación del sueño modifica de forma significativa la estructura de sus ciclos en un corto plazo, y afecta a funciones vitales (cardiorrespiratorias) y al desarrollo normal de esta estructura en etapas posteriores de la vida.
El conocimiento de esto debe servir para organizar el cuidado del recién nacido ingresado con medidas de prevención del dolor y de protección ambiental.
BIBLIOGRAFÍA
1. Curzi-Dascalova L. Figueroa JM. Eiselt M. Sleep state organization in premature infants of less than 35 weeks' gestational age. Pediatr Res 1993;34:624-8.
2. Curzi-Dascalova L. Development of the sleep and autonomic nervous system control in premature and full-term newborn infants. Arch Pediatr 1995;2:255-62.
3. Curzi-Dascalova L. Between-sleep states transition in premature babies. J. Sleep Res 2001;10:153-8.
4. Anders TF, Keener M. Sleep-wake patterns in full-term and premature infants during the first year of life. Sleep 1985;8:173-92.
5. Ficca G. Fagioli I, Salzarulo P. Sleep organization in the first year of life: developmental trends in the quiet sleep-paradoxical sleep cycle. J Sleep Res 2000;9:1-4.
6. American Academy of Pediatrics. Comité on environmental health. Noise: a hazard for the fetus and newborn. Pediatrics 1997;100:724-7.
7. Roqués V, Miranda J, Garrigues JV. Contaminación ambiental en las unidades de neonatología. RELAN 1999;(Suppl 1):99-105.
8 Robinson J, Moseley MJ, Fielder AR. Iluminance neonatal units. Arch Dis Child 1990;65:679-82.
9. Strauch C, Brandt S, Edwars-Beckett J. Implementation of a quiet hour effect on noise levels and infant sleep states. Neonatal Netword 1993;12:31-5.
DOLOR NEUROPÁTICO Y SUEÑO
J. López-Trigo
Jefe de Sección de Neurología. Hospital General Universitario. Valencia. España.
INTRODUCCIÓN
Los pacientes que sufren de dolor crónico experimentan alteraciones del sueño, normalmente reducción o privación de sueño que provoca un cansancio y apatía durante el día, este hecho estaba demostrado en los casos de depresión, aunque desde hace años sabemos que los pacientes con dolor crónico que tiene un claro origen somático como es el caso del dolor neuropático, sufren alteraciones del sueño en relación con los distintos estadios de su enfermedad. Los pacientes con síndrome regional complejo, neuropatía diabética dolorosa o neuralgia postherpética tienen alteraciones tanto cuantitativas como cualitativas del sueño.
Se ha llegado a decir que los pacientes con dolor neuropático sufren más por la falta de sueño que por el dolor. Los modelos animales propuestos y realizados especialmente en ratas en un intento de medir las alteraciones electroencefalográficas que se producen en el dolor neuropático no han mostrado alteraciones significativas, hecho este que ha sido explicado por el hecho de que estos modelos animales carecían de estímulos externos, por lo que no podían ser el espejo de la experiencia humana que incluye en las alteraciones del sueño los factores cognitivos sobre el dolor, los aspectos emocionales e incluso los sociales.
Por todo ello, las alteraciones del sueño en los pacientes con dolor neuropático se han medido y aún hoy se siguen midiendo a través de 2 tests fundamentalmente que son los que miden las calidad del sueño, y los tests de calidad de vida en los que se incluye la influencia del sueño en la calidad de vida del paciente.
En mi exposición lo que he tratado es de exponer como los diversos factores implicados en el dolor neuropático influyen en el sueño, desde los síntomas predominantes hasta las medicaciones a utilizar en el tratamiento del mismo.
¿QUÉ SÍNTOMAS INFLUYEN MÁS EN EL SUEÑO?
Desde hace años el Grupo del Dolor Neuropático de la SEN ha planteado la necesidad de que el diagnóstico, exploración y tratamiento del dolor neuropático se realice a través de los síntomas más que de las enfermedades que lo producen, por eso durante años un mismo tratamiento parece que haya servido para todo lo que ha llevado a muchos fracasos terapéuticos cuando se sabía que lo que en verdad marca el dolor es el tipo de dolor y su mecanismo de acción. Del mismo modo, al realizar los estudios sobre el sueño casi siempre se ha preguntado al paciente sobre la intensidad del dolor independientemente del síntoma doloroso que padecía el paciente. Por ello en estudios recientes promovidos por el grupo de dolor neuropático de la SEN hemos intentado establecer que síntomas influirían más en sueño del paciente y que influencia en la calidad de vida del paciente podría producirse por dicha falta de sueño.
En la figura 1 se han estudiado los diferentes síntomas espontáneos del dolor neuropático y su interferencia con el sueño y se ha establecido un valor medio de los mísmos a lo largo de un periodo de tres meses:
Figura 1. Síntomas y dolor.
Como se observa en el gráfico las disestesias es el síntoma que en principio menos afecta o interfiere con el sueño y como era lógico pensar la combinación de varías síntomas en concomitancia o no es el factor más influyente.
Prácticamente en todos ellos la sensación de interferencia con el sueño parece que diminuya a lo largo de las entrevistas como si el paciente en cada una de ellas notara una discreta mejoría seguramente debido al efecto placebo de la mayor atención, sabedor de encontrarse en un estudio, este hecho es sobre todo evidente en las parestesias.
Cabría esperar que el dolor lancinante interfiriera más con el sueño pero como se ve en la gráfica ocupa un tercer lugar, la explicación puede ser debida a que si los accesos de dolor no son frecuentes el paciente puede dormir horas sin ver interrumpido su sueño por lo que la apreciación es mucho más favorable.
En la figura 2 se exponen la interferencia con el sueño debido a signos evocados; globalmente éstos producen una menor afección, debido seguramente a que como su nombre indica estos signos son provocados y los pacientes durante sus horas de sueño desarrollan técnicas para evitar la aparición de estas molestias.
Figura 2. Signos evocados.
La alodinia es claramente el signo que más interfiere en el sueño, mientras que la hiperalgesia mecánica y el neuroma son lo que menos la afectan, llamando la atención que la hiperalgesia térmica especialmente en pacientes diabéticos es bastante molesta a la hora del sueño, siendo solucionado en muchos casos evitando por el paciente el calor directo de ropas (pijamas, mantas, etc.) el paciente duerme desnudo y compensa esa pérdida de calor con la utilización de calor ambiental ligeramente humidificado.
Sabemos que estos datos son puramente descriptivos sobre una población mínima de 15 sujetos por cada ítem y que en ellos influyen otras variables importantes como la edad, sexo, ámbito social, etc. Por todo ello no pretendemos afirmar que estos resultado sean exactos sino que intentamos orientar o dar ideas de por donde deberían ir los estudios sobre la interferencia en el sueño y en otros síntomas en los pacientes con dolor neuropático.
¿INFLUYE LA PRIVACIÓN DE SUEÑO EN LA CALIDAD DE VIDA?
La figura 3 muestra cómo la falta de sueño interfiere en la calidad de vida de estos pacientes para lo que se les ha preguntado que valoren en % esa afectación tanto en calidad de vida global, laborar y social.
Figura 3. Calidad de vida.
Las alteraciones de sueño en estos pacientes producen alteraciones en su calidad de vida, en todos los ítems la vida laboral es la que más se resiente, seguido de la vida social, por supuesto hay que valorar estos datos siempre teniendo en cuanta que la mayoría de estos pacientes se encuentran dentro de un cuadro depresivo y que hay múltiples factores que pueden influir como son de nuevo la edad, sexo, tipo de trabajo, etc. En general podríamos suponer como era por otra parte lógico que los síntomas y signos que más alteraciones iban a producir en el sueño eran las que más iban a influir en la calidad de vida de estos pacientes, resaltando que en el caso de la hiperalgesia térmica las soluciones que los pacientes aportan para la solución de la misma también se ven reflejadas en este gráfico.
¿QUÉ ENFERMEDADES CON DN PRODUCEN ALTERACIONES DE SUEÑO?
Por otro lado, y por no dejar de lado los estudios clásicos sobre el dolor neuropático, en la gráfica siguiente se exponen algunas de las patologías más relevantes y su interferencia con el sueño, de nuevo con una media aproximada de al menos 10 sujetos por cada patología (fig. 4).
Figura 4. Enfermedades.
Hemos querido incluir la migraña y el dolor tálamico, sabiendo que la sería motivo de discusión el considerar a la migraña como dolor neuropático no por ello y aunque sólo fuera de referencia hemos creido que sería de interés su inclusión, así como, la del dolor central gran olvidada en todos los estidios y ensayos clínicos aunque nosotros nos hemos centrado en el dolor tálamico para evitar la dispersión que el término dolor central podría acarrear.
Es la neuralgia postherpética la que más trastornos del sueño produce un poco en consecuencia con las gráficas anteriores donde la alodinia era un factor importante y hay que pensar que muchos de los pacientes con neuralgia postherpética presentan alodinia.
Resulta al menos curioso la alta incidencia de la migraña en el sueño, aunque en la mayoría de los estudios de migraña se señala la alta incidencia del predominio nocturno de la misma, además de que la mayoría de los cuadros migrañosos no ceden hasta después del reposo, pero por otra parte impiden entrar en él.
Llama la atención la contradicción de que el dolor tálamico muchas veces descrito como un dolor lancinante produzca poca interferencia en el sueño, la única explicación que se le puede dar es que en el grupo de estos pacientes el dolor talámico no sea homogeneo, incluso dentro del propio paciente por lo que la diversidad de este tipo de dolor podría inducir a una menor valoración por parte de los pacientes según la intensidad o tipo del mismo.
En nuestro estudio el dolor causado por la polineuropatía diabética tiene el valor más bajo, creo que las causas podrían ser las mismas que en caso del dolor tálamico.
¿CÓMO INFLUYEN LOS TRATAMIENTOS?
El grave problema de evaluar como influyen los tratamientos del DN en el sueño se debe a varias causas. La primera de ellas es que la una gran mayoría de las medicaciones utilizadas tienen dentro de sus efectos secundarios la provocación de somnolencia y/o sedación por lo que el efecto beneficioso de las mismas sobre el dolor y la mejoría de este en la mejoría de la calidad del sueño es muy difícil de evaluar.
Sabemos que los antidepresivos, antiepilépticos, anestésicos, bloqueadores de receptores NMDA, antipsicóticos, analgésicos opiáceos provocan en mayor o menos cuantía somnolencia y sedación, quedando fuera de este grupo algunos analgésicos y los AINE aunque su utilización el tratamiento del DN es puntual, en fases agudas y con un éxito limitado.
Por lo que sabemos hasta la actualidad entre los antidepresivos utilizados en el DN los que menos acción sedante presentan son la maprotilina, la nortriptilina y la desimipramina, y aunque la acción contra el dolor se ha diferenciado claramente de su acción antidepresiva, no así ocurre con la acción sedativa, por lo que las mejorías en el sueño de estos pacientes no podemos considerarlas independientes dicha acción. Por otro lado, si consideramos como factor influyente a la depresión en las alteraciones del sueño en estos pacientes probablemente la acción de estos fármacos sea contribuir a una mejoría dichos trastornos simplemente mejorando ese estado depresivo.
Tampoco podemos juzgar la acción de anestésicos como la lidocaína ya que el principal inconveniente de su uso y dado que en de la única manera que ha mostrando cierta eficacia en el tratamiento del DN es por vía intravenosa, es la gran sedación y somnolencia que produce. Algo semejante ocurre con los bloqueantes de NMDA como la ketamina que ha demostrado eficacia en el tratamiento de la neuralgia postherpética pero no solo produciendo una acción muy sedativa sino que además por su carácter disociativo produce pesadillas. El dextrometorfono un antitusígeno no opiode y la memantina también pertenecientes a este grupo no han mostrando de momento eficacia en el tratamiento del DN.
Por tanto, centrándonos en el tratamiento más en uso, los antiepilépticos, realizamos un estudio descriptivo sobre su efecto en el tratamiento del DN, sus efectos secundarios y los efectos sobre otros parámetros como el sueño y la calidad de vida, de manera semejante a la realizada con los síntomas. En la figura 5 hemos valorado distintos fármacos antiepilépticos desde el punto de vista de mejoría de las alteraciones del sueño, excluyendo aquellos pacientes que de alguna manera mostraban sedación o somnolencia provocados por estos fármacos, o sea, intentando sólo valorar aquellos que al mejorar el dolor mejoraban también el ritmo del sueño.
Figura 5. Antiepilépticos.
Para ello realizamos un seguimiento de los pacientes antes de tomar medicación, al mes y a los dos meses de llegar al máximo de medicación, de sus alteraciones en el sueño valoradas en una escala entre 0-100, con el inconveniente de que la sintomatología no era uniforme, ni la causa de la enfermedad era la misma.
Si buscamos que al menos todos ellos presentaran una valoración por encima de 7 en las escalas de dolor y que al menos todos tuvieran más de un 50% de su sueño interrumpido por causa del mismo. Esta gráfica demuestra la gran dificultad que representa la homogenización de los grupos en estas patologías y señala la gran cantidad de pacientes que debería estudiarse para lograr resultados valederos estadísticamente.
Como se puede apreciar todos los fármacos producen una mejoría en la interferencia del sueño por el dolor en estos pacientes pero es evidente que los mayores efectos se producen con la gabapentina, el topiramato, el valproato, la carbamazepina y la fenitoína. Esta gráfica tendría que hacerse comparativa con aquellas que muestran la evolución de estos pacientes en cuanto a su apreciación global del dolor. Un dato de que quizás los datos que aportan no sean del todo erróneos es que no todos los fármacos que producen somnolencia o sedación son aquellos que más mejoría muestran, como la crabamazepina o la fenitoína sobre todo esta última lo que concuerda con la mayoría de los estudios, salvo algunos en el mundo anglosajón, de que la Fenitoina es poco efectiva en el tratamiento del DN.
DISCUSIÓN
Los pacientes con DN sufren una alta prevalencia en su percepción de las alteraciones del sueño. Estas alteraciones sobre todo se centran en la fragmentación del sueño, aumento de la latencia de la vigilia previa al sueño y disminución generalizada de la calidad del mismo así como graves alteraciones sociales, personales y laborales por la contribución de estas alteraciones al cuadro depresivo típico acompañante de los pacientes con algún tipo de dolor crónico.
Parece claro aunque no demostrado que las alteraciones del sueño se correlacionan con la intensidad del dolor, reflejada en las distintas escalas de valoración del mismo.
La mayoría de los pacientes se quejan de dificultad para conciliar el sueño, interrupciones bruscas y más o menos frecuentes del mismo y en algunos casos se lamentan de la corta duración del sueño global. Algunos de estos pacientes toleran mejor este trastorno gracias a periodos de sueño de corta duración durante el día.
La depresión sobre todo si es intensa y de larga duración puede contribuir a una peor valoración de las alteraciones del sueño por estos pacientes, a veces esta los antidepresivos contribuyen a una mejora del sueño en cambio si se utilizan a dosis altas, sabemos que alteran los ciclos del sueño con el trastorno que ello supone.
Otro factor la edad es de difícil valoración contrariamente a lo que se pensaba de que a mayor edad mayores serían las alteraciones del sueño algunos datos de nuestros pacientes hacen pensar lo contrario lo que podría indicar una mayor aceptabilidad del dolor crónico como el DN según la edad va incrementándose.
Otros datos de nuestro estudio sugieren una mayor fragmentación y disminución del sueño en hombres, que otros autores han achacado a la menor respuesta de estos al tratamiento analgésico, afirmación esta que dado el numeroso cruce de factores que se influyen en estas manifestaciones parece a menos adventurado realizarlas.
CONCLUSIÓN
En el dolor neuropático, como en otros dolores crónicos, queda evidenciada la falta de estudios con un muestreo mucho más amplio, que cubran todas las variantes posibles como sexo, edad, medicaciones, educación, depresión, calidad de vida, etc.
Hay que ampliar las escalas de valoración del sueño y la incidencia de las medicaciones en el mismo o a través e la mejoría del dolor.
Habría que incluir en estos estudios si es posible los estudios electroencefalograficos y polisomnográficos necesarios para una mejor comprensión de lo que realmente sucede con el sueño de estos pacientes.
FIBROMIALGIA Y TRASTORNOS DEL SUEÑO
A. Mínguez Martí
Farmacéutica Adjunta. Unidad Multidisciplinar Tratamiento del Dolor. Consorcio Hospital General Universitario de Valencia. Valencia. España.
La fibromialgia es una enfermedad crónica generalizada de etiología desconocida. Su prevalencia se sitúa en el 2% de los adultos (el 3,4% en mujeres y el 0,5% en varones) y se incrementa con la edad. Se caracteriza por una serie de síntomas comunes y presentes en la práctica totalidad de los pacientes afectados y que son: la percepción anómala del dolor generalizado, que se manifiesta en forma de alodinia e hiperalgesia, con múltiples puntos sensibles de localización característica y que va acompañado de cansancio crónico diurno.
Los trastornos en el sueño son muy frecuentes, al menos las 3 cuartas partes de los pacientes presentan alteraciones en el descanso nocturno y se manifiestan fundamentalmente por el sueño no reparador. La electroencefalografía del sueño, realizada en pacientes afectados, muestra múltiples anormalidades, especialmente durante la fase onda lenta del sueño. Otras alteraciones del sueño también son comunes, como los movimientos involuntarios de piernas en el período límbico y la apnea de sueño sobre todo en pacientes obesos.
Otros síndromes frecuentemente se asocian a los síntomas mencionados, con mayor o menor prevalencia, como quedan reflejados en la tabla 1.
Las causas por las que ocurre son desconocidas, siendo probable que sea la interacción de múltiples factores en los que el síntoma principal es la existencia de dolor crónico y difuso acompañado de toda una constelación de síntomas, y en los que la existencia de factores psicológicos y psicosociales son una condición asociada y no la causa del proceso.
La complejidad del síntoma y la etiología desconocida de la fibromialgia han propiciado la utilización, muchas veces de forma irracional, de un amplio arsenal terapéutico. Sin embargo, los resultados obtenidos no siempre han sido los esperados y el paciente presenta además, múltiples intolerancias y efectos secundarios no deseados que provocan abandonos del tratamiento o falta de eficacia de éste.
La ausencia de estudios rigurosos o el número reducido del tamaño muestral de los pacientes incluidos, también han dificultado su óptima selección. Por todo ello, diversos autores proponen una estrategia de tratamiento multidisciplinaria e individualizada en el paciente, buscando un tratamiento farmacológico paliativo de los síntomas más prevalentes,
En el plan de tratamiento, la selección de los medicamentos no solamente debe contemplar mejorar el dolor y el cansancio del paciente, sino, a favorecer o potenciar el descanso nocturno, por ser estos tres los síntomas más relevantes y que con mayor incidencia se producen en la enfermedad. El tratamiento debe ser, además, evaluado, sobre todo en las fases iniciales, de forma constante por los efectos secundarios de los tratamientos para evitar efectos iatrogénicos y potenciar la adherencia terapéutica.
Entre los grupos farmacológicos mas frecuentemente utilizados para el tratamiento de los trastornos del sueño, dolor y fatiga de los pacientes con fibromialgia destacan: los antidepresivos tricíclicos, fundamentalmente la amitrptilina, capaz de mejorar la calidad del sueño. La fluoxetina y la sertralina, inhibidores de la recaptación de serotonina, son eficaces en el dolor, fatiga y trastornos del sueño de distinta intensidad. Del grupo de los inhibidores de la monoaminooxidasa destaca fundamentalmente la pirlindola, un inhibidor reversible. Del grupo de antiepilepticos están representados por su eficacia la pregabalina, la gabapentina y el topiramato, que pueden mejorar los tres síntomas simultáneamente. El hipnótico sedante zopiclona tiene un efecto potente sobre el cansancio y trastornos del sueño, y no presenta acción específica en el tratamiento del dolor. Los relajantes musculares tipo ciclobenzaprina, por su acción antagonista 5-HT2, actúan fundamentalmente mejorando el descanso nocturno y el dolor. El tropisetron y la hormona de crecimiento también han sido eficaces en el tratamiento de los tres síntomas.
Del grupo de los analgésicos, los antiinflamatorios no esteroideos (AINE) presentan una pobre respuesta al tratamiento al igual que los opiáceos, agonistas potentes, tipo morfina. Sin embargo, el tramadol, dotado de un doble mecanismo de acción, es eficaz para el cuadro de dolor de la fibromialgia
A las medidas farmacológicas anteriormente expuestas deben asociarse las no farmacológicas, como un tratamiento psicológico coadyuvante y una terapia rehabilitadora que potencie la restauración funcional, ya que ambas, junto con una amplia información al paciente, son otros de los pilares básicos del tratamiento que pueden potenciar el resultado global.
Teniendo en cuenta estas consideraciones, se describe el plan de tratamiento seguido para enfermos con fibromialgia y los resultados obtenidos en la percepción del dolor, fatiga y descanso nocturno así como otros parámetros evaluados en la Unidad Multidisciplinar del Dolor del Consorcio del Hospital General Universitario de Valencia durante los dos últimos años.
BIBLIOGRAFÍA
Bennett RM The rational management ibromyalgia patients. Rheum Clin North Am 2002;28:181-99.
Nicassio P, Moxhan E, Shuman C:. The contribution of pain, reported sleep quality and depressive symptoms to fatigue in fibromyalgia. Pain 2002;271-9.
Cerdá-Olmedo G, Monsalve V, Minguez A, Lopez D, Valia JC. Utilización del topiramato en el tratamiento de la fibromialgia. Estudio piloto. III Congreso SED; 2002; Salamanca.
Rao SG, Bennett RM. Pharmacological therapies in fibromyalgia. Best Ptact Res Clin Rheumatol 2003;17:611-27.