INTRODUCCION
Los arousals corticales (AC) breves o microarousals frecuentes durante el sueño pueden producir fragmentación de éste y ocasionar hipersomnia diurna sin reducir el tiempo total de sueño1 por lo que su detección debiera realizarse sistemáticamente2. Sin embargo, no hay consenso en cuanto a la forma de reconocimiento de éstos ni en cuanto a las cifras que indican alteración. El AC originado por un progresivo aumento del estímulo relacionado con la respiración3 es una de las consecuencias agudas del síndrome de apnea obstructiva durante el sueño (SAOS), al igual que el aumento de la frecuencia cardíaca y de la presión arterial4,5; se considera que estos cambios contribuyen a los efectos a largo plazo que las apneas tienen en el sistema cardiovascular6 y sus alteraciones7. Se ha señalado que este aumento de la frecuencia cardíaca y de la presión arterial sistémica en asociación con el AC8,9 son expresión de una activación del sistema nervioso simpático3,10 y que este arousal autonómico o subcortical (AA) podría usarse como marcador de arousal en ausencia de cambios corticales visibles, incluso utilizarse como cribado en el SAOS11,12.
Por otra parte, aunque se asume que la apnea finaliza por una respuesta del AC frente al estímulo respiratorio3, no siempre ésta es visible13, bien porque es fruto de una activación subcortical, con mínimos cambios electrofisiológicos corticales o sin ellos, o bien porque, aunque tiene un origen cortical, las variaciones que produce no son perceptibles visualmente, lo que puede deberse a que su morfología no se encuadra en los criterios estándar14,15, o por la localización de los electrodos16. El uso de técnicas de computarización puede ser útil en la detección del AC y ayudar a describir y definir con más precisión el fenómeno14,17-19.
En este trabajo hemos estudiado las modificaciones en la frecuencia cardíaca y los cambios en la actividad bioeléctrica cerebral, mediante análisis automático, durante los episodios de apnea obstructiva. Nuestro objetivo es analizar, en un grupo de pacientes diagnosticados de SAOS, las modificaciones en las frecuencias cardíaca (como índice de AA) y electroencefalográfica (EEG) (como índice de AC) relacionadas con la apnea, que puedan ayudar a una mejor definición del arousal cortical.
SUJETOS Y MÉTODOS
Registros
Hemos seleccionado polisomnogramas realizados de forma rutinaria en nuestro laboratorio, pertenecientes a 30 pacientes (27 varones y 3 mujeres, con una edad de 55,13 ± 10,95 años) con diagnóstico de SAOS, que han presentado un índice de apnea/hipopnea > 10/h (IAH = 43,75 ± 30,27) y no mostraban alteraciones basales del ritmo cardíaco (RC). Todos los datos utilizados se han protegido por la Ley de Protección de Datos de Carácter Personal 15/1999 del 13 de diciembre. A todos los pacientes se les realizó un estudio polisomnográfico nocturno para determinar su afección mediante uno de los 2 polígrafos analógicos de 18 y 21 canales, respectivamente (Medelec, Vickers Medical; Basingstoke, Hampshire, Reino Unido).
Se registraron diversas variables fisiológicas: EEG (C4-A1, C3-A2, C4-C3), electrooculograma (EOG), electromiograma (EMG) submentoniano y de ambos músculos tibiales anteriores, y electrocardiograma (ECG) (mediante 2 electrodos precordiales). La respiración se midió a partir de cambios de la temperatura nasal/oral (termistor) y de los movimientos abdominales y torácicos mediante sensores piezoeléctricos. La duración de la apnea se definió como el tiempo de al menos 10 s desde el final del flujo inspiratorio hasta el inicio del flujo siguiente, y se consideró hipopnea cuando la disminución fue ≤ 50% del flujo basal, aunque se descartaron para este estudio. Un resumen de los datos polisomnográficos, antropométricos y basales de los sujetos se muestran en la tabla 1.
Los registros analizados se digitalizaron mediante la utilización de un sistema de adquisición de polisomnogramas de desarrollo propio20 conectado al registrador polisomnográfico. Cada registro se adquirió con una frecuencia de muestreo de 250 Hz y 12 bits de resolución, y consta de 8 canales: 3 de EEG (C4-A1, C4-C3, C3-A2), 2 de EOG, uno de EMG (submentoniano), uno de flujo respiratorio y uno de ECG. De estos canales, se seleccionaron tres para el presente estudio: EEG (C4-A1), ECG y flujo respiratorio.
Análisis de datos
Para procesar la señal, se desarrollaron 2 detectores. El primero se utilizó para determinar los instantes de comienzo y cese de la apnea21. Este detector proporciona información sobre el tipo (apnea/hipopnea), instante de comienzo/final, amplitud y duración de cada evento detectado, así como las series de amplitud y duración de cada ciclo respiratorio para todo el registro a partir del canal de flujo respiratorio. Las marcas del detector fueron validadas visualmente para descartar falsas detecciones. En el presente estudio, aunque el detector indica el tipo de apnea, y todos los eventos respiratorios detectados eran obstructivos debido a que la identificación de hipopneas se había realizado mediante termistor para evitar la subjetividad de la medida22, se eliminaron los eventos hipopneicos. Posteriormente, los instantes de comienzo y cese de apnea obtenidos se utilizaron como referencia temporal para el cálculo del RC y del espectro del EEG.
El segundo detector se utilizó para la obtención del RC, a partir del canal de ECG mediante una versión modificada del detector de QRS de Pan y Tompkins23. Se obtuvo el tacograma y se eliminaron los ritmos inferiores a 30 pulsos por minuto (ppm) o superiores a 120 ppm.
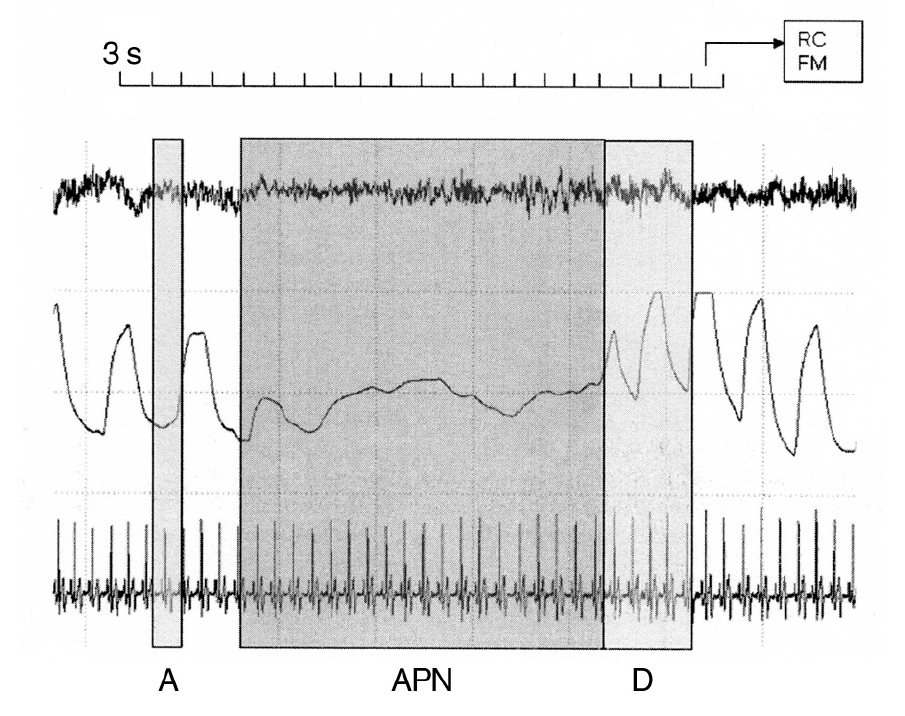
Para cada apnea detectada, se estudió el período que abarca desde 9 s antes de su inicio, toda la duración del episodio y los 9 s posteriores a su cese (fig. 1), y se analizó la evolución de los parámetros en promedios de 3 s. Los eventos consecutivos con separaciones menores que 18 s (9 + 9 s) se descartaron del estudio. Puesto que las apneas detectadas presentan duraciones diferentes, de todos los valores calculados se han seleccionado los correspondientes a los 12 últimos segundos previos al cese y los 9 s posteriores.
Figura 1. Segmentos temporales analizados. APN: toda la duración de la apnea. A: ventana de 9 s previos al comienzo de la apnea, tomada como referencia de valores; D: 9 s tras el cese de la apnea. Para cada ventana de 3 s se calculan el ritmo cardíaco (RC) medio y la frecuencia media (FM) espectral del EEG.
Para cada evento se calcularon 2 parámetros: el RC y la frecuencia media (FM) del espectro EEG. Para obtener el valor de FM se obtuvo el espectro de la señal de EEG mediante el método de Welch (ventana de Hanning). Por último, para independizar los valores obtenidos de la fase en que se produce la apnea se obtuvieron las diferencias entre los valores de RC y FM, y el correspondiente valor 9 s antes del comienzo del evento, que puede considerarse como valor basal e independiente del efecto de la apnea.
Análisis estadístico
Se realizó un análisis de la varianza de un factor de medidas repetidas, utilizando la aproximación multivariante para determinar la existencia de diferencias significativas (p < 0,05) de los valores de los parámetros en función del instante temporal de la apnea. En la comparación por pares, se aplicó el ajuste para comparaciones múltiples de Bonferroni.
RESULTADOS
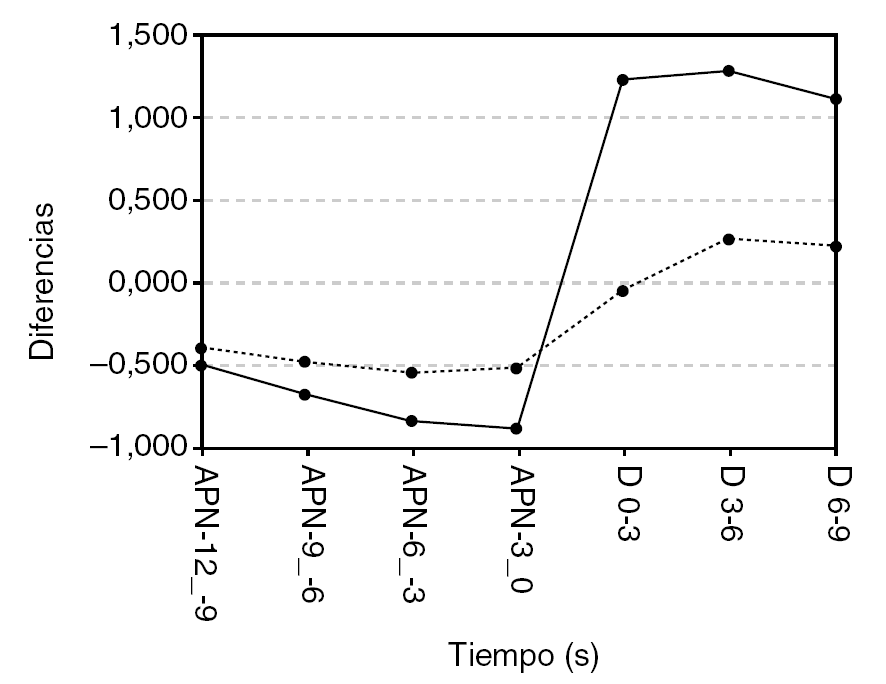
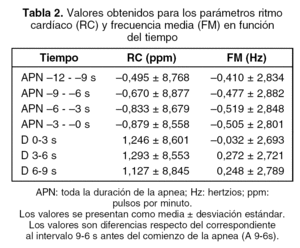
Se analizó un total de 2.455 apneas obstructivas del total de las detectadas, tras desechar las que no cumplían el criterio de separación mínima de 18 s. La tabla 2 y la figura 2 muestran los valores obtenidos para cada parámetro en función del tiempo, correspondiente a intervalos de 3 s en los segundos finales de la apnea y después del cese (D).
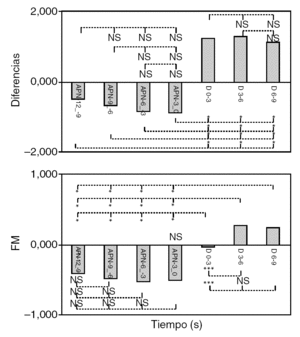
Figura 2. Evolución de los parámetros de ritmo cardíaco (RC) y frecuencia media (FM) en función del tiempo. Se muestran las diferencias entre los valores medios cada 3 s y el valor de referencia, que corresponde al intervalo 9-6 s antes del comienzo de la apnea (A 9-6). La línea discontinua indica el momento de cese de la apnea.
En el caso del RC, se observa un decremento durante los segundos finales de la apnea. Se alcanzó un valor mínimo inmediatamente antes del cese (apnea 3-0 s), y tras éste se incrementó hasta alcanzar valores significativamente superiores a los anteriores al establecimiento del evento respiratorio. El valor de RC permaneció todavía por encima del valor de referencia (apnea 9-6 s) 9 s después del cese, lo que, posiblemente, indica una duración superior del efecto del AA
Para la FM puede observarse un perfil de evolución similar al del RC, aunque las variaciones respecto del valor de referencia son menores que en el caso del RC. Los valores posteriores también son más elevados que los presentes antes del comienzo de la apnea, por lo que la duración del efecto del AC también sería > 9 s. Se observa también que el incremento de la FM tras el cese de la apnea no es tan rápido como para el RC, y alcanza el máximo entre 3 y 6 s después.
En la figura 3 se resumen las comparaciones estadísticas entre los valores durante y tras la apnea para cada parámetro. En el caso del RC, no se observaron diferencias entre los valores de cada período estudiado (durante o después de la apnea). Sí que se alcanza una alta significación estadística (p < 0,0001) entre los valores presentes durante la apnea y los posteriores al cese de ésta, lo que indica la presencia del AA.
Figura 3. Resultados de la prueba de ANOVA para medidas repetidas. Valores de significación estadística para la comparación por pares entre los valores de los parámetros ritmo cardíaco y frecuencia media (FM) para distintos intervalos. NS: no significativo.
En el caso de la FM, los resultados son equivalentes a los obtenidos para el RC. No se observan diferencias significativas entre los valores durante la apnea, y se alcanza significación estadística (p < 0,0001) para todas las comparaciones entre los valores durante la apnea y los instantes posteriores al cese. Sin embargo, el valor correspondiente a los 3 s tras el cese (D 0-3) presenta diferencias también con los otros valores posteriores al cese de la apnea (D3-6, D6-9). No se obtuvo este resultado para el caso del RC, lo que podría indicar que el AC aparece de forma más gradual en el tiempo y alcanza su valor máximo aproximadamente entre 3 y 6 s tras el cese.
DISCUSION
Los resultados confirman los hallazgos señalados por diferentes autores, que muestran un incremento del RC, sobre todo en la terminación de la apnea y que refleja una modificación en la función simpática, fenómeno que se puede utilizar para identificar el AA1,12,24. Los AC visibles durante el sueño en sujetos normales se asocian a cambios en el RC relacionados con una activación simpática, sobre todo en fase 2 NREM y en menor proporción en REM8,25, aunque algunos autores señalan que los AA que no se acompañan de AC no tienen repercusión sobre la somnolencia diurna26. De hecho, no parece existir una relación única entre la presencia de la apnea y somnolencia diurna, posiblemente debido a la variabilidad de los arousals inducidos por el cese de la apnea27. Esta variabilidad puede depender de otros factores, y algunos estudios han propuesto la edad5.6, el nivel de desaturación de oxígeno17 el grado de apnea (apnea/hipopnea)27, la fase de sueño en que aparece (REM/ NREM)5,17,28 y la posición corporal27 como coadyuvantes en la gravedad de los efectos producidos.
En las apneas analizadas en el presente estudio (tabla 2) vemos que el RC disminuye durante la apnea y se produce un aumento significativo de éste tras el cese. Spicuza et al29 también encuentran esta alternancia cíclica bradicardia-taquicardia acompañando a la apnea. El valor clínico de este fenómeno precisa de la realización de estudios futuros controlados.
Respecto de la FM-EEG, se han descrito modificaciones en los AC reconocibles mediante el análisis visual en arousals espontáneos de personas normales8. Mediante análisis espectral en pacientes con apneas se ha observado un aumento de la FM desde la primera a la segunda mitad de la apnea, tanto si el episodio finaliza con AC visible o no13. Nuestros resultados apoyan estas observaciones, con un comportamiento similar al del RC: su valor disminuye durante la apnea (tabla 2) de forma significativa y se incrementa tras el cese (D); el valor final siempre es mayor que el previo a la apnea, lo que indica un desplazamiento de la actividad en el EEG hacia bandas de mayor frecuencia alfa y beta compatibles con un AC. Los incrementos de la frecuencia del EEG observados al fin de la apnea son menores que para el RC, lo que podrían no detectarse como AC. En este sentido, el no haber considerado la fase de sueño en que se produce la apnea puede suponer una limitación, dada la dificultad de que el AC sea reconocido28, aunque en el presente trabajo el AC no se ha analizado de forma visual en todas las apneas. La diferencia encontrada entre los valores de la FM-EEG inmediatos tras el cese de la apnea (D3-6) y los posteriores (D6-9), y que no se observa en el RC, podría ser indicativa de cierto retraso en el AC respecto al autonómico, o bien expresión de un incremento más gradual en el AC, lo que apoyaría la teoría de una jerarquía en la aparición de ambas respuestas, como señalan Sforza et al8, que se iniciaría desde el troncoencéfalo con una primera respuesta autonómica (modificación del RC), con una posterior respuesta del sistema nervioso central (AC). Ese AC sería visible o no dependiendo de la intensidad del estímulo. En las apneas analizadas en el presente estudio, el paralelismo de las modificaciones encontradas en los parámetros EEG y en el RC durante y al final de los episodios de apnea nos demuestra que durante éstas se producen modificaciones en el sistema nervioso autónomo (SNA) y nos permite suponer que, en las apneas estudiadas, se han asociado los dos tipos de respuesta, tanto autonómica como cortical, por lo que se puede especular con la posibilidad de que el arousal en este fenómeno analizado entrañe siempre ambos tipos de respuesta, aunque los cambios EEG no sean siempre visibles y requieran técnicas de análisis automático para su puesta en evidencia, lo cual podría ayudar a explicar las consecuencias que los AC y los AA tienen sobre el sueño y sobre la actividad diurna y el sistema cardiovascular. La explicación de estos aspectos necesita posteriores comprobaciones con un mayor número de casos en que se considere la influencia de otros factores, como diferentes fármacos, comorbilidad con alteraciones en el SNA, la influencia de la edad5,30 y la presencia de lesiones cerebrales31, estudiando el comportamiento según la fase de sueño, gravedad y momento evolutivo de estos pacientes.
Correspondencia:
Dr. A. Benetó Pascual.
Unidad de Sueño. Hospital Universitario La Fe. Avda. de Campanar, 21.
46009 Valencia. España.
Correo electrónico: beneto_ant@gva.es
Aceptado tras revisión externa: 25-04-2007.
El presente trabajo ha sido financiado por el proyecto 01/0318 del Fondo Investigación Sanitaria (FIS).