Determinar la presencia de signos de liberación cortical, asociada a daño de sustancia blanca, es un método clínico de fácil realización. El objetivo es deter minar la presencia de signos de liberación cortical en pacientes con enfermedades mentales y enfermedad cerebrovascular y determinar su utilidad clínica, dado que indica daño cortical.
Material y métodosSe realiza búsqueda de signos de liberación cortical en pacientes hospitalizados en clínica psiquiátrica y hospital general con diagnósticos de trastorno afectivo bipolar (40), depresión (37), esquizofrenia (33), enfermedad cardiovascular (33) y demencia (37).
ResultadosLos signos de liberación cortical no tienen igual importancia en la determinación de daño cortical; por ejemplo, se encontró reflejo glabelar en todos los grupos; el de paratonía, especialmente en el grupo con esquizofrenia, y más signos, en el grupo de pacientes con demencia.
ConclusionesSe formula que estos signos implican daño de sustancia blanca subcortical; la aparición de estos signos supone la necesidad de seguimiento de pacientes con diagnósticos de trastorno afectivo bipolar, depresión y esquizofrenia.
Determining the presence of cortical release signs associated with white matter damage, is a clinically easy method to perform. The objective of this study is to determine the presence of cortical release signs in patients with mental illnesses and cerebrovascular disease, as well as its clinical usefulness, given that it indicates cortical damage.
Material and methodsA review was made of cortical release signs in patients hospitalized in clinical psychiatry and general hospitals with bipolar affective disorder (40), depression (37), schizophrenia (33), cardiovascular disease (33) and dementia (37).
ResultsThe signs of cortical release do not have the same importance as cortical damage. For example, the glabellar reflex was found in all the groups, that of paratonia, particularly in the group with schizophrenia, and others signs in the group of patients with dementia.
ConclusionsIt is suggested that these signs imply subcortical white matter damage. The appearance of these signs shows the need for a follow up of patients diagnosed with bipolar affective disorder, depression and schizophrenia.
La implicación clínica de los reflejos positivos es discutida en pacientes con enfermedad tanto psiquiátrica como neurológica1. Se han reportado anormalidades neurológicas menores en enfermedades psiquiátricas, lo cual refleja disfunción del sistema nervioso central debido a alteraciones en el neurodesarrollo o degeneración de un sistema nervioso central (SNC) previamente sano1,2.
Los signos de liberación cortical, conocidos como reflejos primarios, son un grupo de signos motores o del comportamiento que representan reacciones adaptativas que ocurren en el feto normal durante el desarrollo posnatal del SNC, cuando la mielinización cortical no se ha completado, y desaparecen cuando la maduración cerebral ha finalizado3. Su presencia en el adulto mayor refleja pérdida de la inhibición cortical, por lo que se hallan en presencia de enfermedad o la señalan4 (tabla 1).
Se reconoce, sin embargo, que algunos de estos reflejos se encuentran en individuos normales. En adultos jóvenes, aparece reflejo palmomentoniano en un 6–27% de los sujetos de 20–50 años. El reflejo de trompa puede encontrarse en el 13% de los individuos de 40–57 años5. Los controles sanos raramente tienen positivos más de dos reflejos; solo en mayores de 70 años6, la presencia y el número de reflejos de liberación cortical encontrados están relacionados con la reducción de la capacidad cognitiva en ancianos sanos4,7.
Cuando los signos de liberación cortical aparecen en individuos asintomáticos, comúnmente están asociados con pequeñas lesiones vasculares en los ganglios basales o sustancia blanca subcortical8.
Podemos agrupar los reflejos de liberación en un grupo prensil (principalmente agarrar un objeto cercano) —reflejo de prensión, ref lejo de succión— y un grupo nocioceptivo (ausencia de estímulos dolorosos) —reflejo hocico, reflejo palmomentoniano, reflejo glabelar, reflejo trompa— y otro grupo —reflejo nucocefálico, corneomandibular—. Esta distinción es clínica, los reflejos motores aparecen en enfermedades cerebrales moderadas-graves, raramente en enfermedades leves9. Los reflejos nocioceptivos aparecen en una proporción alta de la población y tardíamente7,10; sin embargo, la presencia de reflejo nucocefálico es difícil de clasificar.
Reflejos de liberación corticalA continuación se describe cómo se determina clínicamente la presencia de los diferentes reflejos descritos.
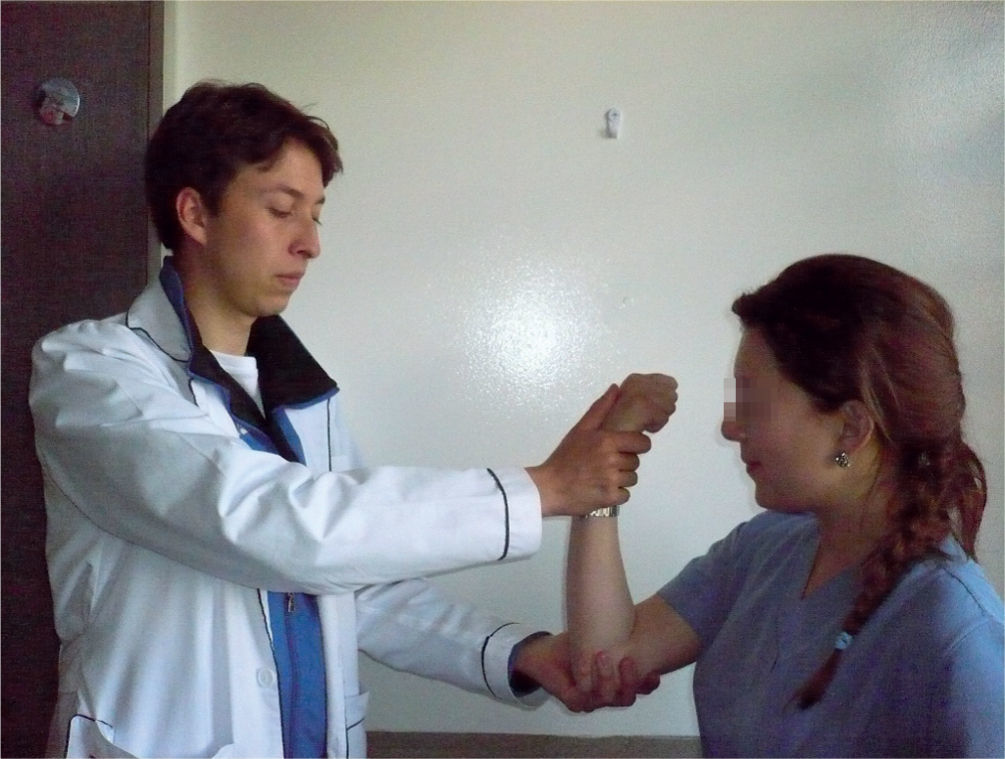
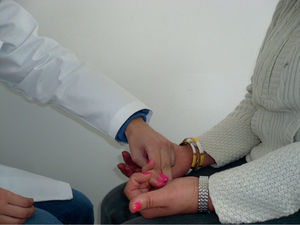
Reflejo de prensiónCon el paciente sentado con las manos encima de los muslos con las palmas hacia arriba, se lo distrae y se toca ligeramente la palma de la mano y el paciente agarra la mano del examinador. Es positivo si al repetir la prueba el paciente agarra la mano del examinador11,12 (fig. 1).
El ref lejo puede mostrar inicialmente daño en el giro anterior del cíngulo (con interrupción de la modulación en el área premotora lateral), área suplementaria (con remoción de la inhibición de la corteza motora primaria) y en la profundidad de la materia blanca si el sitio de la lesión está cerca del sitio de estimulación del reflejo13. Es raro en individuos sin enfermedad del SNC y ausente en adultos jóvenes5,12–14.
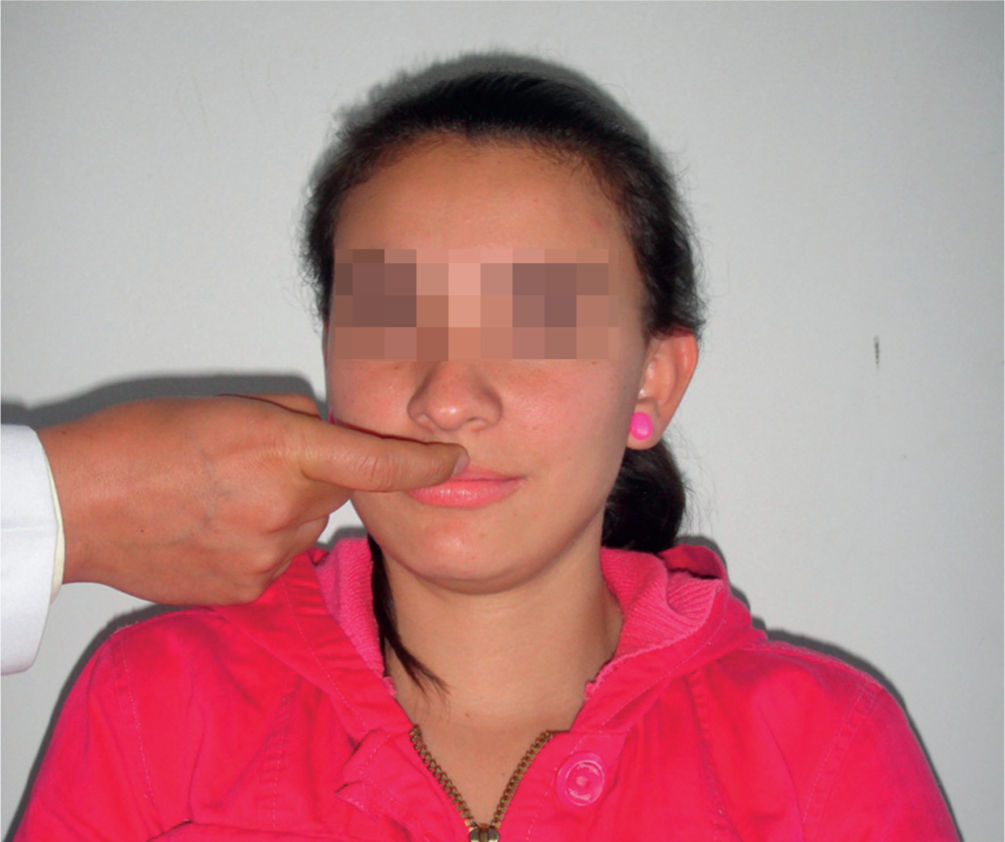
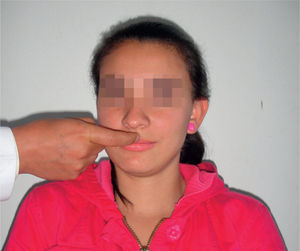
Reflejo de trompa y búsquedaEs un grupo de reflejos primitivos orales que facilitan la búsqueda de la comida en neonatos (succión, búsqueda y trompa). En el reflejo de búsqueda, el examinador debe realizar un toque en la región de las comisuras; la respuesta es la apertura oral o búsqueda con la lengua hacia el sitio del estímulo, o desviación del labio homolateral al estímulo (fig. 2). El reflejo de trompa es un reflejo miotáctico; es positivo si, al tocar con el dedo índice el borde del labio superior o con golpe sobre el philtrum, el paciente protruye los labios (fig. 3). Este reflejo es raro en adultos jóvenes. Es positivo en enfermedades frontales o trastornos difusos del SNC y refleja afección subcortical frontal y desconexión15–17.
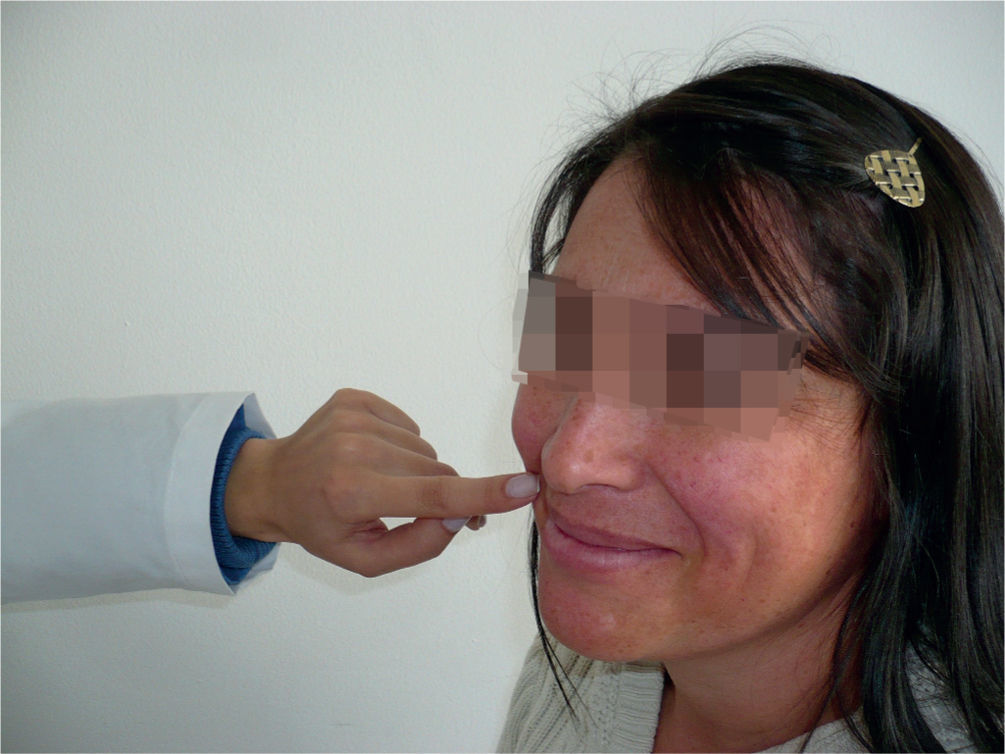
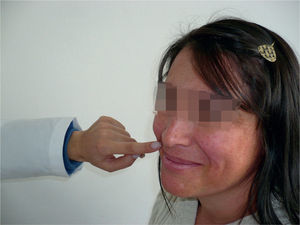
Reflejo del hociqueoEs un signo anormal desencadenado al golpear suavemente la nariz, provoca una marcada mueca facial (fig. 4). La presencia del signo indica lesiones corticobulbares bilaterales18.
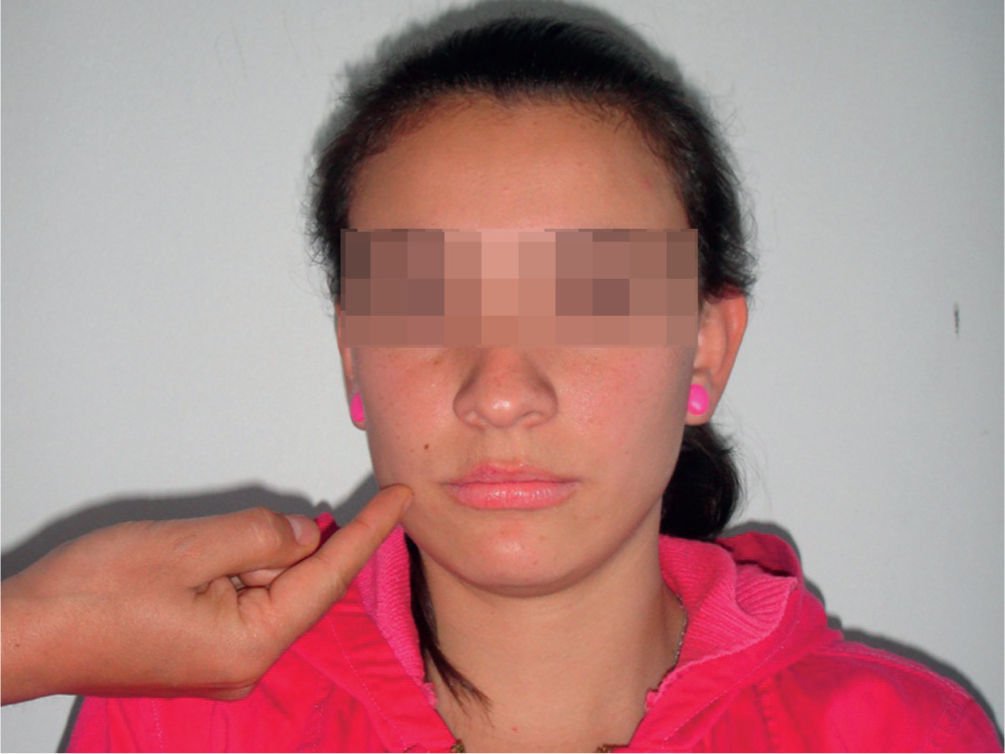
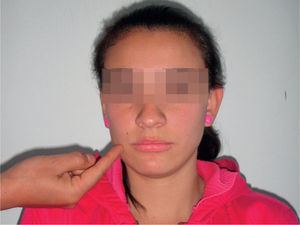
Reflejo palmomentonianoMarinescu et al lo describieron en 1920 en pacientes con esclerosis lateral amiotrófica. Se produce cuando se toca suavemente la eminencia tenar de la palma o se punciona proximal o distalmente19, y este estímulo produce una pequeña contracción de los músculos de la barbilla o el ángulo homolateral de la boca, pero en ocasiones puede producir contracción contralateral o bilateral (fig. 5). Este reflejo puede estar presente en más del 30% de la población sana y más del 60% de los pacientes mayores de 50 años20.
Presenta habituación o agotamiento después de 3–5 estímulos; cuando se presenta respuesta contralateral se ha visto asociado a enfermedades neurológicas21. Este reflejo se puede producir al estimular otras áreas como brazos, tronco o planta de los pies.
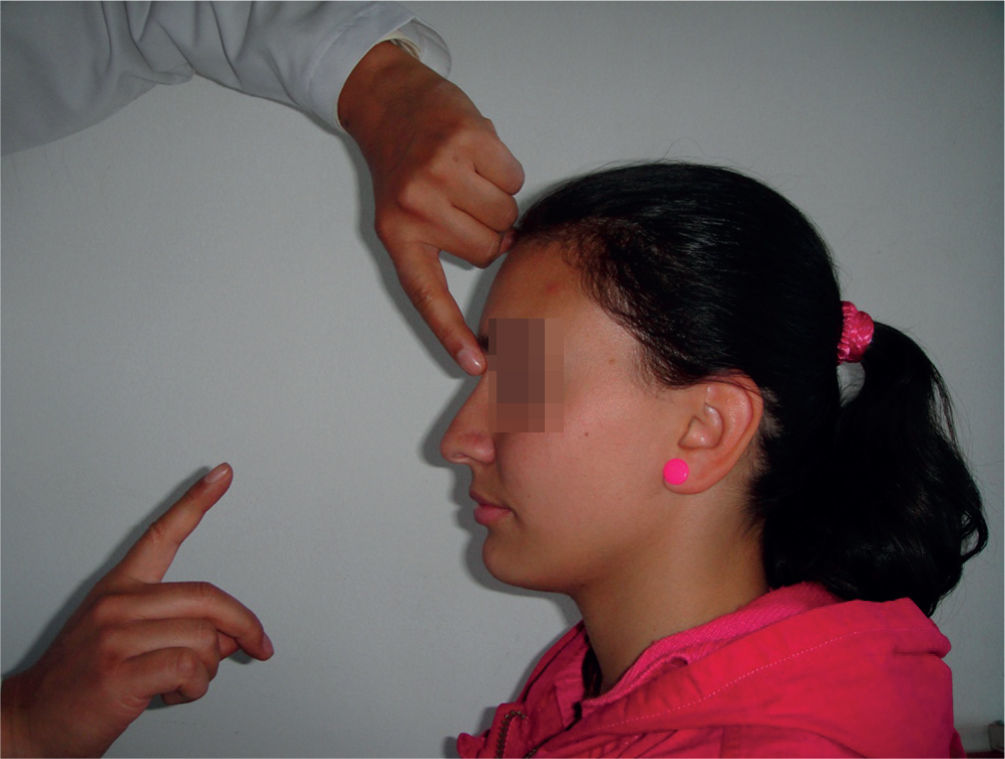
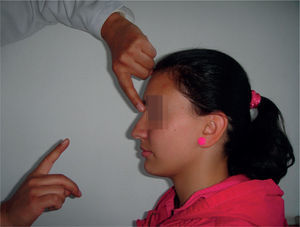
Reflejo glabelarEl examinador fija su dedo índice izquierdo a 30° y 50cm delante del examinado, mientras con su dedo índice derecho percute la región del entrecejo, aboliendo el reflejo del parpadeo. Golpea una vez por segundo, viendo el parpadeo del paciente; en sujetos normales, el cierre de los párpados ocurre solo en las primeras dos o tres percusiones y desaparece22,23. La respuesta se considera positiva por parpadeos persistentes después de nueve golpes (fig. 6). En individuos sanos, la prevalencia es del 30% de los menores de 70 años24. Se ha visto positivo en sujetos con enfermedad de Parkinson, Alzheimer y otras demencias.
Reflejo nucocefálicoEste reflejo es positivo cuando se gira rápidamente al sujeto fijado por los hombros y, al forzar la contracción de los músculos del cuello, mantiene la cabeza en posición original; entre los menores de 80 años, ocurre en menos del 10%25.
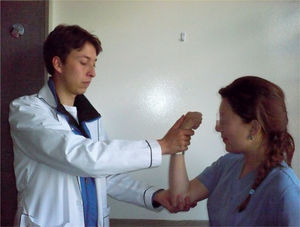
Paratonía (gegenhalten)Hay un incremento en el tono muscular de la extremidad al realizar movimientos rápidos pasivos, y la acción del examinador encuentra cada vez más resistencia, lo que lo diferencia del fenómeno de navaja, en el cual al final hay pérdida de la resistencia (se observa en pacientes con enfermedad motoneuronal) o rigidez en rueda dentada, observada en la enfermedad de Parkinson (fig. 7). Se ha asociado con lesiones frontales no rolándicas en conexión con el segmento externo de los globus pallidus26.
Reflejo de TrömnerEl examinador despierta el reflejo del dedo flexor golpeando con sus dedos contra la yema de los dedos del paciente ligeramente inclinados en una contracción y flexión. El flexor del dedo es uno de los reflejos musculares intrínsecos y representa los segmentos C7-T1 y los nervios periféricos mediano y cubital27.
Reflejo de HoffmannEs un reflejo de los dedos en casos de hiperreflexia. Al golpear la uña de los dedos segundo, tercero o cuarto, si el ref lejo está presente, se produce la flexión de los dedos correspondientes e incluso del pulgar. Su presencia indica un tendón hiperreactivo18.
Reflejo corneomandibularMovimiento de la mandíbula abriendo la boca hacia el lado opuesto del ojo cuya córnea se toca ligeramente28. Desviación del maxilar inferior hacia el lado opuesto del ojo cuya córnea es estimulada29.
Reflejo oculocefálicoEs una prueba de la integridad de la función del tronco encefálico. Se produce cuando el paciente mueve la cabeza rápidamente de uno a otro lado; normalmente los ojos van detrás del movimiento de la cabeza y se sitúan lentamente en la línea media. La incapacidad de los ojos de retrasarse apropiadamente o volver a la línea media indica una lesión homolateral localizada en el tronco encefálico.
Signos de liberación cortical en algunas enfermedadesSignos de liberación cortical en esquizofreniaEn pacientes con esquizofrenia, se han encontrado anormalidades de la integración sensorial y la coordinación motora y sobrestimulación15,30. En 1989 se publicaron estudios neurológicos de seguimiento de pacientes con esquizofrenia, otras enfermedades mentales y controles, y se evaluaron los reflejos de trompa, succión, presión y glabelar: más de la mitad de los pacientes que tenían esquizofrenia demostraron al menos un reflejo positivo31,32; se ha publicado un incremento en la prevalencia de reflejos palmomentoniano, prensión, trompa y glabelar en estos pacientes33,34.
En un metanálisis se encontró una alta prevalencia de reflejos palmomentoniano, trompa y prensión en contraste con los controles25. El reflejo de prensión se ha hallado en estados de psicosis marcada35,36; también los signos de liberación cortical están relacionados con la presencia de discinesia tardía.
Los reflejos más comúnmente hallados en esquizofrenia son el reflejo palmomentoniano y el glabelar; pueden resultar del efecto parkinsoniano de los antipsicóticos, pero es controvertido, ya que antes de la era de los antipsicóticos ya se habían registrado casos con signos de liberación cortical.
Signos de liberación cortical en trastorno afectivo bipolarLos signos de liberación cortical están presentes en pacientes con mal pronóstico24. Más de la mitad de los pacientes con trastorno afectivo bipolar (TAB) pueden tener positivo el reflejo palmomentoniano y un cuarto de los pacientes tienen positivos el reflejo de trompa y el glabelar.
Signos de liberación cortical en depresión mayorHay pocos estudios que examinen la presencia de reflejos de liberación cortical en pacientes con depresión. Los signos de liberación cortical y retardo psicomotor pueden estar relacionados con disfunción frontoestriatolímbica37. Un estudio controlado en pacientes con manía y depresión mostró incremento de la prevalencia del reflejo nucocefálico y glabelar, pero predominante en pacientes con deterioro cognitivo asociado38.
Signos de liberación cortical en demenciaEnfermedad de AlzheimerLos reflejos de prensión y trompa son comunes en demencia tipo Alzheimer9,39, y su presencia se correlaciona con el grado de deterioro cognitivo y la gravedad de la enfermedad. Los signos de liberación cortical están asociados con ensanchamiento ventricular y signos motores extrapiramidales40,41. Estos signos prensiles aparecen en estadios avanzados de la enfermedad (GDS, estado 6), y los signos nocioceptivos aparecen tempranamente (GDS, estado 3)42. La presencia de signos se asocia con atrofia cortical y pérdida de las células piramidales largas en corteza en las capas III y IV en el lóbulo frontal43.
Demencia frontotemporalLos reflejos de prensión y búsqueda han sido más prevalentes en la demencia frontotemporal que en la enfermedad de Alzheimer. Los reflejos de trompa, prensión, palmomentoniano y glabelar están presentes en más de la mitad de los pacientes con demencia frontotemporal44,45.
Signos de liberación cortical en enfermedad cerebrovascularLos signos de liberación cortical se han correlacionado con el grado de atrofia cortical y enfermedad subcortical46,47; también están asociados con estenosis carotídea e infarto lacunar anterior, son resultado de «desaferentación» y pueden ser causa de la pérdida de la inhibición cortical48,49.
Los signos de liberación cortical ocurren en la mitad de los pacientes en postoperatorio de bypass de la arteria coronaria obstruida50.
Varios autores han argumentado que los signos de liberación cortical pueden indicar la localización cerebral implicada, daño difuso hemisférico o local, notablemente en la región frontal. Algunos autores mencionan la relación entre reflejos primitivos y disfunción neuropsicológica específica y grado de deterioro cognitivo51,52; otros autores cuestionan el valor de los signos de liberación cortical en la investigación neurológica habitual, argumentando que los reflejos primitivos no tienen un valor diagnóstico específico y son simplemente signos de madurez neuropsicológica53.
La importancia clínica de los signos de liberación cortical permanece inconclusa, debido a la falta de estandarización en su toma, lo que lleva a que la incidencia y la prevalencia varíen en los diferentes estudios54.
Material y métodosEl estudio se llevó a cabo en dos clínicas psiquiátricas, un hospital general y una institución de protección. La población de referencia fueron los pacientes atendidos en cualquiera de las instituciones mencionadas.
Constituyeron la población de estudio pacientes con diagnósticos de demencia, depresión, esquizofrenia, enfermedad cerebrovascular (ECV) y TAB que cumplieran los criterios de inclusión (diagnóstico de la enfermedad, episodio sintomático y no tener más de un diagnóstico de las categorías en estudio).
Tipo de estudio: serie de casos.
Muestreo: por conveniencia.
MétodosTodos los investigadores recibieron el mismo entrenamiento para la toma de reflejos. En caso de duda en la positividad de un reflejo, un segundo evaluador examinaba el paciente. Si persistían las dudas, un tercer evaluador valoraba al paciente, y la respuesta se tomaba por consenso.
Se llevó hoja de registro de toma de reflejos y datos generales y revisión en historia clínica para la búsqueda de los datos faltantes.
Se buscó en todos los pacientes los reflejos: búsqueda, glabelar, Hoffmann, oculocefálico, palmomentoniano, paratonía, prensión, Trömner y trompa.
Se analizaron los reflejos en la muestra general y en las subpoblaciones buscando sus propiedades de medición para cada reflejo y para el conjunto de reflejos.
El estudio fue aprobado por el comité de bioética y no tuvo efecto en el tratamiento que los pacientes estaban recibiendo al momento de examinarlos.
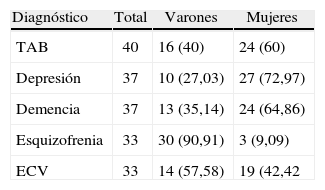
ResultadosConstituyeron la población de estudio 180 pacientes. Los diagnósticos se muestran en la tabla 2, así como la distribución por sexo: 96 (53,3%) mujeres y 84 (46,7%) varones. La media de edad era 55,2 (21–95) años. Llama la atención el promedio consignado en el eje V (45, de 1 a 100), y se halló gran impacto de la enfermedad mental en el funcionamiento general; no se calculó esta escala para pacientes con ECV debido a que se trata de medición de impacto de enfermedad mental, incluida la demencia.
Distribución de la muestra total por sexos
| Diagnóstico | Total | Varones | Mujeres |
| TAB | 40 | 16 (40) | 24 (60) |
| Depresión | 37 | 10 (27,03) | 27 (72,97) |
| Demencia | 37 | 13 (35,14) | 24 (64,86) |
| Esquizofrenia | 33 | 30 (90,91) | 3 (9,09) |
| ECV | 33 | 14 (57,58) | 19 (42,42 |
ECV: enfermedad cerebrovascular; TAB: trastorno afectivo bipolar.
Las cifras muestran n (%)
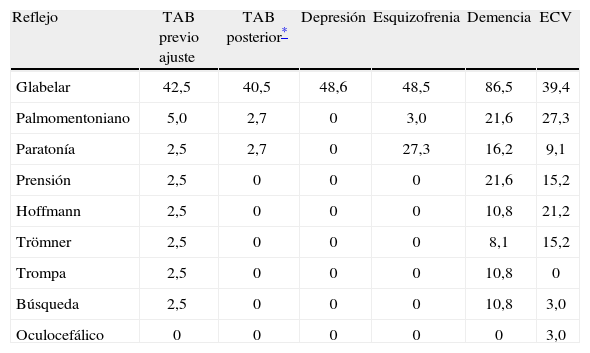
En la tabla 3 se presenta la positividad de los reflejos en el total de la muestra estudiada. El porcentaje de positividad de los reflejos por las subpoblaciones clínicas estudiadas se muestra en la tabla 4. Para pacientes con diagnóstico de TAB, se encontró: el reflejo glabelar fue el más positivo, encontrado en el 40,5% (tras excluir el caso de un paciente clasificado como TAB pero que tenía positividad en paratonía, Trömner y Hoffman, antecedente de intento de suicidio por ahorcamiento y lesión cerebral hipóxica secundaria). Un paciente presentó reflejos glabelar, de búsqueda y oculocefálico, con comorbilidades: neuralgia del trigémino, hipertensión arterial, migraña, reemplazo valvular aórtico y traumatismo craneoencefálico 6 años antes, por lo cual también se evidenció lesión cerebral previa. Otra paciente de 70 años tuvo diagnóstico de TAB y síndrome demencial corticosubcortical en estudio, por lo cual se la excluyó también; esta paciente presentaba positividad para reflejos glabelar y palmomentoniano.
Distribución (%) de la positividad de reflejos por subpoblaciones
| Reflejo | TAB previo ajuste | TAB posterior* | Depresión | Esquizofrenia | Demencia | ECV |
| Glabelar | 42,5 | 40,5 | 48,6 | 48,5 | 86,5 | 39,4 |
| Palmomentoniano | 5,0 | 2,7 | 0 | 3,0 | 21,6 | 27,3 |
| Paratonía | 2,5 | 2,7 | 0 | 27,3 | 16,2 | 9,1 |
| Prensión | 2,5 | 0 | 0 | 0 | 21,6 | 15,2 |
| Hoffmann | 2,5 | 0 | 0 | 0 | 10,8 | 21,2 |
| Trömner | 2,5 | 0 | 0 | 0 | 8,1 | 15,2 |
| Trompa | 2,5 | 0 | 0 | 0 | 10,8 | 0 |
| Búsqueda | 2,5 | 0 | 0 | 0 | 10,8 | 3,0 |
| Oculocefálico | 0 | 0 | 0 | 0 | 0 | 3,0 |
ECV: enfermedad cerebrovascular; TAB: trastorno afectivo bipolar.
Excluidos los casos mal clasificados inicialmente, la positividad fue del 2,7% en el grupo de TAB para reflejo palmomentoniano y paratonía, y los demás reflejos fueron negativos.
Al revisar estos datos, se encuentra que un paciente con reflejo palmomentoniano positivo era mujer de 60 años con hipotiroidismo y que un paciente con reflejo de prensión era mujer de 67 años con hipertensión arterial.
Entre los 37 pacientes con diagnóstico de depresión (26 mujeres y 11 varones; media de edad, 41,19 [intervalo, 21–79] años; GAF promedio, 50), el único reflejo positivo es el glabelar, en casi la mitad de pacientes (48,6%), y los demás resultaron negativos.
Entre los 33 pacientes con diagnóstico de esquizofrenia estudiados (3 mujeres y 30 varones; media de edad, 46,78 [22–58] años; GAF promedio, 53,84), se encontró a una paciente de 50 años con diagnóstico de trastorno esquizoafectivo con tres reflejos positivos —glabelar, palmomentoniano y paratonía—, sin comorbilidades detectadas al momento del examen.
Entre los pacientes con diagnóstico de esquizofrenia, el reflejo más frecuentemente hallado fue el glabelar (el 48,5% de los pacientes), seguido de la paratonía (27,3%) y el palmomentoniano (3,03%); no se encontraron los demás reflejos en la muestra.
Llama la atención el alto porcentaje de pacientes con reflejo de paratonía (más de un cuarto de los pacientes lo tuvieron positivo). Una asociación por determinar es con el tiempo de evolución, ya que todos los pacientes con este reflejo positivo tenían 39 o más años.
Entre los 37 pacientes con diagnóstico de demencia estudiados (24 mujeres y 13 varones; media de edad, 74,05 [58–87] años; GAF promedio, 14,86, según lo registrado en la historia clínica), el reflejo glabelar fue el más hallado (32 pacientes [86,5%]), seguido del palmomentoniano (n=8) y el de prensión (8 [21,6%]), la paratonía (6 [16,2%]), de trompa (n=4), búsqueda (n=4) y Hoffmann (4 [10,8%] y Trömner (3 [8,11%]), y ningún paciente presentó reflejo oculocefálico.
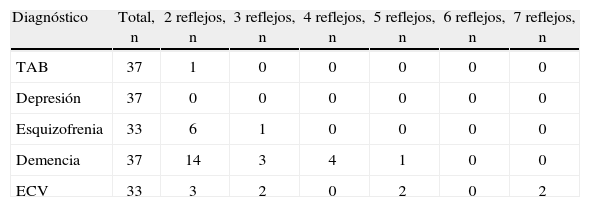
En la tabla 5 se muestra la positividad de los reflejos en pacientes con tres o más reflejos positivos.
Positividad de reflejos según diagnóstico.
| Diagnóstico | Total, n | 2 reflejos, n | 3 reflejos, n | 4 reflejos, n | 5 reflejos, n | 6 reflejos, n | 7 reflejos, n |
| TAB | 37 | 1 | 0 | 0 | 0 | 0 | 0 |
| Depresión | 37 | 0 | 0 | 0 | 0 | 0 | 0 |
| Esquizofrenia | 33 | 6 | 1 | 0 | 0 | 0 | 0 |
| Demencia | 37 | 14 | 3 | 4 | 1 | 0 | 0 |
| ECV | 33 | 3 | 2 | 0 | 2 | 0 | 2 |
ECV: enfermedad cerebrovascular; TAB: trastorno afectivo bipolar.
Para pacientes con demencia:
- •
Con tres reflejos positivos. Mujer de 82 años, con reflejos glabelar, presión y Trömner, diagnóstico de demencia vascular, comorbilidad con hipertensión. Varón de 70 años, con reflejos glabelar, trompa y paratonía positivos, diagnóstico de demencia mixta corticosubcortical, comorbilidad con diabetes mellitus y polineuropatía diabética. Varón de 81 años, con reflejos positivos glabelar, presión y paratonía, diagnóstico de demencia tipo Alzheimer, con antecedente de ECV isquémica transitoria.
- •
Pacientes con cuatro reflejos positivos. Mujer de 74 años, con diagnóstico de demencia mixta y enfermedad de Parkinson, reflejos positivos glabelar, palmomentoniano, presión y paratonía. Paciente de 71 años, con reflejos positivos glabelar, palmomentoniano, presión y Hoffman, diagnóstico de DTA e hipertensión arterial. Mujer de 85 años, con diagnóstico de DTA sin comorbilidades anotadas, con reflejos positivos glabelar, palmomentoniano, Trömner y Hoffman. Mujer de 86 años, con diagnóstico de demencia vascular e hipertensión arterial, con reflejos positivos glabelar, presión, paratonía y Hoffmann.
- •
Pacientes con cinco reflejos positivos. Mujer de 75 años con diagnóstico de enfermedad de Parkinson, demencia tipo Parkinson, con reflejos positivos trompa, glabelar, presión, Trömner y Hoffman.
Entre los 33 pacientes con diagnóstico de ECV (19 mujeres y 14 varones; media de edad, 70,48 [26–95] años), el reflejo más encontrado fue el glabelar en el 39,4% de los pacientes (n=13), seguido del palmomentoniano en el 27,27% (n=9), Hoffmann en el 21,21% (n=7), Trömner (n=5) y prensión (n=5) en el 15,2%, paratonía en el 9,1% (n=3) y búsqueda y oculocefálico en el 3,0% (n=1); el de trompa no se encontró. Es necesario resaltar que los procesos de osteoartrosis, por ejemplo, pueden dificultar el examen y dar positivo para reflejo de paratonía. Para pacientes con ECV:
- •
Pacientes con tres reflejos positivos. Varón de 78 años, con diagnóstico de ECV (no especificado), reflejos positivos glabelar, palmomentoniano y Hoffman. Mujer de 76 años, con diagnósticos de HTA, diabetes mellitus y ECV, con reflejos positivos glabelar, palmomentoniano y prensión.
- •
Pacientes con cinco reflejos positivos. Mujer de 83 años, con diagnóstico de ECV, hipertensión y osteoartrosis, con reflejos positivos glabelar, palmomentoniano, prensión, paratonía y Trömner. Mujer de 89 años, con diagnósticos de ECV de arteria cerebral media izquierda e hipertensión, con reflejos positivos glabelar, palmomentoniano, prensión, Trömner y Hoffman.
- •
Paciente con siete reflejos positivos. Varón de 95 años, con diagnósticos de ECV de fosa posterior, ECV multiinfartos y demencia vascular, reflejos positivos glabelar, palmomentoniano, prensión, búsqueda, paratonía, Trömner y Hoffman. En este caso la comorbilidad de demencia con ECV de diferentes orígenes nos permite deducir superposición de daño cerebral en paciente de edad avanzada.
La búsqueda de signos de liberación cortical es un examen fácil y no costoso que puede ayudar a determinar afección comórbida neurológica en pacientes psiquiátricos.
El reflejo glabelar no es buen discriminador de lesión, pues se halla en población sana o con enfermedad mental «funcional». Los pacientes con ECV tienden a tener más reflejos positivos, posiblemente por tipo de lesión, cuadro agudo y comorbilidades (factores de riesgo). Habría que hacer seguimiento de estos reflejos como factores pronósticos o de evolución del cuadro. Dos pacientes con TAB dieron tres reflejos; se determinó que había comorbilidad con lesiones cerebrales, por lo cual se los excluyó de los pacientes «funcionales».
Llama la atención el alto porcentaje de signos de liberación cortical en pacientes con esquizofrenia, en particular, del reflejo de paratonía, lo cual puede deberse a alteraciones estructurales en algunos tipos de esquizofrenia o a efectos de medicación y comorbilidades; habría que explorar si el tipo de medicación antipsicótica pudiera dar falsos positivos, en especial en la paratonía, o si este signo se debe al diagnóstico de base, como la catatonia.
La lesión orgánica detectada aumenta con el número de reflejos positivos encontrados, y a más reflejos positivos, sería mayor el daño cerebral.
La prueba de reflejos con uno o dos reflejos (excluido el glabelar) se podría utilizar para cribar lesiones estructurales.
Limitaciones del estudioEl muestreo fue por conveniencia, no hubo cegamiento de los investigadores. En la muestra del grupo de depresión predominan las mujeres, y en el caso de la población de esquizofrenia, predominan los varones institucionalizados. El tamaño de la muestra no permite un análisis estratificado y realizar modelos de correlación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.